La punción por aguja fina de tiroides es el examen diagnóstico disponible más preciso para evaluar el nódulo tiroideo. Desde 2009 está vigente la clasificación de Bethesda, que estratifica los hallazgos citomorfológicos en 6 categorías, cada una asociada a un riesgo de malignidad. Esta clasificación fue revisada en 2017 donde se mantuvieron las 6 categorías con algunas modificaciones principalmente debido a la reclasificación de la Variante Folicular de Carcinoma Papilar (VFCP) encapsulada que era considerada maligna y actualmente se considera benigna y se denomina “Neoplasia folicular del tiroides no invasiva con características nucleares de tipo papilar” (NIFTP). Esto cambia los valores de riesgo de malignidad en algunas categorías de Bethesda. En los casos indeterminados, se sugiere la adición de estudios de biología molecular.
Thyroid fine-needle aspiration biopsy is the best diagnostic test available for the evaluation of the thyroid nodule. In 2009, the Bethesda system for the cytomorphologic stratification of thyroid cytopathology, was established. In it, 6 categories carry a defined risk of malignancy. The Bethesda system was revised in 2017. The six categories remained, but there were some modifications mainly due to the reclassification of the encapsulated follicular variant of papillary carcinoma (VFCP), which is now called Noninvasive follicular thyroid neoplasm with papillary-like nuclear features (NIFTP). This reclassification changes the risk of malignancy for some of the Bethesda categories. Molecular biology testing is suggested in indeterminate cases.
Los nódulos tiroideos son frecuentes. En estudios ultrasonográficos, se encuentran en el 19 a 35% de la población1,2. A pesar de su frecuencia, solo 4 a 6.5% son malignos3,4.
La ecografía tiroidea debería realizarse en todos los pacientes con sospecha de nódulos tiroideos, para evaluar las características del nódulo y clasificarlos de acuerdo al índice de sospecha de cáncer5.
Las pautas actuales de la Asociación Americana de Endocrinología Clínica (AACE), sugieren clasificar los nódulos en tres grupos: Bajo riesgo, riesgo intermedio y alto riesgo6.
Recomendaciones para punción por aguja fina de tiroides7, se muestra en la Tabla 1.
Recomendaciones para la punción por aguja fina basándose en las características y tamaño ecográfico29
| Descripción | |
|---|---|
| A | Nódulos ≥1cm con patrón ecográfico intermedio o altamente sospechoso |
| B | Nódulos ≥1,5cm con patrón ecográfico de baja sospecha |
| C | Nódulos ≥2cm con patrón ecográfico de muy baja sospecha. Opción alternativa: seguimiento. |
| D | Para nódulos que no poseen los criterios anteriores, no es necesaria la PAAF*, incluyendo nódulos menores de 1cm y nódulos completamente quísticos |
La punción por aguja fina (PAAF) es el método más importante para el estudio del nódulo tiroideo.
Es un procedimiento ambulatorio, que se realiza sin anestesia. Es seguro, preciso y costo-efectivo8,9
La PAAF se realiza por el radiólogo o el endocrinólogo con asistencia del radiólogo, con una aguja 23 a 27 G, bajo visión ecográfica.
Mediante la aspiración, se obtiene un coágulo que se fija en formalina tamponada al 10%, posteriormente se incluye en parafina, se corta en forma seriada y se tiñe con Hematoxilina-Eosina. Además, se obtienen frotis para citología que se tiñen con Papanicolau10.
DIAGNÓSTICO CITOPATOLÓGICOPara el diagnóstico citopatológico de la PAAF, se usa actualmente el Sistema de Bethesda, descrito en 200911,12. La clasificación fue revisada en 201713 (Tabla 2) donde se mantienen las mismas categorías, con algunas consideraciones adicionales:
- -
La introducción de estudios de biología molecular como método adyuvante al examen cito-histológico.
- -
-La re-clasificación de la variante folicular de carcinoma papilar encapsulado (NIFTP) como entidad benigna.
| I. INSUFICIENTE O INSATISFACTORIA |
|---|
| Solo contenidos del quiste |
| Espécimen virtualmente acelular |
| Otros (Frotis hemorrágico, artefacto por desecación, etc.) |
| II. BENIGNO |
| Compatible con nódulo folicular benigno (incluye nódulo adenomatoide, nódulo coloideo, etc.) |
| Compatible con tiroiditis linfocitaria autoinmune (Hashimoto) |
| Compatible con tiroiditis granulomatosa subaguda (de Quervain) |
| Otros |
| III. LESIÓN FOLICULAR DE SIGNIFICADO INDETERMINADO O ATIPÍA DE SIGNIFICADO INDETERMINADO |
| IV. NEOPLASIA FOLICULAR O SOSPECHA DE NEOPLASIA FOLICULAR |
| Especificar si es de tipo oncocítico (células de Hürthle) |
| V. SOSPECHOSO DE MALIGNIDAD |
| Sospechoso de Carcinoma Papilar |
| Sospechoso de Carcinoma Medular |
| Sospechoso de metástasis |
| Sospechoso de Linfoma |
| Otros |
| VI. MALIGNO |
| Cáncer Papilar del tiroides |
| Cáncer pobremente diferenciado |
| Cáncer Medular del tiroides |
| Carcinoma Anaplástico |
| Carcinoma Escamoso |
| Carcinoma con características mixtas (especificar) |
| Cáncer metastásico |
| Linfoma |
| Otros |
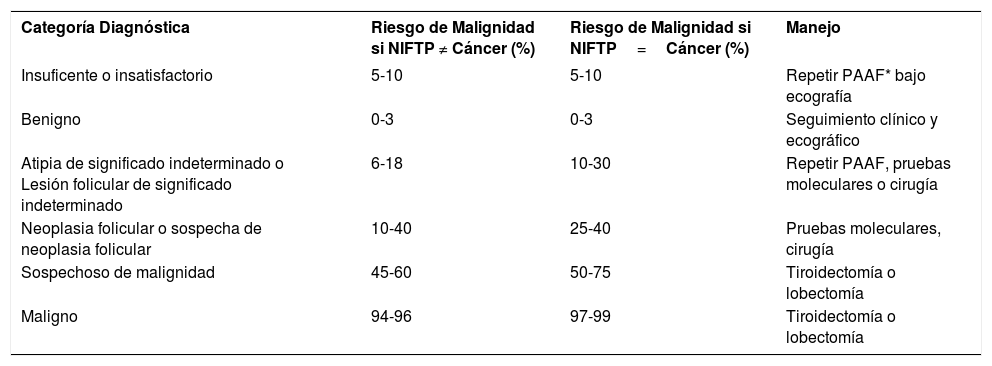
Cada categoría de Bethesda se asocia a un riesgo de malignidad y se dan recomendaciones para el manejo del paciente (Tabla 3).
Sistema de Bethesda para el informe de la citopatología de tiroides (2017) Riesgo de malignidad y manejo clínico recomendado30
| Categoría Diagnóstica | Riesgo de Malignidad si NIFTP ≠ Cáncer (%) | Riesgo de Malignidad si NIFTP=Cáncer (%) | Manejo |
|---|---|---|---|
| Insuficente o insatisfactorio | 5-10 | 5-10 | Repetir PAAF* bajo ecografía |
| Benigno | 0-3 | 0-3 | Seguimiento clínico y ecográfico |
| Atipia de significado indeterminado o Lesión folicular de significado indeterminado | 6-18 | 10-30 | Repetir PAAF, pruebas moleculares o cirugía |
| Neoplasia folicular o sospecha de neoplasia folicular | 10-40 | 25-40 | Pruebas moleculares, cirugía |
| Sospechoso de malignidad | 45-60 | 50-75 | Tiroidectomía o lobectomía |
| Maligno | 94-96 | 97-99 | Tiroidectomía o lobectomía |
PAAF=Punción por Aguja Fina.
Se debe incluir el nombre de la categoría y el número de la clasificación, por ejemplo: Tiroiditis Linfocitaria Crónica. Bethesda II.
Consideraciones respecto a las distintas categorías Bethesda:
I: Insatisfactoria/No-diagnósticaEn esta categoría se incluyen muestras hemorrágicas, con mala preservación celular e insuficiente número de células foliculares. Una muestra satisfactoria, debe incluir al menos 6 grupos de 10 células cada uno.
Hay varias excepciones: una muestra que contiene abundante coloide, es adecuada, aunque haya menos de 6 grupos celulares.
Si hay células atípicas, no importa el número de grupos celulares, se reporta como satisfactoria.
Las muestras que contienen solo macrófagos, se reportan como “contenidos de quiste” y si la ecografía no presenta hallazgos sospechosos, no es necesaria la re-punción.
Sin embargo, si la ecografía es sospechosa, está indicado repetir la punción.
Se considera aceptable, hasta un 4% de casos insuficientes/inadecuados. En centros con alto número de insuficientes, se recomienda:
- a)
Las PAAF deben ser realizadas bajo visión ecográfica, por radiólogos experimentados.
- b)
La lectura de las muestras debe ser realizada por citopatólogos expertos.
- c)
Se ha sugerido disminuir el número de células foliculares (menos de 6 grupos), pero no hay consenso al respecto7.
En esta categoría se incluyen muestras con macrofolículos sin atipía, coloide, linfocitos, granulomas, etc. (Nódulos hiperplásticos, quistes coloideos, tiroiditis autoimmune, tiroiditis granulomatosa).
III: Lesión folicular o atipia de significado indeterminadoEn esta categoría hay dos nombres alternativos. Cada laboratorio debe elegir uno de los dos nombres y usar siempre el mismo.
Se incluyen lesiones con células atípicas y nódulos mixtos macro y microfoliculares.
El riesgo de malignidad (ROM) es de 5 a 15%.
El problema es que la mayoría de los pacientes en esta categoría no se operan, por lo que hay una sobreestimación del ROM (sesgo de selección).
Se recomienda subclasificar la atipia: Atipia citológica, atipia arquitectural (microfolículos), abundantes células de Hürthle, entre otros.
Es recomendable usar esta categoría como “último recurso”. El porcentaje debería ser un 10% del total, como máximo. En centros con alto % de esta categoría, se recomienda como primera medida interconsultar el caso a un centro con mejor experiencia14. Otra alternativa es la re-punción, que se puede realizar de inmediato. No es necesario esperar, ya que no se producen atipías secundarias a la punción15.
En series de re-punción de casos indeterminados, el % de malignidad varía entre un 23 y un 48%15,16.
Se estima que el riesgo global de malignidad es de 5 a 15%. Sin embargo, existe un sesgo de selección tanto en la re-punción como en los casos que van a cirugía, ya que si la ecografía es de aspecto benigno y no hay otros factores de riesgo, los pacientes quedan en observación; los que son sometidos a re-punción y posteriormente cirugía son los pacientes con ecografía sospechosa de malignidad.
Si después de la re-punción, el caso persiste como indeterminado, se pueden realizar pruebas moleculares, pero este es un campo en evolución y actualmente de alto costo13.
IV: Neoplasia folicular o sospecha de neoplasia folicularEsta categoría incluye nódulos microfoliculares y lesiones de células de Hürthle.
En la revisión de 2017, se incluye una modificación a los criterios diagnósticos, debido a la nueva entidad NIFTP.
En la clasificación original, si las células presentaban núcleos sugerentes de cáncer papilar, eran excluidos. En la modificación de 2017, se incluyen casos con patrón microfolicular, con aumento del tamaño nuclear, bordes nucleares irregulares o núcleos claros, siempre que no hayan papilas o pseudoinclusiones nucleares.
Se debe agregar un comentario mencionando que los cambios nucleares podrían corresponder a VFCP o NIFTP. La distinción definitiva entre estas dos entidades, se logra con el estudio de la pieza quirúrgica. En estos casos los estudios de biología molecular podrían ser útiles.
V. Sospechoso de malignidadSe incluyen casos con algunas características de carcinoma, pero que no cumplen con todos los requisitos. Por ejemplo, fragmentos epiteliales con núcleos sugerentes de cáncer papilar, pero no se observan papilas. En esta categoría también pueden haber casos de NIFTP17,18.
VI. MalignoEsta categoría se usa cuando las características citomorfológicas son concluyentes para malignidad.
En esta categoría también pueden haber casos de NIFTP, por lo que se sugiere limitarla solo a casos de Carcinoma Papilar Clásico.
MARCADORES MOLECULARESSu uso se ha sugerido en los casos indeterminados, para tomar decisiones de manejo (cirugía). Las pruebas con más datos disponibles, son el Afirma Gene-expression Classifier19, el panel de 7 genes de mutaciones y reordenamiento20 y la inmunohistoquímica con Galectina-321,22.
El ensayo de Afirma (167 genes) evalúa la presencia de un patrón genético benigno. Tiene alta sensibilidad 92% y valor predictivo negativo (VPN) de 93%, pero muestra un bajo valor predictivo positivo (VPP) y baja especificidad 48-53%23. Un test benigno, predice bajo riesgo de malignidad, pero los nódulos clasificados como benignos, tienen un riesgo de malignidad cercano al 5%24.
El panel de 7 genes, que evalúa mutaciones puntuales de BRAF, NRAS, HRAS, y KRAS y además, los reordenamientos RET/PTC y PAX/PPARγ. Tiene alta especificidad 86-100% y VPP 84-100%, pero baja sensibilidad 44-100%25–27.
Esta es una área en desarrollo y se están estudiando otros marcadores. Sin embargo, ningún ensayo disponible puede confirmar o descartar malignidad en el 100% de los casos indeterminados.
Se necesitan datos a largo plazo para confirmar la utilidad de estos marcadores.
Por otro lado las pruebas moleculares son costosas y en la decisión para el manejo de un nódulo indeterminado se deben considerar otros factores como características ultrasonográficas, tamaño del nódulo, preferencia del paciente y la posibilidad de seguimiento.
En la actualidad, las pruebas moleculares son un complemento al estudio citopatológico de la PAAF y la ultrasonografía.
CONCLUSIONESLos nódulos tiroideos son frecuentes y se asocian a un riesgo global de malignidad de 4-6.5%.
La PAAF es costo-efectiva, precisa y presenta un bajo nivel de complicaciones.
Los nódulos menores de 1,0cm no requieren PAAF con algunas excepciones, por ejemplo, pacientes con adenopatías cervicales sospechosas28.
Los nódulos benignos pueden ser seguidos periódicamente con estudio ecográfico.
En los casos indeterminados (B-III y B-IV), se pueden usar pruebas moleculares como estudios complementarios.
Todos los casos con sospecha de malignidad o malignos (V y VI), deben ser referidos a cirugía.