El cáncer constituye la segunda causa de muerte en Chile; si bien los tumores malignos de encéfalo constituyen el 1.2% del cáncer en Chile, presentan alto impacto social por su mal pronóstico. En los últimos 20 años se ha desarrollado abundante investigación que ha llevado a dilucidar importantes mecanismos genéticos y epigenéticos de los tumores cerebrales. La nueva edición del año 2016 de la “Clasificación de tumores primarios del sistema nervioso central de la Organización Mundial de la Salud (OMS)” incorpora por primera vez la necesidad de contar con marcadores de biología molecular para la correcta clasificación de tumores astrocíticos, oligodendrogliales y méduloblastoma. Esperamos que la iniciativa de estructurar esta enfermedad en entidades con mecanismos biológicos comunes, nos permita un desarrollo futuro de terapias dirigidas o terapia personalizada con mayor efectividad para esta devastadora enfermedad.
Cancer is the second mortality cause in Chile; despite the malignant brain tumors are the 1.2% of cancer in Chile, they cause large social burden because of the poor prognosis. The profuse study of genetic and epigenetic mecanisms for the past 20 years have lead to a new understanding of this disease. The 2016 “WHO Classification of Tumors of the Central Nervous System” incorporates for the first time the use of molecular markers for the classification of astrocytic, oligodendroglial tumors and Medulloblastoma. We hope the concept of order brain tumors in categories with a common biological mechanism can lead to a new personalized and more effective therapeutic in this devastating disease.
A nivel mundial el cáncer es una de las principales causas de mortalidad, responsable de 8.2 millones de muertes el año 2012. Se prevé que el número de casos nuevos aumentará en un 70% en 20 años1. En Chile el cáncer constituye la segunda causa de mortalidad con una tasa de 129.5 por 100000 habitantes el año 2007. El plan piloto de registro de cáncer para el quinquenio 2003-2007 presenta una tasa ajustada de incidencia para cáncer de encéfalo (CIE-0 70-72) de 4.3 en hombres y 2.9 por 100000 habitantes en mujeres, correspondiendo al 1.2% de las neoplasias malignas en nuestro país. Cabe destacar la baja tasa de verificación histológica expuesta en el plan piloto de registro llevado a cabo en las regiones de Antofagasta, los Ríos y la provincia del Bio-Bío, la que alcanza sólo el 50% de los pacientes2. Las tasas de incidencia en Chile construidas a través de derivación a GES de tumores cerebrales benignos son 1.21 por 100000 habitantes para meningioma y 1.39 para 100000 habitantes para adenoma de hipófisis3. Dentro de los tumores primarios del sistema nervioso central (TPSNC) destacan por su mayor presencia en adultos los meningiomas 36.4%, tumores neuroepiteliales 25.2%, entre ellos el glioblastoma y tumores pituitarios 15.5%4. En niños y adolescentes existe una mayor presencia de tumores embrionarios 11.4% principalmente méduloblastoma, astrocitoma pilocítico 15.5% y tumores ependimarios 5.2%. Numerosos factores nutricionales y ocupacionales, así como la exposición a productos químicos e infecciones virales han sido estudiados como posibles factores de riesgo para TPSNC. Entre ellos, solamente las radiaciones ionizantes han mostrado evidencia consistente como factor de riesgo para tumores cerebrales.
En el seguimiento a largo plazo de niños expuestos a dosis bajas de radioterapia sobre el cuero cabelludo para el tratamiento de tinea capitis y hemangiomas cutáneos, se observó un riesgo relativo de 18 veces la población general para el desarrollo de tumores de la vaina nerviosa, 10 veces para meningioma y 3 veces para gliomas. En niños portadores de leucemia linfoblástica aguda tratados con quimioterapia y radioterapia encefálica profiláctica se ha mostrado también, una mayor incidencia de meningiomas y gliomas5. Existen algunos sindromes genéticos determinados por la presencia familiar de un oncogen específico que determinan una mayor tendencia a desarrollar TPSNC. Estos son la neurofibromatosis 1 (NF1) y 2 (NF2), la esclerosis tuberosa (TSC1,TSC2), síndrome de von Hippel - Lindau (VHL), síndrome de Li–Fraumeni (p53), el syndrome de Turcot (APC, hMLH1, hMSH2, PMS2) síndrome de Gorlin (PTCH1) y el síndrome de Cowden o hamartoma múltiple (PTEN). Fuera de dichos síndromes genéticos, los estudios realizados en familiares de pacientes con gliomas, muestran una gran variabilidad de resultados. Si bien, aparentemente existe una leve mayor incidencia de glioma en familiares de primer grado con preponderancia en hombres, el patrón de herencia que los estudios reportan, son poco consistentes con un patrón hereditario claro5.
A partir de 1979, la Organización Mundial de la Salud desarrolló un sistema de clasificación de los TPSNC basado en la célula de origen del proceso tumoral y características morfológicas asociadas al pronóstico. Considerando estos fenómenos los TPSNC se estratifican entre tumores6:
OMS Grado I: Tumores circunscritos, de lento crecimiento y bajo potencial de conversión a un tumor de mayor malignidad.
OMS Grado II: Tumores de borde difuso, lento crecimiento y, algunos, con tendencia a progresar a tumores de mayor malignidad.
OMS Grado III: Tumores infiltrantes con células atípicas o anaplásicas y mayor número de mitosis.
OMS Grado IV: Tumores de rápido crecimiento con alta tasa mitótica, pudiendo presentar vasos de neoformación y áreas de necrosis.
La clasificación OMS presenta una implicancia terapéutica, pues las lesiones OMS grado I, es decir, circunscritas o de borde neto pueden ser removidas en su totalidad a través de la neurocirugía; las lesiones infiltrantes OMS II, III y IV, al presentar un borde difuso su exéresis suele ser incompleta, por lo que requieren seguimiento imagenológico y, especialmente en lesiones OMS III y IV tratamiento de carácter oncológico como radioterapia y quimioterapia.
En las últimas dos décadas a través de intensa investigación en el campo de la tumorigénesis y desarrollo tumoral de distintos TPSNC, se han pesquisado alteraciones genéticas y epigenéticas que determinan subgrupos de tumores con diferente evolución (marcadores moleculares pronósticos) y subgrupos con diferente respuesta a tratamientos (marcadores moleculares predictivos). Como resultado, la clasificación de tumores del sistema nervioso central OMS versión 2016 (7) introduce por primera vez la necesidad de contar con la realización de estudios de biología molecular en algunos TPSNC como son la mutación IDH 1 y IDH 2 y co-deleción 1p19q para la correcta clasificación en tumores oligodendrogliales o WNT, SHH y p53 para clasificar meduloblastoma6 (Tabla1).
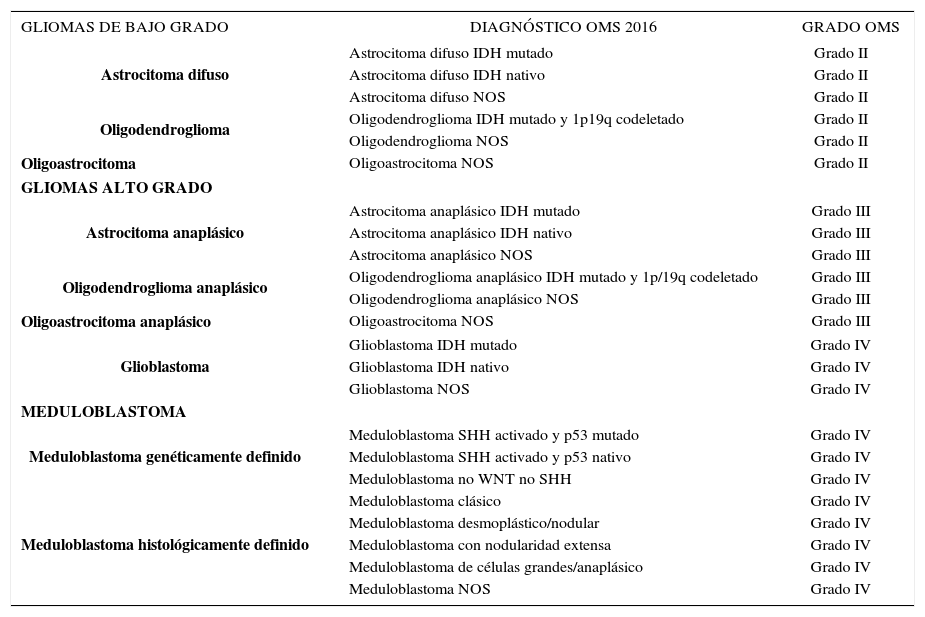
EXTRACTO CLASIFICACIÓN DE TUMORES DEL SISTEMA NERVIOSO CENTRAL, OMS AÑO 2016
| GLIOMAS DE BAJO GRADO | DIAGNÓSTICO OMS 2016 | GRADO OMS |
|---|---|---|
| Astrocitoma difuso | Astrocitoma difuso IDH mutado | Grado II |
| Astrocitoma difuso IDH nativo | Grado II | |
| Astrocitoma difuso NOS | Grado II | |
| Oligodendroglioma | Oligodendroglioma IDH mutado y 1p19q codeletado | Grado II |
| Oligodendroglioma NOS | Grado II | |
| Oligoastrocitoma | Oligoastrocitoma NOS | Grado II |
| GLIOMAS ALTO GRADO | ||
| Astrocitoma anaplásico | Astrocitoma anaplásico IDH mutado | Grado III |
| Astrocitoma anaplásico IDH nativo | Grado III | |
| Astrocitoma anaplásico NOS | Grado III | |
| Oligodendroglioma anaplásico | Oligodendroglioma anaplásico IDH mutado y 1p/19q codeletado | Grado III |
| Oligodendroglioma anaplásico NOS | Grado III | |
| Oligoastrocitoma anaplásico | Oligoastrocitoma NOS | Grado III |
| Glioblastoma | Glioblastoma IDH mutado | Grado IV |
| Glioblastoma IDH nativo | Grado IV | |
| Glioblastoma NOS | Grado IV | |
| MEDULOBLASTOMA | ||
| Meduloblastoma genéticamente definido | Meduloblastoma SHH activado y p53 mutado | Grado IV |
| Meduloblastoma SHH activado y p53 nativo | Grado IV | |
| Meduloblastoma no WNT no SHH | Grado IV | |
| Meduloblastoma histológicamente definido | Meduloblastoma clásico | Grado IV |
| Meduloblastoma desmoplástico/nodular | Grado IV | |
| Meduloblastoma con nodularidad extensa | Grado IV | |
| Meduloblastoma de células grandes/anaplásico | Grado IV | |
| Meduloblastoma NOS | Grado IV | |
NOS: no especificado, se utiliza en aquellos casos en los que el estudio molecular no se ha realizado.
La introducción de marcadores moleculares en términos diagnósticos, permite contar con elementos objetivos, reduciendo así la variabilidad interobservador habitual e incluso entre patólogos entrenados. Se organizan categorías que comparten características biológicas comunes, permitiendo así tomar mejores decisiones terapéuticas; el mejor pronóstico observado en meduloblastoma WNT ha llevado a plantear la evaluación de un tratamiento más conservador y con menor toxicidad. Los oligodendrogliomas grado II y III IDH mutado y 1p19q codeletado han mostrado una mejor respuesta a tratamientos combinados de radioterapia y quimioterapia. Sin embargo, el proceso continúa, a través de iniciativas multicéntricas como es The Cancer Genome Atlas (TCGA) que estudiaron 500 muestras de glioblastoma pre-tratamiento con análisis de ADN (número de copias, secuenciamiento y metilación), de ARNm (perfil de expresión genómica) y micro ARN (regulación de la expresión) se ha determinado que bajo la categoría histológica de glioblastoma subyacen 4 entidades con un perfil molecular diferenciado: proneural, neural, clásico y mesenquimal7. El glioblastoma proneural es la variante más frecuente en glioblastomas secundarios, es decir, aquellos que provienen de gliomas OMS grado II y III. Su alteración más frecuente es la mutación del IDH1 e IDH2 y PDGFRA. Es la variante de mejor pronóstico.
El glioblastoma neural presenta marcadores de expresión neuronal como el NEFL, GABRA1, SYT1, and SLC12A5.
El glioblastoma clásico presenta amplificación del cromosoma 7 y pérdida del cromosoma 10, así como amplificación del EGFR en el 97% de ellos.
El glioblastoma mesenquimal presenta deleción 17q11.2, región que codifica en gen NF1, así como marcadores mesenquimales. Es el subtipo de peor pronóstico7.
Así el devastador glioblastoma se diagnostica hoy como glioblastoma IDH mutado (sobrevida global 31 meses), glioblastoma IDH nativo (sobrevida global 15 meses)6, pero se reconocen con estudios moleculares avanzados cuatro categorías distintas. Esta transición actual desde una clasificación de carácter estructural a una basada en biología molecular que reconoce los distintos mecanismos de iniciación y desarrollo de la enfermedad, busca subdividirlas en entidades biológicamente más homogéneas. Esto permitirá el estudio de nuevas terapias dirigidas a blancos específicos y esperamos en un futuro acercarnos a un terapia personalizada y altamente efectiva para nuestros pacientes.
La autora declara no tener conflictos de interés, en relación a este artículo.