Las epilepsias resistentes a fármacos son aquellas donde hay persistencia de crisis pese a un tratamiento farmacológico óptimo. En niños, su tratamiento es diferente al de los adultos, ya que las crisis producen daños encefálicos irrecuperables en un cerebro en desarrollo, por lo que se recomienda plantear la cirugía lo más precoz posible en casos de epilepsia refractaria y con alternativa terapéutica quirúrgica, incluso aunque las crisis lleven pocos meses de evolución.
Entre el 25 al 33% de los niños presentan epilepsias resistentes a fármacos y la mitad de ellos son candidatos para iniciar un estudio prequirúrgico. En Chile, aproximadamente 347 niños al año necesitarían cirugía, pero no se operan más de 50 casos al año. Si a esto agregamos los casos rezagados de los años anteriores, significa que hay miles de niños que esperan por una cirugía de la epilepsia. Este artículo revisa el estado del arte actual.
Drug resistant epilepsy is defined as the persistence of seizures, despite the optimal antiepileptic treatment. However the approach is different in children because they have a brain that is still developing. The International League Against Epilepsy proposed for these children to “eliminate seizures as soon as possible to optimize cognitive development, and improve behavior and quality of life”. About 25 to 33% of epileptic children have refractory epilepsy and half of them require a pre-surgical evaluation. Around 347 children in Chile need epilepsy surgery treatment every year, but no more than 50 get access to it. If we include cases of previous years, the waiting list in Chile is over 1,000 children. This paper analyzed the state of art in epilepsy surgery in children.
En todo el mundo, las epilepsias resistentes a fármacos son el mayor problema para los pacientes con epilepsia (1-4), especialmente cuando se trata de niños (5-7), siendo el principal reto para los profesionales involucrados en su tratamiento (8, 9).
La Liga Internacional contra la Epilepsia (ILAE) define a la “Epilepsia resistente a fármacos” (“drug resistant” en inglés), como la falla de dos o más fármacos anti-epilépticos (FAEs) adecuados, bien tolerados, apropiadamente elegidos, y correctamente usados, administrados en mono terapia o en combinación, que lleven a la libertad de crisis (10). De hecho, la misma ILAE prefiere no usar los términos “intratable” o “refractaria”, dado que puede involucrar la idea que no existe alternativa terapéutica para estos pacientes. Sin embargo, esta definición está orientada más bien a adultos, ya que en niños el enfoque es muy diferente, porque el tiempo de evolución de las crisis, el tipo de síndrome, etiología de las crisis y la edad del niño, son factores fundamentales para determinar en forma temprana la refractariedad y plantear un cirugía de la epilepsia lo más precoz posible, para evitar secuelas neurológicas permanentes de un cerebro en desarrollo.
En adultos se recomienda esperar un máximo de dos años antes de diagnosticar a un paciente como refractario. Sin embargo, en niños, dependiendo del síndrome epiléptico y su etiología, en muchos casos se deben plantear escasos meses entre el inicio de crisis y la cirugía de la epilepsia refractaria (5-7, 11).
En algunos casos de niños candidatos a cirugía de la epilepsia deberíamos hablar de “encefalopatía epiléptica”; es decir: un grupo de desórdenes, donde el paciente presenta epilepsia refractaria y/o actividad epileptiforme en el electroencefalograma (EEG), que implica un alto riesgo de daño cognitivo progresivo y/o déficits neurológicos permanentes. La mayoría de estas condiciones son edad dependiente y afectan al cerebro inmaduro que está en desarrollo (13, 14).
En el presente texto se analizará el estado actual de la cirugía de la epilepsia en niños, con especial acento en Chile.
Epidemiología de la epilepsia resistente en niñosUn estudio del año 2006 reportó 144 niños con epilepsia recién diagnosticada y con un seguimiento de 37 años (15), este mostró que el 67% tiene un excelente pronóstico con remisión total de sus crisis, un 33% tendrá epilepsia de pobre pronóstico sin remisión; de estos, un 19% son fármaco resistentes desde el inicio y un 14% de mal curso (crisis que remiten y luego regresan).
Por otro lado, el año 2009 un estudio prospectivo en Connecticut, EE.UU. mostró que la incidencia de epilepsia en niños es de 500 casos por millón de habitantes año (N = 613), de los cuales un 25,4% llega a ser refractarios (127 casos por millón de habitantes año), cerca de la mitad de estos necesitará evaluación pre-quirúrgica y 21 niños por millón de habitantes año necesitarían ser sometidos a una cirugía de la epilepsia, lo cual supera por lejos a las cirugías de tumores intracraneanos en niños (6 casos por millón de habitantes año) (16).
En consideración a lo anteriormente descrito, la mayoría de los niños con epilepsia recién diagnosticada tienen un pronóstico favorable a largo plazo, en particular los casos de causa idiopática, quienes eventualmente irán a la remisión. En contraste, las epilepsias permanecen resistentes a fármacos (activa) son aproximadamente un 25 a 33%, llegando a ser intratables y requiriendo cirugía entre un 4,5 a 10% del total de los casos nuevos. Los FAE probablemente no influencian el curso de la epilepsia; estos sólo suprimen crisis.
Chile tiene aproximadamente 16.500.000 de habitantes. Si tomamos la incidencia de epilepsia de Connecticut (16), cada año Chile tendría alrededor de 8.250 niños nuevos con epilepsia, de los cuales 2.096 tendrían “epilepsia resistente a fármacos” (epilepsia activa o no controlada) y 347 niños al año necesitarían una cirugía de su epilepsia.
Sin embargo, en la actualidad en Chile no se operan más de 50 niños al año (a lo menos la mitad de estos en nuestra institución) (17), existiendo una falencia anual cercana al 85,0% de lo esperado para el país. A lo anterior se deben agregar los niños en espera de cirugía de los años previos, lo que permite extrapolar que en Chile hay miles de niños con indicación quirúrgica, pero sin acceso a ella, ya sea por razones de desconocimiento médico, complejidad y/o alto costo del diagnóstico pre-quirúrgico, falta de centros debidamente equipados o del personal entrenado para hacer cirugías complejas con estudio invasivo, como son los “Centros Avanzados de Cirugía de la Epilepsia”.
Los centros de epilepsia, según el entrenamiento de su personal y los recursos de equipamientos, se dividen en básicos y avanzados (18), donde en los básicos pueden realizar cirugía de la epilepsia en niños, tales como lesionectomías, callosotomías, implantación de estimulador de nervio Vago y hemisferectomías. Los centros avanzados por sus mayores recursos humanos y tecnológicos, como el caso de nuestra institución, pueden realizar además de los procedimientos antes descritos, cirugía invasiva con implantación de electrodos intra-craneanos, cirugía en pacientes sin lesión; es decir, Resonancia Magnética (RM) cerebral normal, en lactantes menores, etc.
Bases de la cirugía de la epilepsia en niñosLos niños tiene un cerebro en desarrollo, donde al año de vida su volumen ya ha alcanzado más del 50% y a 6 o 7 años más del 90% del volumen final que tendrá el encéfalo como adulto. Además en los dos primeros años se produce su mielinización. Por lo tanto, cualquier daño que afecte al cerebro en desarrollo, entre más precoz sea, mayor será su secuela posterior (13, 19, 20).
Basado en lo anterior, la ILAE ha establecido que “se deben eliminar las crisis tan pronto como sea posible para optimizar el desarrollo cognitivo, mejorar los aspectos conductuales y la calidad de vida del paciente” (21). Por lo tanto, la ILAE sugiere que las indicaciones para referir niños a un centro de cirugía de la epilepsia son:
- 1)
Todo niño con persistencia de crisis generalizadas o focales, después de usar 2 o 3 FAEs o por efectos inaceptables de los FAEs. Especialmente importante si hay más de una crisis por día, aunque la RM inicial sea “negativa”.
- 2)
Niños bajo 2 años: Urgente referir para prevenir retraso del desarrollo y encefalopatía epiléptica, especialmente si hay crisis diarias.
- 3)
Casos Especiales: Epilepsia del lóbulo temporal, displasia cortical, tumores con crisis, esclerosis tuberosa, Sturge-Weber, hemimegalencefália, encefalitis de Rasmussen, hamartoma hipotalámico, etc.
Existe un grupo de niños con epilepsias muy refractarias desde su inicio, quienes además cursan con severo daño neurológico, donde muchas veces su mala calidad de vida está dada más que por la frecuencia de crisis, por el déficit neurológico agregado. Este es un grupo no muy bien definido en la literatura y cuya nominación de “catastrófica” aún está en discusión, dado que le da una connotación de irreversibilidad, donde muchas veces, por ser epilepsias primariamente generalizadas o multifocales independientes, la única alternativa terapéutica es una cirugía paliativa, para mejorar su calidad de vida (18, 19).
Estudio pre-quirúrgicoTodo niño portador de epilepsia refractaria debe tener una indicación quirúrgica certificada por un(a) neurólogo(a) infantil, idealmente con sub-especialidad en epilepsia. Cada caso debe ser estudiado en detalle y contar con: historia clínica detallada, vídeo EEG (ictal/inter-ictal), RM de alta resolución y eventualmente evaluación neuropsicológica, si la edad lo permite.
La ILAE tiene una fuerza de trabajo para cirugía de la epilepsia en niños y diagnóstico, cuyas recomendaciones de baterías diagnósticas serán publicadas este año. El esquema de flujograma sugerido se presenta en la Figura 1 (22).
Resumen de abordaje diagnóstico pre-quirúrgico de niños portadores de epilepsia refractaria (22)
EEG: Electroencefalografía, RM: Resonancia Magnética de cerebro, RMF: Resonancia magnética funcional, PET: Imagen de emisión de positrones, MEG: Magnetoencefalografía, ETM: Esclerosis temporal mesial, DCF: Displasia cortical focal (Nota: modificada por el autor la indicación de PET en Esclerosis tuberosa, ya que en nuestro centro es de regla).
La cirugía de la epilepsia en niños difiere en múltiples aspectos a la de adultos, como lo son: sus etiologías, tipos de cirugía, momento de la cirugía (ya analizado previamente) y hallazgos del EEG pre-operatorios.
Etiología y control de crisisEl control de crisis post-operatorio en cirugías curativas varía según la etiología y localización de la lesión, así como la buena determinación del área epileptógena involucrada. En lesiones tenemos para tumores o displasias corticales se logra hasta un 70 a 80% de libertad de crisis, al igual que para hemisferectomías, cuando su etiología es un Síndrome de Rasmussen, pero este porcentaje baja a 60% cuando la causa de la hemisferectomía es una hemimegalencefalia (18, 19, 23).
Un registro realizado por la ILAE en cirugía de la epilepsia en niños de países desarrollados (23), mostró que las principales etiologías al estudio histopatológico fueron: displasias corticales (42,4%), tumores (19,1%), atrofia o secuela vascular (10%), esclerosis del hipocampo (6.5%), etc. Lo cual es muy diferente en adultos (24), donde la principal etiología es la esclerosis hipocampal (43.5%), seguida de los tumores (30%) y las displasias corticales ocupan el tercer lugar con solo un 13% de los casos. La displasia cortical (DC) es la principal causa de epilepsia refractaria en niños (22, 25). Estas están incluidas dentro de las Malformaciones del Desarrollo Cerebral (MDC), las que ocurren en le primer trimestre de la gestación.
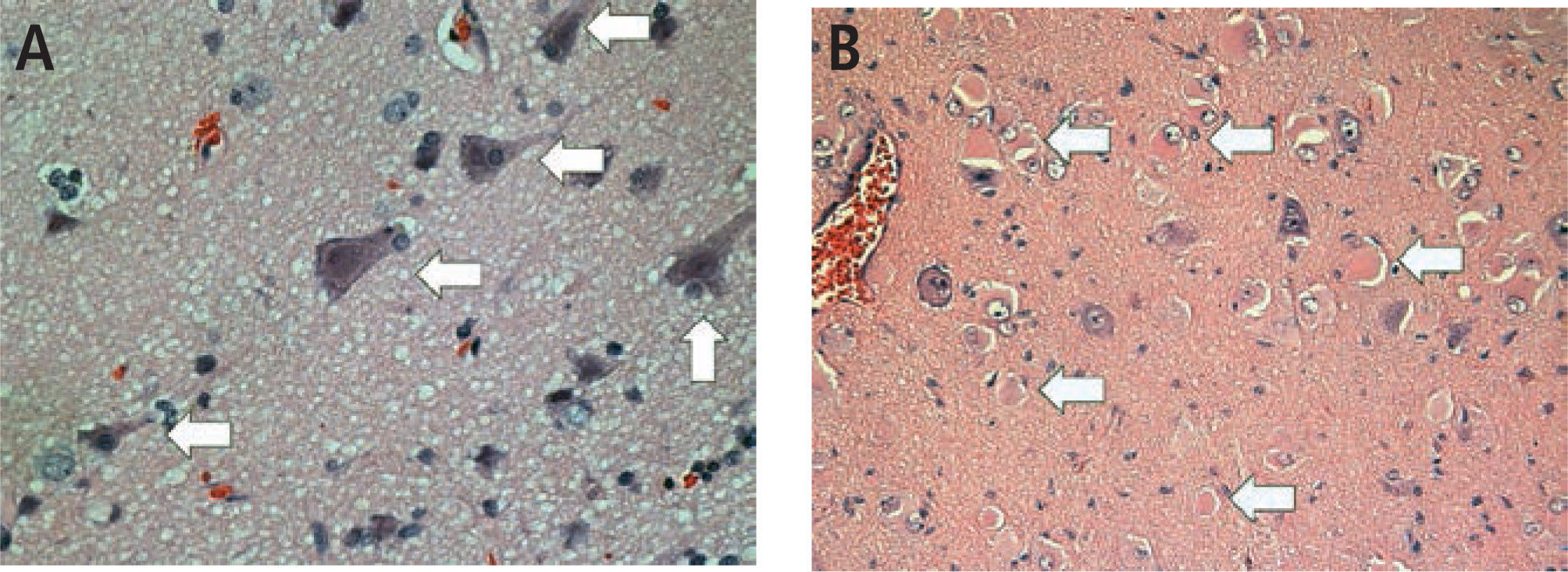
Existen múltiples clasificaciones (embriológicas, radiológicas, etc.), pero la más aceptada actualmente por la ILAE se basa en sus hallazgos histológicos (26-28), (Figura 2):
Tipo IA: Deslaminación Cortical más comúnmente con neuronas heterotópicas.
Tipo IB: Deslaminación Cortical con meganeuronas.
Tipo IIA: Deslaminación Cortical con neuronas dismórficas.
Tipo IIB: Deslaminación Cortical con “balloon cells” (células en Balón o Globo
Tipo III: Displasia cortical focal asociada a:
IIIA Esclerosis Hipocampal
IIIB Tumores
IIIC Malformaciones vasculares
IIID: Lesiones adquiridas precozmente en la vida: traumatismos, isquémias, encefalitis, etc.
En algunas oportunidades es muy difícil de diagnosticar, ya que pueden ser alteraciones microscópicas invisibles a la RM, aunque esta sea de alta resolución, como ocurre especialmente en los casos de DC tipo I. A lo anterior debemos agregar que en niños menores de dos años sus cerebros están madurando y van variando la cantidad de agua y progresivamente va produciéndose la mielinización. Entonces las imágenes de RM pueden ser muy variables en los primeros 24 meses, pasando a estabilizarse luego de dos años; por lo tanto una RM normal antes de los dos años no garantiza que lo será a futuro. La sensibilidad para detectar DC de una RM realizada con protocolo de epilepsia no supera el 66%. El PET (Positron emission tomography) con un 80% es el examen de mayor sensibilidad en el estudio de las DC (29). Por lo tanto el abordaje diagnóstico de las DC debe ser multimodal (EEG, RM, PET, etc.). En nuestra institución tenemos excelentes resultados en evaluar la zona epileptógena con PET, tanto inter-ictal, como ictal, aunque la RM sea normal o no concluyente (Figura 3). El control de crisis llega hasta un 80% cuando la resección de la DC es completa, pero cae a solo un 20%, cuando la resección es incompleta (29).
Niño portador de epilepsia refractaria evaluado por primera vez en el año 2004 en otra institución. Presenta crisis focales caracterizadas por extensión de extremidad superior izquierda. En el video EEG las crisis se inician en la región posterior derecha (parietal), además de abundante actividad inter-ictal de la misma localización. Dado que su RM es normal se descartó cirugía. Pero vuelve a consultar en nuestra institución seis años después y se realiza PET, el que muestra hipometabolismo parietal derecho y nueva RM volumétrica de alta resolución ponderada en T1, revela lesión compatible con displasia cortical en la misma zona del hipometabolismo (Fig. 3, flechas), el caso fue estudiado con ECoG crónica y la patología correspondió a una DC IIB. El paciente permanece libre de crisis con seguimiento de tres años. Este caso enfatiza la necesidad de repetir RM con imágenes avanzadas, cuando se tiene una primera RM normal y un PET anormal.
Las cirugías más frecuentes en niños en países desarrollados son las resecciones lobares (48%), seguidos de las hemisferectomías e implantación de estimulador del nervio Vago (VNS) con un 15,8% cada una. Las callosotomías ocupan apenas el 6to lugar, con solo un 3,1% (23). Sin embargo, en países en vías de desarrollo, esta técnica quirúrgica, pese a no existir estadísticas, debe tener un mayor porcentaje, considerando su menor costo y alta efectividad, especialmente para las crisis de caídas (atónicas o hipertónicas).
Tanto la implantación del VNS, como la callosotomía se consideran cirugías paliativas, cuya meta es bajar la frecuencia e intensidad de crisis, pero no curar la epilepsia (20, 30). Ambas tienen similares indicaciones (crisis primariamente generalizadas o multifocales), las diferencias en su indicación básicamente tienen una explicación en los costos asociados (US$ 26,000 solo el costo del equipo de VNS en Chile). los riesgos quirúrgicos, pero también en la efectividad. El VNS tiene como gran ventaja, que su implantación no tiene riesgo de mortalidad o secuelas neurológicas, como si lo tiene la callosotomía. Sin embargo la callosotomía para algunos tipos de epilepsia primariamente generalizada tiene mejor control de crisis que el VNS, donde la reducción de crisis (superior al 50% del pre-operatorio), llega a un máximo de 80% para callosotomías y de solo 40 a 60% para VNS (20); además la callosotomía es efectiva de inmediato y el éxito del VNS se debe esperar hasta dos años. En el Centro Avanzado de Epilepsia se realizan callosotomías con sección completa del cuerpo calloso, ya que así se desconectan ambos hemisferios y de los primeros 10 niños, con esta técnica los resultados en control de crisis fueron obtenidos en forma inmediata en nueve de ellos, sin mortalidad y solo un caso de leve hemiparesia transitoria. De esta serie, tres niños tenían ya un VNS instalado que había fallado en el control de sus crisis.
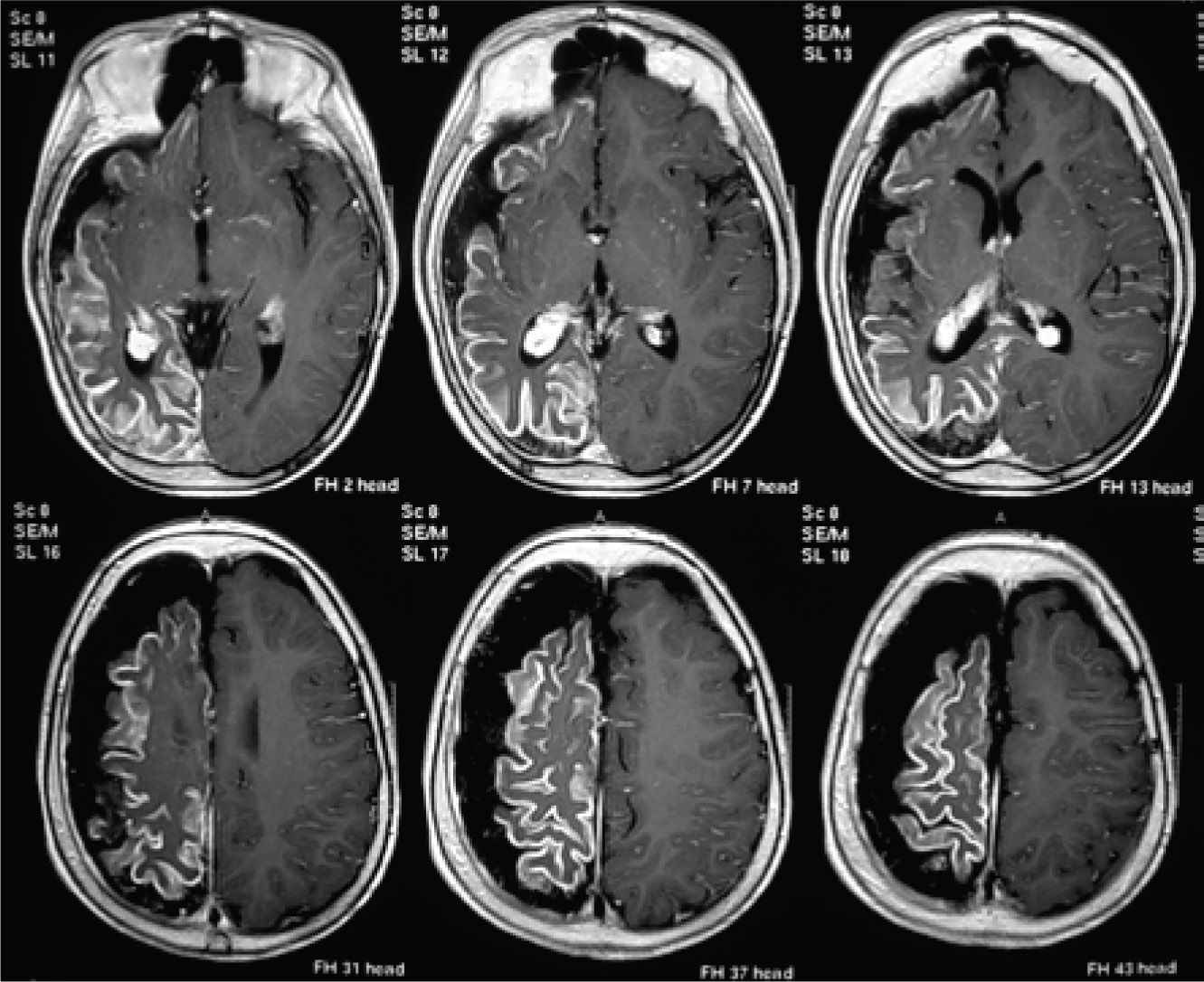
Hallazgos en el EEG pre-operatorioEn adultos se debe buscar una coherencia entre el foco eléctrico y la lesión cerebral mostrada por la RM. Pero en niños esta premisa no es estricta. En niños y adolescentes seleccionados, portadores de grandes lesiones unilaterales en la RM, de tipo congénitas o adquiridas precozmente. A pesar de tener abundantes descargas generalizadas o contralaterales en el EEG, los resultados en el control de crisis son iguales post-cirugía, que los pacientes con lesiones similares y alteración al EEG ipsilateral (32). La expresión difusa del EEG puede deberse a una interacción entre la lesión de instalación precoz y el cerebro en desarrollo (Figura 4).
Niño portador de epilepsia refractaria con crisis de clínica frontal de área motora suplementaria y hemiparesia izquierda. RM de cerebro, corte axial en ponderación T1, con contraste (Gadolinio), muestra un Síndrome de Sturge Weber de hemisferio cerebral derecho. Se ve captación anormal del contraste en toda la corteza hemisférica derecha, así como atrofia de todo el hemisferio. Este caso fue evaluado en el año 2005 en otra institución y “se desechó alternativa quirúrgica por presentar EEG, con actividad ictal contra-lateral”. Post-publicación de Wyllie (Ref. 31) el niño fue evaluado en nuestra institución y pese a persistir los mismo hallazgos, se realizó una hemisferectomía funcional en el año 2011, permaneciendo libre de crisis hasta la fecha.
Grupos seleccionados de pacientes pueden requerir implantación de electrodos sub-durales o intra-cerebrales, para electrocorticografía (ECoG). Esta puede ser:
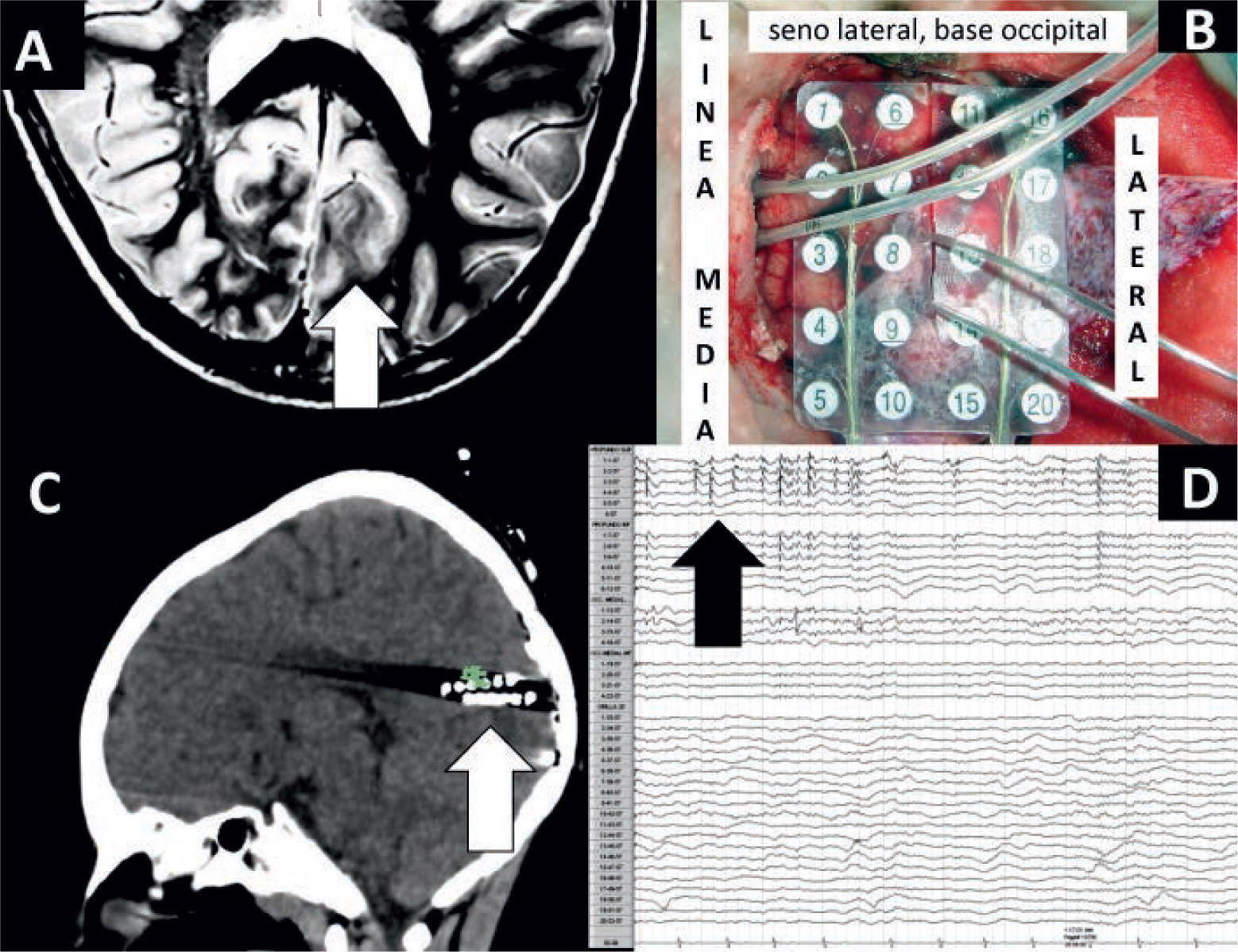
a) Crónica (peri operatoria), la cual incluye dos cirugías de la epilepsia, la primera para la implantación de los electrodos y la segunda cirugía post-monitoreo neurofisiológico, en orden a definir de manera óptima el área epileptógena por ECoG crónica y/o realizar estimulación cerebral, para definir áreas elocuentes (motor, lenguaje, visión, etc.) (Figura 5). Pero este procedimiento puede fracasar si no se logra determinar el área epileptógena o esta coincide con áreas elocuentes (32).
Niño portador de epilepsia refractaria con clínica de crisis occipitales (alteraciones en el campo visual y profundidad a derecha). RM de cerebro revela lesión occipital izquierda (A, flecha), implantación con dos electrodos profundos y sub-durales posteriores y mediales (B), TAC de cerebro confirma posición de electrodos profundos en relación a la lesión (C, flecha) y Electrocorticografía crónica que muestra actividad epileptógena solo en los electrodos profundos (D, flecha). Lo anterior muestra la importancia del uso de los electrodos profundos, ya que si solo se hubieran implantado electrodos sub-durales, no se podría haber determinado en forma precisa el área epileptógena. Biopsia: DC IIB, paciente libre de crisis a la fecha.
b) Intraoperatoria, la ECoG en la sala de operaciones está validada por numerosos autores (33-35), aunque tiene como limitaciones el solo tener registros inter-ictales y por poco tiempo. Nosotros la usamos de regla en todos los casos operados, donde su etiología es una probable DC o tumores, tales como gangliogliomas o disembrioplasticos neuroepiteliales, etc. incluso la ECoG intra operatoria es muy útil en la evaluación post resección, aunque el paciente haya ya estado implantado en forma crónica, para poder certificar la resección completa del área epileptógena.
SíntesisLa neurobiología y la plasticidad del cerebro en desarrollo guían la decisión clínica para la cirugía de la epilepsia en niños. Donde el propósito es detener las crisis precozmente para prevenir mayores daños cognitivos.
Niños con crisis refractarias están en riesgo de retraso del desarrollo y muerte prematura. Si las crisis del niño no son controladas por FAEs, el médico y los padres deben saber el por qué y realizar todos los estudios, para determinar la etiología de la epilepsia y así realizar una eventual cirugía.
Los hallazgos clínicos de casos operados y las etiologías son diferentes en las series pediátricas comparadas a los adultos.
La Organización Panamericana de Salud (OPS) lanzó el 2011 una “Estrategia y Plan de acción sobre las epilepsias”, cuyo objetivo es mejorar el diagnóstico y tratamiento de las personas con epilepsia en las Américas (36). Por lo tanto, Chile tiene un compromiso adquirido con las autoridades mundiales, para mejorar la calidad de vida de las personas con epilepsias, especialmente a los más necesitados, como son los niños.
En Chile existen centros básicos y avanzados de epilepsia, donde se pueden realizar todos los procedimientos de cirugía de la epilepsia en niños. El desafío está en poder ofrecer esta gran herramienta terapéutica a toda la población, por su alto impacto en la calidad de vida de los pacientes y sus familias. Además de ser costo beneficio para el Estado, ya que logra reincorporar a niños a una vida normal e independiente en la gran mayoría de los casos, con lo cual se ahorran grandes cantidades de recursos. El desafío está planteado y depende en gran medida de las autoridades solucionar el problema a miles de niños en Chile portadores de epilepsia refractaria y susceptibles de cirugía.
Agradecimientos: a todo el equipo humano del “Centro Avanzado de Epilepsias” de Clínica Las Condes. Especialmente a las epileptólogas (orden alfabético): Carolina Álvarez, Andrea Contreras, Larisa Fabres, Gisela Kuester, Isabel López, Loreto Ríos, Francesca Solari, Ximena Varela. El neuro-radiólogo Marcelo Gálvez y el especialista en PET David Ladrón de Guevara. Los neuropatólogos Facundo Las Heras y Roger Gejman (PUC). La neuro-psicóloga Carolina Pérez; las psiquíatras Flora de la Barra y Vania Krauskopf; el ingeniero Gonzalo Rojas; y la enfermera Jefa de Epilepsia, Loreto Olate, sin quienes este trabajo sería imposible.
Los autores declaran no tener conflictos de interés, con relación a este artículo.