La degeneración macular relacionada a la edad es la causa más frecuente de pérdida de visión irreversible en personas mayores de 60 años. Son factores de riesgo la edad, la genética, el tabaquismo y la obesidad abdominal. Su primera manifestación visible son las drusas, acumulación de productos provenientes de la degradación incompleta de la digestión de segmentos de fotoreceptores por el epitelio pigmentario. La administración de antioxidantes y zinc disminuye el riesgo de pérdida severa de visión en un 25% en pacientes con drusas. El proceso puede evolucionar a la atrofia de fotoreceptores y epitelio pigmentario (forma seca) o a la aparición de vasos de neoformación que invaden el espacio subretinal, son sangre y líquido subretinal (forma húmeda). La primera es de comienzo insidioso y lentamente progresiva. La segunda produce pérdida brusca de visión central. No existe hoy día un tratamiento eficaz para la forma seca.
La forma neovascular no tratada tiene un pobre pronóstico conduciendo a ceguera legal.
Sin embargo, la terapia antiangiogénica con inyecciones intravitreas repetidas de bloqueadores del factor de crecimiento endotelial (VEGF) permite la estabilización o mejoría de visión en la mayoría de los pacientes.
Age-related macular degeneration (AMD) is the leading cause of irreversible blindness in persons over 60 years of age. Risk factors are age, genetics, smoking and abdominal obesity. Drusen are the first visible sign of the disease, as yellow deposits lying deep in the retina. Drusen are accumulation of residual bodies due to incomplete digestion of the outer segments of the photoreceptors by the retinal pigment epithelium. In patients with drusen, the administration of antioxidants and zinc, reduces the risk of severe loss of vision by 25%. The disease may progress to atrophy of the retinal pigment epithelium (“dry AMD”) or to a neovascular form, with invasion of the subretinal space by sprouts of coroidal neovascularization, with blood and subretinal fluid (“wet AMD”). The dry form is a slowly progressive disease, with patches of retinal pigment epithelium and photoreceptor atrophy. Patients with the wet form experience sudden loss of vision. There is no proven effective treatment for the dry form today.
Neovascular AMD has a poor prognosis if left untreated, resulting in legal blindness. However, antiangiogenic therapy with anti-vascular endotelial growth factor modalities, administered in repeated intravitreal injections, allows stabilization or improvement of visual acuity in most cases.
La degeneración macular relacionada a la edad (DMRE) es la causa más frecuente de pérdida severa de visión en ambos ojos en personas mayores de 60 años. El aumento de la esperanza de vida en nuestra población se manifestará en un aumento exponencial de esta patología, ya que el riesgo de DMRE aumenta con la edad. En el Framingham Eye Study, 6.4% de las personas de 65–74 de edad y 19.7% de los mayores de 75 años tenían DMRE (1).
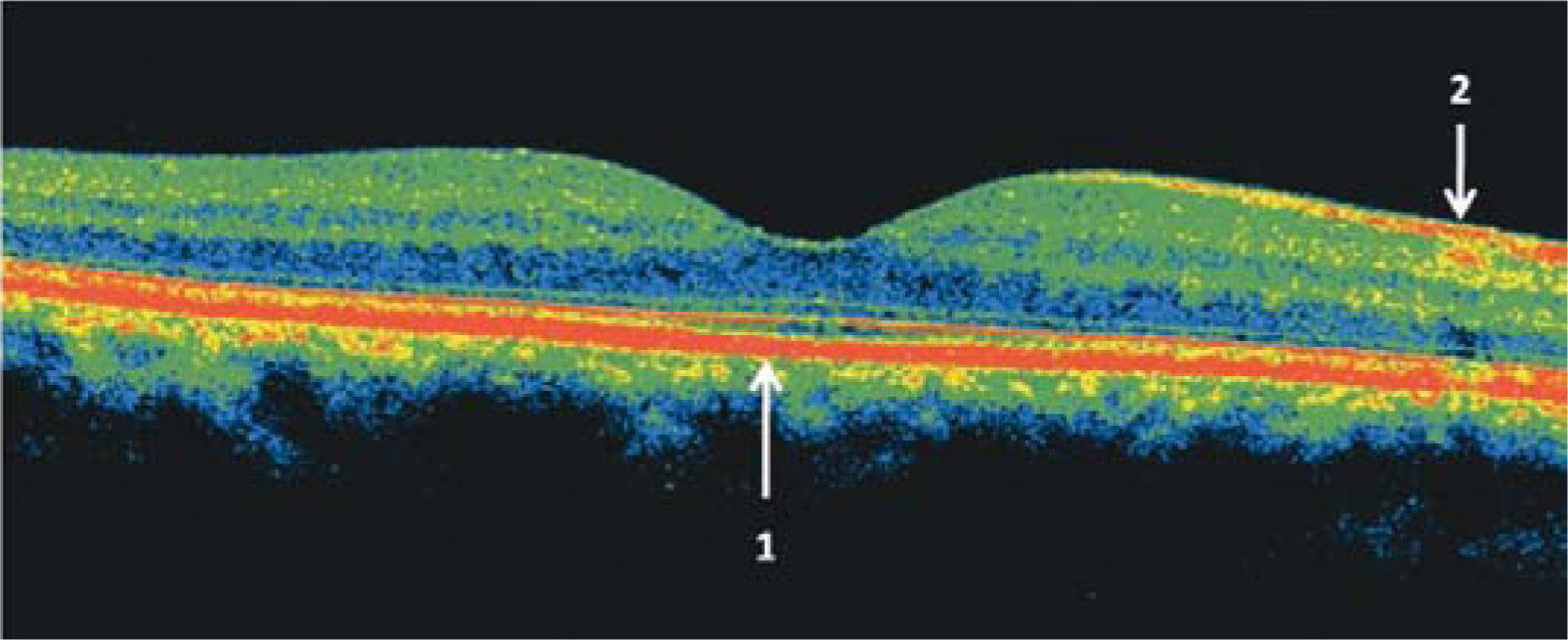
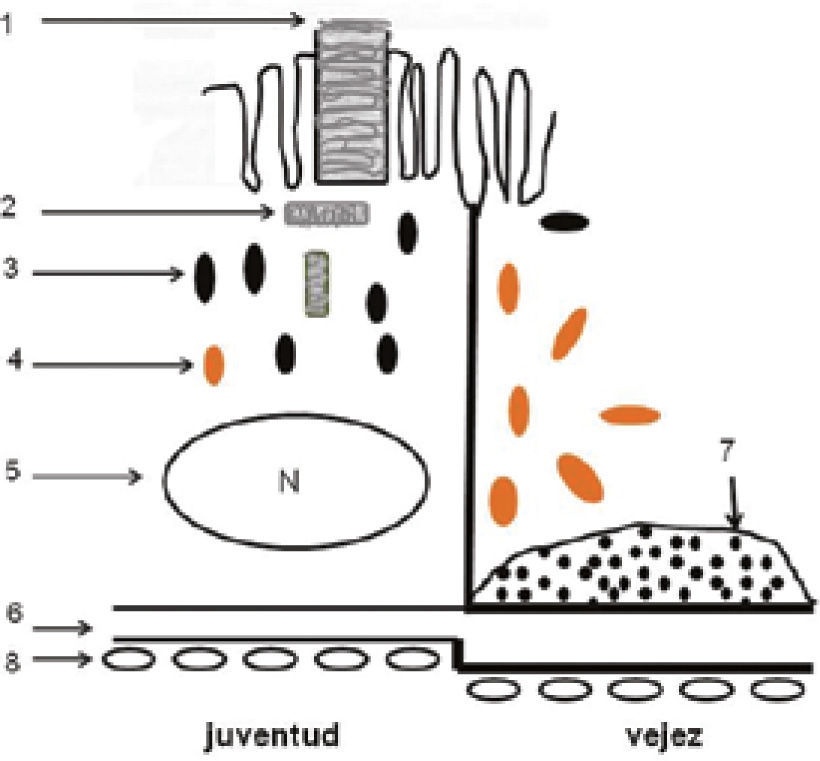
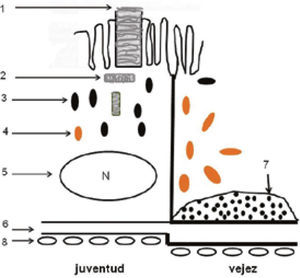
La mácula es un área pequeña de la retina posterior de 5 a 6mm de diámetro, conocida como mácula lútea, por el color amarillo que imparten sus carotenoides, luteína y zeaxantina. Los carotenoides tienen propiedades antioxidantes y protegen a la mácula del componente azul de la luz, previendo el daño fótico. La mácula presenta una depresión en el centro denominada la fóvea, anatómicamente configurada para obtener la más alta resolución visual (Figura 1). Toda patología de la mácula afecta la visión fina, como es la lectura o el reconocimiento de los rostros. La DMRE, si compromete ambas máculas hará imposible la lectura y, por tanto, impactará severamente la calidad de vida de esa persona; el paciente podrá deambular, porque el campo visual periférico estará conservado, pero su acceso a la información y al entretenimiento y a la interacción social estará severamente limitado. De allí la importancia de las normas de prevención y tratamiento, por limitadas que éstas sean en sus resultados en la actualidad.
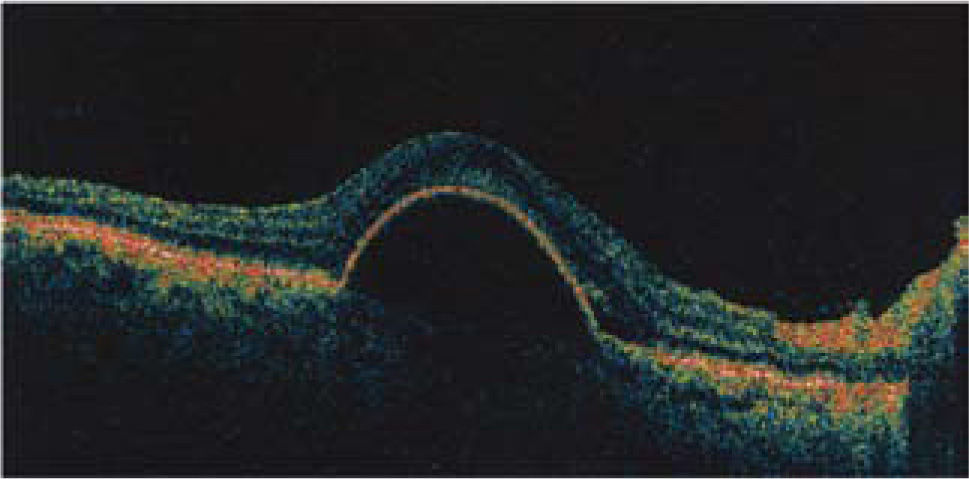
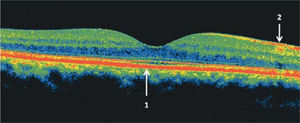
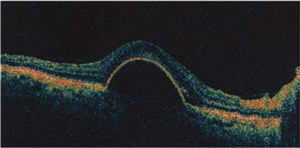
Tomografía de coherencia óptica (OCT) del área macular de un ojo normal. Las zonas más reflectantes tienen colores más cálidos (rojo). En el centro se observa la depresión foveal 1: epitelio pigmentario de la retina, 2: capa de fibras ópticas. En el sector nasal, en dirección a la papila, la capa de fibras ópticas es más gruesa.
La DMRE es una enfermedad multifactorial, en que además del envejecimiento los factores de riesgo genéticos y ambientales juegan un rol determinante.
Todos los estudios epidemiológicos han demostrado que el envejecimiento es el principal factor de riesgo para la DMRE.
El envejecimiento normal afecta especialmente la mono capa del epitelio pigmentario de la retina y la membrana de Bruch que está firmemente unida a la base del epitelio pigmentario (Figura 1). Bajo la membrana de Bruch, está la coriocapilar, fina capa de capilares que nutre a los fotoreceptores (conos y bastones) ya que la fóvea es avascular (requisito para una máxima transparencia). Los nutrientes, provenientes de la coriocapilar, deben ser transportados de la coriocapilar a través de la membrana de Bruch y el epitelio pigmentario.
El epitelio pigmentario retinal tiene un rol esencial en la sobrevida de los fotoreceptores. Los bastones desprenden los discos usados gastados al alba y los conos lo hacen al atardecer. Estos discos son fagocitados por el epitelio pigmentario, que está en íntimo contacto con los segmentos externos de los fotoreceptores (Figura 1). Estos discos gestados son digeridos por la acción de enzimas y degradados para ser reciclados. Sin embargo, con el paso de los años, este mecanismo tan perfecto de renovación circadiana empieza a fallar. Moléculas alteradas por el daño oxidativo no son reconocidas por los enzimas y el material no digerido empieza a acumularse dentro del EP. Estos productos de degradación incompleta constituyen los gránulos de lipofuccina, que se acumulan dentro del epitelio pigmentario.
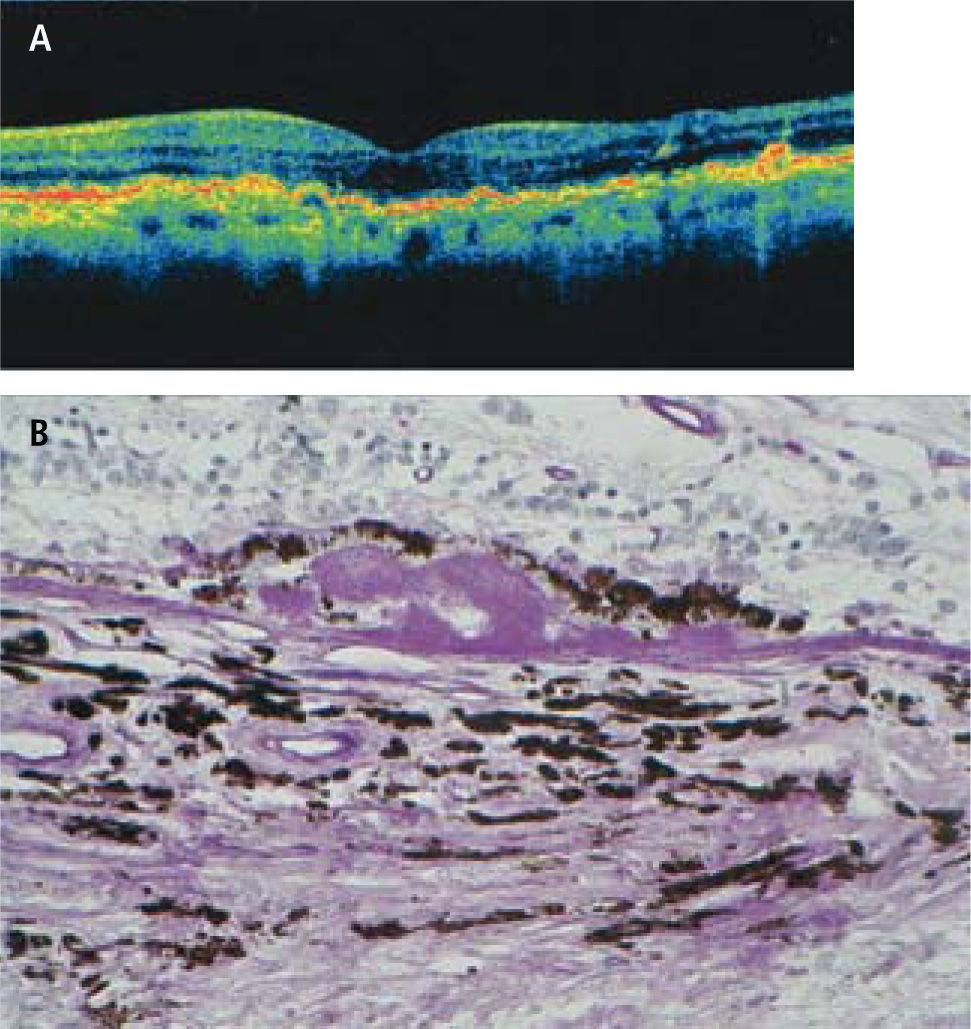
En algunos individuos, este proceso de envejecimiento se transforma en uno patológico: la acumulación de lipofuccina dentro del epitelio pigmentario es masiva, daña el funcionamiento de la célula y finalmente, el material de degradación incompleta es expulsado fuera de la célula y se acumula entre el epitelio pigmentario y la membrana de Bruch, constituyendo las DRUSAS, primera manifestación visible oftalmoscópicamente de este proceso, hasta aquí silencioso clínicamente (Figura 3 y Figura 4). Factores genéticos. Desde hace años, la literatura, basada en estudio de gemelos y en la concentración familiar de la enfermedad, sugería un rol genético en la etiología de la DMRE (2, 3). Hoy día, hay por lo menos 15 genes que han sido asociados a la DMRE (4).
El gen que ha demostrado la asociación más fuerte con la DMRE es el factor de complemento H en el cromosoma 1q32 (5). Además, estudios han demostrado la presencia de proteínas de la cascada del complemento en las drusas, sugiriendo que la inflamación pueda jugar un rol en la DMRE.
Los individuos homocigotos para una mutación en el gen del factor de complemento H (CC) tendrían mayor riesgo de hacer la enfermedad y responderían peor al tratamiento; los heterocigotos (CT) tendrían menor riesgo y los individuos no mutantes para el factor H no tendrían riesgo (6).
Otros factores de riesgo. En un estudio epidemiológico en el país, encontramos que la DMRE es más frecuente en la mujer, aún corrigiendo por la mayor esperanza de vida de este género. Un meta análisis demostró un riesgo ligeramente más elevado en la mujer (7). La enfermedad es también más frecuente en personas de raza blanca e iris claros.
El tabaquismo es un factor de riesgo comprobado en muchos estudios (8, 9). Se ha calculado que las mujeres que fuman más de 25 cigarrillos diarios tienen un riesgo relativo de 2,4 (10). En varones, el riesgo relativo para fumadores de más de 20 cigarrillos diarios era de 2.5 (11).
La exposición a la luz es difícil de cuantificar. Sin embargo, algunos estudios demuestran que la exposición al sol sin protección desde edades tempranas es un factor de riesgo por DMRE (12, 13). Sin duda, el uso de un gorro con visera y lentes protectores en toda actividad al aire libre está justificado como medida preventiva.
La obesidad, en especial la obesidad abdominal y el sedentarismo son también factores de riesgo para DMRE. El riesgo relativo para un índice de masa corporal de 30 o más es 2.35, comparado con la categoría menor (<25). Los valores altos de circunferencia abdominal tendrían un riesgo dos veces mayor de DMRE (14).
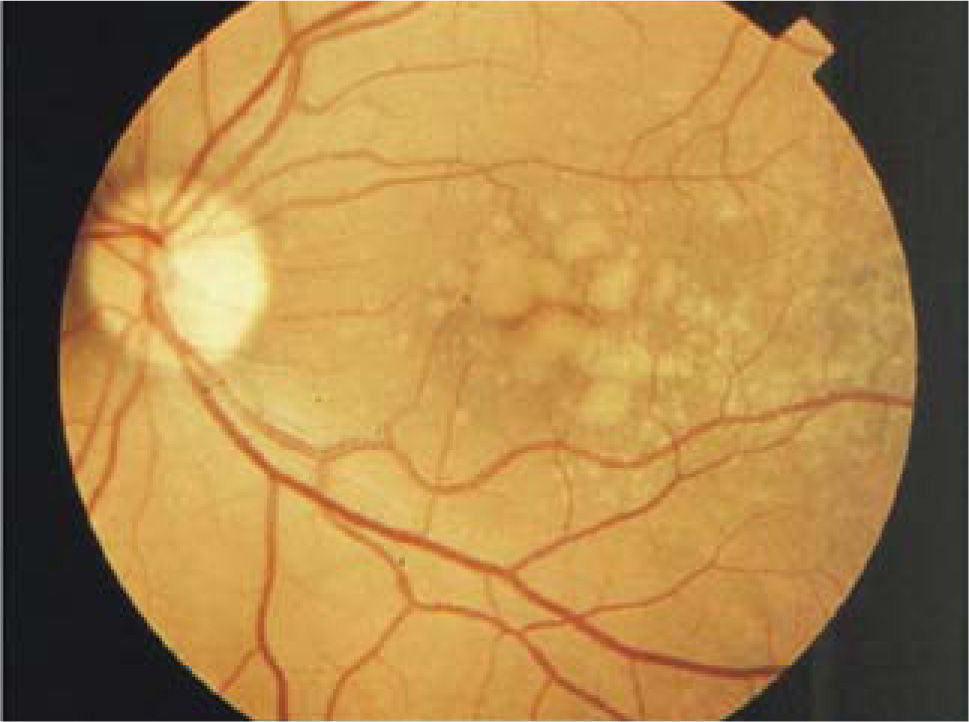
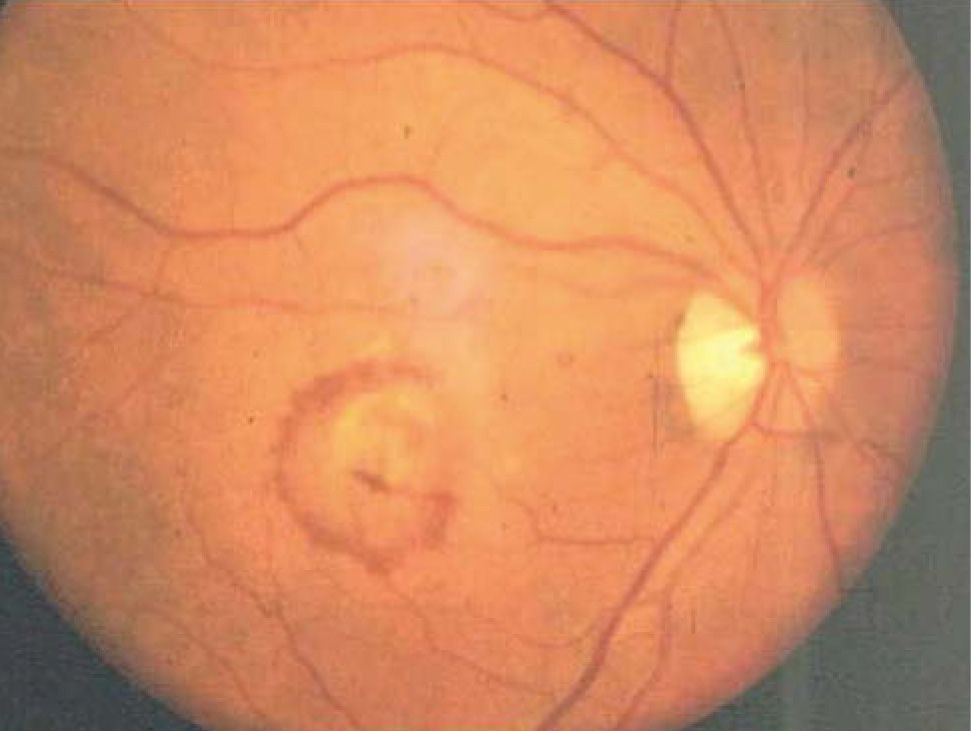
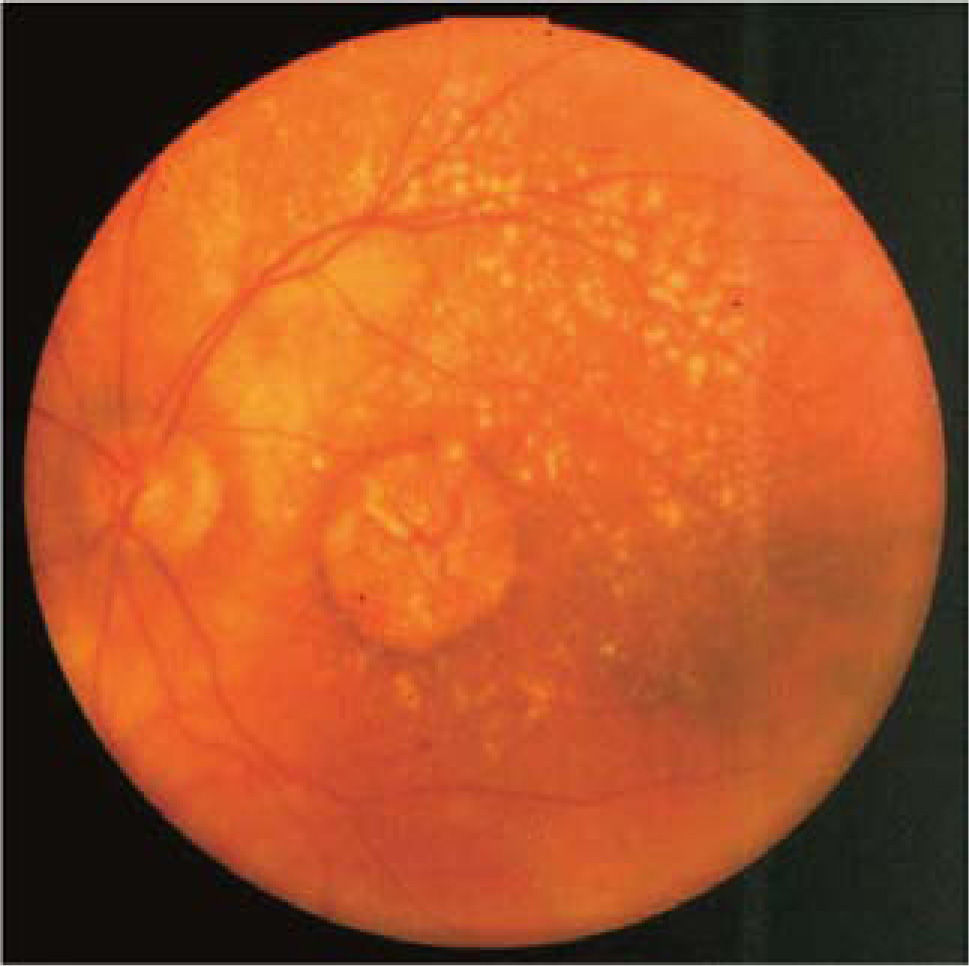
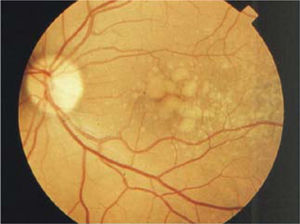
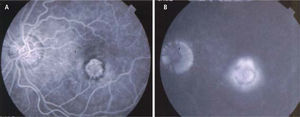
Formas clínicasIDrusasAl examen oftalmoscópico, las drusas se ven como pequeños depósitos redondeados de color amarillo, de ubicación sub-retinal (Figura 3). Las drusas pequeñas, puntiformes, de límites muy bien definidos (drusas duras) no se asocian con un riesgo significativo de DMRE. Las drusas de tamaño intermedio o grandes, de bordes poco definidos, llamadas drusas blandas, son el marcador clínico de la enfermedad. Durante muchos años, pueden ser asintomáticas, sin comprometer la visión, pero en la medida que transcurran los años, estos pacientes pueden hacer una de las dos formas de la enfermedad: la forma atrófica o seca y la forma húmeda, con neovascularización coroidea.
En un paciente con drusas, son factores de riesgo para la progresión el tamaño de las drusas, el número de las drusas, la confluencia de drusas formando depósitos de gran tamaño (Figura 4) y la aparición de pequeños focos de hiperpigmentación.
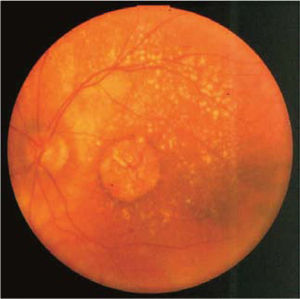
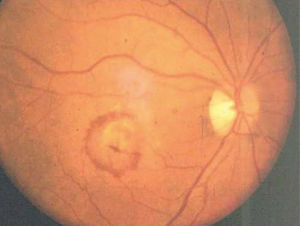
IIForma atrófica o secaLos depósitos anormales dentro del EP y bajo él (drusas), y las alteraciones de la membrana de Bruch alteran significativamente el aporte de nutrientes desde la coriocapilar. A lo largo de los años, aparecen fenómenos atróficos en el epitelio pigmentario y en los fotoreceptores, con alteración de la visión central. Al examen de fondo de ojo, se observan áreas de hipopigmentación, por pérdida de pigmento por el EP. Inicialmente se observan placas redondeadas de color más amarillento, de bordes bien definidos, a lo que se pueden agregar algunos gránulos de pigmento dispersos, que han salido de las células enfermas. El resultado final de este proceso es la atrofia geográfica, con placas redondeadas u ovaladas de depigmentación, de bordes bien definidos y que pueden ocupar toda el área macular, con pérdida de la visión central (Figura 5). Habitualmente, la progresión es asimétrica, con un ojo más afectado que el otro. En la angiografía retinal con fluoresceína, la atrofia geográfica muestra una hiperfluorescencia de toda el área atrófica, pero sin filtración (extravasación) de colorante. La falta de pigmento en el EP permite ver, como a través de una ventana, la fluorescencia del colorante que circula por la coriocapilar y la coroides.
La DMRE de forma atrófica es lentamente progresiva; inicialmente las placas atróficas pueden ser paracentrales, dando lugar a escotomas paracentrales que pueden pasar inadvertidos. La Extensión de la placa atrófica hacia el centro de la mácula dará lugar a un escotoma central y pérdida de la visión central.
IIIForma neovascular o húmeda (Neovascularización coroidea)Aproximadamente 10% de los pacientes con DMRE presentan la forma neovascular de la enfermedad (15). Es la forma más grave, del comienzo catastrófico y la causa más importante de pérdida de visión en el adulto mayor.
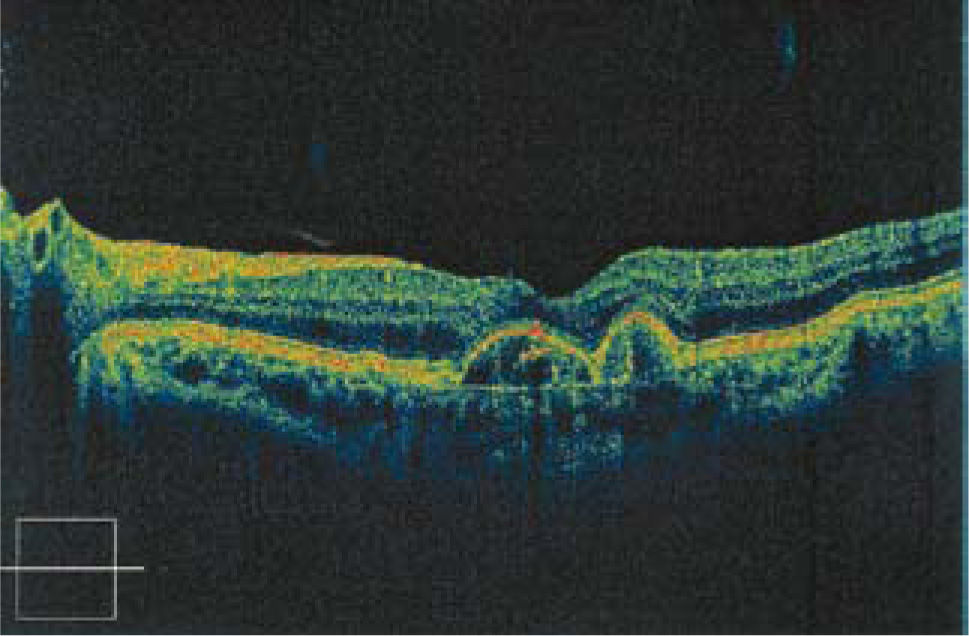
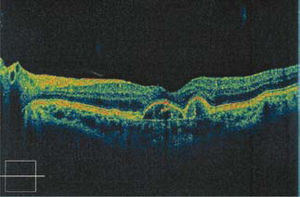
Se caracteriza por la presencia de una membrana neovascular coroidea que crece bajo el EP y luego bajo la retina. Estos vasos de neoformación se originan en la coriocapilar, proliferan y penetran al espacio subepitelial a través de una ruptura de la membrana de Bruch. Se requiere por lo tanto: a) una ruptura de la membrana de Bruch, b) angiogénesis (formación de vasos de neoformación a partir de una estructura endotelial pre- existente). La acumulación, ya descrita, de material anormal bajo el EP y en la membrana de Bruch, la activación del complemento en un proceso inflamatorio con reclutamiento de macrófagos, son factores que contribuyen a la formación de fisuras en la membrana de Bruch que permiten la entrada de neovasos y tejido fibroso. La angiogénesis es un proceso complejo no bien dilucidado, que implica factores pro-angiogénicos como el VEGF (vascular endothelial growth factor) y metaloproteasas que degradan la membrana basal y permiten la proliferación de las células endoteliales. En algunos casos, el epitelio pigmentario se separa de la membrana de Bruch (desprendimiento del EP) y se eleva en forma de cúpula. El desprendimiento del epitelio pigmentario puede preceder a la neovascularización coroidea y, en ese caso, su contenido es seroso (Figura 7). Cuando asocia a neovascularización coroidea (“desprendimiento del epitelio pigmentario vascularizado”) su contenido es fibrovascular. La presencia de desprendimientos de epitelio pigmentario grandes o gigantes ensombrece el pronóstico de la DMRE.
Los vasos neoformados son frágiles y fácilmente pueden sangrar o filtrar al espacio sub-retinal. El paciente acusa una pérdida de visión de comienzo brusco, con escotoma central (mancha oscura en el centro del campo visual). Otro síntoma frecuente es la metamorfopsia o deformación de la imagen. Si el paciente no es muy observador y el otro ojo está sano, la enfermedad puede pasar desapercibida hasta que se compromete el otro ojo.
Al examen oftalmoscópico del ojo afectado, se detecta un solevantamiento retinal, habitualmente redondeado y generalmente rodeado de un halo de sangre subretinal (Figura 8). El solevantamiento se debe a la presencia de líquido subretinal o edema retinal. La membrana neovascular puede ser extrafoveal, alejada del centro, pero en la mayoría de los casos es sub foveal y de allí que el escotoma central sea el síntoma más frecuente.
Una complicación inusual es la hemorragia subretinal masiva, lo que en algunos pacientes se asocia a terapia anticoagulante.
Si la neovascularización coroidea no es tratada o no responde al tratamiento, el proceso termina en una cicatriz fibrótica disciforme, con destrucción definitiva de las capas más externas de la retina (Fotoreceptores).
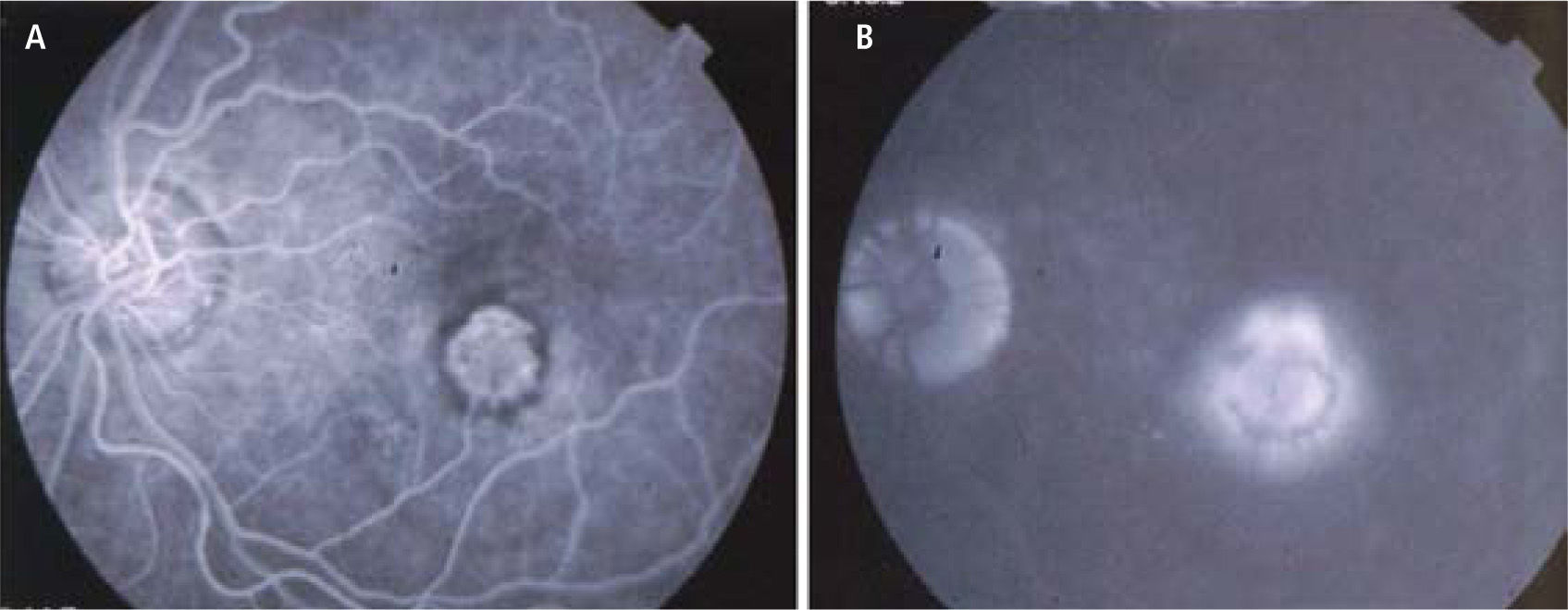
DiagnósticoSi la sintomatología y el aspecto oftalmoscópico sugieren una membrana neovascular, se debe solicitar una angiografía retinal con fluoresceína. Normalmente, la fluoresceína permanece dentro del espacio vascular, porque las uniones estrechas entre las células endoteliales de los capilares retinales no permiten la extravasación del colorante. Los vasos de neo-formación en cambio, carecen de estas uniones y dejan salir libremente el colorante. El angiograma muestra a nivel de la membrana, una mancha de colorante que se expande durante los tiempos angiográficos (filtración) (Figura 9). La angiografía con fluoresceína revela los vasos de formación en forma muy nítida si los vasos son subretinales (“neovascularización clásica”). Los vasos neoformados sub-epiteliales son más difíciles de visualizar (“neovascularización oculta”) y a veces se requieren de otro tipo de angiografía retinal para ponerlos en evidencia (Angiografía retinal con indocianina verde).
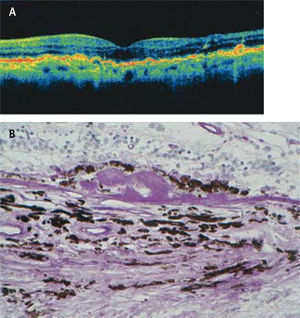
Otro examen esencial hoy día para el diagnóstico y seguimiento de la DMRE neovascular es la tomografía de coherencia óptica (OCT). El OCT nos revela la morfología de la retina con una definición microscópica. Pone en evidencia la membrana y los cambios secundarios (Edema retinal, líquido subretinal, desprendimiento del epitelio pigmentario) (Figura 10).
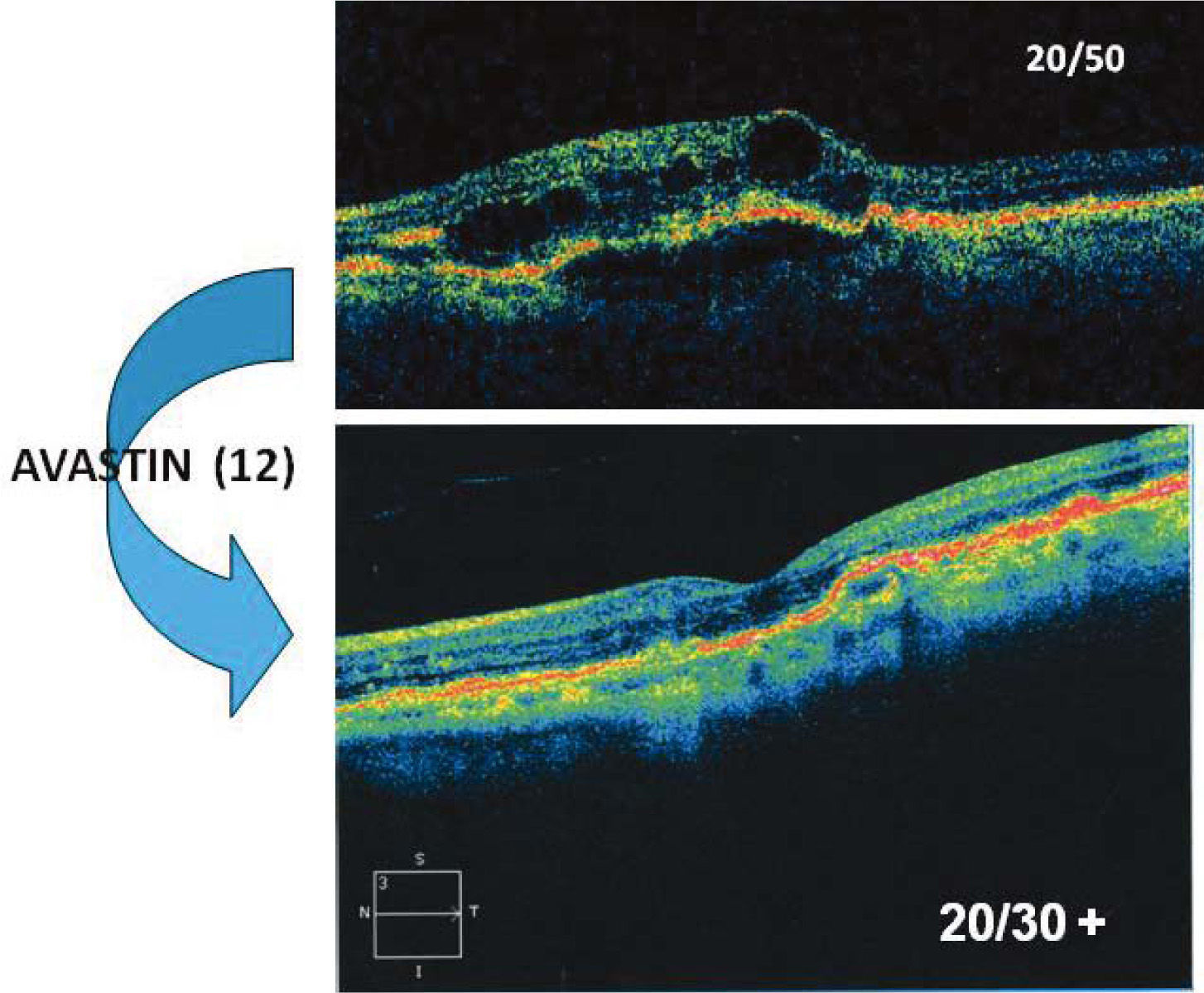
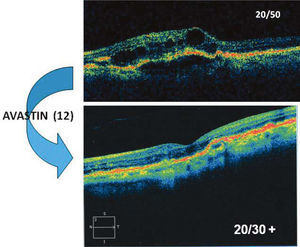
Paciente de 83 años, con pérdida de visión central en su ojo único. El OCT (foto superior) muestra edema de retina (áreas hiporeflectantes) y desprendimiento del epitelio pigmentario. Después de 12 inyecciones de Avastin, la paciente ha recuperado visión útil y del OCT muestra ausencia de edema y recuperación de la depresión foveal.
El estudio AREDS. El Age-Related Eye Disease Study enroló 4.753 pacientes y evaluó el efecto de una dosis alta de antioxidantes y vitaminas (500mg de vitamina C, 400 UI de vitamina E y 15mg de beta caroteno) y zinc (80mg de óxido de zinc con 2mg de óxido de cobre para prevenir la anemia inducida por zinc) en la DMRE. Ese estudio demostró que en individuos con drusas de tamaño intermedio o grandes o con visión central perdida por DMRE en un ojo y que fueron aleatoriamente asignados a esta fórmula, tenían un 25% de reducción del riesgo de progresión a una forma avanzada de la enfermedad, en relación con los controles (16).
En consecuencia, el uso de la fórmula AREDS está indicada en pacientes con esas características. Dos preparados contienen la fórmula AREDS en Chile: el ICAPS® de Alcon Laboratories y el VITALUX PLUS® de Novartis; debe prescribirse uno cada 12 horas. Esta terapia preventiva no puede usarse en fumadores, ya que el consumo de beta caroteno (vitamina A) a altas dosis por tiempo prolongado aumentaría la incidencia de cáncer pulmonar en fumadores (17). En Chile se expenden preparados con la fórmula AREDS, pero sin beta caroteno. En Estados Unidos está disponible el Preser Vision Lutein®, en el que el betacaroteno se ha reemplazado Luteína.
Está en curso el estudio ARED 2, en que el betacaroteno ha sido reemplazado por luteína, zeaxantina y 1000 de ácidos grasos omega-3.
IITratamiento de la forma atrófica de la DMRENo hay a la fecha un tratamiento aprobado para la forma seca de la enfermedad. En la práctica diaria, se prescribe la fórmula AREDS 2, aunque no es mayormente efectiva en detener la progresión de las placas de atrofia geográfica. El estudio ARED 2 no se ha completado aún, pero la investigación básica y clínica hace pensar que el uso de carotenoides (Luteína y zeaxantina) podría tener un rol protector. Están en curso numerosas líneas de investigación para el tratamiento de la forma seca de la DMRE; una de ellas ha obtenido el “fast track” de FDA para la etapa 3. Curiosamente, se trata de una droga (FENRETINDE) que bloquea el ciclo de la vitamina A, necesaria para la visión nocturna; al frenar el ciclo visual, se reduce la acumulación de lo subproductos tóxicos del metabolismo del epitelio pigmentario. La función de conos (visión diurna) no se ve alterada (14).
IIITratamiento de la forma neovascularUna membrana neovascular alejada del centro de la mácula se puede tratar con LASER, que si bien siendo efectivo, tiene alta tasa de recidivas. Además, la inmensa mayoría de las membranas son subfoveales o yuxtafoveales, no tratables con láser.
La terapia fotodinámica con verteporfina prácticamente se ha abandonado del arsenal terapéutico en la DMRE, dados sus pobres resultados.
El advenimiento de las drogas anti-angiogénicas para uso intravítreo representa un notable avance en el tratamiento de la DMRE neovascular; por primera vez hemos visto un tratamiento capaz de mantener y mejorar la visión en la mayoría de estos pacientes. Estas drogas actúan impidiendo la unión del VEGF a sus receptores en la superficie de las células endoteliales de los vasos de la coriocapilar; además de antiangiogénicas, disminuyen la permeabilidad vascular alterada.
Dos son las drogas en uso:
- a)
el ranibizumab (Lucentis®). Es un fragmento Fab de anticuerpo murino monoclonal humanizado que inhibe todas las isoformas de VEGF-A.
- b)
el bevacizumab (Avastin®), que es el anticuerpo anti VEGF murino humanizado completo y, por tanto, es una molécula de mayor tamaño. El Avastin se utiliza en forma intravenosa en el tratamiento del cáncer colorectal.
Ambos son producidos por el mismo laboratorio (Genetech). Se colocan dentro de la cavidad vítrea mediante una inyección a través de la esclera, a la altura de la plars plana usando una aguja de finísima calibre Varios estudios clínicos prospectivos multicéntricos (ANCHOR, MARINA, PIER, SAILOR, SUSTAIN y EXITE) han demostrado la eficacia de Lucentis® (19, 20, 21).
La mayor eficacia se consigue con inyecciones mensuales repetidas por 12 a 24 meses. Esta estrategia, sin embargo, es extraordinariamente costosa emocional y monetariamente para el paciente. La evidencia científica, sin embargo, demuestra que una estrategia flexible, sino óptima es viable: tres inyecciones mensuales, al término de las cuales se evalúa la visión y el OCT, tratando sólo en caso necesario (22). No todos los pacientes responden a la terapia intravítrea con antiangiogénicos: un 10 a 15% pueden clasificarse como no-respondedores; un 10 a un 15% son respondedores y sólo requieren 3 a 4 inyecciones. La inmensa mayoría son respondedores, pero dependientes de los antiangiogénicos (60 a 70%), requiriendo inyecciones repetidas para mantener la visión.
El Avastin® no dispone de estudios controlados, pero la experiencia mundial es muy extensa, dado que el precio de cada dosis es muy bajo; lo contrario sucede con el Lucentis. En Europa y Estados Unidos, el Estado o los seguros de salud cubren el costo de esta última droga; en Chile ninguna de estas drogas está cubierta. Varios estudios no demuestran diferencias en la eficacia de estos medicamentos; (23) son sin embargo estudios pequeños. El estudio CATT en Estados Unidos y otros estudios clínicos en curso responderán en forma definitiva sobre la eficacia relativa de estos medicamentos.
Las complicaciones de las inyecciones intravítreas de antiangiogénicos son rarísimas. Existe un riesgo potencial de endoftalmitis y, por esta razón, el procedimiento se realiza en condiciones estériles. Hasta ahora, no se han reportado complicaciones sistémicas significativas por la inhibición del VEGF; la tasa de accidentes tromboembólicos no difiere significativamente de la de los controles.
El autor declara no tener conflictos de interés, en relación a este artículo.