El trasplante de órganos sólidos se ha incorporado al tratamiento de pacientes portadores de una gran variedad de condiciones clínicas. La falta de una adecuada pesquisa de donantes así como su inadecuado manejo médico son factores relevantes para la ocurrencia de la actual gran carencia de órganos sólidos disponibles para ser trasplantados en nuestro País. En este artículo se presenta una revisión acotada de los términos usualmente empleados y luego se refiere primordialmente a los donantes fallecidos en muerte encefálica (DFME). Se hace énfasis en las ultimas cifras nacionales, las formas con las que contamos para poder predecir la capacidad generadora de potenciales donantes, cómo y dónde detectarlos, las principales estrategias para aumentar su detección, los aspectos fisiopatológicos subyacentes a esta particular condición. Finalmente se presentan algunas recomendaciones para el adecuado manejo del donante potencial, desde su detección hasta que se convierte en donante efectivo.
Solid organ transplantation has been incorporated as a valid treatment option for patients that suffer several conditions. The failure to identify potential cadaveric donors early and their subsequent inadequate treatment are undoubtedly relevant factors that go some way to explain the actual shortage of organs available to be transplanted in Chile. In this article we present a review and explanation of the terminology associated with organ donation before focusing on the legal criteria required for the clinical diagnosis of brain-stem death. We use data from other countries in order to predict how many donors should be available in our country as well as trying to anticipate their diagnoses and where they are usually located. The discussion then moves on to present the current reality in Chile before reviewing some measures that have been found useful in other countries to increase donation rates. Finally we present some suggestions on how the patient should be managed from the moment they are considered as a potential donor until they complete the donation process.
Con el avance del conocimiento y de la tecnología médica muchas áreas de la Medicina han sufrido un fuerte impacto. Quizás una de las más destacadas en términos de lo vertiginoso de su avance ha sido el trasplante de órganos sólidos (TOS). El TOS ha pasado así de ser una terapia experimental a una terapia médica real para un determinado grupo de pacientes, sustentado en resultados exitosos.
Con el progresivo incremento en la expectativa de vida de la población, la prevalencia de enfermedades crónicas así como de patología oncológica se ha generado un mayor número de personas que requieren de un TOS. Ante este incremento progresivo de la demanda de órganos para ser trasplantados como país debemos trabajar unidos seriamente, aunando esfuerzos para así ser capaces de generar tanto las institucionalidad requerida como las condiciones necesarias para tener una suficiente generación de órganos sólidos de la mejor calidad, que puedan ser ofrecidos a nuestros compatriotas.
Todo el proceso del trasplante de órganos sólidos está constituido por una muy particular cadena de eventos, los cuales necesariamente deben ocurrir en una forma ordenada y estructurada. Ello exige la existencia de una entidad coordinadora con cobertura nacional muy bien organizada que tenga la potestad requerida como para poder cumplir con el objetivo de poder identificar a los potenciales donantes y lograr que la mayor cuantía de dichos órganos sólidos extraídos tengan una calidad mínima como para ser trasplantados a sus potenciales receptores, garantizando la mayor duración de los mismos.
El eslabón más importante en la cadena de generación de trasplantes de órganos sólidos (OS) lo constituye el tener una suficiente cantidad de OS de adecuada calidad, susceptibles de ser trasplantados. Tal es así que se ha llegado a acuñar la frase “SIN DONANTES NO HAY TRASPLANTES”, la que grafica de buen modo lo gravitante de ello.
Los órganos sólidos que serán transplantados pueden provenir de un donante vivo (DV) o bien de una persona previamente fallecida o donante fallecido (DF). El donante vivo (DV) puede ser genéticamente relacionado (DVGR), emocionalmente relacionado (DVER) y no relacionado (DVNR), el que a su vez puede ser altruista o cruzado. El donante fallecido (DF) puede llegar a esa condición por la vía de la muerte encefálica (DFME) o bien directamente por la vía del paro cardiaco (DFPC), también conocido como donante con corazón detenido o en Inglés non heart beating donor.
Glosario de términos usualmente utilizados (1)Donante de órganos sólidos y/o tejidos (DOST)Persona que ha permitido la extracción de sus órganos y/o tejidos en vida (donante vivo) o después de su muerte (donante fallecido), para serles implantados a un receptor que padece una insuficiencia terminal de algún órgano o requiere de la implantación de un tejido.
Donante potencial (DP)Persona que no presenta ninguna contraindicación médica ni legal para la donación de órganos y tejidos.
Donante real (DR)Se denomina así al donante al que se le extirpa mediante métodos quirúrgicos reglados uno o más órganos o tejidos, para ser implantados en un receptor adecuado.
Donante efectivo (DE)Es el donante al que se le extrae uno o más órganos con o sin tejidos, los que son efectivamente implantados en un(os) receptor(es).
Donante vivo (DV)Persona que decide donar algún órgano o parte de él en vida. En estos casos se puede donar un riñón (órgano par), un segmento de hígado, un lóbulo pulmonar, un segmento de intestino delgado y ya existen reportes de donación parcial de páncreas.
Donante vivo genéticamente relacionado (DVGR)Subclase de DV en que el donante tiene una vínculo sanguíneo con el potencial receptor.
Donante vivo emocionalmente relacionado (DVER)El donante conoce al receptor y si bien no tiene con éste un vinculo sanguíneo, sí mantiene una relación emocional estable que lo une a él. Puede ser la pareja o amigo/a de un paciente por ejemplo.
Donante vivo no relacionado (DVNR)Es un donante no emparentado con el receptor que dona sus órganos sin recibir ningún tipo de compensación por ello. Dentro de esta categoría está el donante vivo altruista (DVA) quien permite la extracción de un órgano o parte de él a su persona en pleno uso de sus facultades mentales, como genuino acto de generosidad al prójimo no recompensada sino con la sola satisfacción de hacerle un bien a un tercero. Otra opción es el donante vivo cruzado (DVC); en esta situación hay dos enfermos que tienen donantes, pero que están imposibilitados de donarles sus órganos sólo a su respectivo receptor y no al otro receptor. Es así que si bien un donante da su órgano o parte de él a un tercero que no conoce, lo hace con la expectativa de que como retribución otro donante le de un órgano al enfermo con el que él está relacionado.
Donante fallecido (DF)Es aquella persona que se convierte en donante de órganos y tejidos una vez ocurrido su fallecimiento.
Donante fallecido en muerte encefálica (DFME)Aquella persona que ha muerto bajo criterios neurológicos (muerte encefálica), en la que todos los órganos menos el cerebro y el tronco encefálico continúan irrigados y oxigenados porque aún se mantiene la función de bomba cardíaca y la oxigenación está asistida por un ventilador mecánico.
Donante fallecido en paro cardiaco (DFPC)Lo es una persona que ha muerto en paro cardiaco presenciado o no, que no ha respondido a las maniobras de reanimación así como aquella que con una patología declarada fuera del alcance terapéutico, se le retiran medidas de soporte vital y que a su vez cumple con ciertos criterios de inclusión y exclusión.
*Esta práctica no se realiza en nuestro país actualmente*.
Donante fallecido multiorgánico (DFMO)Se denomina así al donante real al que se le extraen dos o más órganos sólidos como pueden ser la combinación de riñones, hígado, pulmones, corazón, páncreas, intestino con o sin tejidos.
Donante Ideal (DI)Es un potencial donante que reúne todas las características clínicas, de laboratorio o histológicas que hacen poder predecir el que ese injerto funcionará de la mejor forma y por el mayor tiempo posible una vez trasplantado.
Donante con criterios de aceptación expandidos (DCAE)Aquel donante que tiene determinadas características clínicas, de laboratorio o histológicas que hacen predecir el que si bien sus órganos tendrán una menor sobrevida que el promedio de los órganos ideales trasplantados, aún darán un beneficio real al receptor que justifica plenamente el hacerlo.
Los órganos provenientes de donantes vivos han demostrado ser una muy buena alternativa terapéutica, pero tienen asociado un inherente riesgo para el donante, lo que hace que su realización esté justificada sólo para el aumento de el pool de órganos ante la creciente escasez de órganos disponibles.
Se privilegia el que la mayor cuantía de órganos provenga de donantes fallecidos en la medida de que uno de los principios rectores de esta actividad es la de nunca generar daño a persona alguna (Primum non nocere). No se le generará jamás daño alguno a un individuo fallecido utilizando sus órganos para darle vida y/o mejorar la calidad de vida en otras personas.
Dentro del grupo de los DF a su vez, la prioridad la deben tener los que lo hacen en muerte encefálica por sobre los que lo hacen en paro cardiaco en la medida que la calidad de los órganos obtenidos de los primeros es superior a la de los obtenidos desde la segunda categoría. De lo anteriormente expuesto se extrae que se debe poner énfasis en la precoz detección de DFME y evitar el que una vez identificado un potencial donante, se pierda éste por cualquier motivo, particularmente por un inadecuado manejo médico antes de convertirse en donante efectivo.
Para lograr este objetivo es básico tener claridad absoluta del concepto de muerte, ya que cualquier grado de incerteza al respecto impide avanzar en la consecución de éste.
Mucho se ha escrito de la muerte, no existiendo una definición que abarque todos los ámbitos comprendidos por ella. En el diccionario de la Real Academia de la lengua Española se estipula que el término proviene del latín mors o mortis y se la define como la cesación o término de la vida así como también la separación del cuerpo y el alma.
La muerte es una sola, no debe relativizarse su existencia ni su definición. Lo único que ha pasado es que por el avance de la ciencia y del soporte vital actualmente existente ella ha ido variando su lugar de ocurrencia y el contexto en el que se produce. Antes la muerte se daba en situaciones en las que se carecía de soporte vital y podía ser fácilmente reconocida clínicamente, pero luego de la aparición de Unidades de Cuidados Intensivos (UCI) debemos ser capaces de reconocerla, en un ambiente muy distinto. En ellas el paciente se encuentra bajo el efecto de drogas potencialmente depresoras del sistema nervioso central, intubado, conectado a un ventilador mecánico y ademas está eventualmente con apoyo de drogas vasoactivas para mantener su presión arterial en rangos adecuados.
Conceptualmente se reconoció una nueva forma para definir la muerte de una persona, caracterizada única y fundamentalmente por la determinación de la pérdida total e irreversible de todas las funciones de sus estructuras neurológicas intracraneales incluyendo los hemisferios cerebrales y el troncoencéfalo, la que se equiparó a la previamente existente basada en el cese irreversible de las funciones cardio-respiratorias. Así se hizo posible establecer el diagnóstico de muerte con toda seguridad en una persona que, teniendo un daño estructural severo e irreversible de su tejido encefálico, seguía respirando, teniendo pulso y presión sólo gracias al soporte dado por el ventilador mecánico y drogas vasoactivas. Ello porque dicha persona está irremisiblemente destinada a tener un cese de su actividad cardiaca, refractario a todas las medidas médicas en un corto periodo de tiempo.
A partir de este concepto, se hizo necesario establecer normativas para definir con absoluta precisión la existencia de la muerte. Se publicó el primer grupo de criterios en 1968 (criterios de Harvard) (2). Posteriormente fueron publicadas las dos normas sobre el diagnóstico de muerte que cuentan con mayor aceptación universal en el presente y que son el Código del Reino Unido para el Diagnóstico de Muerte Encefálica 1979 (3) y | as Guías de la Comisión Presidencial de los EE.UU. para el diagnóstico de muerte 1981 (4).
En Chile el marco legal regulatorio que rige las actividades concernientes a la donación, procuramiento y trasplante de órganos y tejidos se encuentra contenido en la ley 19.451 de trasplante publicada en el diario oficial el 10 de abril 1996, en su reglamento publicado en 1997 y en el artículo 129 del Código Sanitario. Recientemente se discutió y aprobó la Ley N° 20.413 del donante Universal. Ella fue aprobada el 22 de diciembre del 2009 por la Cámara de Diputados y promulgada el día 6 de enero del 2010 por la presidenta de nuestro país. En ella se estipula que todo chileno mayor de 18 años será considerado donante potencial a no ser que en vida se haya opuesto a ello por escrito, le entrega la responsabilidad al Ministerio de Salud de implementar la Política Nacional de Trasplante y que crea la Coordinadora Nacional de Donación y Trasplante del Ministerio de Salud, que será el organismo encargado de la promoción del trasplante, pesquisa de donantes y trasplante de órganos sólidos en los diferentes hospitales de nuestro país.
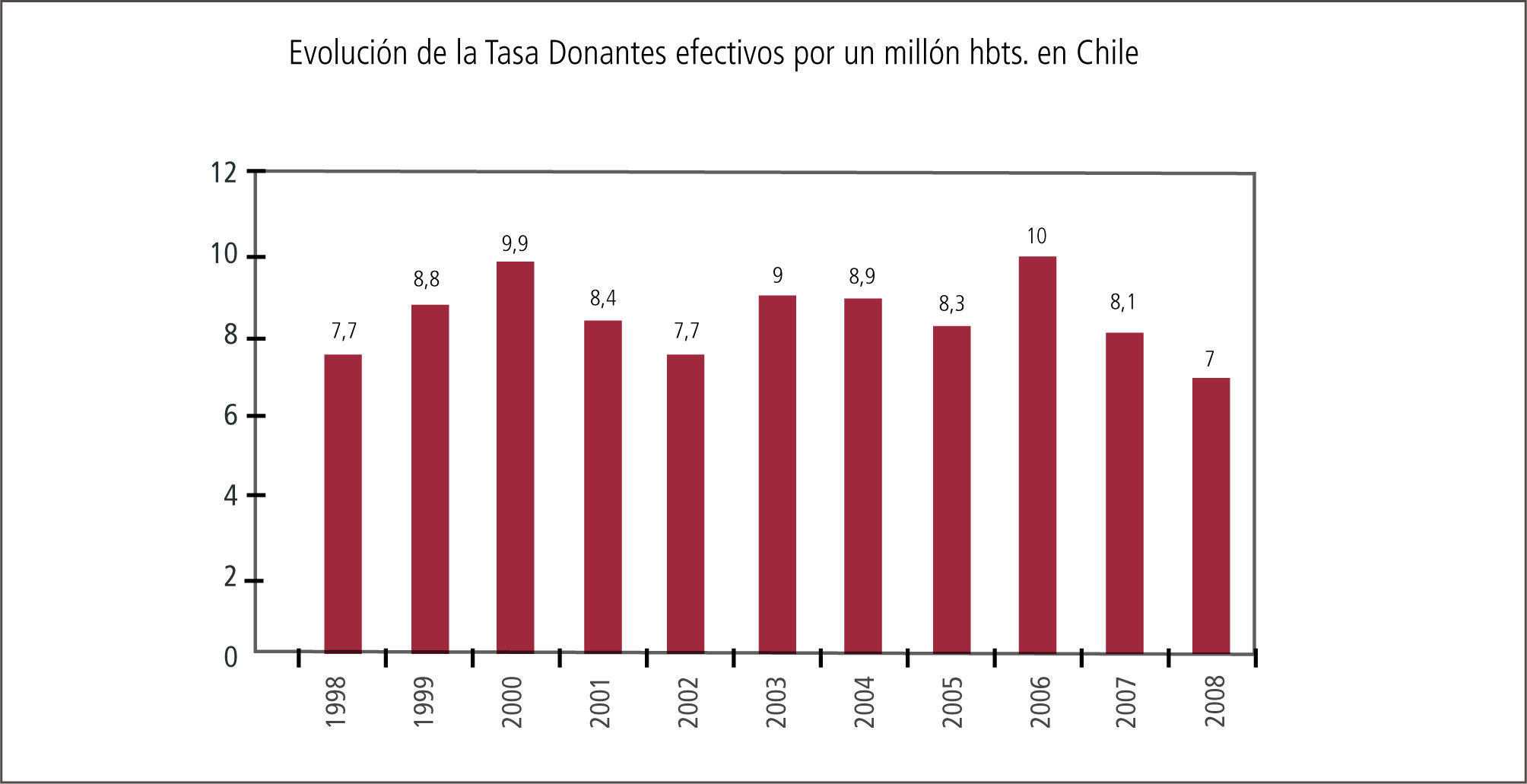
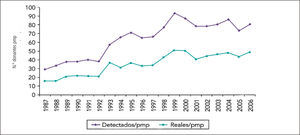
Pesquisa de donantes potencialesActualmente en nuestro país la entidad que lleva un recuento de el número de donantes potenciales y efectivos fallecidos en muerte encefálica es la Corporación Nacional de Fomento del Trasplante. Las cifras obtenidas en Chile se muestran en el gráfico 1.
Para poder desarrollar una estrategia adecuada para la pesquisa de los donantes potenciales es imprescindible poder saber o estimar la máxima capacidad de generación de los mismos a objeto de poder evaluar la efectividad del programa así como el impacto de las medidas instauradas.
En nuestro país no existe una medición de la real capacidad generadora de donantes potenciales fallecidos por ME en la medida que el reportar su existencia al Servicio Nacional de Salud (SNS) no es obligatorio. Lo que nos resta entonces es hacer una estimación de su ocurrencia. Esto se puede hacer aplicando a nuestra realidad las tasas de donantes generados, obtenidas por otros programas nacionales de trasplante. Estos hicieron una acuciosa detección de cada uno de los donantes potenciales en sus hospitales y así establecieron ciertos indicadores de incidencia de los mismos que luego compararon contra el número total de habitantes de la región, tipo de hospital, número de camas UCI disponibles, etc.
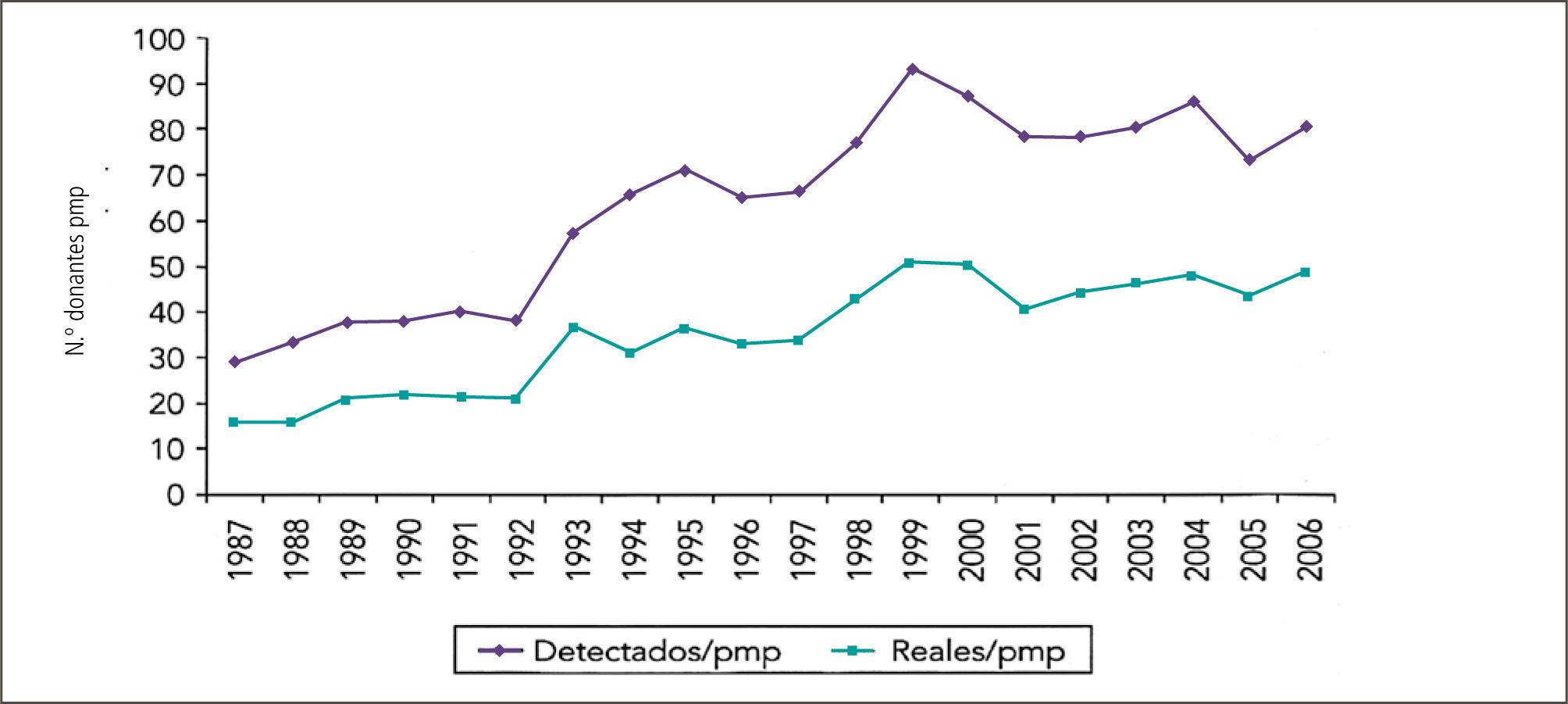
En España, país líder mundial absoluto en este campo, la Organización Nacional de Trasplante (ONT) audita todos los fallecimientos en las UCIs de ese país, como parte del programa de garantía de calidad del proceso de donación. Así cuantifica rigurosamente cuántos de los pacientes fallecidos en UCIs lo hicieron en muerte encefálica. Con esta aproximación se ha demostrado que la capacidad teórica de generación de DFME de un país está directamente relacionada con el tamaño de su población, la accesibilidad de ella a sus hospitales, tamaño del hospital, número de pacientes fallecidos en el pacientes fallecidos en la UCI del hospital y de si cuentan o no con una Unidad de Neurocirugía en su interior (5) como muestra el grafico 2
Una vez estimada la máxima capacidad generadora de DFME del país, de una región e incluso de un determinado hospital y conocida su real generación en el presente, se podrá desarrollar una estrategia que mejore su pesquisa.
Estrategias para mejorar la pesquisaLa medida más eficiente al respecto fue la propuesta en el “modelo español”, que consistió en la generación de la figura del coordinador de trasplante en cada UCI. Este funcionario corresponde a un médico que depende directamente del director del hospital y que se desempeña como médico de turno en la misma UCI. Él es quien conocerá a todos los pacientes de dicha UCI y en los que se encuentren en ME, planteará la opción de la donación como parte natural del proceso de atención del paciente que, refractario a las medidas y esfuerzos por salvarle la vida, se convierte en un donante potencial.
Esta fue la principal medida que catapultó a España en pocos años a la cima de los países con las mayores tasas de donación y lo convirtió en un referente internacional en el tema. Lo mejor es que ella fue igualmente eficiente al ser transferida a otras culturas y otros países, como fue demostrado en el programa de trasplante de la Toscana en Italia (6).
Complementariamente a lo expuesto se pueden generar otras estrategias que potencien aún más el incremento de la donación efectiva;
– Estrategia retrospectiva; en la que todo paciente fallecido en UCI sea auditado y si se considera que pudo haber sido considerado como un potencial DFME sin haberlo sido (una fuga) analizar el caso, aprender de él y no volver a cometer el mismo error nuevamente.
– Estrategia prospectiva, en la que se identifique trazador que obligue a seguir la evolución del paciente en su hospitalización dado su mayor riesgo de fallecer en ME y de ser así, diagnosticarla a tiempo y proceder en consecuencia.
La estrategia prospectiva se basa en la utilización del valor obtenido de la escala de evaluación del coma de Glasgow (GCS) (7) descrita en la Tabla 1 al ingreso al hospital de pacientes que sufrieron una injuria cerebral, como elemento predictor del desarrollo de ME.
Escala de evaluación del coma de glasgow
| Apertura ocular | Respuesta verbal | Respuesta motora |
|---|---|---|
| Espontánea 4 | Orientada 5 | Obedece órdenes 6 |
| Al hablarle 3 | Confusa 4 | Localiza el dolor 5 |
| Al dolor 2 | Palabras inapropiadas 3 | Retirada ante el dolor 4 |
| Ninguna 1 | Sonidos incomprensibles 2 | Flexora ante el dolor 3 |
| Ninguna 1 | Extensora ante el dolor 2 | |
| Ninguna 1 |
Este modelo se desarrolló al identificar en forma retrospectiva el que un 47% de los pacientes con injuria cerebral grave que ingresaron con un GCS de 6–8, evolucionan a un coma persistente o fallecieron y a el que un 85% de los que ingresan con un valor de 3–5 lo hacen.
Luego se buscó la capacidad predictiva del valor de GCS al ingreso de pacientes con injurias cerebrales graves con respecto a su potencial evolución a la ME. Ello lo demostró el Dr. Senouci y colaboradores (8) en un estudio multicéntrico hecho en UCIs francesas. Un 15% de los pacientes ingresados con GCS igual o menor a 8 falleció en ME.
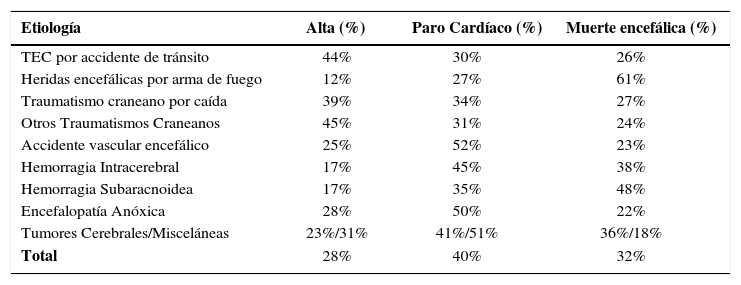
Con estos antecedentes en Argentina se inició en Septiembre del 2003 un programa nacional multicéntrico prospectivo de detección precoz de potenciales donantes sobre la base de identificar a su ingreso a UCI a pacientes con injurias cerebrales graves con un GCS igual o inferior a 7. Su experiencia fue publicada en el 9° Congreso mundial de terapia intensiva y luego en el Transplantation proceedings (9). De 5.561 pacientes estudiados, la etiología del coma que motivó las admisiones con mayor frecuencia en las UCIs resultó el accidente cerebrovascular (43%), seguido por el traumatismo craneoencefálico (32%), la encefalopatía anóxica (9%), los tumores cerebrales (4%) y misceláneas (11%) identificadas como otras causa. Luego se estableció en este grupo de pacientes la asociación de la causa de su injuria cerebral y la evolución a la muerte, tanto por la vía de la ME como por la de el paro cardiaco. (Tabla 2).
Relación entre el diagnóstico de ingreso y evolución de pacientes ingresados a UCI con GCS de igual o inferior a 7
| Etiología | Alta (%) | Paro Cardíaco (%) | Muerte encefálica (%) |
|---|---|---|---|
| TEC por accidente de tránsito | 44% | 30% | 26% |
| Heridas encefálicas por arma de fuego | 12% | 27% | 61% |
| Traumatismo craneano por caída | 39% | 34% | 27% |
| Otros Traumatismos Craneanos | 45% | 31% | 24% |
| Accidente vascular encefálico | 25% | 52% | 23% |
| Hemorragia Intracerebral | 17% | 45% | 38% |
| Hemorragia Subaracnoidea | 17% | 35% | 48% |
| Encefalopatía Anóxica | 28% | 50% | 22% |
| Tumores Cerebrales/Misceláneas | 23%/31% | 41%/51% | 36%/18% |
| Total | 28% | 40% | 32% |
Cuando se analiza la evolución de acuerdo a la etiología del coma, edad y sexo, los pacientes de sexo masculino entre 20 y 29 años con herida por arma de fuego son los que fallecen en ME con mayor frecuencia y aquellos con encefalopatía anóxica sin importar edad o sexo fallecen con mayor frecuencia en paro cardiaco. En un periodo de dos años con la aplicación de este simple modelo, siguiendo la evolución de estos pacientes en forma eficiente Argentina aumentó, por la vía de la mayor pesquisa, la procuración de órganos de pacientes DFME en un 67%.
Complementariamente al uso de la escala de Glasgow aplicada al ingreso de pacientes con injurias cerebrales graves se puede usar la medición de la proteína S-100b sérica como un marcador del daño neurológico capaz de predecir la evolución hacia un daño neurológico irreversible refractario a medidas terapéuticas que determine la ME del paciente.
Esta proteína ligadora de calcio tiene su origen en los astrocitos y en las células de Schwann y parece tener una relevancia parecida a las enzimas cardíacas como indicadora de daño tisular. Su vida media plasmática es de 2 horas aproximadamente luego de ser liberada al torrente sanguíneo y para su detección inmunoenzimática se utilizan dos anticuerpos monoclonales. Dimopoulou y colaboradores (10) la midieron en los pacientes ingresados a UCI por traumatismo craneoencefálico. Demostraron que la asociación de valores mayores de los 2ug/L de S-100b medidos antes de transcurridas 6 horas de ocurrida la injuria cerebral en sujetos con un score de GCS de 6 o menos a su ingreso, es un marcador pronóstico de muerte encefálica con un 75% de sensibilidad y 82% de especificidad.
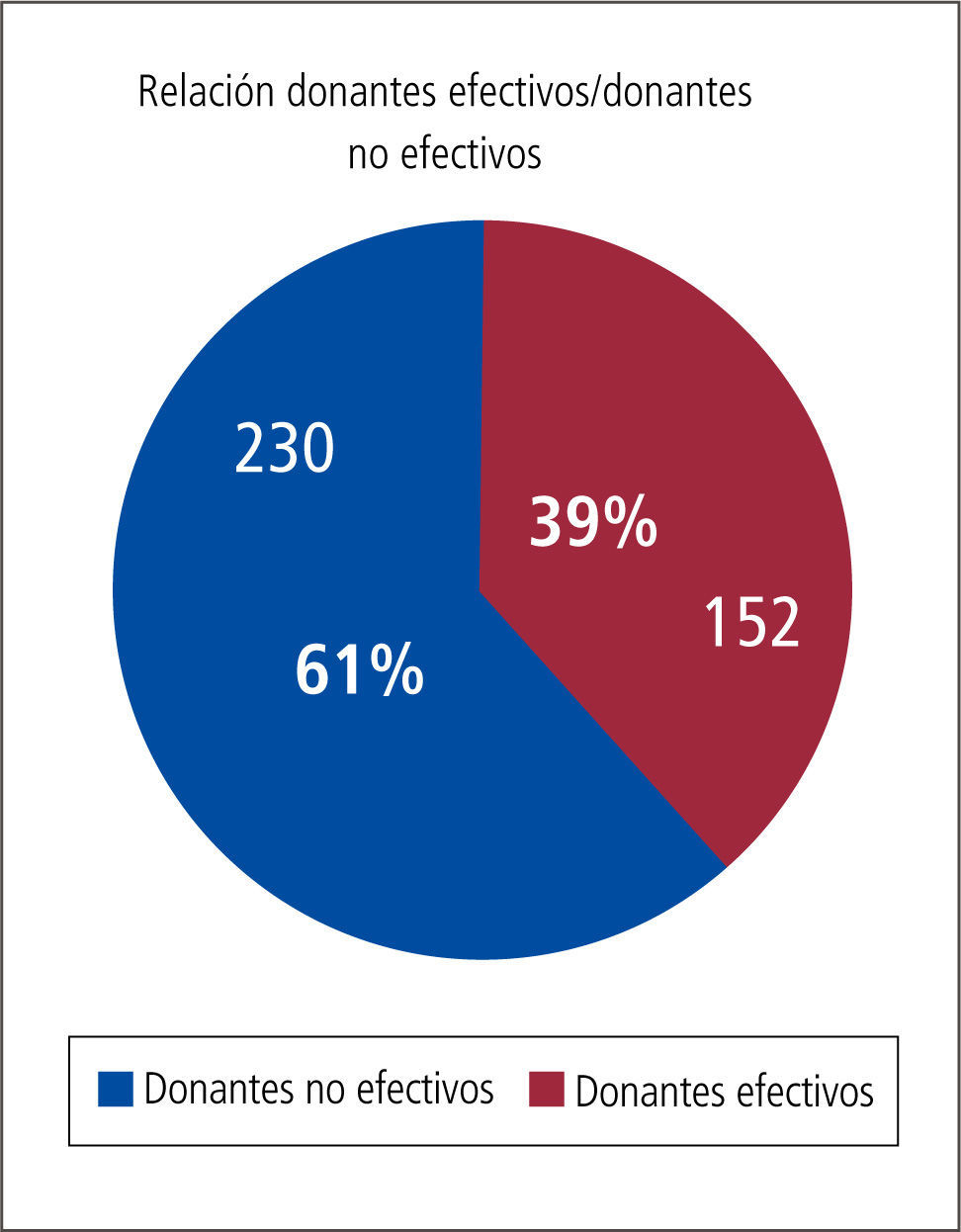
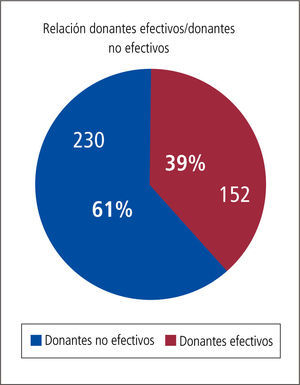
Cuidados del donante potencial (DFME)Un donante multiorgánico ideal puede regalarle un total de 55 años de sobrevida a la sociedad aproximadamente, los que se repartirán entre los diferentes pacientes que reciban los órganos por él donados. Desgraciadamente no todos los donantes potenciales detectados se transformarán en donantes efectivos ni reales. (Gráfico 3).
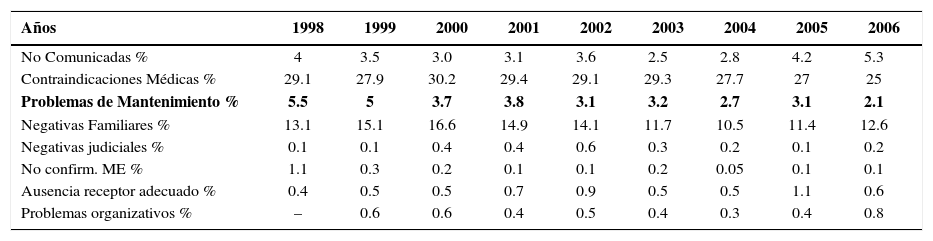
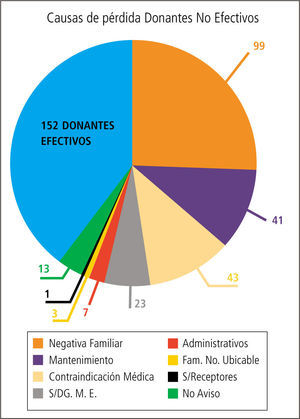
Las causas que motivan el que un donante potencial se pierda y no llegue a ser donante real son variadas, pero se mantiene una constante: en la mayoría de los países la causa subyacente es un inadecuado manejo médico del donante potencial (Tabla 3).
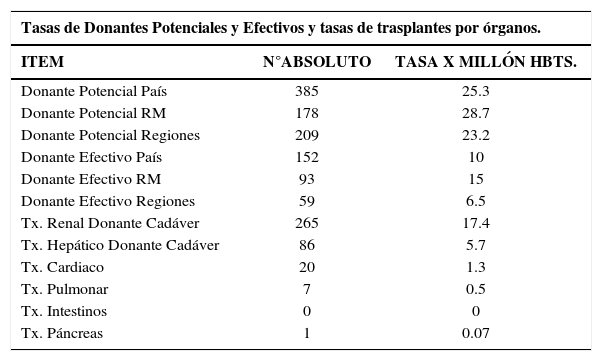
Donantes en chile año 2006
| Tasas de Donantes Potenciales y Efectivos y tasas de trasplantes por órganos. | ||
|---|---|---|
| ITEM | N°ABSOLUTO | TASA X MILLÓN HBTS. |
| Donante Potencial País | 385 | 25.3 |
| Donante Potencial RM | 178 | 28.7 |
| Donante Potencial Regiones | 209 | 23.2 |
| Donante Efectivo País | 152 | 10 |
| Donante Efectivo RM | 93 | 15 |
| Donante Efectivo Regiones | 59 | 6.5 |
| Tx. Renal Donante Cadáver | 265 | 17.4 |
| Tx. Hepático Donante Cadáver | 86 | 5.7 |
| Tx. Cardiaco | 20 | 1.3 |
| Tx. Pulmonar | 7 | 0.5 |
| Tx. Intestinos | 0 | 0 |
| Tx. Páncreas | 1 | 0.07 |
* Población Chile 2002: 1 5.2 millones; RM: 6,2 millones de Hbts., Regiones 9,0 millones Hbts.
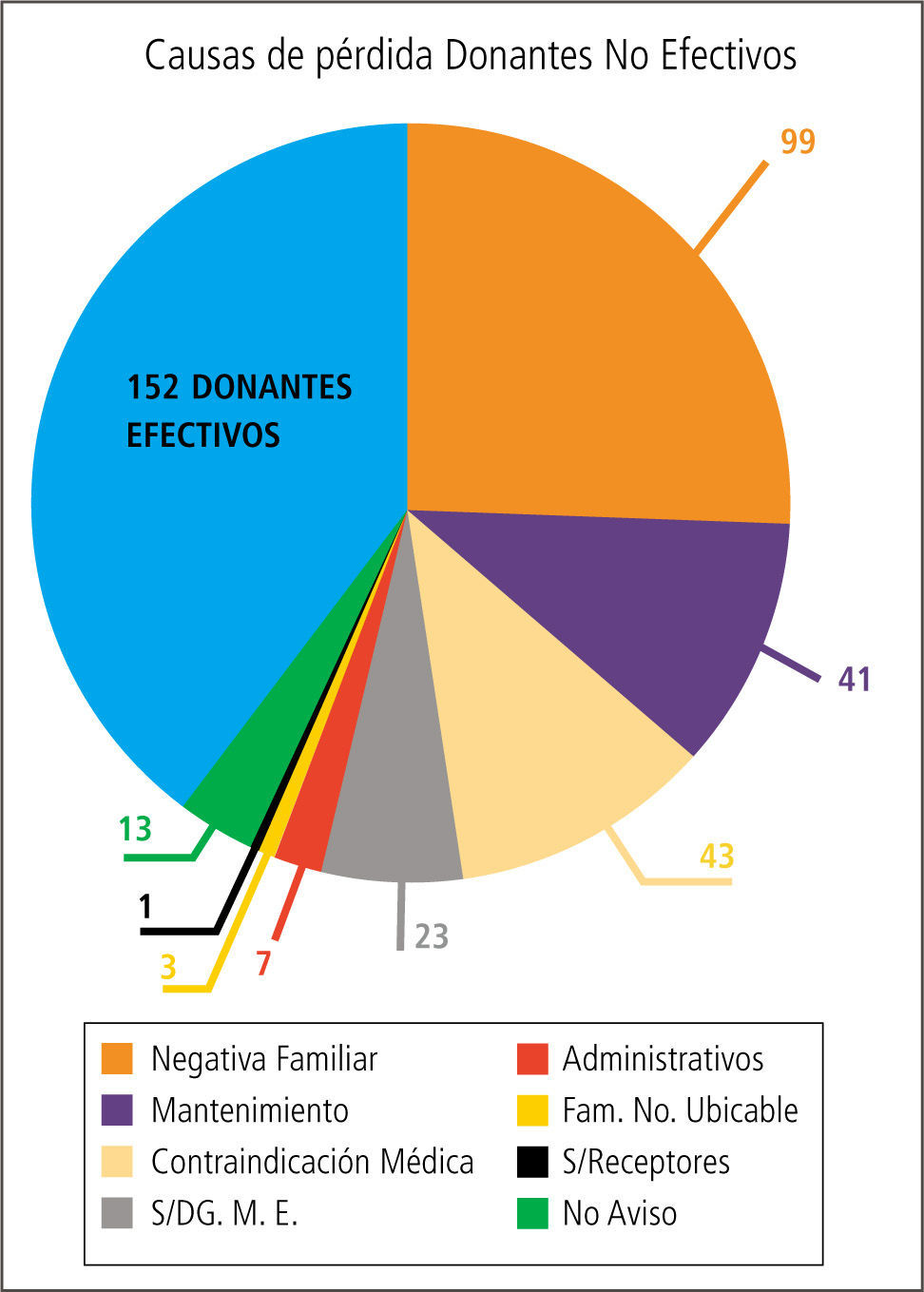
En nuestro país ello también ocurre, de los escasos donantes potenciales detectados muchos se pierden en la etapa previa a que se conviertan en donantes reales, lo que profundiza aún más la carencia de órganos disponibles para ser trasplantados (Tabla 3). Cerca de un 40% de estos no llegan a ser donantes reales.
En cuanto a las causas que motivan el que un donante potencial se pierda y no llegue a ser un donante real son variadas, pero se mantiene una constante; en la mayoría de los países, en un gran número de casos la causa subyacente es un inadecuado manejo del donante potencial.
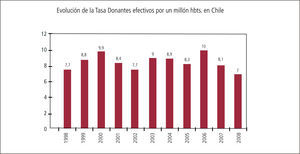
En nuestro país según cifras de la Corporación Nacional de Fomento del Trasplante de Chile, un 55 a 61% de los potenciales donantes no llegan a convertirse en donantes efectivos (Gráfico 4).
De este grupo un 11% se pierde por un inadecuado manejo médico en el periodo que media entre la donación y la extracción de los órganos donados en pabellón.
Dada la tremenda escasez de órganos disponibles para ser donados, el perder un donante potencial por un inadecuado manejo médico en la fase que media desde su diagnóstico hasta que se lo lleva a pabellón resulta intolerable. Por tanto es imperativo conocer la fisiopatología de estos pacientes, para así anticiparse a los eventos que se desarrollan en su evolución y realizar un manejo médico dedicado y de calidad, teniendo en mente que si lo hacemos bien, no sólo aumentaremos la cuantía de donantes efectivos y de órganos donados, sino también la calidad de dichos órganos será mejor, beneficiando aún más a los receptores.
Análisis de las causas de pérdida de donantes potenciales en relación al total de me españa 1998–2006.
| Años | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 |
|---|---|---|---|---|---|---|---|---|---|
| No Comunicadas % | 4 | 3.5 | 3.0 | 3.1 | 3.6 | 2.5 | 2.8 | 4.2 | 5.3 |
| Contraindicaciones Médicas % | 29.1 | 27.9 | 30.2 | 29.4 | 29.1 | 29.3 | 27.7 | 27 | 25 |
| Problemas de Mantenimiento % | 5.5 | 5 | 3.7 | 3.8 | 3.1 | 3.2 | 2.7 | 3.1 | 2.1 |
| Negativas Familiares % | 13.1 | 15.1 | 16.6 | 14.9 | 14.1 | 11.7 | 10.5 | 11.4 | 12.6 |
| Negativas judiciales % | 0.1 | 0.1 | 0.4 | 0.4 | 0.6 | 0.3 | 0.2 | 0.1 | 0.2 |
| No confirm. ME % | 1.1 | 0.3 | 0.2 | 0.1 | 0.1 | 0.2 | 0.05 | 0.1 | 0.1 |
| Ausencia receptor adecuado % | 0.4 | 0.5 | 0.5 | 0.7 | 0.9 | 0.5 | 0.5 | 1.1 | 0.6 |
| Problemas organizativos % | – | 0.6 | 0.6 | 0.4 | 0.5 | 0.4 | 0.3 | 0.4 | 0.8 |
La presencia de hipotermia es un fenómeno constante en el DFME por la lesión del centro termorregulador hipotalámico. Se define la hipotermia por el registro de temperaturas corporales centrales menores a 35°C. Será hipotermia leve entre 32–35°C, moderada entre 28–32°C y severa a la de menos de 28°C.
Sus consecuencias pueden ser graves ya que afecta al miocardio en su actividad contráctil (depresión miocárdica) y eléctrica facilitando la generación de arritmias auriculares y ventriculares. Restringe la entrega de oxígeno desde la hemoglobina por la desviación de la curva de saturación de oxígeno de la hemoglobina hacia la izquierda, contribuyendo a la disminución de la oferta de oxígeno a los tejidos (hipoxia). A nivel renal disminuye la capacidad de reabsorción de agua, agravando la poliuria asociada a la diabetes insípida central. A nivel hematológico en hipotermias profundas puede producirse: Coagulación Intravascular Diseminada (CID), granulocitopenia, hemoconcentración y plaquetopenia.
Efectos hemodinámicosLa situación de inestabilidad hemodinámica que acompaña a la muerte encefálica ha sido descrita como un estado de desacople autonómico cardiovascular que implica la pérdida de la oscilación normal de la presión arterial, invariabilidad de la frecuencia cardíaca, pérdida de la actividad de los barorreceptores y colapso vasomotor.
Sebening y colaboradores (11) comunicaron que existe una primera fase hiperdinámica aguda que duraría unos 15 minutos caracterizada por taquicardia con o sin hipertensión, volumen minuto cardíaco aumentado y catecolaminas plasmáticas elevadas, denominada tormenta adrenérgica o catecolamínica. En ella se libera particularmente noradrenalina, neuropéptidoY (NPY) y simultáneamente, a través de la estimulación de los nervios esplácnicos colinérgicos adrenalina al torrente circulatorio desde la glándula suprarrenal.
Luego sobreviene una segunda fase de estabilización seguida por una hipotensión arterial y disminución de la contractilidad miocárdica acompañada de disminución de catecolaminas plasmáticas, refractariedad a su presencia en la circulación sanguínea secundaria a la disfunción endotelial existente y una disminución de hormona antidiurética (vaso-presina) sérica.
Efectos endocrinos– Déficit de VasopresinaLos DFME suelen tener un profundo compromiso de las áreas hipotalámicas y neurohipofisarias involucradas en la síntesis y almacenamiento de la vasopresina u hormona antidiurética (ADH), tales como los núcleos supraquiasmático o paraventricular y causan un típico síndrome de diabetes insípida central. Las estadísticas sugieren que ella ocurre en más del 70% de las ME. Ella se caracteriza por osmolaridad plasmática > 300mOsm/kg de agua, densidad urinaria menor a 1.005, poliuria superior a 4ml/kg/h, osmolaridad urinaria <300mOsm/kg de agua y cuando la reposición de fluidos es inadecuada se presentan signos clínicos de deshidratación e hipotensión arterial.
– Déficit de Hormona TiroideaEn DFME se ha descrito una entidad clínica conocida como el síndrome eutiroídeo enfermo (11), en el que se detectan valores séricos disminuidos de triiodotironina libre (FT3), tiroxina libre (T4) normal, tirotrofina (TSH) normal, aumento de T3 reversa (T3R) por mayor conversión desde T4, disminución de proteína transportadora (TBG) y menor unión de ella a su ligando. La administración de T3 o de T4 por vía endovenosa produce efectos hemodinámicos inmediatos (minutos) a través de la ligadura a receptores localizados en la superficie celular. Esta acciones han sugerido que puede incluirse a las hormonas tiroídeas en la resucitación hormonal en el donante hemodinámicamente inestable. Sin embargo, esta conducta no demostró beneficio sobre la recuperación de la función contráctil miocárdica en DFME (12).
– CortisolLa secreción de cortisol suele afectarse en todas las situaciones de stress. Se recomienda seguir actualmente los criterios de Annane, que exigen la determinación del cortisol plasmático y luego administra ACTH sintética (synachten 1mg IV) observando la respuesta. El paciente en muerte encefálica en aquellos que no superan los valores de cortisol de 18ug/dl a los 30 minutos de la prueba (76% de los donantes), se autoriza la infusión de corticoides. La UNOS según la publicación de Rosendale y colaboradores (13) incluye en el protocolo de resucitación hormonal a la metilprednisolona (15mg/kg en bolo), pero con un criterio antiinflamatorio.
– Hiperglucemia – InsulinaSe observa hiperglucemia en aproximadamente el 40% de los potenciales donantes. Está asociada a la tormenta catecolamínica, a la disfunción pancreática responsable de una falla en la liberación temprana de insulina, al desarrollo de hormonas contrarregulatorias, resistencia periférica a la insulina con la consecuente refractariedad de los receptores a la insulina por desacople y al aporte terapéutico de dextrosa. La insulina tiene capacidades antiapoptóticas y protectoras de la función endotelial a través de la estimulación de la óxido nítrico sintetasa endotelial (eNOS).
Efectos sobre la CoagulaciónDurante la muerte encefálica se produce la liberación de material neuronal y endotelial al torrente sanguíneo. Entre los productos liberados a la circulación sanguínea destaca la tromboplastina o factor tisular, particularmente en los traumatismos craneoencefálicos y en la hemorragia cerebral. Un 30 a 90% de los donantes presenta algún trastorno bioquímico de la coagulación, la mayoría sin expresión clínica. Si la hay, la mayoría de las veces será como una coagulación intravascular diseminada (CID), la que usualmente se presenta en forma clínica después de las 48 horas de diagnóstico de ME.
Debe tenerse en cuenta el que si como parte del manejo del donante se le administra desmopresina o vasopresina, existirán efectos de ella sobre algunos factores de la coagulación como el factor VIII y Von Willebrand, cuya secreción endotelial es estimulada por la hormona.
Propuesta de manejo médico del donante potencial (DFME)Desde el momento en que se diagnostica la muerte encefálica (ME), los cuidados del enfermo se transforman en medidas de mantenimiento de un DP de órganos; así el esfuerzo terapéutico pasa de estar centrado en el tratamiento de la lesión cerebral al adecuado mantenimiento del donante y de sus órganos.
Estas son algunas sugerencias de manejo de condiciones que usualmente se presentan en un paciente fallecido en muerte encefálica y que es un donante potencial.
1)Manejo Hemodinámico• HipertensiónEs mencionada inicialmente por su frecuencia en la instauración de la muerte encefálica. Puede ser frecuente la crisis hipertensiva debido a la liberación masiva de catecolaminas (tormenta adrenérgica). Deben ser tratadas por que pueden producir lesiones hemorrágicas y/o microinfartos en órganos como el corazón y pulmón. El objetivo es mantener una PAM<de 90mmHg cuando el donante es hipertenso, pero siempre por sobre los 65–70mmHg (14).
• HipotensiónEs el hallazgo más habitual en el potencial donante (80%). Lo primario es descartar una hemorragia oculta. Una vez realizado ello, la hipotensión puede estar dada por una pérdida del tono vasomotor que causa vasodilatación, por disminución de la contractilidad miocárdica o hipovolemia absoluta (la mayoría de las veces generada por el uso previo de manitol, diuréticos, por hiperglucemia o diabetes insípida no adecuadamente tratadas) o relativa (pérdida del tono vasomotor con el incremento de la capacitancia venosa o hipotermia tratada con medidas de calentamiento periférico).
Luego se procede a la reanimación en forma reglada con fluidos con el objetivo de conseguir una PAM no menor a 65mm Hg con una PVC óptima entre 8 a 12mmHg (10/15cm H2O) y una diuresis de alrededor de 1ml/kg/hr.
Una estrategia más liberal con los líquidos (balances positivos) puede realizarse cuando previamente se ha descartado la donación pulmonar o multiorgánica, en caso contrario se recomienda una estrategia restrictiva (PVC 8mmHg).
Un 70 a 90 % de los potenciales donantes pueden ser exitosamente reanimados recuperando su precarga y con dosis bajas de vasopresores, los que se deben administrar en forma reglada y protocolizada.
Protocolo vasopresor de rutina (15)
- 1)
Comenzar con dopamina a 5ug/kg/min
- 2)
Seguir aumentando hasta alcanzar la PAM deseada
- 3)
Dosis máxima de dopamina 10ug/kg/min
- 4)
Si no se logra la PAM deseada con la dosis máxima de dopamina comenzar con Noradrenalina a 0.5ug/kg/min. Dosis máxima de nora-drenalina 0.25ug/kg/min. Considerar introducción de vasopresina en infusión endovenosa continua para intentar retiro de vasoactivos.
En los DFME se producen una serie de alteraciones hormonales ya comentadas, a las que debemos anticiparnos y tratar en forma adecuada. Se recomienda:
- 1)
Metilprednisolona 15mg/Kg
- 2)
Insulina 1U/hr como mínimo titulada por HGT horario
- 3)
Vasopresina 1U bolo, seguida de 0.5–4U/hr
- 4)
T3 4ug en bolo IV seguido de 3ug/hr en infusión continua o T4 20ug en bolo y 10ug/hr en infusión continua.
Es frecuente hallar hiperglicemia en los potenciales donantes. El tratamiento consiste en retirar las soluciones glucosadas e iniciar Insulina idealmente por vía endovenosa, titulando su dosis por HGT horario.
4)Temperatura• HipotermiaLa muerte encefálica causa pérdida de la regulación térmica en el donante y el desarrollo de hipotermia es de regla. No debe utilizarse el control de temperatura axilar o bucal, sino central. El objetivo es mantener el cuerpo entre 36°C – 37.5°C. Se debe minimizar la superficie expuesta del cuerpo, adecuar la temperatura ambiente (aire acondicionado) y usar como tratamiento de calentamiento:
- 1)
Mantas térmicas o mantas múltiples con bolsas de agua caliente entre ellas cuidando no provocar quemaduras locales.
- 2)
Líquidos IV calientes (Cristaloides) hasta 41°C (cautela con caramelización de soluciones glucosadas).
- 3)
Calentamiento de los humidificadores de cascada del respirador hasta 38.5°C.
Es menos frecuente la elevación de la temperatura corporal, ocasionalmente en la fase final de destrucción del centro termorregulador del hipotálamo pueden aparecer picks febriles transitorios. Se debe tratar retirando los medios de calentamiento y usar medios físicos en los que se privilegie la pérdida de calor por convección. Nunca enfriar el gas inspirado en el ventilador mecánico ya que se produce parálisis ciliar.
5)AnemiaSi el donante será multiorgánico la recomendación será mantener el Hto por encima de 30%. El procedimiento quirúrgico de extracción de órganos puede producir sangrados y subsecuente anemia que dañe la perfusión de los órganos a donar por hipoxia tisular.
6)CoagulaciónEl que un DFME tenga una CID de laboratorio es la regla, eventualmente puede tener expresión clínica. OBJETIVO: alcanzar valores normales, de tiempo protrombina(TP) menor 14.5 seg., recuento de plaquetas > 1 50.000/mm3 y Tiempo Parcial de Tromboplastina (TTP) 35.6 seg., Fibrinógeno (1 50 – 350mg/dl). Se deberá reponer con hemoderivados si; el recuento de plaquetas es <65.000/mm3, el TP y TTP son mayores de 15 y 38 seg. respectivamente y/o si el fibrinógeno < 100mg/dl.
7)Ventilación mecánicaEl manejo respiratorio se complica frecuentemente por la existencia de injuria pulmonar primaria o por la presencia de edema pulmonar neurogénico asociado a otras complicaciones. El objetivo de la ventilación mecánica es alcanzar una saturación de O2>95%, con la menor Fi O2 posible (ideal < 40%).
Se recomienda: (16)
- •
Elevar la cabeza del paciente 30°.
- •
Ventilación controlada por Volumen (VCV).
- •
Ventilación por minuto 8–10l/min.
- •
Volumen Corriente (Tidal) 8–15ml/kg peso ideal.
- •
PEEP (presión positiva de fin de espiración) >5cm H2O.
- •
Presión Peak de vía aérea < 30cm H2O.
- •
Presión plateau (meseta) <25cm H2O.
- •
PCO2 entre 30–35mmHg.
- •
Ph arterial 7.35 – 7.45.
- •
Patrón de flujo desacelerado.
Cuando la presión plateau es mayor de 30cm H2O se sugiere utilizar PCV (Ventilación controlada por Presión), para alcanzar los mismos objetivos. Se puede realizar una broncoscopía con el objetivo de evaluar la anatomía, realizar cultivos y toilette de secreciones. Se recomienda prevenir las atelectasias, realizar maniobras kinésicas para tal fin y técnicas de expansión pulmonar.
8)Manejo de Electrolitos• Sodio; – Hipernatremia(Na>150mEq/l) Se asocia a disfunción primaria del injerto hepático. Es la anomalía hidroelectrolítica más frecuente y se produce por poliuria asociada a uso de diuréticos osmóticos y/o a la diabetes insípida (DI) propia de la ME. Tratamiento: Iniciar con 1ug de desmopresina IV (amp. 4ug) e iniciar la reposición con solución hipotónica. OBJETIVO: Mantener una diuresis entre 75/100ml/h (1ml/kg/h) con natremia normal.
Hiponatremia(Na<133mEq/l)En general se debe al aporte de soluciones hipotónicas. Se corrige con aporte de soluciones hipertónicas.
• Potasio; – HiperpotasemiaSe asocia a arritmias cardiacas. Debe tratarse cuando los niveles sean superiores a 5.8mEq/l. Se asocia a destrucción tisular en los politraumatizados, por lo que está indicado solicitar creatin kinasa plasmática ante una eventual rabdomiolisis e insuficiencia renal. Si se confirma la Hiperpotasemia deberán instaurarse las medidas para estabilizar el potencial de membrana y así prevenir arritmias cardiacas, redistribuir e incrementar la eliminación de el potasio del organismo. – Hipopotasemia. Se asocia a arritmias cardiacas. Deben tratarse cuando el potasio sea menor a 3.4mEq/l. Está asociada a poliuria y déficit en el aporte.
•Magnesio; – HipomagnesemiaPuede asociarse a arritmias. Debe tratarse cuando es menor a 1.5mg/dl. Se asocia al uso de diuréticos, a hipopotasemia y a pérdidas por SNG. Se trata con sulfato de Magnesio ev.
• Fósforo; – HipofosfatemiaPuede asociarse a Falla cardiaca transitoria. Debe tratarse cuando la fosfatemia es menor a 2.2mg/dl. Administrar 30mEq de fosfato de sodio o de potasio durante 3 horas y controlar al finalizar la infusión. Se puede repetir la dosis de ser necesario.
• Calcio;se debería medir regularmente y tratar los niveles fuera de rango del calcio iónico, dado que el calcio total puede descender por sobrecarga de volumen, hemodilución o hipoproteinemia. –Hipocalcemia. Se asocia a disfunción sistólica y a arritmias. Iniciar el tratamiento cuando el calcio iónico es menor a 4.4mg/dl. Administrar gluconato de calcio 10ml al 10%, en bolo lento y controlar a la hora.
9)Alteraciones del Estado Ácido-BaseSe recomienda mantener el Ph sanguíneo dentro de parámetros normales (7.35 – 7.45). En caso de acidosis metabólica se administra bicarbonato de sodio endovenoso, previa administración de gluconato o cloruro de calcio por una vía distinta.
ConclusiónEl trasplante de órganos sólidos es una actividad en franco crecimiento en el mundo entero. Nuestro país y por sobretodo nuestros pacientes requieren de nosotros que como equipo médico que hagamos nuestro máximo esfuerzo para que ello también sea una realidad en Chile. Para lograr un transplante exitoso se requiere de la ocurrencia de una serie de eventos muy particulares concatenadamente y con una coordinación muy precisa. En esta cadena de eventos hay eslabones que resultan críticos (fases limitantes), tales como la pesquisa del donante potencial y su adecuado manejo médico. La implementación de estrategias bien orientadas, que estén dirigidas a la mejora de la eficiencia en estas etapas particulares del proceso, con toda seguridad tendrán una mayor eficiencia en la consecución del objetivo final, que no es otro sino el que una mayor cuantía de nuestros pacientes puedan beneficiarse de esta terapia tan promisoria.
Los autores declaran no tener conflictos de interés, en relación a este artículo.