La relación entre función tiroidea y trastornos del ánimo se ha observado desde hace más de 50 años. Las hormonas tiroideas, actúan en el cerebro modulando génicamente proteínas asociadas a la fisiopatología de los trastornos del ánimo y potenciando los sistemas de neurotransmisión serotoninérgica y noradrenérgica. En el tratamiento de un episodio depresivo, la normalización de hormonas tiroideas es fundamental, y debe realizarse en todo paciente con sintomatología anímica, especialmente en aquellos con respuestas insuficientes a tratamiento, que requieren niveles de hormonas más estrictos que lo recomendado para población general. En pacientes eutiroideos, la potenciación con triyodotironina ha sido probada, pero también se ha utilizado T4 en altas dosis en casos resistentes, en que se postula que pudiese existir un estado de resistencia a hormonas tiroideas, no reflejado en los niveles hormonales periféricos evaluados rutinariamente. Las enzimas deiodasas, el receptor de hormona tiroidea, y el transportador de hormona tiroidea en la barrera hematoencefálica son blancos a investigar. Los objetivos de la presente revisión son ofrecer orientaciones respecto del uso de hormonas tiroideas en pacientes con trastornos del ánimo, una puesta al día sobre la relación entre hormonas tiroídeas y sistema nervioso central, y las interacciones entre psicofármacos y función tiroidea.
The relationship between thyroid function and mood disorders has been observed for more than 50 years. Thyroid hormones act in the brain genetically modulating proteins associated with the pathophysiology of mood disorders and potentiating the serotonergic and noradrenergic neurotransmission systems. In the treatment of a depressive episode, the normalization of thyroid hormones is essential, and should be performed in all patients with mood symptoms, especially in those with insufficient responses to treatment, which require more stringent hormone levels than recommended for the general population. In euthyroid patients, potentiation with triiodothyronine has been proven, but T4 has also been used in high doses in resistant cases, in which it is postulated that there might be a state of resistance to thyroid hormones, not reflected in the peripheral hormonal levels evaluated routinely. The enzymes deiodasas, the thyroid hormone receptor, and the thyroid hormone transporter in the blood brain barrier are white to investigate. The objectives of this review are to provide guidance regarding the use of thyroid hormones in patients with mood disorders, an update on the relationship between thyroid hormones and central nervous system, and the interactions between psychoactive drugs and thyroid function.
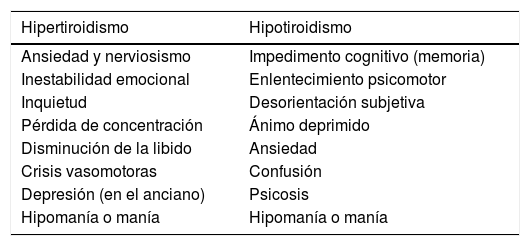
La indemnidad funcional del eje hipotálamo-hipófisis-tiroides (HPT), permite producir las hormonas tiroideas (HT) necesarias para mantener el normal funcionamiento de prácticamente todos los órganos1, por lo que su alteración genera sintomatología variada, incluyendo síntomas neuropsiquiátricos2 (ver tabla 1).
Manifestaciones neuropsiquiátricas asociadas a disfunción tiroidea
| Hipertiroidismo | Hipotiroidismo |
|---|---|
| Ansiedad y nerviosismo | Impedimento cognitivo (memoria) |
| Inestabilidad emocional | Enlentecimiento psicomotor |
| Inquietud | Desorientación subjetiva |
| Pérdida de concentración | Ánimo deprimido |
| Disminución de la libido | Ansiedad |
| Crisis vasomotoras | Confusión |
| Depresión (en el anciano) | Psicosis |
| Hipomanía o manía | Hipomanía o manía |
El objetivo de esta revisión amplia de la literatura es describir el impacto de las HT en el sistema nervioso central (SNC), la asociación clínica y epidemiológica entre patología tiroidea y psiquiátrica, el uso de HT como psicofármaco y el impacto que tienen los psicofármacos sobre el normal funcionamiento de las HT.
Hormonas tiroideas en el SNCLa función tiroidea participa en la modulación de la sintomatología anímica y/o ansiosa, si bien los mecanismos no son del todo claros, es sabido que la función tiroidea participa en una amplia gama de actividades orientadas al desarrollo y maduración cerebral. Estos mecanismos pueden resumirse en: Acción genómica vía Thyroid Hormone Response Elements (TRE), modulación de receptores alfa y beta adrenérgicos postsinápticos, modulación de la concentración de serotonina intracerebral y regulación de estados proinflamatorios.
Respecto a la acción genómica vía TRE, las HT actúan en TRE presentes en zonas regulatorias en amígdala, hipocampo y otras áreas de control emocional, modulando la expresión génica de al menos cinco familias de proteínas1,3 tales como proteínas de mielina, neurotrofinas, factores de transcripción, reguladores de splicing y proteínas involucradas en vías de señal intracelular. También actúan regulando la actividad de yodotironina deiodinasa tipo 2 en células gliales4.
El segundo mecanismo corresponde a la modulación del número de receptores alfa y beta adrenérgicos postsinápticos, tanto en corteza cerebral como en cerebelo, modulando la respuesta noradrenérgica. De esta forma, en el hipotiroidismo la disminución de receptores adrenérgicos podría explicar la hipoactividad neuronal y con ello los efectos en la esfera anímica y cognitiva asociados a esta enfermedad5.
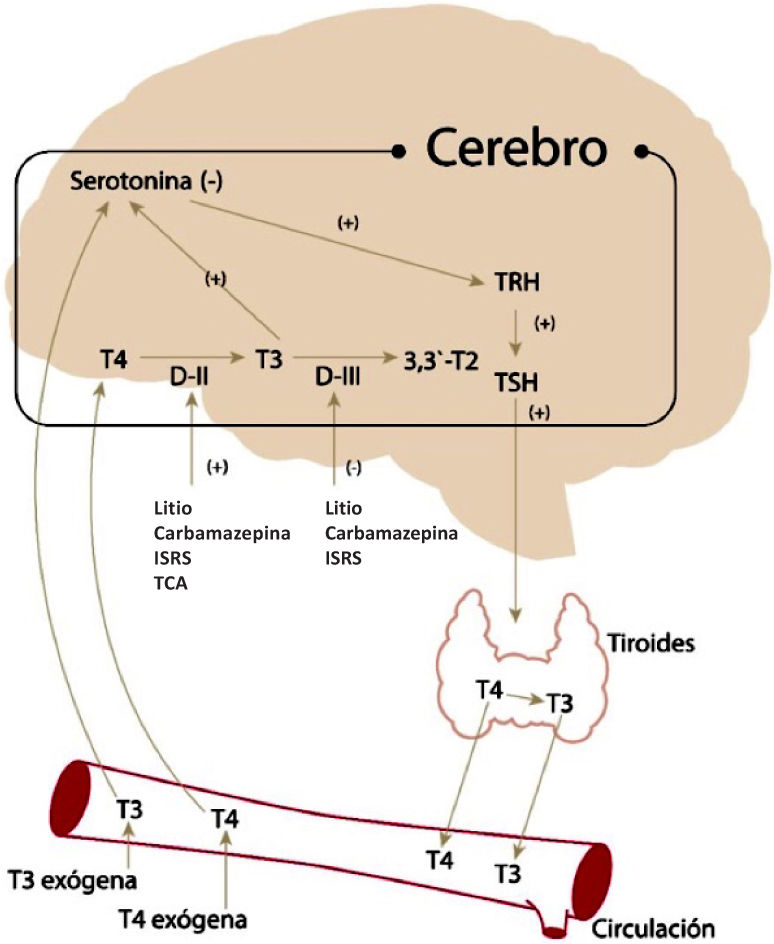
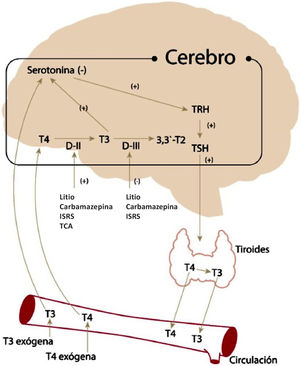
Un tercer mecanismo es la modulación de la concentración de serotonina intracerebral6 observado en estudios en animales, en que la administración tanto aguda como crónica de T3 induce un aumento en la neurotransmisión serotoninérgica, mediante disminución de la sensibilidad de autoreceptores 5-HT1A en el área del rafe, y a un incremento de la sensibilidad del receptor 5-HT27. En seres humanos se ha podido establecer una correlación positiva entre niveles plasmáticos de serotonina y la concentración circulante de T38. Por otra parte, se ha demostrado que la serotonina cerebral disminuye en el hipotiroidismo y aumenta en el hipertiroidismo7. Además, se ha demostrado que una disminución de serotonina intracerebral determina un aumento en la concentración de TRH (thyrotropin releasing hormone), que secundariamente se traduce en una elevación de HT, que a su vez determinan un aumento de serotonina, completándose de esta forma un mecanismo de feedback entre tiroides y SNC en lo que respecta a serotonina intracerebral (Figura 1).
Interacción de serotonina cerebral y hormonas tiroideas
La disminución de serotonina activa el eje Hipotálamo-Hipófisis-Tiroides e incrementa la producción de T3, que a su vez incrementa los niveles de serotonina intracerebral. Se muestran además la acción de enzimas desiodasas y los fármacos que actúan sobre ella. DII y DIII corrresponde a desiodasas II y III. 3,3-T2 es diiodotironina. (Adaptado de Kirkegaard y faber 1998 con autorización de autores.).
Finalmente, se ha descrito que la terapia con levotiroxina conduciría a una disminución significativa de citoquinas inflamatorias, lo cual a su vez estaría asociado a mejoría clínica9.
Relación entre función tiroidea y trastornos del ánimoLa ausencia de síntomas patognomónicos que orienten al clínico en el diagnóstico diferencial entre enfermedad tiroidea y trastorno psiquiátrico, debiera hacer rutinaria la evaluación de función tiroidea en todo paciente que consulta por patología anímica. Nuestro grupo identificó que un 10% de los consultantes a un centro de atención psiquiátrica ambulatoria chileno por depresión y crisis de pánico, presentaban hipotiroidismo, afectando principalmente a mujeres en edad laboral10. Reportes de otros países comunican frecuencias similares, en un rango entre 8 y 17%11. La mayor parte de estos cuadros corresponden a hipotiroidismo subclínico, el cual se caracteriza por ausencia o escasos signos clásicos de hipofunción tiroidea, niveles de hormona estimuladora de tiroides (TSH) inmediatamente por sobre la norma12 y molestias anímicas como principal manifestación.
Por otra parte, un metaanálisis que incluyó 21 estudios, evidenció un riesgo de depresión en adultos con hipotiroidismo subclínico casi 2,5 veces mayor a lo observado en eutiroideos1. Esta asociación afecta transversalmente a diversos segmentos etáreos, tanto en mayores de 50 años14, como en menores de 60 años15. Por otra parte, independiente de la función tiroidea, el sólo hecho de presentar Tiroiditis de Hashimoto se asocia a cuadros depresivos16.
La patología tiroidea impacta negativamente en las tasas de respuesta a tratamiento antidepresivo. Se ha observado mayor prevalencia de patología tiroidea en sujetos que han experimentado una pobre o nula respuesta a tratamiento psicofarmacológico. En nuestro trabajo del año 2004, el diagnóstico de hipotiroidismo llegó a duplicarse en pacientes no respondedores, alcanzando cifras cercanas al 25% de la muestra17, lo que se correlaciona con lo reportado internacionalmente, llegando a un 52% de hipotiroidismo en pacientes con depresión refractaria18. La muy alta frecuencia de disfunción tiroidea en pacientes refractarios a tratamiento con psicofármacos, o que recaen después de una buena respuesta inicial, debiera hacer mandatorio evaluar o reevaluar su función tiroidea.
Sugerimos por lo tanto, la determinación de TSH ultrasensible, hormonas tiroideas y anticuerpos antitiroideos al ingreso y luego anual en pacientes con patología depresiva, las cuales debieran repetirse periódicamente cada 6 meses en el seguimiento de pacientes en mayor riesgo de desarrollar enfermedad tiroidea: antecedentes de enfermedad tiroidea familiar, episodios depresivos refractarios, uso de litio y antipsicóticos (ver secciones posteriores), u otras drogas, como amiodarona, de reconocida acción antitiroidea. En casos de refractariedad, síndromes depresivos de rápida progresión y severidad o historia de autoinmunidad, se sugiere repetir y complementar con anticuerpos antiroideos y ecografía.
Uso de hormona tiroidea en psiquiatríaEs fundamental para la salud mental de todo paciente el mantener una función tiroidea estable y normal, especialmente en situaciones de mayor demanda y gasto energético, tales como embarazo, lactancia y enfermedades crónicas. Es por esta razón, que el uso de hormona tiroidea en pacientes con trastornos del ánimo tiene múltiples indicaciones, abarcando desde aquellos pacientes con depresión e hipotiroidismo, hasta el uso de hormona tiroidea en pacientes eutiroideos.
Uso de hormona tiroidea en depresión comórbida con hipotiroidismoComo principio general, en pacientes con patología psiquiátrica los controles de la función tiroidea debieran ser más frecuentes que los realizados en pacientes sin patología psiquiátrica. Esto obedece a que los pacientes depresivos parecen ser más sensibles a pequeñas modificaciones en el nivel de HT circulante y a las posibles interacciones entre psicofármacos y la biosíntesis y metabolización de hormonas tiroideas. En pacientes que no presentan una disfunción tiroidea, la presencia de bocio o títulos elevados de anticuerpos antitiroideos debe considerarse un elemento importante en su evaluación, tanto por el riesgo de desarrollar una alteración en la función tiroidea como por su relación independiente con la patología psiquiátrica16,17.
La normalización de TSH debiera seguir criterios más estrictos que aquellos usados en el tratamiento de sujetos sin patología psiquiátrica. Actualmente se acepta la propuesta de Haggerty, que postula mantener en los pacientes con enfermedad tiroidea y trastorno psiquiátrico niveles de TSH bajo 3.0mUI/ml y no de 5.0mUI/ml, como se propone en población general19. Esto, dado por la distribución no normal de TSH en población general, con 90-95% de la población bajo 2.5mUI/ml. Así, un porcentaje significativo de pacientes pueden presentar sintomatología de hipotiroidismo leve, asociada al cuadro depresivo20, ya que en las primeras etapas del hipotiroidismo el SNC sería más sensible que órganos periféricos, dando manifestaciones más precoces.
Uso de hormona tiroidea en depresión monopolar eutiroideaA modo de definición, las HT se pueden usar como un acelerador de la respuesta a psicofármacos (en conjunto con un antidepresivo para promover una respuesta más rápida al comienzo del tratamiento), o como potenciador (adicionar hormona tiroidea a un paciente en tratamiento que ha respondido de manera parcial o nula)21.
Como estrategia general, se sugiere su uso como potenciador en pacientes con depresión refractaria, buscando llegar a TSH<2mUI/ml utilizando 50μg/día de T4 ó 25μg/día de T3, incrementando semanalmente según respuesta, con posibilidad de llegar a TSH cercana a 1mUI/ml en caso de no observar respuesta antidepresiva adecuada20. Habría una asociación entre niveles bajos de TSH y una mejor respuesta antidepresiva de inhibidores de recaptura de serotonina lo que sustentaría esta práctica clínica22. Sin embargo, su uso como acelerador de respuesta antidepresiva, que pudiera ser útil en casos con marcada anergia e inhibición psicomotora, es una estrategia poco explorada y validada por la literatura.
Respecto del uso de T4, un estudio abierto de muy bajo tamaño muestral evidenció que dosis suprafisiológicas de T4 (250-600μg/día), son efectivas y bien toleradas cuando se agregan al tratamiento con antidepresivos o estabilizadores del ánimo en depresión refractaria23. Un hecho interesante de resaltar es que, en estos pacientes sometidos a dosis suprafisiológicas de T4, la aparición de efectos adversos es muy escasa o nula, a diferencia de lo que ocurre en pacientes con enfermedad tiroidea clásica, y los signos de hipertiroidismo están ausentes en la mayor parte de los pacientes23,24, incluso con el uso de largo plazo. Estudios de moderada calidad muestran que no hay efecto cardiovascular significativo en el uso prolongado (>2 años) de supradosis de L-T4 (dosis promedio 463mcg/día)25.
Otros eventos adversos son la elevación de transaminasas y pérdida de masa ósea, especialmente deletéreo en mujeres posmenopáusicas que ya pueden tener disminución de su contenido mineral óseo.
Respecto al uso de T3, estudios clínicos randomizados doble ciego, controlados por placebo, han demostrado que T3 es efectiva como potenciador en dosis de 25 a 50μg/día, incrementados de a 25ug/día por semana, por plazos de prueba de 2 a 8 semanas, con mayor efectividad en sujetos con niveles pre estudio más bajos de T3 y con disminución de TSH post intervención26. El beneficio de T3 como estrategia de aceleración presenta evidencia contradictoria, ya que depende de la dosis del ISRS utilizada27. Se encontró beneficio en un estudio con dosis media de 100mg de sertralina, pero ausencia de beneficio en un estudio con dosis promedio de 144.7mg de sertralina, ambos estudios comparables en población y estrategia de medición de sintomatología. Se podría concluir que para dosis moderadas en rango terapéutico de sertralina, la potenciación con T3 es efectiva, beneficio que se pierde al subir a dosis altas en rango útil, posiblemente explicado por la farmacodinamia de sertralina, que a dosis incrementales involucra receptores dopaminérgicos y sigma. Nuestro equipo, en un caso excepcional con respuesta nula a múltiples tratamientos antidepresivos, demostró efectividad y buena tolerancia con dosis suprafisiológicas de T328.
El beneficio de T3 ha sido establecido y ampliamente discutido en el estudio STAR-D realizado por el National Institute of Mental Health (NIMH) de EE.UU., estudio con un diseño naturalístico secuencial randomizado realizado con pacientes con depresión moderada atendidos en centros ambulatorios. Se evaluó la tasa de respuesta antidepresiva de pacientes que comenzaron usando citalopram y ante refractariedad, cambio a psicoterapia u otro antidepresivo (sertralina, venlafaxina, bupropion) y en caso de nuevamente no responder, una tercera etapa de potenciación con T3 o litio. En este tercer nivel, un 24,7% de los pacientes alcanzaron remisión significativa a las 6,6 semanas de tratamiento con T3, tratamiento que fue superior a litio en tolerabilidad, no así en eficacia ni tiempo de respuesta29.
El uso de terapia combinada de T3+T4 no parece tener ventajas sobre el uso de monoterapia con T4 en el control de los síntomas ansiosos, depresivos o cognitivos, de acuerdo a lo reportado por estudios de baja calidad y no orientados a población depresiva propiamente tal, así su uso depende de la clínica y se reserva para pacientes con sospecha de falla en la conversión periférica de T430,31.
Uso de HT en Depresión bipolarSe ha reportado que bajos niveles de T4 libre en pacientes con trastorno afectivo bipolar (TAB) se asocian a mayor frecuencia de episodios y mayor severidad de los mismos durante la fase de profilaxis con litio. En pacientes con TAB, se ha observado mayor prevalencia de alteraciones tiroideas y mayor frecuencia de autoanticuerpos contra peroxidasa tiroidea (TPO), lo que contribuye síntomas depresivos. Finalmente, un alto porcentaje de pacientes en tratamiento con litio desarrollan hipotiroidismo durante su tratamiento, lo que impacta en la respuesta clínica y severidad de los episodios (ver siguiente sección)32.
Lamentablemente, la evidencia es heterogénea y escasa, por lo que las recomendaciones clínicas tienen bajo nivel de evidencia. Es una recomendación de experto considerar HT en casos de: TAB ciclador rápido (que afecta al 10-15% de los pacientes con TAB) y en depresión bipolar refractaria a tratamiento. Se recomienda partir con T4 100mcg/día y aumentar de a 100mcg/día por semana según respuesta, con dosis máxima de 300mcg/día32,33
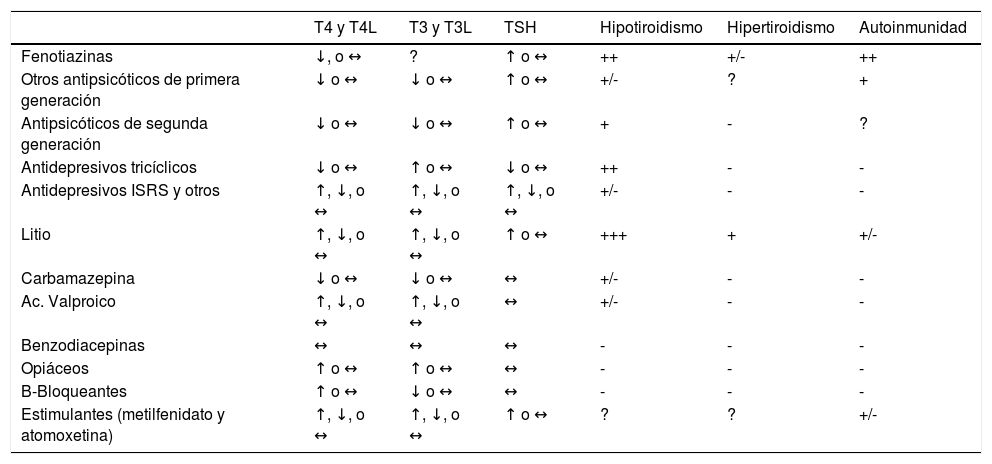
Hormonas tiroideas y psicofármacosPsicofármacos y hormonas tiroideas poseen mecanismos de acción comunes. Ambos pueden modular el número de receptores postsinápticos y la concentración de serotonina intracerebral7, mecanismos que eventualmente podrían potenciarse. Por otra parte, varios fármacos psicotrópicos pueden interferir con la fisiología tiroidea, como resultado de sus acciones en diferentes niveles de la síntesis de hormonas tiroideas34. Dado que los pacientes con patología mental, frecuentemente tienen indicado uno o más fármacos psicotrópicos, se hace relevante la comprensión de los efectos adversos que éstos fármacos pueden tener sobre el funcionamiento tiroideo (ver Tabla 2 y Figuras 1 y 2).
Efecto de diferentes psicotrópicos sobre la función tiroidea
| T4 y T4L | T3 y T3L | TSH | Hipotiroidismo | Hipertiroidismo | Autoinmunidad | |
|---|---|---|---|---|---|---|
| Fenotiazinas | ↓, o ↔ | ? | ↑ o ↔ | ++ | +/- | ++ |
| Otros antipsicóticos de primera generación | ↓ o ↔ | ↓ o ↔ | ↑ o ↔ | +/- | ? | + |
| Antipsicóticos de segunda generación | ↓ o ↔ | ↓ o ↔ | ↑ o ↔ | + | - | ? |
| Antidepresivos tricíclicos | ↓ o ↔ | ↑ o ↔ | ↓ o ↔ | ++ | - | - |
| Antidepresivos ISRS y otros | ↑, ↓, o ↔ | ↑, ↓, o ↔ | ↑, ↓, o ↔ | +/- | - | - |
| Litio | ↑, ↓, o ↔ | ↑, ↓, o ↔ | ↑ o ↔ | +++ | + | +/- |
| Carbamazepina | ↓ o ↔ | ↓ o ↔ | ↔ | +/- | - | - |
| Ac. Valproico | ↑, ↓, o ↔ | ↑, ↓, o ↔ | ↔ | +/- | - | - |
| Benzodiacepinas | ↔ | ↔ | ↔ | - | - | - |
| Opiáceos | ↑ o ↔ | ↑ o ↔ | ↔ | - | - | - |
| B-Bloqueantes | ↑ o ↔ | ↓ o ↔ | ↔ | - | - | - |
| Estimulantes (metilfenidato y atomoxetina) | ↑, ↓, o ↔ | ↑, ↓, o ↔ | ↑ o ↔ | ? | ? | +/- |
↑: aumenta; ↓: disminuye; ↔: mantiene.
Rojo: Alteración más probable, con evidencia consistente; Naranjo: Alteración más probable, con evidencia más débil o controversial.
Adaptado de Bou & Richa (2011) y Quiroz et. al. (2004) con permiso de los autores.
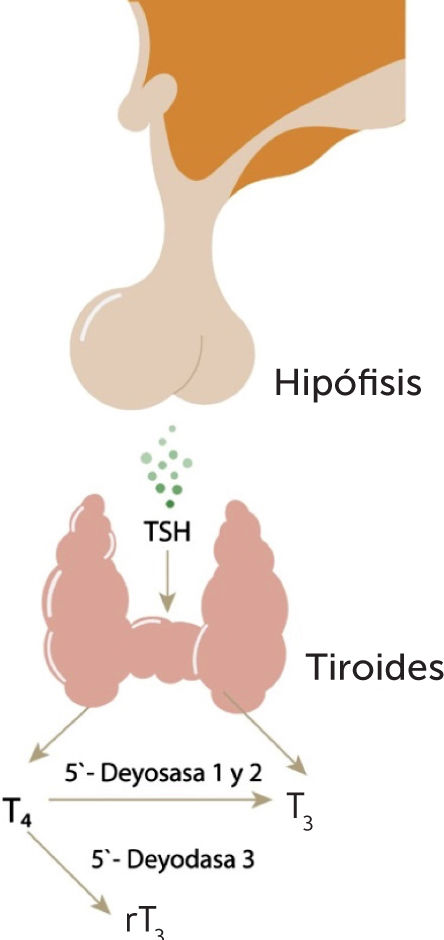
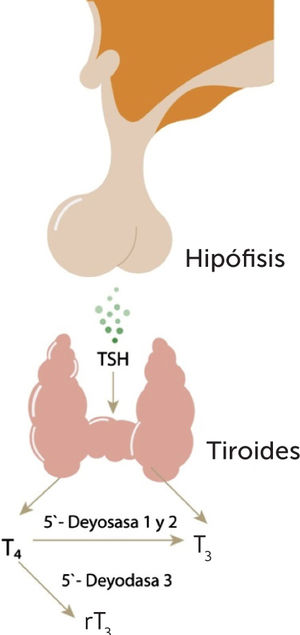
Desiodasas y Hormonas Tiroideas
La TSH estimula a la glándula tiroides para que secrete las hormonas tiroideas (10 veces más T4 que T3). A nivel periférico (principalmente hepático y renal), la 5’ deiodasa 1 y 2 convierte la T4 en T3, que es la hormona biológicamente activa. La conversión periférica da cuenta del 80% de la T3 disponible. Por otra parte, la T4 también se puede convertir en T3r, que no tiene actividad biológica, por desiodación mediada por la 5’ deiodasa 3.
TSH: Hormona estimulante de tiroides (por sus siglas en inglés), T4: Tetrayodotironina o tiroxina, T3: Triyodotironina, T3r: Triyodotironina reversa.
Se ha descrito que los antipsicóticos de primera generación fenotiazínicos (Ej: clorpromazina, tioridazina y flufenazina), como grupo, interfieren directa y significativamente con la captura de yodo por las células tiroideas, un efecto que tendría relación con la formación de complejos yodo-fenotiazina, dependiente de la constante de formación (Kc) de cada fármaco35, además de un efecto inmunogénico sobre el tejido tiroideo, con eventual tiroiditis iatrogénica. Las fenotiazinas también pueden afectar al eje HPT mediante la disminución de la sensibilidad a la respuesta de TSH a TRH, por inhibición de receptores alfa adrenérgicos, sin alterar los niveles de TSH basal36. Por otra parte, algunos antipsicóticos de segunda generación bajan los niveles de T4L, en particular olanzapina y quetiapina, pero no así risperidona o aripiprazol, lo que evidencia la compleja diversidad en la farmacodinamia que se observa dentro de esta familia de fármacos37.
Efecto de fármacos antidepresivos sobre la función tiroideaLa interferencia de fármacos antidepresivos como tricíclicos (TCA) e ISRS es conocida38,39. El efecto más constante es la disminución de los valores de T4 total y de la fracción libre40, este efecto sería mayor en quienes presentan mejor respuesta terapéutica, posiblemente por potenciación en las enzimas deyodasa I y II, encargadas de convertir T4 en T341. Por otra parte, se ha observado que litio, carbamazepina y fluoxetina disminuyen la actividad de la deyodasa III, encargada de metabolizar T3 a T2; aumentando aún más los niveles de T341 (Figuras 1 y 2). Lamentablemente esto último es conflictivo en la literatura, ya que hay reportes de disminución tanto de T4 como de T3 asociado al uso de ISRS, pero sin cambios en los niveles de TSH22.
En específico, los TCA pueden alterar las HT tanto por efectos periféricos como centrales. A nivel periférico, dependiendo de su Kc, desactivan las moléculas de yodo por reacciones de complejación (en especial desipramina, imipramina o clomipramina)35. Pueden desactivar la enzima peroxidasa tiroidea, mediante la formación de enlaces covalentes con el grupo hemo, necesaria para la oxidación de yoduro a yodo y la transformación de tiroglobulinas hasta tironinas activas (T4 y T3)39, lo que puede alterar los niveles de T4, sin afección de los niveles de TSH. A nivel central, se ha demostrado que los desipramina puede alterar el eje HPT, llevando a un estado hipotiroideo, con reducción de los niveles tanto de T4L como TSH42.
Antidepresivos no-ISRS como mirtazapina, reboxetina, venlafaxina y hierba de San Juan, presentan alteraciones poco claras y contradictorias de T3, T4 y TSH por lo que no es posible realizar conclusiones que modifiquen la práctica clínica43–45. Dado que las implicancias clínicas de los antidepresivos sobre la función tiroidea son poco claras, no se recomienda de regla el monitoreo de HT en todos los usuarios de antidepresivos, más allá de la recomendación básica aplicada a los pacientes con depresión.
Efecto del litio sobre la función tiroideaProbablemente el litio es el fármaco más conocido y estudiado respecto de sus efectos adversos sobre la función tiroidea y el eje HPT39. Dentro de los mecanismos de acción descritos están: competición por el transporte de yodo, la inhibición de la liberación de T4 desde la glándula tiroides a la circulación, la inhibición de la actividad de la deiodasa tipo 1 (conversión periférica de T4 a T3), inducción secundaria de la secreción de TSH desde la glándula pituitaria y activación de anticuerpos antitiroideos con desarrollo de tiroiditis46. Algunas de estas alteraciones, como la inhibición en la liberación de T4, ocurren ya desde la primera semana de uso.
Como consecuencia de estas alteraciones, se puede desarrollar:
- •
Hipotiroidismo subclínico y clínico: 10-20% de los usuarios de litio, principalmente en mujeres o en personas con autoinmunidad tiroidea previa, y se puede desarrollar tan rápido como algunas semanas desde el inicio del fármaco hasta los dos primeros años de tratamiento39.
- •
Bocio: especialmente en mujeres, hasta en 40% de usuarios de litio entre 1 y 5 años, y hasta un 50% en aquellos que se han tratado por más de 10 años47, pero puede surgir desde el primer mes de tratamiento. Se ha estimado una incidencia de bocio de 4% por año de uso de litio48.
- •
Hipertiroidismo es la complicación menos frecuente, con mayor probabilidad tras varios años de uso de litio49 y se relacionaría con bocio tóxico nodular y tiroiditis silente. La incidencia de tiroiditis silente asociada a uso de litio se ha estimado en aproximadamente en 1,3 casos por 1000 personas/año, mientras que tirotoxicosis asociada a litio en 2,7 casos por 1.000 personas/año, que de todas formas serían más elevadas que en la población general de 0,03 a 0,28 y 0,8 a 1,2 por 1.000 personas/año, respectivamente50. El hipertiroidismo también se podría manifestar tras la suspensión de la terapia con litio, el mecanismo implicado guardaría relación con el “enmascaramiento” de un hipertiroidismo subyacente por inhibición sostenida de la liberación de hormona tiroidea al torrente sanguíneo mientras se usa el fármaco51.
Se recomienda con amplio acuerdo, que los pacientes tratados con litio cuenten con una evaluación previa de la función tiroidea, así como su monitoreo posterior en forma regular, con seguimiento inicialmente semestral por al menos un año y posteriormente según clínica, con un control mínimo anual.
Efecto de otros psicofármacos sobre la función tiroideaLa carbamazepina puede reducir los niveles de HT mediante la inducción de enzimas hepáticas que aceleran la metabolización, determinando una caída en los niveles de T4 y T3, tanto total como de sus fracciones libres. Sin embargo, la disminución de la concentración de HT no va acompañada de un efecto sobre el eje HPT con incremento paralelo de la TSH, especulándose un efecto central de carbamazepina impidiendo la elevación de esta hormona52.
El ácido valproico parece tener un efecto mucho menos homogéneo sobre la función tiroidea, mostrando elevaciones, disminuciones o incluso normalidad de los niveles de HT asociados a su uso53. Las benzodiacepinas, opioides de sustitución (Metadona), B-bloqueantes no selectivos (Propranolol) y anticolinérgicos (Orfenadrina) también pueden presentar alteraciones en los niveles de T3 y T4, pero sin efectos sobre los niveles de TSH ni claras implicancias clínicas39 (Tabla 2).
En suma, más allá de los clásicos y conocidos efectos del Litio sobre la función tiroidea, existen varios fármacos menos conocidos por su injerencia sobre la homeostasis de ésta glándula y el eje HPT. En particular, además del litio, tanto psiquiatras como endocrinológos, deberíamos tener en mente la relevancia de los antipsicóticos, en especial de las fenotiazinas, como causa probable de hipotiroidismo iatrogénico, e incorporar medidas de monitorización en aquellos pacientes que usen este tipo de fármacos, en especial mujeres.
ConclusiónLa relación entre función tiroidea y trastornos del ánimo es estrecha, significativa y con alto impacto en la clínica. La importancia del diagnóstico precoz de una disfunción tiroidea tiene implicancias sustanciales en el manejo y, por lo tanto, puede modificar conducta, previniendo cuadros refractarios, prolongados y de difícil manejo, con la consecuente mejoría en la calidad de vida de nuestros pacientes. Asimismo, puede llevar aparejada una disminución en el número y dosis de psicofármacos utilizados, con reducción de costos y consecuencias en otros aspectos médicos relevantes en el manejo de patologías crónicas, como una mejoría de los parámetros lipídicos y de potenciales alteraciones cardiovasculares, y otras anomalías que suelen estar asociadas a la enfermedad tiroidea12. Con esto, estamos integrando la totalidad de la problemática de nuestros pacientes, realizando una medicina centrada en la persona y no en los síntomas.
Conflicto de interésDeclaración de conflicto de interés
Autores declaran que no tienen conflictos de interés.
Referencia no citada13.