El dolor musculoesquelético (DME) es una de las causas principales de dolor crónico no oncológico y de discapacidad laboral. Tiene una gran prevalencia y está subdiagnosticado. En este artículo se analizan las causas de DME entre las que destacan la fibromialgia (FBM) y el sindrome dolor miofascial (SDM). Se comparan ambas patologías y se describen las principales causas y características, que pueden facilitar su distinción por un médico no especialista. Se analizan las causas de la FBM, su etiología, características clínicas y las formas de manejo según consensos de guías clínicas. Se describen características clínicas del SDM como la causa más frecuente de dolor regional persistente y se evalúa el manejo farmacológico y no farmacológico adecuados para evitar la cronificación del dolor.
Musculoskeletal pain is one of the main causes of chronic non cancer pain and work disability. Has a great prevalence and is underdiagnosed disease. In this article we analyze the causes of musculoekeletal pain, among those fibromyalgia and myofacial pain syndrome. This article compares both pathologies and describes their main causes and characteristics that can facilitate their distinction by a non specialist doctor. It analyse the causes of fibromyalgia, their etiology, clinical characteristics and the management according to consensus of clinical guides. It describes clinical characteristics of myofacial pain Syndrome as the most frequent cause of persistent regional pain and the pharmacological and non pharmacological treatments in order to avoid chronification of pain.
El dolor musculoesquelético (DME) es una de las causas principales de dolor crónico no oncológico, provoca discapacidad laboral [1], tiene una gran prevalencia y muchas veces es subdiagnosticado. En Chile el dolor crónico además tiene un alto impacto social y económico [2]. Afecta a un porcentaje relativamente alto de la población, en las últimas encuestas europeas entre 11% y 40%, y en Chile es de un 30% [3]. Se menciona además que es más frecuente en mujeres, aumenta conforme avanza la edad, es mayor en personas casadas y viudas, de nivel sociocultural bajo y con elevada comorbilidad asociada [3].
En el DME se debe diferenciar el dolor que proviene de las articulaciones, en donde predominan enfermedades degenerativas e inflamatorias, y el no articular o de partes blandas. La causa más frecuente de dolor musculoesquelético articular es la artrosis y luego la lumbalgia crónica. En la mayoría se mantiene el dolor por largo tiempo.
Como causa importante de DME crónico no articular, se debe considerar afecciones de partes blandas que la circundan, en donde pueden estar involucrados tendones, ligamentos, bursas, cartílagos, nervios y músculos [4,5], y que representan el grueso de las afecciones musculoesqueléticas; entre éstas encontramos con frecuencia cuadros como dolor miofascial y fibromialgia, los que deben ser diferenciados entre sí.
Es importante considerar que en el dolor musculoesquelético crónico, el fenómeno inflamatorio no es lo más importante, pero sí son relevantes los mecanismos de neuroplasticidad. Además, hay factores biofísicos y psicosociales que contribuyen al mantenimiento de este tipo de dolor, no estando totalmente aclarada aún la interacción entre ellos [5].
A pesar de los costos involucrados en la rehabilitación, los estudios a largo plazo muestran controversias en los tratamientos y con esto mejorías subóptimas. Una de las razones que se ha encontrado en este manejo discorde, es partir con un diagnóstico errado. Si no hay un diagnóstico etiológico preciso hay menos probabilidad de curación y sólo se puede mitigar el dolor.
En esta oportunidad haremos una revisión de dos causas relevantes de dolor no articular o de partes blandas como causa de DME y que se deben distinguir entre sí: la fibromialgia y el dolor miofascial. Se hará una revisión, evaluando características comunes y diferencias.
2FIBROMIALGIA Y DOLOR MIOFASCIALSi podemos efectuar un paralelo de similitudes de estas dos enfermedades, en cuanto a las características del dolor, ambas provocan dolor muscular, de intensidad variable y referido a áreas del cuerpo involucradas. Hay diferencias que las distinguen entre sí, así vemos que el dolor en la fibromialgia involucra varias áreas del cuerpo, mientras que el síndrome miofascial es un dolor localizado en ciertas regiones. En la fibromialgia suele aparecer de forma gradual y puede empeorar con el transcurso del tiempo, mientras que el dolor miofascial puede darse en forma repentina y volverse crónico. En la fibromialgia, los puntos de dolor son varios y se encuentran expandidos, en cambio en el caso del síndrome miofascial, los puntos de dolor están localizados. Los puntos dolorosos (tender points) de la FBM se asocian con dolor sólo en el lugar de la palpación, no se acompaña de dolor referido, y ocurren en la zona de inserción de los músculos, no en la “banda tensa” del vientre muscular [41]. Por definición, los pacientes con fibromialgia tienen puntos dolorosos (tender) no puntos gatillos (trigger) del dolor miofascial.
La fibromialgia puede convertirse en una condición que perdura a través del tiempo hasta el punto de desarrollar algún grado de discapacidad en la persona. En el síndrome miofascial el dolor es, por lo general, moderado y la discapacidad es temporal.
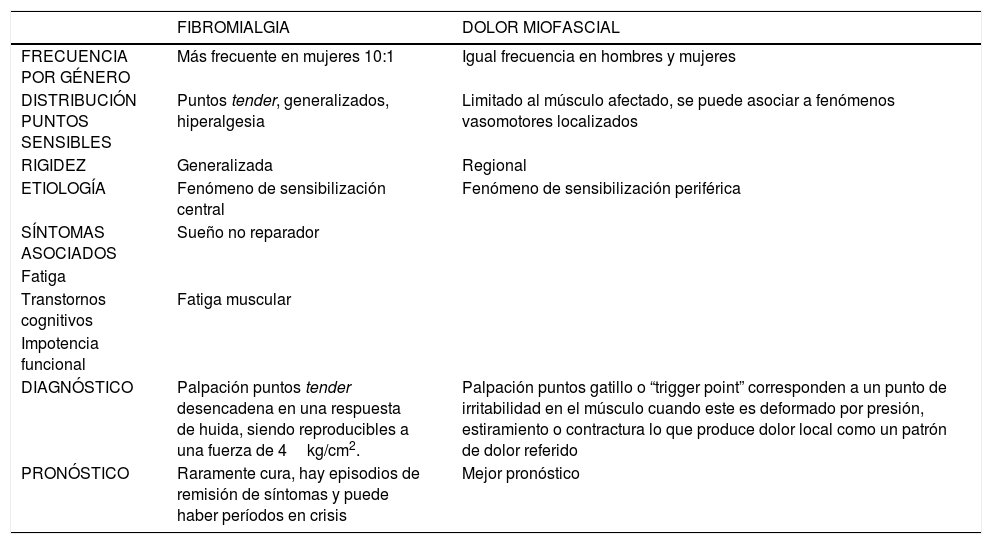
Conocer estas diferencias permitirá al médico tomar las decisiones adecuadas en el plan de tratamiento. En la Tabla 1, se pueden ver características de ambos sindromes, los que analizaremos con más detalle a continuación.
Comparación entre Fibromialgia y Dolor Miofascial
| FIBROMIALGIA | DOLOR MIOFASCIAL | |
|---|---|---|
| FRECUENCIA POR GÉNERO | Más frecuente en mujeres 10:1 | Igual frecuencia en hombres y mujeres |
| DISTRIBUCIÓN PUNTOS SENSIBLES | Puntos tender, generalizados, hiperalgesia | Limitado al músculo afectado, se puede asociar a fenómenos vasomotores localizados |
| RIGIDEZ | Generalizada | Regional |
| ETIOLOGÍA | Fenómeno de sensibilización central | Fenómeno de sensibilización periférica |
| SÍNTOMAS ASOCIADOS | Sueño no reparador | |
| Fatiga | ||
| Transtornos cognitivos | Fatiga muscular | |
| Impotencia funcional | ||
| DIAGNÓSTICO | Palpación puntos tender desencadena en una respuesta de huida, siendo reproducibles a una fuerza de 4kg/cm2. | Palpación puntos gatillo o “trigger point” corresponden a un punto de irritabilidad en el músculo cuando este es deformado por presión, estiramiento o contractura lo que produce dolor local como un patrón de dolor referido |
| PRONÓSTICO | Raramente cura, hay episodios de remisión de síntomas y puede haber períodos en crisis | Mejor pronóstico |
TD: transdérmico; VO/24hr: dosis diaria vía oral.
Nota: Conversiones referenciales en valores aproximados extraídos y adaptados de diferentes fuentes. No deben ser usados como guía terapéutica.
Existen muchas maneras de ayudar a aliviar los síntomas y volver al estado óptimo de salud. Las personas que sufren de fibromialgia y síndrome miofascial deben conocer lo que significa su enfermedad para poder reintegrarse a sus actividades y poder llevar una vida saludable y activa.
3FibromialgiaLa fibromialgia es el síndrome de dolor crónico musculoesquelético que ha manifestado más cambios en el último tiempo. Desde que el American College of Rheumatology (ACR) en 1990 estableció criterios que ponía especial énfasis en la exploración de puntos de dolor denominados tender points, y logró con esta definición hacer un consenso de este síndrome, aumentando el número de estudios en forma exponencial. Es fundamental tener una terminología uniforme para unificar criterios y hacer estudios de mejor calidad. Las últimas investigaciones indican que es la segunda enfermedad más prevalente dentro de las que cursan con dolor crónico [6]. En estudios recientes los resultados dan esperanzas acerca del control de los síntomas.
Tiene una prevalencia de 2% en población general y de 6 a 10% en consultas de Medicina Interna. Hay un aumento de frecuencia progresiva a medida que se ha conocido más del síndrome y unificación de criterios diagnósticos Es más frecuente en las mujeres con una proporción 10:1, sobre todo en el rango de edad de los 30 a 60 años.
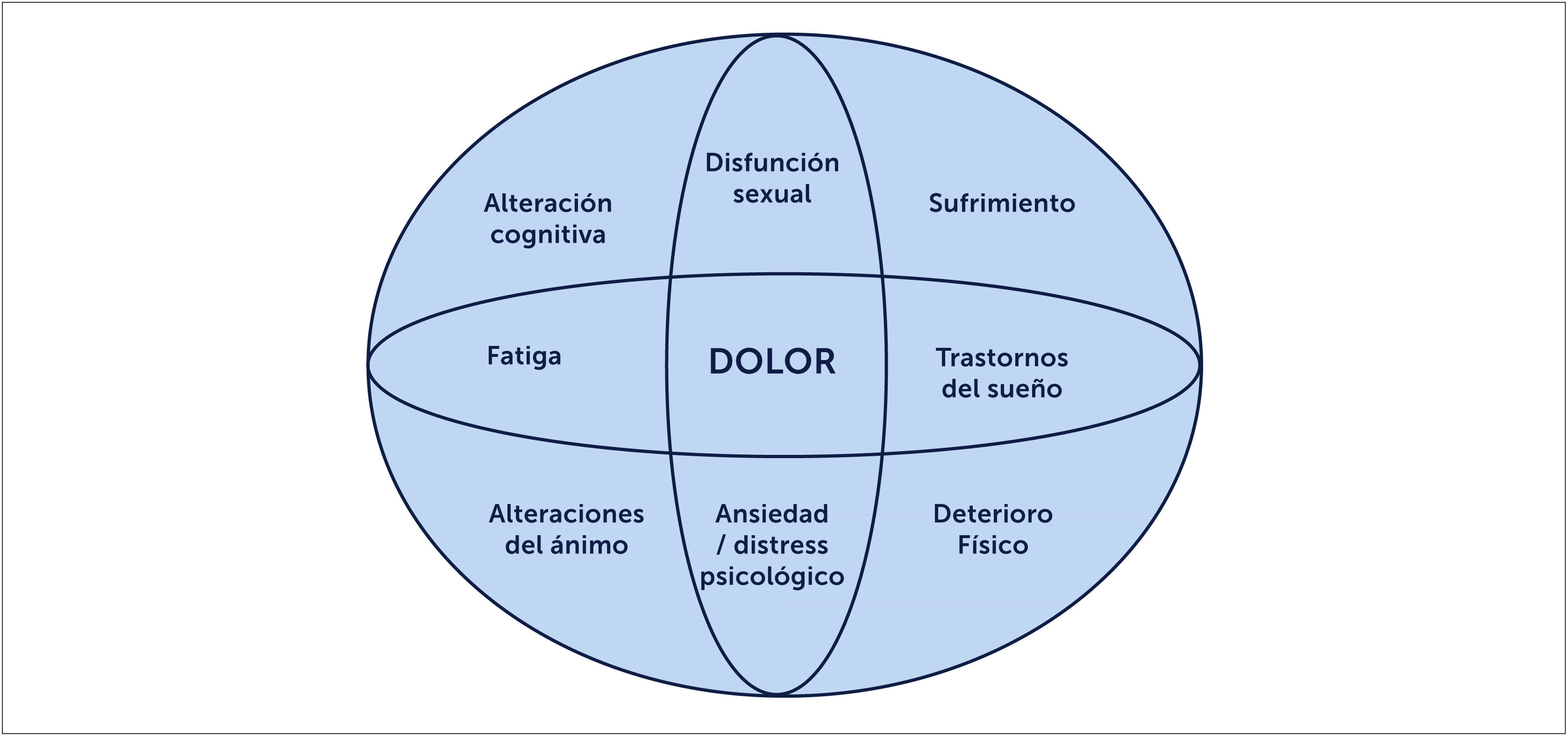
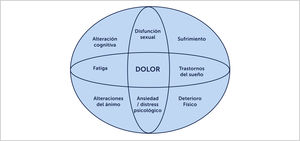
La FBM define como una enfermedad que provoca dolor musculoesquelético crónico generalizado, por más de 3 meses, asociado a múltiples síntomas como fatiga, alteraciones del sueño, disfunción cognitiva y trastornos depresivos. También puede incluir síntomas neurológicos como parestesias, visión borrosa, entumecimiento y debilidad muscular. Además, de acuerdo al médico evaluador se puede entrecruzar con otras patologías de dolor funcionales como colon irritable, vejiga neurogénica, dolor pélvico crónico, vulvodinia o trastornos temporo mandibulares [23] (Figura 1). Estas condiciones de dolor pueden estar solapadas y se ha visto que tienen patogenia subyacentes similar a la del dolor de la FBM. Existe también una alta prevalencia de insomnio dentro de los síntomas frecuentes que no son explicadas por depresión o dolor. Se ha visto en algunos estudios que voluntarios sanos con deprivación de sueño tienen síntomas similares a FBM [17].
Reconocida por la OMS como enfermedad en 1992, pertenece al grupo M79 [24], como enfermedad reumática no articular de la actual CIE-10 y cambiaría por la categoría MG40 que engloba al dolor crónico generalizado en la CIE-11 y que entrará en vigencia el 1 de enero de 2022 [7].
La FBM pertenece a un grupo de enfermedades con dolor y otros síntomas somáticos que no pueden ser adecuadamente explicados por el grado de inflamación que se encuentra en sus tejidos periféricos. Hoy existen evidencias que demuestran una alteración de los mecanismos inhibitorios descendentes de la transmisión del dolor.
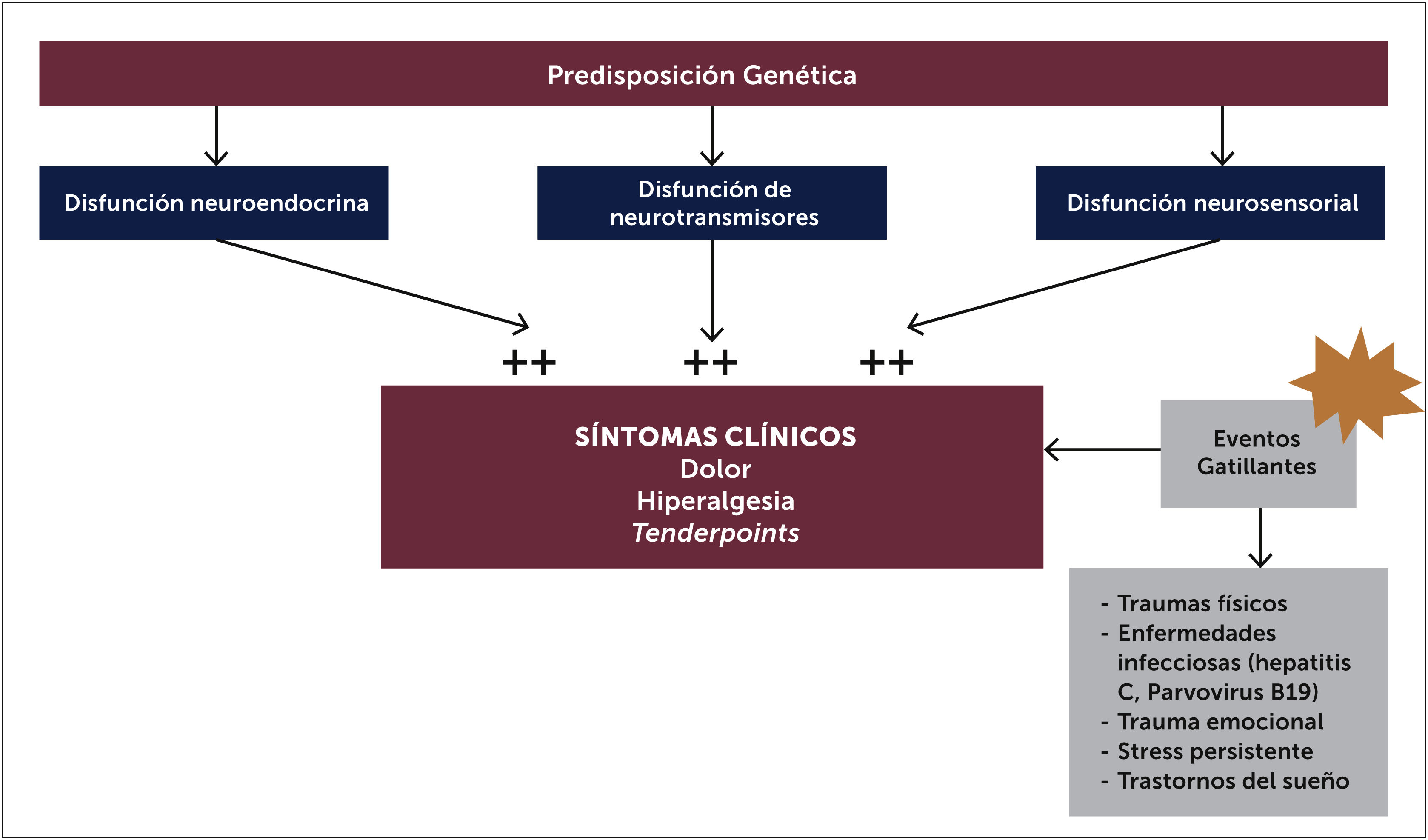
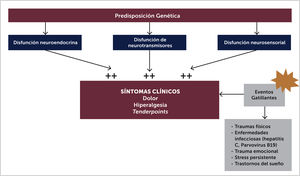
3.1FisiopatologíaAunque la etiología de la FBM no ha sido completamente clarificada, hay consenso en que el procesamiento del dolor está alterado, siendo esta la principal causa de su patogenia. Existen alteraciones neuroendocrinas, disautonómicas y neurosensoriales, que estarían presentes en individuos con una predisposición genética, un probable polimorfismo [17] en donde una gran variedad de estresores medio ambientales pueden ser factores precipitantes en desencadenar los síntomas de FBM [8,14] (Figura 2). Se ha estudiado además rasgos de personalidad predisponentes [8] que pueden actuar frente a estos factores gatillantes como infecciones, trauma y el stress [9].
Las alteraciones neuroendocrinas se presentan como disfunción del eje hipotálamo hipofisiaria y adrenal. Los pacientes tienen cortisol plasmático elevados y habría una respuesta anormal a los eventos estresantes como traumas o infecciones. Se han encontrado además alteraciones de hormonas tiroideas y hormona del crecimiento. En relación a la disfunción del sistema autónomo, hay estudios que demuestran una respuesta potencial anormal del Sistema Nervioso Autónomo (SNA) frente a determinados estímulos, con menor tolerancia al frío y diferencias en la temperatura central y periférica [15], siendo frecuente los fenómenos de disautonomía.
Las alteraciones de neurotransmisores en pacientes con FBM se manifiestan con alteración de la concentración de mediadores de la transmisión de dolor, con aumento de los neurotransmisores excitatorios y disminución de los inhibitorios. Hay disminución de los niveles de serotonina en LCR [22] y aumento de los niveles de sustancia p comparado con controles; en la FBM alrededor de un 80% tienen aumento de los niveles de sustancia p en el LCR. Recientes hallazgos sugieren que podría haber ciertas mutaciones genéticas que predisponen a la FBM, se han identificado genes como el receptor de 5HT2A (serotonina), transportador de serotonina, receptor D4 de dopamina y COMT (catecolamin ometil transferasa) o transportador de catecolaminas, que apoyan la teoría de la existencia de una deficiencia de serotonina predisponente [5].
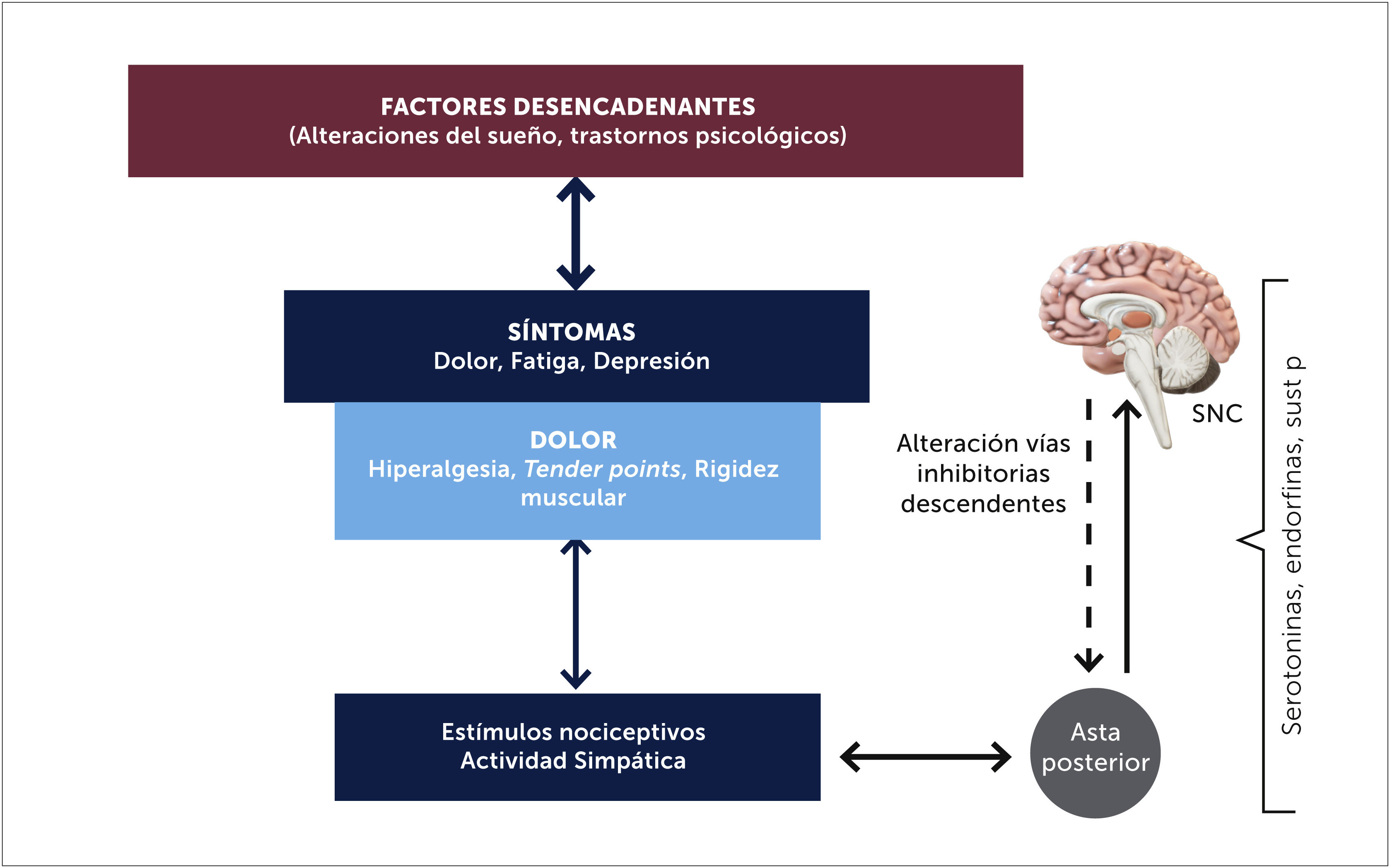
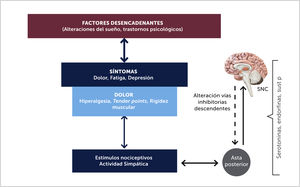
La sensibilización central sería así el principal factor responsable de los fenómenos de dolor que se presentan en la FBM, tanto de la hiperalgesia (aumento de respuesta del dolor frente a un estímulo doloroso) y/o de la alodinia (respuesta de dolor a un estímulo no doloroso) [23]. En el asta posterior hay activación de los receptores NMDA, neuronas de amplio rango dinámico y desinhibición del dolor debido a función deficiente del sistema inhibitorio descendente y que serían los responsables de la alodinia y la hiperalgesia [17]. Estudios en animales han descubierto cambios en el SNC que van desde la médula espinal hasta la corteza. Se ha demostrado que hay alteración de los receptores NMDA. En un estudio efectuado por Henriksson con ketamina (inhibidor de receptores NMDA), utilizados para manejo del dolor en 58 pacientes con FBM, se encontró que 33 pacientes (57%) fueron respondedores, con disminución del dolor de reposo [17].
Los estímulos nocivos estresores podrían en ciertas condiciones, producir cambios neuroplásticos que llevan a un estado corticolímbico sensibilizado provocando una cascada secuencial y amplificada, que producirían un dolor de las características de la FBM. Esta condición cerebral sensibilizada, implica procesos centrales espontáneos, sumación de síntomas adicionales mediante expansión neuroanatómica y sensibilidad patológica a nuevos estímulos no nociceptivos [14,15] (Figura 3). Las respuestas aberrantes y amplificación del dolor quedan demostradas en estudios funcionales con RNM cerebrales, estudiando el pattern de activación cerebral secundario al estímulo de dolor, reproduciéndose las imágenes funcionales cerebrales con 3 veces menos presión al comparar con personas sanas [19].
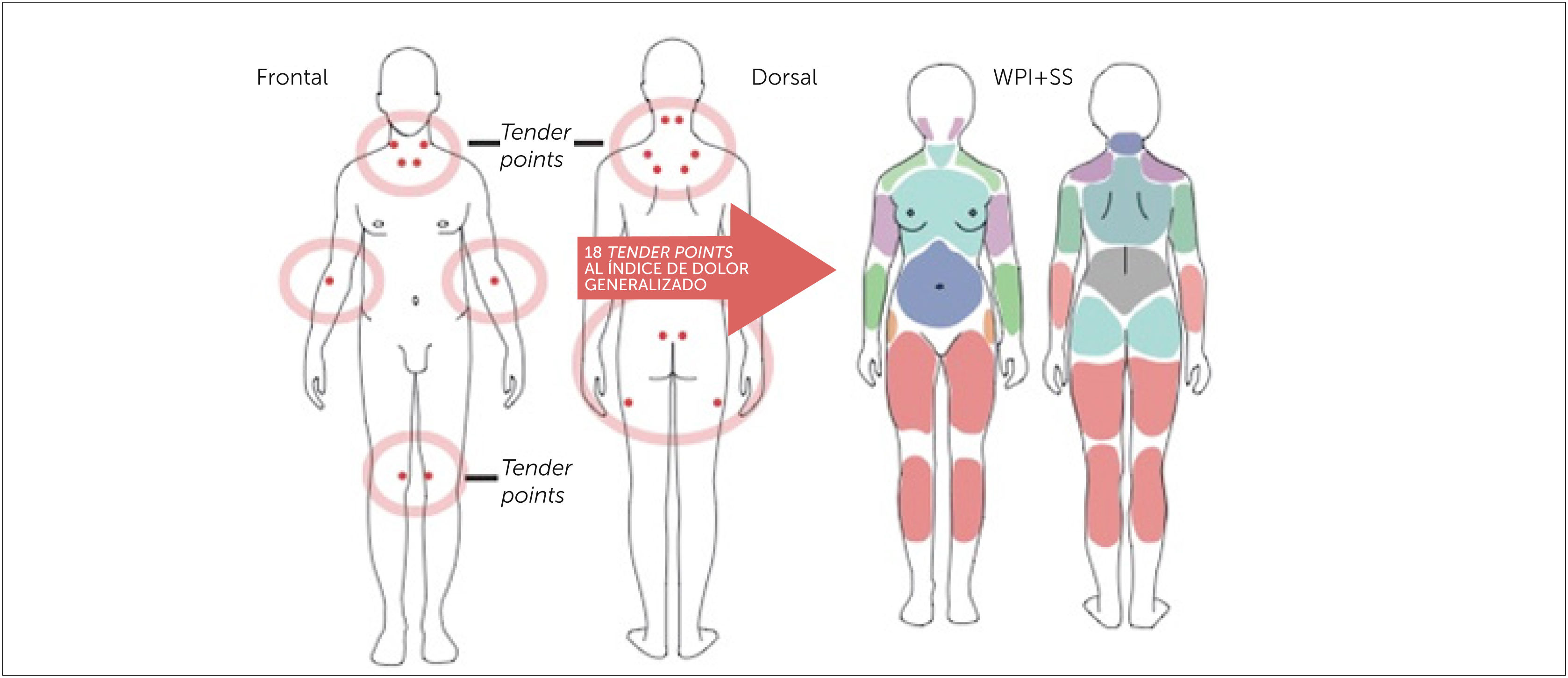
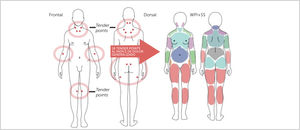
La principal característica de la fibromialgia es la condición de dolor crónico multifocal, que se presenta con alodinia (percepción autónoma del dolor) o hiperalgesia generalizada [17], esto es lo que distingue a la FBM de otras condiciones de dolor musculoesquelético crónico, se acompaña además de mialgias de localización imprecisa y de duración prolongada. El dolor suele ser difuso, profundo, intenso, a veces difícil de describir, y suele empeorar con el ejercicio físico intenso, el frío y el stress [19]. El dolor puede estar presente a la palpación con una presión digital de más o menos 4kg (cuando cambia la coloración subungueal del explorador) varios puntos del cuerpo, inicialmente se valoraba que fueran 11 de un total de 18 puntos dolorosos (según ACR 1990). Estos puntos de dolor se denominan tender points y no tienen alteraciones orgánicas demostrables, habitualmente son acompañados de discapacidad musculoesquelética y se asocian a múltiples síntomas secundarios específicos como fatiga, rigidez matutina, trastornos del sueño y trastornos cognitivos [10]. A pesar de que estos síntomas no fueron considerados por el ACR 1990, para el diagnóstico de FBM, en la clasificación actual (ACR 2010), son considerados como relevantes para el diagnóstico. La FBM entonces, ha dejado de ser una enfermedad musculoesquelética crónica, más bien una sensibilización central como la base neurobiológica que explica la mayoría de los síntomas sistémicos. En este sentido, se condidera la FBM con un criterio más dinámico con síntomas fluctuantes, y esto dio pie a los nuevos criterios diagnósticos de ACR del 2010 [11].
Los tender points pueden ser usados en el diagnóstico de FBM cuando evaluados en combinación con otros trastornos funcionales, suman criterios de diagnóstico. Hasta el 2010, los criterios diagnósticos se habían basado en el consenso de 1990 de la ACR en que la base era el reconocer número de puntos tender. Desde el 2010 la ACR elimina el conteo de “tender points”, sumando a la evaluación síntomas a menudo reportados por los pacientes en la evaluación clínica y dejando además, la posibilidad de incluir pacientes en que el dolor generalizado no predomina en los síntomas y que eran excluidos con los criterios de ACR 1990. La repercusión funcional de la FBM dependerá de la intensidad del dolor, la fatiga, la alteración del sueño y la sintomatología ansiosa depresiva.
Es así como las variables diagnósticas más importantes en el diagnóstico de FBM desde el consenso de ACR del 2010 se basan en el dolor generalizado y la gravedad de los síntomas que la acompañan [11], medidas por: Índice de Dolor generalizado (WidespreadPainIndex: WPI) y el Índice de Gravedad de Síntomas (Sympyom Severity Score: SS) (Tablas 2 y 3).
- -
-Índice de Dolor Generalizado (WidespreadPainIndex (WPI): el paciente debe registrar el número de áreas (entre un total de 19 regiones en las que se divide el cuerpo) en las que ha tenido dolor durante la última semana (Tabla 2). El valor debe estar entre 0 y 19. Un valor mayor de 7, establece el diagnóstico. El WPI tiene un 83.2% de sensibilidad, 87.6% de especificidad y 85.4% de precisión [10].
Tabla 2.Índice de Dolor Generalizado (Widespread Pain Index (WPI))
Cintura escapular izquierda Nalga derecha Pecho (Tórax) Cintura escapular derecha Pierna superior izquierda Abdomen Brazo superior izquierdo Pierna superior derecha Cuello Brazo superior derecho Pierna inferior izquierda Espalda superior Brazo inferior Izquierdo Pierna inferior derecha Espalda Inferior Brazo inferior derecho Mandibula izquierda Nalga izquierda Mandibula derecha Indicación para el paciente: Ponga una cruz sobre cada área en la que ha sentido dolor durante la semana pasada, teniendo en cuenta que no debe incluir dolores producidos por otras enfermedades que sepa que sufre (artritis, lupus, artrosis, tendinitis, etc.).
- -
Escala de Gravedad de Síntomas (Symptom Severity Score [SS Score]) (Tabla 3)
SS score, parte 1: Se usa para cada uno de los tres síntomas (fatiga, sueño no reparador y síntomas cognitivos), el paciente debe elegir el nivel de gravedad durante la última semana en una escala de 0 a 3. La puntuación del SS-Score 1 es la suma de la gravedad de los 3 síntomas.
SS score, parte 2: Mide el grado de los síntomas somáticos en general.
- •
Sin sintomas, su puntuación 0
- •
Entre 1 y 10, su puntuación es 1
- •
Entre 11 y 24, su puntuación es 2
- •
De 25 o más, su puntuación es 3
Luego se suman SS1+SS2: la puntuación final oscila entre 0 y 12. Si es ≥5 es significativo.
- •
Se considera que un paciente cumple criterios diagnósticos de fibromialgia de la ACR 2010 (Wolfe 2010) [11] si reúne las 3 condiciones siguientes:
- 1.
Índice de dolor generalizado (WPI) ≥ 7 y escala de gravedad de los síntomas (SS-Score) ≥ 5, o si hay un WPI 3-6 y gravedad de los síntomas ≥ 9.
- 2.
Cuando los síntomas se han presentado con la misma intensidad durante al menos 3 meses.
- 3.
El paciente no padece otra patología que pueda explicar el dolor.
Todas las guías de práctica clínica coinciden en que no existen pruebas de laboratorio ni biomarcadores disponibles para el diagnóstico de la FBM. Tampoco hay pruebas complementarias ni datos radiológicos que apoyen el diagnóstico, los exámenes normales son un apoyo para confirmarlo. Aún así, se debe hacer una serie de pruebas con el fin de realizar el diagnóstico diferencial en forma correcta [19]. En consecuencia, la base del diagnóstico sigue siendo la historia clínica junto con la evaluación física y pruebas de laboratorio básicas para descartar otras patologías.
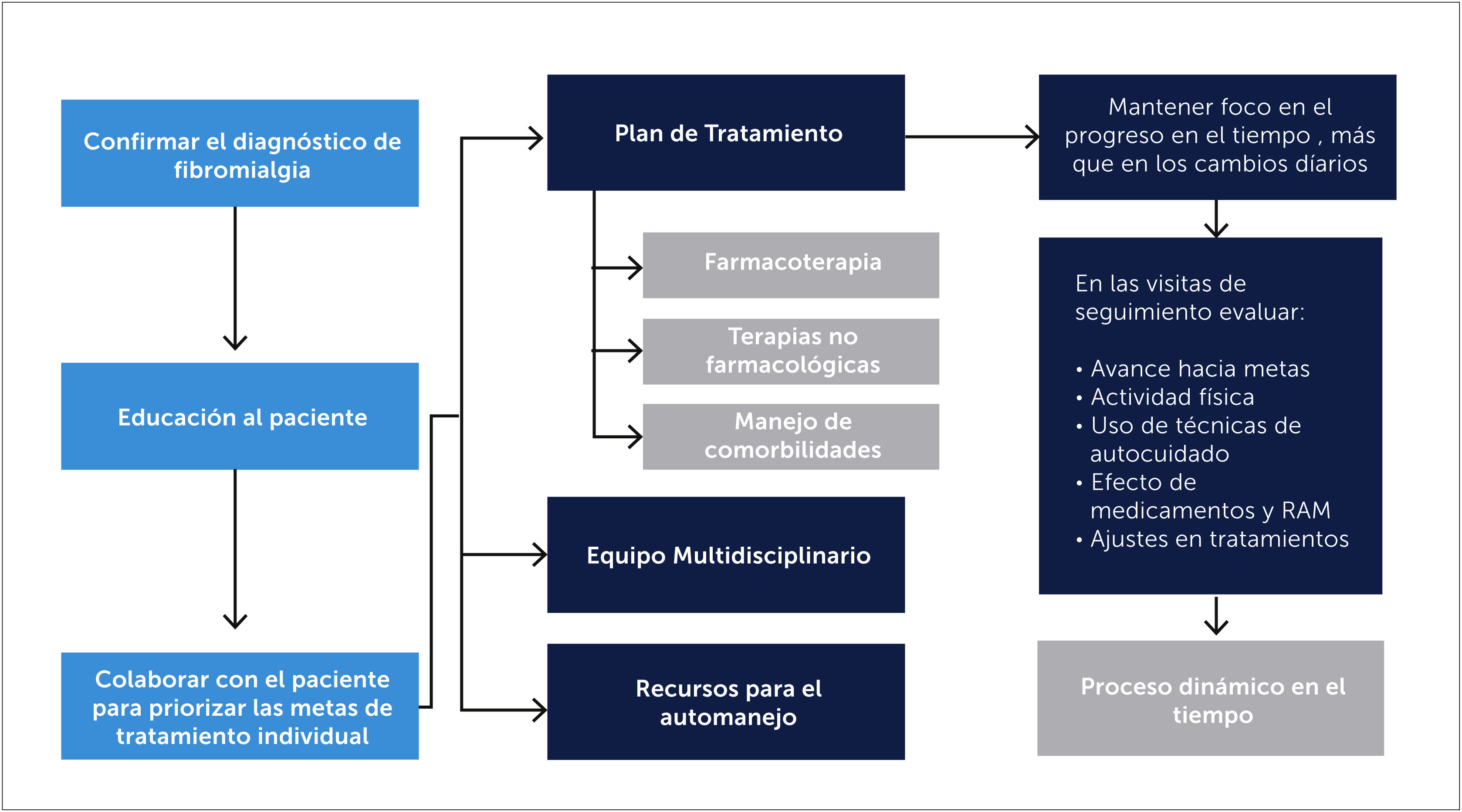
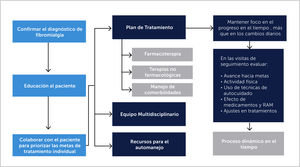
3.4TratamientoComo es una condición crónica y requiere de un manejo dinámico (Figura 5), la educación juega un rol importante en el manejo de la FBM, y debe ser integrada al plan de tratamiento y al seguimiento después del diagnóstico [26]. Una vez confirmado el diagnóstico es importante la validación del paciente y el confort emocional. El tratamiento irá enfocado a mejorar la funcionalidad y la calidad de vida, aunque lo más probable es que se consiga en forma parcial [10]. Esto debe ser comunicado a los pacientes, evitar la creación de falsas expectativas y la desilusión por parte del paciente y su médico en el caso de que los síntomas no se resuelvan [19]. Se debe hacer un plan de tratamiento de acuerdo con el paciente y en relación a sus molestias principales. Este modelo de atención puede ser usada por médicos de atención primaria y sólo recurrir al especialista en casos especiales.
3.5Fármacos y medidas no farmacológicasLa combinación de tratamientos farmacológicos y no farmacológicos es lo recomendable para un adecuado alivio de los síntomas. Al analizar guías de manejo de FBM se sugiere que el uso de farmacoterapia debe ser puntual para responder a síntomas no controlados o al dolor irruptivo intenso. Es necesario un abordaje que incluya todas las áreas afectadas, con un manejo farmacológico adecuado para disminuir dolor, el insomnio y mejorar el estado del ánimo.
3.6FarmacoterapiaLa FDA aprobó la duloxetina, milnacipram y pregabalina para el tratamiento de la fibromialgia [25], los años 2007, 2008 y 2009 respectivamente [37]. Tanto la duloxetina como el milnacipram ayudan a controlar niveles de dolor por cambio en los neurotransmisores cerebrales (serotonina y NA) y son efectivos en el manejo de múltiples dominios. La pregabalina (PGB) es un bloqueador de canales de calcio α2δ, bloquea la actividad aumentada de las neuronas involucradas en la transmisión de dolor. En revisión Cochrane de 2016 con trabajos de buena calidad se evaluó que con dosis de pregabalina entre 300 a 600mg hay reducción del dolor moderado a severo de la FBM entre 12 a 36 semanas en un 10% más que el placebo [27]. Este alivio del dolor va acompañado de mejoría de otros síntomas, calidad de vida y función. Estos resultados son similares al de los otros medicamentos aprobados para la FBM (duloxetina y milnacipram). A pesar de que no todos los pacientes con FBM responden a la pregabalina, este medicamento representa un importante paso en su tratamiento. Es necesario considerar los efectos adversos como mareos, somnolencia que ocurre en 1 de cada 5 pacientes, además del aumento de peso, confusión y euforia.
La gabapentina, otro bloqueador α2δ, tiene evidencia más limitada que la PGB y no está aprobada por la FDA para uso en FBM. Un estudio de Arnold y cols, muestra que la gabapentina es segura y eficaz al compararla con placebo [37,40]. Puede ser una alternativa a pregabalina cuando exista barreras para acceso al fármaco.
Los tricíclicos, como amitriptilina, es el tratamiento farmacológico con evidencia más sólida, en manejar síntomas de dolor, el insomnio y la fatiga asociada a la FBM, aunque se muestra necesario tener un seguimiento exhaustivo de los efectos secundarios. Se aconseja que debe ser usada por períodos cortos para controlar el dolor [6]. La ciclobenzaprina, relajante muscular tiene estructura similar a amitriptilina y ha sido usado en el manejo de molestias musculares y alteraciones del sueño.
El papel de los analgésicos como paracetamol, AINES y opioides débiles es limitado en las guías de consenso de tratamiento. El tramadol es el que mejor resultado muestra. Se puede recomendar su uso en caso de haber agotado otras vías de abordaje y el paciente siga presentando dolor moderado a grave. Los tratamientos con estos fármacos deben ser cortos; utilizándose en casos concretos [6,26], usado como segunda línea, asociado o no a paracetamol y como inicio en dosis bajas para mejorar la tolerancia. Deben retirarse apenas sea posible y controlar en forma periódica. No están indicados los opioides potentes.
El manejo del trastorno del sueño es fundamental en el paciente con FBM, ya que un sueño no reparador aumenta la fatiga y disminuye el umbral del dolor. Se debe comenzar por hacer una higiene de sueño, uso de inductores de sueño o derivar a especialista para manejo del área, si hay un trastorno específico de éste.
3.7Terapias no farmacológicasLas terapias no farmacológicas incluyen ejercicios físicos especialmente aeróbicos y de flexibilidad. Se debe empezar con un calentamiento suave, seguido de estiramientos de grupos musculares grandes [6] y luego relajación, puede ser en piscina temperada con y sin ejercicio. Las terapias de manejo cognitivo conductual de grupo, tienen una evidencia fuerte de eficacia en la FBM [12] y se debe evaluar las necesidades específicas de cada paciente [14].
Todas las terapias alternativas muestran controversias entre guías, por lo que se necesitan más estudios y de mayor calidad para poder valorar su aplicabilidad. Solo la acupuntura, el Qi-Gong (Chi Kung), el yoga y el taichi presentan recomendaciones positivas en alguna guía [6]. Estudios recientes muestran favorables resultados con la terapia laser de bajo nivel (LLTL) [29].
Aunque no se conoce tratamiento curativo para la FBM, puede haber disminución de los síntomas más limitantes, disminuyendo la discapacidad física y con eso mejorar la calidad de vida. Se debe considerar que la enfermedad siempre está latente.
4SINDROME DOLOR MIOFASCIALEl Sindrome de Dolor Miofascial (SDM) es una de las causas más comunes de dolor musculoesquelético y es la causa más frecuente de dolor regional persistente. La falta de criterios unificados y la ausencia de pruebas diagnósticas dificultan el cálculo de su prevalencia real. Se estima una prevalencia entre 13.5 a 47% en promedio, entre 21 a 30% en la consulta del internista o traumatólogo y aumenta a un 85 a 90% en unidades de dolor [35]. Frecuentemente es subdiagnosticado porque a menudo se acompaña de síntomas y signos adicionales al dolor, en coincidencia con condiciones patológicas, con problemas conductuales y psicosociales. Afecta por igual a hombres y mujeres.
Conocer y entender el síndrome de dolor miofascial es necesario para los médicos de atención primaria considerando que este tipo de dolor representa el motivo de consulta en el 39% de pacientes en la atención primaria, aumentando su prevalencia con la edad. El SDM es una entidad descrita por Janet Travell y David Simons en 1992, referida a un proceso de dolor muscular regional agudo o crónico, primario o secundario, prevalente, incapacitante, subdiagnosticado y por consiguiente poco tratado [32].
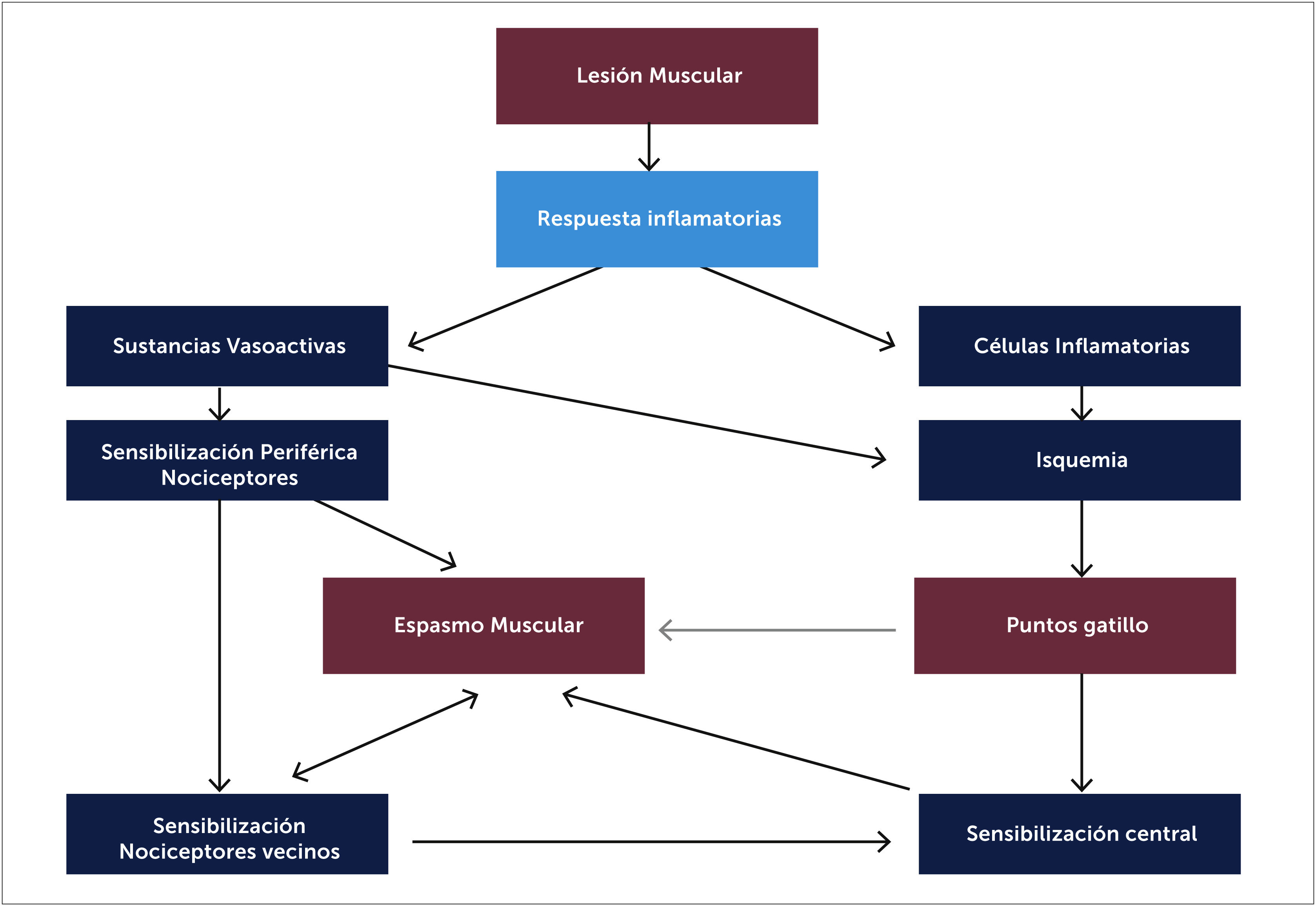
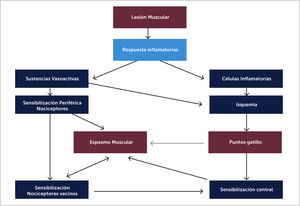
4.1FisiopatologíaNo hay una teoría aceptada en su totalidad, se propone que situaciones como traumatismos agudos, microtraumatismos repetidos, falta de ejercicio, posturas inadecuadas y mantenidas, deficiencias de vitaminas, alteraciones del sueño y problemas articulares que predispongan a microtraumatismos crónicos [33] incrementan de manera sostenida la liberación de acetilcolina en la placa motora. Esta disfunción parece debida a una despolarización anormal de la placa motora por mecanismos presinápticos, sinápticos y postsinápticos (excesiva liberación de acetilcolina [ACh], defectos de la enzima acetilcolinesterasa y aumento de la actividad del receptor nicotínico de la ACh, respectivamente) y la consecuente contracción y agotamiento energético de la fibra muscular [43]. Así se inicia un ciclo de hipoxia e isquemia que lesiona aún más la fibra muscular y libera sustancias nociceptivas (sensibilización periférica), perpetúando el ciclo y formando los puntos gatillo miofasciales (Figura 6). La isquemia relativa es el factor más importante en el desarrollo de la banda tensa al igual que el acortamiento y el espasmo que dañan tejidos afectados y libera neurotransmisores inflamatorios que activan receptores musculares y aumentan la actividad de la placa motora. Estudios electromiográficos han demostrado ruido de placa terminal 5 veces más frecuente en zonas del punto gatillo que en zonas alejadas de éste [36]. En estudios histopatológicos en ratas se han encontrado sarcómeros acortados con disminución de mitocondrias y con estructura alterada [35].
La definición de Simons [33] sigue siendo la más aceptada para describir el sindrome de dolor miofascial, descrita en 1992, lo define como “un conjunto de síntomas sensoriales, motores y autonómicos que son causados por un punto de gatillo miofascial”.
Los puntos gatillos miofasciales son nódulos dolorosos, sensibles de mayor consistencia e hiperirritables que se localizan sobre bandas musculares tensas, palpables en los músculos o fascias que pueden desencadenar una respuesta local contráctil ante la estimulación mecánica, apreciada como una contracción. Este dolor local es percibido como profundo y puede ser referido a sitios adyacentes o lejanos que rara vez coinciden con distribución sensitiva de dermatomas o nervio periférico [36]. El dolor referido puede dar alteraciones en la sensibilidad y cambios autonómicos en sitios remotos a su ubicación.
Por lo tanto, el dolor miofascial tiene tres componentes básicos [42], los cuales son:
- -
Una banda palpable en el músculo estriado afectado
- -
Un punto gatillo (PG) o trigger point
- -
Dolor referido
La banda palpable o tensa está conformada por un grupo de fibras que se extiende a lo largo del músculo y que forman una banda aumentada de consistencia. Representa un espasmo segmentario de una pequeña porción del músculo, que no puede ser vista al examen visual, pero se puede apreciar por la palpación [33].
El Punto gatillo se localiza sobre banda muscular tensa. Hay puntos gatillos activos y latentes. Los activos son los que provocan el dolor miofascial y causan dolor espontáneo. Los latentes causan disfunción al realizar ciertas maniobras musculares pero no son dolorosos a la palpación Pueden activarse bajo stress, sobreuso o estiramiento. Los pocos estudios disponibles sugieren que los PG silentes pueden presentarse en un 45-55% de los adultos jóvenes asintomáticos en la cintura escapular, siendo el trapecio superior el músculo que con más frecuencia presenta puntos gatillos y un 5-45% en los músculos lumboglúteos [36,42]. De las personas que consultan por dolor lumbar crónico en las unidades de dolor, un 80% presenta SDM [36].
El dolor referido es común encontrarlo como parte del estímulo de los trigger points, puede causar serios problemas para el diagnóstico y tratamiento, ya que podría llevar a una localización errónea del dolor [32], al ser percibido en un lugar remoto a la zona donde se inicia el dolor. El dolor puede ser referido desde otros músculos, articulaciones y vísceras. Hay patrones musculares definidos hace muchos años, según el músculo involucrado. Cada músculo tiene su propio patrón de irradiación y distribución metamérica o radicular al comprimir el punto gatillo. Hay veces que es difícil diferenciar el dolor referido del de la zona original, debido a las características difusa de los tejidos blandos profundos (músculos, tendones, articulaciones) [10]. Puede confundirse con un dolor radicular, aunque habitualmente no sigue la distribución de un nervio, ni exhibe déficits motores o sensitivos asociados [9].
Los músculos afectados pueden también provocar un aumento de la fatigabilidad, poca elasticidad, debilidad subjetiva, dolor en los movimientos, con disminución de movilidad de rangos de movimiento sin relación con la disminución de rango articular.
Simons [33] propone ocho puntos para diagnosticar el sindrome de dolor miofascial:
- 1.
Dolor espontáneo localizado.
- 2.
Alteraciones de la sensibilidad, como hipoestesia o alodinia en zonas remotas al punto gatillo miofascial.
- 3.
Bandas musculares tensas palpables.
- 4.
Dolor lancinante y localizado al palpar la banda tensa.
- 5.
Disminución en el rango de movimiento del segmento articular del músculo involucrado.
- 6.
Reproducción del dolor espontáneo percibido por el paciente al presionar el punto gatillo miofascial.
- 7.
Respuesta de contracción con la estimulación mecánica del punto gatillo.
- 8.
Disminución del dolor con el estiramiento muscular o con la punción con aguja del punto gatillo miofascial.
El diagnóstico del sindrome miofascial es eminentemente clínico. No hay consenso sobre criterios diagnósticos. Según estos criterios, hay un nódulo doloroso sobre una banda tensa y palpable con la reproducción de los síntomas de dolor espontáneo al presionar el punto gatillo miofascial, así se deben reconocer los músculos involucrados. El dolor suele ser constante, profundo y sordo. En ocasiones se puede presentar hiperalgesia y/o alodinia que semejan parestesias, lo que obliga a hacer diagnóstico diferencial con el dolor neuropático.
4.3ClínicaEl SDM puede presentarse de manera insidiosa o en forma aguda en respuesta a un trauma o lesión. Los pacientes refieren dolor localizado o regional persistente, de intensidad leve a severa. El dolor es exquisito y reconocible a la compresión, puede ser constante y en general se relaciona con los movimientos. El diagnóstico del SDM se realiza identificando los triggerpoint que se relacionan con el tipo de dolor que generó la consulta de dolor miofascial. Un signo característico que se observa en los pacientes es el signo del salto o jumpsign, el cual es un reflejo involuntario o estremecimiento del paciente, desproporcionado a la presión aplicada sobre un punto gatillo [42].
Otros síntomas asociados son fatiga y debilidad. Pueden aparecer alteraciones funcionales en la medida de que el cuadro se va cronificando como son alteraciones del ánimo y trastornos del sueño [6,9].
No existe un test de laboratorio, técnicas de imagen o invasivas para diagnosticar el SMF, por lo que un adecuado y minucioso examen físico al igual que una detallada y exhaustiva historia clínica son los elementos básicos y más valiosos para llegar al diagnóstico. Se debe realizar un meticuloso examen médico, neurológico y musculoesquelético.
4.4TratamientoEn el tratamiento es fundamental la comunicación y la educación. El paciente debe saber de qué se trata su enfermedad, que no es grave, entender las causas del dolor, qué síntomas están asociados y la línea de tratamiento con sus expectativas [36].
El tratamiento debe ser individual y multidisciplinario. Va a depender de la duración y de la intensidad del dolor. El primer objetivo es identificar la causa que genera puntos de gatillo miofasciales de acuerdo al sistema comprometido y corrección del desbalance muscular, postural y biomecánico. Individualizar el tratamiento es fundamental para ofrecer al paciente la mejor alternativa. En los pacientes crónicos, el estudio y tratamiento de factores precipitantes constituye una parte fundamental del manejo. A veces, los factores favorecedores son tan importantes que sólo con su eliminación se inactivan de forma espontánea los puntos gatillo [43].
La meta a corto plazo es restaurar la elongación normal del músculo, la postura y mejoría del rango articular con ejercicios y tratamiento de trigger points.
La meta a largo plazo incluye reducir los síntomas y sus efectos negativos y con esto lograr que el paciente retome sus funciones normales sin la necesidad de cuidados médicos constantes. Los tratamientos deben instaurarse de modo progresivo, desde los más inocuos hasta, en caso necesario, los más invasivos [42].
Hay pocos ensayos clínicos para mostrar efectividad de los tratamientos. Requiere un abordaje multidimensional. Eliminar los factores perpetuadores, educar al paciente y proporcionarle un programa de ejercicios es lo básico [42]. La fisioterapia, la farmacoterapia y diversos tratamientos conductuales se emplean de forma individualizada. En casos refractarios, la infiltración de los PG, efectuada desde aguja seca hasta medicamentos realizadas por un médico con experiencia, suele ser eficaz en diferentes estudios [39].
Manejo de triggerpoints: El punto gatillo se puede visualizar según ecógrafo y según adiestramiento del operador como una imagen por ultrasonido con transductores de 5-12MHz en banda muscular que muestra una imagen hipoecoica. Es útil además la sonoelastografía que evalúa zonas de tejido muscular con alteración de la vibración. Para manejar esta zona se prefiere terapia física manual con técnicas de estiramiento y electroterapia (TENS, iontoforesis). En caso de persistir molestias o EVA>4 se recomienda uso de terapias inyectables directamente en la zona de gatillo, únicas o seriadas, de acuerdo a la respuesta. La infiltración del punto gatillo es más efectiva si va seguida de liberación manual [37]. Pueden ser desde sólo aguja seca o con fármacos como anestésicos locales, corticoides o toxina botulínica. Tanto la ecografía como la elastografía son útiles para distinguir el punto gatillo que en caso de infiltración hacen más exitoso el procedimiento [38].
Los anestésicos locales como lidocaina al 1- 2% o anestésicos locales de larga duración como bupivacaina o chirocaina al 0.25 - 0.5%, se usan en volúmenes variables dependiendo del músculo a infiltrar (1 a 3cc). Se pueden inyectar solos o asociados a un corticoide de depósito. La toxina botulínica tiene efecto en la zona de contracción localizada, además de la acción nociceptiva local ayuda a disminuir el dolor del triggerpoint[34]. A pesar de que no se ha encontrado evidencia suficiente para recomendar su uso, algunos autores recomiendan la toxina cuando han fracasado otras medidas terapéuticas más sencillas [39], en este caso debiera ser efectuada por un especialista.
Si se compara la sustancia inyectada en el punto gatillo, en un estudio, el año 2001, con 23 ensayos no se encontró diferencias en los resultados al comparar aguja seca con inyección de medicamentos, salvo que el dolor post infiltración de la zona es peor que si se hace con lidocaina [39]. La acupuntura también se ha evaluado con evidencia limitada [41].
Medicamentos: No hay estudios que permitan recomendar los AINEs en el SDM. Se prefiere paracetamol o AINES Cox-2 por corto tiempo para disminuir efectos adversos. El parche tópico de lidocaína, usado en la zona del dolor por 12hrs tiene mejor evidencia. Se ha usado ciclobenzaprina pero no hay evidencia que apoye su uso.
El éxito en el tratamiento del dolor crónico ME, especialmente el dolor miofascial radica en la necesidad de hacer un buen diagnóstico y un balance del programa de manejo de dolor con la situación específica del paciente. Una falla en la dirección del problema por el equipo de trabajo puede llevar a la dificultad de resolver el dolor y llevar a una perpetuación del sindrome de dolor crónico.
5ConclusionesEl dolor ME es una patología frecuente, muchas veces subdiagnosticada y en general la primera consulta por este dolor se hace en atención primaria. En el dolor ME crónico, y especialmente en patologías como la Fibromialgia y el Dolor Miofascial están implicados factores psicosociales que hacen algo más complejo su manejo. El médico de atención primaria debería contar con herramientas de reconocimiento y manejo básico de estos sindromes de dolor. Con un abordaje inicial multimodal y de acuerdo a cada paciente en donde la comunicación y la educación son pilares fundamentales, se pueden aliviar un gran número de enfermos. Sólo será necesario recurrir al especialista en caso de requerir un abordaje más especializado y si se evalúan problemas psicosociales complejos con tendencia a la cronificación del dolor
Declaración conflictos de interés.
Declaro no tener conflictos de interés con el artículo.
Referencias no citadas