ECMO (Extracorporeal Membrane Oxygenation) es un sistema de soporte vital extracorpóreo en falla pulmonar catastrófica, insuficiencia cardiaca aguda y reanimación de uso cada vez más común. En Chile se ha implementado en distintos centros, con resultados comparables al registro internacional. Cuando el candidato a ser sometido está demasiado inestable como para ser transportado a un hospital que cuente con ECMO, la canulación antes del traslado permite la estabilización y posterior transporte al centro de ECMO. Los resultados en los pacientes transportados son similares a los casos generados en el mismo lugar. En el siguiente artículo revisaremos las definiciones en soporte extracorpóreo, indicaciones y contraindicaciones, los resultados esperables y las experiencias internacionales y propia de Clínica Las Condes en ECMO y ECMO Mobile.
ECMO (extracorporeal membrane oxygenation) is an increasingly common system of extracorporeal life support in catastrophic pulmonary failure, acute heart failure and resuscitation. Chile has implemented this technology in different hospitals, with results comparable to international registry. When the candidate to be submitted is too unstable to be transported to a hospital with ECMO, cannulation in site, allows the stabilization and transfer to a facility that runs a program for extracorporeal oxygenation with similar results if generated in the same place. The following article reviews the definitions in extracorporeal support, indications and contraindications, expected results and international experiences and own statistics in Clinica Las Condes in ECMO and ECMO Mobile.
El uso de tecnologías extracorpóreas en el soporte cardiopulmonar se ha extendido en los últimos 20 años. Existen distintas máquinas y esquemas, siendo el ECMO (Extracorporeal Membrane Oxygenation) u oxigenación por membrana extracorpórea, la forma más utilizada, debido a: Su impacto en la sobrevida, disponibilidad de la técnica, mejoría en los insumos, y equipos más pequeños y amigables que lo han ido haciendo menos complejo (1-9).
El objetivo del presente artículo es describir las indicaciones de soporte en ECMO y mostrar la experiencia con el uso de ECMO Mobile (instalado en el hospital de origen y posterior traslado al centro de ECMO).
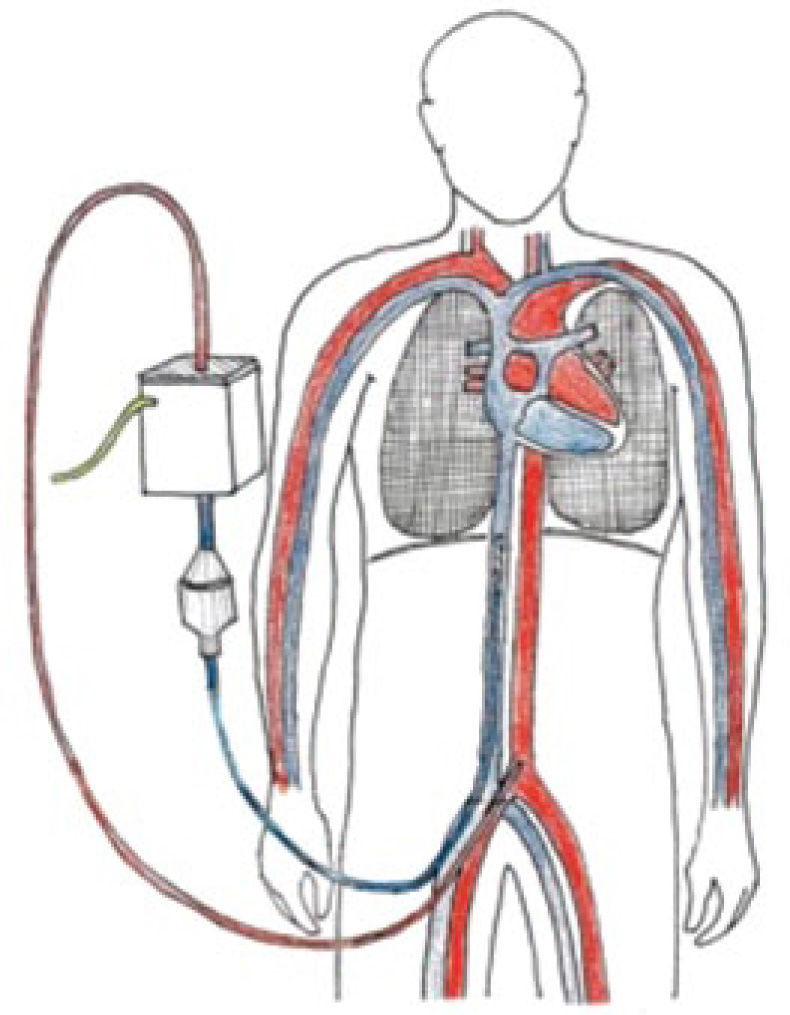
DefiniciónEl intercambio de gases transmembrana extracorpórea o ECMO utiliza una bomba y un oxigenador (intercambiador de gases) para proveer soporte hemodinámico y/o respiratorio prolongado. Dependiendo del tipo de paciente es el tipo de ECMO que se elige: veno venoso para la falla respiratoria y/o venoarterial cuando existe compromiso hemo-dinámico (9, 10).
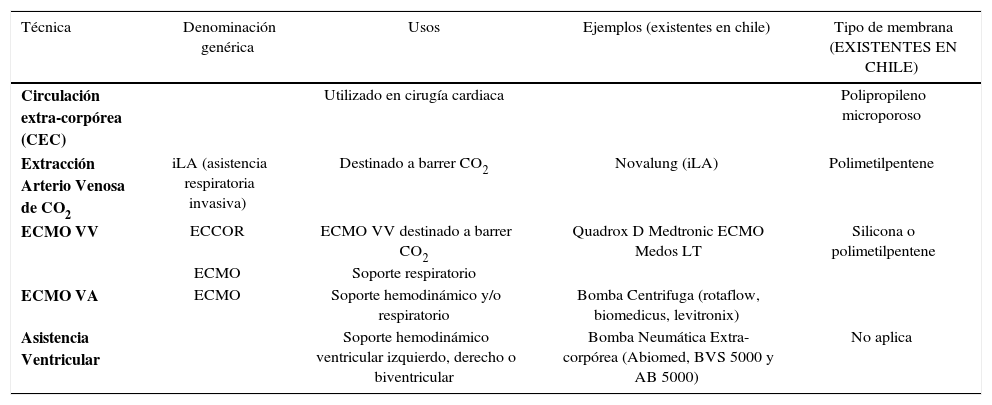
La tabla 1 muestra los tipos de soportes extracorpóreos cardiopulmonares (10-12) (Figura 1 y 2) (Tabla 1).
Soporte vital extracorpóreo
| Técnica | Denominación genérica | Usos | Ejemplos (existentes en chile) | Tipo de membrana (EXISTENTES EN CHILE) |
|---|---|---|---|---|
| Circulación extra-corpórea (CEC) | Utilizado en cirugía cardiaca | Polipropileno microporoso | ||
| Extracción Arterio Venosa de CO2 | iLA (asistencia respiratoria invasiva) | Destinado a barrer CO2 | Novalung (iLA) | Polimetilpentene |
| ECMO VV | ECCOR | ECMO VV destinado a barrer CO2 | Quadrox D Medtronic ECMO Medos LT | Silicona o polimetilpentene |
| ECMO | Soporte respiratorio | |||
| ECMO VA | ECMO | Soporte hemodinámico y/o respiratorio | Bomba Centrifuga (rotaflow, biomedicus, levitronix) | |
| Asistencia Ventricular | Soporte hemodinámico ventricular izquierdo, derecho o biventricular | Bomba Neumática Extra-corpórea (Abiomed, BVS 5000 y AB 5000) | No aplica |
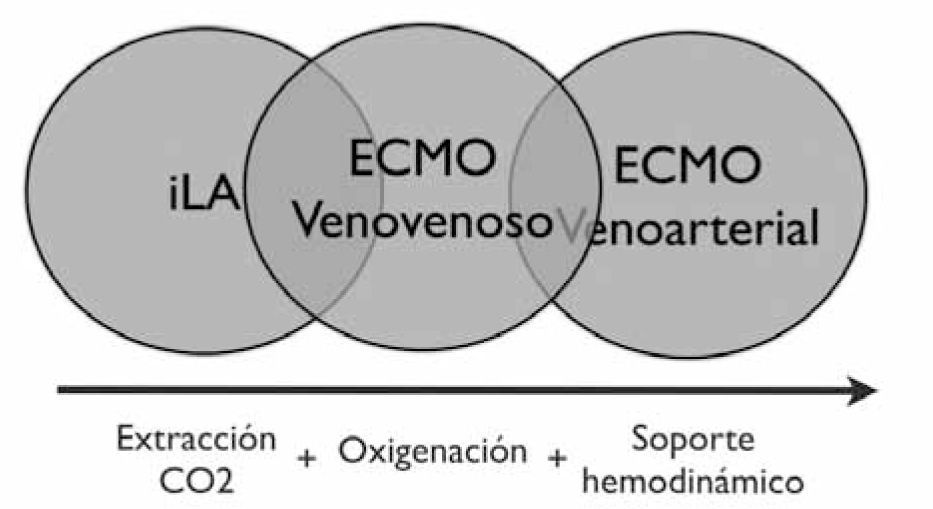
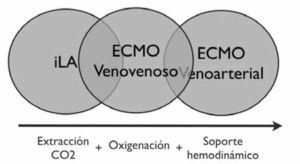
Dejando fuera los soportes ventriculares, la indicación del ECMO e iLA (Invasive Lung Assistance) (o Novalung) es el sostén hemodinámico y/o respiratorio. Si observamos (Figura 3) los círculos desde izquierda a derecha se van agregando las siguientes funciones:
- •
Extracción de CO2
- •
Oxigenación
- •
Soporte Hemodinámico
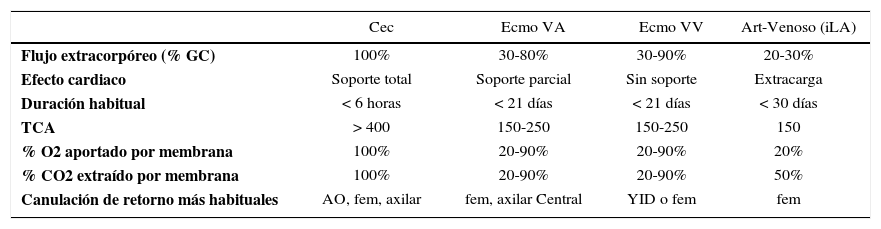
Así como aumenta el soporte aumentará también su complejidad (Tabla 2):
Principales diferencias en los soportes vitales extracorpóreos
| Cec | Ecmo VA | Ecmo VV | Art-Venoso (iLA) | |
|---|---|---|---|---|
| Flujo extracorpóreo (% GC) | 100% | 30-80% | 30-90% | 20-30% |
| Efecto cardiaco | Soporte total | Soporte parcial | Sin soporte | Extracarga |
| Duración habitual | < 6 horas | < 21 días | < 21 días | < 30 días |
| TCA | > 400 | 150-250 | 150-250 | 150 |
| % O2 aportado por membrana | 100% | 20-90% | 20-90% | 20% |
| % CO2 extraído por membrana | 100% | 20-90% | 20-90% | 50% |
| Canulación de retorno más habituales | AO, fem, axilar | fem, axilar Central | YID o fem | fem |
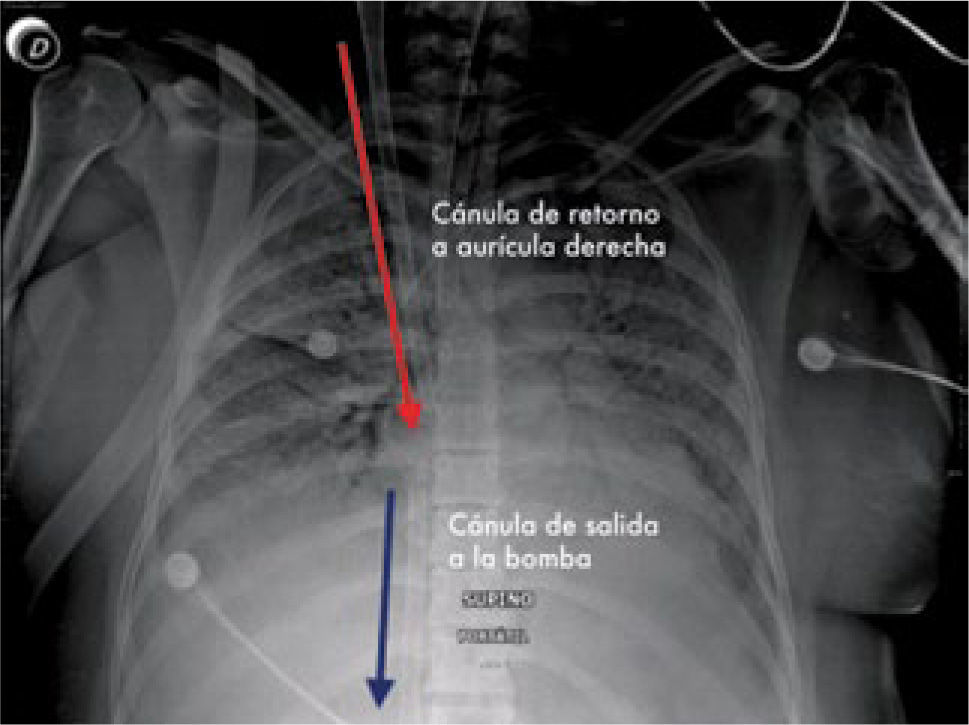
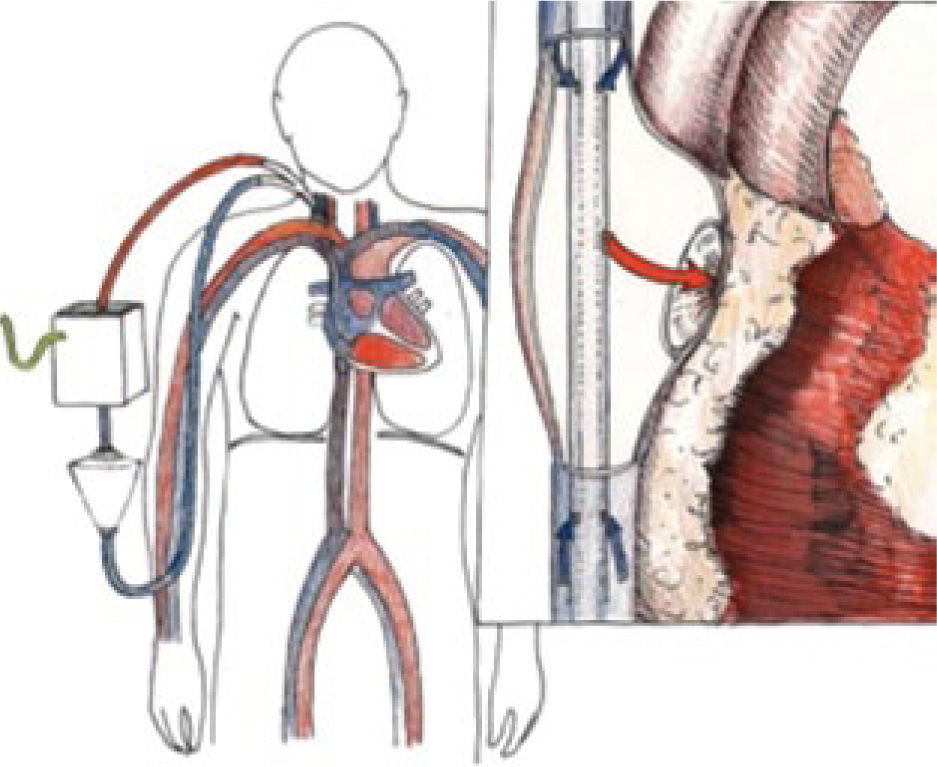
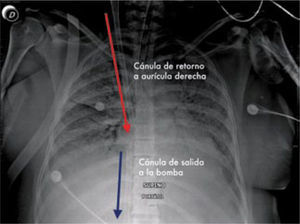
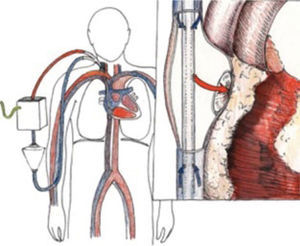
El ECMO entrega intercambio de gases en la membrana del “oxige-nador”, y el soporte hemodinámico lo hace en su configuración veno arterial drenando el lado derecho de la circulación y devolviendo en el lado sistémico (Figura 4) ya sea en una arteria femoral, arteria axilar o directamente en la aorta.
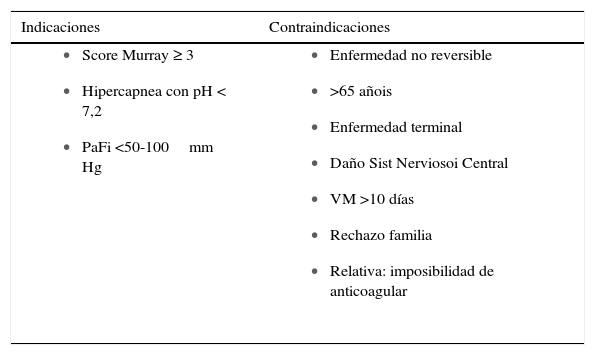
IndicacionesPacientes en falla pulmonar o cardiaca catastrófica que con soporte convencional tienen una sobrevida estimada <20% (15). Sus indicaciones pueden ser divididas en falla cardiaca y falla respiratoria o mixtas como es el Síndrome Cardiopulmonar por Hanta virus (16).
Es importante tener en cuenta la recuperabilidad del enfermo para no realizar maniobras fútiles (que desgraciadamente no es una frontera siempre clara) (15), aunque el instalar un ECMO puede ser visto también como un puente para la toma de decisiones y así observar la condición del paciente y sus probabilidades de sobrevivir en un periodo de 24 a 48 horas (17) y evitar con el soporte que exista un mayor daño de órganos mientras se reevalúa.
La posibilidad de sobrevida dependerá de la co-morbilidad pre existente, la reversibilidad de la patología aguda y la capacidad de reparación de los daños mientras dure el soporte cardiopulmonar. Es necesario balancear la relación riesgo v/s beneficio al indicar y tomar la decisión de poner al paciente en soporte, es imprudente indicarlo si no es del todo necesario, pero también aumenta la posibilidad daño de órganos irreversible por hipoxia tisular si se demora la toma de la decisión de iniciarlo (15).
Falla respiratoriaLas indicaciones de ECMO en falla respiratoria incluye: síndrome de distrés respiratorio, falla respiratoria neonatal (aspiración meconial, hipertensión pulmonar persistente, hernia diafragmática), síndrome de reperfusión post trasplante pulmonar, crisis bronquial obstructiva severa intratable y trauma. Hasta ahora el mayor numero de casos y las mejores tasas de sobrevida se han comunicado en recién nacidos con falla respiratoria.
Independiente de la causa, el ECMO otorga un soporte inmediato de oxigenación y eliminación del CO2 otorga un soporte inmediato de oxígeno en pacientes severamente hipoxémicos y/o acidóticos, con una disminución instantánea en las necesidades de presiones y FiO2 en el ventilador (18). Durante el tiempo de soporte el pulmón se ventila en “protocolo de reposo” que tiene distintas variantes pero que básicamente utiliza presiones pico menores a 30cm H2O, FiO2 < 50% y FR bajas (6 x minuto en adultos). El soporte extracorpóreo con novalung o ECMO facilita o permite una ventilación mucho menos agresiva, evitando el daño secundario al volumen y baro trauma.
Se puede o no paralizar al paciente, pero la mayoría de los centros lo mantienen lo más despierto posible para poder controlar el estado neurológico de este.
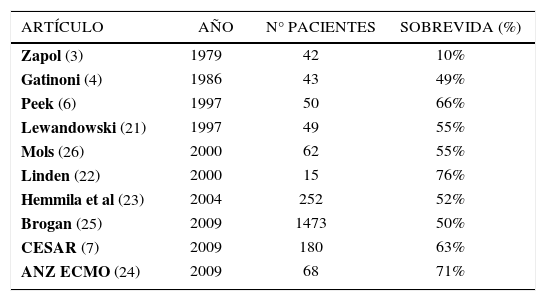
Con respecto a los resultados la mayoría de los trabajos son estudios de casos, no controlados y con poblaciones muy heterogéneas (19-25), existen 2 trabajos randomizados en adultos que en 1979 y 1994 estancaron el desarrollo del ECMO respiratorio adulto pues no observaron diferencias de mortalidad entre los grupos (3, 27) pero sin aplicar el concepto de ventilación de reposo, que en cierto sentido es lo que también ha disminuido la mortalidad en los pacientes con SDRA tratados con VM con volúmenes corrientes más bajos (28).
En neonatología su uso está bien establecido (29, 30), con buenos resultados, pero su uso ha disminuido desde hace 15 años por el impacto positivo que tuvo en esta población de pacientes el uso del iNO y la ventilación de alta frecuencia (31, 32).
El estudio CESAR (Conventional Ventilatory Support Versus Extracorporeal Membrane Oxygenation for Severe Adult Respiratory Failure) (7) es un trabajo inglés multicéntrico, prospectivo randomizado en adultos con enfermedad pulmonar severa reversible definida por un Score de Murray ≥ 3 o una acidosis respiratoria con pH ≤ 7. Los criterios de exclusión fueron: presiones de ventilación pico >30cm H2O o FiO2 >80% por más de 7 días, sangrado intracraneano, o alguna contraindicación a heparinización o a tratamiento médico agresivo. La variable independiente: muerte o incapacidad severa a 6 meses de la randomización o antes del alta. El trabajo se planificó inicialmente para 300 pacientes (9) aleatoriamente asignados a recibir tratamiento convencional (manejado en su hospital de referencia a discreción, con recomendación de volúmenes corrientes bajos) o transporte a un único centro ECMO (Leicester) para seguir un protocolo de manejo y ECMO en caso necesario. El estudio fue detenido por la “Data Safety Monitoring Board” después del análisis de 180 pacientes. De los 90 pacientes tratados en forma convencional 41 sobrevivieron, de los 90 en grupo ECMO 5 murieron antes o durante el transporte al centro ECMO (transporte convencional, no se hizo ECMO Mobile), 17 mejoraron sin apoyo extracorpóreo y 68 requirieron ECMO. El resultado final a 6 meses: 63% (57/90) en el grupo ECMO comparado a 47% (41/90) en el convencional (RR:0.69; 95% CI, 0.05- 0.97; p= 03).
La experiencia inicial en Australia/ Nueva Zelanda en Influenza AH1N1 fue de 61 pacientes en ECMO por hipoxemia refractaria, con una sobrevida del 71% (24).
En la siguiente tabla se resumen las principales variables que utilizamos para indicar el Soporte extracorpóreo en falla respiratoria del adulto. Necesariamente debe primero pasar por manejar y optimizar los parámetros de ventilación mecánica. En más de una ocasión pacientes derivados a nuestro centro para manejo con ECMO han sido manejados de manera convencional al optimizar la ventilación mecánica.
| Score murray (34). | ||||
|---|---|---|---|---|
| PARÁMETRO | 1 | 2 | 3 | 4 |
| PaO2/FIO2 | 299-225 | 224-175 | 174-100 | <100 |
| Rx Tx (cuadrantes) | 1 | 2 | 3 | 4 |
| PEEP | 6-8 | 9-11 | 12-15 | ≥15 |
| Compliance (ml/cmH2O) | 79-60 | 59-40 | 39-20 | <20 |
En falla cardiaca su uso reporta en el registro internacional una sobrevida de: 39% (en neonatos y adultos) y 48%,(en pediátricos) (32). Esto en pacientes que sin el soporte tienen una mortalidad cercana al 100%, pero no existen, ni se ve posible que existan trabajos controlados que comparen esta conducta con un enfrentamiento más conservador, aunque sabemos que el uso de 3 o más drogas vasoactivas en dosis alta post falla cardiaca aguda son un marcador de muy mal pronóstico, lo mismo presiones de llenado altas con índices cardiacos bajos, lo que justificaría un enfrentamiento precoz con soporte mecánico (35, 36), donde el ECMO entra como puente a toma de decisiones, permitiendo dejar en reposo el corazón y disminuir el daño de órganos. Las indicaciones cardiacas más comunes son falla de salida de circulación extracorpórea o síndrome post cardiotomía, le sigue la falla cardiaca aguda post IAM, miocarditis, y cardiomiopatías descompensadas, como puente a asistencias ventriculares o a trasplante y en resucitación cardiopulmonar (ECPR) (37-51).
Aunque no existe un análisis controlado del uso del ECMO en shock cardiogénico, la sobrevida pareciera ser mejor cuando se realiza precozmente (antes de 2 hrs. en shock post cardiotomía o < 12 hrs. en shock cardiogénico post IAM) en una falla reversible.
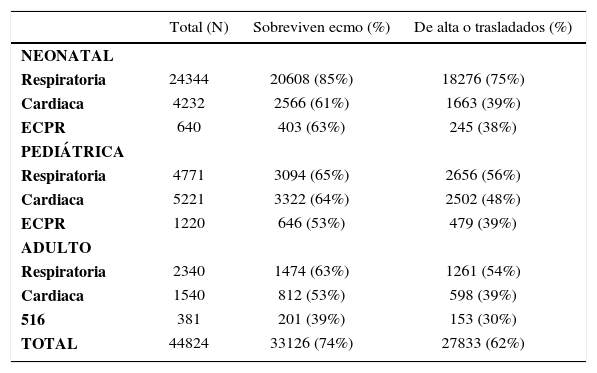
El Registro, de casos de la ELSO (Extracorporeal Life Support Organization) que data desde 1986 y que hasta diciembre de 2010 contaba con 132 centros en el mundo y 44824 en la base de datos. En Latino América hay 3 centros registrados: uno en Colombia, el exitoso programa neonatal del Hospital Clínico de la Universidad Católica y el Programa ECMO de Clínica Las Condes que hasta ahora ha concentrado principalmente su experiencia en adultos.
Registro internacional elso enero 2011 (32)
| Total (N) | Sobreviven ecmo (%) | De alta o trasladados (%) | |
|---|---|---|---|
| NEONATAL | |||
| Respiratoria | 24344 | 20608 (85%) | 18276 (75%) |
| Cardiaca | 4232 | 2566 (61%) | 1663 (39%) |
| ECPR | 640 | 403 (63%) | 245 (38%) |
| PEDIÁTRICA | |||
| Respiratoria | 4771 | 3094 (65%) | 2656 (56%) |
| Cardiaca | 5221 | 3322 (64%) | 2502 (48%) |
| ECPR | 1220 | 646 (53%) | 479 (39%) |
| ADULTO | |||
| Respiratoria | 2340 | 1474 (63%) | 1261 (54%) |
| Cardiaca | 1540 | 812 (53%) | 598 (39%) |
| 516 | 381 | 201 (39%) | 153 (30%) |
| TOTAL | 44824 | 33126 (74%) | 27833 (62%) |
ECPR: Extracorporeal cardiopulmonary resucitation. Son los casos asociados a maniobras de resucitación. Un paciente en paro al momento de la canulación, pero cuya indicación inicial es pulmonar o hemodinámica se considera respiratorio o cardiaco respectivamente.
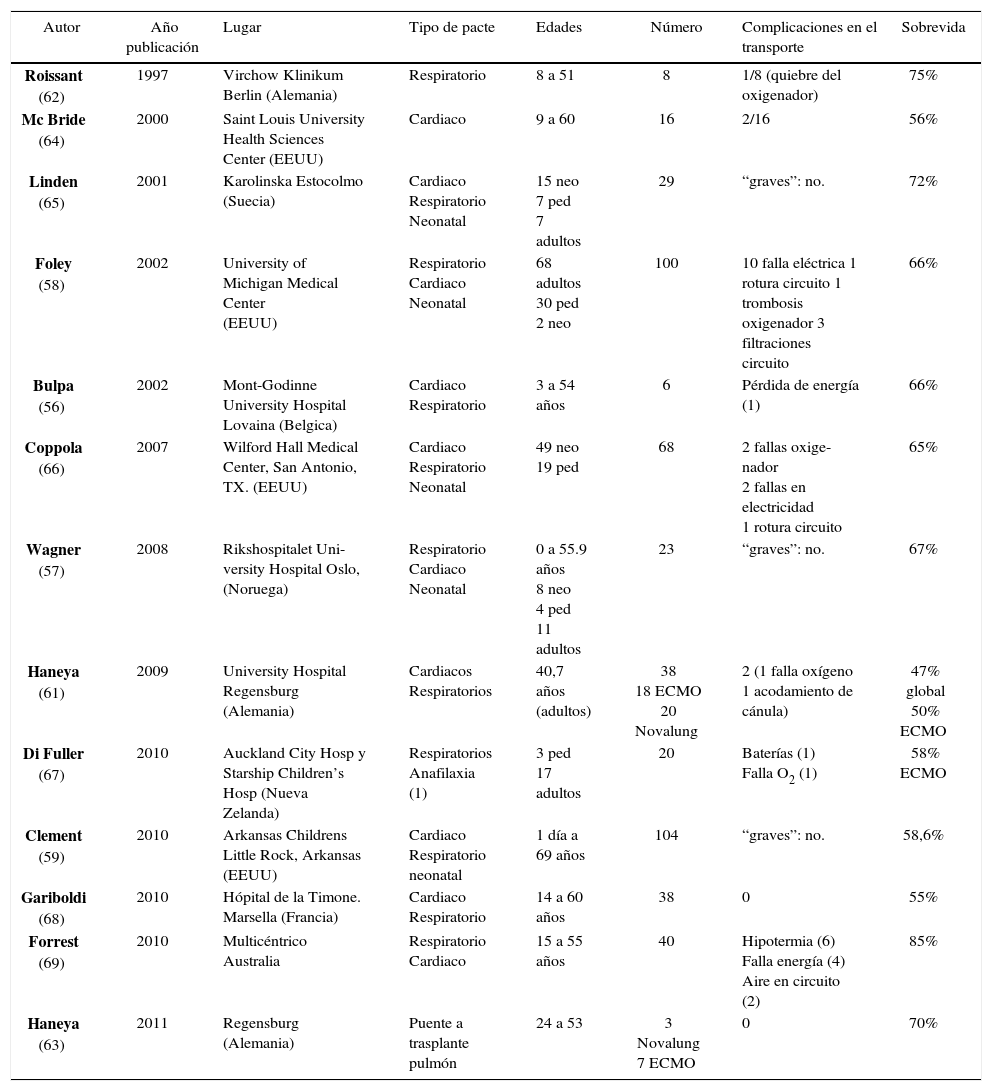
| Autor | Año publicación | Lugar | Tipo de pacte | Edades | Número | Complicaciones en el transporte | Sobrevida |
|---|---|---|---|---|---|---|---|
| Roissant (62) | 1997 | Virchow Klinikum Berlin (Alemania) | Respiratorio | 8 a 51 | 8 | 1/8 (quiebre del oxigenador) | 75% |
| Mc Bride (64) | 2000 | Saint Louis University Health Sciences Center (EEUU) | Cardiaco | 9 a 60 | 16 | 2/16 | 56% |
| Linden (65) | 2001 | Karolinska Estocolmo (Suecia) | Cardiaco Respiratorio Neonatal | 15 neo 7 ped 7 adultos | 29 | “graves”: no. | 72% |
| Foley (58) | 2002 | University of Michigan Medical Center (EEUU) | Respiratorio Cardiaco Neonatal | 68 adultos 30 ped 2 neo | 100 | 10 falla eléctrica 1 rotura circuito 1 trombosis oxigenador 3 filtraciones circuito | 66% |
| Bulpa (56) | 2002 | Mont-Godinne University Hospital Lovaina (Belgica) | Cardiaco Respiratorio | 3 a 54 años | 6 | Pérdida de energía (1) | 66% |
| Coppola (66) | 2007 | Wilford Hall Medical Center, San Antonio, TX. (EEUU) | Cardiaco Respiratorio Neonatal | 49 neo 19 ped | 68 | 2 fallas oxige-nador 2 fallas en electricidad 1 rotura circuito | 65% |
| Wagner (57) | 2008 | Rikshospitalet Uni-versity Hospital Oslo, (Noruega) | Respiratorio Cardiaco Neonatal | 0 a 55.9 años 8 neo 4 ped 11 adultos | 23 | “graves”: no. | 67% |
| Haneya (61) | 2009 | University Hospital Regensburg (Alemania) | Cardiacos Respiratorios | 40,7 años (adultos) | 38 18 ECMO 20 Novalung | 2 (1 falla oxígeno 1 acodamiento de cánula) | 47% global 50% ECMO |
| Di Fuller (67) | 2010 | Auckland City Hosp y Starship Children’s Hosp (Nueva Zelanda) | Respiratorios Anafilaxia (1) | 3 ped 17 adultos | 20 | Baterías (1) Falla O2 (1) | 58% ECMO |
| Clement (59) | 2010 | Arkansas Childrens Little Rock, Arkansas (EEUU) | Cardiaco Respiratorio neonatal | 1 día a 69 años | 104 | “graves”: no. | 58,6% |
| Gariboldi (68) | 2010 | Hópital de la Timone. Marsella (Francia) | Cardiaco Respiratorio | 14 a 60 años | 38 | 0 | 55% |
| Forrest (69) | 2010 | Multicéntrico Australia | Respiratorio Cardiaco | 15 a 55 años | 40 | Hipotermia (6) Falla energía (4) Aire en circuito (2) | 85% |
| Haneya (63) | 2011 | Regensburg (Alemania) | Puente a trasplante pulmón | 24 a 53 | 3 Novalung 7 ECMO | 0 | 70% |
Son frecuentes y ponen en riesgo la vida del enfermo, por lo que una vigilancia estrecha, protocolizada y con alto índice de sospecha debe estar siempre presente. El perfil de problemas para la población adulta y pediátrica son similares. Debido a la interacción de la sangre-superficie se pueden formar coágulos en el circuito y embolizar con consecuencias potencialmente devastadoras. La infusión sistémica de la heparina no fraccionada y el uso de circuitos especiales ayudan a reducir la formación de trombos, pero aumenta el riesgo de sangrado El delicado equilibrio entre la hemostasia y la trombosis requiere de frecuente supervisión clínica y de laboratorio, con reemplazo de factores de coagulación, fibrinógeno, plaquetas, y de antitrombina III.
Sangrado: es frecuente y puede ser importante en cantidad. Se asocia a la anticoagulación utilizada, disfunción plaquetaria y trombocitopenia. En adultos: sangrado de sitio quirúrgico (22,2%), del sitio de canulación (12,2%), hemorragia digestiva (4,1%) e intracraneano (2,6%) son los más frecuentes (52, 53).
Falla mecánicas: la más común es la falla del oxigenador (18%), problemas con las cánulas (10,8%) y trombos (9,5%).
Infecciones: un 21,2°% de los pacientes se sobreinfectan, las infecciones del sitio de canulación o del circuito son excepcionales.
HIT (tromcitopenia inducida por heparina): complicación cada vez más frecuente. De la serie de 45 pacientes uno hizo esta complicación.
Ecmo mobileBoedy et al, en 1990, fue el primero en describir la idea que existía una mortalidad “escondida” asociada con la referencia a un centro ECMO. Encontraron que 12 % de 158 recién nacidos referidos a sus centros para ECMO murieron antes, durante en pronto luego de ser transportados al hospital (54). La Universidad de Michigan reportó que ue 10% de sus traslados no neonatales entre 1988 y 1990 o murieron durante el transporte convencional o se les negó la posibilidad por inestabilidad cardiorrespiratoria(55).
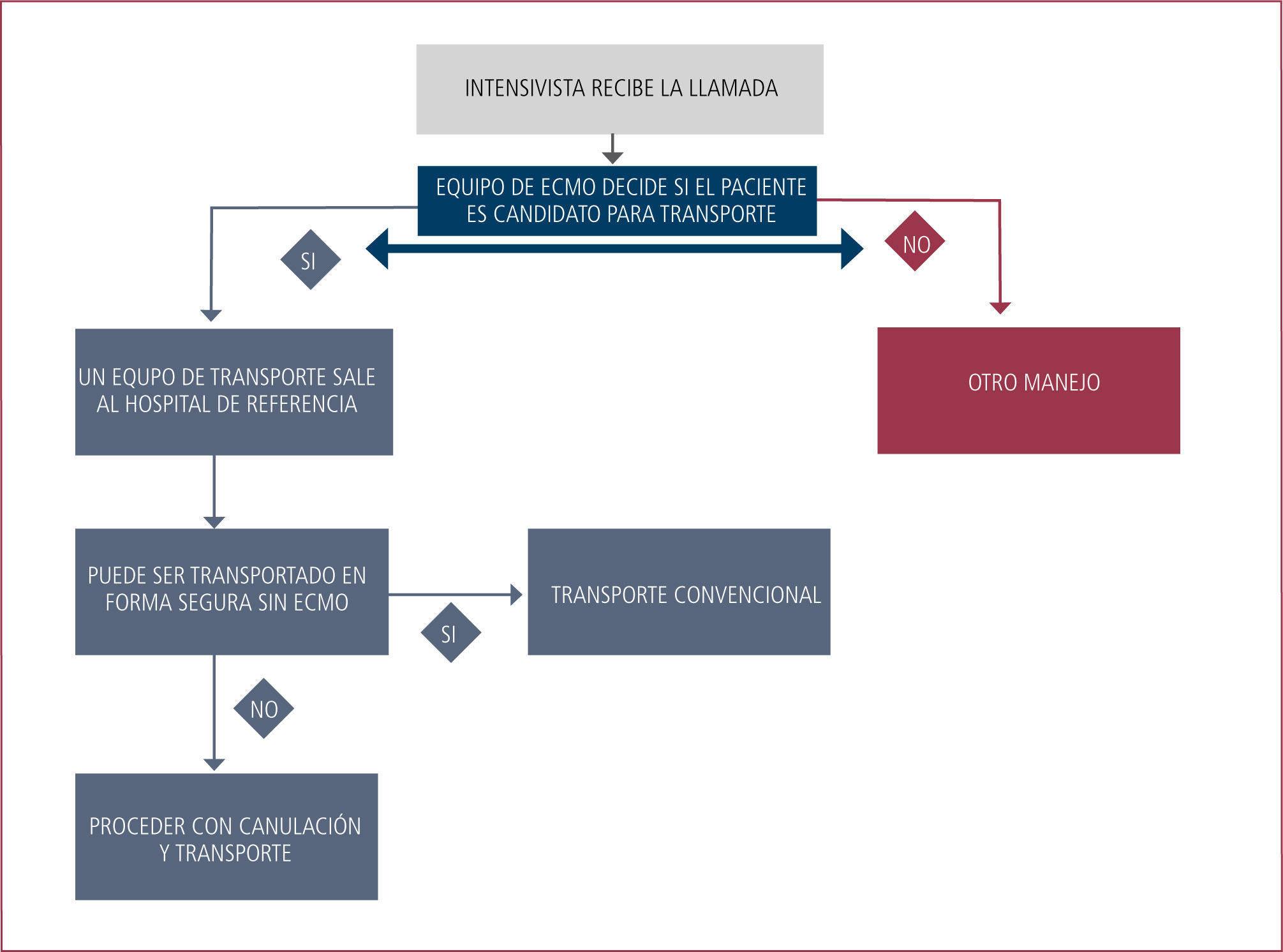
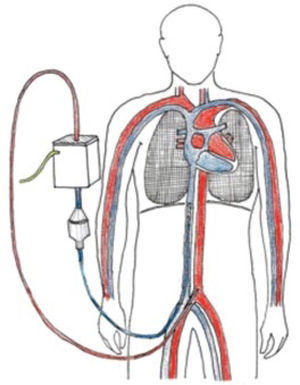
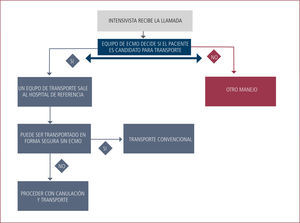
En los pacientes que tienen indicación de soporte extracorpóreo, pero que se encuentran extremadamente inestables en su centro de referencia o cuyo transporte es inviable por la gravedad del paciente, el “ECMO Mobile” o soporte de ECMO durante el transporte es una forma de enfrentar el problema que en distintas series y experiencias soluciona graves problemas de inestabilidad del enfermo.
La Tabla 4 resume las experiencia publicadas, donde destaca que de hube en ninguna una muerte atribuible al traslado, y en todas ellas los resultados son similares a los obtenidos a los casos generados dentro del centro ECMO (56 - 69).
Desde el año 2003 hasta febrero 2011, en las unidades de pacientes críticos de CLC se han realizado 44 casos ECMO. 41 adultos y 4 pediátricos. Con una sobrevida global del 64%. En el caso de indicación cardiaca: 35,7% y respiratorios: 68%. ECPR (n=2): 0%. De estos pacientes tuvieron paro pre ECMO 15/44 (39%).
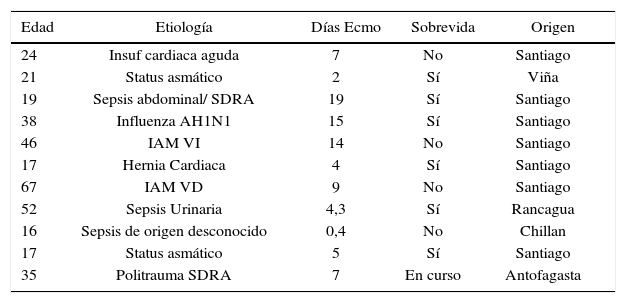
El nacimiento del programa ECMO mobile en Clínica Las Condes es producto de la generación de enfermos no trasladables por su gravedad y que requieren soporte extracorpóreo en un centro que tenga el soporte de equipo y educación del personal necesarios para que la técnica tenga el mayor impacto posible en el resultado de estos pacientes Hasta la fecha se han realizado 11 trasportes en ECMO, 9 en ambulancia y 2 en avión.
Las características demográficas son las siguientes:
Edad: 31,9+/-17,2 (16-67)
PCR preECMO: 6/11
Ingreso a ECMO:
Pacientes en ecmo mobile. clínica las condes (2006-2011)
| Edad | Etiología | Días Ecmo | Sobrevida | Origen |
|---|---|---|---|---|
| 24 | Insuf cardiaca aguda | 7 | No | Santiago |
| 21 | Status asmático | 2 | Sí | Viña |
| 19 | Sepsis abdominal/ SDRA | 19 | Sí | Santiago |
| 38 | Influenza AH1N1 | 15 | Sí | Santiago |
| 46 | IAM VI | 14 | No | Santiago |
| 17 | Hernia Cardiaca | 4 | Sí | Santiago |
| 67 | IAM VD | 9 | No | Santiago |
| 52 | Sepsis Urinaria | 4,3 | Sí | Rancagua |
| 16 | Sepsis de origen desconocido | 0,4 | No | Chillan |
| 17 | Status asmático | 5 | Sí | Santiago |
| 35 | Politrauma SDRA | 7 | En curso | Antofagasta |
Sobrevida global: 64%
Días ECMO: 7,7 +/- 5,9
Días en centro ECMO: 29,7 +/- 26,2 (6 - 101)
Tipos de ECMO: VV: 5/11 VA 6/11
No hubo complicaciones que pusieran en riesgo la vida del enfermo, pero los problemas logísticos (traslados de insumos y personal por ejemplo) en un comienzo fueron frecuentes. Estos han disminuido con la acumulación de experiencia, el desarrollo de un programa, pausas de seguridad y listas de chequeos. La mayoría de los potencies problemas están en relación a la autonomía de gases y poder eléctrico, por lo que es vital chequear estos soportes en todas las etapas del trasudo (Figura 7).
Podemos finalmente resumir de la siguiente manera:
- •
El Soporte extracorpóreo es una herramienta útil en aumentar la sobrevida de pacientes con altas posibilidades de muerte, especialmente si falla es respiratoria.
- •
Los resultados obtenidos hasta ahora están de acuerdo a la experiencia internacional
- •
El ECMO Mobile permite entregar esta técnica en centros que no la poseen, con resultados similares a un ECMO convencinal.
El autor declara no tener conflictos de interés, en relación a este artículo.