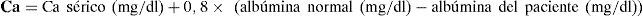Abordamos algunas de las emergencias oncológicas (complicaciones agudas en el curso evolutivo del cáncer), con acento principal en el diagnóstico. Se tratan las más características, entre estas, las emergencias cardiovasculares (síndrome de Vena Cava superior, taponamiento cardiaco), las emergencias metabólicas (hipercalcemia, lisis tumoral) emergencias neurológicas (compresión medular, hipertensión endocraneana).
We approach some of the oncologic emergencies (acute complications in the evolution of Cancer), with emphasis in diagnosis. This article deals with the most typical ones, including cardiovascular emergencies (Superior Vena Cava Syndrome, Cardiac Tamponade); metabolic emergencies (Hypercalcemia, Tumor Lysis Syndrome) and neurologic emergencies (Spinal Cord Compression, Intracranial Hypertension).
Emergencia Oncológica se refiere a un grupo de complicaciones que surgen en el curso de la evolución de pacientes con cáncer.
Estas complicaciones llevan a los pacientes a una situación de mayor riesgo tanto de morbilidad, como de secuelas o de muerte.
Enfrentarse a estas situaciones clínicas requiere un alto nivel de sospecha, una evaluación diligente y un tratamiento con criterio de emergencia.
Con el aumento del cáncer en la población general y con la mayor sobrevida que tienen los pacientes gracias a los nuevos tratamientos, presenciamos la llegada frecuente y regular de estos pacientes a los servicios de atención primaria o a los servicios de urgencia (1, 2).
Es justamente en los niveles de atención primaria y en salas de emergencia de nuestros servicios médicos donde el rol del reconocimiento precoz de estas patologías tiene especial importancia. Los principales objetivos del reconocimiento precoz son lograr la disminución de las morbilidades, secuelas y muerte, sin desconocer la reducción de costos asociados a la prevención de estos efectos.
Para conseguir esto, como es lo habitual en la oncología, es necesario un manejo multidisciplinario.
Según la etiología, las Emergencias Oncológicas pueden ser divididas en tres grupos:
- a)
Provocadas por la enfermedad tumoral.
- b)
Provocadas por los tratamientos antitumorales.
- c)
Presencia de emergencias no oncológicas en pacientes que tienen cáncer. Estas últimas requieren un esfuerzo de diagnóstico diferencial con las emergencias oncológicas propiamente tales y su atención es igualmente con sentido de urgencia.
Sin embargo, la clasificación más práctica es aquella que se refiere a los órganos o sistemas involucrados. Podemos así, distinguir emergencias cardiovasculares, neurológicas, metabólicas y hematológicas.
Existen otras numerosas situaciones de emergencia, detalladas en revisiones extensas. Por su extensión y por estar presentes también en otras patologías (1), no las abordaremos en este artículo, aunque vale la pena enumerarlas:
- 1.
Crisis de dolor catastrófico
- 2.
Extravasación de drogas antineoplásicas
- 3.
Reacciones alérgicas a drogas antineoplásicas
- 4.
Fenómenos trombóticos (trombosis venosa profunda y tromboembolismo pulmonar)
- 5.
Fenómenos hemorrágicos
- 6.
Fractura patológica
- 7.
Obstrucción de vías respiratorias
- 8.
Paro cardiorrespiratorio en pacientes con cáncer
Algunas de las complicaciones hematológicas ameritan per se una revisión más extensa, ejemplo de esto son los cuadros de neutropenia febril, las trombocitopenias y los fenómenos de hiperviscocidad o leucocitosis extremas.
En común, estas son situaciones de emergencia en pacientes con cáncer, pero a menudo tienen también causas no malignas (ej TVP, fractura patológica), o bien ya están confinadas a un ambiente especializado (neutropenia febril, extravasación de drogas antineoplásicas).
En la práctica, cuando enfrentamos a un paciente que está en una Emergencia Oncológica, en el entorno de un “Servicio de Urgencias” debemos tratar de obtener una comprensión rápida y cabal de la situación clínica (3, 4). En ese sentido es importante inquirir sobre esta información relevante:
- a)
Quien toma las decisiones en el caso: paciente, familiar
- b)
Tipo de cáncer que sufre nuestro paciente (probado por biopsia o presunto).
- c)
El tiempo que lleva desde el diagnóstico y tiempo de descompensación.
- d)
Los tratamientos antineoplásicos o de soporte previos y también las posibles alternativas y tratamientos futuros
- e)
Información sobre el pronóstico oncológico y pronóstico médico global
- f)
Los exámenes recientes
- g)
Medicación que el paciente está recibiendo
Estos datos contribuirán al enfoque terapéutico que plantearemos para cada uno de nuestros pacientes (3).
En nuestra acción debemos considerar la manera de enfrentamiento (coping) de su patología en cada paciente. Muchos pacientes con cáncer avanzado han sido capaces de aceptar su condición de incurabilidad y desean un enfoque paliativo, en tanto otros desean seguir con tratamiento antitumoral activo (5, 6).
En la interacción con el paciente, sus familiares y cuidadores, en los servicios de emergencia debemos considerar los siguientes puntos. Tabla 1 (3).
Relación médico-paciente y familia
| 1. Asegurar al paciente y familia que el dolor y otros síntomas serán atendidos. |
| 2. Evaluar la capacidad de afrontamiento a su patología. |
| 3. Explorar los objetivos terapéuticos y la existencia de Directivas Anticipadas. |
| 4. Apoyar la relación Paciente-Oncólogo cuando sea posible. |
| 5. Tratar de aclarar y solucionar conflictos encontrando bases comunes. |
| 6. Prepararse para dar malas noticias. |
El pericardio normalmente acoge una pequeña cantidad de fluido bajo en proteínas, unos 20 ml. La presencia de derrame pericárdico de pequeña cuantía es frecuente en cánceres avanzados y habitualmente es asintomática. el equilibrio entre secreción y reabsorción de este líquido, mantiene una condición fisiológicamente constante.
La presencia de un derrame pericárdico, clínicamente importante, se correlaciona con un mal pronóstico (7–11).
PatogeniaEl derrame puede producirse tanto por metástasis, como por invasión directa de un tumor (11).
La acción directa de implantes tumorales, el efecto de los mecanismos inflamatorios y la acción de factores como VEGF (factor de crecimiento del endotelio vascular), tienen un rol en el problema.
La aparición de síntomas ocurre por la acumulación progresiva de líquido en el pericardio, que actúa como un saco relativamente inelástico, llevando al aumento de la presión intrapericárdica y que compromete especialmente el retorno venoso; de acuerdo a la ley de Starling, esta disminución del llenado diastólico (caída de la precarga), llevará a disminución del volumen expulsivo y del gasto cardiaco. Esto ocurre con volúmenes sobre 140 ml. de líquido pericárdico, cuando se ha acumulado en forma rápida. La instalación gradual, permite la acumulación de volúmenes mayores (sobre un litro).
Del párrafo anterior concluimos que los síntomas también dependen de la velocidad con que se acumula el líquido, siendo más imprevisible en el caso del cáncer, por la presencia de hemorragias intrapericárdicas, que pueden aumentar el ritmo de acumulación.
Llamamos taponamiento a “la compresión de las cavidades cardiacas, hemodinámicamente significativa, por la acumulación de líquido pericárdico, que sobrepasa los niveles de compensación fisiológicos”. Esta situación produce la activación de los mecanismos del sistema simpático y también la activación del eje renina-angiotensina.
Debemos considerar que algunos de los pacientes con cáncer, pueden desarrollar derrames de origen no neoplásico.
Presentación clínicaSobre dos tercios de los pacientes son asintomáticos.
Los síntomas pueden instalarse en forma muy lenta, o bien en forma brusca y aguda, habitualmente cuando se llega al límite de la capacidad funcional o cuando ha habido un sangramiento.
La disnea es el síntoma más frecuente y está presente en un 93%; es inicialmente frente a ejercicio, pero con la progresión llega a presentarse en reposo.
El dolor o la sensación de opresión están presentes en un 63%.
La tos es frecuente (30%-43%). Muchos pacientes acusan gran debilidad. Pueden existir fiebre de bajo grado, a veces disfagia, singulto y muy ocasionalmente disfonía.
La coexistencia de derrame pleural es habitual, esto provoca síntomas muy similares y a menudo actúa como un fenómeno confundente.
Al examen físico es posible encontrar taquicardia, ruidos cardíacos disminuidos, yugulares distendidas, edema de extremidades, puede existir hepatomegalia, y detectarse pulso paradójico.
En caso de taponamiento, observaremos los signos de la repercusión hemodinámica (pulso y presión bajas, cianosis periférica, vasoconstricción, edema, etc.).
En algunos casos está presente la Tríada de Beck (Hipotensión, tonos cardiacos disminuidos, yugulares ingurgitadas), aunque su ausencia no descarta el taponamiento.
La presencia de pulso paradójico (caída de más de 10 mmHg de la presión sistólica con la inspiración) es altamente sugerente de taponamiento, pero está presente también en el TEP o en la falla cardiaca derecha.
El signo de Kussmaul (incremento visible de la presión venosa en la inspiración) estará presente a menos que se trate de un enfermo depletado de volumen (11, 12, 14).
En el electrocardiograma son distintivas las bajas de voltaje, son frecuentes las alteraciones inespecíficas del segmento ST y se considera la alternancia eléctrica (alternancia de complejos QRS grandes y pequeños) como patognomónica. No son raras las arritmias.
La radiografía es sugerente, siendo posible ver la típica imagen en “Botellón de agua”, detectándose además un derrame pleural en más del 70%. La Resonancia Magnética y la Tomografía Computada son capaces de mostrarnos la presencia de líquido en pericardio, la posible infiltración de este y también darnos algunas pistas sobre la etiología (13).
El examen de elección es el ecocardiograma. Se trata de un examen sensible y específico que nos mostrará la presencia de líquido, desde 15 ml o más (8–10, 14).
Puede detectar signos de taponamiento antes de que sea sospechado clínicamente. Los primeros signos son el colapso de las cavidades derechas, en primer lugar la aurícula y luego el ventrículo. Puede verse la disminución de las cavidades izquierdas y la falta de colapso de la vena cava inferior en la inspiración.
La ecocardiografía permite además efectuar una maniobra terapéutica (punción pericárdica).
El análisis del líquido pericárdico es raramente necesario en pacientes con un cáncer avanzado; la citología es positiva en un 65 a 90% de los casos.
TratamientoLas efusiones pequeñas asintomáticas no necesitan un tratamiento específico (8–10).
Cuando hay síntomas, sobre todo cuando hay deterioro rápido, el tratamiento debe ser urgente. La elección es una Pericardiocentesis bajo ecografía,(14, 15) la extracción de una escasa cantidad de líquido puede significar una inmediata e importante mejoría sintomática. Este procedimiento tiene una tasa de éxito de más del 97% y tiene escasa morbilidad (2,4%), casi sin mortalidad asociada (8).
Este es un procedimiento transitorio, que puede ser complementado con instalación de un drenaje, para continuar la extracción en forma intermitente.
Pasada la situación de mayor emergencia, se han descrito varias alternativas. El uso de agentes esclerosantes (doxiciclina, bleomicina) es de utilidad, pero se ha descrito en aquellos que sobreviven varios meses, la aparición de pericarditis constrictiva. Esta técnica puede ser adecuada en pacientes que se encuentran en muy malas condiciones y tienen un pronóstico de vida breve.
El abordaje quirúrgico sigue siendo el más utilizado, siendo la Pericardiectomía subxifoidea (ventana pericárdica), el enfrentamiento más popular. Esta técnica es rápida, tiene baja morbilidad y mortalidad, permite extraer una buena muestra para análisis. Debemos considerar esta técnica para aquellos pacientes que tienen un pronóstico estimativo superior a 3 meses.
Existen otros abordajes para pericardiectomía, incluyendo por vía toracoscópica.
El tratamiento de la enfermedad de base es un punto importante a definir. La histología del tumor y las características del paciente nos permitirán escoger el tipo de tratamiento antineoplásico a seguir (8).
A.2 Síndrome de vena cava superiorOcurre cuando las delgadas paredes de la vena cava son comprimidas por estructuras rígidas que la rodean. Esto provoca una disminución del retorno venoso al corazón, con congestión de los órganos inadecuadamente drenados.
En la actualidad la causa más frecuente es el cáncer. No obstante, cuando se describió este cuadro, la primera causa eran los aneurismas sifilíticos (otras causas benignas son grandes bocios, infección sifilítica o tuberculosis, la mediastinitis fibrosante o la presencia trombosis relacionada con catéteres centrales o cables de marcapasos) (16–18).
Dentro de los cánceres el más frecuente es el cáncer pulmonar que es causante de un 52 a un 81% de los síndromes de cava superior, siendo especialmente frecuente los cánceres de células pequeñas (SCLC). Vemos con más frecuencia este síndrome en los tumores del lado derecho.
Los linfomas pueden provocar este problema entre un 2 a un 9% de los casos, siendo los más involucrados los Linfomas No Hodgkin (LNH), especialmente el Linfoma B de Células Grandes.
Otros cánceres dan cuenta de un 3 a 16% del total de síndromes de vena cava superior. En cuanto a las patologías no neoplásicas, pueden llegar hasta un 13%.
La compresión de la vena cava a menudo se asocia a fenómenos trombóticos in situ, siendo estos fenómenos los responsables de la aparición o de la exacerbación de los síntomas. La presencia de síndrome de vena cava superior por catéteres puede presentarse de manera atípica con síntomas predominantemente unilaterales.
PatogeniaLa vena cava tiene una pared delgada, la presencia de un cáncer rodeándola, la comprimirá disminuyendo el retorno venoso. Esto lleva a congestión circulatoria en cabeza, cuello y extremidades superiores.
Existen numerosos vasos sanguíneos que pueden recibir el flujo en forma vicariante, constituyen los vasos colaterales, entre estos la vena ázygos, las intercostales, las paravertebrales, la mamaria interna y toracoepigástrica y las venas de la pared anterior del tórax.
Cuando el fenómeno ocurre por cáncer, en el curso de pocas semanas, no hay tiempo para desarrollo de colaterales. En otros casos, por ejemplo por causa benigna o en cánceres de lento crecimiento, la evolución es más prolongada y se desarrollan colaterales.
Según la ubicación anatómica se puede distinguir la compresión de la cava sobre el nivel de la desembocadura de la vena ázygos en la vena cava. En este caso la disminución del flujo hacia el corazón, provoca congestión venosa con distensión de las venas del cuello y de los brazos, edema, y dilatación de los vasos del tórax superior.
La compresión bajo el nivel de la ázygos da síntomas más severos, con mayor dilatación venosa y aparición de colaterales en el abdomen superior, que muestran flujo inverso desde el territorio ázygos hacia la cava inferior para alcanzar las cavidades derechas por esta vía (16–18).
Presentación clínicaEl 60% de los pacientes que se presentan con síntoma de cava superior no tiene diagnóstico conocido de cáncer, es por tanto una forma de debut de esta enfermedad.
El comienzo de los síntomas tiende a ser insidioso. El síntoma que a menudo es el motivo de consulta es la disnea (66%). A esto se agrega edema facial (82%) y de extremidades (68%). Es habitual la ortopnea.
Con frecuencia hay presencia de tos, disfagia y disfonía (la disfonía puede ser tanto por edema de cuerdas vocales como por la compresión de los nervios recurrentes a nivel mediastínico, lo que dificulta la función laríngea).
Puede haber síntomas de compromiso congestivo cerebral, como cefalea, mareos, confusión y síncope. La confusión y el letargo deben hacer pensar en edema cerebral.
Normalmente habrá otros síntomas relacionados con el cáncer de origen.
Como antecedente es importante la presencia de historia personal de cáncer o de procedimientos vasculares.
Al examen físico son visibles la presencia de edema facial, cervical y la presencia de venas distendidas en tórax o en abdomen alto.
Existe plétora con edema en esclavina (en cara, cuello y extremidades superiores, simulando una pequeña capa), la cianosis es un hallazgo frecuente. En un 25% de los casos coexiste derrame pleural, sobretodo al lado derecho. El edema y la cianosis empeoran en decúbito.
Debe buscarse la presencia de nódulos palpables, puesto que pueden ser objeto de biopsia para el diagnóstico.
La Tomografía Computada con contraste venoso es el medio de diagnóstico de elección (16), permite ver el lugar y la extensión del bloqueo, la causa de éste, la presencia de trombosis asociada y la presencia de colaterales. Ocasionalmente la Resonancia Magnética puede ser de ayuda en pacientes que tengan alergia al medio de contraste o no puedan realizarse Tomografía Computada. La venografía se reserva para los casos en que se realizará algún procedimiento endovascular.
TratamientoEn el pasado el síndrome de vena Cava se consideraba una situación de emergencia, frente a cuyo diagnóstico se procedía a tratar de inmediato y en forma agresiva. Varios estudios han mostrado que podemos esperar un tiempo prudente para afinar el diagnóstico (16, 18).
Las excepciones son la presencia de síntomas neurológicos (signos de edema cerebral) o cuando hay presencia de estridor (que indica problemas laríngeos y que puede requerir la intubación y traslado a Unidad de Cuidados Intensivos). Fuera de estos casos, un breve retardo en el tratamiento no tiene repercusión en la mayoría de los pacientes, por el contrario, permite planificar una terapia específica.
Es posible llegar pronto a un diagnóstico ya sea por Fibrobroncoscopía (con éxito de 50-70%, dependiendo de la ubicación de las masas) o por Mediastinoscopía (éxito de 90-100%). La biopsia guiada por EBUS (endobronchial ultrasonography), parece ser un medio de mayor eficacia (16, 17).
La presencia de síndrome de vena cava superior entraña un pronóstico más sombrío, sin tratamiento la mediana de sobrevida es menos de 30 días. En globo menos del 10% de los pacientes está vivo a dos años después del diagnóstico de síndrome de vena cava superior.
El tratamiento dependerá de la etiología, y deberá tener un enfoque flexible, pues al comienzo, durante la evaluación inicial, puede no estar claro cuál será el sentido de la terapia. Después de aclarados los aspectos de diagnóstico y etapificación, podemos tener casos que trataremos con intención curativa, o bien con intención paliativa ya sea con tratamiento antitumoral o sólo sintomático.
Los tratamientos comprenden los cuidados de soporte, la radioterapia. La quimioterapia o la instalación de stents (16–21).
Las primeras medidas deben siempre pasar por descartar la verdadera emergencia (edema cerebral, edema laríngeo). Las medidas de soporte no han sido evaluadas en forma prospectiva, pero tiene una clara racionalidad; la posición sentada, el uso de oxígeno, uso de diuréticos, son considerados útiles.
No hay claridad sobre la utilidad, el uso y las dosis de esteroides (16, 19). Existe cierta preocupación en que el uso de estos medicamentos pueda producir dificultad en el análisis histológico en casos de linfoma. Una aproximación es el uso de dexametasona en dosis fraccionadas de 8 a 16 mgrs/día.
Con respecto a anticoagulación, la debemos considerar en casos de presencia de trombos, no está clara su utilidad en ausencia de trombosis o fenómenos embólicos. Tampoco está clara cuál es la mejor forma administrar esta terapia.
El tratamiento de más rápido efecto es la instalación de un Stent en vena cava, su resultado puede ser inmediato, aunque usualmente es más visible en las primeras 24 a 72 horas. Es instalado en sala de angiografía, bajo anestesia local. No obstaculiza la posterior toma de biopsias.(16, 19–21)
Está indicado cuando queremos un rápido alivio de síntomas, sin entorpecer la posterior biopsia, tiene un rol en pacientes previamente irradiados o con tumores resistentes a quimioterapia. En la revisión de Rowell, se muestra un alivio total o parcial de 95%, con una recaída de 11%. Tiene baja tasa de complicaciones, entre estas embolias y sobrecarga ventricular por la reanudación brusca del flujo venoso (19).
Aunque no ha sido comparado directamente con quimioterapia, radioterapia o quimioradioterapia, parece ser más efectivo.
El uso de stent puede ser seguido por radioterapia o quimioterapia. se desconoce la mantención de sus efectos positivos en el largo plazo. Es posible que estos dispositivos se asocien a un mayor riesgo de trombosis.
El estándar de tratamiento ha sido el uso de radioterapia, con una efectividad cerca del 78% y un inicio de acción en 7 a 15 días. No es buena elección en casos de radioterapia previa sobre la zona, en algunas enfermedades del tejido conectivo (esclerodermia) o en tumores no radiosensibles. (16–18)
Las modalidades de radiación dependerán del tumor. En casos de tratamientos paliativos es apropiado planificar tratamientos de 1 a 2 semanas (30 Gy en 10 fracciones o 20 Gy en 5 fracciones) tratamientos más abreviados pueden ser aplicados en pacientes ancianos o con mal performance status.
Los LNH, los tumores de células pequeñas y los tumores de células germinales son muy quimiosensibles, en estos el uso de quimioterapia es efectivo. La tasa de éxito de la quimioterapia en LNH es de hasta 80% y en casos de SCLC es de 77%. El efecto es visible entre 7-15 días.
B- Emergencias metabólicasB-1 HipercalcemiaLa hipercalcemia está presente en hasta un 30% de los enfermos con cáncer.
Entre los tumores que más frecuentemente la provocan encontramos los cánceres de mama, pulmón y el mieloma múltiple.
La presencia de hipercalcemia tiene un significado pronóstico, particularmente cuando hay elevación del PTHrP (proteína relacionada con PTH). Entre un 10 a 30% de los enfermos con hipercalcemia están vivos un año después(1, 22, 23).
PatogeniaExisten tres mecanismos de producción hipercalcemia.
El más evidente es la destrucción local de hueso con aumento de la actividad de osteoclastos y liberación de citoquinas. Este mecanismo da cuenta de cerca de un 20% de las hipercalcemias. Es visible cuando existe osteolisis importante, como en los casos de mieloma múltiple o en tumores sólidos como mama o pulmón. Las citoquinas más identificadas con el problema son el TNF, la Interleuquina 1 y la interleuquina 6 y son las que activan a los osteoclastos.
Un segundo mecanismo es el “humoral”, con presencia de PTH-rP, que es una sustancia secretada por los tumores y que es análoga a la PTH (tienen concordancia en los primeros 13 aminoácidos), con una acción similar, produciendo aumento de la reabsorción ósea de calcio y aumento de la absorción a nivel de túbulo distal. Este mecanismo es responsable de cerca de un 80% de los casos de hipercalcemia (1, 24).
Por último, algunos tumores secretan Calcitriol, que produce hipercal- cemia, este mecanismo es diagnosticado en presencia de hipercalcemia con persistencia de niveles elevados de vitamina D. Esto es más frecuente entre los linfomas no Hodgkin, observandose la formación de 1,25 hidroxi vitamina D, por los linfocitos o macrófagos neoplásicos. Este mecanismo está también presente en enfermedades granulomatosas como la sarcoidosis.
La acción de la PTH-rP, secretada a la sangre o en forma paracrina, promueve la expresión del Ligando del receptor activador del factor nuclear kappa B (RANKL), en el hueso. El ligando de RANK (RANKL) contribuye a la hipercalcemia uniéndose a RANK en la superficie de los precursores de osteoclastos, llevando a la activación de estos (24, 27).
Presentación clínicaLos síntomas de hipercalcemia son inespecíficos, dentro de ellas están los síntomas neurológicos, letargia y confusión, síntomas digestivos náuseas, anorexia y constipación.
Hay síntomas generales como la fatiga.
Son remarcables la presencia de poliuria, polidipsia y aparición de hipovolemia, que puede ser profunda, contribuyendo a un deterioro agudo de la función renal.
El diagnóstico se hace con la medición de calcio iónico o el calcio total en sangre, en este último caso se puede aplicar una fórmula para corregir la calcemia.
El calcio iónico es el catión bioquímicamente activo. En la sangre el calcio va unido en 40% de albúmina, en un 50% va ionizado y en un 10% va unido a iones complejos. Cambios en los niveles de albúmina, llevan a cambios en la concentración de calcio iónico.
Como aproximación es útil la fórmula:
En las Imágenes, serán visibles las lesiones osteolíticas cuando las hay; la presencia de PTH baja en el contexto de hipercalcemia y ausencia de lesiones líticas, hace sospechar la existencia del mecanismo humoral, explicándose el fenómeno por la supresión de la PTH por su símil. En la práctica clínica es también posible la medición y monitoreo de la PTH-rP.
TratamientoEl primer punto a decidir es si vamos a hacer una terapia activa (reducción de los niveles de calcemia) o no, pues el tratamiento activo puede ser adecuado si existe un pronóstico favorable y si tenemos más terapias para ofrecer, sin embargo, no será necesario en un paciente que está cerca del fin de su vida.
El tratamiento comprende hidratación vigorosa con solución salina, el primer objetivo es la reposición de volumen, tratando de llevar el paciente a euvolemia. La forma más rápida de iniciar la reducción de la calcemia, es el aporte de fluído, aun cuando su utilidad está limitada por la necesidad de aportar varios litros de soluciones intravenosas. Una clara limitante de esta estrategia la vemos en pacientes con insuficiencia cardiaca o renal, que no pueden tolerar sobrecargas de volumen.
La aplicación de diuréticos de asa (Furosemida) promueve la calciuria y acentúa el efecto de la hidratación. Deben utilizarse con precaución, una vez corregida la hipovolemia y con atención a los desbalances hidroelectrolíticos potenciales (22, 23).
El estándar actual es la aplicación de Bisfosfonatos (análogos inorgánicos de pirofosfato), estos actúan impidiendo la acción reabsortiva de los osteoclastos. Su acción es relativamente rápida con un peak cerca del tercer o cuarto día. Los bifosfonatos disponibles son Pamidronato (en dosis de 60 a 90 mgrs EV, en 4 horas), o Zoledronato (en dosis de 4 mgs EV, en 15 minutos) o Ibandronato (en dosis de 4-6 mgs EV, en 2 horas) (22, 23, 25, 26).
La aplicación de Calcitonina subcutánea o endovenosa, es eficaz, aunque de utilidad muy limitada (unas 48 hrs), por taquifilaxis.
Los corticoides tienen efecto en la reducción de secreción de vitamina D3, por linfocitos o macrófagos. Este efecto tiene lugar entre 2 a 5 días del inicio. Son particularmente útiles en las neoplasias hematológicas. Las dosis de 40 a 60 mgs de prednisona al día, son eficaces en estos casos.
Los antiguos tratamientos de Mitramicina y Galio han quedado abandonados.
Gran interés ha suscitado la posible utilidad del nuevo anticuerpo monoclonal Denosumab, que actúa como inhibidor de RANKL, inactivando la formación de osteoclastos y ha mostrado ser más efectivo que los bifosfonatos en disminuir las complicaciones óseas; su rol en hipercalcemia está en investigación (27).
B-2 Síndrome de lisis tumoralEs una alteración metabólica general que se produce en el contexto de una gran carga de tumor junto con muerte celular masiva. Esto tiende a ocurrir desde algunas horas hasta unos cinco días después del inicio de los tratamientos de quimioterapia. Habitualmente se presentan tumores hematológicos (especialmente linfomas tipo Burkitt o la leucemia linfática aguda) (23, 28, 29).
Está definido como la presencia de hiperuricemia, hiperfosfatemia e hiperkalemia, como hallazgos principales, siendo fenómenos secundarios la elevación de deshidrogenasa láctica (LDH), la hipocalcemia y la falla renal aguda.
La presencia en tumores sólidos es rara, pero se da en aquellos tumores con alto grado mitótico (sarcomas, tumores germinales, neuroblastomas, carcinoma de células pequeñas y otros).
En algunos casos se puede presentar en forma espontánea, siempre mayoritariamente en tumores hematológicos y raramente en tumores sólidos (lo hemos visto frente a hemorragias con necrosis espontánea de metástasis hepáticas).
Sabemos que existen factores de que confieren mayor riesgo de desarrollar este cuadro, entre estos la presencia de hiperuricemia, de disfunción renal, de hipovolemia u oliguria previas.
PatogeniaLos mecanismos son la liberación masiva de contenido intracelular hacia el espacio extracelular y el intravascular.
Los ácidos nucleicos producen una liberación masiva de ácido úrico (metabolito de las purinas), este puede cristalizar en los tubos conduciendo insuficiencia renal aguda.
El ascenso de la kalemia, puede conducir a arritmias potencialmente peligrosas.
El fósforo está en mucha mayor concentración en las células tumorales, la muerte masiva de éstas puede provocar aumento brusco de la fosfemia. Como resultado se produce una hipocalcemia secundaria. Un incremento en la disponibilidad de calcio y fósforo sanguíneos (aumento del producto calcio x fósforo sobre 60 mg2/ dl2), puede llevar a la precipitación de fosfato de calcio en los túbulos renales, o en otros tejidos. Alteraciones significativas de la volemia pueden acentuar este efecto.
Presentación clínicaEl síndrome de lisis tumoral puede ir desde un fenómeno asintomático hasta, en los casos más graves, un fenómeno mortal. En los casos asintomáticos el diagnóstico es sólo de laboratorio.
Los síntomas son absolutamente inespecíficos y reflejan las alteraciones subyacentes. Esto implica que debemos sospecharlo y solicitar los exámenes de evaluación que permiten el diagnóstico de este fenómeno.
Es clave el control de los niveles de ácido úrico, fosfemia, kalemia. Es de utilidad la vigilancia de la LDH y el controla de calcemia, con el fin de corregirlos a la brevedad.
TratamientoLa principal herramienta de manejo es la prevención. (23, 28–30) La hidratación agresiva es uno de los pilares fundamentales en su prevención, el objetivo es producir un aumento del débito urinario; tenemos problemas en los casos de preexistencia de insuficiencia cardiaca o renal, situación que requiere máxima prudencia, para evitar la sobrecarga de volumen. La dosis recomendada es de 2-3 lt/m2 / día, para mantener un débito urinario mayor a 100 ml/m2 x hora. El tipo de aporte dependerá de las alteraciones hidroelectrolíticas y hemodinámicas previas.
El uso de Alopurinol en dosis de 300 a 900 mg. al día iniciados unos dos a tres días previos a la quimioterapia. Su dosis se ajusta según función renal y se mantiene hasta normalización de la uricemia.
Una vez establecido el problema usaremos las terapias necesarias para cada tipo de alteración específica, distintas armas de tratamiento para solucionar cada alteración particular. La presencia de insuficiencia renal habitualmente se puede controlar con una hidratación vigorosa endovenosa tanto profiláctica como en los casos que ya tenemos presencia de un síndrome de lisis tumoral inicial.
El aumento del ácido úrico se previene y se trata con hidratación vigorosa y con medicamentos como el Alopurinol; la rasburicasa (Urato oxidasa recombinante), aunque no disponible en nuestro país, es una alternativa, que parece ser más efectiva que el alopurinol (31, 32).
La alcalinización de la orina es controvertida, pues si bien aumenta la excreción del ácido úrico, disminuye la excreción de xantinas. Su uso es adecuado en casos de acidosis, en cuyo caso podemos recurrir a infusiones de bicarbonato, hasta la normalización del acido úrico. Otra medida, en ausencia de acidosis, es la utilización de Acetozolamida (600-800 mgrs/d en 2 ó 3 tomas).
El aumento de fósforo se controla con disminución de su ingesta y con quelantes de fósforo (como el hidróxido de aluminio en dosis de 50-150 mgrs/kg cada 4 a 6 horas)).
La hiperkalemia es tratada según su nivel de gravedad, con las medidas habituales para este problema (beta2 agonistas, dextrosa hipertónica, insulina, sales de intercambio iónico).
La hipocalcemia, dependiendo del nivel y de la presencia de síntomas, responde a la aplicación de Gluconato de calcio intravenoso.
La diálisis debe considerarse precozmente especialmente con fosfato sobre 10 mg/dl, con hiperkalemia grave o con producto Calcio fósforo > 50mg2/ dl2.
C- Emergencias neurológicasC.1 Compresión medularEste es un fenómeno relativamente común en pacientes de cáncer avanzado, encontrándose hasta en un 5% de las autopsias. Los estudios muestran que entre un 2.5% a un 6% de los pacientes presentan compresión medular en el curso de su evolución (33–35).
En un 20% de los casos de compresión medular, encontraremos la presentación de un cáncer hasta entonces desconocido para el paciente.
Cualquier cáncer puede dar compresión medular siendo los más frecuentes los de mama, de pulmón, de próstata y el mieloma múltiple, que dan cuenta de más de dos tercios de las compresiones medulares neoplásicas.
La topografía tumoral muestra que un 60-78% de los fenómenos de compresión medular ocurren a nivel torácico, siendo este segmento de la columna el más problemático, pues se trata del área relativamente más estrecha (la proporción entre médula y canal es muy desfavorable). De los restantes casos de compresión medular, entre un 16-33% ocurren a nivel lumbar y cerca de un 4-15% a nivel cervical. Más de un 50% de los pacientes tiene compromiso multisegmentario (33–35).
La presencia de compresión medular tiene significado pronóstico, pues su presencia implica una drástica disminución de la mediana de sobrevida, particularmente cuando hay parálisis.
El pronóstico neurológico va a depender del status neurológico al momento del diagnóstico e intervención. Es peor cuando hay parálisis en lugar de paresia, peor cuando hay disfunción autonómica y trastornos esfinterianos. Depende también del tiempo evolutivo de la compresión medular, empeorando las posibilidades de recuperación cuando hay más de 24 hrs. desde ocurrido el fenómeno de compresión hasta la intervención terapéutica. Le velocidad de instalación tiene un rol, pues la aparición rápida de déficit neurológico entraña un peor pronóstico.
La sobrevida global, dependerá finalmente del tipo de tumor, de los tratamientos disponibles y de las secuelas que ha dejado la comprensión medular.
Nunca será suficiente enfatizar que este cuadro requiere un diagnóstico precoz para evitar el daño neurológico permanente.
PatogeniaEl efecto mecánico de la compresión epidural es el responsable del cuadro.
Habitualmente es provocado por tumores metastásicos a vértebras (vía hematógena) o por contigüidad (acción local). Estos tumores crecen y provocan efecto de masa y destrucción local, a veces desplazando fragmentos óseos. La compresión puede aparecer agudamente en caso de fractura patológica en una vertebra metastásica debilitada (33–35).
Metástasis tanto en médula como meníngeas pueden producir déficits neurológicos similares, pero son bastante raras.
Existen algunos tumores entre ellos los linfomas, los sarcomas y el tumor del ápex pulmonar que pueden dar compresión por su propagación desde los espacios paravertebrales a través de los agujeros de conjunción intervertebrales, sin que exista lesión ósea evidente.
En ocasiones, pacientes que están en tratamiento anticoagulante oral con INR excesivamente alto, o con fenómenos hemorragíparos, pueden ver agravado su cuadro por esta causa (36).
La compresión mecánica puede dañar directamente la médula o a través de la compresión de los vasos sanguíneos medulares. Este último mecanismo parece ser el más importante. Tanto la lesión mecánica, como la compresión de los plexos venosos despiertan una respuesta inflamatoria; entre los mediadores inflamatorios se secreta VEGF (factor de crecimiento del endotelio vascular), que produce edema medular vasogénico, y lleva al aumento de la presión tisular afectando el flujo sanguíneo arteriolar y agravando la isquemia.
La destrucción de segmentos óseos compromete la estructura de la columna generando inestabilidad, esto contribuye a desencadenar fenómenos de compresión.
Presentación clínicaUn 80% de las compresiones medulares ocurren en pacientes con un cáncer conocido. En un 20% de los casos es la forma de debut del cáncer (33, 35).
El 95% de los pacientes tiene dolor, el dolor puede adoptar diferentes formas. Puede iniciarse con un dolor localizado, en la zona de la metástasis, provocado por el compromiso de periostio y la invasión de otros tejidos. El dolor radicular es frecuente, particularmente en el compromiso lumbar. El dolor tiende a aumentar en la noche y en la posición decúbito, a menudo empeora con la maniobra de Valsalva. La presencia de dolor incidental, asociado con el movimiento, es particularmente ominosa, pues puede indicar inestabilidad mecánica de la columna.
Como síntoma precursor, este dolor puede preceder durante dos a tres meses a la compresión.
En muchos enfermos de cáncer, la presencia de dolor dorsolumbar persistente, debe hacer sospechar metástasis vertebrales, hasta que se pruebe lo contrario.
Con frecuencia se encuentra dolor a la palpación, por el compromiso de periostio.
En 75% de los pacientes encontramos debilidad, a esto se pueden ir agregando trastornos de sensibilidad y alteración de la marcha; los trastornos de sensibilidad casi no se ven en ausencia de compromiso motor. Las dificultades progresivas para la marcha, con riesgo de caídas, son un signo de progresión del compromiso motor o sensitivo.
La disfunción autonómica se manifiesta con disfunción e incontinencia vesical y anal, que son síntomas tardíos. En ancianos es más frecuente ver la aparición de retención urinaria.
Desde L2 hacia abajo puede afectarse el cono medular, esto da una constelación particular de síntomas y signos que constituyen el Síndrome de Cauda Equina. Este tiene como característica la debilidad distal, las parestesias e hipoestesias en silla de montar, la alteración de la marcha y la afección esfinteriana.
En los casos de compresión medular o de cauda equina, no se deben esperar la progresión de los síntomas, pues esto puede traer la instalación de déficits permanentes.
El examen de confirmación es la Resonancia Magnética, este método tiene una sensibilidad de 93% y una especificidad de 97% para la detección de compresión epidural. En caso en que no se puede utilizar o no esté disponible, es posible recurrir a la Tomografía Computada, especialmente la mieloTAC (con medio de contraste intraraquideo).
En las imágenes radiológicas, el 80% muestra alteraciones, sin embargo el diagnóstico definitivo requiere mayor precisión.
TratamientoLos pacientes aquejados de compresión medular presentan con frecuencia enfermedad muy diseminada. Los objetivos son paliativos; se trata de controlar el dolor, evitar complicaciones y prevenir el déficit neurológico (33–35, 37).
Aquellos pacientes que están asintomáticos, en que sólo hay compresión radiológica, pueden ser manejados en forma conservadora, definiendo los tratamientos antitumorales que tengan mejor indicación.
Cuando hay déficit neurológico es indispensable iniciar corticoides, la elección es dexametasona. Las dosis y esquemas de carga y de mantención no han sido definidos. Existe controversia sobre cuál es la mejor forma de utilización y su uso va desde una dosis de carga de 10 mgs seguida de 16 mg/día (dosis moderada), a dosis de 96 mg/ día (dosis alta), que se va reduciendo gradualmente. Esta última dosis tiene la ventaja de mostrar una disminución de las secuelas neurológicas en el grupo tratado, pero a costa de mayores complicaciones (gastrointestinales).
Aunque no está claro el mecanismo, el efecto de los corticoides parece estar relacionado con su acción para reducir la expresión de VEGF, en la médula isquémica. (35)
El tratamiento estándar ha sido la radioterapia, los esquemas de radioterapia han ido variando desde la clásica aplicación de 25 a 30 Gy en 10 fracciones, hasta esquemas de hipofraccionamiento con 8 Gy en una sesión. Este último esquema tiene similar efecto analgésico y de recuperación motora, pero se asocia a mayor necesidad de reirradiación; por otro lado, esta forma de aplicación puede ser más tóxica para el tejido medular a mediano plazo, por lo que se recomienda para uso en pacientes que tengan perspectivas de vida muy limitadas.
Un área interesante es el desarrollo de la radiocirugía estereotáctica para el manejo de estas metástasis.
La cirugía ha ido evolucionando gradualmente, haciéndose más compleja, pero también más efectiva (38–40).
Desde al año 2003, a raíz de la publicación de Patchell, quedó demostrado que la combinación de cirugía seguido por radioterapia es la modalidad más efectiva y debiera ser la primera elección en enfermos debidamente seleccionados. En el estudio de Patchell, el grupo con cirugía y radioterapia mostró que el 56% había recuperado la marcha, contra un 19% de los tratados con radioterapia exclusiva (39, 40).
Aunque los resultados son favorables a la combinación, los criterios de inclusión no permiten extender estas conclusiones a todo el universo de pacientes con compresión medular.
La cirugía tiene otros roles de importancia y la debemos tener en cuenta en casos de:
- a.
Inestabilidad
- b.
Síntomas en rápida progresión durante o post-radioterapia.
- c.
Necesidad de tejido para biopsia.
Gradualmente se han introducido técnicas menos invasivas como la vertebroplastía y la kifoplastía percutáneas, que han demostrado ser particularmente útiles en la disminución del dolor.
C.2 Metástasis cerebrales e hipertensión endocraneanaLa hipertensión endocraneana puede ser producida por metástasis en cerebro o por tumores primarios. Las metástasis cerebrales están presentes en un cuarto de los pacientes con cáncer; aquellos tumores que afectan el sistema nervioso central de manera más frecuente son pulmón, mama y melanoma. La mayoría de los pacientes tiene un cáncer conocido (y a veces largamente tratado) al momento de la presentación clínica.
En algunos casos la metástasis cerebral es la forma de presentación inicial. En raros casos resulta ser única y de un primario que puede no encontrarse (41, 42).
PatogeniaLa llegada de metástasis es por vía hematógena, esto explica que la distribución topográfica muestre un 90%de lesiones supratentoriales. Las metástasis se ubican especialmente a nivel de la unión de sustancia gris y blanca. Característicamente provocan gran efecto de masa, con edema muy significativo.
El crecimiento provoca inicialmente signos focales, en la medida que los tumores se expanden comienzan a producir hipertensión endocraneana por el efecto de masa, la presencia de edema, la obstrucción del flujo de circulación del líquido cefaloraquídeo.
El edema vasogénico es producido por la disrupción de la barrera hematoencefálica por la implantación de un tumor, esto conlleva un aumento de la permeabilidad, con aumento de la presión hidrostática.
El edema llevará finalmente a la herniación de las estructuras encefálicas y finalmente a la muerte.
Presentación clínicaLos síntomas pueden ser focales o generalizados según la localización (del) o de los tumores.
Sólo un 50% presenta con cefalea al inicio, especialmente cuando se trata de tumores de crecimiento rápido o infratentoriales.
La cefalea es inicialmente inespecífica, a veces es de tipo opresivo, como la cefalea tensional; inicialmente leve, va aumentando en intensidad en el curso de días a semanas. Aparecen otros signos que apuntan a focalidad neurológica, sólo un 10 % de los tumores cursa con cefalea aislada.
Algunos pacientes con hipertensión endocraneana, pueden experimentar cefalea más intensa en relación a ondas de “plateau pressure” (abrupta elevación de la presión intracranial por pérdida de la regulación del tono vascular) (43), en estos casos hay episodios de cefalea de 5 a 20 minutos, acompañados de emesis y de obnubilación, con frecuencia son desencadenados por movimientos o cambios de posición.
Las alteraciones de conciencia están presentes en aproximadamente un tercio de los pacientes, van desde leve retardo psicomotor a el sopor o el coma. Es frecuente encontrar edema de papila.
Las manifestaciones de aumento de presión intracraneal se van haciendo cada vez más patentes en la medida que la enfermedad avanza.
Puede haber vómitos, con o sin náuseas, provocados por la compresión sobre el tronco cerebral, no es raro que esto se acompañe de una sensación de mareo, no vertiginosa. Los vómitos fáciles (sin náuseas) ocurren en pacientes con tumores de fosa posterior o hidrocéfalo, sin embargo no son habituales.
Las convulsiones son frecuentes. Se pueden producir diferentes tipos de crisis epilépticas. Algunos de estos pacientes pueden desarrollar un estatus epiléptico.
El diagnóstico se sospecha con la historia y los hallazgos del examen y se confirma con Resonancia Magnética y Tomografía Computada.
TratamientoLa evaluación y el tratamiento van a depender de las condiciones generales del paciente, de la presencia (fuera del encéfalo) de una enfermedad controlada o no y del tipo histológico del tumor.
Las metástasis cerebrales entrañan un particular mal pronóstico. La estrategia terapéutica, puede hacer necesario que en algunos casos sólo hay que preocuparse del control de los síntomas; mientras en otros casos puede requerir un tratamiento agresivo.
En pacientes asintomáticos puede no ser necesario el uso de corticoides.
El aumento de la presión intracraneana, especialmente si hay síntomas, se trata con corticoides (dexametasona). Las dosis en casos de pacientes estables van entre 6 y 24 mgrs/día. En situación de emergencia (p. ej. her- niación), la aplicación de un bolus de 40 mg seguidos de 40-100 mgrs/d en dosis dividida, puede ser efectivo (44).
El uso de Hiperventilación, Manitol o solución salina hipertónica quedan restringidos a situaciones críticas, especialmente si se está planificando una cirugía.
El uso de anticonvulsivantes es de regla en pacientes que han tenido crisis epilépticas; su uso es controvertido en pacientes que no han tenido convulsiones y no es recomendado por la Asociación Americana de Neurología (45).
La cirugía (46) y la radioterapia (48, 49) siguen siendo los tratamientos a elección. En algunos casos seleccionados la quimioterapia es la principal herramienta (p.ej. linfomas cerebrales).
La cirugía es fundamental en caso de tumores primarios y tiene un rol especial cuando se trata de metástasis única (47, 48), particularmente si no hay un primario conocido y necesitamos tener biopsia. Es también importante en caso de oligometástasis, en particular si se trata de pacientes con buen performance status y con tumor (fuera del SNC) bien controlado, o en casos de tumores en fosa posterior.
La Radiocirugía esterotáctica, es una técnica eficaz y más selectiva que se está usando crecientemente (50).
ConclusiónLas emergencias oncológicas seguirán siendo un área de singular desafío médico, tanto por sus formas de presentación, como por sus implicancias diagnósticas y terapéuticas. Sigue siendo un punto crucial para su manejo, el contar con buenos equipos multidisciplinarios.
La mayor parte de las emergencias ocurren en pacientes con cáncer ya conocido.
El diagnóstico precoz es clave en todo el manejo posterior y en sus resultados.
La observación, la experiencia y también la evidencia médica nos lleva a repetir algunas viejas recomendaciones clínicas, que valen la pena aplicar:
- 1)
Si usted “no piensa” en el diagnóstico posible, no va a diagnosticar el problema.
- 2)
Ante la sospecha de una emergencia oncológica, la evaluación del paciente (clínica, de laboratorio y radiológica) debe ser sin dilación y...
- 3)
La aplicación del tratamiento debe ser lo más precoz posible.
Por último es recomendable la pronta opinión de especialistas en oncología para el manejo de estos pacientes y la coordinación de equipos multidisciplinarios.
El autor declara no tener conflictos de interés, en relación a este artículo.