In the heart failure patient spectrum, there is a group that has been called advanced heart failure. This group of patients is characterized by remaining in functional class III-IV and/or by recurrent hospitalizations despite maximum doses of neuro-hormonal management (by the way, the maximum doses in these patients are usually much lower than the target doses since their tolerance to medication decreases as the disease progresses) and interventional strategies when applicable (this is resynchronization-type stimulation devices, wireless monitoring sistemas (cardioMEMS), correction of valve disease, among others). In this group of patients, one of two paths must be chosen: palliative management or advanced therapies. Both paths are also accompanied by continuing cardinal medication as far as possible; day hospitalization with inotropy, intravenous diuretics, iron replacement; cardiac rehabilitation and multidisciplinary support. In patients who decide on advanced therapies, the first option is transplantation, however, not all will have access to an organ, for these patients the alternative of left ventricular assistance has been created. In the following pages we will delve into the classification, operation, indications, contraindications of said devices and what has been their evolution in the hands of research studies that support their use, as well as what is the current evidence regarding these devices. In a tangential way, the artificial heart will also be discussed, with regards to its structure, operation and the available clinical evidence.
En el espectro de los pacientes con falla cardíaca, hay un grupo que se ha denominado falla cardíaca avanzada, este grupo de pacientes se caracteriza por permanecer en clase funcional III-IV y/o por hospitalizaciones recurrentes a pesar de dosis máximas de manejo neuro-hormonal (dicho sea de paso, las dosis máximas en estos pacientes suelen ser bastante menores a las dosis metas pues su tolerancia a los medicamentos disminuye a medida que progresa la enfermedad) y estrategias de intervencionismo cuando aplique (esto es, dispositivos de estimulación tipo resincronización, sistemas de monitoreo inalámbricos (cardioMEMS), corrección de valvulopatías, entre otras). En este grupo de pacientes se toma la decisión de elegir uno de dos caminos: manejo paliativo o terapias avanzadas. Ambos caminos además se acompañan de continuar la medicación cardinal en la medida de lo posible; hospitalización día con inotropia, diuréticos intravenosos, reposición de hierro; rehabilitación cardíaca y apoyo multidisciplinario. En los pacientes que se decide terapias avanzadas la primera opción es el trasplante, sin embargo, no todos tendrán la oportunidad de poder acceder a un órgano. Para estos pacientes se ha creado la alternativa de asistencia ventricular izquierda. En las siguientes páginas ahondaremos en la clasificación, el funcionamiento, las indicaciones, las contraindicaciones y cuál ha sido la evolución de la terapia de asistencia ventricular de la mano de los estudios de investigación que avalan su uso, así como cuál es la evidencia actual de dichos dispositivos. De forma tangencial también se hablará del corazón artificial en cuanto a su estructura, funcionamiento y la evidencia clínica disponible.
Desde la década de 1960, cuando se desarrollaron los primeros dispositivos de asistencia circulatoria mecánica, ha habido una evolución sorprendente de su tecnología. Las primeras bombas se utilizaron para recuperar pacientes con complicaciones agudas después de una cirugía cardíaca. Hoy en día, la asistencia circu- latoria mecánica es una herramienta esencial para el tratamiento de la insuficiencia cardíaca avanzada. Los dispositivos de asis- tencia circulatoria pueden proporcionar soporte hemodinámico al ventrículo izquierdo, al derecho o a ambos, e incluso pueden sustituir completamente sus funciones tras la explante1.
2Clasificación de la asistencia circulatoria mecánica y de la severidad de la falla cardíaca avanzadaLos dispositivos de asistencia circulatoria se clasifican de acuerdo con el destino al cual se pretende llegar y se denominan puente a trasplante, puente a recuperación, puente a decisión y terapia de destino. Históricamente, el primer uso de los dispositivos de asistencia circulatoria mecánica era proporcionar soporte hemo- dinámico para evitar la muerte o el deterioro clínico mientras se realizaba un trasplante2. En algunas ocasiones la alteración hemo- dinámica se puede resolver o compensar por lo cual el soporte se realiza hasta que ocurre una recuperación. Cuando es difícil determinar inmediatamente si existe posibilidad de recuperación o de trasplante y hay incertidumbre sobre la función neurológica u orgánica, el soporte permite tener tiempo para resolver estas preguntas y definir con certeza la intención del tratamiento3.
Cuando no hay posibilidad de recuperación cardíaca y existen contraindicaciones para realizar el trasplante, el soporte circu- latorio es la alternativa final de reemplazo cardíaco. De forma consecuente con esta intención, los dispositivos de asistencia se dividen en corta, mediana y larga duración. Si el paciente puede tener autonomía sin necesidad de cuidado intrahospitalario se denomina de larga duración, los dispositivos que no permiten este grado de independencia serán dispositivos de corto y mediano plazo, a saber: el balón de contrapulsación intraaórtico, el Impella, el Tandem-Heart, el CentriMag y en términos generales la membrana de circulación extracorpórea (ECMO por sus siglas en inglés) aunque en sentido estricto este último más que una asistencia ventricular es una asistencia circulatoria4.
Como se verá en el recuento histórico, el desarrollo de los disposi- tivos de larga duración está íntimamente ligado a la falla cardíaca avanzada, pues es esta su principal indicación. Conviene entonces repasar este concepto: la Asociación Americana del Corazón (AHA, por sus siglas en inglés) clasifica la falla cardíaca crónica en esta- díos según la ausencia de anormalidad estructural (en presencia de factores de riesgo, AHA A), la presencia de anormalidad estructural, pero en ausencia de síntomas (AHA B), la aparición de síntomas (AHAC) y la falla cardíaca terminal (AHA D, también llamado falla cardíaca avanzada), término que si bien puede resultar un tanto brusco pone de manifiesto una verdad que no se debe perder de vista, la falla cardíaca es una enfermedad crónica, cuyo curso depende de muchos factores, pero independiente- mente de estos, termina en la muerte del paciente si el tiempo es suficiente.
Intentando generar objetividad en la definición de falla avan- zada, se han establecido los siguientes criterios, que parten del hecho que el paciente está bajo terapia médica óptima, entendida esta como las dosis máximas de medicamentos tole- radas por el paciente: persistencia sintomática en estadio III-IV, limitación marcada para actividad física (consumo de oxígeno <12-14ml/kg/min o test de caminata de 6 minutos <300 metros), episodios de descompensación (por bajo gasto, congestión o arritmias) con una frecuencia mayor a uno por año y disfunción cardíaca severa (para el tema que nos compete: fracción de eyección del ventrículo izquierdo <30%)5. Una vez el paciente está en falla cardíaca avanzada se vuelve necesario decidir si el paciente será candidato a terapias avanzadas (es decir: trasplante cardíaco, asistencia ventricular izquierda de largo término como terapia puente a trasplante, puente a candidatura o como terapia de destino o corazón artificial total con las mismas intenciones que las asistencias) o no, para lo cual se toman en cuenta en primer lugar la clasificación Interagency Registry for Mechanically Assisted Circulatory Support (INTERMACS) propuesto por Stevenson y sus colegas6 (Tabla 1).
Clasificación INTERMACS propuesto por Stevenson et al.6
| Categoría | Definición | Descripción |
|---|---|---|
| INTERMACS 1 | «critical cardiogenic shock» | Inestabilidad hemodinámica pese a dosis crecientes de catecolaminas y/o soporte circulatorio mecánico con hipoperfusión crítica de órganos diana (shock cardiogénico crítico) |
| INTERMACS 2 | «progressive decline» | Soporte inotrópico intravenoso con cifras aceptables de presión arterial y deterioro rápido de la función renal, el estado nutricional o los signos de congestión |
| INTERMACS 3 | «stable but inotrope dependent» | Estabilidad hemodinámica con dosis bajas o intermedias de inotrópicos e imposibilidad para su retirada por hipotensión, empeoramiento sintomático o insuficiencia renal progresiva |
| INTERMACS 4 | «resting symptoms» | Es posible retirar transitoriamente el tratamiento inotrópico, pero el paciente presenta recaídas sintomáticas frecuentes, habitualmente con sobrecarga hídrica |
| INTERMACS 5 | «exertion intolerant» | Limitación absoluta de la actividad física, con estabilidad en reposo, aunque habitualmente con retención hídrica moderada y un cierto grado de disfunción renal |
| INTERMACS 6 | «exertion limited» | Menor limitación de la actividad física y ausencia de congestión en reposo. Fatiga fácil con actividad ligera |
| INTERMACS 7 | «advanced NYHA III» | Paciente en clase funcional NYHA III sin balance hídrico inestable actual ni reciente |
La clasificación INTERMACS es una herramienta muy valiosa para establecer la indicación de soporte circulatorio mecánico y también el riesgo de muerte y complicaciones. Esta escala utiliza criterios clínicos y requerimiento de inotropia para definir la falla cardíaca avanzada en siete perfiles. Los primeros tres perfiles se refieren a pacientes que dependen de soporte inotrópico.
Pacientes con hipotensión, e hipoperfusión orgánica crítica y soporte inotrópico alto se clasifican en el perfil 1. Los pacientes con perfil 2 están normotensos, pero están deteriorando la función orgánica a pesar de la terapia inotrópica, los pacientes con perfil 3 están estables, pero no se pueden destetar de terapia inotrópica. Los perfiles restantes 4-7 implican diferentes estadios de gravedad en pacientes ambulatorios que no reciben terapia inotrópica continua.
3Historia de la evidencia de la utilidad de la asistencia ventricularLa evidencia científica que soporta el beneficio de reemplazar la función de bomba del corazón con un dispositivo mecánico es reciente en comparación con la alternativa de trasplante cardíaco. El ensayo REMATCH7, publicado en 2001, fue el primer estudio aleatorizado que demostró que la supervivencia de la insufi- ciencia cardíaca en etapa terminal no apta para trasplante podría mejorarse mediante el implante de un dispositivo de asistencia circulatoria mecánica. Se estudiaron 129 pacientes con insufi- ciencia cardíaca avanzada que no eran candidatos a trasplante y se aleatorizaron a una terapia médica óptima o a una terapia médica óptima más implantación de un soporte circulatorio mecánico con un dispositivo de flujo pulsátil de primera gene- ración (Thoratec XVE). Los criterios de ingreso fueron una fracción de eyección del ventrículo izquierdo del 25% o menos, un VO2 máximo de 12ml/kg/min o menos, y una insuficiencia cardíaca de clase funcional IV de la New York Heart Association (NYHA) durante al menos 90 días a pesar del tratamiento con diurético, digital e inhibidor de la enzima convertidora de angiotensina; o el paciente tenía soporte inotrópico. Posteriormente, las indica- ciones se ampliaron para incluir pacientes que se encontraban en insuficiencia cardíaca de clase funcional III y IV de la NYHA durante al menos 28 días y que habían recibido 14 días de trata- miento con balón de contrapulsación intraaórtico o dependían de inotrópicos a pesar de los intentos de destete con el VO2 máximo 14ml/kg/min o menos. Hubo una reducción muy significativa del 48% en el riesgo de mortalidad por todas las causas. La supervi- vencia a 1 año fue del 52% en el grupo de dispositivos y del 25% en el grupo de tratamiento médico. La supervivencia a 2 años fue del 23% en el grupo de dispositivos y solo del 8% en el grupo de terapia médica, lo que sugiere el pobre pronóstico de aquellos que cumplen los criterios de elegibilidad. La importancia central del ensayo REMATCH es que esta fue la primera demostración de que un dispositivo de asistencia circulatoria mecánica podría prolongar la vida de un paciente en ausencia de un trasplante posterior. El dispositivo utilizado en el ensayo REMATCH fue un dispositivo pulsátil de primera generación con durabilidad limi- tada. En el estudio INTrEPID, Rogers et al.8 compararon pacientes con insuficiencia cardíaca avanzada tratados con el dispositivo de asistencia ventricular NOVACOR con pacientes tratados con trata- miento médico óptimo, pero sin soporte circulatorio mecánico (SCM). Los pacientes tratados médicamente tuvieron una super- vivencia pésima (90% de mortalidad a 1 año) similar a la cohorte tratada médicamente informada anteriormente en REMATCH. Posteriormente, se evaluó el Thoratec HeartMate II, en un ensayo clínico aleatorizado, en donde se comparó con el dispositivo de flujo pulsátil Thoratec XVE. En este ensayo, Slaughter et al.9 alea- torizaron a 200 pacientes que tenían fracción de eyección menor al 25%, un VO2 pico menor a 14ml/kg/min o menor al 50% del predicho, estaban en clase funcional IIIb o IV de la NYHA durante al menos 45 de los 60 días antes de la aleatorización y no fueron considerados candidatos para trasplante cardíaco. Adicional- mente, los pacientes podrían inscribirse si fueron dependientes de balón de contrapulsación intraaórtico durante al menos 7 días o dependientes de inotrópicos durante 14 días antes de la inscripción. El objetivo principal del ensayo fue la supervivencia sin accidente cerebrovascular incapacitante o la reoperación para reparar o reemplazar el dispositivo de asistencia circulatoria mecánica. La supervivencia libre de eventos estimada a 1 y 2 años para el soporte circulatorio mecánico de flujo continuo fue del 68% y el 58%, respectivamente, y para el soporte circulatorio pulsátil del 55% y el 24%. Solo el 8% de los pacientes con soporte circulatorio mecánico de flujo pulsátil estaban vivos con el dispo- sitivo pulsátil a los 2 años.
En la cronología de las asistencias ventriculares, el siguiente estudio a mencionar es el estudio ENDURANCE, en el cual se comparó el HeartWare vs. HeartMate II, en este estudio, que incluyó pacientes con FEVI ≤25% y clase funcional IIIb-IV a pesar de terapia médica óptima y con contraindicación para trasplante, el objetivo principal era un desenlace compuesto de evento cerebro vascular y mal funcionamiento del dispositivo a dos años. Tras finalizar el seguimiento, se encontró que el HeartWare era no inferior al HeartMate II y al desglosar el compuesto fue evidente que en el grupo de HeartWare había mayor riesgo de evento cerebrovascular, pero menos tasa de mal funcionamiento del dispositivo10.
Finalmente, en el año 2019 es publicado el estudio MOMENTUM 3 en el cual se comparó el HeartMate III vs. su versión previa en población que requiriese asistencia ventricular independien- temente de la intensión de esta (destino o puente). El objetivo principal del estudio era la presencia de mal funcionamiento del dispositivo o accidente cerebro vascular a dos años; se encontró que el HeartMate III era superior en cuanto a este desenlace compuesto11. El recuento histórico previamente mencionado permite entender porque en la actualidad solo se considera el HeartMate III como la asistencia ventricular de largo término disponible.
Recientemente, los datos publicados del Registro INTERMACS12 sugieren una mejora continua en la supervivencia de los pacientes tratados con dispositivo de asistencia ventricular izquierda (DAVI) con una supervivencia a 2 años que ahora supera el 70%, mucho mejor de lo que podría esperarse con la terapia médica exclusiva.
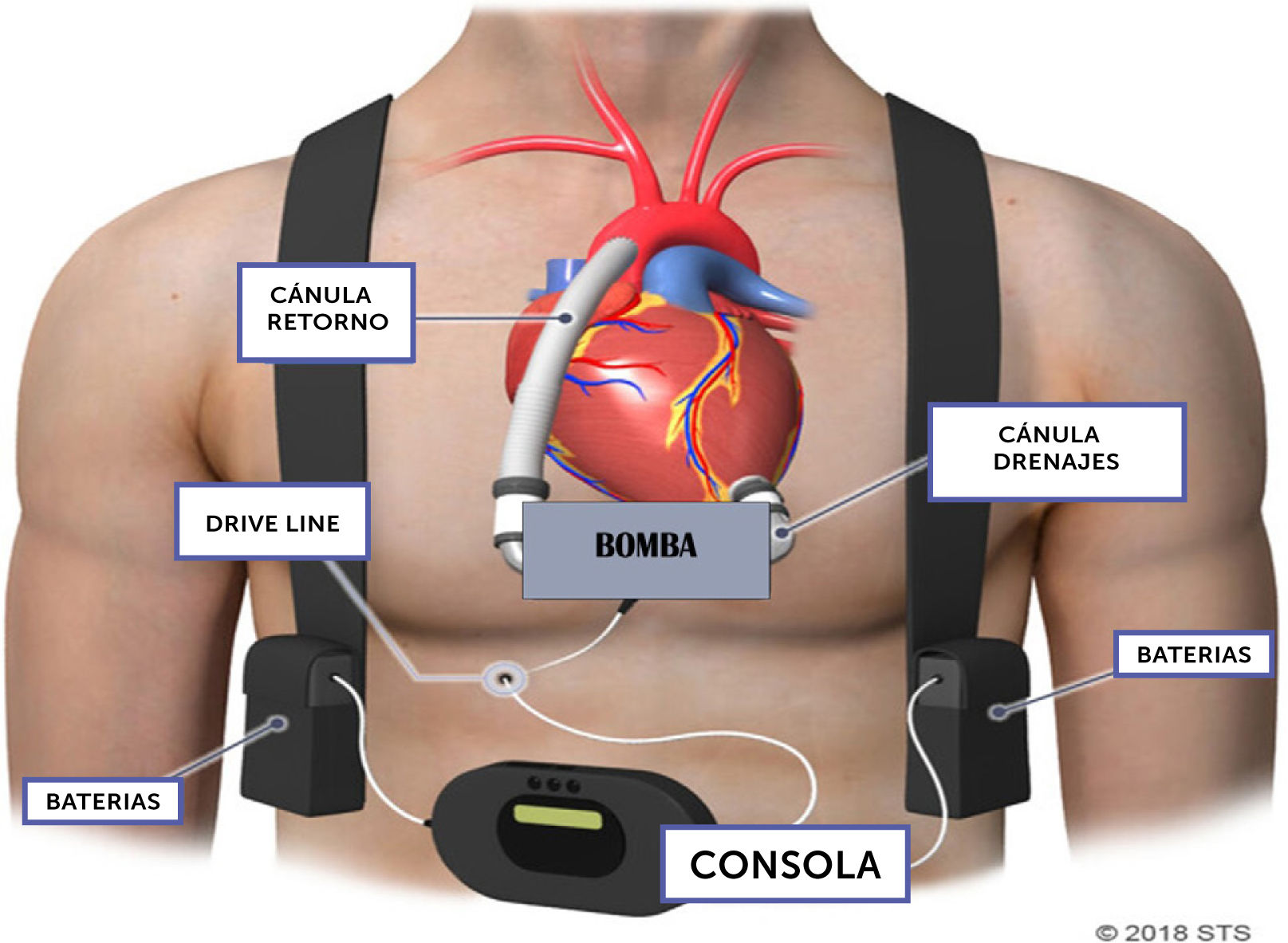
4Mecánica y fisiología de las asistencias ventricularesLos dispositivos de asistencia ventricular tienen varios compo- nentes: la cánula de ingreso que permite descargar el ventrículo izquierdo, una bomba que impulsa el flujo de la sangre y una cánula de retorno hacia la aorta. Además, poseen una fuente de energía y una consola que controla y monitoriza el funciona- miento de la asistencia, así como una conexión “drive line” o cable de conexión que conecta la consola con la bomba. (Fig. 1). En cuanto a la fisiología, la cánula de drenaje que se encuentra en el ventrículo izquierdo permite succionar la sangre del ventrículo izquierdo de forma activa. La bomba tiene una única parte móvil denominada rotor el cual gira y transmite energía potencial y cinética a la sangre; la sangre es impulsada a la circulación arte- rial a través de la cánula de retorno por la energía que imprime la bomba (en el caso del Heartmate II se trata de una bomba axial; mientras que en el Heartware y el Heartmate III existe una bomba centrifuga). La consola controla la velocidad de rotación del rotor. De acuerdo con las condiciones de carga y de flujo se puede requerir menor o mayor campo magnético para mantener la velocidad programada. La consola monitoriza la potencia eléctrica requerida. El flujo se estima con una relación entre el poder y la velocidad de la bomba. Este estimado es impreciso y en las bombas centrifugas es necesario estimar la viscosidad de la sangre por medio del hematocrito. La variación del flujo de la bomba en la fase sistólica y diastólica se expresa como un índice de pulso. Estos cuatro parámetros son monitorizados por la consola y permiten diagnosticar el adecuado funcionamiento del sistema. La bomba requiere un suministro constante de energía eléctrica que se obtiene de dos fuentes de poder, la red eléctrica o dos baterías recargables13–15.
En la Tabla 2 se resumen las diferencias entre los tipos de asisten- cias disponibles en el mercado.
Diferencias entre los tipos de asistencias disponibles en el mercado
| Dispositivo/característica | Heart-Mate II | Heart-Mate III | Heart-Ware |
|---|---|---|---|
| Tipo de bomba | Axial-mecánico | Centrifugo-magnético | Axial-magnético |
| Sitio de implante de bomba | Preperitoneal | Intrapericárdico | Intrapericárdico |
| Revoluciones por minuto | 8.800 - 10.000Máxima 15.000 | 5.200 - 5.800Máxima 9.000 | 2.400 - 3.200Máxima 4.000 |
| Litros por minuto de gasto cardíaco | 4 - 8Máximo 10 L | 3 - 6Máximo 10 L | 4 - 7Máximo 10 L |
| Poder (watts) | 4 - 7 | 3 - 7 | 3 - 7 |
Aunque, como ya se evidenció, hay diferencias entre los disposi- tivos, su funcionamiento e interacción hemodinámica es similar. El control que se ejerce sobre la bomba es únicamente sobre las revo- luciones del rotor. Este parámetro determina la cantidad de energía que se transmite a la circulación y se convierte en flujo y en dife- rencia de presión en la circulación sistémica. Las bombas no modi- fican automáticamente estas revoluciones y es muy importante ajustar este valor a la capacidad de funcionamiento del ventrí- culo derecho. Unas revoluciones insuficientes van a generar poca descarga del ventrículo izquierdo con signos de congestión venosa pulmonar y bajo gasto cardíaco. Unas revoluciones excesivas van a generar falla ventricular derecha, congestión venosa sistémica y de nuevo bajo gasto cardíaco. Además de las revoluciones los otros dos parámetros que determinan el funcionamiento de la bomba son su precarga y poscarga. La precarga es básicamente la función de bomba del ventrículo derecho y el flujo pulmonar. A unas mismas revoluciones la bomba genera mayor gasto cardíaco a mayor precarga. La poscarga es la impedancia en la aorta ascendente. A una mayor poscarga la bomba genera menor gasto cardíaco y mayor presión arterial sistémica. Las interacciones entre las revolu- ciones, la precarga, la poscarga, la geometría del septo interventri- cular, la interdependencia ventricular y la eficiencia del ventrículo derecho son complejas16 y no van a ser discutidas en este artículo.
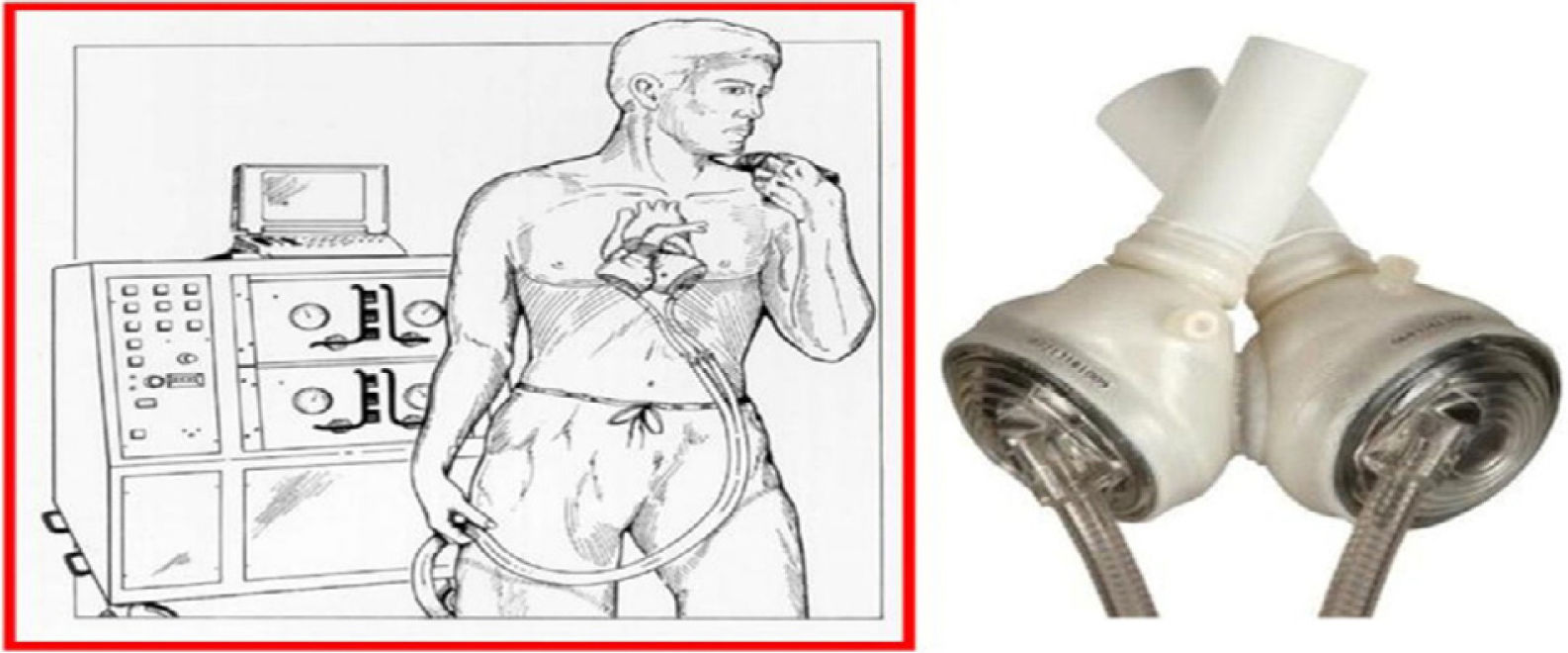
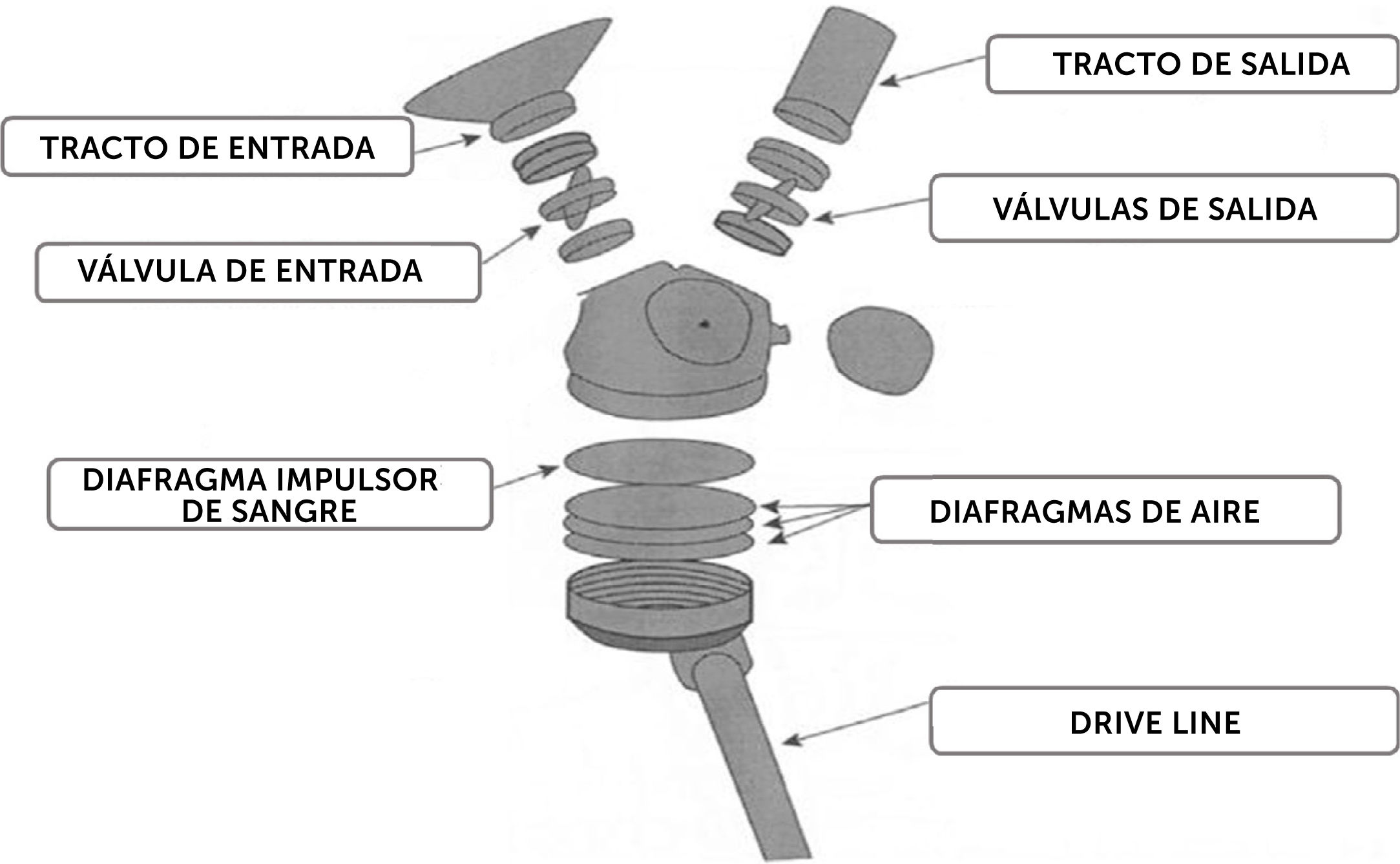
5Corazón artificialEn cuanto al corazón artificial, es una tecnología consistente en el reemplazo de los ventrículos por dos bombas neumáticas conectadas cada una a través de un “drive line” a una consola que coordina el inflado y desinflado de los diafragmas que contienen cada una de las bombas, logrando así una sístole y una diástole independiente en cada cámara (Fig. 2); el único corazón arti- ficial disponible en el mercado actual es el Syncardia y su uso es bastante menor respecto a las asistencias ventriculares izquierdas, por ejemplo, al año 2015 se habían implantado 1.400 Syncardia vs. más de 20.000 HeartMate II (Figs. 3 y 4)17. Esto se explica dado que su implante es técnicamente mucho más difícil (implica la resección de los ventrículos y la conexión a las aurículas y grandes vasos correspondientes, con el cambio valvular respectivo) y tiene mayor probabilidad de generar un mediastino lo suficientemente hostil como para impedir el trasplante posterior. Su uso se limita a los pacientes con indicación de trasplante que no pueden recibir el mismo y tampoco son susceptibles a asistencia ventricular izquierda por defectos anatómicos, por disfunción ventricular derecha grave o por tormenta arrítmica18. Como se puede deducir, las implica- ciones fisiológicas del corazón artificial total distan mucho de las asistencias ventriculares izquierdas de largo término y poseen una relación con la precarga y la poscarga muy similar al corazón nativo.
Persona con corazón artificial total. Corazón artificial total ex vivo17.
Progresión histórica de las consolas del corazón artificial total17.
Componentes de una de las bombas del corazón artificial total17.
De forma muy general se puede decir que las asistencias ventri- culares están indicadas en aquellos pacientes en quien a pesar de recibir un manejo médico óptimo la falla cardíaca genera un aumento de la fragilidad y un deterioro funcional con aumento del riesgo de muerte. Están indicadas en pacientes que tienen contraindicación para el trasplante cardíaco o que tienen un riesgo alto de muerte mientras están en lista de espera.
La anterior definición, aunque es un intento por describir de forma global las indicaciones, deja varios campos muy abiertos, a saber: ¿qué es un gasto cardíaco insuficiente y por qué no es posible ofrecer un trasplante cardíaco? Se resalta que algunas contraindi- caciones para el trasplante también lo son para las asistencias, por lo que en una sección posterior se ahondará en las contraindica- ciones para asistencias ventriculares y corazón artificial.
El elemento clave para indicar una terapia de reemplazo cardíaco es establecer el momento en que la falla cardíaca, a pesar de un manejo médico adecuado, genera un incre- mento progresivo de la fragilidad del paciente. A mayor fragi- lidad, mayor riesgo de muerte y complicaciones por lo cual es importante realizar el implante en una fase temprana de este proceso, considerándose candidatos a estas terapias los pacientes en INTERMACS 1-4. En el caso de que el paciente sea candidato a terapias avanzadas, la terapia de elección actual- mente es el trasplante cardíaco. El segundo paso es evaluar el riesgo del trasplante cardíaco, ya sea porque existan contra- indicaciones, o porque el tiempo en lista de espera pueda ser muy prolongado. En ambos casos se debe considerar implantar una asistencia ventricular izquierda si esta ofrece una mayor probabilidad de sobrevida. Para esto se evalúan los riesgos asociados al implante de asistencia ventricular, en particular el riesgo de falla ventricular derecha19,20. Las contraindica- ciones para el implante de una asistencia ventricular izquierda se presentan en la Tabla 3; en caso de contraindicación para ambos tipos de terapias avanzadas el paciente será candidato a cuidado paliativo.
Las contraindicaciones para el implante de una asistencia ventricular izquierda
| Falla ventricular derecha severa no secundaria a falla izquierda | Defecto septal ventricular no corregible |
| Compromiso neurológico severo | Área de superficie corporal <1,2 m2 |
| Enfermedad terminal coexistente | Pobre red de apoyo social/familiar |
| Sangrado no controlable | Enfermedades psiquiátricas o consumo de psicoactivos que imposibiliten adherencia |
| Contraindicación para anticoagulación | Infección activa |
| Cardiomiopatía hipertrófica | Insuficiencia aórtica moderada a severa o prótesis mecánica aórtica que no se pueda cambiar |
La asistencia ventricular izquierda es una terapia costosa y compleja y solo ofrece valor a la sociedad si se realiza con muy buenos resultados a largo plazo. Para conseguirlo se requiere una indicación precisa y oportuna; un proceso de optimización preoperatoria; un implante preciso de la bomba que en ocasiones incluye otras intervenciones cardíacas; un proceso postoperatorio de ajuste del sistema a la circu- lación del paciente; rehabilitación y recuperación aguda; educación del paciente y sus cuidadores; seguimiento al largo plazo para la prevención y manejo oportuno de las complicaciones y un proceso de medicina paliativa y cuidado del final de la vida.
La asistencia ventricular izquierda es un recurso valioso que, junto al trasplante cardíaco, el manejo óptimo de la falla cardíaca y al cuidado paliativo, permite prolongar la vida y mejorar la calidad de vida de los pacientes con falla cardíaca avanzada. El desarrollo de centros de excelencia permite integrar esta terapia de alto costo con la calidad necesaria para que sea valiosa para el sistema de salud en países de América Latina21,22.
Declaración de conflicto de interésLos autores declaran no tener conflictos de intereses.