La epilepsia es una alteración neurológica crónica caracterizada por crisis recurrentes. Se estima que aproximadamente el 30% de los pacientes con crisis epilépticas focales son refractarios al tratamiento médico. Las causas más comunes de epilepsia encontradas en estos pacientes corresponden a Esclerosis Temporal Mesial (ETM), Malformaciones del Desarrollo Cortical (MDC), tumores, lesiones vasculares y lesiones secuelares.
Los pilares para el diagnóstico de las epilepsias refractarias son las manifestaciones clínicas, las alteraciones electroencefalográficas y las imágenes de Resonancia Magnética (RM). El rol de las imágenes en la evaluación de estos pacientes es identificar, localizar y delimitar la extensión de la lesión subyacente, así como tratar de determinar su etiología. Se ha estimado que sólo es posible determinar la existencia de una lesión estructural subyacente en el 82-86% de los pacientes con epilepsia focal, incluso utilizando protocolos para el estudio de epilepsia.
Por lo tanto existe un grupo de pacientes con epilepsia focal refractaria al tratamiento médico que tienen RM normales, lo que se ha relacionado con un peor pronóstico post quirúrgico. Por esto se requiere de nuevos recursos para la identificación de alteraciones subyacentes en este grupo de pacientes, quienes frecuentemente tienen displasias corticales, ETM o lesiones secuelares pequeñas.
Necesitamos nuevas técnicas para aumentar la visualización de las lesiones, como la búsqueda de signos radiológicos clásicos con software de post proceso, mediante la localización de las áreas de pérdida de diferenciación de la unión córticosubcortical y aumento del espesor cortical.
Las imágenes cuantitativas T2 permiten determinar características específicas e invariables de los tejidos, que ayudan a la detección de alteraciones sutiles de la intensidad de señal. La volumetría se utiliza especialmente para la determinación cuantitativa de volúmenes hipocampales, en los casos de lesiones unilaterales leves o lesiones bilaterales que son difíciles de evaluar visualmente.
Las imágenes de RM funcional permiten la localización de las áreas elocuentes, especialmente para funciones motoras, visuales y de lenguaje.
Las imágenes con Tensor de Difusión hacen posible le visualización de los tractos y su relación con las lesiones epileptogénicas.
Las imágenes durante la cirugía permiten la integración de toda la información, que puede ser de ayuda para la determinación de los límites de la resección y localización de las áreas elocuentes. La ecografía intraoperatoria muchas veces es muy útil para determinar la extensión de las lesiones.
Epilepsy is a chronic neurological condition characterized by recurrent convulsive seizures. Approximately 30% of patients with focal seizures are refractory to medical treatment. The most frequent etiologies of epilepsy include Mesial Temporal Sclerosis (MTS), Developmental Cortical Malformations, tumors, vascular and scar lesions. The diagnostic keys for refractory epilepsy are the clinical manifestations, Electroencephalography (EEG) alterations and Magnetic Resonance Imaging (MRI) findings. The primary purpose of the imaging evaluation of these patients is to localize, characterize and determine the extension of the lesion and also attempt to determine its etiology. It is estimated that it is possible to determine the presence of a structural lesion in approximately 82 – 86% of the patients with focal epilepsy, even if an advanced MRI sequences are utilized. Therefore, there is a group of patients with focal epilepsy refractory to medical treatment that have a normal MRI exam, which is associated with a poorer post surgical prognosis. That is why there is a need for new tools to identify underlying abnormalities in this group of patients, which frequently have cortical dysplasia, MTS, or small scar lesions.
We need new imaging techniques utilizing post processing software to better visualize focal cerebral lesions such as classic imaging signs of the loss of the grey and which matter differentiation and enlarged cortical mantel thickness. Quantitative T2 imaging permits a better characterization of the brain tissues and helps identify subtle focal signal abnormalities. Volumetric analysis is utilized specially to quantify de hippocampus volumes in cases of mild unilateral lesions or bilateral lesions difficult to determine by visual inspection.
Functional MRI imaging permits to localize the eloquent areas of the brain, especially the motor, visual and language regions. Diffusion Tensor imaging permits the characterization of the axonal tracts in the brain and its relationship to the epileptogenic lesion.
Imaging during epilepsy surgery permits the integration of all the information and may be helpful to determine the resection margins and determine eloquent cerebral regions. Intraoperative ultrasound many times is helpful to determine the extension of the brain lesion.
La epilepsia es una alteración neurológica crónica caracterizada por crisis recurrentes generadas por descargas eléctricas anormales de las neuronas corticales. Desde el punto de vista clínico se clasifican en epilepsias generalizadas y epilepsias focales.
Se estima que aproximadamente el 30% de los pacientes con crisis epilépticas focales son refractarios al tratamiento médico, representando un gran desafío para los equipos médicos.
Las causas de epilepsia refractaria varían según el grupo etario, siendo en adultos las más frecuentes: ETM, MDC, tumores cerebrales, lesiones vasculares y lesiones secuelares, tanto traumáticas como isquémicas (1, 2). Los pilares para el diagnóstico de las epilepsias refractarias son las manifestaciones clínicas, las alteraciones electroencefalográficas (EEG) y las imágenes RM.
El rol de las imágenes en la evaluación de estos pacientes puede resumirse en:
- 1.
Identificar una lesión subyacente
- 2.
Establecer su localización
- 3.
Delimitar su extensión
- 4.
Determinar su etiología.
La RM es una de las técnicas radiológicas que más desarrollo ha tenido desde su inicio a fines de la década del 70, alcanzando un rol fundamental en el estudio de los pacientes epilépticos.
En la época previa a la RM, el diagnóstico de ETM se establecía por medio de las alteraciones del EEG y la confirmación histológica postcirugía. La primera generación de imágenes de RM utilizando protocolos estándares de cerebro hizo posible identificar lesiones estructurales como causa de las crisis epilépticas con una sensibilidad de aproximadamente un 40% (3).
A partir de 1995, en los principales centros a nivel mundial aparece una segunda generación de imágenes de RM (4), que establece la utilización de protocolos dirigidos a estudiar las principales causas de epilepsia, consistente en imágenes coronales T2 con alto contraste y orientadas perpendicularmente al eje del hipocampo, además de imágenes volumétricas ponderadas en T1 de alta resolución espacial a nivel de todo el encéfalo. Esto hizo posible el diagnóstico de ETM con una sensibilidad que excede el 90% (5).
Sin embargo, debemos considerar que la RM no es una técnica infalible. Utilizando resonadores convencionales sólo es posible visualizar cierto tipo de lesiones. Se ha estimado que sólo es posible determinar la existencia de una lesión estructural subyacente en el 71% de los pacientes con epilepsia refractaria (6). Existe entonces un grupo de pacientes con epilepsia refractaria a tratamiento médico, con RM normales o con alteraciones sutiles no categóricas, incluso utilizando protocolos de epilepsia.
La necesidad de nuevos recursos para la identificación de alteraciones subyacentes, cuando la anatomía ya no entrega más información, abre paso a la fisiología. Las imágenes funcionales evalúan diferentes procesos cerebrales, tales como el movimiento de las moléculas de agua en las imágenes de difusión (DWI); la desoxigenación de la hemoglobina en los casos de RM funcional (RMf); o la ocupación de la glucosa en los casos de Tomografía por Emisión de Positrones (PET) (7).
Las imágenes funcionales han tenido éxito en la obtención de nuevas formas de contraste entre el parénquima cerebral normal y las lesiones. Las expectativas con respecto a su rendimiento se han extendido a las áreas de la memoria y del lenguaje.
Teniendo en cuenta la multiplicación de los recursos de imágenes producida por el avance de las técnicas, se considera que serán estas otras modalidades de imágenes y posiblemente la combinación de estas técnicas las que permitan avanzar en la identificación de lesiones subyacentes.
El informe radiológicoLa opinión experta sobre los hallazgos imaginológicos queda plasmada en el informe radiológico, donde se deberá consignar si se trata de un examen anormal, si existen alteraciones sospechosas o si se trata de un examen sin alteraciones.
Dependiendo de las características técnicas de los equipos, del protocolo utilizado, de la experiencia del radiólogo y de la calidad de las imágenes, el informe puede ser muy variable. Es importante que las imágenes sean revisadas en el contexto de las manifestaciones clínicas y los hallazgos en el EEG, además de la eventual presencia de otras alteraciones. Aunque sea detectada una lesión cuyas imágenes se correspondan con las alteraciones clínicas, es necesario considerar la posible existencia de una segunda lesión, especialmente en los casos de ETM.
La mención de hallazgos sospechosos que puedan correlacionarse con las alteraciones clínicas, es de la mayor trascendencia y debiera ser la meta y razón del estudio.
Estructura del cerebro normal en resonancia magnéticaEl parénquima cerebral se encuentra constituido principalmente por neuronas, células gliales y vasos sanguíneos, que en conjunto otorgan una estructura e intensidad de señal características del parénquima cerebral normal.
El cerebro y especialmente la corteza cerebral tienen una estructura altamente compleja. Esta organización corresponde a capas neuronales, cuya diferenciación está fuera del alcance de la RM convencional, que la representa como una monocapa homogénea que mide entre 3 y 5 mm de espesor (Figura 1).
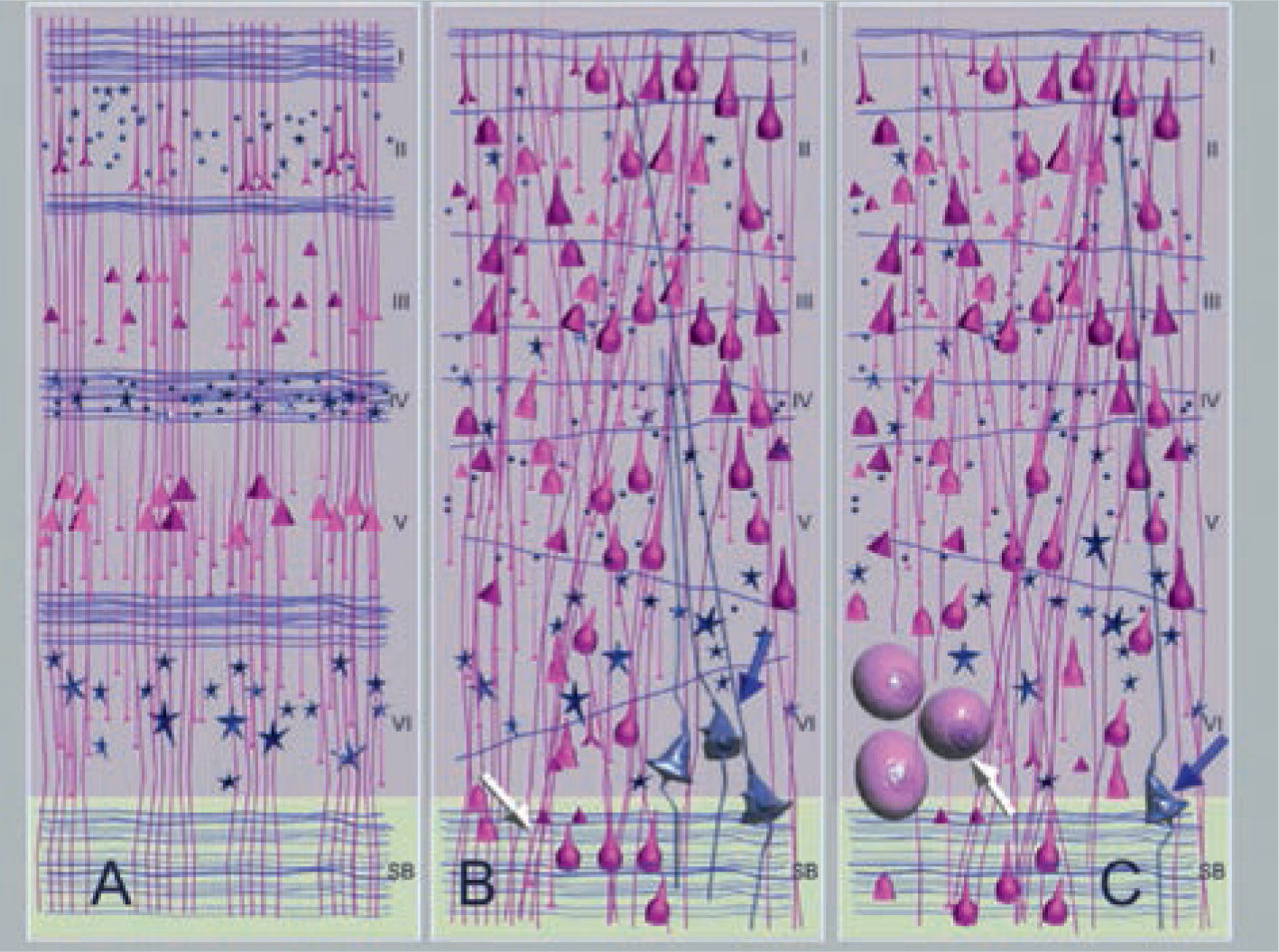
Representación esquemática del patrón histológico de las multicapas de la corteza cerebral y de la unión cortico subcortical. (A) En el cerebro normal la corteza presenta una estructura organizada en 6 capas. (B) En la displasia cortical IIA, se observa una pérdida de la estructura y presencia de células dismórficas anormales (flechas), en la unión ente la sustancia gris y la sustancia blanca que produce borrosidad en sus límites. (C) En la displasia cortical tipo IIB se observa la presencia de células valonadas o en globo “Ballon cells” (Reproducido con autorización de Revista Chilena de Radiología. 2009; 15(3)).
Sin embargo, las lesiones estructurales producen alteraciones en la composición del tejido cerebral, que hacen posible su reconocimiento en los protocolos de epilepsia.
Es posible aumentar la señal mediante el aumento de la potencia del magneto, utilizando por ejemplo resonadores de 8 Tesla, obteniendo imágenes en las cuales la corteza se visualiza como una estructura trilaminar, pero actualmente su uso actual está reservado a la investigación (8).
Rol de las imágenes1Identificación de una lesión subyacenteLa visibilidad se entiende como la capacidad de representar mediante imágenes una lesión localizada en el interior del parénquima cerebral. En el caso de las imágenes de RM convencional, esta diferencia corresponde a la diferencias en los tiempos de relajación de los protones de hidrógeno. La visibilidad de la lesión corresponde entonces a la diferenciación de ésta con respecto al cerebro normal. La definición de los límites está determinada por el grado de contraste de la señal.
La visibilidad de las lesiones depende de la alteración de la estructura cerebral y de la repercusión en la intensidad de la señal, hecho que se ha atribuido a la desorganización de la corteza cerebral, a la presencia de neuronas ectópicas en la sustancia blanca subcortical y áreas de gliosis. Si la lesión no altera significativamente la estructura del parénquima cerebral en relación a la cantidad de mielina o agua intraparenquimatosa, es poco probable que podamos demostrar cambios de señal que hagan posible visualizar estas áreas como anormales.
La visibilidad de las lesiones en las imágenes de resonancia es uno de los factores fundamentales en el pronóstico post operatorio de los pacientes. El pronóstico no es tan favorable cuando las imágenes de RM no muestran alteraciones. Según Tatum y colaboradores, el pronóstico postquirúrgico de los pacientes con epilepsia temporal y RM normal es sólo de un 56% libre de crisis, menor al demostrado cuando la RM es positiva (9). Sólo el 60% de pacientes tratados quirúrgicamente por epilepsia refractaria con foco temporal y RM con “Protocolo de Epilepsia” normal quedaron libre de crisis en el estudio de Bell y colaboradores (Clase I de Engel) (10). Wetjen por su parte constató que en los pacientes tratados quirúrgicamente por epilepsia refractaria con foco extratemporal y RM normal, sólo un 35,7% de los pacientes quedaron libre de crisis (11), datos coincidentes con los resultados obtenidos por Jeha en pacientes con epilepsia del lóbulo temporal (12) y con el reporte de Mosewich, donde los pacientes sometidos a cirugía por epilepsia del lóbulo frontal tuvieron un pronóstico favorable en el 72% de los pacientes en que la lesión era visible, versus un 41% de los pacientes en que las imágenes eran normales (13).
a)Alteraciones estructuralesAún cuando se han descrito estudios anatomopatológicos totalmente normales en algunos casos de pacientes con epilepsia refractaria y hallazgos focales en el EEG, la mayor parte de los pacientes tiene una alteración estructural subyacente demostrada en la biopsia operatoria. La existencia de crisis que no se generen en una alteración estructural demostrada es una situación infrecuente. Cuando los hallazgos son contradictorios la instalación de electrodos invasivos puede ser de ayuda.
b)Lesiones sutilesExisten algunas lesiones que se expresan como alteraciones sutiles que pueden ser fácilmente omitidas durante la evaluación, como son las displasias corticales, la ETM, la esclerosis tuberosa frustra, la polimicrogiria y el encefalocele temporal.
En algunos pacientes estas lesiones pueden corresponder sólo a leves asimetrías de los hipocampos o del patrón de los giros corticales, por lo que es indispensable contar con la información volumétrica, para revisar la anatomía en los tres planos ortogonales o realizar reconstrucciones paralelas a la superficie cortical.
Las lesiones de más difícil diagnóstico, como es el caso de las displasias corticales o ETM, corresponden a un espectro continuo de alteraciones, que van desde las alteraciones evidentes a imágenes prácticamente normales. Esta variabilidad justifica la incorporación de imágenes adicionales. La presencia de un hallazgo sospechoso que tenga correlación con las manifestaciones clínicas y eléctricas requiere de estudio adicional.
c)El paciente con RM normalDurante muchos años se ha seguido el paradigma que “el diagnóstico radiológico más exacto es aquel que más se parece a los hallazgos de pieza operatoria”. Sin embargo, en epilepsia refractaria existe un grupo de pacientes con alteraciones anatomopatológicas categóricas, pero con exámenes completamente normales.
Los pacientes con epilepsia refractaria y RM con protocolo de epilepsia sin hallazgos patológicos visibles probablemente presentan una ETM leve o sutil, especialmente en los casos de lesiones bilaterales, displasias corticales o pequeñas lesiones secuelares inespecíficas. Sin embargo, en otras ocasiones no es fácil visualizar lesiones muy pequeñas o sutiles, como algunas displasias corticales tipo I, polimicrogirias focales o heterotopías periventriculares. En estos casos, los exámenes frecuentemente son reportados como normales.
Este subgrupo de pacientes es el que requiere de imágenes avanzadas y/o técnicas cuantitativas que permitan demostrar las alteraciones más sutiles. Los intentos para mejorar la visualización de las lesiones deben estar dirigida a los pacientes con alteraciones sutiles o con exámenes normales, enfocándonos a las localizaciones guiados por las manifestaciones clínicas, alteraciones eléctricas y últimamente con las imágenes del PET.
Para el año 2013, estamos en condiciones de ofrecer una “tercera generación de imágenes”, para este 20-30% de pacientes con epilepsia refractaria y resonancias magnéticas con “protocolo de epilepsia” con hallazgos sutiles o totalmente normales.
2Localización de la lesión subyacenteUna vez determinada la presencia de una lesión subyacente, la ubicación que ésta tiene en el cerebro merece una importante consideración.
En general las lesiones extratemporales son de más difícil manejo, con peor pronóstico en comparación con las de localización temporal y una posibilidad de quedar libre de crisis menor al 50% después de la cirugía (14).
3Extensión de la lesión subyacenteLos mejores resultados quirúrgicos se logran en aquellas lesiones que presentan límites bien definidos, que permiten su resección completa. Algunas lesiones, como las neoplasias de bajo grado y lesiones vasculares como cavernomas, tienen contornos bien definidos que hacen más fácil determinar su extensión; por lo tanto, realizar una resección completa de la lesión es más factible que en los casos de lesiones mal definidas. Debido a esto, este tipo de lesiones tiene una posibilidad de hasta un 80% de quedar libre de crisis en el caso de los tumores de bajo grado (15) y cercana al 100% en el caso de los cavernomas (16).
4EtiologíaLa naturaleza de la lesión subyacente en pacientes con epilepsia refractaria tiene gran impacto en el pronóstico. En el grupo de pacientes con exámenes sospechosos o negativos, las displasias corticales y la ETM corresponden a los hallazgos histopatológicos más frecuentemente encontrados (17).
Las displasias corticales corresponden a un grupo heterogéneo de MDC (18, 19), secundarias a una lesión ocurrida durante los períodos de proliferación u organización cortical (Figura 1). Aunque su etiología no se encuentra completamente dilucidada, estas lesiones presentan neuronas y células gliales anormales en una región de la corteza cerebral (Figura 2). Clínicamente se caracterizan por una menor respuesta al tratamiento médico. En la actualidad, éstas son reconocidas como la causa frecuente de epilepsia refractaria en pacientes sometidos a cirugía (20).
Representación esquemática de algunas manifestaciones radiológicas de las displasias corticales: (A) Engrosamiento cortical focal. (B) Aumento de señal de la corteza cerebral. (C) Pérdida de la diferenciación entre la corteza y la sustancia blanca. (D) Aumento de la señal subcortical.
El hipocampo es una estructura arquitectónicamente compleja, generada por el enrollamiento de la corteza cerebral y la sustancia blanca sobre sí misma (Figura 3). La ETM tiene una apariencia característica con atrofia unilateral del hipocampo, debida principalmente a atrofia del segmento CA1, que produce un aumento de la señal en T2, producto de la gliosis con pérdida neuronal y a la pérdida de la arquitectura interna, con la consiguiente menor diferenciación de la sustancia gris y sustancia blanca; la RM tiene una sensibilidad entre 75 y 90% para su detección. Los mejores resultados se obtienen en casos de ETM unilateral, con RM y estudio EEG concordantes. Los pacientes con ETM tienen un muy buen pronóstico postquirúrgico con hasta 80% de pacientes libre de crisis a l año y un 66% a largo plazo, lo que tiene un impacto muy significativo en la calidad de vida de estos pacientes (21).
5Concordancia de los hallazgosLos mejores resultados post quirúrgicos se obtienen cuando existe una completa concordancia entre las manifestaciones clínicas, las alteraciones en el EEG y los hallazgos imaginológicos. El 77% de los pacientes con ETM unilateral, con clínica y EEG concordantes, quedan libres de crisis (22).
Participación de las imágenes en el fracaso de la cirugíaLa mayor parte del fracaso de las cirugías de epilepsia se produce por la resección incompleta de las lesiones o por la aparición de un segundo foco epileptógeno en otra localización. La resección parcial de una lesión deja en evidencia el hecho que, a pesar de ser capaces de visualizar y localizar una lesión subyacente, no siempre es posible determinar su extensión exacta.
La aparición de un nuevo foco es un hecho frecuente como causa de un resultado quirúrgico desfavorable. Incluso aquellos pacientes con lesiones epileptógenas clásicas como ETM o cavernomas pueden tener nuevas crisis, con focos aparecidos en cualquier otra parte del cerebro. El sitio más frecuente de recurrencia, después de una resección temporal, es la región neocortical, que frecuentemente aparece normal en las imágenes de RM (23).
Técnicas para aumentar la visibilidad de las lesionesDebido a que es un hecho que el pronóstico de los pacientes mejora cuando se logra determinar la localización de la lesión subyacente, la necesidad de reclutar nuevas técnicas orientadas a mejorar la visualización de alteraciones es apremiante para la radiología.
Aún cuando no es posible asegurar que hacer visible una lesión en este grupo de pacientes iguales su pronóstico con aquellos pacientes con lesiones obvias en RM, persiste la búsqueda de alternativas para obtener demostración de las lesiones por métodos indirectos.
Estas imágenes se alejan de los procedimientos estándar y representan una tercera generación de imágenes, cuyo único objetivo es aumentar la detección de lesiones sutiles o no visibles en las imágenes de RM de segunda generación.
Las técnicas actualmente disponibles para aumentar la visualización de las lesiones corresponden a:
- 1.
Búsqueda de los signos radiológicos clásicos con software de post proceso
- 2.
Imágenes cuantitativas T2
- 3.
Volumetría
- 4.
Tomografía computada de positrones (PET)
- 5.
Resonancia magnética funcional
- 6.
Imágenes de difusión
- a.
Anisotropía
- b.
Tractografía (DTI)
- c.
Direccionalidad
7. Imágenes durante la cirugía
- a.
El primer esfuerzo en esta línea ha estado puesto en insistir en el reconocimiento de los signos radiológicos convencionales utilizando software computacional, que permitan el post-proceso de las imágenes, potenciando la aparición de estos signos.
Así por ejemplo, las imágenes ponderadas en T1 con alta resolución espacial enfatizan la pérdida de la definición de la unión córtico subcortical y el engrosamiento cortical
aPérdida de la diferencia entre la corteza y la sustancia grisLas imágenes potenciadas en T1 establecen una diferencia entre la sustancia blanca, con alta señal otorgada por su contenido graso (mielina) y la corteza cerebral, esta última con señal intermedia, determinada principalmente por la presencia de una gran cantidad de cuerpos neuronales. Estas imágenes se utilizan para demostrar alteraciones de la macro-arquitectura cerebral, como es la pérdida de la definición entre la sustancia blanca y la sustancia gris.
Se requiere además que estas imágenes tengan alta resolución espacial, entendiendo como resolución la capacidad para distinguir entre dos puntos muy próximos uno a otro. La resolución de las imágenes volumétricas T1 es de aproximadamente 1 mm y es isométrica en todos sus sentidos, por lo que es posible reconstruirla en todos los planos.
Los software de post-proceso permiten realizar segmentación automática de la corteza cerebral, núcleos grises y sustancia blanca, a través de lo cual es posible mejorar la visualización de algunas lesiones sospechosas o que no son evidentes en las imágenes convencionales. La segmentación de la corteza cerebral realizada por el software requiere primero limitar la unión córtico-subcortical, que en condiciones normales se encuentra bien demarcada.
En los casos de displasia corticales o de lesiones secuelares la pérdida de la diferenciación entre la corteza y la sustancia blanca produce una falla en la segmentación que puede traducirse en una disminución (Figura 4 y 5) o aumento (Figuras 6 y 7) del espesor cortical. La pérdida de diferenciación entre la corteza y la sustancia blanca puede ponerse de manifiesto utilizando imágenes (IR y T2) que acentúen la visualización de la transición entre estas estructuras (Figura 8, 9 y 10).
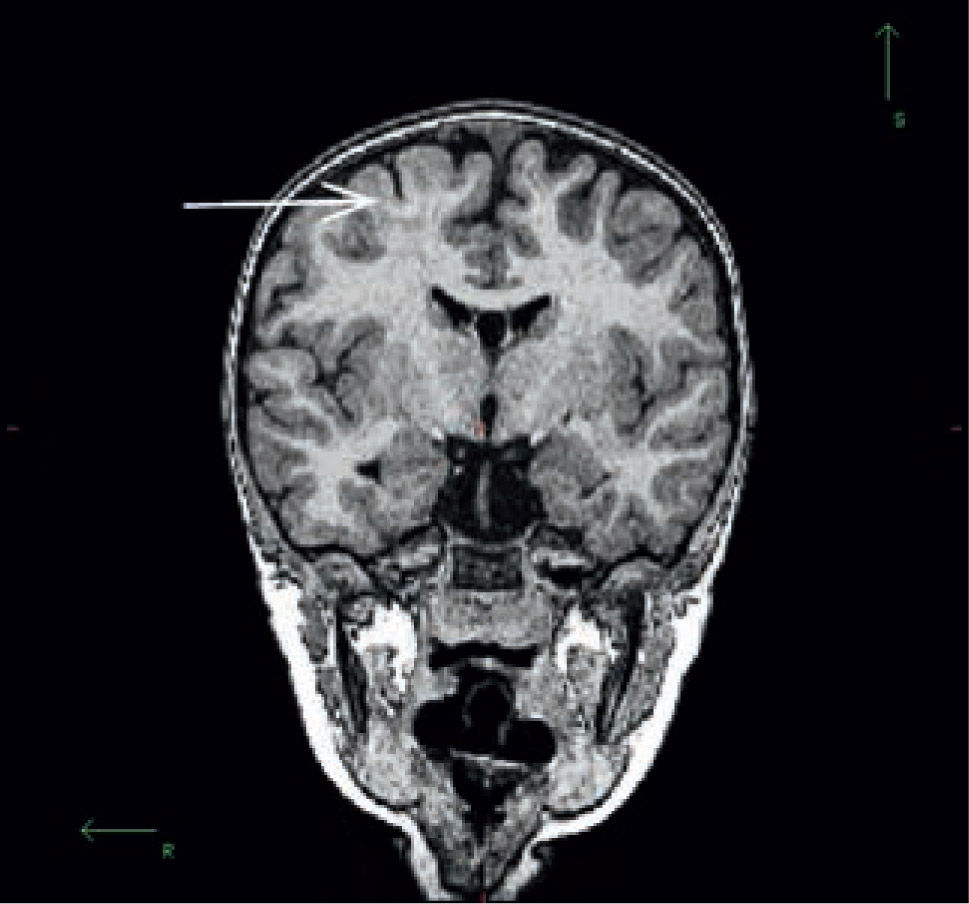
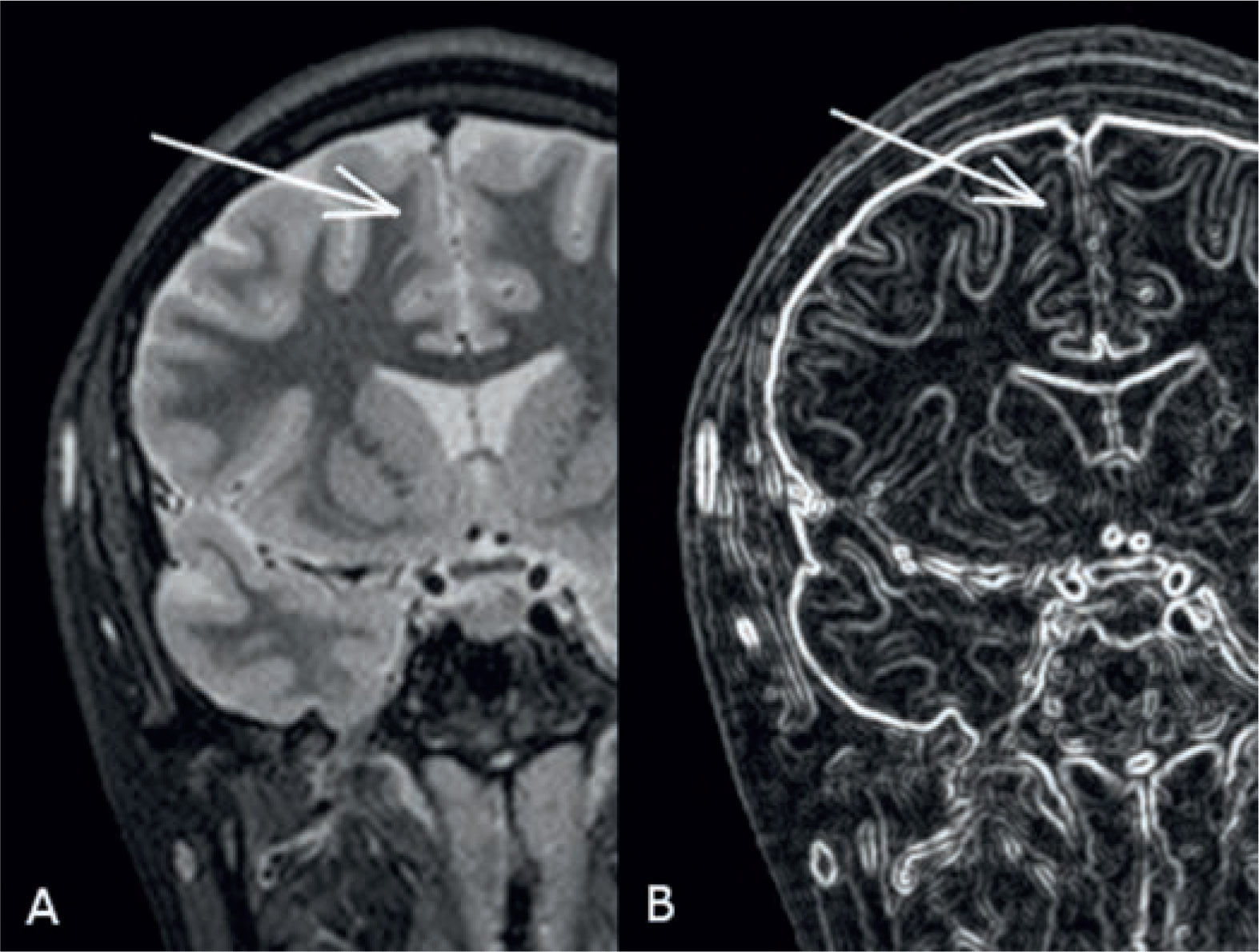
Paciente con displasia cortical. Imagen coronal potenciada en T1 de alta resolución, segmentada. (FreeSurfer, Martinos Center for Biomedical Imaging, v4.5.0). Pseudo adelgazamiento focal de la corteza frontal, secundario a la falta de diferenciación entre la corteza y la sustancia blanca (flecha).
Paciente con displasia cortical. Imagen coronal potenciada en T1 de alta resolución, segmentada. (FreeSurfer, Martinos Center for Biomedical Imaging, v4.5.0). La pérdida de la diferenciación entre la corteza y la sustancia blanca hace que el software interprete que la corteza cerebral es de mayor espesor al real lo que se designa como un pseudo-engrosamiento cortical. Pseudo-engrosamiento cortical a nivel de la parte más baja del giro temporal inferior izquierdo (flecha).
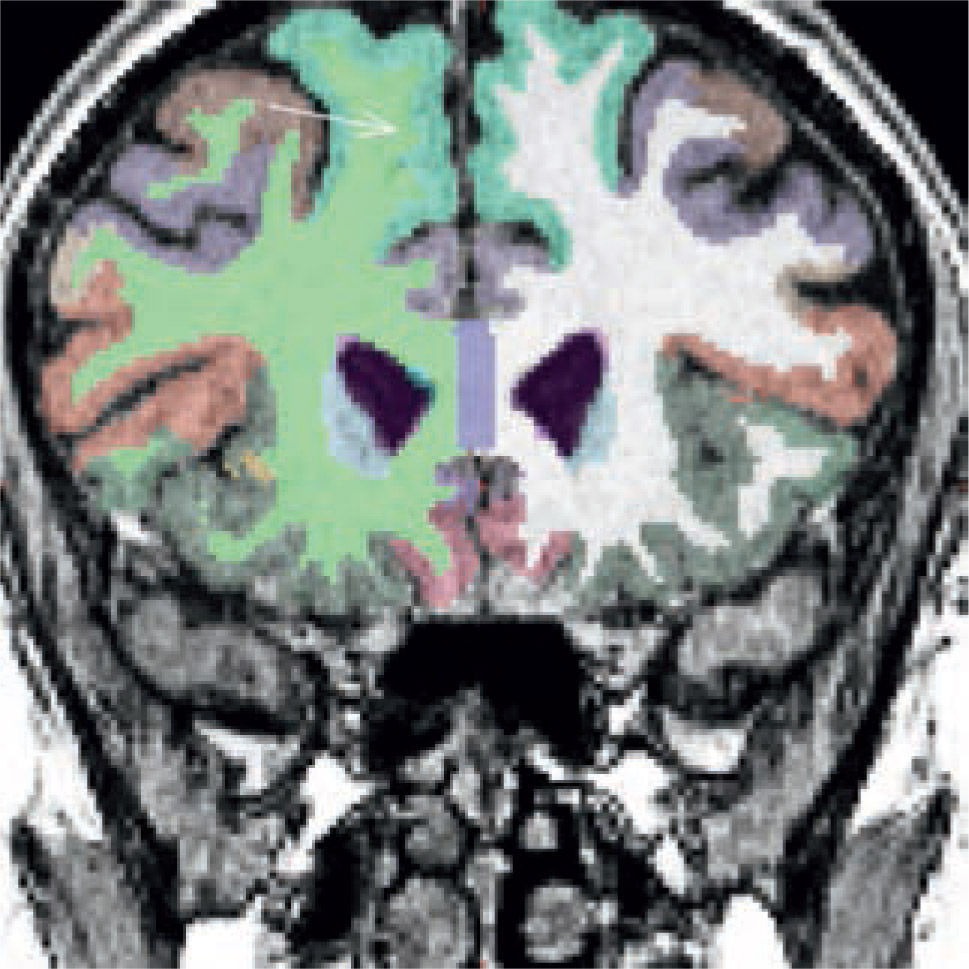
Paciente con displasia cortical. Imagen transversal potenciada en T1 de alta resolución, segmentada. (FreeSurfer, Martinos Center for Biomedical Imaging, v4.5.0) Pseudo-engrosamiento cortical (flecha) por pérdida de la diferenciación entre la corteza y la sustancia blanca. La totalidad de la parte baja del temporal se segmenta junto a la corteza adyacente. Por transparencia, pueden reconocerse los límites anatómicos de la sustancia blanca subcortical.
Paciente con crisis focales frontales bilaterales. (A) Imagen coronal STIR (Short tau Inversion Recovery), que demuestra pérdida de la definición entre la corteza y la sustancia blanca subcortical frontal a nivel medial bilateral (flecha). (B) Imagen de post-proceso con realce de los bordes de transición, que muestra borrosidad focal de la unión entre sustancia blanca y corteza.
Imagen de Figura 9 coronal potenciada en T1 de alta resolución, segmentada, magnificada. (FreeSurfer, Martinos Center for Biomedical Imaging, v4.5.0) Pseudo-engrosamiento cortical frontal medial bilateral. Se puede comparar con el resto de la corteza de espesor normal.
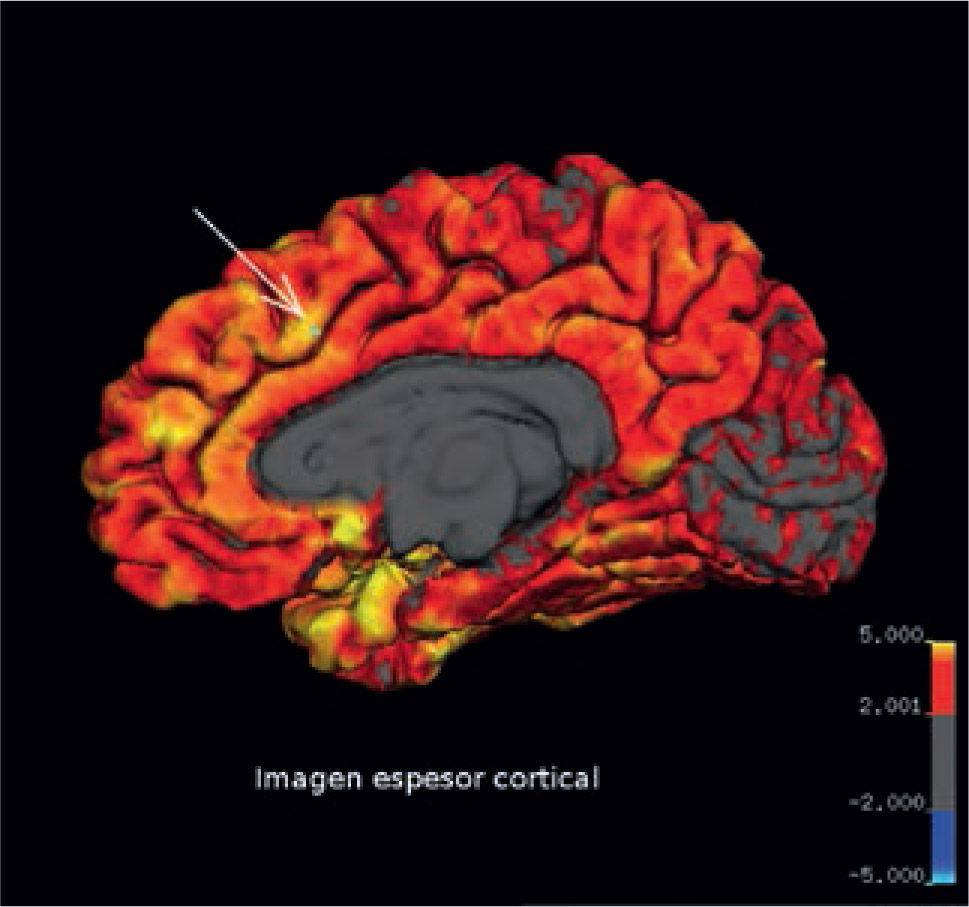
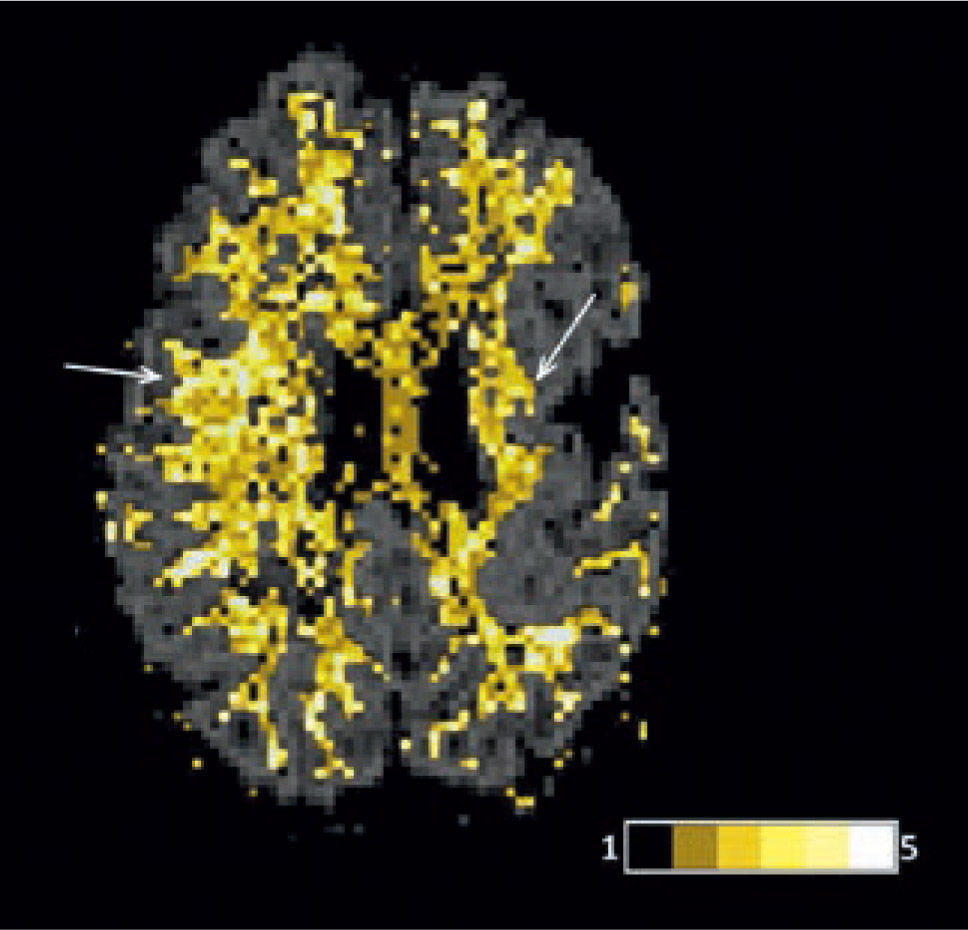
La corteza cerebral presenta un espesor cortical promedio menor de 5 mm. Esta información se visualiza mediante una escala de colores sobrepuesta a la superficie cerebral. El aumento de espesor evidenciado por los software de post-proceso puede corresponder a un engrosamiento verdadero o a un pseudo engrosamiento, producido por falta de diferenciación entre la corteza y la sustancia blanca (Figuras 11 y 12). La información del espesor cortical puede ser también correlacionada con las alteraciones demostradas por otras técnicas como el PET (Figura 13).
Imagen de grosor cortical (FreeSurfer, Martinos Center for Biomedical Imaging, v4.5.0). La corteza normalmente tiene un espesor menor de 5 mm. Nótese a derecha, en la región frontal, que la zona medial anterior tiene valores altos de espesor, debido a pseudo-engrosamiento cortical.
Las imágenes potenciadas en T2 se caracterizan por una alta resolución de contraste que corresponde a la capacidad para demostrar diferencia de señal entre dos tejidos. Estas se utilizan principalmente para determinar alteraciones de la señal del parénquima cerebral anormal.
En condiciones normales los axones neuronales se encuentran recubiertos por mielina, que debido a su alto contenido graso presentan una muy baja señal en las imágenes ponderadas en T2, mientras que la corteza cerebral, debido a la presencia de los núcleos neuronales y a la ausencia de mielina, tiene una señal intermedia.
La alteración de la microestructura de la sustancia blanca, la presencia de células anormales, gliosis o edema producen un cambio cualitativo de la señal en las imágenes ponderadas en T2, la que tiende a aumentar a nivel de las lesiones (Figura 14). Las lesiones que producen sólo una leve alteración de la microestructura de la sustancia blanca, pueden pasar desapercibidas en las imágenes convencionales. Es por esto que se requiere de imágenes que permitan una evaluación cuantitativa de la intensidad de señal.
Las imágenes cuantitativas T2 requieren de múltiples imágenes con diferente potenciación para determinar los tiempos T2. El tiempo T2 es la propiedad física que es propia de cada uno de los tejidos y permite hacer estimaciones cuantitativas de las imágenes (24). Este análisis permite determinar lesiones que son sutiles o prácticamente invisibles para el ojo humano.
3Imágenes volumétricasLa ETM se caracteriza por una disminución del volumen hipocampal, que generalmente es evidente en las imágenes convencionales. Sin embargo, las dificultades se producen en los casos leves, donde sólo existe una discreta disminución de volumen o en lesiones bilaterales simétricas, difíciles de detectar para el ojo humano (Figuras 15 y 16).
La utilización de métodos cuantitativos en la evaluación del volumen hipocampal tiene una leve ventaja sobre los métodos visuales, ya que la sensibilidad utilizando métodos visuales se ha estimado en 80-90% versus un 90-95% utilizando métodos cuantitativos. El método visual requiere de más de un 15% de disminución del volumen para ser detectable (25).
bLesiones bilateralesSe ha determinado que, desde el punto de vista patológico, el 40% de los pacientes con ETM tienen una alteración anatomopatológica contralateral a la lesión evidente (26). Sin embargo, esto sólo es posible de demostrar entre un 10-20% de los pacientes mediante estudios volumétricos. Las imágenes volumétricas pueden ser comparadas con una base de individuos normales, lo que representa una ventaja en lesiones de este tipo.
4Tomografía por Emisión de Positrones (PET)El PET es una imagen funcional que ha ayudado a aumentar la detección de lesiones y determinar su localización, especialmente en los pacientes que tienen RM normal o con hallazgos dudosos. Tiene una resolución espacial de 4 a 8 mm y una resolución temporal de aproximadamente 40 minutos.
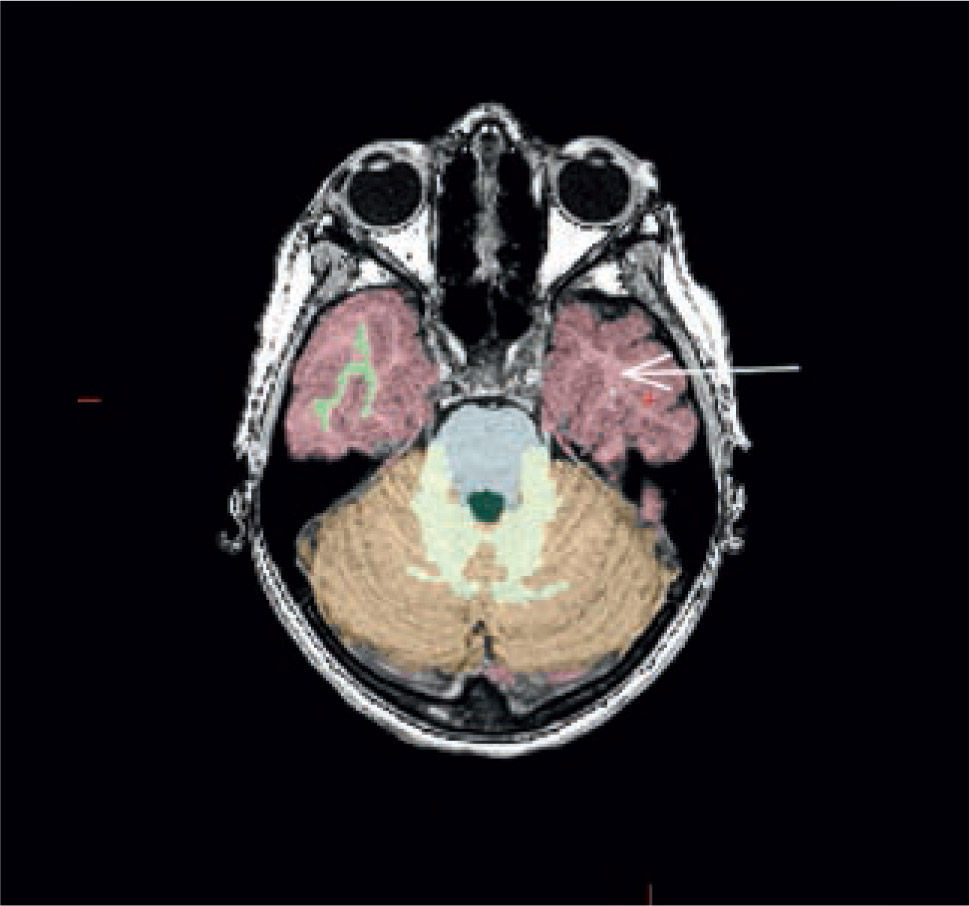
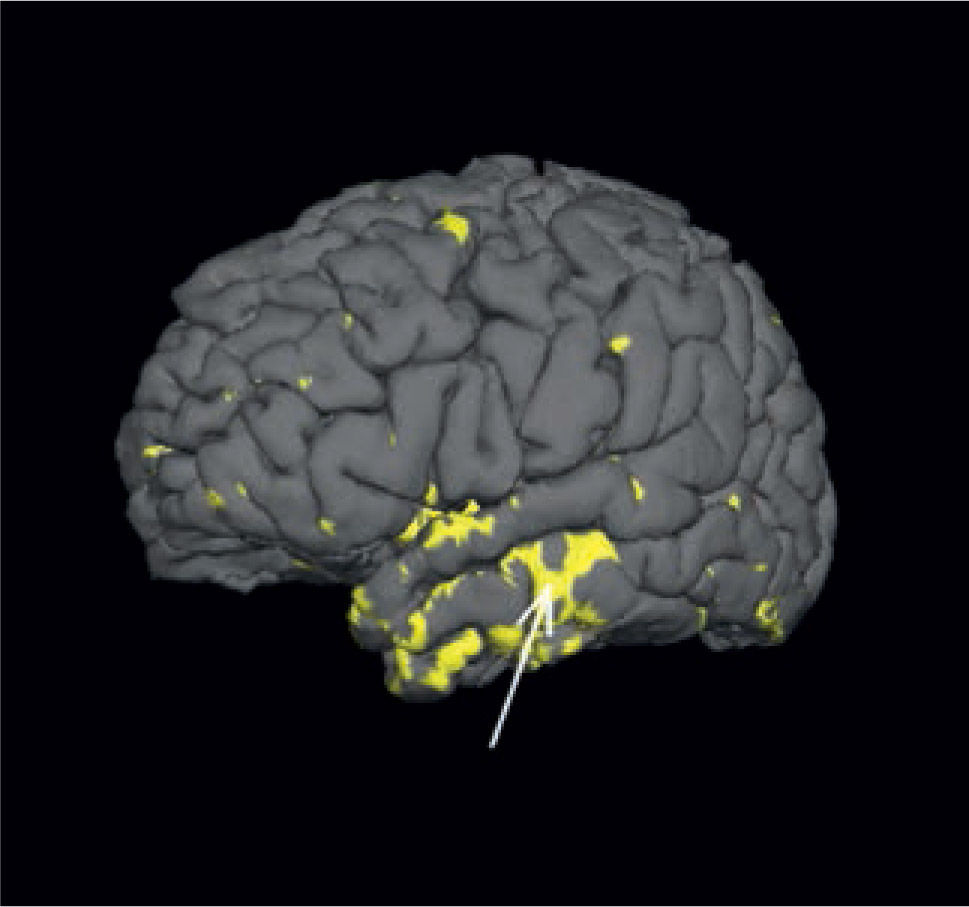
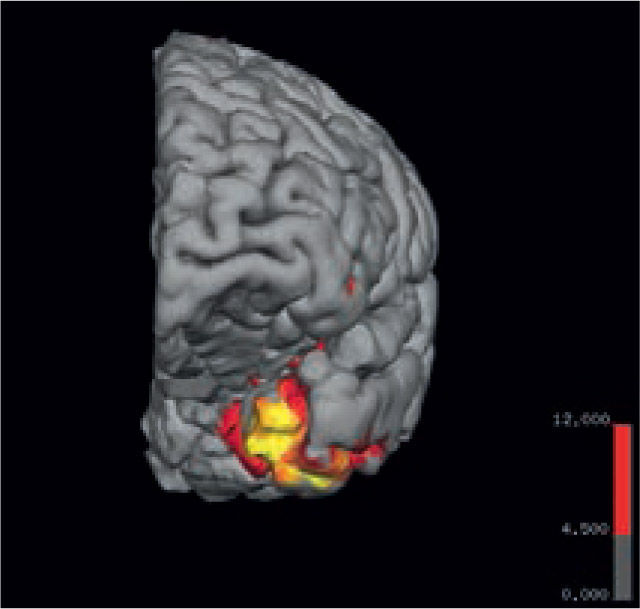
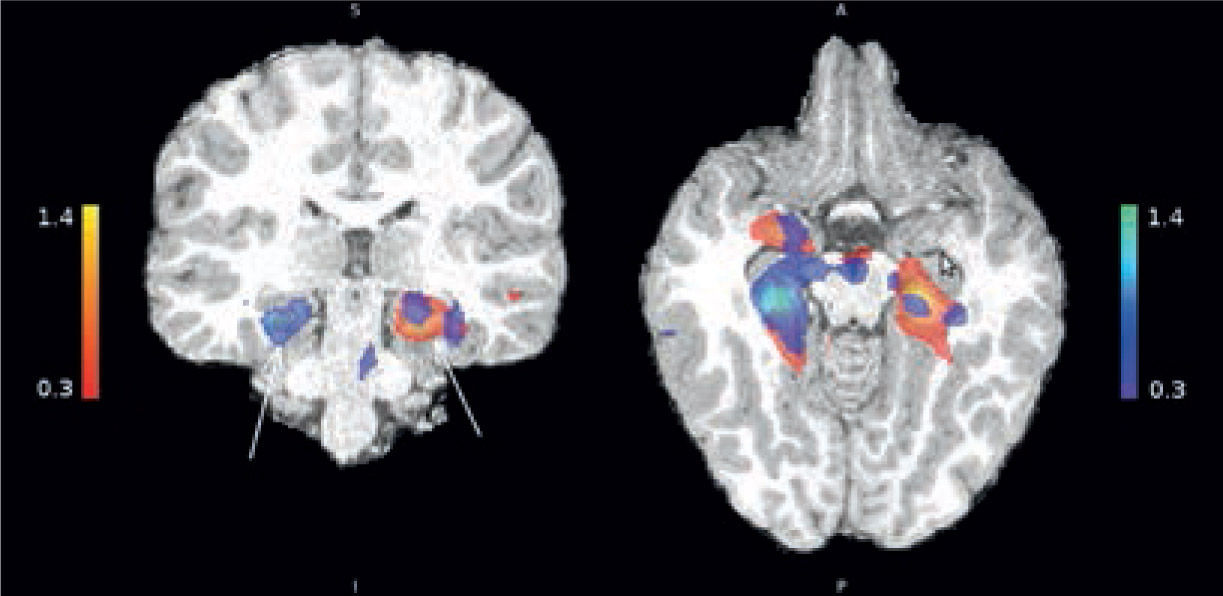
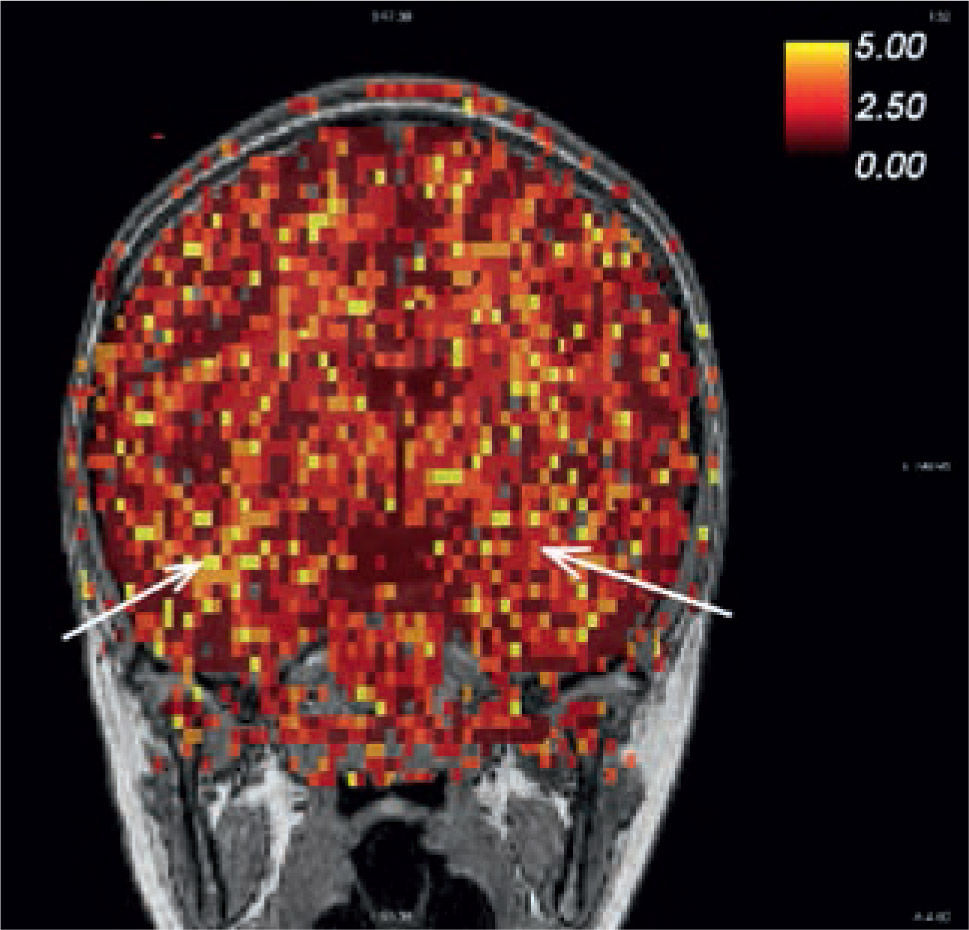
La fusión de las imágenes PET-CT con RM otorgan la posibilidad de buscar dirigidamente alteraciones en la RM que pudieran pasar desapercibidas en una evaluación inicial (Figuras 17 y 18), por lo que se considera como una modalidad de gran utilidad en la planeación de la resección quirúrgica.
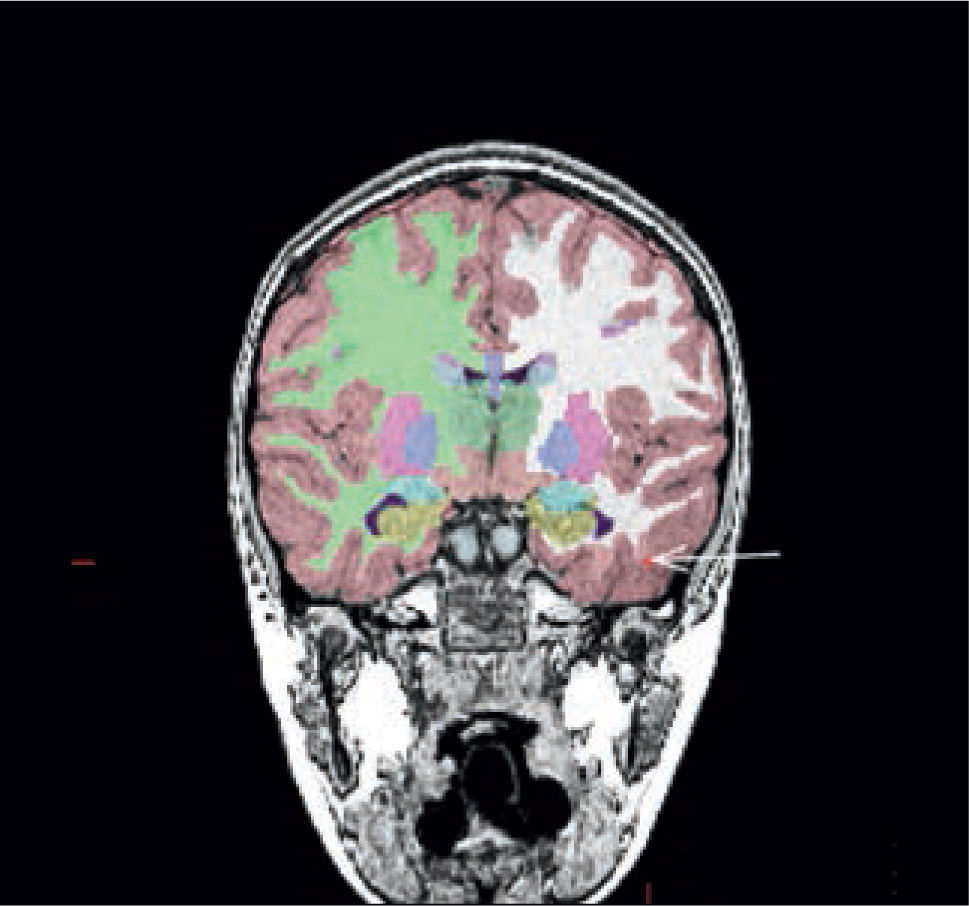
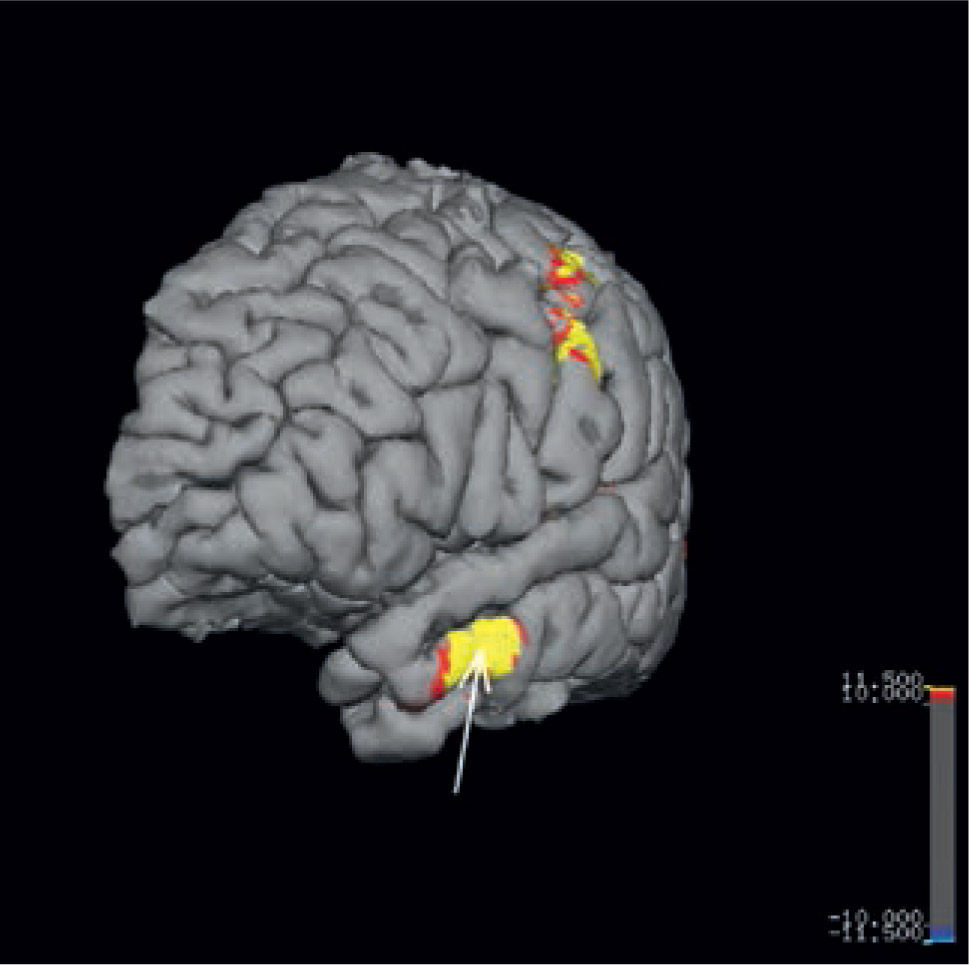
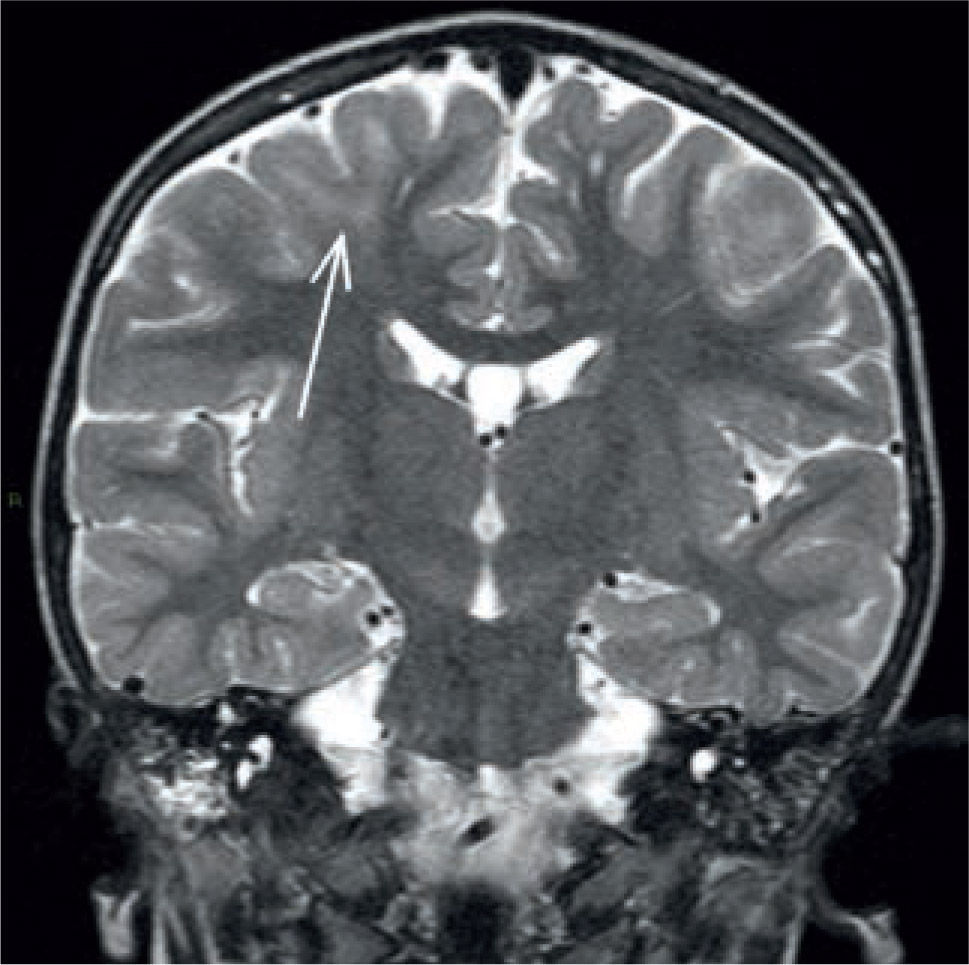
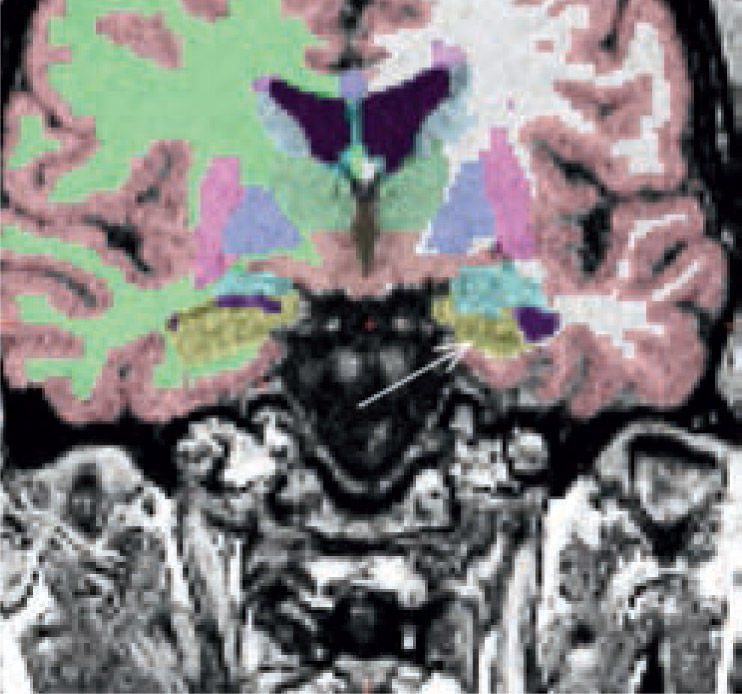
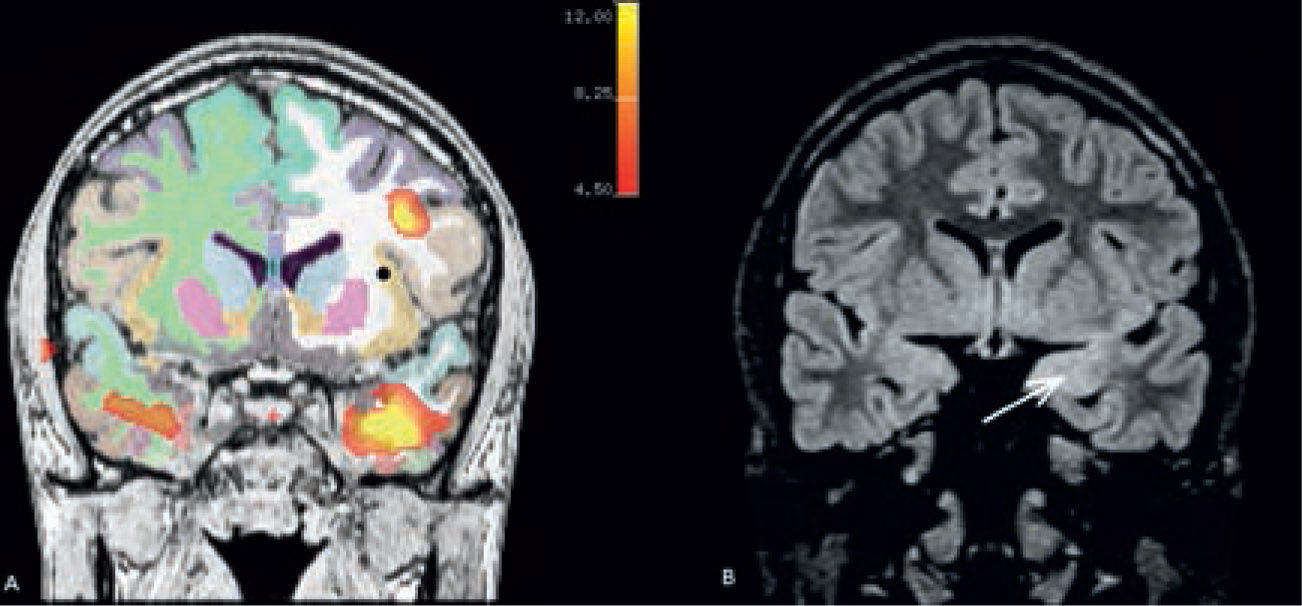
Paciente con epilepsia temporal refractaria a tratamiento. Imagen coronal T1 de alta resolución segmentada y sobreposición con estudio cuantitativo PET mediante comparación estadística con base de datos normales. (A) Muestra un área de hipometabolismo en la amígdala izquierda. (B) Imagen coronal STIR que muestra aumento de la intensidad de señal en la misma zona. (SPM5, Wellcome Trust Centre for Neuroimaging, Institute of Neurology, UCL)
El cerebro normal presenta un gran metabolismo intrínseco de glucosa. La mayor parte de las lesiones epileptógenas presentan una disminución del metabolismo de la glucosa en la etapa interictal. Se estima que la sensibilidad puede llegar aproximadamente a un 90-95%; sin embargo, es necesario tener en cuenta que el área de hipometabolismo puede extenderse por fuera de la lesión estructural (27).
Las alteraciones simétricas pueden ser de difícil diagnóstico, pero se pueden realizar estudios comparativos de poblaciones normales para identificar alteraciones sutiles.
Hay que destacar que en los casos en que la RM es normal el PET presenta una sensibilidad cercana al 50%, especialmente a nivel neocortical (28).
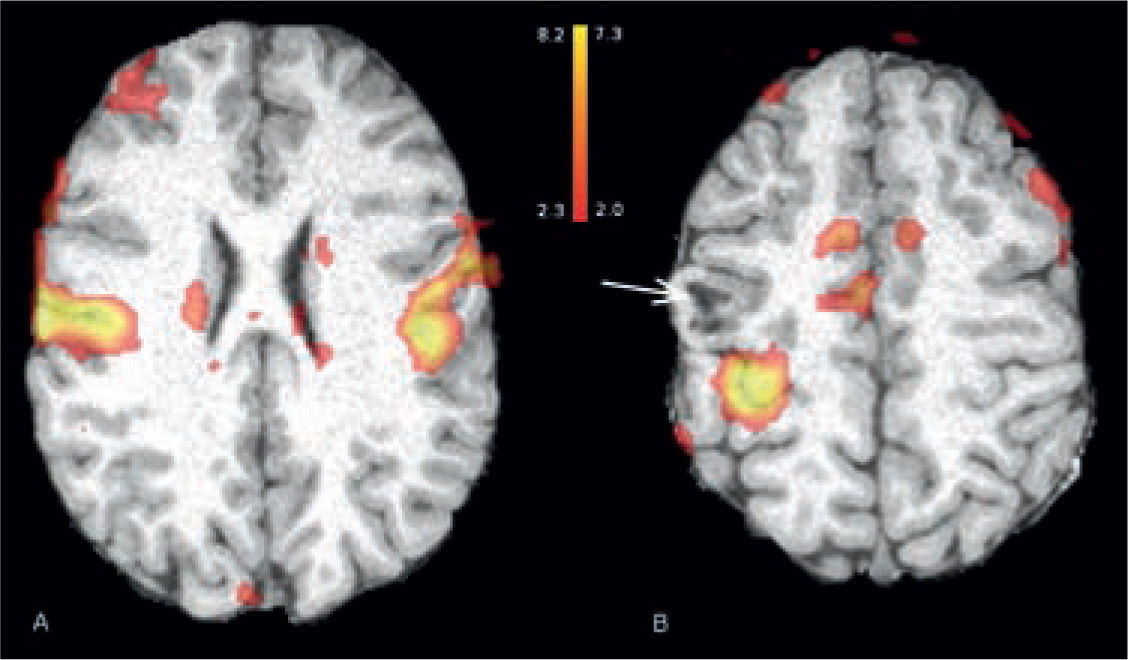
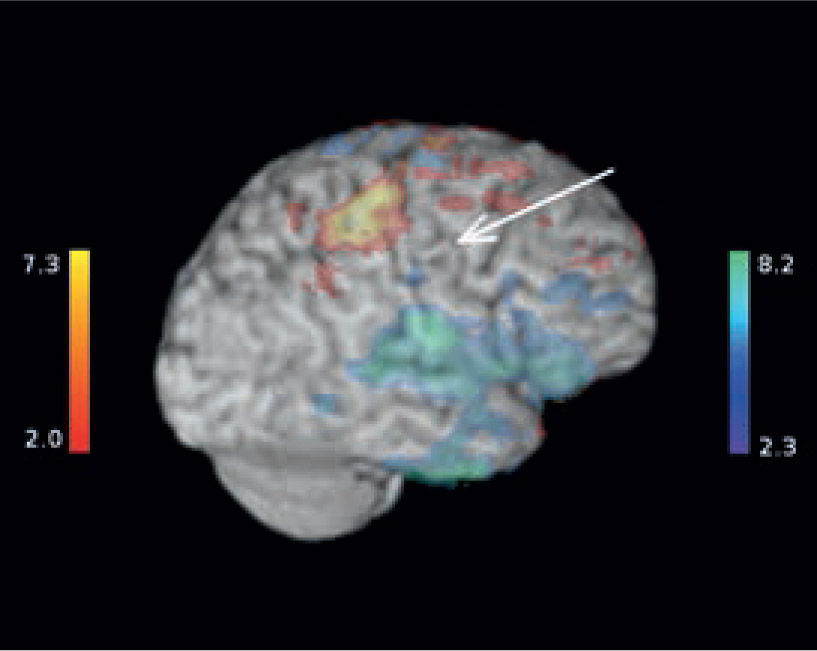
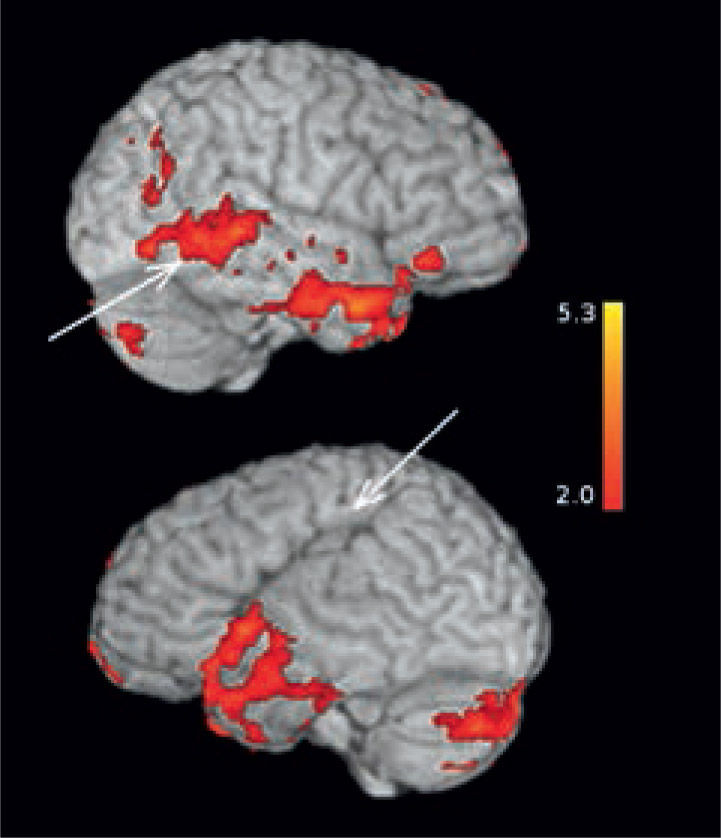
5RM funcionalLas resonancia magnética funcional es una técnica que permite localizar las áreas elocuentes cerebrales, mediante la realización de pruebas de activación o utilizando técnica de resting state (“Reposo” en español), que registran la activación de redes neuronales cerebrales. Las imágenes más utilizadas son las imágenes funcionales sensorio-motoras, visuales (29) y de lenguaje (Figuras 19, 20 y 21). Las funciones más avanzadas como la memoria son algo más complejas, pero factibles de realizar (Figura 22).
Desde el punto de vista quirúrgico es necesario establecer la relación de las lesiones epileptógenas con las áreas funcionales cerebrales. Al co-registrar las imágenes con cerebros estándares es posible obtener coordenadas Talairach para las áreas de activación
(30).
6Imágenes difusiónLas imágenes de difusión son imágenes funcionales que representan la movilidad de las moléculas de agua al interior del parénquima cerebral. A nivel de la sustancia blanca, la presencia de las membranas celulares y vainas de mielina hacen que la difusión de las moléculas de agua se encuentre favorecida en el eje principal de los axones. La información derivada de las propiedades de la difusión del agua a nivel intracerebral puede ser representada de diferentes maneras:
aAnisotropía fraccionalLa imágenes de Anisotropía Fraccional (FA) es una medida de la anisotropía de la difusión del agua en el parénquima cerebral, es decir, mientras más ordenada y organizada se encuentre la sustancia blanca, mayor va a ser el direccionamiento que produce sobre la difusión. Esto se representa como un aumento de la señal en las imágenes FA. Los valores de anisotropía van de 0 a 1, siendo 0 la ausencia de anisotropía, que se representa con ausencia de señal o color negro, y 1 la anisotropía teórica máxima, que se representa en color blanco. Hay que decir que la anisotropía en el cuerpo calloso, que es la región más organizada estructuralmente de la sustancia blanca, tiene una anisotropía de aproximadamente 0,8 (31).
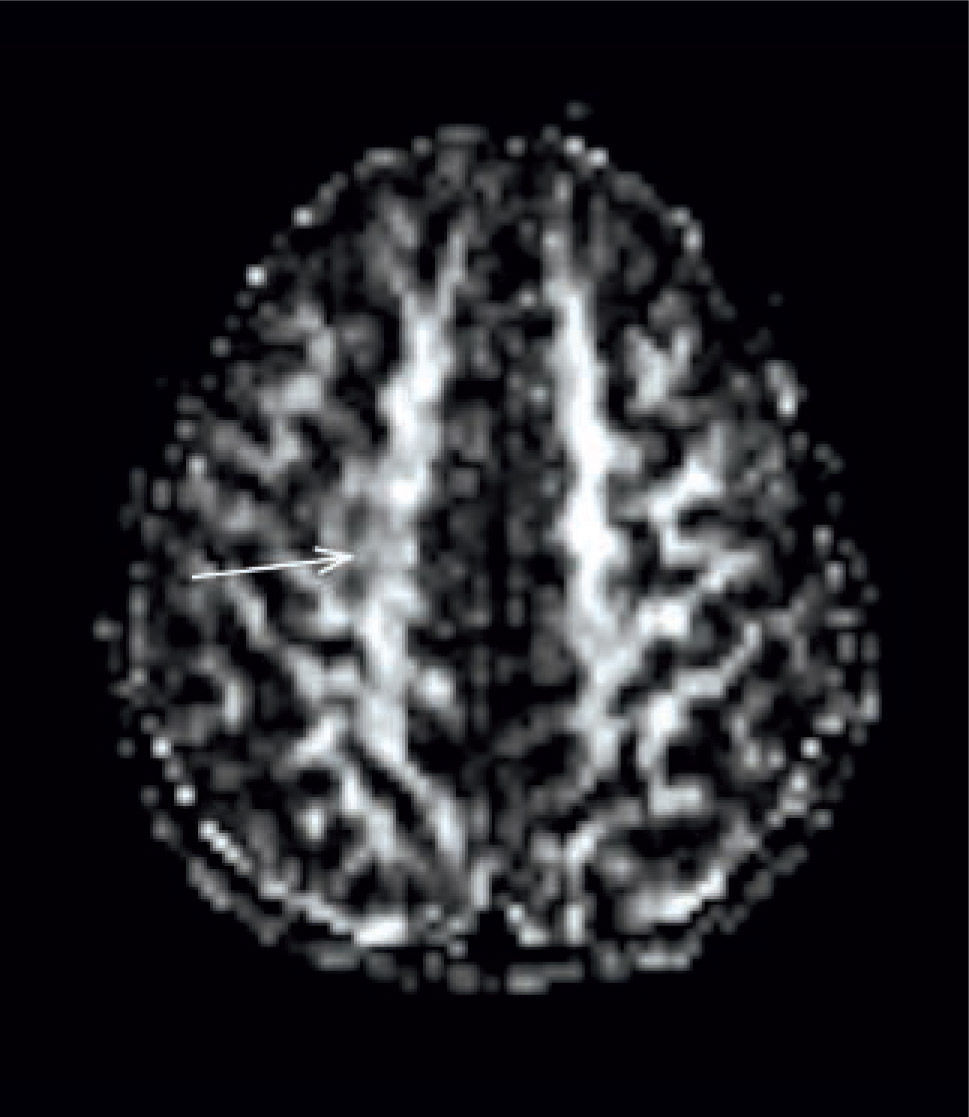
Las MDC generalmente se caracterizan por una desorganización de la sustancia blanca subyacente, que en parte explica la baja señal visualizada de este tipo de lesiones en las imágenes FA (Figura 23).
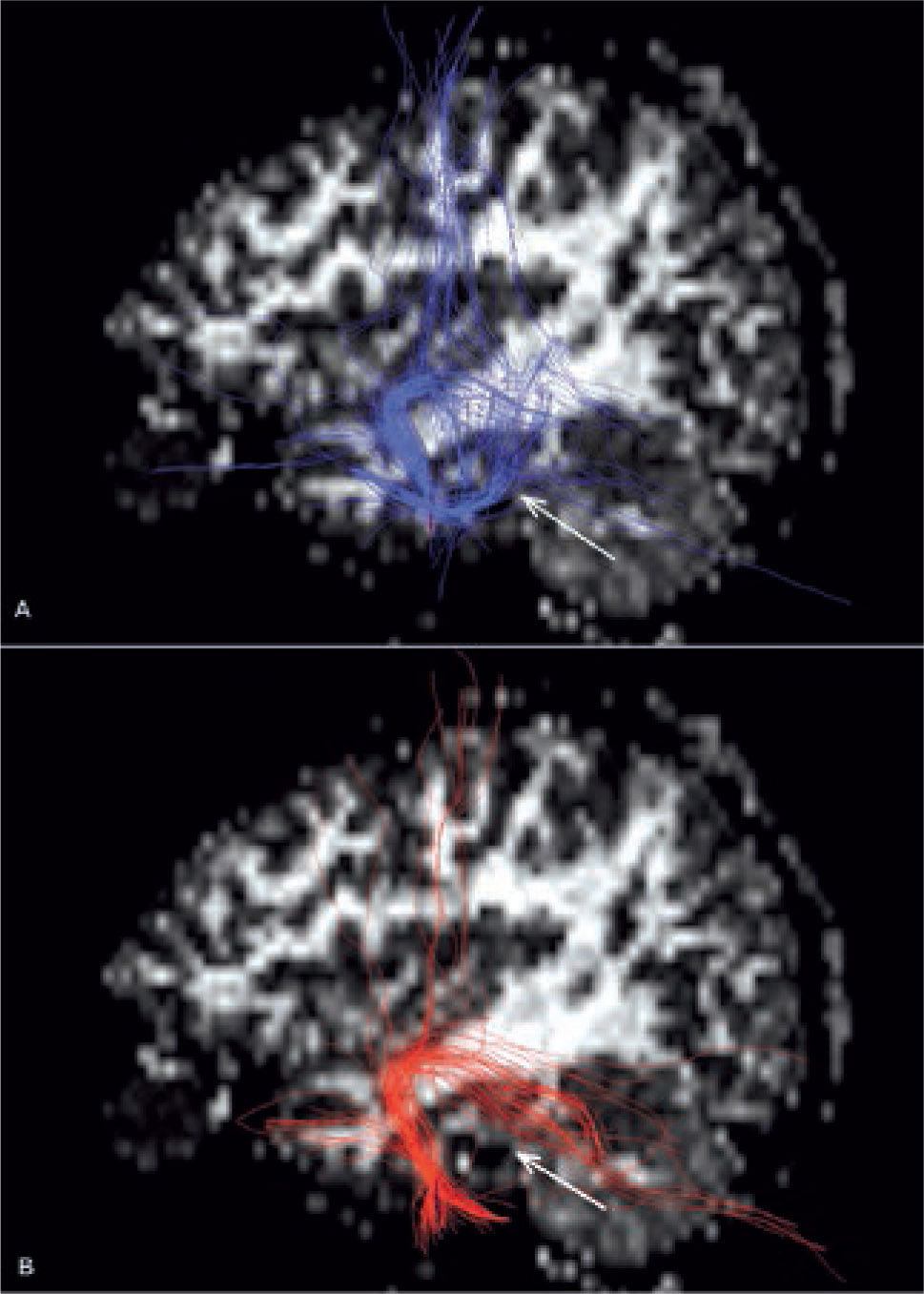
bTractografía. (DTI)Las imágenes de difusión permiten determinar además la orientación del eje principal de las vías neuronales. Esta información puede ser utilizada para la reconstrucción de los haces nerviosos mediante la técnica DTI utilizando distintos software de post-proceso para este objetivo (32).
Los pacientes con displasia corticales frecuentemente tienen alterada la conectividad de las regiones afectadas, debido a la pérdida de la organización y/o a la axonogénesis anormal de la corteza cerebral (Figura 24). Se pueden obtener también imágenes de las conexiones neuronales combinado las imágenes de RM funcional y tractografía para seleccionar tractos específicos de sustancia blanca (33).
cDireccionesUtilizando múltiples imágenes de difusión y software de post-proceso es posible determinar el número de direcciones de las fibras nerviosas al interior de cada vóxel (34). Por ejemplo, en el cuerpo calloso se identifica sólo una dirección principal que comunica cada hemisferio, debido a que las fibras se encuentran muy ordenadas y compactas. A nivel subcortical es posible determinar la presencia de al menos tres direcciones; incluso en algunas áreas es posible ver hasta 5 direcciones en el interior de un voxel.
Sin embargo, este número disminuye a nivel de las malformaciones del desarrollo cortical, probablemente debido a la alteración de la organización y conectividad. Es posible que estas áreas originen y reciban un menor número de fibras, que se traduce en un menor número de direcciones de las fibras subcorticales en comparación con el parénquima normal (Figuras 25 y 26).
Paciente con polimicrogiria silviana izquierda. Imagen de difusión que representa el número de direcciones de las fibras observadas en la sustancia blanca. Asimetría en el número de direcciones en la sustancia blanca subcortical izquierda en comparación a la corteza contralateral (flechas). (MTV.py, MULTI-TENSOR.py, Clinica Las Condes, Universidad de los Andes).
Paciente con displasia cortical de la región temporal basal izquierda. Imágenes de difusión que muestra en número de direcciones de las fibras observadas en la sustancia blanca. Asimetría en el número de direcciones en los polos temporales, menor a izquierda (flechas). (MTV.py, MULTITENSOR.py, Clinica Las Condes, Universidad de los Andes).
La mayor parte de las lesiones que presentan escasas alteraciones estructurales en las imágenes de RM, son difíciles de diferenciar del parénquima cerebral normal durante la cirugía. Es posible fusionar las imágenes de las distintas modalidades, con lo cual se correlacionan los hallazgos de las imágenes estructurales y funcionales (35).
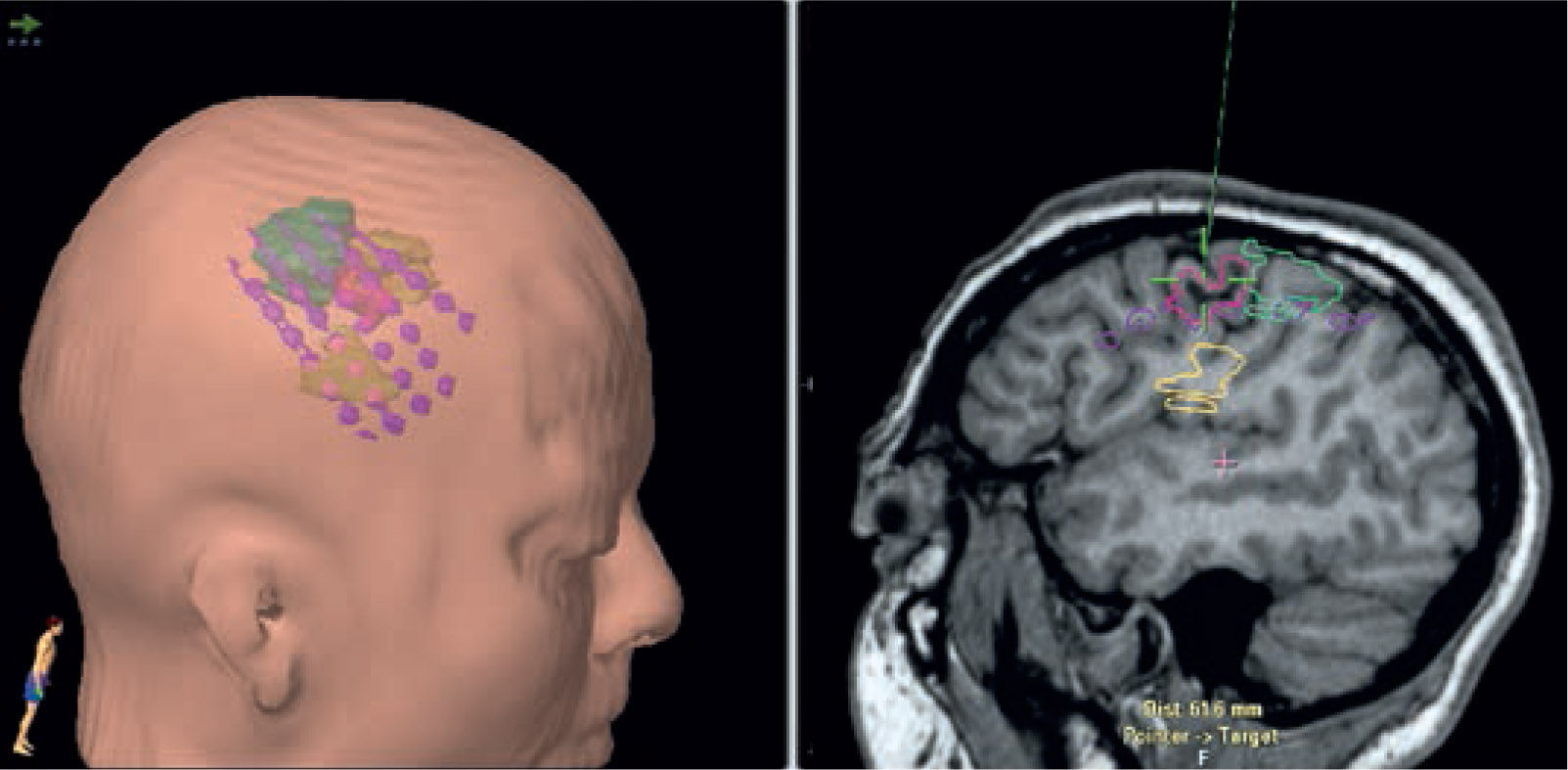
Instrumental como el neuronavergador permite utilizar la información de distintos tipos de imágenes realizadas en el paciente para determinar la localización tridimensional exacta de las lesiones y áreas elocuentes dentro del pabellón. Para esto se requiere de métodos de corrección geométrica para ajuste exacto entre las diferentes modalidades de imágenes (Figura 27).
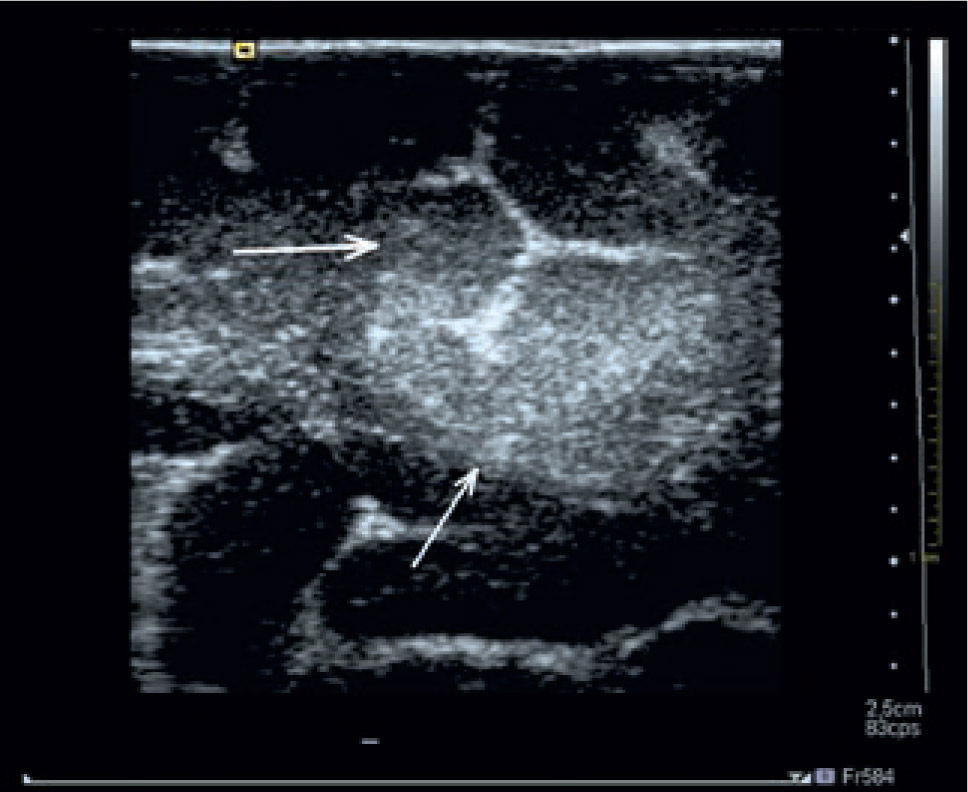
En algunos casos las lesiones son más evidentes en la ecografía intraoperatoria que en la RM (Figura 28).
Aunque la cirugía resectiva es más eficiente en los casos con alteraciones estructurales visibles en RM es posible realizar resecciones guiándose por las alteraciones del EEG y del PET.
Softwares utilizados- 1.
Segmentación, volumetría y espesor cortical: Freesurfer v4.5.0, Athinoula A. Martinos Center for Biomedical Imaging (36, 37 y 38).
- 2.
Tractografía: MedINRIA v1.9.0, INRIA (39).
- 3.
Resonancia magnética funcional: FSL v4.1.5, FMRIB Centre, Department of Clinical Neurology, University of Oxford (40).
- 4.
Estudio cuatitativo PET: SPM 5, Wellcome Trust Centre for Neuroimaging, Institute of Neurology, UCL. (41).
Base de datos imágenes de controles normales PET-FDG: James C. Patterson, MD, PhD. Profesor asociado de Psiquiatría, Lousiana Stae University Health Sciences Center.
- 5.
Difusión multidirección: MTV.py, MULTITENSOR.py, Clínica Las Condes, Universidad de los Andes (32).
Los autores declaran no tener conflictos de interés, con relación a este artículo.