La neuropatía periférica inducida por quimioterapia (NPIQ) es un grupo heterogéneo de neuropatías producidas por los tratamientos oncológicos y es la complicación neurológica más frecuente relacionada con la quimioterapia. Actualmente, existen pocas alternativas de tratamiento. El objetivo de nuestro estudio es la valoración y control de la NPIQ, a través de un consejo nutricional asociado a un suplemento dietético (SD) basado en antioxidantes no enzimáticos (Neuronuva®). Se realiza un estudio cuasiexperimental en 31 pacientes con un seguimiento de 6 meses. Se realizan mediciones que incluyen cuestionario y exploración física; con una medición basal, a los 3 y 6 meses, en pacientes con NPIQ, aguda o crónica, grado 2 o superior en la escala NCI-CTCAE. La NPIQ fue causada por oxaliplatino en un 54,8%, por paclitaxel en un 19,4%, por cisplatino, carboplatino o nabpaclitaxel en un 6,5% cada uno y por docetaxel o eribulina en un 3,2% respectivamente. A los tres primeros meses, tras inicio de consejo nutricional y SD presentaron mejoría de la NPIQ 24 pacientes con una tasa de respuesta objetiva de 77,4% (IC95% 0,61-0,93), 5 pacientes (16,1%) no presentaron cambios, y 2 pacientes suspendieron el SD por no cumplimiento. Tras la administración del SD la NPIQ mostró mejoría a los tres meses (p=0,001) y a los seis meses (p=0,002). A pesar de que no existe terapia eficaz que controle completamente la NPIQ, los datos obtenidos en nuestro estudio son favorables, objetivándose una mejoría evidente de la NPIQ en más de 2/3 de los pacientes. Planteamos realizar estudios confirmatorios multicéntricos más amplios. Además, se podría valorar el uso de este SD, junto a medidas nutricionales, como profilaxis en las quimioterapias que son más neurotóxicas.
Chemotherapy-induced peripheral neuropathy (CIPN) is a heterogeneous group of neuropathies caused by oncological treatments and is the most common neurological complication related to chemotherapy. Currently, there are few treatment alternatives. The objective of our study is the assessment and control of CIPN, through nutritional advice associated with a dietary supplement (DS) based on non-enzymatic antioxidants (Neuronuva®).
A quasi-experimental study with a six month follow-up was carried out in 31 patients. Measurements that included a questionnaire and physical examination were performed at baseline, at 3 and 6 months, in patients with acute or chronic CIPN grade 2 or higher on the NCI-CTCAE scale. NPIQ was caused by oxaliplatin in 54.8%, by paclitaxel in 19.4%, by cisplatin, carboplatin or nabpaclitaxel in 6.5% each and by docetaxel or eribulin in 3.2% respectively. At three months after the start of nutritional advice and SD, 24 patients showed improvement in NPIQ with an objective response rate of 77.4% (95% CI 0.61-0.93), 5 patients (16.1%) showed no changes, and 2 patients discontinued SD. After administration of SD, NPIQ showed improvement at three months (p=0.001) and at six months (p=0.002). Although there is no effective therapy thats completely controls CIPN, the data obtained in our study are favourable, showing a clear improvement in CIPN in more than 2/3 of patients. We propose carrying out larger multicentre confirmatory studies. In addition, the use of this DS, together with nutritional measures, could be considered as prophylaxis in chemotherapies that are more neurotoxic.
La neuropatía periférica inducida por quimioterapia (NPIQ) es un efecto secundario frecuente de los citostáticos producido por el daño de los nervios periféricos sensoriales y motores de las extremidades, aunque también puede afectar a funciones autonómicas como la vesical o intestinal. Las tasas de incidencia varían entre el 19-85% (con una prevalencia del 68% durante el primer año, del 60% a los tres meses y del 30% a los seis meses de finalización del tratamiento), aunque podrían ser incluso superiores ya que se trata de una entidad infradiagnosticada1. Conlleva un impacto negativo en la calidad de vida de los pacientes y obliga frecuentemente a reducir, llegando incluso a suspender precozmente, el esquema quimioterapéutico, a su vez comprometiendo los resultados oncológicos y supervivencia de los pacientes2.
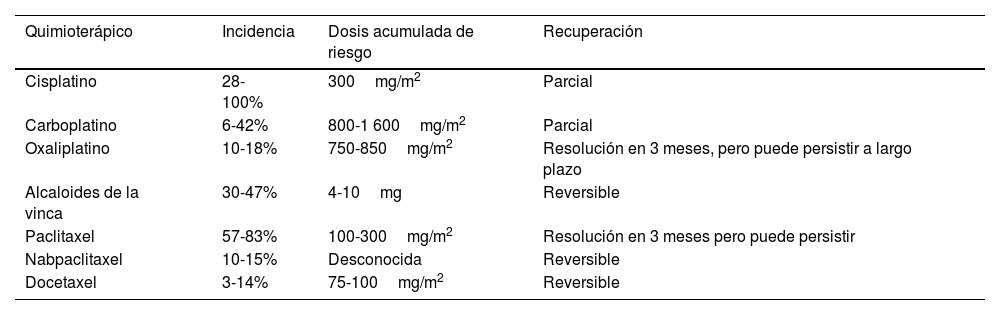
La etiopatogenia de la neuropatía consiste en el daño de los axones de los nervios periféricos, aunque el mecanismo exacto de producción no está completamente dilucidado y varía según el tipo de fármaco3. Su curso evolutivo se puede dividir en agudo (ocurriendo durante la administración de los tratamientos, y hasta los primeros 3 meses post quimioterapia) y crónico (si persiste o aparece después de los primeros 3 meses tras finalizar su tratamiento, pudiendo incluso persistir de forma indefinida)4. El riesgo de desarrollar NPIQ depende de varios factores tales como el tipo de fármaco quimioterápico, la vía de administración, los esquemas y combinaciones de fármacos y el tipo de cáncer. Aumenta además según la dosis por ciclo, la dosis acumulada, medicaciones concomitantes, edad avanzada y condiciones preexistentes como el tabaquismo, la diabetes o neuropatía previa. En su desarrollo también puede incidir un importante componente genético5. Entre los quimioterápicos que más comúnmente causan NPIQ destacan: fármacos derivados del platino (oxaliplatino, cisplatino, carboplatino), taxanos (paclitaxel, docetaxel, nabpaclitaxel), alcaloides de la vinca y bortezomib1,4. La incidencia de la NPIQ según quimioterápico se recoge en la tabla 1. Otros fármacos, como los inhibidores de los puntos de control inmunológicos, pueden provocar neuropatías inmunomediadas6. Clínicamente, la NPIQ se manifiesta como una polineuropatía que generalmente se inicia en los dedos de los pies o de las manos y progresa a los pies, piernas, manos y brazos, habitualmente con carácter simétrico7. Los síntomas sensitivos son mucho más habituales que los motores o autonómicos. Dependiendo de los nervios afectados, los síntomas comunes de la NPIQ pueden incluir parestesias y disestesias en extremidades, de predominio distal, ocasionalmente con afectación del área orofacial; y dolor, generalmente con características neuropáticas, que afecta a las extremidades, también de predominio distal8,9.
Incidencia de neuropatía inducida por quimioterapia
| Quimioterápico | Incidencia | Dosis acumulada de riesgo | Recuperación |
|---|---|---|---|
| Cisplatino | 28-100% | 300mg/m2 | Parcial |
| Carboplatino | 6-42% | 800-1 600mg/m2 | Parcial |
| Oxaliplatino | 10-18% | 750-850mg/m2 | Resolución en 3 meses, pero puede persistir a largo plazo |
| Alcaloides de la vinca | 30-47% | 4-10mg | Reversible |
| Paclitaxel | 57-83% | 100-300mg/m2 | Resolución en 3 meses pero puede persistir |
| Nabpaclitaxel | 10-15% | Desconocida | Reversible |
| Docetaxel | 3-14% | 75-100mg/m2 | Reversible |
Adaptado de National Comprehensive Cancer Network® (NCCN®) Task Force6.
Respecto al tratamiento de esta complicación, y a pesar de su trascendencia, se establecen pocas opciones terapéuticas. Hasta el momento, la reducción o suspensión de la quimioterapia causante de la NPIQ y el uso de duloxetina, que reduce el dolor neuropático, son las únicas de eficacia probada10.
Los compuestos antioxidantes endógenos se producen de forma habitual en nuestro organismo para protegernos del daño oxidativo11. Dentro de los compuestos antioxidantes exógenos no enzimáticos encontramos: vitamina A y E, selenio, zinc, magnesio, carotinoides, ácidos grasos omega-3, melatonina, cúrcuma y glutamina12. Aunque ninguno de los compuestos ha demostrado beneficio para la prevención o tratamiento de la NPIQ, muchos pacientes oncológicos sufren carencias nutricionales derivadas del proceso oncológico o de los tratamientos que les ocasionan anorexia, disgeusia, dispepsia, entre otros síntomas, que les hace consumir una dieta no adecuada. Esto conlleva a una potencial carencia de los elementos que podrían contrarrestar el daño oxidativo provocado por la quimioterapia13.
Por tanto, teniendo en cuenta lo expuesto anteriormente, el objetivo de nuestro estudio es la valoración y control de la NPIQ, a través de un consejo nutricional asociado a un suplemento dietético (SD) basado en antioxidantes no enzimáticos (Neuronuva®).
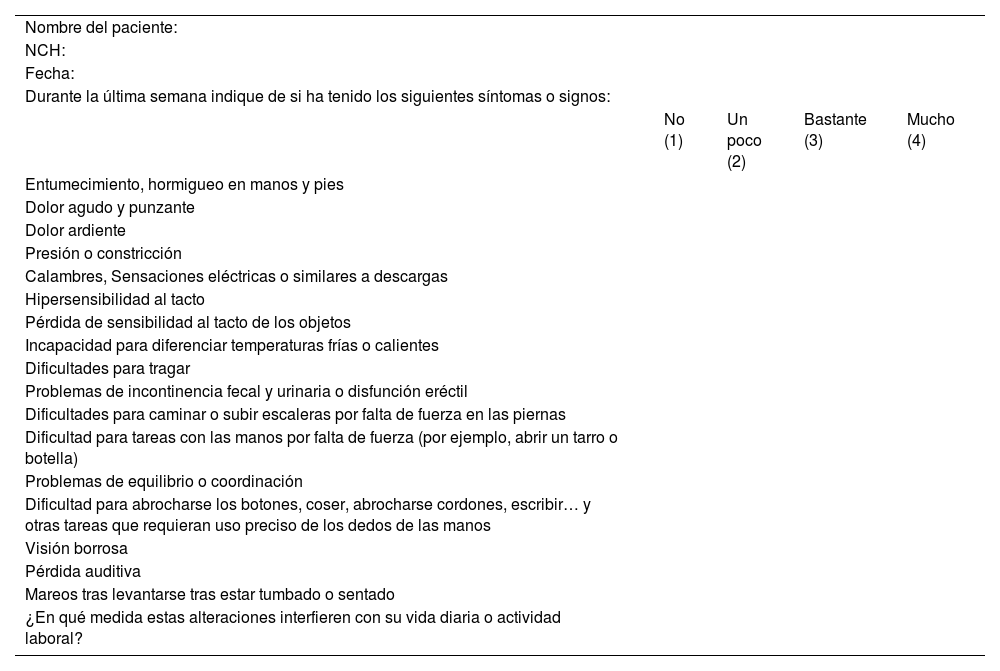
Material y métodosSe trata de un estudio cuasiexperimental de medidas repetidas con un seguimiento de al menos seis meses. Se han incluido 31 pacientes del Servicio de Oncología Médica del Hospital Juan Ramón Jiménez (HJRJ) de Huelva en tratamiento con quimioterapia activa o que la hayan finalizado dentro de los tres meses previos y que presenten NPIQ aguda o crónica, grado 2 o superior de la escala NCI-CTCAE (Criterios Terminológicos Comunes para Eventos Adversos (CTCAE, por sus siglas en inglés) del National Cancer Institute (NCI) de Estados Unidos (tabla 2). Se realizó una medición basal basada en un cuestionario (anexo 1) y en exploración física y posteriormente se realizaron dos mediciones; una a los tres meses y otra a los seis meses tras la introducción de la dieta y el SD.
Escala National Cancer Institute-Common Terminology Criteria for Adverse Events (NCI-CTCAE) valoración de neurotoxicidad9
| Grado 1 | Grado 2 | Grado 3 | Grado 4 | Grado 5 | |
|---|---|---|---|---|---|
| Neuropatía sensorial | Asintomático | Síntomas moderadosInterfiere con actividades instrumentales de la vida diaria | Síntomas severosInterfiere con auto cuidado para actividades de la vida diaria | Amenaza para la vidaRequiere intervención urgente | ---- |
| Neuropatía motora | Asintomático: debilidad solo a la exploración | Debilidad Moderada.Interfiere con actividades instrumentales de la vida diaria | Debilidad severa.Interfiere con auto cuidado para actividades de la vida diaria | Amenaza para la vida.Requiere intervención urgente | Fallecimiento |
El SD Neuronuva® es un complemento alimenticio formulado con ácido lipoico, cúrcuma, zinc, melatonina, resveratrol, melissa, piperina, vitaminas E, B6, B1 y B12, ácido fólico y selenio; cuya combinación, por sus acciones antioxidantes y antiinflamatorias, puede contribuir al manejo de neuropatías, siendo sustancias seguras, con bajo riesgo de efectos secundarios. El método de uso consistiría en un comprimido vía oral cada 24 horas.
Las recomendaciones dietéticas, base fundamental de este proyecto, han sido adaptadas a las características individuales de cada paciente, atendiendo a sus preferencias, creencias, comorbilidades y situación social. La alimentación se basará en los siguientes alimentos: frutos secos y semillas (vitamina E, complejo B, selenio); verduras de hoja verde (vitamina E); huevos y lácteos (vitamina B12, melatonina, glutamina); frutas cítricas, kiwis y pimientos (vitamina C); plátano (vitamina B6); cereales integrales, pescados y huevos (complejo B); pescados y mariscos (complejo B, zinc, selenio); legumbres (melatonina); carnes rojas y blancas (complejo B, selenio, glutamina).
En la primera visita tras realizar el cuestionario inicial, se le indicó al paciente las medidas dietéticas de acuerdo al proyecto, se le explicó la toma del SD y se entregaron muestras gratuitas, siendo citados a volver al mes y medio del inicio de tratamiento y de la dieta. En esa oportunidad se evaluó la adherencia a la dieta recomendada y al SD, sin realizar exploración ni el cuestionario. Posteriormente fueron citados a los 3 y 6 meses donde además de evaluar la adherencia al SD, se realizaron las 2 mediciones con exploración física y cuestionario.
En caso de que el grado de neuropatía empeorara o no mejorara, se terminaba el estudio y se suspendía el SD. Por el contrario, en caso de notar mejoría en la evaluación final de los seis meses, el paciente, a criterio propio, podría seguir con el consejo dietético hasta un máximo de 1 año o hasta la completa resolución.
El análisis estadístico fue realizado con IBM SPSS Statistics 22. Se realizó análisis descriptivo y analítico mediante tasa de respuesta y T-student de muestras relacionadas, para contrastar la eficacia de la NPIQ tras SD y nutrición a los tres meses y seis meses.
ResultadosSe incluyeron 31 pacientes; 17 hombres y 14 mujeres. La mediana de edad fue de 60 años. Hubo antecedentes de hábito tabáquico en 17 pacientes (54,8%), de los cuales el 26% eran fumadores activos. El 20% (6 pacientes) eran diabéticos.
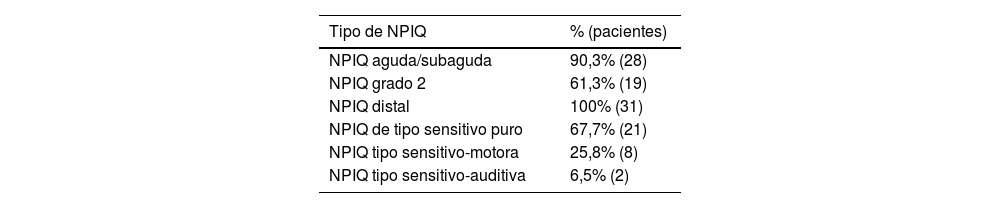
La NPIQ ha sido causada en 17 pacientes por oxaliplatino (54,7%); en 6 pacientes por paclitaxel (19,3%), en 2 pacientes por cisplatino, carboplatino o nab-paclitaxel (6,5% respectivamente); 1 paciente por docetaxel y otro por eribulina (3,2% respectivamente). La intención de la quimioterapia fue neoadyuvante en 3 pacientes (9,6%), adyuvante en 14 pacientes y paliativa en otros 14 (45,2% respectivamente). Las características de la NPIQ se recogen en las tablas 3 y 4.
Caracterización de la neuropatía periférica inducida por quimioterapia (NPIQ) de los participantes
| Tipo de NPIQ | % (pacientes) |
|---|---|
| NPIQ aguda/subaguda | 90,3% (28) |
| NPIQ grado 2 | 61,3% (19) |
| NPIQ distal | 100% (31) |
| NPIQ de tipo sensitivo puro | 67,7% (21) |
| NPIQ tipo sensitivo-motora | 25,8% (8) |
| NPIQ tipo sensitivo-auditiva | 6,5% (2) |
A los tres primeros meses, tras el inicio de consejo nutricional y la toma del SD presentaron mejoría de la NPIQ 24 pacientes con una tasa de respuesta objetiva (porcentaje de pacientes con reducción o desaparición de los síntomas después del SD y de la dieta) de 77,4% (IC95% 0,61-0,93), 4 pacientes (16,1%) no presentaron cambios de la NPIQ, 2 pacientes suspendieron el SD por olvido en su toma diaria y no cumplimiento del consejo dietético y 1 paciente lo suspendió por mala tolerancia (toxicidad gástrica grado 1). La mejoría fue medida por reducción del nivel según la escala NCI-CTCAE. Veintiocho pacientes (90%) tuvieron adherencia al SD y 65% al consejo dietético.
A los seis meses, de los 24 pacientes que siguieron con medidas nutricionales junto con SD, 19 persistían con la mejoría de la NPIQ y 5 no presentaron cambios tras haber presentado previamente una mejoría.
Tras comprobar la normalidad de la muestra mediante la prueba de Kolmogorov-Smirnov, concluimos mediante T de Student de muestras relacionadas que tras el SD y el consejo nutricional la NPIQ mejoró a los tres meses (p=0,001) (IC95% 0,5-0,9) y a los seis meses (p=0,002) (IC95% 0,7-1,3).
Se realizó una regresión logística para determinar si el sexo, el hábito tabáquico, la diabetes mellitus o el tipo de quimioterapia influyen en la mejoría de la NPIQ. Aunque no alcanzaron la significación estadística, el hábito tabáquico fue la única variable que se asocia con empeoramiento de la NPIQ, con una OR de 4 (p=0,1).
DiscusiónLa NPIQ es un efecto secundario bastante frecuente, altera la calidad de vida de los pacientes y compromete la eficacia de los tratamientos. Por eso la búsqueda de soluciones, tanto preventivas como terapéuticas, es una inquietud constante en el mundo de la oncología7.
Actualmente no disponemos de medidas preventivas eficaces para evitar la aparición de la NPIQ10, más allá de evitar las dosis acumulativas que pudieran generar estas neuropatías y realizar una evaluación exhaustiva de los posibles síntomas y signos del inicio de una NPIQ antes de cada nuevo ciclo. Es importante identificar a los pacientes de mayor riesgo a la hora de planificar la quimioterapia. Por otra parte, el desarrollo de fármacos con potencial para evitar la NPIQ, podrían producir un posible efecto perjudicial sobre la efectividad de la quimioterapia5.
A pesar de los múltiples intentos de conseguir una terapia preventiva y/o terapéutica de la NPIQ, hasta la fecha no se ha conseguido un tratamiento de efectividad establecida, de ahí la importancia de nuestro estudio14. Entre los agentes que se han estudiado en ensayos clínicos fase III y que no han demostrado eficacia destacan el ácido alfa lipoico15, calcio-magnesio intravenoso16, vitamina E17, acetil-L-carnitina18, glutation16, gabapentina19 y lamotrigina20, entre otros. Solo la duloxetina21 ha demostrado una disminución de la puntuación del dolor en comparación con placebo a las 6 semanas, por ello es el único tratamiento recomendado en la NPIQ y cuya utilidad se limita a reducir el dolor neuropático. Estudios preliminares parecen mostrar beneficios con el ejercicio físico y otras intervenciones conductuales22.
Dado que la nutrición es unos de los factores modificables en las enfermedades crónicas, como el cáncer, hemos pretendido aportar una dieta complementada con SD que tengan actividad antioxidante ricos en vitaminas, minerales y oligoelementos23. En base a esto, comprobamos en nuestro estudio que con una dieta rica en sustancias antioxidantes y antinflamatorias contenidas de forma natural en los alimentos, junto con el SD, se consigue mejorar la NPIQ de forma significativa. En efecto, aunque tradicionalmente se han usado muchos tipos de SD en estos pacientes, en nuestro caso hemos seleccionado uno que presenta algunas características diferenciales basadas en el enfoque de las necesidades de paciente más allá de los problemas neuropáticos, abordando posibles factores como son descanso o relajación, inflamación crónica y sobre todo el estrés oxidativo. Para ello se ha formulado una presentación con alta concentración de antioxidantes de gran potencia junto a elementos antiinflamatorios y melatonina, además de ciertas vitaminas y minerales que tienen reconocida función en el sistema nervioso24. Aunque ninguno de los compuestos ha demostrado beneficio para la prevención o tratamiento de la NPIQ, muchos pacientes oncológicos sufren carencias nutricionales derivadas del proceso oncológico o de la toxicidad de la quimioterapia, que les hace consumir una dieta no adecuada conllevando una potencial carencia de los elementos que podrían contrarrestar el daño oxidativo provocado por la quimioterapia. La combinación de estos agentes antioxidantes y su perfil antiinflamatorio, puede contribuir al manejo de neuropatías, siendo sustancias seguras, sin efectos secundarios.
El estudio se desarrolló como un estudio piloto, por lo que nuestras limitaciones son: la muestra reducida, ser un estudio unicéntrico y que la “eficacia” pueda estar influenciada por la evolución natural de la neuropatía, algo que no se ha controlado al no incluir un brazo control. Sin embargo, a pesar de ser pocos pacientes, hemos logrado obtener diferencias significativas tras el consejo nutricional y la toma de SD, teniendo además en cuenta que no hay trabajos previos que hasta el momento hayan demostrado esta evidencia. Por ello, pensamos que esta línea de investigación es prioritaria para poder mejorar uno de los principales problemas que encontramos actualmente en las consultas de oncología.
ConclusiónA pesar de que no existe terapia eficaz que controle la NPIQ, los datos obtenidos en nuestro estudio son favorables, objetivándose una mejoría evidente de la NPIQ en más de dos tercios (77,4%) de los pacientes. Se trata de un estudio con tamaño muestral reducido, por lo que planteamos realizar estudios confirmatorios multicéntricos más amplios. Además, se podría valorar el uso de este SD junto a medidas nutricionales como medida preventiva en las quimioterapias que son más neurotóxicas.
Consideraciones éticasEste estudio fue aprobado por el Comité Ético de nuestro hospital. Se informó a los pacientes que participaron en el estudio, y firmaron el consentimiento informado. Se ha garantizado la protección de los datos personales según el Reglamento (UE) n° 2016/679 del Parlamento Europeo y del Consejo de 27 de abril de 2016 de Protección de Datos (RGPD), la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales y el Real Decreto 1720/2007, de 21 de diciembre. En todo momento se garantizarán los derechos de los pacientes (Declaración de Helsinki actualizada, 2013).
Declaración de conflicto de interesesLos autores declararon que no existen posibles conflictos de intereses con respecto a la investigación, autoría y/o publicación de este artículo.
FinanciaciónLos autores no han recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo.
| Nombre del paciente: | ||||
| NCH: | ||||
| Fecha: | ||||
| Durante la última semana indique de si ha tenido los siguientes síntomas o signos: | ||||
| No (1) | Un poco (2) | Bastante (3) | Mucho (4) | |
| Entumecimiento, hormigueo en manos y pies | ||||
| Dolor agudo y punzante | ||||
| Dolor ardiente | ||||
| Presión o constricción | ||||
| Calambres, Sensaciones eléctricas o similares a descargas | ||||
| Hipersensibilidad al tacto | ||||
| Pérdida de sensibilidad al tacto de los objetos | ||||
| Incapacidad para diferenciar temperaturas frías o calientes | ||||
| Dificultades para tragar | ||||
| Problemas de incontinencia fecal y urinaria o disfunción eréctil | ||||
| Dificultades para caminar o subir escaleras por falta de fuerza en las piernas | ||||
| Dificultad para tareas con las manos por falta de fuerza (por ejemplo, abrir un tarro o botella) | ||||
| Problemas de equilibrio o coordinación | ||||
| Dificultad para abrocharse los botones, coser, abrocharse cordones, escribir… y otras tareas que requieran uso preciso de los dedos de las manos | ||||
| Visión borrosa | ||||
| Pérdida auditiva | ||||
| Mareos tras levantarse tras estar tumbado o sentado | ||||
| ¿En qué medida estas alteraciones interfieren con su vida diaria o actividad laboral? |