La inmunización se encuentra entre las intervenciones en salud pública más exitosas y costo efectivas de todas las épocas, siendo su beneficio tan importante como su seguridad.
Las vacunas, como cualquier otro medicamento, pueden generar eventos adversos, los que deben ser monitorizados permanentemente por sistemas de vigilancia. Esta disciplina recibe el nombre de Farmacovigilancia de Vacunas (FVV), encargada de estudiar los Eventos Supuestamente Atribuidos a la Vacunación ó Inmunización (ESAVI).
El objetivo de este trabajo es revisar la evolución del sistema de farmacovigilancia de vacunas en Chile.
El sistema de FVV chileno se basa en la vigilancia pasiva, y contempla la notificación obligatoria al Instituto de Salud Pública (ISP) de todos los ESAVI detectados, por parte de profesionales de la salud, directores de establecimientos y titulares de registro sanitario, priorizando las notificaciones de ESAVI serios e incluyendo la monitorización de todas las vacunas usadas en el país, tanto las que se encuentran incorporadas al Programa Nacional de Inmunización (PNI), como las que se encuentran fuera de este. El sistema de FVV chileno se caracteriza por un trabajo colaborativo permanente entre el ISP y el PNI, y parte de sus desafíos incluyen generar capacidades y alianzas estratégicas con la academia para la realización de estudios post comercialización sobre seguridad de vacunas.
Finalmente, es importante destacar que tanto el marco normativo promulgado el año 2010, como la elaboración de procedimientos, el trabajo permanente con el PNI, y la conformación de un comité de expertos de ESAVI, y las diferentes estrategias de retroalimentación, son medidas implementadas que han contribuido a mejorar la tasa de reporte nacional y el análisis de los casos.
Immunization is among the most successful and cost-effective public health interventions of all times, its benefits being as important as its safety.
Vaccines, like any other medicine, can generate adverse events, which must be permanently monitored by surveillance systems. Vaccine Pharmacovigilance (VPV) is the discipline responsible for studying Adverse Events Following Immunization (AEFI).
The objective of this article is to review the evolution of the pharmacovigilance system of vaccines in Chile.
The Chilean VPV system is based on passive surveillance, and establishes the mandatory reporting of all AEFI detected by healthcare workers, directors of healthcare facilities, and Marketing Authorization holders, to the Public Health Institute of Chile (PHI), prioritizing the reporting of serious ESAVI and including the monitoring of all vaccines used in the country, both those that are incorporated into the National Immunization Program (NIP), and those that are outside of it. The Chilean VPV system is characterized by a permanent collaborative work between the PHI and the NIP, and its challenges include generating capacities and strategic alliances with the academy to carry out post-marketing studies on vaccine safety.
Finally, it's important to point out that the regulatory framework promulgated in 2010, as well as the elaboration of procedures, the permanent work with the NIP, the formation of an AEFI expert committee, and the different feedback strategies implemented, have contributed in improving case analysis and the national reporting rate.
La inmunización se encuentra entre las intervenciones en salud pública más exitosas y costo efectivas de todas las épocas, logrando dentro de sus hitos la erradicación de la viruela, lo que ha sido considerado uno de los logros más grandes de la humanidad. Recientemente se ha comunicado un nuevo logro de las vacunas, con la erradicación del virus polio salvaje tipo 3, lo que se suma al ya erradicado virus polio salvaje tipo 2 en el mundo, siendo un gran avance para la iniciativa global de erradicación de poliomielitis. Actualmente, cada año la inmunización evita aproximadamente 2 a 3 millones de muertes por difteria, tétanos, tos ferina y sarampión, en diferentes grupos etarios1–4.
Tan importante como el beneficio que las vacunas aportan, es su seguridad, considerando que éstas, como cualquier otro medicamento, pueden generar eventos adversos y que además son utilizadas por un gran número de personas. Estos eventos deben ser monitorizados permanentemente por sistemas de vigilancia, disciplina que recibe el nombre de Farmacovigilancia de Vacunas1,2,5.
La definición de Farmacovigilancia de Vacunas (FVV) fue generada en el año 2012 por el Consejo para las Organizaciones Internacionales de Ciencias Médicas (CIOMS)5, definiéndose como la ciencia y las actividades relacionadas con la detección, evaluación, entendimiento y comunicación de los eventos adversos que ocurren a continuación de la inmunización, problemas relacionados con la inmunización, y la prevención de efectos indeseados a la vacuna o inmunización. Así mismo, un Evento Adverso a Continuación de la Inmunización (Adverse Event Following Immunization, AEFI en inglés) se define como un evento médico adverso que se presenta tiempo después de la inmunización y que no necesariamente tiene una relación causal con el uso de la vacuna. El evento adverso puede ser cualquier signo desfavorable o no deseado, hallazgo anormal de laboratorio, síntoma o enfermedad5. Para este mismo concepto en la región de las Américas6 se ha acuñado el término Evento Supuestamente Atribuido a la Vacunación ó Inmunización (ESAVI), a modo de establecer desde su notificación que se trata de una sospecha. Para fines de este artículo, y en concordancia con la terminología usada en la región de las Américas y la normativa nacional usaremos el acrónimo ESAVI7.
Parte de los desafíos de los sistemas de monitorización de ESAVI es enfrentar la alta percepción del riesgo que genera la ocurrencia de un ESAVI en la población. Otro desafío es generar información que refute los mitos y la falsa información en torno a los efectos de la vacunación, que requiere respuestas basadas en evidencia científica que sean claras y oportunas1,8.
Uno de los sistemas más utilizados en la monitorización de los ESAVI es la vigilancia pasiva, la que consiste en la notificación voluntaria de estos eventos, cuya principal utilidad es la detección de potenciales señales de seguridad de una vacuna en particular. Vale decir, que permite identificar nuevos riesgos, nueva información sobre riesgos poco documentados a la fecha, además permite la monitorización de un gran número de vacunas al mismo tiempo, es de fácil acceso y de bajo costo, pero por otra parte, también presenta desventajas como la potencial sub notificación de casos, la calidad variable de los datos de los reportes recibidos y la imposibilidad de confirmar la hipótesis de que una vacuna sea la causa directa de un ESAVI9–12.
El grupo de seguridad y vigilancia de vacunas de la Organización Mundial de la Salud (OMS), ha generado directrices y herramientas para apoyar la implementación de sistemas de farmacovigilancia tanto a nivel regional como en los distintos países de cada región. Una herramienta relevante es la creación de un indicador que permite medir el rendimiento de los países que utilizan la vigilancia pasiva e identificar si logran alcanzar un mínimo de capacidad en seguridad de vacunas. De acuerdo este indicador, si un país cuenta con una tasa de reporte de al menos 10 ESAVI por 100.000 nacidos vivos al año, se considera que ha alcanzado el mínimo umbral de capacidad respecto de seguridad en vacunas13.
Con la finalidad de adquirir conocimientos que permitan una óptima implementación de las actividades de farmacovigilancia de vacunas, la OMS cuenta con diversas herramientas de libre acceso. En la tabla 1, se detallan algunas de las herramientas y además se incluyen otros sitios que pueden ser de interés1,8.
Herramientas y lineamientos de seguridad de vacunas de libre acceso diseñados por OMS y otros sitios validados
| Herramienta | Links disponible |
|---|---|
| Curso básico de seguridad de vacunas e-learning | https://vaccine-safety-training.org/ |
| Curso de seguimiento de casos en vacunas e-learning | https://www.vaccine-safety-training.org/investigation/ |
| Manual de evaluación de causalidad de casos ESAVI | Disponible en la pág. web de seguridad de vacunas de la OMShttps://www.who.int/vaccine_safety/publications/gvs_aefi/en/ |
| Software de evaluación de causalidad | Disponible en la pág. web de seguridad de vacunas de la OMShttp://gvsi-aefi-tools.org/ |
| 25 variables principales para ser pesquisadas por sistemas de vigilancia de ESAVI | Disponible en la pág. web de seguridad de vacunas de la OMShttps://www.who.int/vaccine_safety/initiative/tools/es/ |
| Hojas informativas sobre las tasas observadas de ESAVI según vacuna | Disponible en la pág. web de seguridad de vacunas de la OMShttps://www.who.int/vaccine_safety/initiative/tools/vaccinfosheets/en/ |
| Capítulo de seguridad de vacunas del Manual de vacunas en línea de la Asociación Española de Pediatría | Disponible en la pág. web de la Asociación Española de Pediatríahttps://vacunasaep.org/documentos/manual/cap-3 |
| Información acerca de vacunas e inmunización para profesionales y público en general | Disponible en la pág. Web de centro para el control y prevención de enfermedadeshttps://www.cdc.gov/spanish/inmunizacion/index.html |
| Información del beneficio y seguridad de vacunas para profesionales y público en general | Disponible en la pág. Web del instituto de Salud Pública de Chilehttp://www.ispch.cl/anamed_/farmacovigilancia/vacunas |
A nivel mundial no existe un modelo único de cómo deben ser desarrollados los sistemas de FVV, no obstante, existen lineamientos generales que establecen principios, tanto para los centros de farmacovigilancia14, como para actividades de seguridad de vacunas5,15. En general estos lineamientos son adaptados por cada país, según la realidad y los recursos disponibles.
OBJETIVORevisar la evolución del sistema de farmacovigilancia de vacunas en Chile.
FARMACOVIGILANCIA DE VACUNAS EN CHILEEn Chile, la FVV ha sido desarrollada en el Instituto de Salud Pública (ISP), en su rol de autoridad regulatoria del país, en base a los fundamentos técnicos del Uppsala Monitoring Centre (UMC), centro colaborador de la OMS en farmacovigilancia14, y los lineamientos del Global Vaccine Safety Blueprint de la OMS15. El Centro Nacional de Farmacovigilancia (CNFV) del ISP, es la entidad responsable de coordinar las actividades de FVV a nivel nacional. El sistema de FVV chileno tiene la particularidad de contar con un trabajo colaborativo permanente entre el ISP y el Departamento de Inmunizaciones del Ministerio de Salud (MINSAL)7,16,17.
Actualmente, el sistema de FVV se basa en un sistema de vigilancia pasiva, en el que se establece la notificación obligatoria de todos los ESAVI detectados por parte de los profesionales de la salud, directores de establecimientos y los titulares de registro sanitario al ISP, priorizando las notificación de ESAVI serios e incluyendo la monitorización de todas las vacunas usadas en el país, tanto las que se encuentran incorporadas al Programa Nacional de Inmunización (PNI), como las que se encuentran fuera de este. Las notificaciones pueden ser enviadas al CNFV a través de tres vías, las que se describen en la tabla 27,17,18.
Vías de notificación de ESAVI actualmente disponibles
| Vías de notificación de ESAVI | Sitio disponible |
|---|---|
| Sistema notificación en línea ESAVI-MINSAL | http://esavi.minsal.cl/ |
| Sistema notificación en línea REDRAM-ISP | http://sistemared-ram.ispch.gob.cl/farmacovigilancia/Login.aspx |
| Notificación Manual | Descargar formulario en http://www.ispch.cl/anamed_/farmacovigilancia_1/nramEnviar formulario a esavi@ispch.cl |
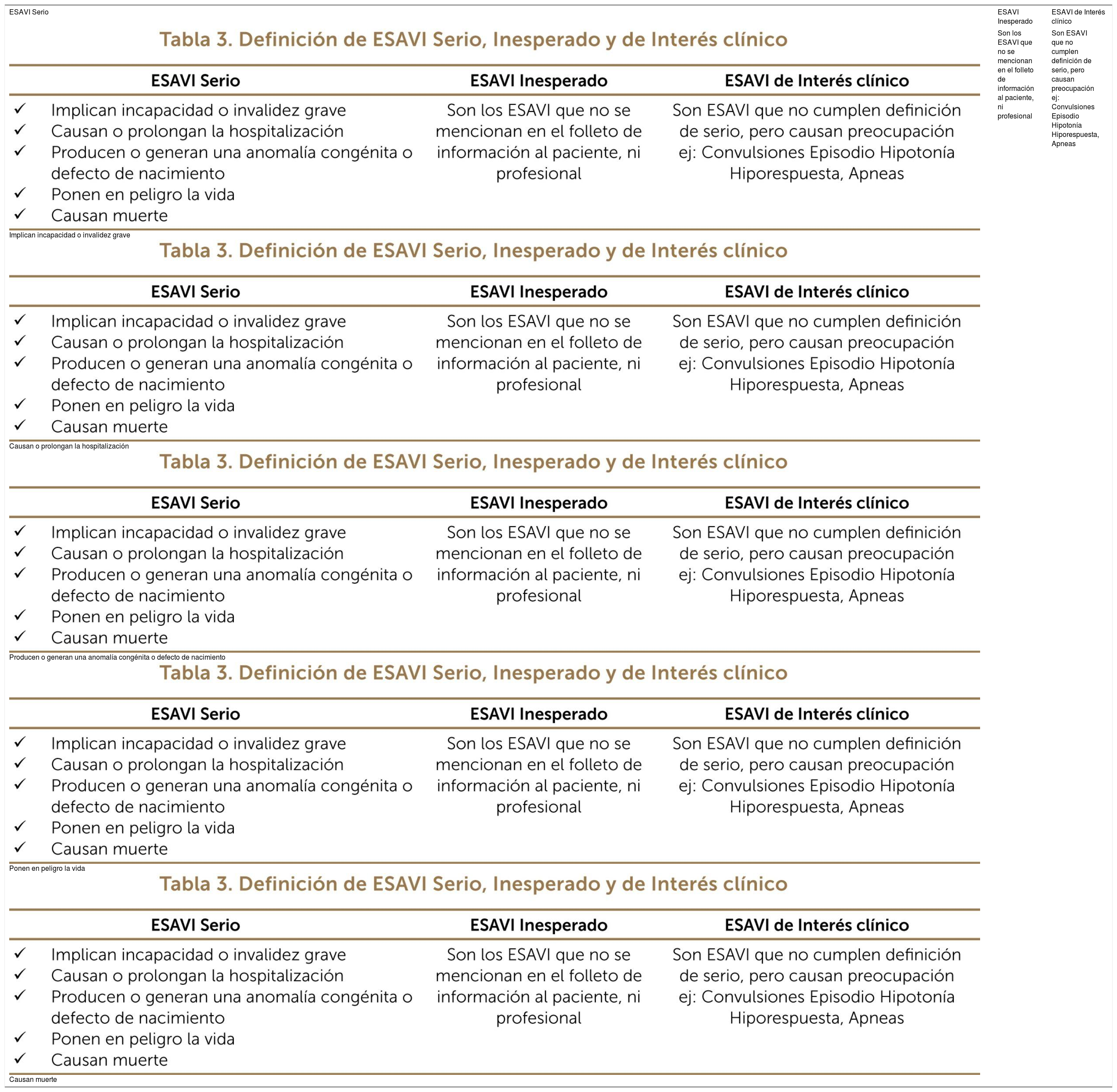
Los ESAVI calificados como serios, inesperados y de interés clínico son evaluados en un comité de expertos compuesto por profesionales del CNFV y del Departamento de Inmunizaciones del MINSAL, y por especialistas externos pertenecientes a la Sociedad Chilena de Pediatría, la Sociedad Chilena de Infectología, y un neurólogo de adultos. En la tabla 3 se muestra la definición de un ESAVI serio, ESAVI inesperado y ESAVI de interés clínico.
Definición de ESAVI Serio, Inesperado y de Interés clínico
| ESAVI Serio | ESAVI Inesperado | ESAVI de Interés clínico |
|---|---|---|
| Implican incapacidad o invalidez grave Causan o prolongan la hospitalización Producen o generan una anomalía congénita o defecto de nacimiento Ponen en peligro la vida Causan muerte | Son los ESAVI que no se mencionan en el folleto de información al paciente, ni profesional | Son ESAVI que no cumplen definición de serio, pero causan preocupación ej: Convulsiones Episodio Hipotonía Hiporespuesta, Apneas |
Además del análisis de casos individuales, para la detección de señales se realiza análisis cuantitativo, utilizando el método estadístico “razón de notificación proporcional”. El PRR, por sus siglas en inglés, que analizaremos en mayor detalle posteriormente en este artículo10,12.
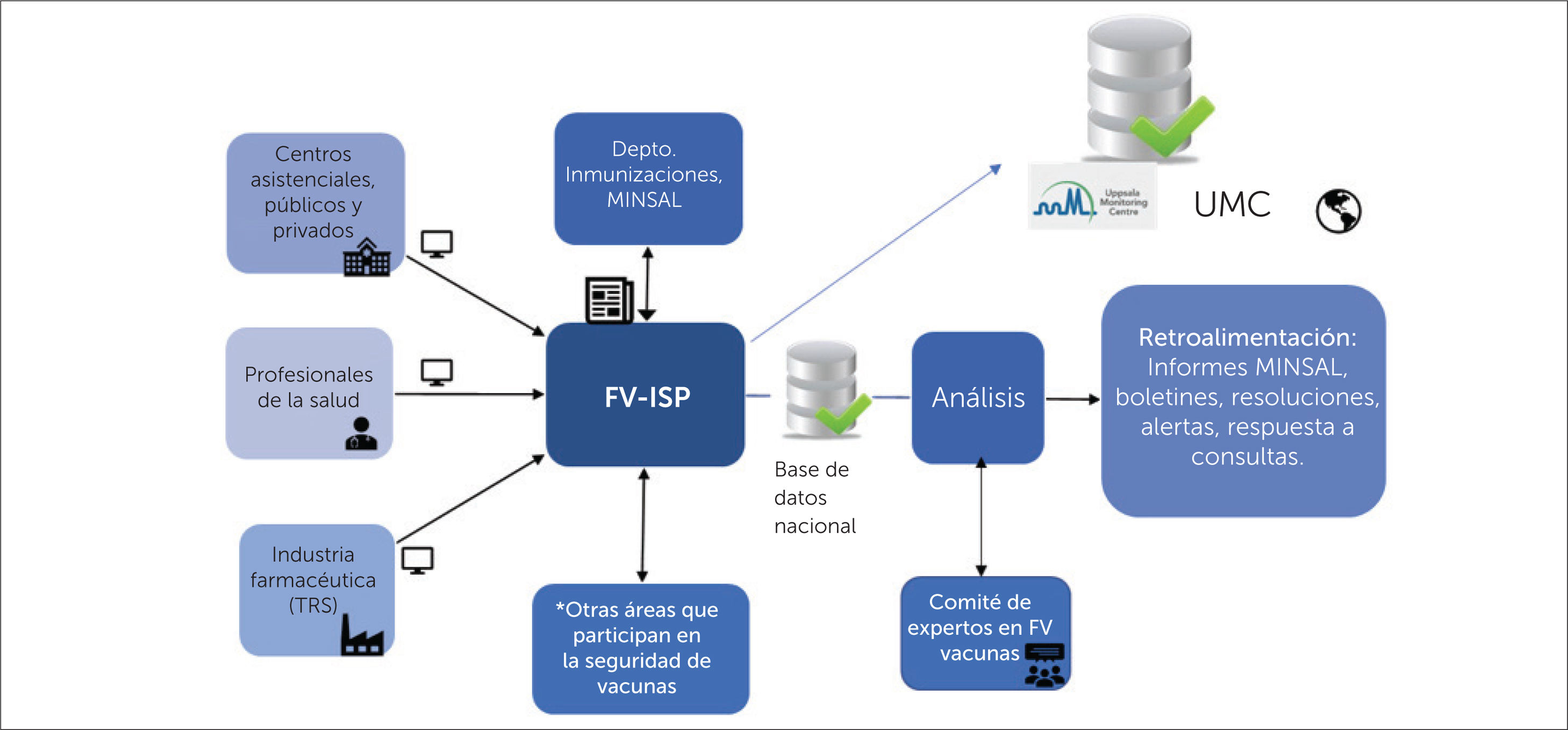
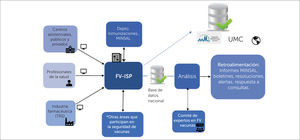
El sistema nacional de farmacovigilancia envía información de casos individuales al programa internacional de monitorización de medicamentos, a cargo de UMC. Chile es integrante de este programa desde el año 199619, desde entonces y hasta el año 2018 se ha enviado a UMC un total de 1696 reportes de ESAVI, vale decir el 29,2% del total de datos recolectados a nivel nacional. En la figura 1 se muestra el flujo de las notificaciones de ESAVI.
Esquema del flujo de la notificación de ESAVI al CNFV y a UMC
ESAVI= Evento Supuestamente Atribuible a la Vacunación o Inmunización, CNFV= Centro Nacional de Farmacovigilancia, FV= farmacovigilancia, ISP= Instituto de Salud Pública de Chile, UMC= Uppsala Monitoring Centre, TRS= Titulares de Registro Sanitario
*otras áreas que participan de la seguridad de vacunas son Departamento de Epidemiologia MINSAL; Departamento Laboratorio Biomédico Nacional y de Referencia, ISP; Subdepartamento Laboratorio Nacional de Control ANAMED, ISP; Subdepartamento de Autorizaciones y Registro Sanitario, Subdepartamento de Fiscalización, ANAMED, ISP.
Además de la monitorización de los ESAVI nacionales, el ISP realiza un seguimiento permanente de las alertas y notas informativas de seguridad de vacunas publicadas a nivel internacional, de esta forma, se evalúan y comunican las alertas que podrían tener un impacto a nivel nacional. Así mismo, el ISP cuenta con un centro de información de medicamentos16, que gestiona las respuestas a las consultas relacionadas con farmacovigilancia y seguridad de vacunas, provenientes de profesionales de la salud y otros tomadores de decisión.
Adicionalmente, el área de FVV del ISP participa en distintas instancias de trabajo conjunto con otras áreas del ISP, tales como Registro de Productos Farmacéuticos, Fiscalización, Laboratorio Nacional de Control de Medicamentos y con el Departamento Laboratorio Biomédico Nacional y de Referencia ISP, además de participar en el secretariado del Consejo Asesor de Vacunas e Inmunizaciones (CAVEI) del MINSAL20. Estas actividades permiten integrar información de las distintas áreas que impactan en la monitorización de la seguridad de vacunas.
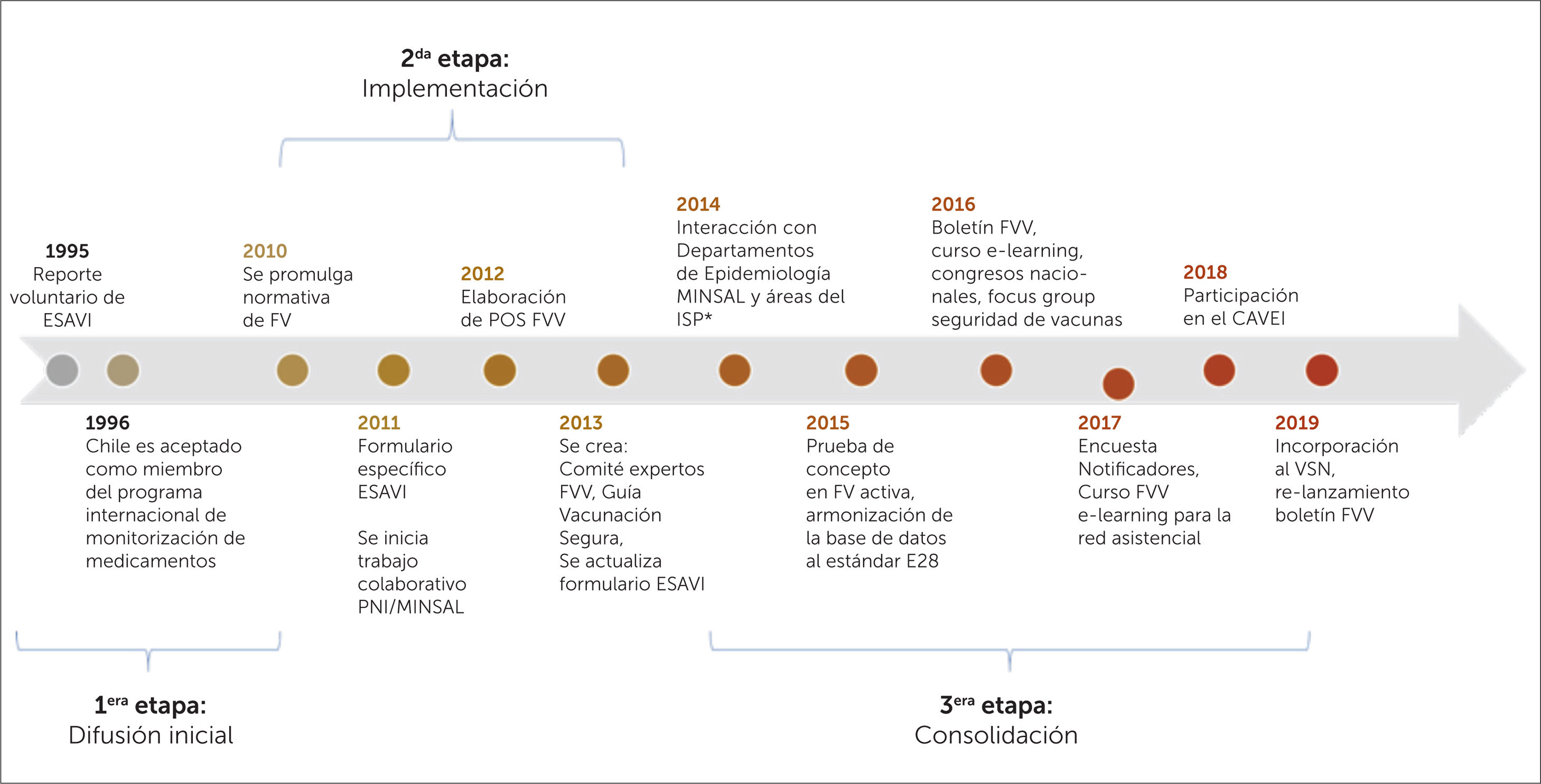
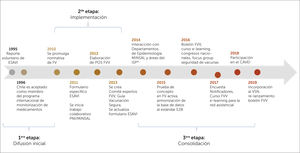
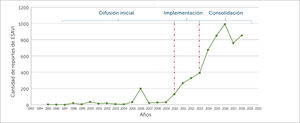
Etapas del desarrollo del sistema de farmacovigilancia en vacunas en ChileEl sistema de FVV en Chile se ha desarrollado de forma espontánea en tres etapas, que pueden ser clasificadas en: Difusión inicial, Implementación y Consolidación. Estas se detallan a continuación junto a algunos de sus resultados, lo que se ilustran en la figura 2.
Línea de tiempo del sistema nacional de FVV, que describe los distintos hitos de la implementación de la farmacovigilancia de vacunas en el país
FVV= Farmacovigilancia de Vacunas, ESAVI= Evento Supuestamente Atribuible a la Vacunación o Inmunización, MINSAL= Ministerio de salud de Chile, Estándar E2B= estándar de transmisión de datos en Farmacovigilancia, creado por la Conferencia Internacional de Harmonization (ICH), POS = Procedimiento Operativo Estándar. VSN = Vaccine Safety Net. CAVEI=Consejo Asesor de Vacunas e Inmunización.
Esta etapa corresponde al periodo 1995-2010, donde no existía un marco legal que estableciera la obligatoriedad de notificar ESAVI. No obstante el CNFV recibió notificaciones voluntarias de ESAVI por parte de profesionales de la salud, utilizando las herramientas dispuestas para la monitorización de Reacciones Adversas de Medicamentos (RAM), sin existir un trabajo sistemático entre el ISP y el PNI, sino una interacción frente a hechos puntuales, que se ve reflejada en la figura 3, cuando en el año 2006 posterior a un cambio de proveedor de vacunas se detectó un aumento en el número de notificaciones de ESAVI por parte del PNI, las que fueron reportadas al ISP, y también en el año 2010 a raíz de la campaña de la vacunación contra la Influenza tipo H1N1, se evidenció un mayor número de notificaciones por parte del PNI al ISP19,21,22.
Segunda etapa: ImplementaciónEl año 2010 se promulgó el Decreto Supremo N°3, que aprobó el Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de Uso Humano, el cual determinó la obligatoriedad de notificación de los ESAVI, por parte de los profesionales de salud, directores técnicos de establecimientos y titulares de registro sanitario, normativa que entró en vigencia el año 2011. A raíz de esta, se identificó la necesidad de una relación permanente entre el ISP y el PNI, que consistió en generar una serie de acciones de colaboración, como: la elaboración de un formulario de notificación de ESAVI, capacitación a los encargados regionales del PNI, elaboración de Procedimientos Operativos Estándar en el ISP y PNI que determinan una comunicación permanente entre las áreas en cuanto a la monitorización de ESAVI, así como informar el inicio de nuevas campañas de vacunación y cambios de vacunas utilizadas. Adicionalmente se creó el comité de expertos de FVV, denominado Equipo de FVV, el que está compuesto por profesionales del CNFV y del Departamento de Inmunizaciones del MINSAL, y por especialistas externos que realizan el análisis de causalidad de casos serios, inesperados y de interés clínico, es decir, los que presentan mayor relevancia en cuanto al impacto en la comunidad. Esta etapa culmina el año 2013 con la elaboración en conjunto de la Guía de Vacunación Segura, en la cual se establecieron los roles y funciones a nivel local, intermedio y central en la notificación, investigación y evaluación de los ESAVI en el país7,17,18,23. Durante esta etapa, se evidenció un aumento sostenido de la notificación de sospechas de ESAVI, ver figura 3.
Tercera etapa: ConsolidaciónDurante esta fase se incorporó el intercambio de información con otras áreas vinculados a la vigilancia de enfermedades inmunoprevenibles, como el Departamento de Epidemiologia del MINSAL y el Departamento Laboratorio Biomédico Nacional y de Referencia del ISP, se armonizaron las bases de datos del CNFV, incorporándose estándares internacionales, además se participó de iniciativas internacionales en seguridad de vacunas, como el proyecto de Colaboración Multi-País, coordinado por OPS y OMS24–26, y en la elaboración de un puente informático que permitió aumentar en un 182% el número de sospechas de ESAVI enviadas a la base de datos global que administra UMC27. Adicionalmente, se trabajó con alumnos de pre y posgrado, en el desarrollo de estrategias de retroalimentación masiva, en la elaboración de una encuesta (dirigida a notificadores de ESAVI) y en el mejoramiento de la página web del sitio de FVV28,29.
Actividades y herramientas utilizadas de las fases de implementación y consolidación del sistema nacional de farmacovigilancia de vacunas.A continuación, se detallan las actividades realizadas por el CNFV y las herramientas utilizadas, partiendo desde la codificación de los reportes en la base de datos nacional, elaboración de estadísticas descriptivas, cálculo de tasas de reportes, detección de señales, análisis de causalidad de casos individuales, retroalimentación, comunicación, notas informativas y medidas regulatorias.
a) Codificación y estadística de las notificaciones de ESAVILas notificaciones de ESAVI son codificadas e ingresadas a una base de datos en el CNFV, utilizando para la descripción clínica de RAM el diccionario de terminología de la OMS (WHO-ART), la clasificación internacional de enfermedades (ICD-10) para codificar el motivo de la administración de la vacuna, y el quinto nivel de la clasificación Anátomico Químico Terapéutica (ATC) para la codificación del principio activo. En cuanto al registro y transmisión de los datos se utiliza el estándar E2B*, desarrollado por la Conferencia Internacional de Armonización (ICH).
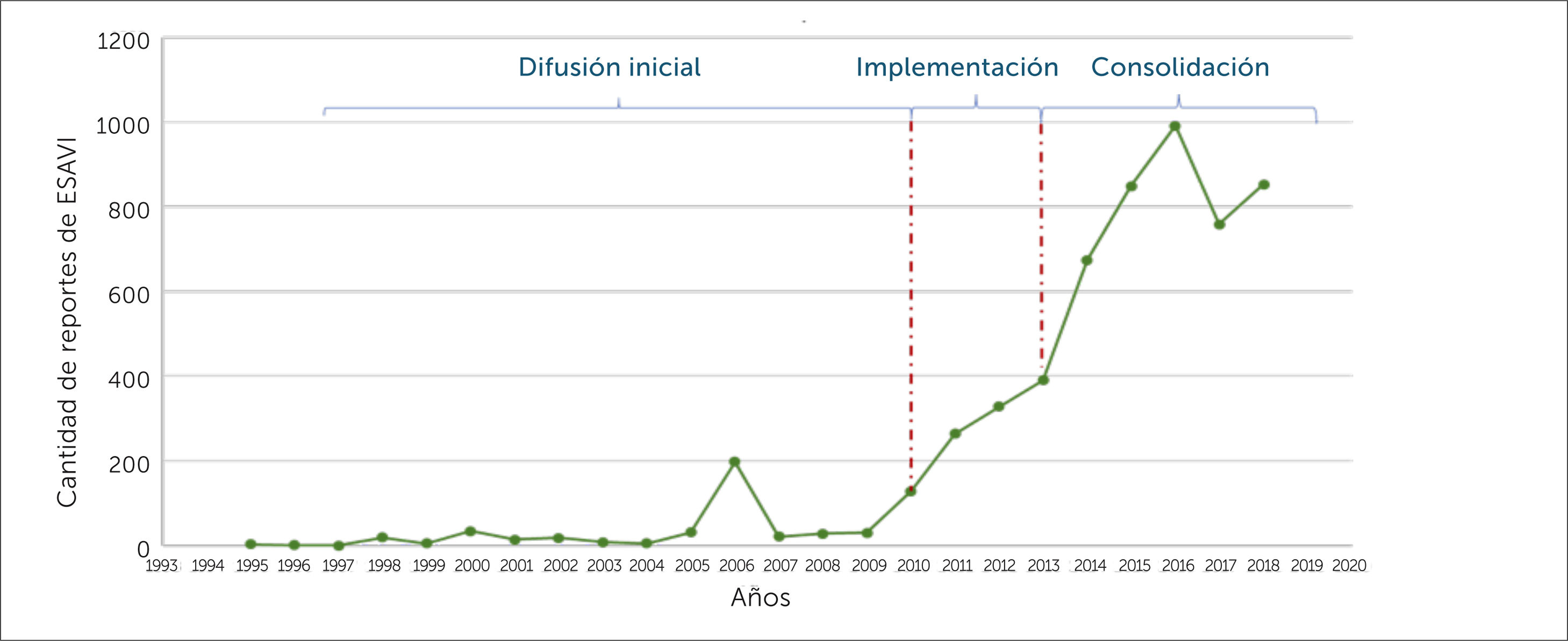
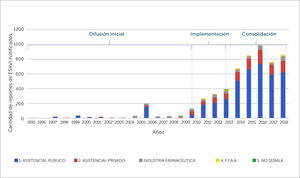
Durante el periodo 1995-2018, se envió un total de 5650 notificaciones de ESAVI al CNFV, mostrando un alza sostenida de la notificación por 7 años consecutivos durante las fases de implementación y consolidación del sistema de FVV, con un descenso el año 2017, seguido de un aumento en el año 2018**, como se muestra en la figura 3.
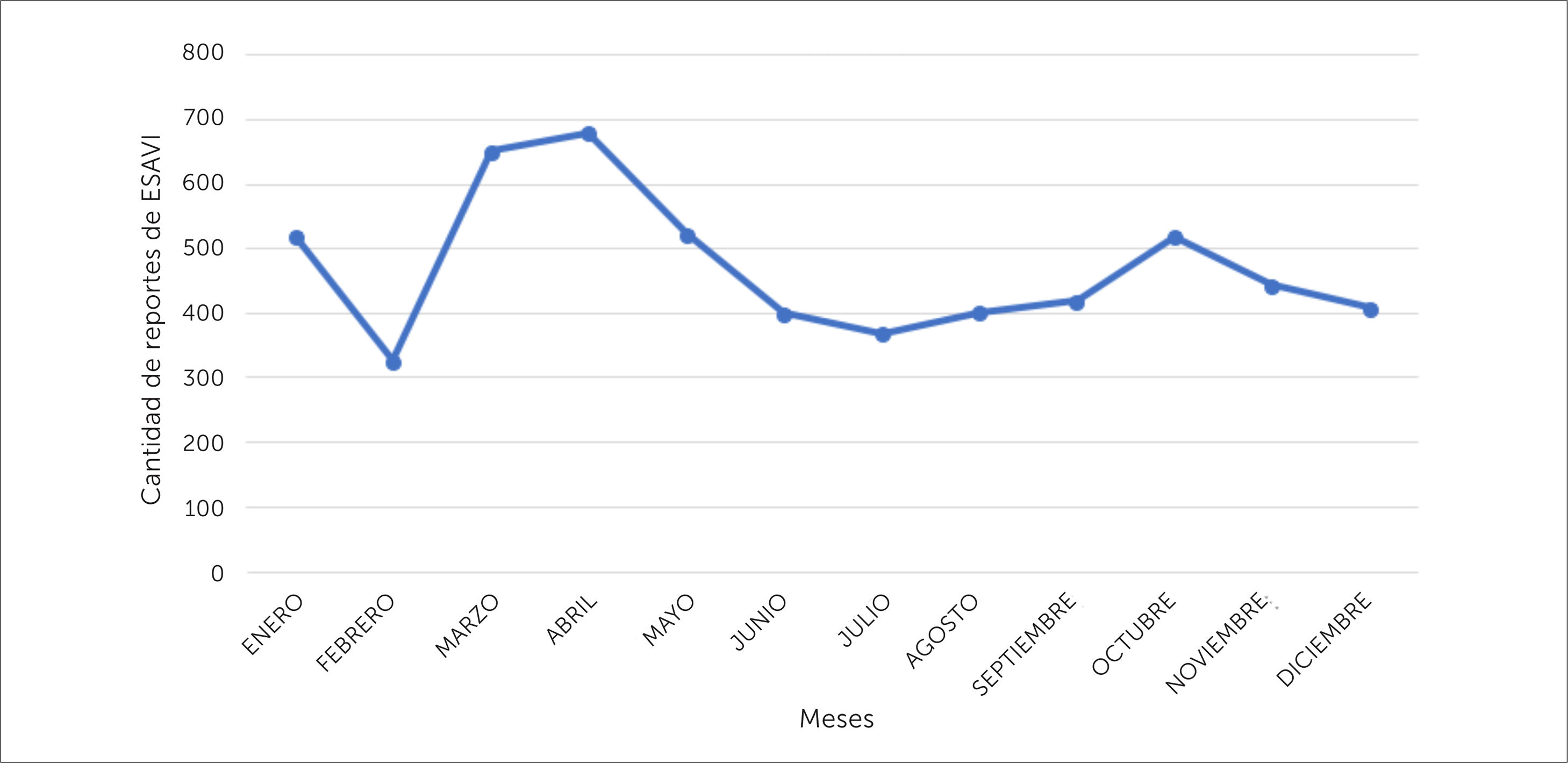
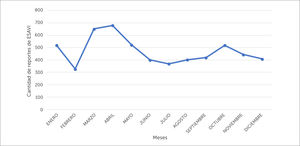
El número de notificaciones de ESAVI se relaciona en parte con la cantidad de dosis de vacuna utilizadas. Es por ello que, cuando se detectan alzas en las estadísticas, uno de los primeros pasos a seguir es conocer el número de dosis de vacunas administradas tanto en campaña como aquellas programáticas en el periodo de estudio. Por ejemplo: cuando se inicia una campaña de vacunación, aumenta el número de personas vacunadas, por lo que es probable que aumente el número de notificaciones de los ESAVI más frecuentes. Al hacer una gráfica de la cantidad de notificaciones de ESAVI versus los meses del año en el periodo 1995-2018 (ver figura 4) se evidencia un aumento de notificación en los periodos de campaña contra la influenza (marzo-mayo), periodo en el cual el PNI administra aproximadamente 4.500.000 dosis de vacuna influenza cada año. Por otra parte, en el segundo semestre del año, se evidencia un aumento en la cantidad de ESAVI notificados en los meses de septiembre y octubre, periodo en que se realiza la estrategia de vacunación escolar (extramural), y que en algunos años ha coincidido con el inicio de otras campañas de vacunación. Estos ejemplos muestran que un aumento en la cantidad de notificaciones de ESAVI no puede ser interpretado a priori como un problema de seguridad, sino, más bien, genera la necesidad de recopilación de mayor información, partiendo por conocer si se ha aumentado el número de dosis de vacunas utilizadas en el país. Por otra parte, se debe considerar que al aumentar el número de individuos expuestos a una vacuna, se aumentan las posibilidades de detectar ESAVI raros o muy raros e inesperados, siendo esta una de las principales ventajas de la vigilancia pasiva, por lo que también deben ser relacionados estos datos con las dosis administradas de la vacuna. Esto a modo de establecer tasas de reporte habitual que se presenta en el país y que nos permiten realizar comparaciones con la tasa de reportes de otros países30.
Distribución del promedio mensual de las notificaciones de ESAVI recibidas en el CNFV, en el periodo 1995-2018, de acuerdo al mes en que fue recibido el reporte
ESAVI= Evento Supuestamente Atribuible a la Vacunación o Inmunización, CNFV= Centro Nacional de Farmacovigilancia
Nota: octubre 2015 (campaña sarampión de octubre), agosto 2016 (inicio de la vacunación contra el VPH en niñas), octubre 2017 (campaña de vacunación contra tos convulsiva en embarazadas). VPH = Virus Papiloma Humano.
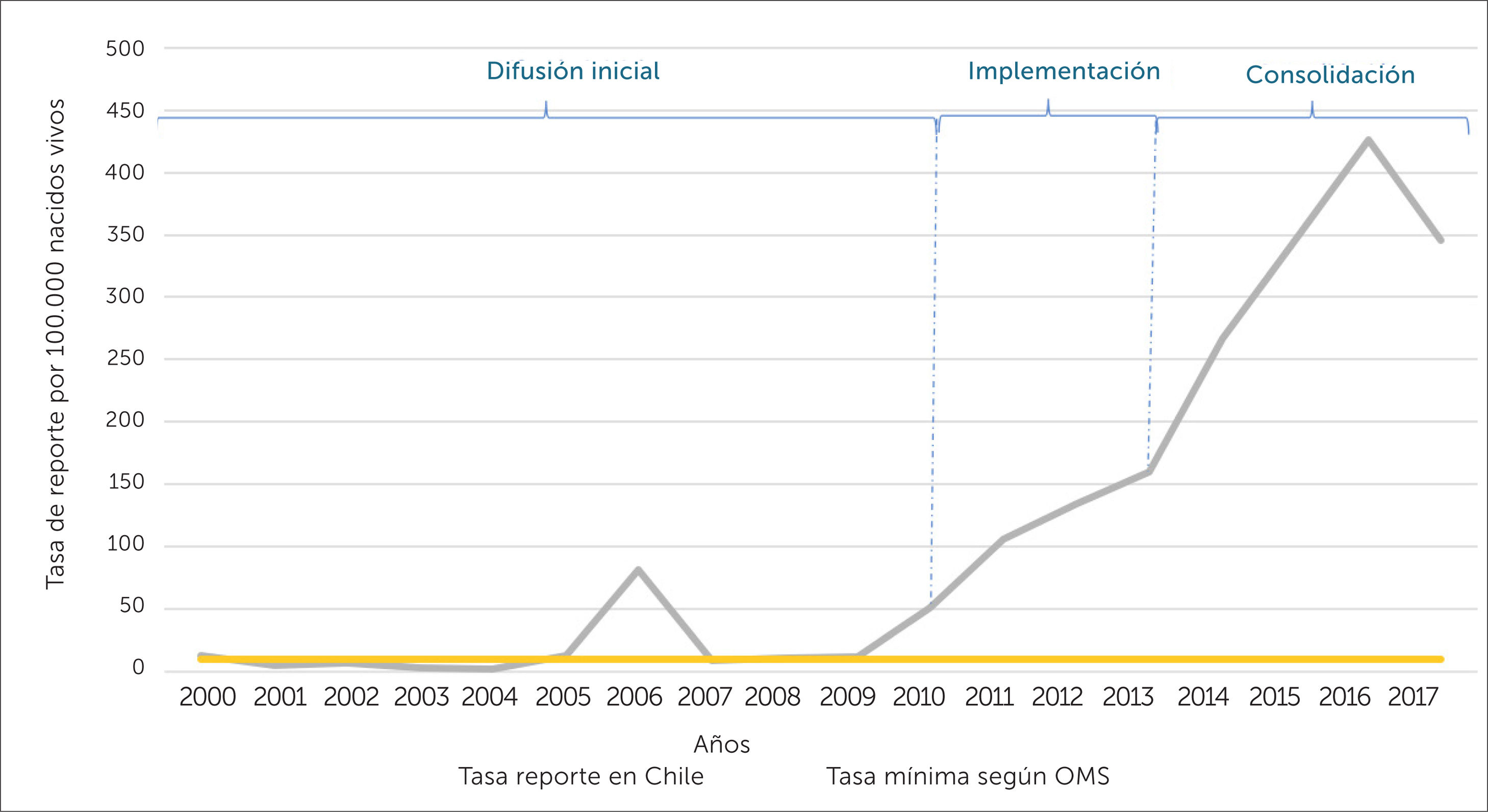
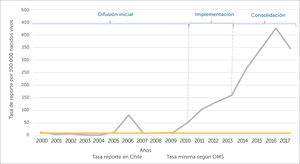
Con los datos de vigilancia pasiva es posible determinar si se alcanza la tasa de reporte de 10 ESAVI por 100.000 nacidos vivos establecido como el mínimo requerido por OMS para demostrar una capacidad mínima en seguridad de vacunas. En el periodo 2000-2017, de acuerdo a la tasa de nacidos vivos en el país31, se evidencia que, en la fase de difusión inicial, se presentó un comportamiento errático en cuanto a la tasa de reporte, de 11 años evaluados, en 5 no se alcanzó la tasa mínima de reporte establecida por OMS. No obstante, a partir de la fase de implementación y consolidación del sistema, se evidencia una tasa de reporte superior al mínimo establecido por OMS, llegando el año 2017 a ser hasta 34 veces superior al mínimo requerido (ver figura 5).
Tasa de notificaciones de ESAVI en Chile versus tasa requerida por OMS, para contar con un mínimo de capacidad en seguridad en vacunas (10 ESAVI/100.000 nacidos vivos)
Tasa de notificaciones de ESAVI en Chile versus tasa requerida por OMS, para contar con un mínimo de capacidad en seguridad de vacunas (10 ESAVI/100.000 nacidos vivos). La tasa de reporte se obtuvo a partir de los datos del CNFV y de la tasa de nacidos vivos corregida publicada por el Departamento de Estadísticas e Información de Salud de MINSAL31.
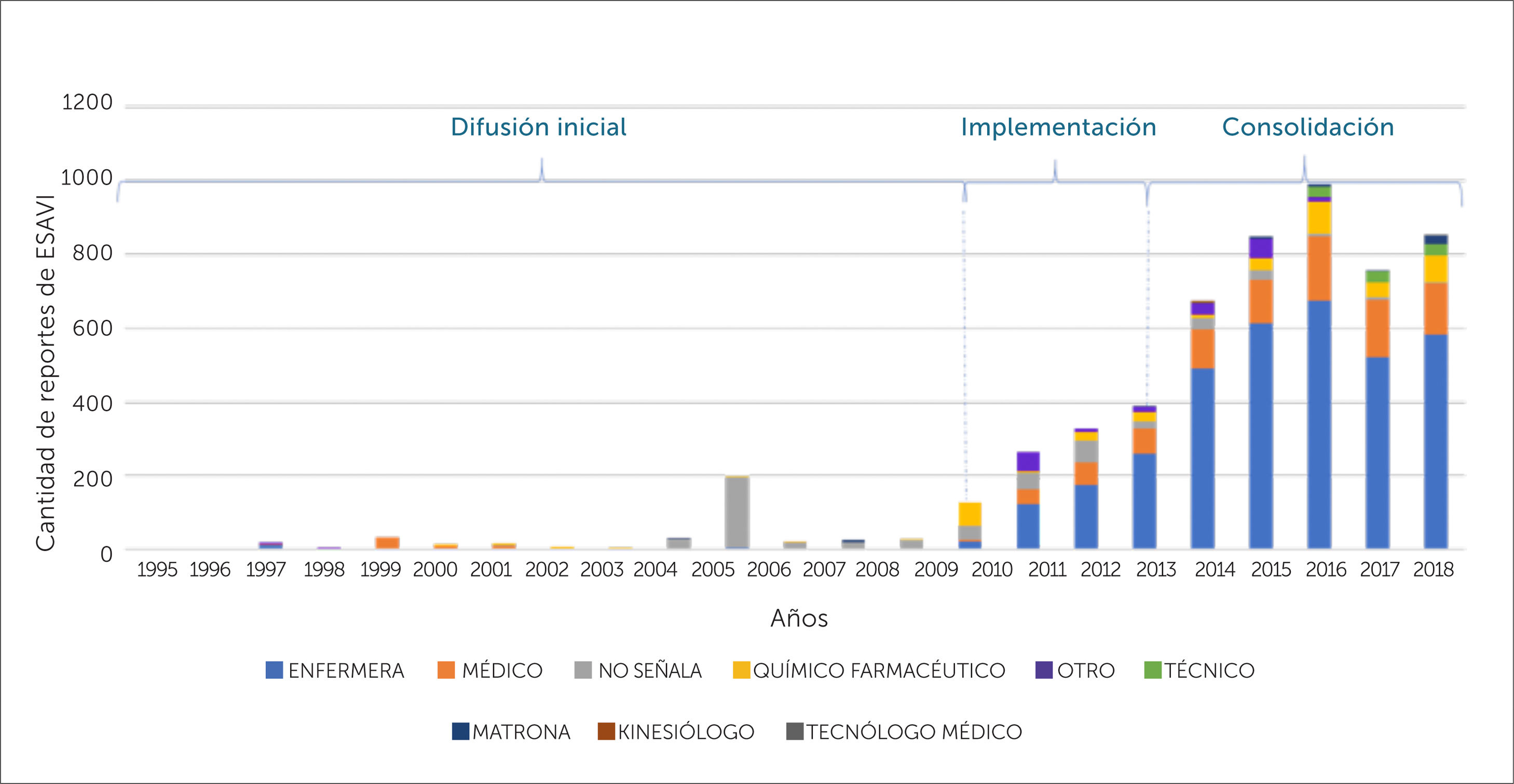
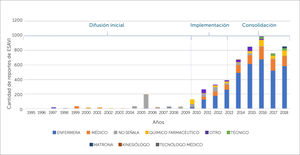
Al revisar la distribución de las notificaciones de ESAVI en el periodo 1995-2018, de acuerdo a la profesión del notificador, se muestra que en la fase de difusión (1995-2010) un 66,7% de las notificaciones de ESAVI realizadas no indica profesión, siendo el 18% realizado por medicos, seguidos por un 6,3% notificados por enfermeras, un 5,8% por químicos farmacéuticos, un 2,2% por matronas y un 1% por otra profesión. A diferencia de la la etapa de implementación y consolidación un 66,1% de los casos fue notificado por enfermeras, seguidas por médicos con un 16,6% y por los químicos farmaceúticos con un 6,9%, siendo sólo un 4,4% de los reportes aquellos en los que no se señala la profesión del reportante y correspondiendo un 3,3% a otras profesiones,un 1,7% a técnicos, un 0,9% a matronas mostrandose, en los últimos 3 años, un incremento de la notificación por parte de los técnicos de enfermería, según se muestra en la figura 6.
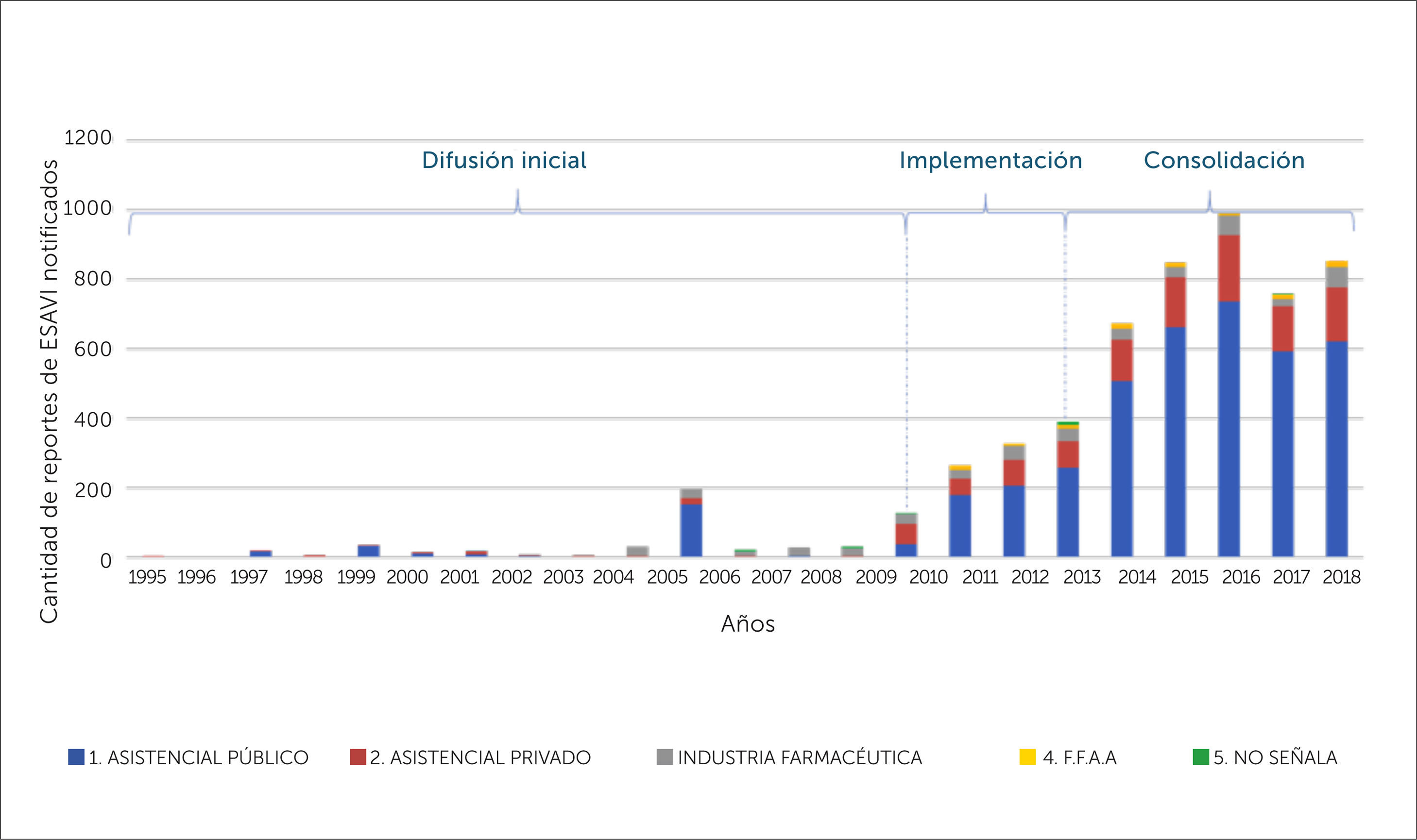
En cuanto a la distribución de notificaciones de ESAVI por tipo de establecimiento desde el que se notifica, la mayoría proviene de centros asistenciales públicos, con un 71,6%, seguido de centros asistenciales privados con un 18,3% y la industria farmaceútica con un 8%, los establecimeintos ligados a las fuerzas armadas (FFAA) con un 1,8%, en tanto en un 0,3% no se señala el tipo de establecimiento, ver figura 7.
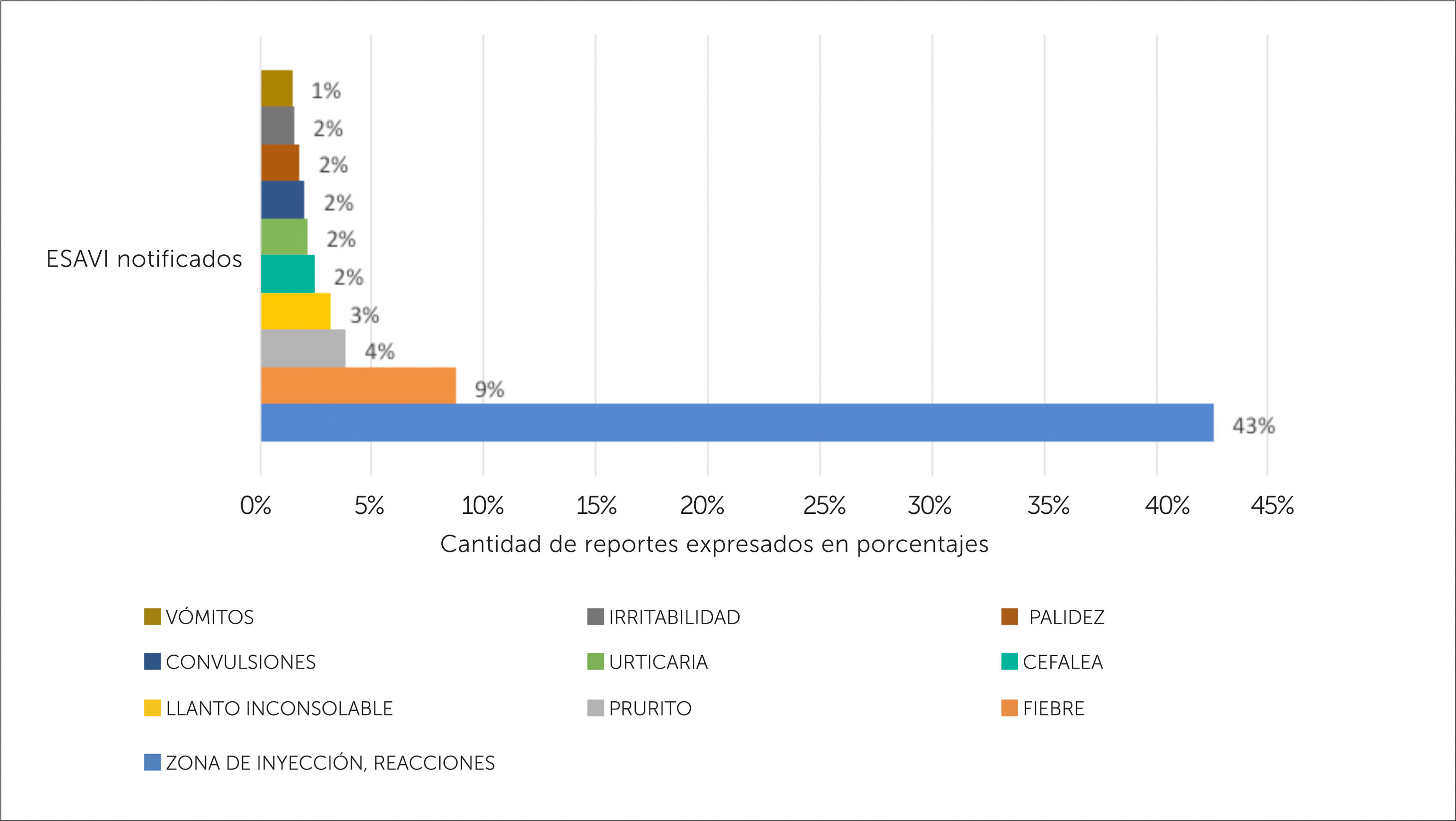
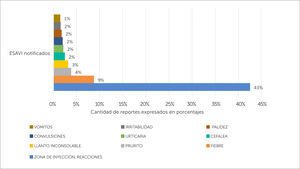
Tal como se mencionó anteriormente, en la fase de consolidación se logró armonizar la terminología utilizada para la descripción de ESAVI de la base de datos del CNFV, esto permitió identificar los ESAVI más notificados en el periodo 1995-2018, siendo las reacciones locales en la zona de inyección las más notificadas con un 42,6%, seguido de fiebre con un 8,8%, prurito con un 3,9%, llanto inconsolable con un 3,2%, cefaleas con un 2,5%. Todos ESAVI conocidos y descritos en la literatura, ver figura 8.
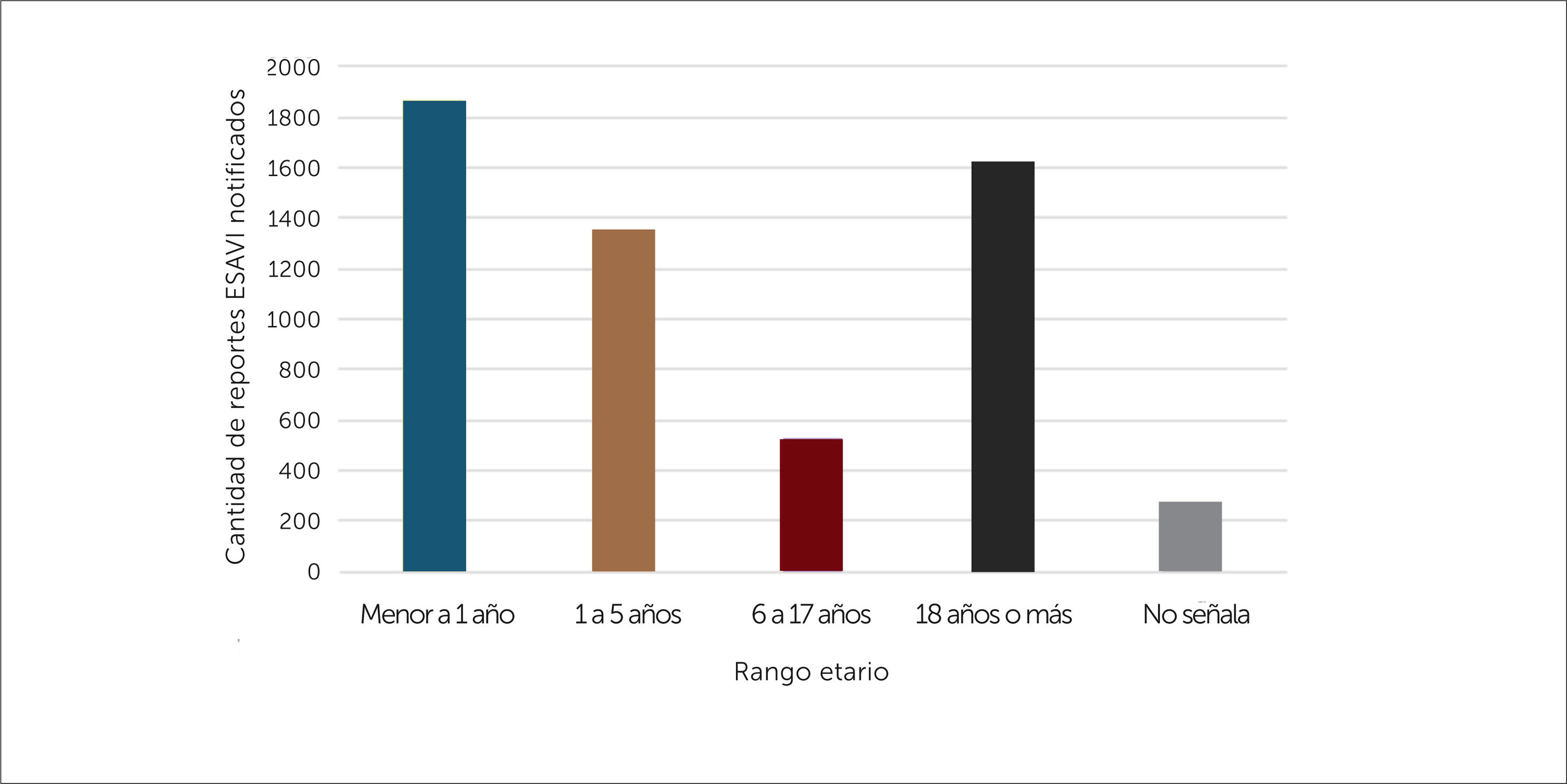
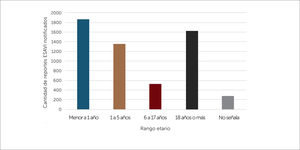
Al caracterizar los reportes por grupo etario, se evidencia un mayor número de reportes en la población menor de 18 años (un total de 3751 reportes), especialmente en el grupo menor a un año de edad, esto probablemente por la cantidad de vacunas administradas a los 0, 2, 4 y 6 meses de edad según calendario de vacunación, ver figura 9.
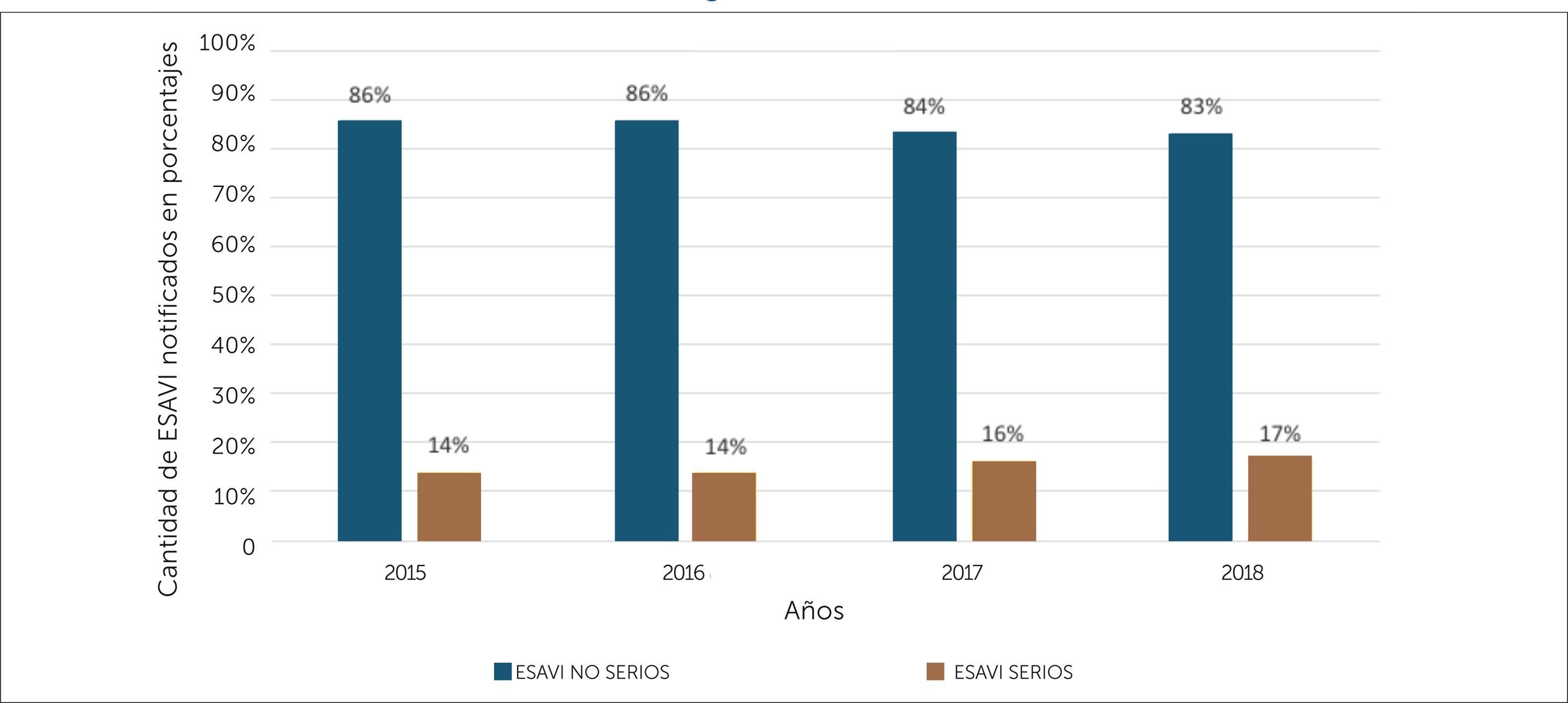
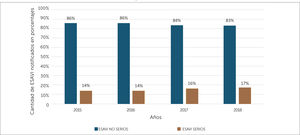
Además, en la fase de consolidación fue posible armonizar los criterios de seriedad de las notificaciones, así a partir del año 2015 es posible identificar la cantidad total de ESAVI serias por año en el CNFV. En el periodo 2015-2018 los ESAVI no serios corresponden en promedio al 84,8% y los ESAVI serios 15,2% del total de notificaciones recibidas, en la figura 10 se muestra la distribución por año y seriedad. Del total de casos serios el 75,9% requirió hospitalización, siendo las convulsiones# el evento serio más frecuente, con un total de 120 casos.
b) Cálculo de tasas de notificaciónComo se mencionó anteriormente, un aumento en la cantidad de notificaciones de ESAVI puede deberse a un aumento en el número de la población vacunada, y no necesariamente está relacionado con la seguridad de la vacuna. Por esta razón, para la monitorización de eventos específicos, el CNFV calcula la tasa de notificación del evento, usando como numerador la cantidad de notificaciones de ESAVI recibidas en el CNFV y como denominador el número de dosis de vacunas administradas por el PNI, en el mismo periodo. Esto permite monitorizar las tasas de reporte observadas en el país, y compararlas con las tasas descritas en la literatura. Ejemplo de ello es la información obtenida al revisar los datos del CNFV sobre notificaciones de convulsiones posteriores a la administración de vacuna neumocócica conjugada, vacuna sarampión-rubéola -paperas (SRP), y vacuna pentavalente, se observa que las tasas obtenidas a nivel nacional son menores a las descritas en literatura32–35 (ver tabla 4).
Tabla comparativa entre las tasas descritas en literatura y las tasas observadas con datos nacionales
| Periodo | ESAVI | Vacuna sospechosa | Tasa descrita en literatura1-3 | Tasa observada de reporte año 2018 |
|---|---|---|---|---|
| 2018 | Convulsiones* | Neumocócica conjugada | 1/1.000-1/10.000 | 1.71/100.000 |
| Convulsiones* | Sarampión, rubéola, paperas | 1/2.300-2.600 | 1.52/100.000 | |
| Convulsiones* | Pentavalente | 1/12.500 | 6.88/100.000 |
Nota: Incluye los términos WHOART convulsión febril, convulsión, convulsión tónico-clónica.
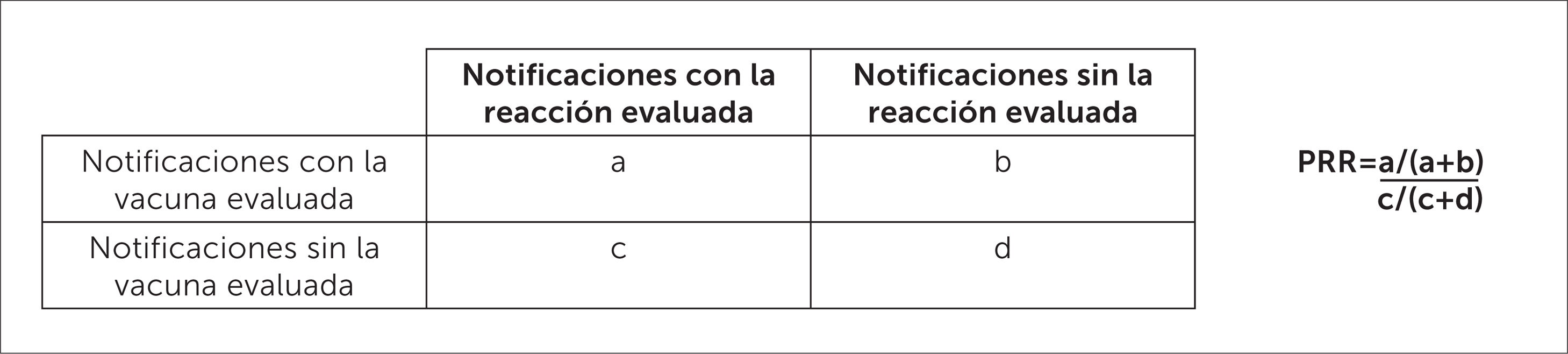
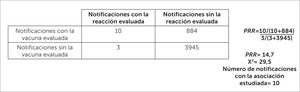
En el CNFV, para detectar potenciales señales en FVV se utiliza la razón de notificación proporcional (PRR), un indicador estadístico de desproporcionalidad, que permite estimar la probabilidad de que la asociación entre una vacuna y una reacción adversa sea una potencial señal de farmacovigilancia, y priorizar aquellas asociaciones que requieran una evaluación cuidadosa y en profundidad. El cálculo de la medida de desproporcionalidad se basa en una tabla de contingencia de dos por dos, como se muestra en la figura 11 y 12.
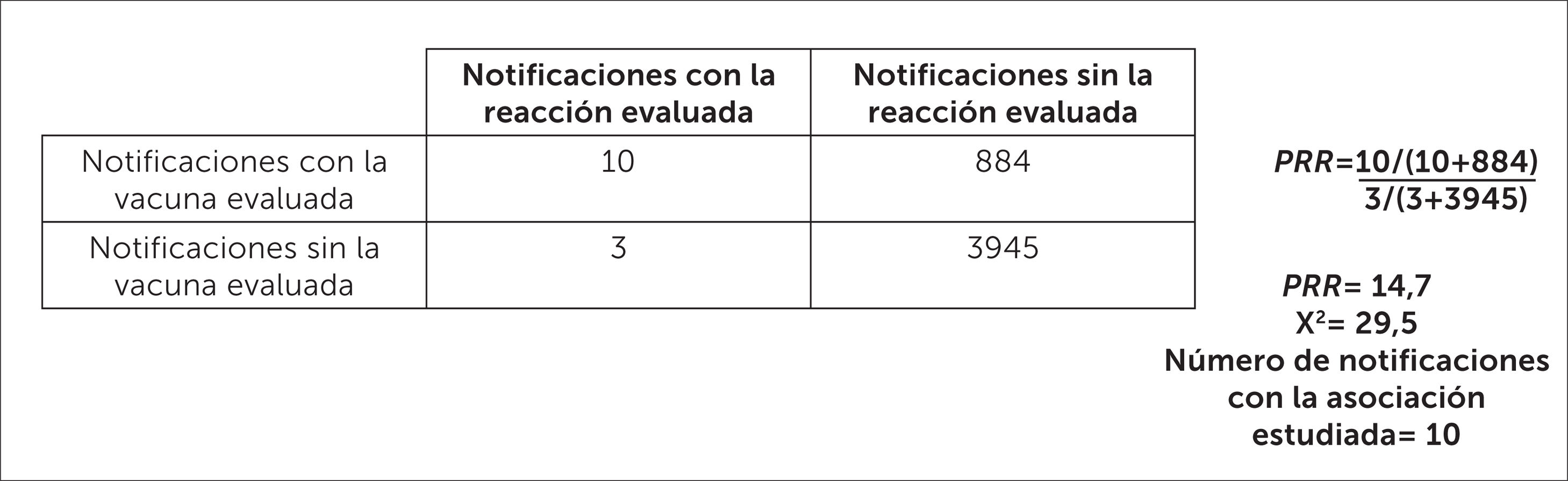
Una vez que se calcula el PRR, se considera que una asociación es una posible señal cuando el PRR >2, el valor de Chi2>4 y el número de notificaciones con la asociación evaluada es >310,12,36,37.
En el ejemplo de la figura 12 se muestra el cálculo de PRR para el Síndrome de Guillain Barré sospechoso de estar asociado a la vacuna influenza estacional, considerando el periodo 2012-2018. El resultado de este análisis indica que existe una mayor desproporcionalidad del reporte para la vacuna influenza estacional en comparación con las demás vacunas, lo que es clasificado como “señal potencial”.
Luego de realizar la detección de una “señal potencial” es necesario realizar un análisis cualitativo de los datos, que incluye caracterizar los casos, detectar notificaciones duplicadas, descartar causar alternativas, revisar patrones comunes, y en el caso del CNFV se realiza además un análisis de causalidad de los casos individuales.
d) Análisis de causalidad de casos individualesEsta evaluación se realiza utilizando el algoritmo descrito en el manual de seguridad de vacunas recomendado por OMS1. Esta metodología requiere que la notificación de ESAVI posea toda la información necesaria (historia clínica, resultados de exámenes, confirmación de la fecha de vacunación, etc) y que ésta cumpla con la definición de caso, vale decir, que el evento notificado cumpla con los elementos clínicos que correspondan al diagnóstico del ESAVI. Para ello el CNFV utiliza las definiciones de caso de Brighton Collaboration (colaboración internacional de científicos expertos en el desarrollo de criterios que permiten la clasificación de un evento de acuerdo a su certeza diagnóstica), o en su defecto la definición del evento clínico según un consenso médico publicado. Una vez que el evento ha cumplido con la definición de caso, se aplica el algoritmo de la OMS, que contempla 4 factores. Primero, conocer si hay causas alternativas establecidas que puedan ocasionar el evento. Segundo, conocer si hay antecedentes bibliográficos de la relación causal con la vacuna. Tercero, conocer si el evento ocurrió dentro de la ventana de tiempo descrita. El cuarto factor es si existe evidencia que demuestre que la vacuna sospechosa y el evento no están relacionados.
En base a los antecedentes, el caso puede ser catalogado como:
- a)
Consistente, es decir, resulta razonable considerar que está relacionado con la inmunización.
- b)
Indeterminado, cuando existe una relación temporal pero no hay evidencia suficiente que logre probar o descartar la asociación con la vacuna o bien existen factores tanto a favor como en contra de la asociación con la vacuna.
- c)
Inconsistente, donde resulta más razonable considerar que el evento puede ser causado por otros factores, tales como una enfermedades de base, una enfermedad concomitante, otros medicamentos administrados, alergias alimentarias, entre otros.
- d)
La categoría inclasificable se utiliza para indicar que faltan antecedentes que permitan evaluar el caso1.
Este tipo de análisis individual no establece una causalidad definitiva entre un evento y la vacuna administrada, sino que está destinado a determinar el grado de plausibilidad de que el evento presentado tras la administración de una vacuna pueda haber sido provocado por ésta1.
e) Retroalimentación y ComunicaciónEn los sistemas de vigilancia pasiva se considera que la retroalimentación es necesaria para mantener adherencia por parte de los notificadores, no obstante, constituye un desafío permanente contar con sistemas de retroalimentación eficientes38,39.
El ISP realiza retroalimentación masiva desde el año 2016, a través del boletín de farmacovigilancia de vacunas, el que se encuentra disponible en la página web del ISP, difundiendo información sobre FVV, la que se encuentra dirigida a profesionales de la salud y a contar del año 2019 comenzó a ser emitido de forma anual. Además, se elaboraron dípticos dirigidos a la población en general que entregan información sobre el beneficio y seguridad de las vacunas, realizados en base a información recopilada en diálogos participativos con la comunidad.
Adicionalmente, existe retroalimentación de casos individuales de notificaciones de ESAVI serios y de mayor relevancia, que consiste en la elaboración de un informe que contiene la descripción del caso clínico, resultados de la evaluación de causalidad y la recomendación de la conducta a seguir en las futuras vacunaciones.
Otra forma de retroalimentación son las respuestas a consultas relacionadas al beneficio y seguridad de vacunas y/o estadísticas de ESAVI que realiza la Sección Información de Medicamentos del ISP, que está enfocada en dar respuesta a las consultas de profesionales de la salud, y que entre los años 2000-2018ha respondido 365 consultas en esta materia.
También se considera una forma de retroalimentación la participación en charlas, cursos presenciales y cursos online sobre farmacovigilancia de vacunas, habiendo capacitado aproximadamente a 4100 personas desde el año 2011 a diciembre de 2018.
Un hito particularmente relevante ocurrió el año 2019, con el ingreso de la página web del ISP a la Red de Seguridad de Vacunas de la OMS (Vaccine Safety Net, VSN por su sigla en inglés), lo que lo valida como un sitio con información sobre vacunas confiable, de calidad y de fácil acceso a la población. Esto se logró luego de un proceso de mejora del sitio web de la información relativa a farmacovigilancia de vacunas del ISP, contenida en la página, enfocada en disponer información útil tanto para los profesionales de la salud y la población en general, creando secciones en las cuales se entrega material educativo, se responden preguntas frecuentes y se aclaran mitos relacionados con la seguridad de vacunas28.
f) Notas Informativas y Medidas RegulatoriasEn aquellos casos que, en base a información emergente a nivel nacional o internacional, se requiera difundir o reiterar alguna información de seguridad, sea que, por ejemplo se detecte algún cambio en la relación beneficio/riesgo de una vacuna (por ejemplo: ESAVI previamente no descritos, nuevas precauciones, nuevas contraindicaciones transitorias o absolutas, restricción de uso de una vacuna en grupos etarios específicos por motivos de seguridad) o simplemente, se quiera llamar la atención sobre algún aspecto que no está siendo suficientemente tenido en cuenta, el ISP tiene la facultad de emitir notas informativas y resoluciones. En la tabla 5 se detallan las últimas notas informativas y resoluciones en materia de seguridad de vacunas, para el periodo 2018-2019.
Notas informativas y resoluciones emitidas por temas de seguridad en vacunas periodo 2018-2019
| Año | Documento | Aspecto de seguridad |
|---|---|---|
| 2019 | Resolución 2532: Se Autoriza modificación al folleto vacuna SRP | Se incorpora la contraindicación de uso de la vacuna SRP en pacientes con antecedentes de alergia a la proteína de la leche de vaca mediada por IgE, o reacción anafiláctica a la leche o una dosis previa de la vacuna |
| 2019 | Nota Informativa: Vacunas Vivas atenuadas no deben ser usadas en pacientes con inmunosupresión clínica significativa | Se recuerda a los profesionales de la salud una contraindicación ya conocida, pero que en el Reino Unido generó casos de BCGitis con desenlace fatal en neonatos con exposición uterina a antagonistas de factor de necrosis tumoral alfa |
| 2018 | Resolución 4971: Actualiza Folletos de Información al profesional y paciente de los productos farmacéuticos de la vacuna anti influenza | Instruye a los titulares de registro sanitario a incorporar como precaución de la vacuna influenza, el estimar la relación beneficio/riesgo en pacientes que hayan presentado Síndrome de Guillain Barré dentro de las 6 semanas posterior a la anterior administración de esta vacuna |
A nuestro entender, este es el primer artículo que describe la operatividad del sistema de farmacovigilancia en Chile, en lo que refiere a la farmacovigilancia de vacunas.
El funcionamiento de la farmacovigilancia de vacunas en Chile ha sido destacado a nivel internacional, reflejándose tanto en el cumplimiento del 100% de los indicadores de farmacovigilancia durante el proceso de obtención de la acreditación como autoridad reguladora de referencia regional (nivel IV) de OPS, el año 2016, en el cual se abordaban algunos indicadores específicos a FVV. Otro hito internacional es la participación de nuestro país en el actual proceso de elaboración del Manual de Farmacovigilancia de Vacunas para las Américas.
Es necesario consignar, no obstante, los desafíos que enfrenta el sistema de FVV en Chile. Entre ellos se encuentran los siguientes:
- •
El sistema de notificación pasiva, es útil para la detección de posibles señales. No obstante, la sensibilidad del sistema depende de la notificación espontánea que realicen los distintos actores del sistema, por lo que se requiere seguir generando estrategias eficientes que motiven la notificación de ESAVI.
- •
Se debe incrementar la cantidad de notificaciones de ESAVI enviadas al programa internacional de monitorización de medicamentos. Actualmente existen limitaciones tecnológicas que impiden el envío del 100% de las notificaciones, y a pesar que se ha trabajado con puentes informáticos que han contribuido a incrementar el envío de notificaciones de ESAVI en los últimos años, aún no es posible enviar el 100% de la información.
- •
Actualmente la normativa que rige el sistema de farmacovigilancia no incluye la notificación por parte de los pacientes (usuarios de vacunas), no obstante, se encuentra en consulta pública una modificación del Reglamento del Sistema Nacional de Control de los Productos Farmacéuticos de Uso Humano, que incluye incorporarla, esto permitirá detectar señales directamente desde la población. Adicionalmente se deberán optimizar los mecanismos de análisis, educación y retroalimentación a los pacientes en materia de seguridad de vacunas.
- •
Se deben generar capacidades y alianzas estratégicas con la academia para la realización de estudios post comercialización sobre seguridad de vacunas. Si bien el ISP y MINSAL participaron de una prueba de concepto internacional en farmacovigilancia activa, es necesario contar con un sistema estable de evaluación de hipótesis en materia de seguridad de vacunas.
- 1.
La farmacovigilancia en vacunas es una actividad fundamental en la monitorización del perfil de seguridad de las vacunas utilizadas por la población nacional, regional y mundial.
- 2.
En Chile el marco normativo promulgado el año 2010, la elaboración de procedimientos, el trabajo permanente con el Departamento de Inmunizaciones, la conformación de un comité de expertos de ESAVI y las diferentes estrategias de retroalimentación, han contribuido a mejorar la tasa de reporte nacional y el análisis de los casos.
- 3.
La tasa de reporte de notificaciones de ESAVI en relación a nacidos vivos demuestra que Chile, desde el año 2010, ha alcanzado la capacidad mínima requerida en vigilancia de la seguridad de vacunas, de acuerdo a los estándares de la OMS.
- 4.
Chile actualmente cuenta con un sistema de monitoreo de ESAVI basado en vigilancia pasiva que permite calcular las tasas de reporte según eventos, detectar nuevas señales y, realizar análisis de causalidad de casos individuales.
- 5.
Actualmente se cuenta con numerosos mecanismos de retroalimentación para los actores del sistema de FVV, así como con una vía de difusión de información de nivel mundial, que cumple con estándares de calidad que le permiten ser parte de la Red de Seguridad de Vacunas de la OMS.
- 6.
Los datos nacionales e internacionales del perfil de seguridad de las vacunas, recabados por el sistema nacional de FVV han sido considerados para la generación de medidas regulatorias en el país, en materia de seguridad de vacunas.
Declaro (Adiela Saldaña) que no he recibido ningún tipo de remuneración por mi participación en el presente artículo, mi empleador es el Instituto de Salud Pública de Chile, desde el año 2015 integro el equipo de expertos del Grupo de Estrategia Priorizada de la Iniciativa Global de Seguridad de la OMS, actividad voluntaria que no posee remuneración y no tengo conflicto de intereses en relación al artículo. Y aunque no representa conflicto de interés, en aras de la transparencia debo señalar que estoy casada con Nahum Vergara uno de los autores de este artículo.
A todos los funcionarios de la salud que contribuyen día a día al sistema de FVV, Servicios de Salud, a las referentes del PNI de las SEREMIs, por su permanente contribución en el seguimiento de casos y capacitación a los equipos, a todos los alumnos y profesionales que han participado en la investigación y estandarización de métodos, a los médicos especialistas que han aportado su experiencia y formación en el análisis de casos clínicos, a todo el equipo de trabajo del Subdepartamento de FV del ISP, del Departamento de Inmunizaciones, MINSAL, por su trabajo permanente en la monitorización del perfil de seguridad de las vacunas y finalmente, a la OMS y la OPS por su apoyo permanente en el desarrollo del sistema de FVV en Chile.
Nota 1: La base de datos está codificada de esta manera desde el año 2012 en adelante. En el periodo 1995-2011, la base de datos se encuentra estandarizada en cuanto a la descripción del ESAVI con la terminología WHO ART y la codificación del principio activo con el quinto nivel de la clasificación ATC.