Los cuadros de lumbociática secundarios a hernia del disco intervertebral (hdi) son frecuentes y causantes de importante morbilidad. En esta revisión narrativa, nos enfocaremos en los aspectos clínicos y de manejo de esta frecuente patología. Se tiene que mantener un algo grado de sospecha, pues no siempre los cuadros clínicos son similares a lo descrito clásicamente. Los signos radiculares irritativos y un examen neurológico exhaustivo son fundamentales, asimismo la correlación entre este cuadro y las imágenes. El curso natural de la hdi es en general hacia la resolución y, por lo tanto, el tratamiento de elección es inicialmente conservador. La cirugía tiene un rol generalmente en pacientes que han fracasado con el manejo conservador. Esta tiene mejores resultados en el corto plazo que el tratamiento conservador continuo, pero en el largo plazo son equivalentes. Es fundamental discutir estos aspectos con el paciente, para lograr una elección informada del tratamiento, de acuerdo a sus preferencias
Sciatic pain caused by a herniated disk (ldh) is frequent and cause of significant morbidity. In this narrative review, we will discuss the clinical aspects and management of ldh diagnosis and management. High suspicion for ldh diagnosis must be kept, since its clinical picture is not always classical. Tension signs and neurological examination are key, along with correlation with images. Ldh natural history is generally towards resolution and therefore, conservative treatment is the first choice. Surgery has its role for patients who have failed conservative treatment. Surgery achieves a faster pain alleviation than conservative treatment, but on the long-term results tend to become equivalent. Ample and detailed discussion of these aspects with the patient are clue for an informed consent and satisfactory results.
Entre un 60-90% de la población sufrirá una crisis de dolor lumbar en algún momento en su vida, pero en sólo un 5-40% este dolor se irradiará a una extremidad inferior, constituyendo un cuadro clínico de lumbociática1–3. Tanto el dolor lumbar como el dolor ciático, son síntomas y como tal pueden ser causados por diversas etiologías3,4. De las diversas causas de ciática, la hernia del disco intervertebral (HDI) y patologías derivadas del disco constituyen más del 85% de los casos4. Este cuadro es más frecuente entre los 30-50 años y predomina en el sexo masculino en proporción 2:1.
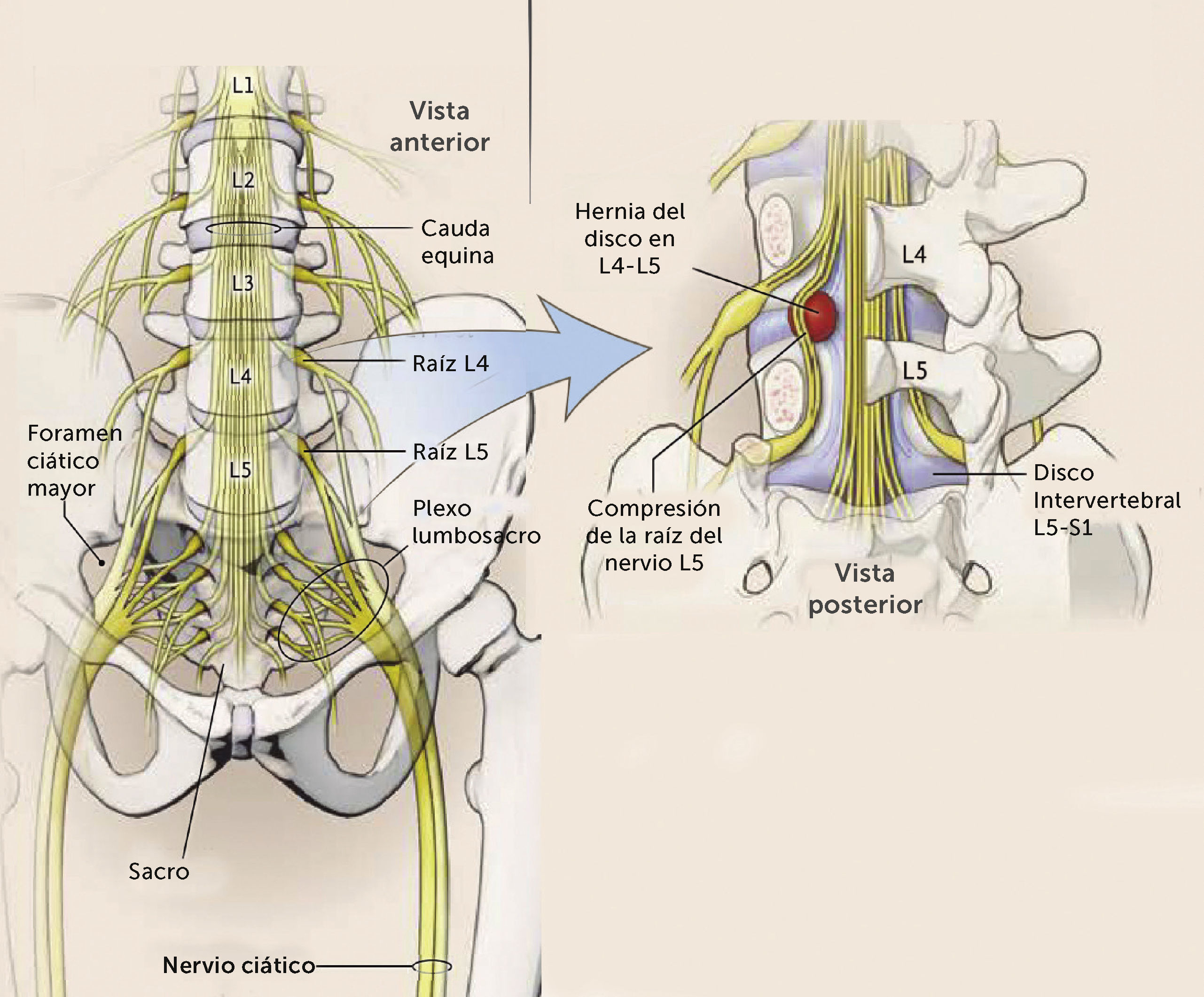
El nervio ciático está formado por contribuciones de las raíces L4 a S2, que después de unirse en el plexo lumbosacro, originan el nervio ciático propiamente tal, con sus divisiones peronea y tibial (Figura 1). Si bien, raíces más altas que contribuyen a otras estructuras neurales como el nervio femoral también pueden ser afectadas, el sitio más frecuente de lesión es la zona de los recesos laterales de los niveles discales lumbares L4-5, L5-S1 y menos frecuentemente L3-44.
Estructura y formación del nervio ciático y compresión de raíz L5 izquierda por HDI L4-5 posterolateral. Nótese que generalmente la compresión se da en la raíz descendente y no en la que sale en el mismo nivel (adaptado de Ropper AH, Zafonte RD. Sciatica. Longo DL, ed. N Engl J Med. 2015;372(13):1240-1248) (Ref. 4).
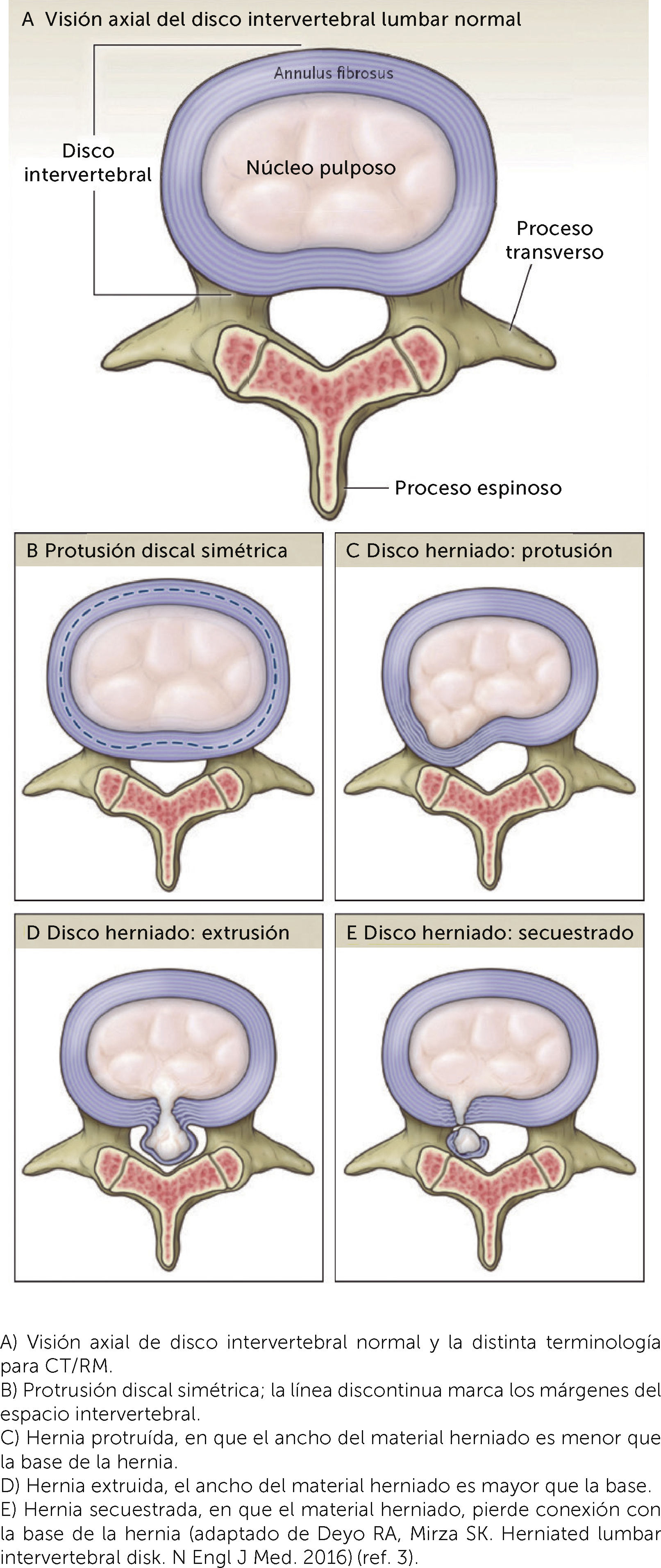
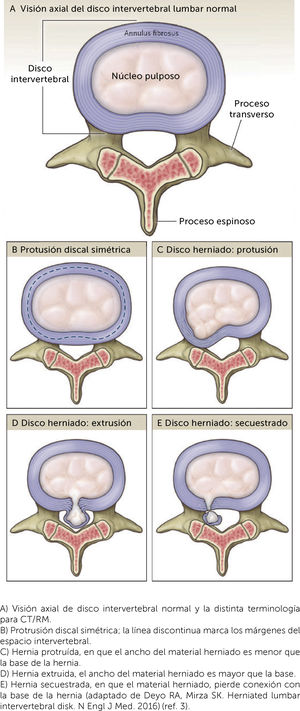
La estructura del disco en visión axial, consiste en el anillo fibroso (AF), compuesto de capas helicoidales alternadas de fibras predominantemente de colágeno tipo I (Figura 2). Este encierra una zona interna o núcleo pulposo (NP), que está compuesto principalmente por agua y una malla de fibras de colágeno tipo II y proteoglicanos, moléculas altamente hidrofílicas, que mantienen la presión interna del sistema al mantener hidratado el NP5. Con cargas axiales el NP dispersa los vectores de fuerza centrífugamente hacia el AF, para disiparlos en cargas en tensión. Además, este sistema permite la movilidad del segmento.
Estructura del disco intervertebral en visión axial: A) Visión axial de disco intervertebral normal y la distinta terminología para CT/RM. B) Protrusión discal simétrica; la línea discontinua marca los márgenes del espacio intervertebral. C) Hernia protruída, en que el ancho del material herniado es menor que la base de la hernia. D) Hernia extruida, el ancho del material herniado es mayor que la base. E) Hernia secuestrada, en que el material herniado, pierde conexión con la base de la hernia (adaptado de Deyo RA, Mirza SK. Herniated lumbar intervertebral disk. N Engl J Med. 2016) (ref. 3).
Con la edad hay una pérdida de las células que mantienen la matriz extracelular, llevando a la deshidratación del NP y fisuras progresivas en el AF. Esto puede llevar a la extrusión de parte del NP y capas internas del AF (luego el término HDI). Por lo tanto, la HDI se define como el desplazamiento focal o localizado de material discal más allá de los márgenes del espacio intervertebral6. Esto puede llevar a la inflamación de la raíz nerviosa próxima y producirse el cuadro clínico característico. Aparentemente la reacción inflamatoria sería necesaria para producir dolor y esto explicaría la frecuente presencia de HDI en personas asintomáticas incluso a temprana edad7. Es por esto que una buena correlación clínica-radiológica es fundamental para un correcto diagnóstico, pues se corre riesgo de atribuir síntomas a cambios imagenológicos asintomáticos.
La historia natural de la HDI es benigna, pues 35-97% de los pacientes alivia su sintomatología con un tratamiento conservador3. En un estudio aleatorizado en pacientes con HDI acerca de la efectividad del reposo en cama, 87% de los pacientes reportó alivio del dolor incluso independiente del reposo8. Por lo tanto, el tratamiento de inicio en la gran mayoría de los casos, es el conservador. La cirugía estaría indicada en caso de falla del tratamiento conservador por 4-6 semanas, paresia o debilidad progresiva, síndrome de cauda equina y dolor intratable. En todas estas indicaciones debe primar el criterio médico y la correlación clínico-radiológica9. En nuestro país, el tratamiento quirúrgico de esta patología está cubierta por AUGE7. En el caso de pacientes con paresia no progresiva de una raíz, el 81% de ellos había recuperado función motora al año en una serie10. En cuanto a déficits sensitivos, estos son más lentos de recuperar, con sólo un 50% de los pacientes habiéndose recuperado al año. También se ha visto la tendencia de las HDI a ser reabsorbidas en el tiempo, con cifras entre 66-90% dependiendo de la serie y el tiempo de seguimiento. Sin embargo, entre 8-37,5% de los pacientes pueden tener un incremento de volumen en su HDI11.
DiagnósticoLos síntomas y signos principales de un cuadro de lumbociática aguda por HDI son dolor, alteraciones sensitivas o paresia en distribución de una o más raíces lumbosacras12. Sin embargo, no todos los casos presentan dolor radicular clásico en toda la extensión dermatómica (p.ej. radiculopatía S1 con sólo dolor en cara posterior de muslo). En estos casos otros aspectos de la anamnesis pueden revelar que sí se trata de dolor radicular: presencia de parestesias asociadas, aumento con maniobras de Valsalva, rigidez en flexión lumbar, entre otros elementos clínicos. Dado este polimorfismo en su presentación, es necesario descartar otros diagnósticos diferenciales tan frecuentes como dolor lumbar agudo inespecífico no radicular, pero con dolor referido a extremidades; patología de cadera, polineuropatías metabólicas, insuficiencia vascular, entre otros. Además, refuerza la necesidad de una coherencia clínica y radiológica13.
Es imperativo siempre tener presente la posibilidad de un síndrome de cauda equina, no siempre evidente y con una presentación clásica. Si bien es de presentación infrecuente, sus secuelas pueden ser devastadoras si no se interviene a tiempo. El índice de sospecha debe ser en relación a la disfunción esfinteriana vesical, pues los otros elementos (p.ej. anestesia en silla de montar) son de presentación tardía y no promueven un diagnóstico precoz. En un estudio prospectivo de análisis transversal, se compararon 70 pacientes con HDI con y sin desarrollo de déficit motor dentro de su cuadro clínico. Entre los pacientes con déficit motor, 25% presentaba disfunción vesical14. Al comparar los grupos, los factores de riesgo encontrados para desarrollar déficit fueron: diabetes, inicio agudo de síntomas, HDI L3-4 o cefálica, HDI central, HDI migrada a superior, HDI secuestrada, >5,9mm de ancho AP HDI, compromiso de canal >59,4%, presencia de un canal lumbar óseo congénito. Al tener ≥4 factores, predice déficit motor con una sensibilidad de 74,3%, especificidad 77,1%, LHR+ 3,14,25.
En el examen físico es interesante reparar en las propiedades diagnósticas del TEPE (test de elevación de pierna extendida) en la detección de una radiculopatía15. Este se realiza con el paciente en decúbito supino y se eleva la extremidad afectada del paciente con la rodilla extendida. En cierto ángulo desde la horizontal se reproducirá el dolor irradiado del paciente y habrá resistencia muscular refleja. De este ángulo dependerán las propiedades diagnósticas del test, pues a menor ángulo de reproducción del dolor, éste será más específico, pero menos sensible para detectar radiculopatía (TEPE <30° sensibilidad 12%, especificidad 94%)15. Situación similar ocurre para el signo de TEPE contralateral, en el cual, al elevar la extremidad contralateral, se reproduce el dolor de la extremidad afectada3,16. Este hallazgo es muy específico de una radiculopatía. En una revisión sistemática reciente, se recomienda usar para el diagnóstico el signo de TEPE en conjunto con tres de cuatro de los siguientes criterios: dolor dermatómico, déficits sensitivos, alteración de reflejos osteotendíneos y/o paresia17. Finalmente, la presencia de TEPE en pacientes seleccionados, se ha asociado a mejores resultados de tratamiento18,19. Evidentemente, junto con el TEPE, corresponde hacer un examen neurológico completo del plexo lumbosacro y también, descartar patología articular según corresponda como diagnóstico diferencial.
Exámenes ComplementariosSi bien la radiografía es un examen simple y no invasivo, no tiene mucha utilidad si la sospecha clínica es clara para una radiculopatía. En este contexto la radiografía sólo sirve para descartar otras patologías como fracturas, metástasis, osteomielitis vertebral, deformidad o espondilolistesis en el contexto de pacientes que presentan síntomas de alarma tales como antecedentes de trauma, baja de peso, cáncer concurrente o fiebre2,3. Si bien el gold estándar para el estudio imagenológico de la HDI es la imagen por resonancia magnética (RM), los avances en las TAC multicorte han casi igualado las propiedades diagnósticas de la RM para HDI20. Por lo tanto, debe ser considerada como una alternativa en casos de contraindicación para RM (p.ej. marcapasos, claustrofobia) o en casos de necesidad urgente (p.ej. sospecha de síndrome de cauda equina sin RM disponible).
La RM es, sin embargo, la mejor alternativa para el estudio diagnóstico de una radiculopatía por HDI con más de un 97% de exactitud diagnóstica y una alta concordancia interobservador12,21. En este sentido, se ha avanzado en estandarizar la terminología con la que se describen las HDI en HDI protruida, extruida y secuestrada, dependiendo de la relación entre las dimensiones de la base de la HDI y su “cuerpo”6 (Figura 2).
Una controversia importante en la toma de decisiones terapéuticas es el efecto del tamaño de la HDI en los resultados tanto del tratamiento conservador como quirúrgico, habiendo hallazgos contradictorios22–24. Carragee y Kim25, en un estudio observacional de 186 pacientes con HDI tratados tanto con métodos conservadores como con cirugía, los distintos parámetros de las dimensiones de la HDI y su ocupación de canal fueron fuertes predictores de los resultados clínicos. Específicamente, todos los pacientes que tuvieron malos resultados quirúrgicos, tenían HDI de menos de 6 mm25. Sin embargo, este estudio no contaba con instrumentos de medición de discapacidad validados y los grupos de tratamiento conservador y quirúrgico no eran comparables, entre otros cuestionamientos metodológicos. Recientemente, otros grupos han reportado hallazgos similares con mejores resultados clínicos después de cirugía en pacientes con más de 1/3 de ocupación de canal por la HDI y peores resultados para pacientes con HDI pequeñas y cambios tipo Modic en las placas vertebrales23.
Los estudios electrofisiológicos tienen utilidad limitada pues demoran en aparecer cambios en los cuadros agudos y no ayudan a esclarecer cuál es la causa de la compresión radicular21. En general, la electromiografía y estudios de velocidad de conducción son más útiles en el diagnóstico diferencial de otras causas de dolor radicular (p.ej. polineuropatía diabética).
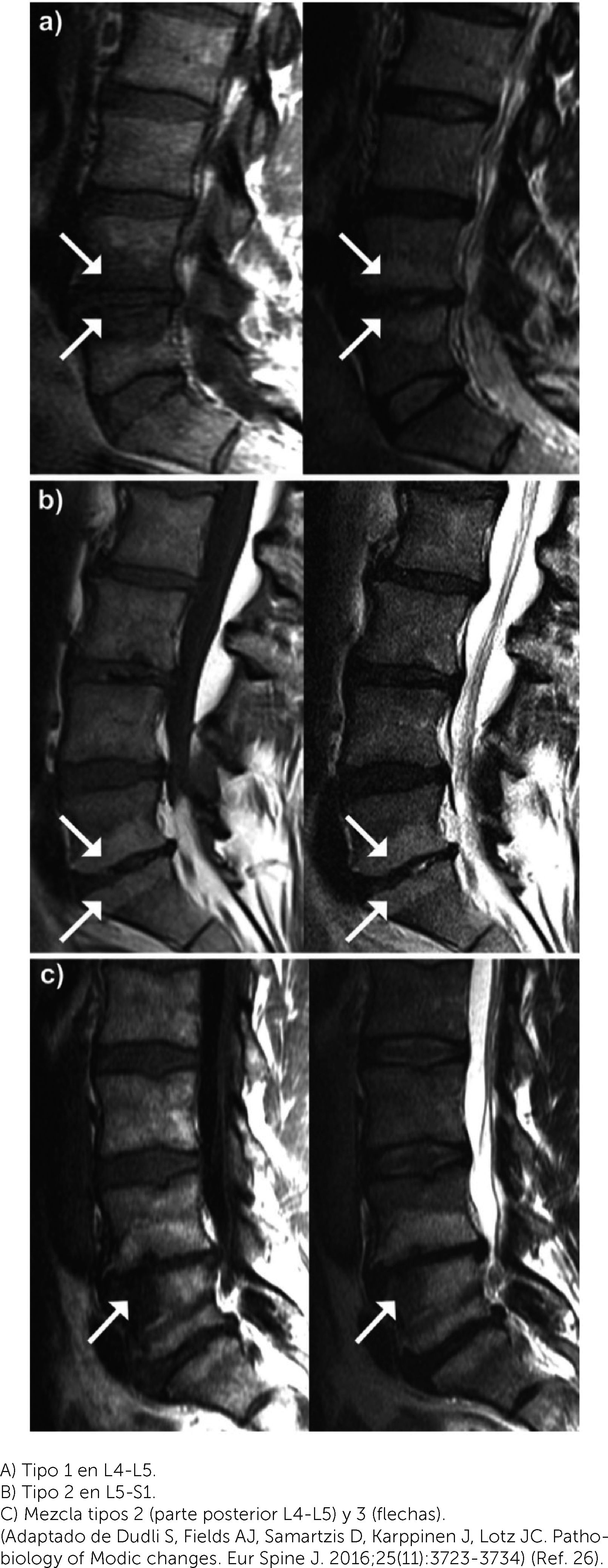
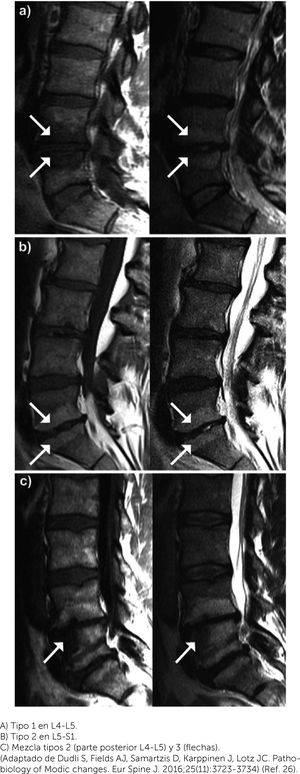
Cambios Tipo ModicLos cambios tipo Modic (CM) se observan en RM y son alteraciones en la señal de la médula ósea adyacente a las placas vertebrales (Figura 3)26. Se propusieron inicialmente dos subtipos (I y II) y se obtuvieron muestras histológicas en algunos casos. Se encontraron fisuras de placas vertebrales y tejido granulatorio en el tipo I; disrupción y conversión a médula ósea grasa en las tipo II. Posteriormente, se agregó un tercer tipo, que evidencia esclerosis en las placas subcondrales. Lo interesante de este fenómeno de placas, es que parecen marcar una etapa más avanzada de la degeneración discal y se asocian más frecuentemente a síntomas que otros tipos de discopatías. Además, como vimos anteriormente, podrían determinar peores resultados de tratamiento en pacientes con HDI23. Sin embargo, no es claro cuál es el origen de los CM, postulándose causas autoinmunes, mecánicas, degenerativas e incluso infecciosas27,28.
Cortes sagitales de RM en T1 (izquierda) y T2 (derecha) mostrando los tres tipos de cambios tipo Modic (flechas): A) Tipo 1 en L4-L5. B) Tipo 2 en L5-S1. C) Mezcla tipos 2 (parte posterior L4-L5) y 3 (flechas). (Adaptado de Dudli S, Fields AJ, Samartzis D, Karppinen J, Lotz JC. Pathobiology of Modic changes. Eur Spine J. 2016;25(11):3723-3734) (Ref. 26).
El curso natural de la HDI es generalmente hacia la resolución de los síntomas y, por lo tanto, el tratamiento conservador es el tratamiento de elección. Más del 30% de los pacientes ya se han recuperado a las 2 semanas y la mayoría lo ha hecho a las 6 semanas3. Por lo tanto, las 6 semanas se han usado como límite sugerido del tratamiento conservador de inicio y se ha usado como criterio de inclusión en todos los estudios prospectivos de manejo de HDI en los últimos años.
El tratamiento conservador debe ser multimodal con medicamentos, educación y terapia física12. Sin embargo, la mayoría de la evidencia pertinente es para dolor lumbar sin radiculopatía, o para otros cuadros de dolor neuropático crónico29–31. Desde el punto de vista farmacológico, es aceptado el uso de los antiinflamatorios32,33, corticoides parenterales34 y opiáceos para agudizaciones35. El rol de los corticoides sistémicos en cuadros de radiculopatía por HDI, es aún controvertido. Goldberg et al., mostraron sólo una leve mejoría funcional, pero sin alivio del dolor a las tres semanas en un estudio prospectivo aleatorizado comparando un curso de 15 días de prednisona oral versus placebo. El grupo que recibió prednisona, experimentó más efectos adversos36. Friedman et al., no demostraron diferencias estadísticamente significativas en un estudio aleatorizado de 82 pacientes que recibieron una dosis única de metilprednisolona intramuscular versus placebo, aunque hubo una tendencia hacia mejores resultados en el grupo experimental37. De manera reciente, en otro estudio aleatorizado para pacientes con lumbociática se comparó el uso de pregabalina versus placebo, sin encontrarse beneficios adicionales con el uso del medicamento38.
Infiltración peridural de corticoidesEl uso de la inyección de corticoides peridurales por distintas vías, se ha incrementado significativamente en el último tiempo. Esto se refiere a procedimientos realizados en estructuras específicas espinales, con guía fluoroscópica, no habiendo valor en procedimientos realizados a ciegas. Sin embargo, se duda de su utilidad más allá del alivio de dolor en el corto plazo, si bien reduciría la necesidad de cirugía ulteriormente en algunas series3,39. Es también importante notar un eventual rol diagnóstico de las inyecciones epidurales realizadas bajo guía imagenológica, tanto en el diagnóstico diferencial con otras patologías (p.ej. coxartrosis)40 y también como método de pronosticar qué pacientes se verán más beneficiados con cirugía41.
Tratamiento QuirúrgicoLa cirugía estaría indicada en casos de daño neurológico masivo (p.ej. síndrome de cauda equina), déficit motor progresivo, y más frecuentemente, en casos de fracaso del tratamiento conservador como vimos anteriormente9. En los primeros dos escenarios hay consenso entre los especialistas del mayor beneficio de la cirugía. Sin embargo, en el escenario más frecuente que es el último, es donde existe mayor variabilidad de criterio. Esto determina ya en parte los resultados obtenidos del tratamiento, como fue demostrado clásicamente en el estudio del condado de Maine42. En este estudio prospectivo se compararon los resultados de los distintos servicios quirúrgicos de columna pertenecientes al condado. Los distintos grupos profesionales tenían tasas de cirugía totalmente distintas con respecto al promedio regional. Asumiendo homogeneidad genética en las distintas comunidades, la variabilidad en la tasa de indicación quirúrgica más bien respondía a distintos patrones de práctica médica. Al dividir los grupos en cuanto a alta o baja indicación de cirugía, los resultados fueron mejores para el grupo de baja indicación en comparación con los otros grupos de alta indicación (79% versus 60% de alivio significativo, respectivamente, p<0,01)42. También se vio que los pacientes operados en los territorios de alta indicación, tenían menor dolor y discapacidad basalmente que los otros. A pesar de lo antiguo y clásico de este estudio, la variabilidad en la práctica continúa, pues en una encuesta publicada recientemente a más de 800 cirujanos de 89 países, aún existía gran heterogeneidad en la duración del tratamiento conservador y en las consideraciones para la cirugía43.
También hay consenso en la indicación quirúrgica en casos de paresia progresiva atribuible a la compresión radicular, pero no está tan claro para aquellos cuadros en que el déficit motor es no progresivo. Esto debido a que ya en los años 80, estudios comparativos mostraban recuperación motora equivalente a 4 años entre pacientes operados y no operados, haciendo entonces cuestionable la ventaja del tratamiento quirúrgico para esta indicación. En un estudio más reciente, se realizó un subanálisis de 150 pacientes con debilidad radicular M3 y M4 por HDI, pertenecientes a una cohorte de pacientes de un estudio aleatorizado. Si bien, los pacientes con paresia aleatorizado a cirugía precoz recuperaron más rápido su debilidad, este efecto se igualaba a los 6 y 12 meses con los pacientes no operados10. No se encontró una relación entre el tiempo hasta cirugía versus la recuperación motora, como se había reportado en estudios previos44.
Asumiendo una buena indicación y selección de pacientes, el rol de la cirugía como opción para pacientes quienes fallaron en el manejo conservador parece estar validado con estudios de alta calidad, pero su utilidad a largo plazo aún está en duda45–47. Estos estudios sugieren que la cirugía alivia el dolor radicular más rápido que el tratamiento conservador, con un efecto más dudoso respecto del dolor lumbar3. En general, a pesar de ser estudios aleatorizados, estos han presentado problemas metodológicos tales como entrecruzamiento significativo entre ramas de tratamiento, tratamiento conservador no sistemático y falta de ciego, entre otros3. La clave más bien está en identificar qué pacientes se beneficiarían más de tratamiento quirúrgico (asumiendo falla de manejo conservador): jóvenes, mejor status funcional preoperatorio, dolor predominio de la extremidad mayor que lumbar, menor duración de cuadro radicular, signo de TEPE positivo y ausencia de factores psicosociales adversos21, entre otros. En un análisis de subgrupos del SPORT de HDI1, se vio que los pacientes que tenían fragmentos extruidos preoperatorios, tenían mejores resultados con cirugía, pero también muy buenos resultados con tratamiento conservador. Los que llevaban menor tiempo de radiculopatía tenían mejores resultados, pero el efecto terapéutico de la cirugía era proporcionalmente mayor en los pacientes que llevaban más de seis meses con dolor.
Como hemos visto, dado que tanto el tratamiento conservador como quirúrgico pueden ser opciones razonables, es fundamental el describir transparentemente ambas alternativas de tratamiento, para que el paciente tome una decisión informada de acuerdo a sus preferencias3. Por lo tanto, el educar sobriamente al paciente acerca de los riesgos de la cirugía y sus complicaciones, es crucial en la toma de decisiones. En general, la discectomía independiente de su técnica, es una cirugía que tiene menos riesgos que otros tipos de cirugía vertebral. Las complicaciones más frecuentes son de la herida operatoria (1-2%), lesión radicular (1-2%)3, lesión de dura madre (3-13,2%) y recurrencia de la HDI (1-27%)24,48. Clínicamente, se define como una recurrencia de HDI un paciente que al menos pasa seis meses postoperatorios libre de síntomas, para después volver con la misma radiculopatía secundaria a una HDI en el mismo disco, ipsilateral. Sin embargo, nuevamente tiene que haber correlación clínica con las imágenes, pues existe hasta un 25% de los pacientes que pueden hacer sólo una recurrencia imagenológica, no asociada a síntomas49. En cuanto a los determinantes del riesgo de recurrencia, destaca el estudio prospectivo de Carragee et al.24, con 180 pacientes con seguimiento mínimo de 2 años, operados por HDI. Los autores dividieron los HDI en cuatro tipos dependiendo de la inspección intraoperatoria y la presencia de defectos anulares y/o fragmentos libres de disco: Fragmento+Fisura anular; Fragmento+defecto anular; Fragmento contenidos; No fragmentos, contenida. La tasa de recurrencia dependía de esta morfología discal, más que de cualquier otro parámetro clínico o demográfico medido: mientras las HDI con fisura anular y fragmentos tenían los mejores resultados clínicos, también tenían la menor tasa de recurrencia, 1%. En cambio, la categoría de Fragmento+defecto anular tuvo una tasa de recurrencia de hasta un 27%. En caso que la recurrencia clínica no ceda con manejo conservador, el paciente puede beneficiarse nuevamente de una discectomía de revisión, en general con resultados similares a una discectomía primaria48.
Durante los últimos 15 años, han surgido nuevas técnicas menos invasivas que la microdiscectomía abierta, considerada el estándar12. En teoría estas técnicas menos invasivas mejorarían los resultados al producir menor daño en partes blandas y en la musculatura extensora. Si bien se ha incrementado el uso de estas técnicas y de discectomías ambulatorias, los resultados aún son preliminares, con seguimientos relativamente cortos3. Dentro de las técnicas menos invasivas, destaca la discectomía endoscópica percutánea (PELD del inglés). En un reciente metanálisis de 9 estudios comparativos (2 aleatorizados; 1585 pacientes), no se econtraron diferencias en dolor, score de discapacidad, proporción de resultados buenos/excelentes, complicaciones ni reoperaciones. Sin embargo, la PELD fue superior en acortar la estadía hospitalaria y tener un retorno laboral más precoz50. También el PELD se asoció a una mayor incidencia de descompresión incompleta o fragmentos de HDI retenidos.
Declaración de conflicto de interésDeclaro no tener conflictos de interés relacionados al tópico de este artículo.