La evaluación histológica de la Enfermedad Inflamatoria Intestinal (EII) tiene como finalidad corroborar el diagnóstico de EII. En este artículo revisaremos múltiples conceptos histológicos relacionados con EII. Definiremos los términos de colitis aguda y crónica, las características macroscópicas y microscópicas de EII (incluyendo las características histológicas distintivas entre Colitis Ulcerativa Idiopática y Enfermedad de Crohn), y otras formas de colitis no relacionadas a EII que actúan como diagnósticos diferenciales (colitis infecciosa, colitis microscópica y colitis diverticular, entre otras). Así mismo, haremos referencia al riesgo de los pacientes con EII a desarrollar cáncer colorrectal y a las características histológicas de displasia en EII, incluyendo la última terminología recomendada para la descripción de la apariencia endoscópica de lesiones en seguimiento de displasia en EII.
The main goal of the histological evaluation of Inflammatory Bowel Disease (IBD) is to corroborate the IBD diagnosis. In this article, we will review multiple histological concepts related to IBD. We will define the terms of acute and chronic colitis, the macroscopic and microscopic characteristics of IBD (including the distinctive histological features between Idiopathic Ulcerative Colitis and Crohn's Disease) and other forms of colitis not related to IBD that act as differential diagnoses (infectious, microscopic and diverticular colitis, among others). Likewise, we will talk about the risk of IBD patients to develop colorectal cancer and the histological features of dysplasia in IBD, including the latest terminology recommended for the description of the endoscopic appearance of lesions in the follow-up of dysplasia in IBD.
En la práctica clínica, el término de Enfermedad Inflamatoria Intestinal (EII) está reservado para Colitis Ulcerativa Idiopática (CUI), Enfermedad de Crohn (EC) y EII de tipo indeterminada1. El diagnóstico requiere un enfoque multidisciplinario de especialistas que incluye gastroenterólogos, psicólogos, nutriólogos, radiólogos, cirujanos y patólogos, y se debe hacer con la combinación de la historia clínica, examen físico, datos de laboratorio y hallazgos típicos endoscópicos, radiológicos e histológicos2. El examen histológico de biopsias endoscópicas o resecciones quirúrgicas juega un importante rol en el estudio de los pacientes con EII para corroborar el diagnóstico, específicamente en diferenciar CUI de EC y diagnósticos diferenciales (colitis no asociadas de EII)1,2. En pacientes en los que se sospecha EII, es crucial realizar un examen histológico antes de iniciar el tratamiento, debido a los cambios en la morfología provocados por éste y establecer el diagnóstico apropiado.
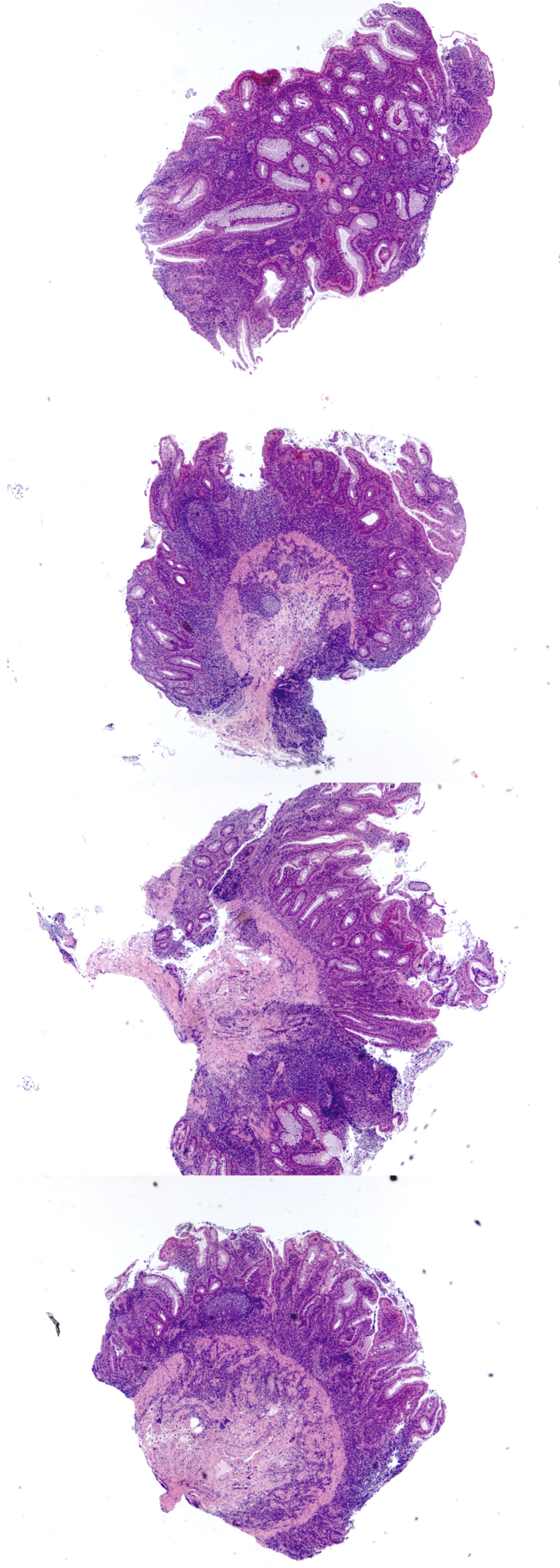
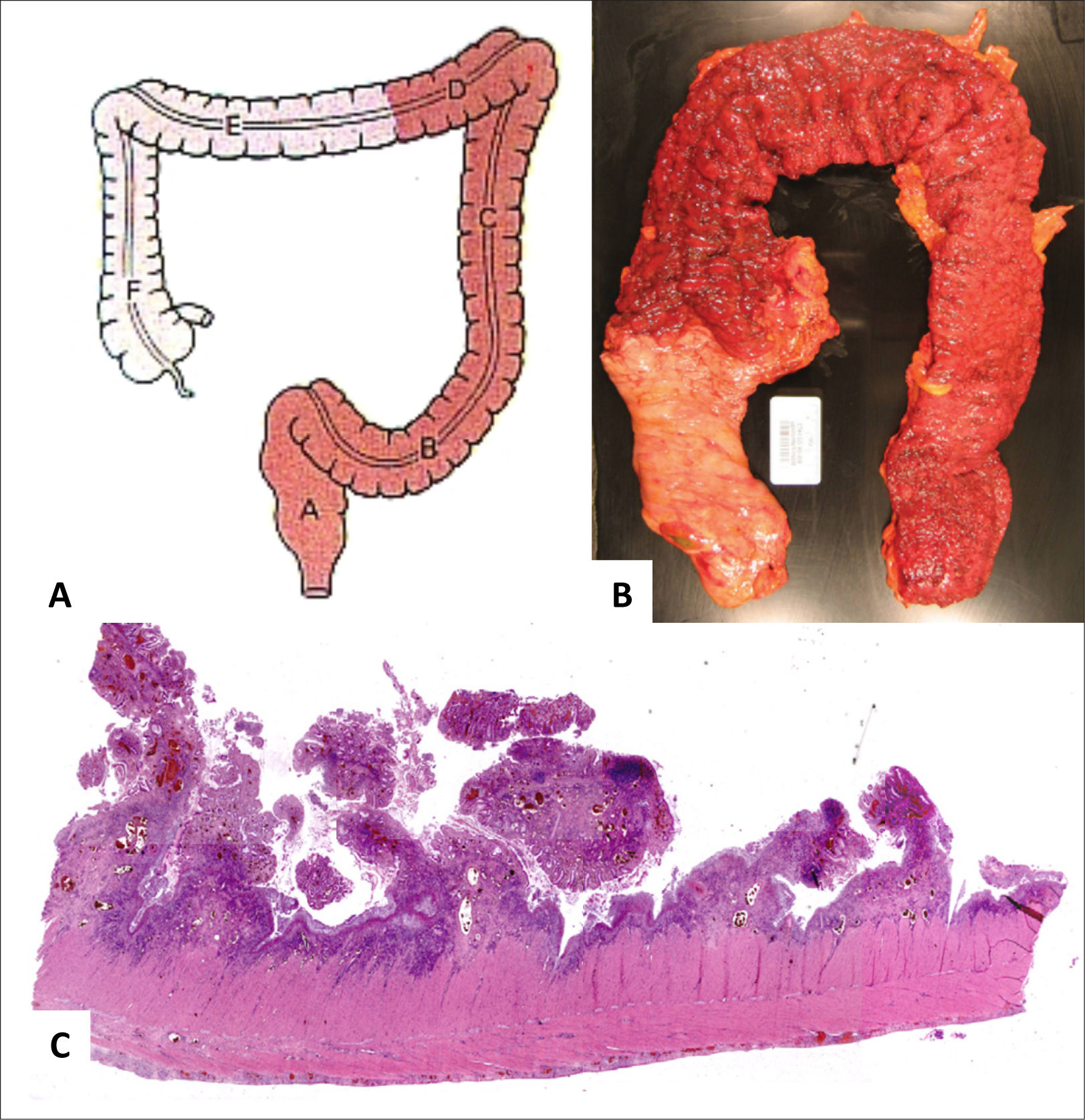
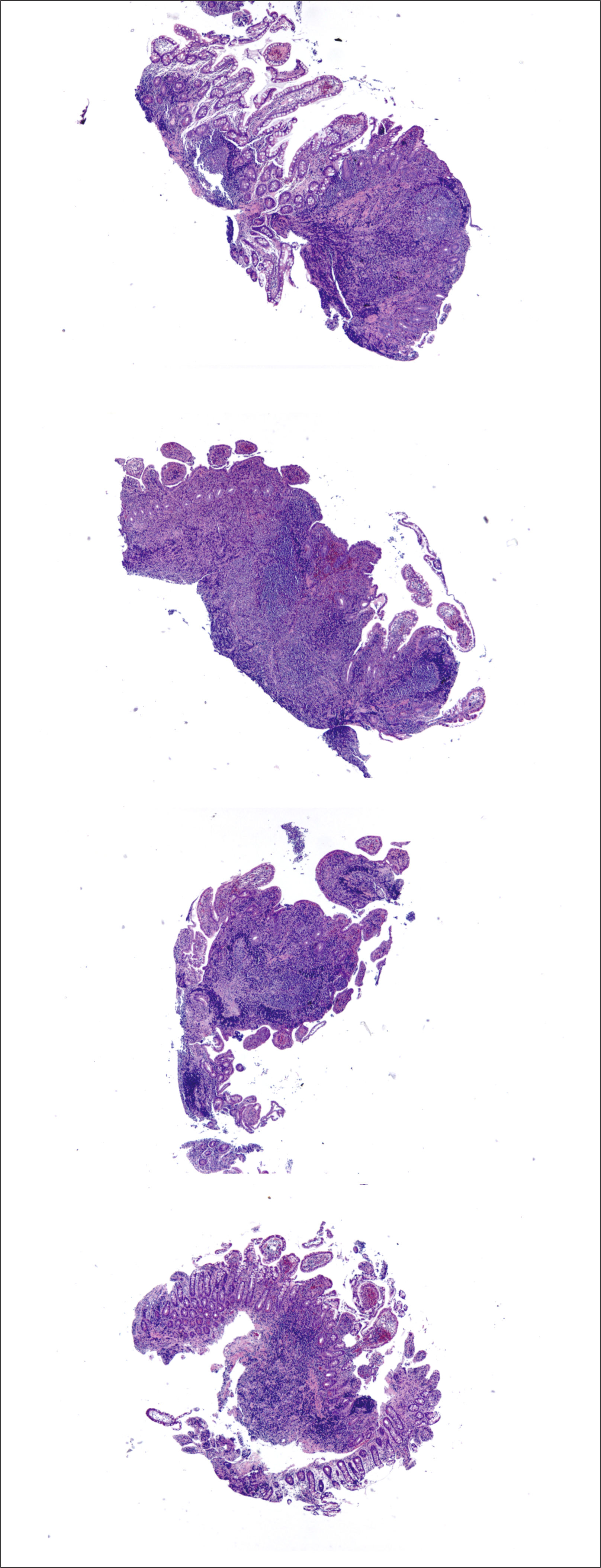
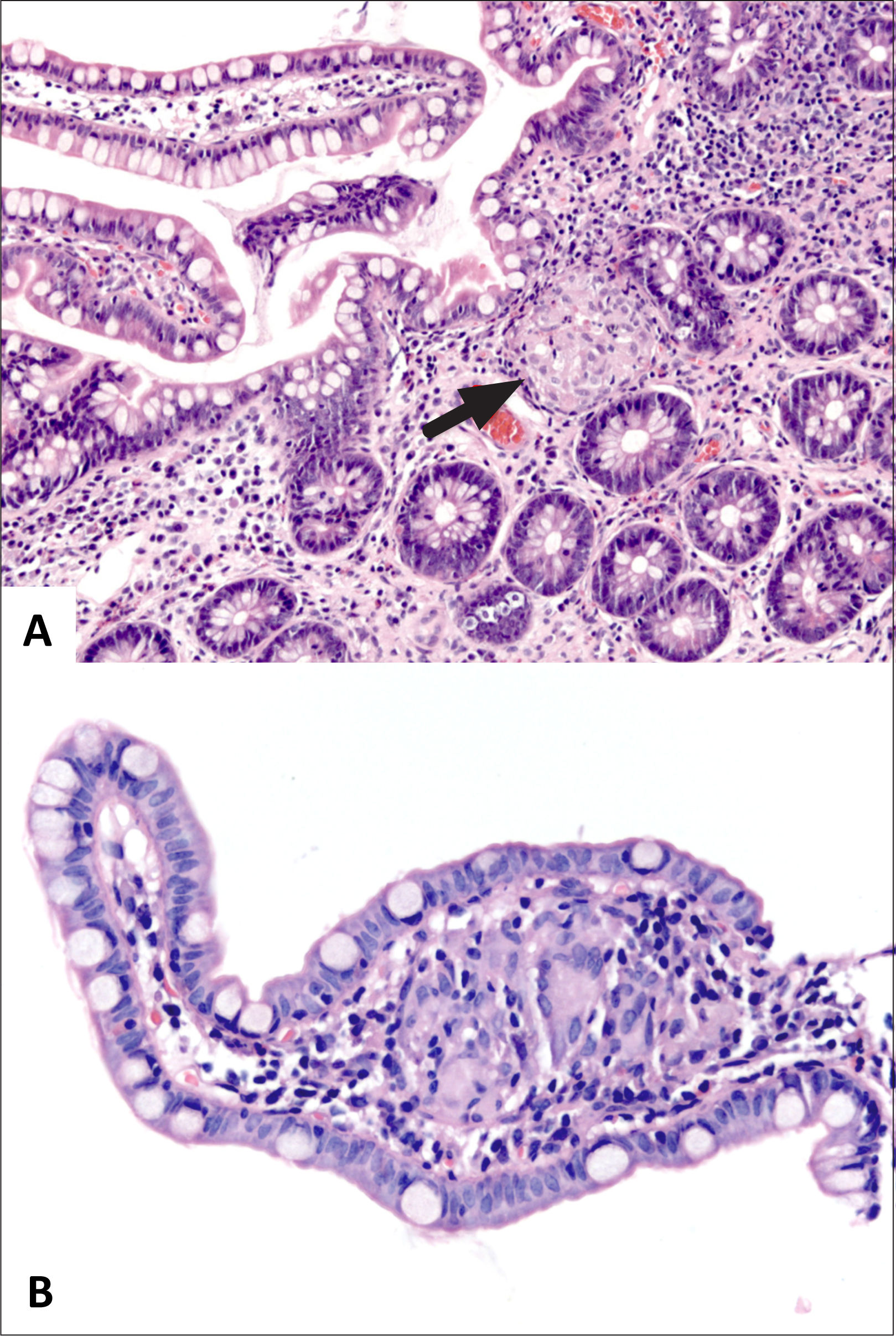
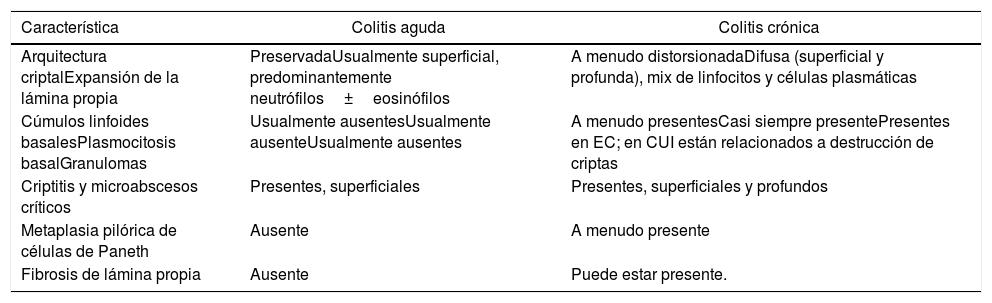
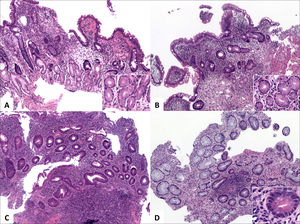
Colitis Aguda vs CrónicaLa evaluación de patrones de daño (i.e. celularidad de la lámina propia y arquitectura de criptas) en biopsias colorrectales se realizan mejor a bajo aumento. Así mismo, a bajo aumento es más fácil comparar cambios histológicos en y entre fragmentos de tejido dentro de un mismo bloque (fig. 1). Los cambios más característicos de colitis crónica son: distorsión arquitectural, folículos linfoides localizados basalmente, plasmocitosis basal, inflamación mixta difusa, metaplasia de células de Paneth (colon izquierdo) o glándulas pilóricas, hiperplasia de células de Paneth (colon derecho) y fibrosis de la lámina propia (fig. 2)3. La plasmocitosis basal (células plasmáticas entre la base de la criptas y la túnica muscular de la mucosa) es un excelente marcador de cronicidad y especialmente útil para diferenciar colitis infecciosa de EII inicial (fig. 3). Vale la pena hacer notar que si bien la presencia de células plasmáticas es común en inflamación crónica4, su mera presencia o simple aumento, en ausencia de las características antes mencionadas, no es suficiente para hacer el diagnóstico de colitis crónica, más aún que normalmente están presentes en la lámina propia de la mucosa colónica normal5. La tabla 1 resume las característica de la colitis aguda y crónica.
Características microscópicos de la colitis aguda vs la colitis crónica
| Característica | Colitis aguda | Colitis crónica |
|---|---|---|
| Arquitectura criptalExpansión de la lámina propia | PreservadaUsualmente superficial, predominantemente neutrófilos±eosinófilos | A menudo distorsionadaDifusa (superficial y profunda), mix de linfocitos y células plasmáticas |
| Cúmulos linfoides basalesPlasmocitosis basalGranulomas | Usualmente ausentesUsualmente ausenteUsualmente ausentes | A menudo presentesCasi siempre presentePresentes en EC; en CUI están relacionados a destrucción de criptas |
| Criptitis y microabscesos críticos | Presentes, superficiales | Presentes, superficiales y profundos |
| Metaplasia pilórica de células de Paneth | Ausente | A menudo presente |
| Fibrosis de lámina propia | Ausente | Puede estar presente. |
EC: Enfermedad de Crohn. CUI: Colitis Ulcerativa Idiopática.
Tomado y traducido de Odze y cols3.
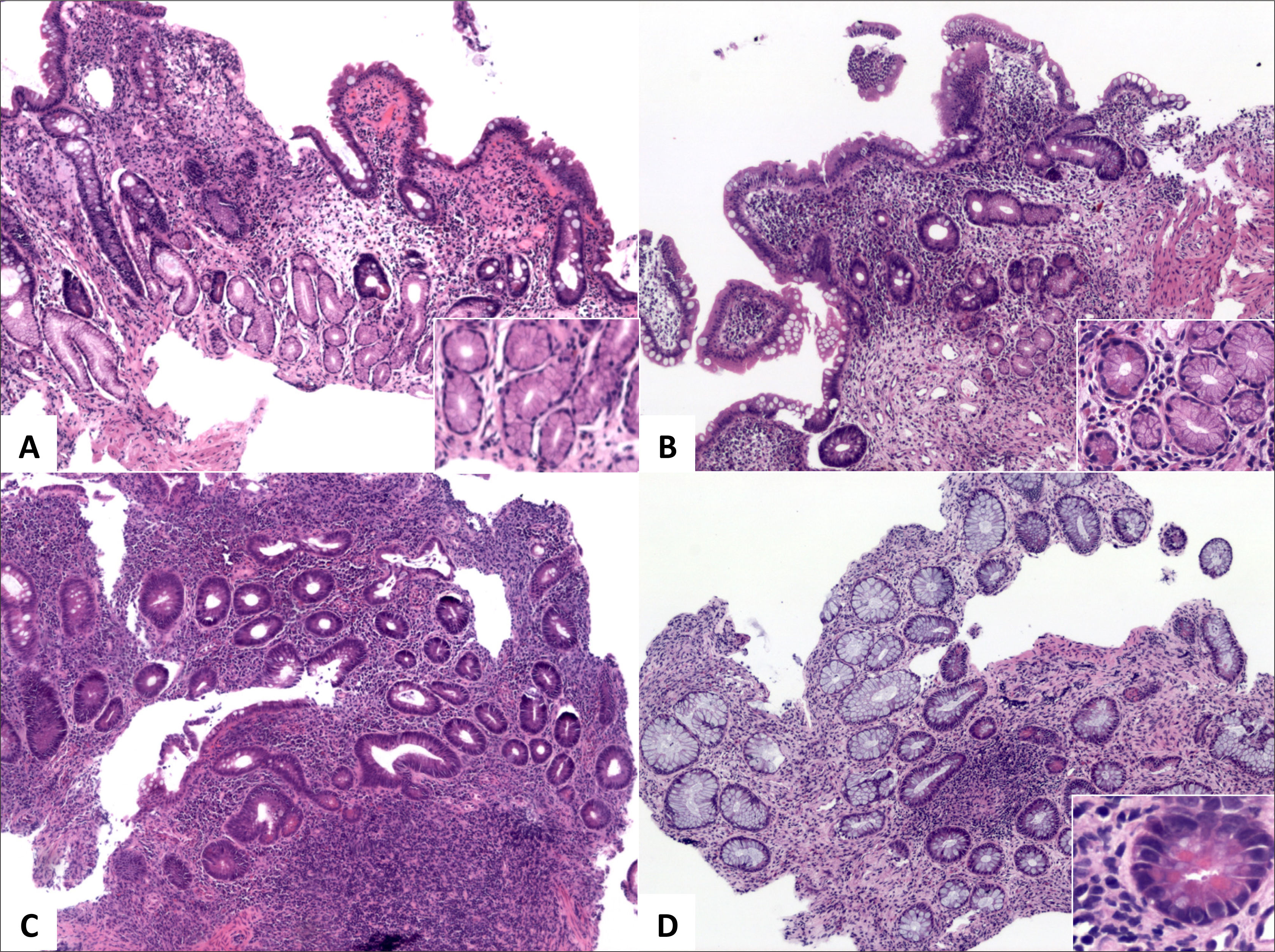
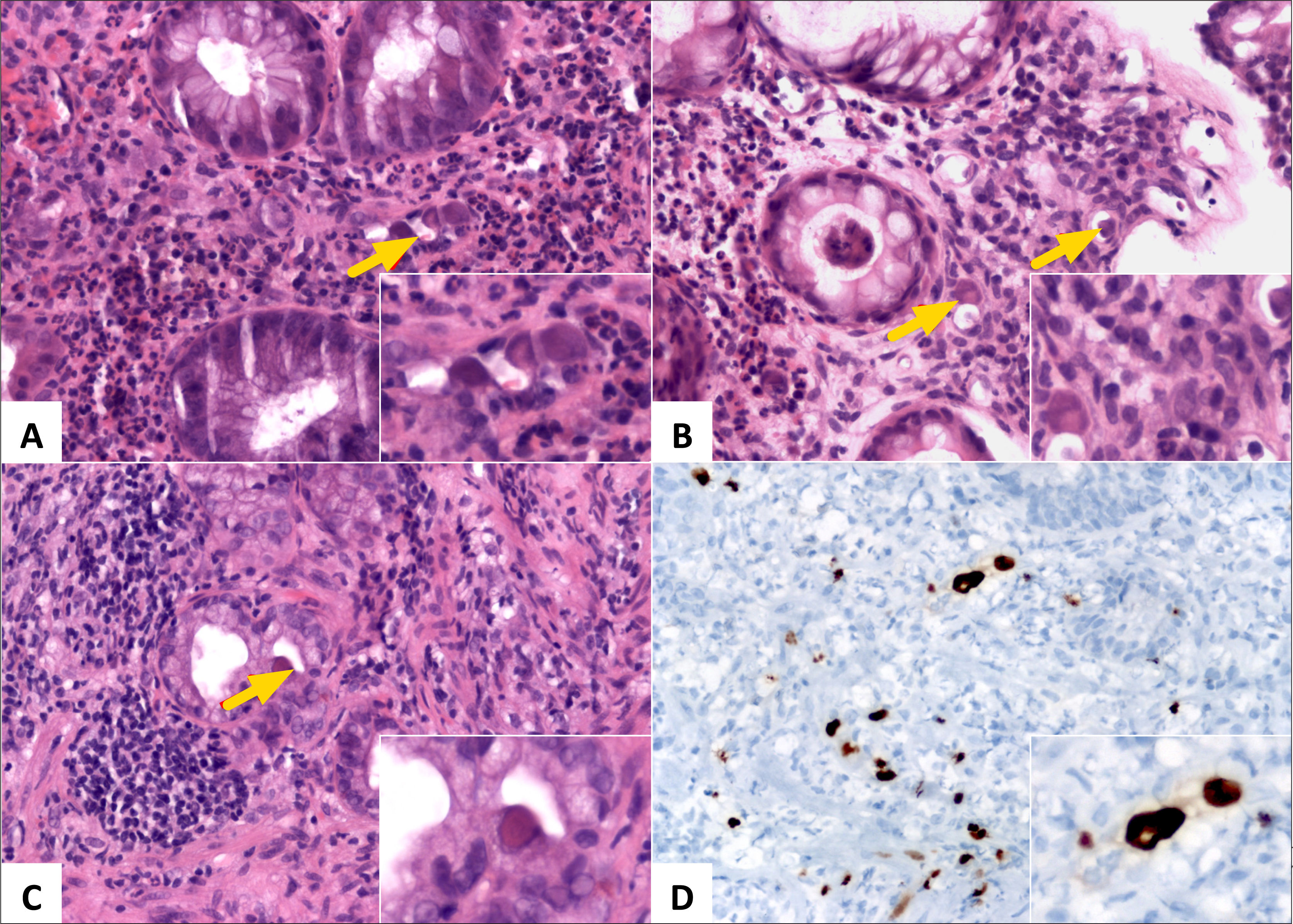
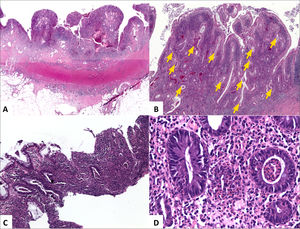
La “actividad inflamatoria” está dada por daño del epitelio tanto por neutrófilos como eosinófilos en la forma de criptitis, microabscesos crípticos, erosión y ulceración de la mucosa y cambios epiteliales degenerativos (fig. 4). Cuando estos cambios están sobrepuestos sobre un fondo de colitis crónica, se le llama colitis crónica activa3. La actividad inflamatoria se gradúa mediante el Índice de Actividad Histológica (IAH), descrito por Gupta, Harpaz y col, consistente en una escala visual análoga: (0) inactiva/ausente, (1) leve, (2) moderada o (3) acentuada, dependiendo de si hay compromiso de menos del 50% (leve) de las criptas, más del 50% (moderada) de las criptas o hay presencia de erosiones o úlceras sin importar otras características (acentuada) (tabla 2). Por convención, cuando más de una biopsia es tomada de un segmento de colon en particular, se considera el IAH más alto. El resultado de una colonoscopía en particular se resume en un valor único, el score inflamatorio, que es igual a la suma de todos los IAH de cada sitio o segmento colónico, dividido por el número de sitios6.
Índice de Actividad Histológica
| Actividad Inflamatoria | Puntaje | Característica Histopatológica |
|---|---|---|
| Inactiva/quiescente/normal | 0 | Sin infiltración epitelial por neutrófilo |
| Actividad leve | 1 | Infiltración de neutrófilos de <50% de las criptas muestreadas o cortes transversales, sin úlceras ni erosiones |
| Actividad moderada | 2 | Infiltración de neutrófilos de>50% de las criptas muestreadas o cortes transversales, sin úlceras ni erosiones |
| Actividad acentuada | 3 | Erosiones o úlceras, independiente de otras características. |
Tomado y traducida de Gupta y cols6.
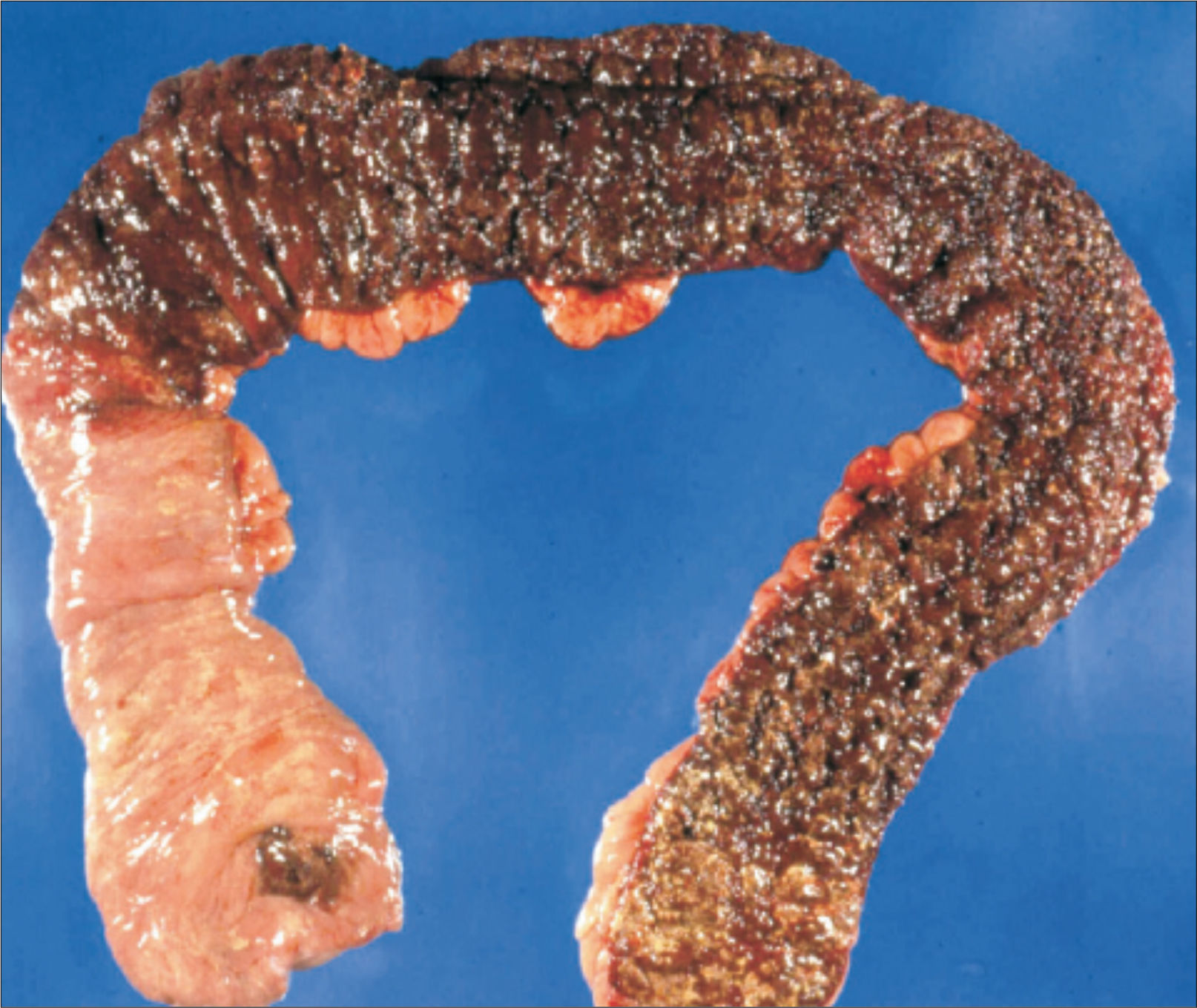
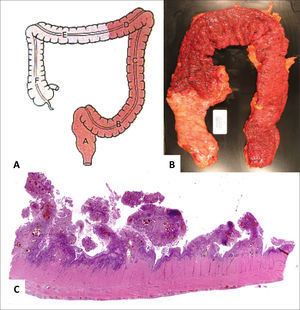
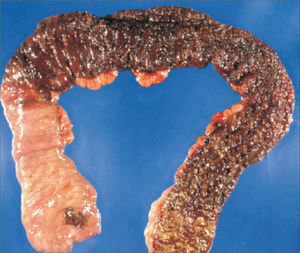
El examen macroscópico de resecciones quirúrgicas por CUI clásicamente muestra una inflamación crónica difusa y continua, sin áreas preservadas, que compromete el recto y se extiende proximalmente con disminución gradual de la severidad de la inflamación. La transición entre la mucosa inflamada y normal generalmente es abrupta (fig. 5)1,2. Es importante considerar patrones poco usuales de inflamación, estos son la preservación rectal, el parche cecal (“cecal patch”) y la ileitis por reflujo. El preservación rectal ocurre en niños sin tratamiento (30%), adultos con colitis fulminante (13%) y pacientes con tratamiento tópico o sistémico (44%)2,7–9. El parche cecal es inflamación alrededor del orificio apendicular asociada a una colitis de colon izquierdo (fig. 6); Ladefoged y cols encontraron inflamación discontinua alrededor del orificio apendicular en 27%, 24% y 40% de pacientes con CUI, EC y colitis de tipo indeterminada, respectivamente10. La ileítis por reflujo ocurre en aproximadamente 20% de los pacientes con pancolitis, sin embargo, se ha descrito en pacientes sin compromiso cecal2,11; Haskell y cols describen que la severidad de los cambios ileales en general se correlacionan con la severidad de la colitis, sin embargo, raramente pueden verse erosiones ileales sin compromiso cecal11. La distinción entre ileitis por reflujo y EC puede ser difícil2. En CUI de larga data, el tejido de reparación se asocia a fibrosis, que a diferencia de la EC, está restringida a la mucosa y submucosa, aunque puede causar áreas de estenosis en 3,2% a 11,2% de los casos2,12.
Parche cecal
Colectomía total con área de inflamación eritematosa en el ciego rodeada de colon normal asociada a colitis de segmentos distales del colon (tomada de Gramlich y cols1).
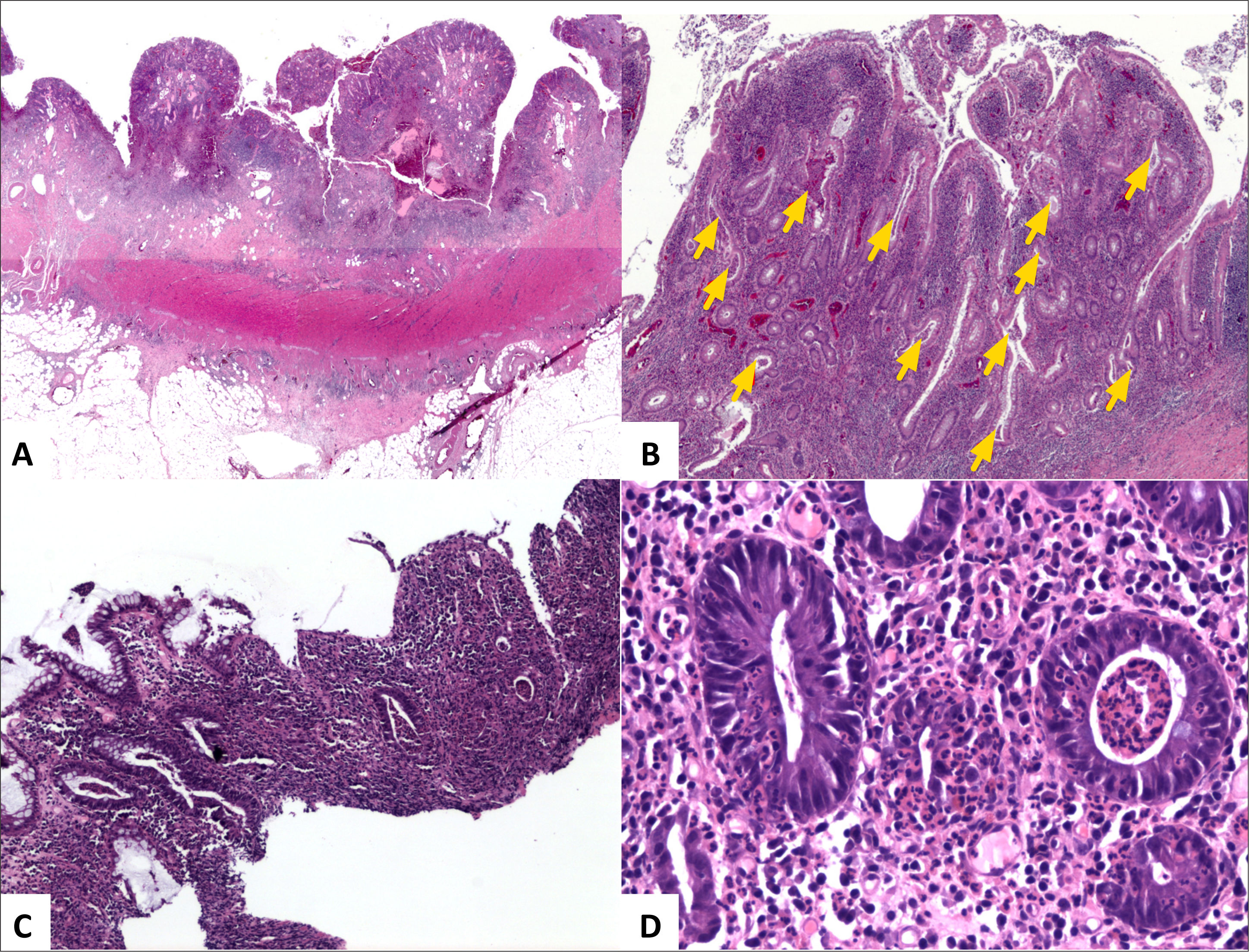
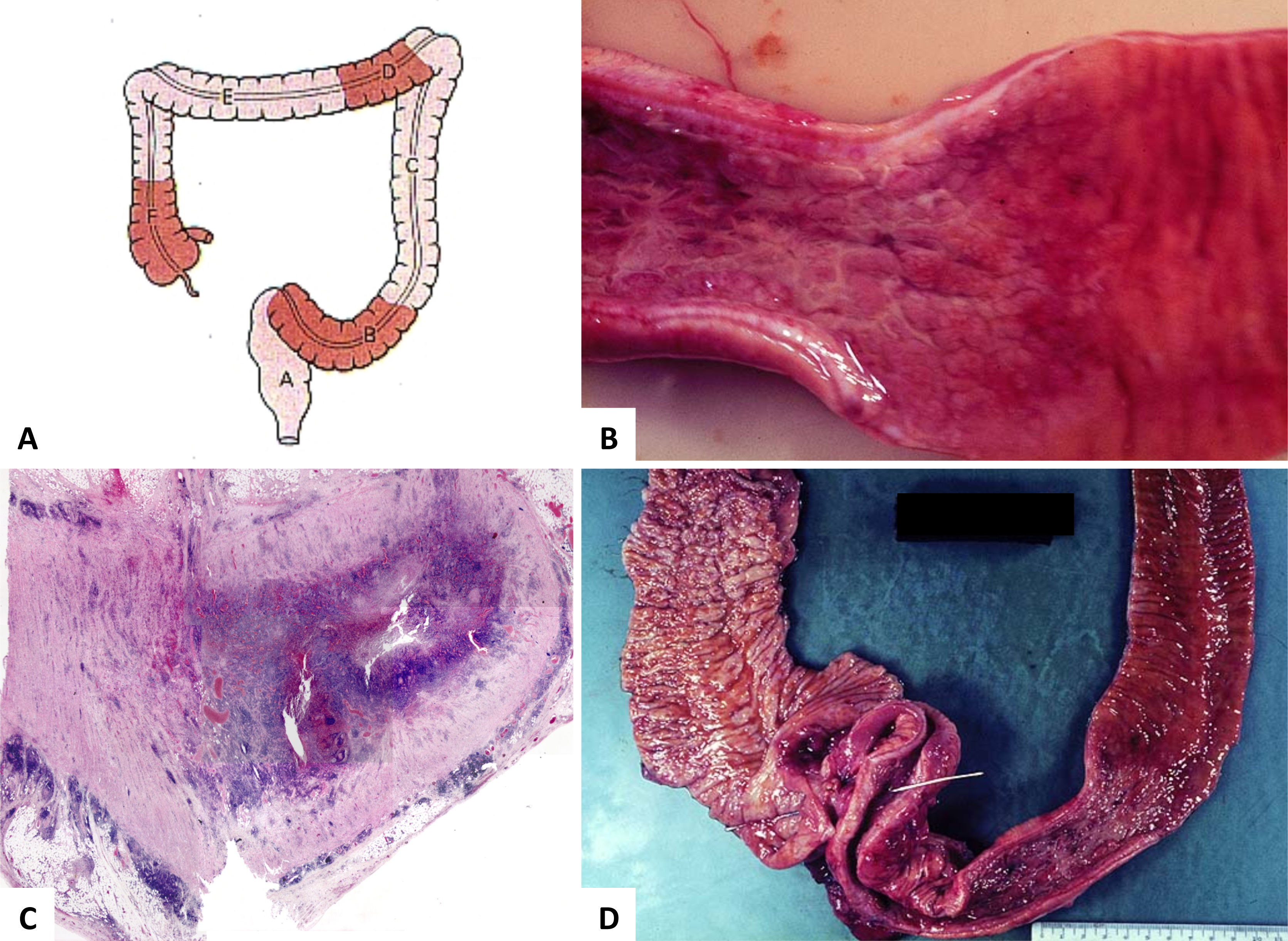
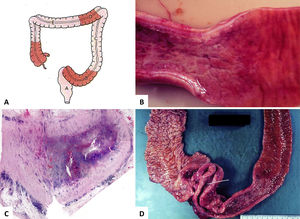
La EC, por el contrario a CUI, pude afectar todo el sistema gastrointestinal. El íleon terminal está más comúnmente comprometido, a menudo junto con el colon derecho. Aproximadamente un 20% de los casos pueden tener afectación sólo el intestino grueso, preferentemente del colon derecho o puede co-existir con EC en otros sitios1,2,13. Hay tres patrones básicos de afectación del intestino grueso: EC restringida al recto, EC con estenosis del intestino grueso y colitis de Crohn difusa que típicamente “respeta” (variable) el recto2,13. Aproximadamente 75% de los pacientes con EC colónica desarrollo enfermedad peri-anal, caracterizada por úlceras profundas, fisuras, fístulas, abscesos, tractos ciegos, estenosis y papilomas cutáneos13. Vale la pena hacer notar que la EC peri-anal puede preceder por años al compromiso intestinal. El compromiso segmentario e inflamación en profundidad de la pared colónica son características distintivas de la EC. En este sentido, la serosa puede ser anormal si hay inflamación transmural. La tejido adiposo subseroso se puede “empaquetar” (“fat-wrapping”) alrededor de la superficie libre del intestino (antimesentérica) y esto es altamente predictivo del diagnóstico de EC1,2. Áreas de estenosis, fístulas y abscesos son también característicos (fig. 7). La mucosa muestras zonas alternadas de inflamación y mucosa normal; a éstas se les llama como “regiones omitidas” (“skip-regions”). La lesión mucosa inicial en EC corresponde a pequeñas úlceras aftosas focales y pequeñas; una enfermedad más extensa se traduce en la formación de úlceras longitudinales y transversas, resultando en el clásico aspecto en “empedrado” (fig. 7D)1.
MicroscopíaMicroscópicamente, la CUI y EC comparten las alteraciones correspondientes a la colitis crónica (descrita previamente) y pueden llegar a ser indistinguibles.
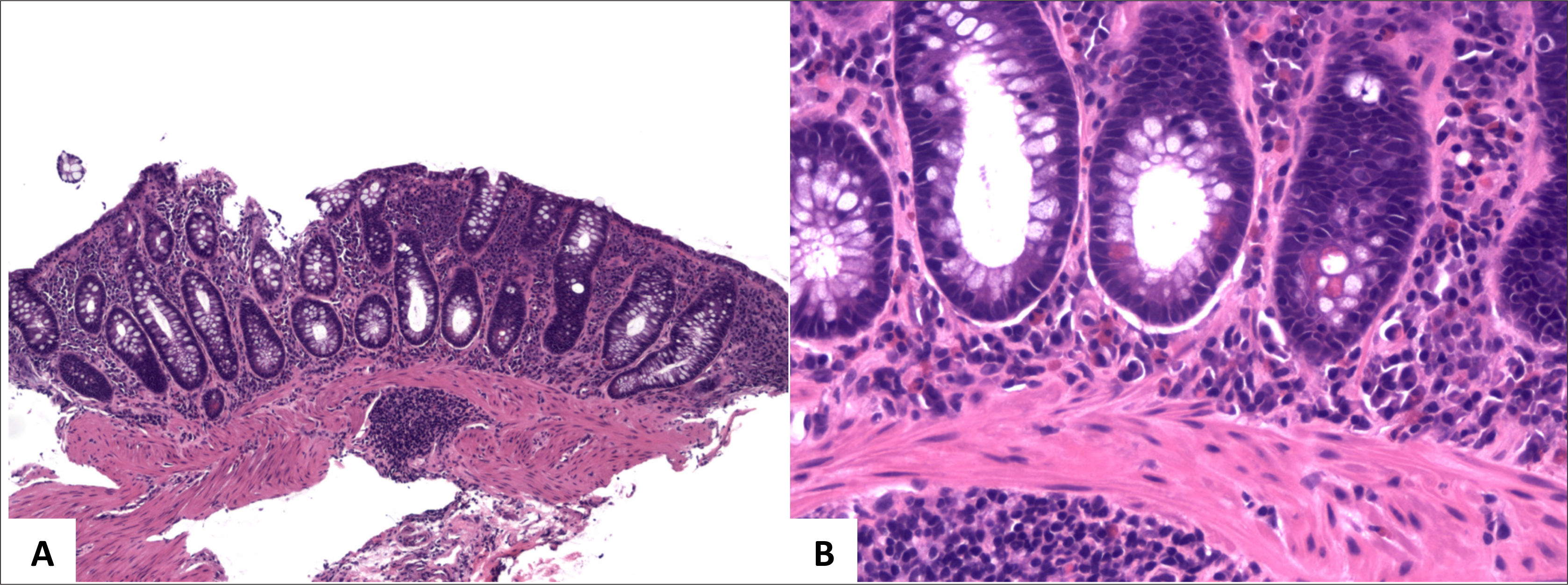
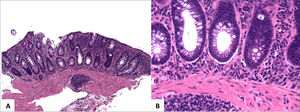
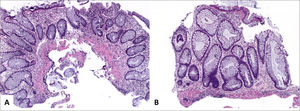
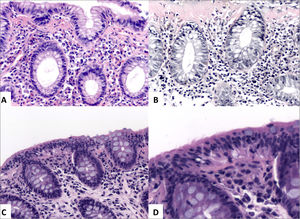
Colitis Ulcerativa IdiopáticaEl consenso Europeo en la histopatología de Enfermedad Inflamatoria Intestinal de Magro y cols. concluyen que el diagnóstico microscópico de CUI se basa en una extensa distorsión arquitectural criptal, un infiltrado inflamatorio difuso transmucoso con plasmocitosis basal, eventualmente asociado a un componente activo con criptitis y microabscesos crípticos. La depleción de mucina es menos específica, y puede verse en colitis infecciosa y EC2. La distorsión arquitectural dada por ramificación y atrofia se ve en 57%-100% de los casos y son más frecuentes que en EC (12%)2. En CUI, la inflamación es difusa y continua sin variaciones en la intensidad o áreas preservadas (fig. 1) que típicamente aumenta hacia el recto. La inflamación típicamente está confinada a la mucosa, pero ocasionalmente puede extenderse a la porción superficial de la submucosa, en cuyos casos la celularidad es mayor en la mucosa. La enfermedad carece de fisuras, aunque en casos fulminantes, las úlceras pueden extenderse hasta la túnica muscular propia (20%). Los microabscesos crípticos son más frecuentes en CUI (41%) que en EC (19%). La plasmocitosis basal es útil para diferenciar CUI en etapas iniciales (63%) de colitis infecciosa (6%), pero no de EC (62%). En biopsias de CUI, granulomas no se ven, a menos aquellos de reacción a cuerpo extraño, en relación a ruptura de criptas y extravasación de mucina. El número de granulocitos eosinófilos es variable, aunque la eosinofilia colónica es de hecho más frecuente debido a EII que alergia u otros tipos de colitis1. Otras características de cronicidad incluyen la presencia de pesudopólipos inflamatorios, hipertrofia de la túnica muscular de la mucosa y fibrosis de submucosa (raro). En etapas iniciales de la enfermedad, el principal diagnóstico diferencial es la colitis infecciosa, caracterizada por arquitectura conservada e inflamación aguda, sin embargo, estas características son inespecíficas y hasta un 30% de los casos con este patrón histológico progresarán a EII. La distorsión arquitectural y plasmocitosis basal se ve sólo en un 20% y 38% de los casos en las primeras dos semanas de iniciados los síntomas, siendo ésta ultima la característica con un mayor valor predictivo de EII1–3. En CUI de larga data y en tratamiento farmacológico, el compromiso intestinal disminuye con el tiempo, cambiando el patrón de compromiso de difuso a discontinuo (93%) y, en ocasiones, llegando a la restauración completa de la mucosa rectal (preservación rectal) en 34% a 44% de los casos. La restauración de la arquitectura puede llegar a una mucosa histológicamente normal, lo que puede dificultar el diagnóstico durante el seguimiento. La remisión es definida como la resolución completa de los síntomas y curación endoscópica de la mucosa, la que, histológicamente, se caracteriza por la resolución del infiltrado inflamatorio y de la distorsión arquitectural (variable); en esta etapa, la mucosa aún puede mostrar evidencias de daño, tales como disminución de la densidad, ramificación y/o acortamiento de criptas, y metaplasia de células de Paneth; el infiltrado inflamatorio puede ser variable, pudiendo llegar a resolverse por completo (incluyendo la plasmocitosis basal) y la lámina propia ser hipocelular (fig. 8).
Colitis ulcerativa idiopática en remisión
A (sigmoides, HE 40x) y B (recto, HE 100x) corresponde a colitis crónica inactiva caracterizada por distorsión arquitectural dada por acortamiento y ramificación de criptas, metaplasia de células de Paneth y ausencia de actividad inflamatoria. Nótese la ausencia de plasmocitosis basal en B.
Tomada de Chiu y cols.24.
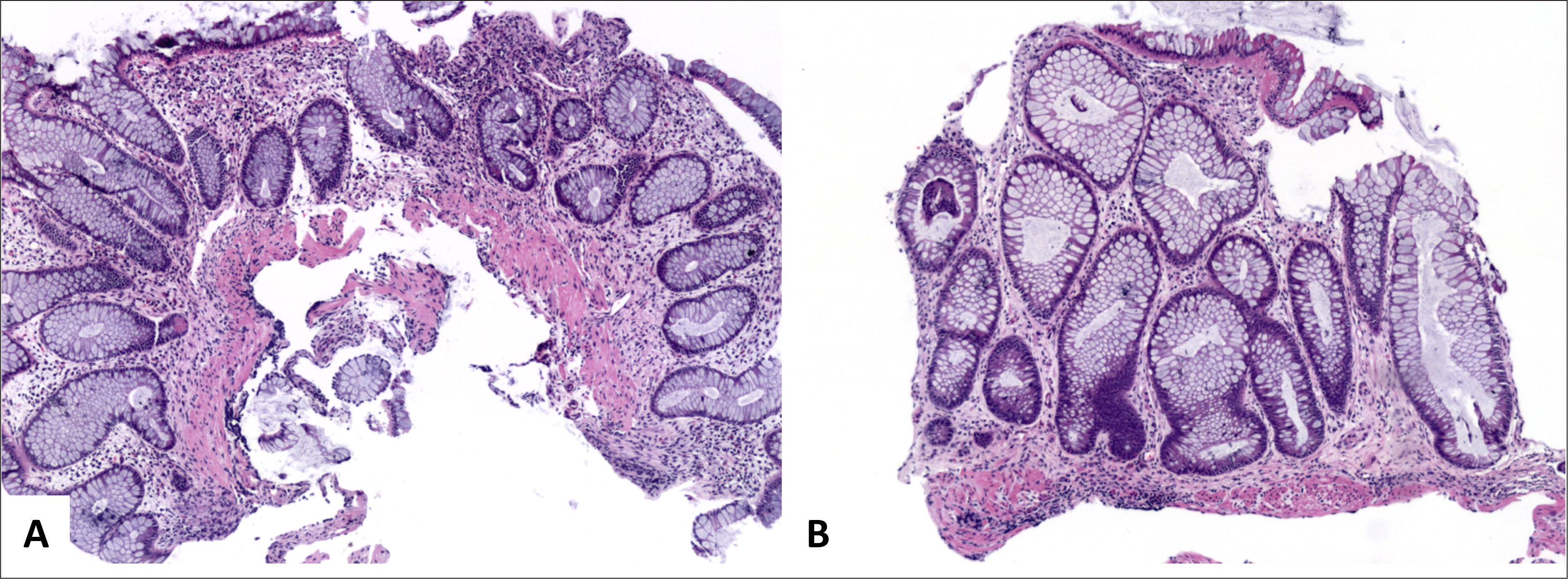
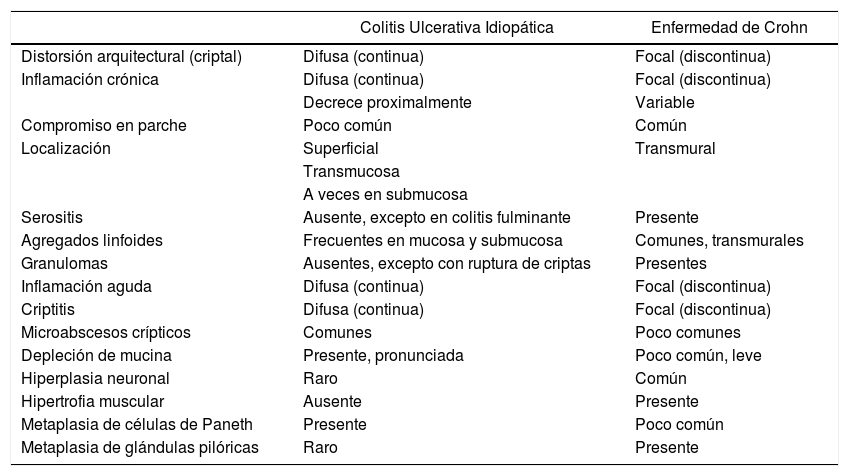
En EC, la celularidad de la lámina propia (linfocitos y células plasmáticas) es característicamente discontinua (focal); específicamente, esto significa, uno o más focos de aumento de células mononucleares con o sin un componente granulocítico (polimorfonuclear y/o eosinofílico), los que ocurren en un biopsias por otra parte normales o con grados variables de inflamación. Cúmulos linfoides normales no denotan inflamación. La variación en la celularidad entre múltiples fragmentos de una biopsia tiene mejor reproducibilidad que en un solo fragmento (fig. 9) y puede haber extensión de la inflamación a la submucosa. La distorsión arquitectural es definida por algunos por anormalidad de más del 10% de las criptas, aunque la presencia de dos criptas ramificadas en un solo fragmento bien orientado debe considerarse anormal2. Los granulomas de la EC corresponden a una agrupación de histiocitos epiteloideos (monocitos/macrófagos) de bordes mal definidos. Células mutinucleadas y necrosis no son característicos y usualmente no están presentes; pequeñas colecciones de histiocitos epiteloideos y células gigantes, granulomas no-caseificantes o células multinucleadas aisladas se pueden observar en colitis infecciosa (granulomas sugieren Mycobacterium sp., Clamidia sp.,Yersinia pseudotuberculosis y Treponema sp.; microgranulomas sugieren Salmonella sp. Campylobacter sp. y Yersinia enterocolitica; células gigantes sugieren Clamidia sp.) y no deben ser considerados como evidencia de EC. En pacientes provenientes de o que viven en áreas con alta prevalencia de tuberculosis, ésta debe excluirse en paciente con posible EC antes de iniciar terapia, especialmente anti-TNF. Sólo granulomas presentes en la lámina propia no relacionados a ruptura criptal deben ser considerados como una característica que apoye el diagnóstico de EC (fig. 10)1–3. En biopsias ileales, las mismas características junto con la irregularidad de vellosidades puede usarse para el diagnóstico e EC. En resecciones intestinales, las principales características que discriminan EC de CUI son la presencia cúmulos linfoides transmurales, especialmente lejos de áreas de ulceración y granulomas epiteloideos no relacionados a daño de criptas. La metaplasia de glándulas pilóricas es otro indicador de inflamación crónica de la mucosa y se observa en 2 a 27% de las biopsias de pacientes con EC y es común en resecciones ileales, sin embargo, es extremadamente rara en biopsias de CUI con o sin ileítis por reflujo. Vale la pena hacer notar, sin embargo, que la metaplasia de glándulas pilóricas se observa hasta en 40% de las biopsias de reservoritis (“pouchitis”) de pacientes con CUI y proctocolectomía con reservorio ileal e ileo-recto anastomosis. En este escenario, la metaplasia de glándulas pilóricas parece ser específica de reservoritis resistentes a terapia antibiótica y EC. Otras características de EC incluyen la hiperplasia neuronal en la submucosa y que, en ocasiones, la inflamación puede comprometer vasos sanguíneos y simular “vasculitis”, que en ocasiones puede ser granulomatosa1,2. En esta línea, cambios en la vasculatura intramural son comunes en EC, los que incluyen daño endotelial, proliferación intimal, trombosis y raramente, vasculitis fibrinoide y granulomatosa3,14. Estas alteraciones se ven en arteriolas adyacentes o subyacentes a áreas de ulceración; en ocasiones, los granulomas pueden tener una distribución perivascular. Estos hallazgos han llevado a algunos autores a especular que la vasculitis puede ser un mecanismo de daño en EC3,14. La tabla 3 resume las principales características de CUI y EC. Por último, la presencia de sólo una de estas características no es suficiente para hacer el diagnóstico certero de EC; por otro lado, no está claro cuántas de estas características deben estar presentes en biopsias endoscópicas para el establecer el diagnóstico de EC; sin embargo, en resecciones intestinales, se sugiere que al menos 3 de éstas deben estar presentes en la ausencia de granulomas o, cuando hay granulomas, al menos una característica adicional debe estar presente para establecer el diagnóstico de EC con un nivel adecuado de confianza y que esto debe aplicarse a biopsias endoscópicas. Actualmente, la mayoría de clínicos y patólogos expertos concuerdan en que la presencia de un granuloma con al menos una otra característica establece el diagnóstico de EC; la segunda característica puede ser tanto inflamación focal o, preferentemente, distorsión arquitectural, exceptuando la apariencia pseudovellositaria de la superficie colónica, la que favorece CUI por sobre EC2. En casos difíciles, sólo el compromiso peri-anal o de porciones proximales del tubo digestivo pueden establecer el diagnóstico definitivo de EC. Debido a que no hay una sola característica patognomónica que identifique los distintos tipos de colitis, el diagnóstico deriva de una compleja evaluación de múltiples cambios histológicos y su distribución topográfica. Un grupo Internacional de Patólogos Gastrointestinales diagnosticaron correctamente sólo el 64 y 74% de casos con EC y CUI respectivamente. Este grupo de expertos concluyeron que i) se necesitan múltiples biopsias para el diagnóstico preciso de EC, ii) biopsias rectales por sí solas no son diagnósticas, iii) la precisión diagnóstica en biopsias endoscópicas es menor en EC que en CUI, iv) la discusión de los criterios diagnósticos y guías clínicas entre patólogos puede mejorar la precisión en el diagnóstico, especialmente de EC, v) características típicas de EC, tales como inflamación transmural, fibrosis y fístulas están presentes sólo en resecciones intestinales y no en biopsias endoscópicas y vi) por el contrario, las características de CUI están limitadas a la mucosa y submucosa, por lo que pueden evaluarse correctamente en biopsias endoscópicas2,15.
Características histológicas de la CUI y EC
| Colitis Ulcerativa Idiopática | Enfermedad de Crohn | |
|---|---|---|
| Distorsión arquitectural (criptal) | Difusa (continua) | Focal (discontinua) |
| Inflamación crónica | Difusa (continua) | Focal (discontinua) |
| Decrece proximalmente | Variable | |
| Compromiso en parche | Poco común | Común |
| Localización | Superficial | Transmural |
| Transmucosa | ||
| A veces en submucosa | ||
| Serositis | Ausente, excepto en colitis fulminante | Presente |
| Agregados linfoides | Frecuentes en mucosa y submucosa | Comunes, transmurales |
| Granulomas | Ausentes, excepto con ruptura de criptas | Presentes |
| Inflamación aguda | Difusa (continua) | Focal (discontinua) |
| Criptitis | Difusa (continua) | Focal (discontinua) |
| Microabscesos crípticos | Comunes | Poco comunes |
| Depleción de mucina | Presente, pronunciada | Poco común, leve |
| Hiperplasia neuronal | Raro | Común |
| Hipertrofia muscular | Ausente | Presente |
| Metaplasia de células de Paneth | Presente | Poco común |
| Metaplasia de glándulas pilóricas | Raro | Presente |
Tomado y traducida de Magro y cols2.
Términos como “colitis indeterminada”, “colitis incierta”, enfermedad inflamatoria intestinal (crónica) no clasificable” y “enfermedad inflamatoria intestinal crónica idiopática NOS (not otherwise specified)” se han descrito en la literatura para pacientes con colitis crónica sin un diagnóstico definitivo. El diagnóstico de CI se debe restringir a casos en donde un completo análisis histológico está disponible en una resección quirúrgica. No se justifica ni aconseja el uso de subclasificaciones tales como “posible o favorece EC” o “posible o favorece CUI”. La mayoría de los pacientes con CI se presentarán con un colitis fulminante con úlceras extendiéndose hasta la túnica muscular propia1,2. El diagnóstico patológico de CI en resecciones intestinales se basa en la presencia de “características sobrepuestas” o la ausencia de un “patrón diagnóstico claro”; las características sobrepuestas son compromiso severo de la mucosa y pared, ausencia de cúmulos linfoides transmurales, fisuras que alcanzan la túnica muscular propia y un patrón discontinuo2. El diagnóstico de CI es un “diagnóstico temporal”. La duda diagnóstica ocurre más frecuentemente en niños, sin embargo, un patrón histológico de una inflamación aguda y crónica parcelar (discontinua) con alteración arquitectural confinados al colon sin que sea posible una clasificación definitiva puede verse en adultos dentro de la historia natural de CUI o secundaria al tratamiento. Para reconfirmar el diagnóstico, se debe revisar las biopsias previas y agendar un seguimiento al año y 5 años. Estudio epidemiológicos han mostrado que la mayoría de la CI se comportan como CUI2.
Diagnósticos diferencialesColitis InfecciosaLa colitis infecciosa (aguda auto-limitada) se caracteriza por un patrón de daño tipo “colitis activa” similar al de la EII, pero sin las características “crónicas” típicas antes mencionadas. Específicamente hay criptitis y microabscesos críticos sin distorsión arquitectural; la lámina propia presenta un infiltrado inflamatorio agudo, en contraste con el típico infiltrado linfo-plasmocitario característico de la EII1.
Clostridium difficile.C. difficile puede presentarse con una gran variedad de patrones histológicos, que van desde edema, una extensa colitis activa sin alteración arquitectural hasta una colitis pesudomembranosa. En pacientes con EII, la ausencia de pesudomembrana se ve en pacientes en tratamiento con inmunosupresores. Endoscópicamente, la pseudomembrana se observa hasta en un 50% de los pacientes con infección por C. difficile, siendo menos frecuente (13%) en pacientes con EII y C. difficile; histológicamente la pseudomembrana típicamente no está presente2. La pseudomembrana está formada por exudado fibrinoleucocitario asociado a necrosis de las porciones superficiales de las criptas, que puede llegar a la destrucción total de la mucosa en casos severos; la mucosa alejada de las pseudomembranas puede mostrar un patrón de colitis activa focal típico de infección1.
Citomegalovirus (CMV). La infección por CMV se asocia frecuentemente a una exacerbación clínica de una EII subyacente. El CMV típicamente infecta las células endoteliales o otras células estromales; con la tinción de H&E se observan células con una gran inclusión nuclear eosinofílica, usualmente rodeadas por un halo claro (fig. 11). La sensibilidad y especificidad de la H&E para las inclusiones nucleares típicas de CMV son de 10 a 87% y 92 a 100% respectivamente; células neuronales ganglionares y estromales degeneradas pueden simular inclusiones por CMV. La sensibilidad y especificidad mejoran con el usa de inmunohistoquímica con anticuerpo monoclonal contra CMV (sensibilidad: 78 a 93%). PCR cualitativa de tejido colónico se puede también usar, aunque el significado de un resultado positivo en ausencia de otros signos de infección es aún desconocido. La PCR cuantitativa podría ser más precisa, sin embargo, no se ha establecido un punto de corte que discrimine entre infección latente o activa ni para establecer el diagnóstico de colitis por CMV16. La cuantificación de células positivas (5 o más) por IHC contra CMV y/o el número de fragmentos de tejido positivos, pueden tener un factor pronóstico o correlacionarse con detección de CMV en sangre1,2,17.
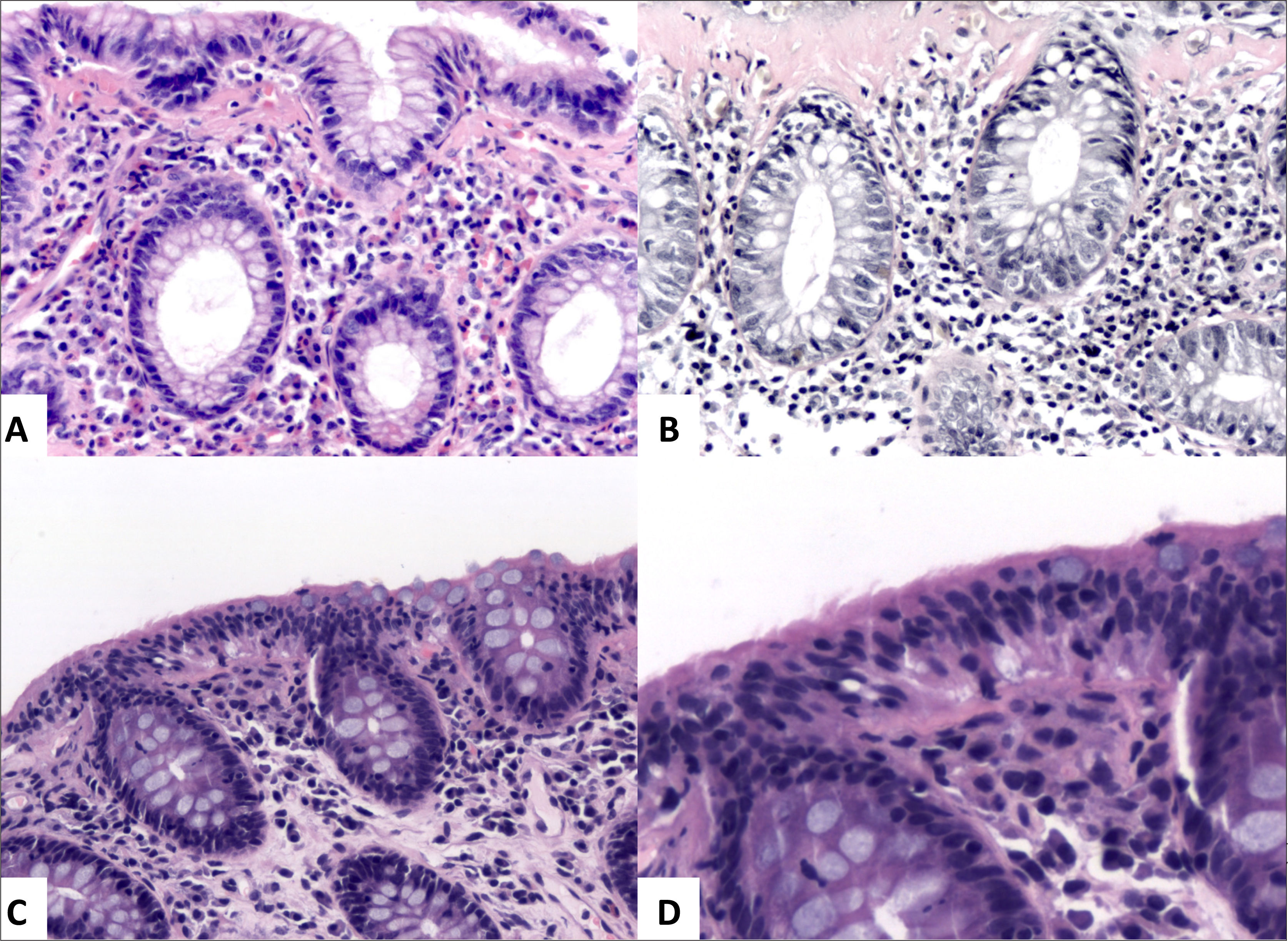
Colitis microscópica: linfocítica/colágenaLa colitis microscópica (CM) es una enfermedad inflamatoria caracterizada por diarrea acuosa, sin sangre, crónica y una colonoscopía normal o casi normal. Histológicamente hay dos subtipos: la colitis colágena (CC) y la colitis linfocítica (CL), las que son indistinguibles clínicamente3,18. La CC se caracteriza por el engrosamiento de la lámina colágena subepitelial de al menos 10μm (valor de referencia 2-7μm), inflamación de la lámina propia con aumento de linfocitos, células plasmáticas y eosinófilos y daño epitelial; puede haber o no aumento de linfocitos intrepiteliales (LIE); en ocasiones, la lámina colágena puede extenderse como enrejado a porciones más profundas de la lámina propia englobando células inflamatorias3. La CL se caracteriza por linfocitosis intraepitelial de más de 20 LIE por 100 enterocitos, inflamación de la lámina propia por células mononucleares (linfocitos y células plasmáticas), daño epitelial y la lámina colágena subepitelial menor a 10μm (fig. 12). Una manera rápida de evaluar el grosor de la lámina colágena subepitelial es contar el número de núcleos de linfocitos (diámetro de 5μm) que se pueden acomodar en ella3,18. Las características histológicas descritas, junto a una colonoscopía normal las distinguen de CUI y EC. Es importante destacar que hay pacientes individuales que pueden tener características histológicas de CC/CL y CUI/EC que se pueden sobreponer. Hay reportes de pacientes con CC/CM que desarrollan características típicas de EC en el seguimiento clínico subsecuente1. Esto denota que estas enfermedades podrían tener una etiología común, la cual es desconocida para ambas enfermedades, aunque algunos postulan que podría ser autoinmune 18.
Colitis DiverticularCambios inflamatorios pueden ocurrir en colitis diverticular; en ocasiones, estos cambios pueden involucrar la mucosa y simular EII en resecciones quirúrgicas, endoscopía y biopsias. A nivel de la mucosa, estos cambios incluyen distorsión arquitectural dada por ramificación y acortamiento de criptas y expansión de la lámina propia por infiltrado linfo-plasmocitario y plasmocitosis basal. En resecciones intestinales, los cambios pueden ser indistinguibles de EC1.
Colitis isquémicaLa isquemia puede causar anormalidades localizadas o difusas de la mucosa dependiendo de la etiología. Histológicamente, la isquemia aguda se caracteriza por grados variables de necrosis de criptas, denudación del epitelio superficial y con el tiempo, fibrosis hialina de la lámina propia asociada a la presencia de microtrombos hialinos en capilares. La isquemia crónica produce cambios crónicos que pueden simular EII, aunque la plasmocitosis basal típicamente está ausente1.
Colitis por exclusión o por desvío (“Diversion colitis”)Los cambios histológicos característicos de la colitis/proctitis por exclusión incluyen hiperplasia folicular linfoide en la mucosa, erosiones/úlceras, distorsión arquitectural criptal, inflamación aguda y crónica de la lámina propia y crititis y microabscesos crípticos. Agregados linfoides transmurales pueden ocurrir sólo por la desfuncionalización. Es importante reconocer estas características por dos razones: i) pacientes sometidos a una exclusión intestinal por razones diferentes a EII (ej: neoplasia, trauma, etc) pueden ser catalogados erróneamente de tener EII en el segmento desfuncionalizado y ii) pacientes con CUI pueden ser incorrectamente catalogados de tener EC basándose en la inflamación transmural del segmento distal excluido1.
Síndrome de Úlcera Rectal Solitaria (Prolapso Mucoso)El Síndrome de Úlcera Rectal Solitaria (SURS) típicamente se acompaña de la historia clínica de constipación y dificultad para defecar. Síntomas comunes incluyen sangramiento, eliminación de mucus y dolor al defecar. El SURS es más frecuente en adultos mayores (hasta 25% en pacientes mayores de 60 años), aunque se ha descrito también en niños. Típicamente ocurre en la pared anterior del recto, entre 10 y 15cm del margen anal. Macroscópicamente no siempre hay una úlcera y puede haber múltiples lesiones (30% de los pacientes). Las lesiones consisten en pólipos (25%), úlceras (21%) o ambos, o sólo manifestarse por una mucosa granular hiperémica (18%). Las úlceras van de los 0.5 a los 4cm y pueden simular un tumor. Microscópicamente, los primeros cambios incluyen erosiones/úlceras de tipo isquémico, a menudo con engrosamiento de la lámina colágena subepitelial; los hallazgos distintivos son hiperplasia fibromuscular lisa en la lámina propia, caracterizada por músculo liso hiperplástico que se extiende perpendicularmente hacia las porciones superiores de la mucosa, engrosamiento e hipertrofia de la túnica muscular de la mucosa, congestión vascular, hemorragia y edema. Las criptas muestras cambios epiteliales reactivos, tales como depleción de mucina y cambios hiperplásticos/serrados1,3.
Displasia y riesgo de adenocarcinoma en EIILa incidencia de cáncer colorrectal (CCR) en CUI es aproximadamente 4/1000 personas por año de enfermedad, con una prevalencia promedio de 3.5%. La EII es el tercer factor de riesgo más alto para desarrollar CCR, siendo la responsable del 1-2% de los casos de CCR en la población general y del 10-15% de todas las muertes en pacientes con EII19. El riesgo de desarrollar CCR depende de la duración y extensión de la enfermedad; un metaanálisis ampliamente citado de Eaden y cols, cuyos datos se originaron de estudios de diversa metodología, estimaron que el riesgo acumulativo en pacientes con CUI es de 2% a los 10 años, 8% a los 20 años y 18% a los 30 años de enfermedad19–22. Por el contrario, estudios poblacionales han arrojado resultados más conservadores; un metaanálisis de Jess y cols basado en 8 estudios poblacionales, reportó riesgos de <1%, 0.4-2% y 1.1-5.3% a 10, 15 y 20 años, respectivamente21,23. Sin embargo, a pesar de estos resultados, la correspondiente incidencia estandarizada fue de un sustancial 2.4 o incluso mayor para toda la cohorte, 4.8 para el subgrupo de colitis extensa y 8.6 para pacientes con inicio de la enfermedad antes de los 30-40 años21. Vale la pena hacer notar que pacientes con EC tienen riesgos de cáncer intestinal comparables a CUI, hecho justificado en metaanálisis basados en estudio poblacionales y no poblacionales. A pesar de estas diferencias, hay un consenso en la literatura de cuáles son los factores de riesgo individuales de CCR en pacientes con EII; los factores de riesgo más importantes son i) la presencia de displasia, ii) duración de la enfermedad mayor a 8 años, iii) colitis extensa o pancolitis, pero también CUI izquierda hasta un grado intermedio, iv) severidad histológica de la inflamación y v) colangitis esclerosante primaria concomitante21. Factores de riesgo adicionales incluyen debut de la colitis a temprana edad, presencia de pseudopólipos, historia familiar de CCR esporádico en familiares de primer grado y severidad endoscópica de la enfermedad2,21,22.
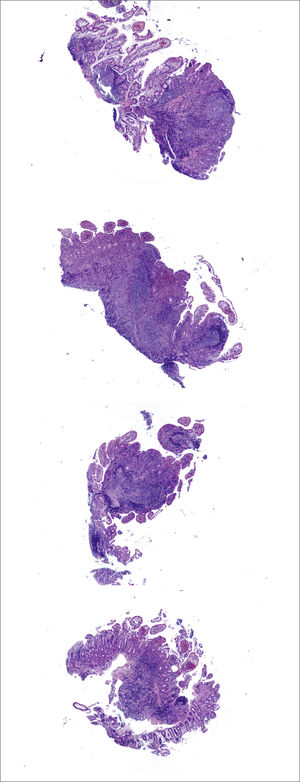
La displasia colorrectal, también llamada neoplasia intraepitelial en los sistemas de nomenclatura de la Organización Mundial de la Salud y Viena, se define como la alteración neoplásica inequívoca del epitelio intestinal, que permanece confinada a la membrana basal en la cual se originó21,24. En 1981 se acuñó el concepto de DALM (“dysplasia-associated lesion or mass”) para describir lesiones displásticas visibles en la colonoscopía en pacientes con EII, la cual, históricamente fue asociada con carcinoma invasor y con la necesidad de colectomía24. Sin embargo, era muy difícil de distinguir entre DALM y un adenoma esporádico, este último con un manejo conservador luego de la resección endoscópica. Además, algunos reportes mostraron que no todos los DALM requerían colonoscopía24–26. Debido a esta percepción de gravedad asociada al DALM, el “Surveillance for Colorectal Endoscopic Neoplasia Detection and Management in Inflammatory Bowel Disease Patients International Consensus” (SCENIC) publicó un consenso el 2015 en el que recomiendan que el término de DALM sea abandonado, para ser reemplazado por una terminología estandarizada que describe el aspecto endoscópico de las lesiones displásticas (tabla 4)24,27.
Terminología para la apariencia endoscópica de lesiones en seguimiento de displasia en EII adoptada por el SCENIC
| Término | Definición |
|---|---|
| Displasia visible | Displasia identificada en biopsia dirigida de una lesión vista en la colonoscopía |
| Polipoide | Lesión que protruye de la mucosa al lumen>2.5 mm |
| Pedunculada | Lesión unida a la mucosa por un pedículo |
| Sésil | Lesión no unida a la mucosa por un pedículo |
| No polipoide | Lesión con poca (<2.5 mm) o sin protrusión sobre la mucosa |
| Elevada superficialmente | Lesión con protrusión pero <2.5mm hacia el lumen |
| Plana | Lesión sin protrusión por sobre la mucosa |
| Deprimida | Lesión con a lo menos una porción deprimida por debajo del nivel de la mucosa |
| Displasia no visible | Displasia identificada en biopsias aleatorias (no dirigida) de la mucosa colónica sin una lesión visible |
El patólogo debe informar la ausencia o presencia de displasia y el grado cuando ésta está presente. El sistema de clasificación para el reporte de displasia más usado en Norte América es el 4 categorías descrito por Riddell y cols28: i) negativo para displasia, ii) indefinido para displasia, iii) displasia de bajo grado y iv) displasia de alto grado. El sistema de Viena, usado más frecuentemente en Japón y Europa, consiste en la misma clasificación pero con categorías adicionales (tabla 5)24. El uso de uno u otro sistema es apropiado y depende preferencias locales o institucionales (fig. 13).
Sistemas de clasificación de displasia de Riddell y Viena en EII
| Riddell | Viena |
|---|---|
| Negativo para displasia | Negativo para neoplasia/displasia |
| Indefinido para displasia | Indefinido para neoplasia/displasia |
| Displasia de bajo grado | Neoplasia no-invasiva de bajo gradoAdenoma/displasia de bajo grado |
| Displasia de alto grado | Neoplasia no-invasiva de alto gradoi. Adenoma/displasia de alto gradoii. Carcinoma no-invasivo (carcinoma in situ)iii. Sospechoso de carcinoma invasivo/Neoplasia invasivai. Adenocarcinoma intramucosoii. Carcinoma invasivo submucoso o más allá |
Tomada de Chiu y cols24.
La distinción entre displasia de bajo y alto grado depende del grado de pérdida de polaridad de la células epitelial. La displasia de bajo grado se caracteriza por un epitelio columnar a cuboidal monoestratificado con núcleos que se mantienen paralelos y en su mayoría se mantienen en la mitad basal de la célula. La displasia de alto grado se caracteriza por pérdida de la polaridad (paralelismo) nuclear, estratificación nuclear que alcanza la mitad apical de la célula y crecimiento celular complejo como la arquitectura cribiforme; adicionalmente, se observan aberraciones citológicas tales como membranas nucleares irregulares, nucléolo anormalmente prominente o figuras mitóticas atípicas. Las características que distinguen criptas reactivas de displásticas incluyen la “maduración” del epitelio reactivo hacia la superficie luminal, ausencia de transiciones abruptas desde el epitelio reactivo al maduro y correspondencia espacial entre los cambios citológicos reactivos y la intensidad de la inflamación de base. Aunque la evaluación de biopsias con mucosa regenerativa ocasionalmente resulta en el diagnóstico de indefinido para displasia, es incorrecto asumir que la displasia no se puede diagnosticar en una mucosa activamente inflamada21.
SíntesisLa evaluación histológica de la EII tiene como finalidad corroborar el diagnóstico de EII, diferenciar CUI de EC y descartar diagnósticos diferenciales (colitis no asociadas a EII). Llegar al diagnóstico correcto requiere un enfoque multidisciplinario de especialistas que incluye gastroenterólogos, psicólogos, nutriólogos, radiólogos, cirujanos y patólogos, y se debe hacer con la combinación de la historia clínica, examen físico, datos de laboratorio y hallazgos típicos endoscópicos, radiológicos e histológicos. La CUI y EC comparten las alteraciones correspondientes a la colitis crónica (i.e. plasmocitosis basal, ramificación y acortamiento de criptas, inflamación mixta y difusa en la lámina propia, metaplasia de células de Paneth, metaplasia de glándulas pilóricas, fibrosis e hiperplasia neuronal en la submucosa) y pueden llegar a ser indistinguibles. El diagnóstico microscópico de CUI se basa en una extensa distorsión arquitectural criptal, infiltrado inflamatorio difuso transmucoso con plamocitosis basal, eventualmente asociado a un componente activo que causa criptitis neutrofílica y microabscesos críticos. Las características histológicas que permiten realizar el diagnóstico de EC en biopsias endoscópicas incluyen inflamación crónica focal (discontinua), irregularidad criptal focal (discontinua) y granulomas (no relacionados a ruptura de criptas); las mismas características más la irregularidad de vellosidades puede usarse para el diagnóstico en biopsias de íleon2. A pesar de los criterios histológicos descritos para diferenciar CUI de EC, la discriminación precisa entre ambas enfermedades no es óptima entre patólogos gastrointestinales expertos. La colitis indeterminada debe hacerse resecciones intestinales con “características sobrepuestas” o la ausencia de un “patrón diagnóstico claro”; no se debe hacer el diagnóstico de CI en biopsias endoscópicas por el alto potencial de error diagnóstico; el término EII no clasificable es preferible en estos casos. El diagnóstico diferencial incluye colitis infecciosa, específicamente la asociada a infección por CMV y C. difficile, colitis microscópica, colitis diverticular, colitis isquémica y colitis por exclusión. Finalmente, los principales factores de riesgo para CCR en pacientes con EII son: presencia de displasia, duración de la enfermedad mayor a 8 años, colitis extensa o pancolitis, grado de severidad histológica de la inflamación y colitis esclerosante concomitante.
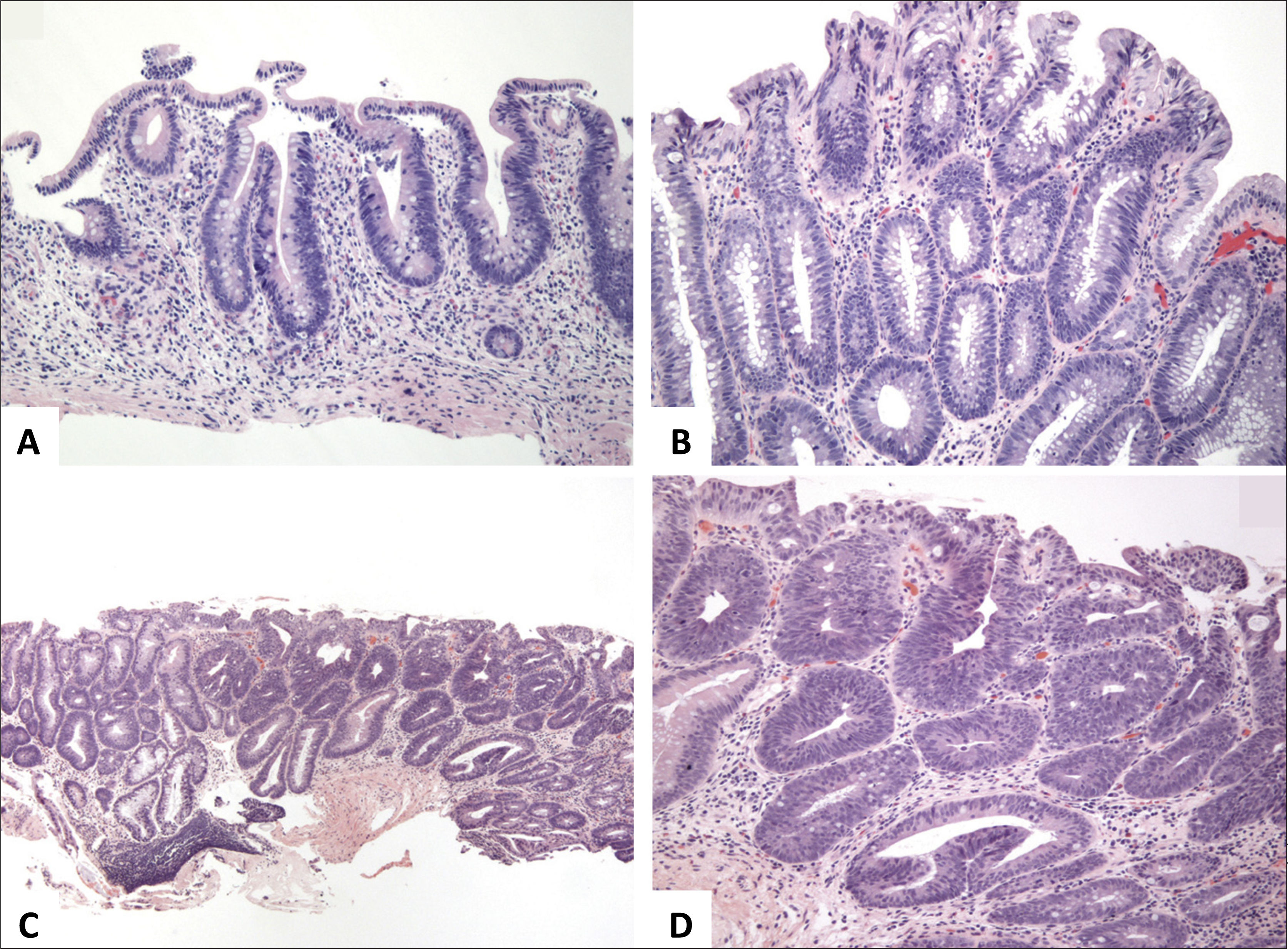
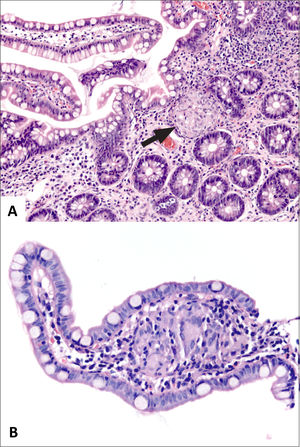
A y B (HE, 100x) corresponden a fragmentos de mucosa ileal con acortamiento y ramificación de criptas, mínima expansión de la lámina propia y metaplasia de glándulas pilóricas (recuadros). (C, HE 100x) destaca infiltrado inflamatorio difuso, un folículo linfoide basal y acortamiento y ramificación de criptas). (D, HE 100x) corresponde a colitis crónica inactiva con metaplasia de células de Paneth (recuadro).
A (HE, 40x) muestra mucosa de intestino grueso con leve acortamiento de criptas y leve expansión de la lámina propia. B (HE, 200x) muestra plasmocitosis basal e infiltrado inflamatorio mixto en la lámina propia compuesto por linfocitos, células plasmáticas y granulocitos eosinófilos. No se observa ramificación de criptas.
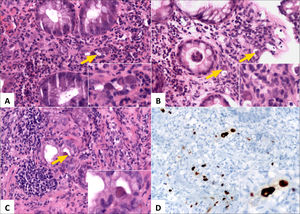
A (HE, vista escaneada) corresponde a resección de intestino grueso por Enfermedad de Crohn con inflamación y fibrosis transmurales y extensas áreas de ulceración y fisuras de la mucosa. B (HE, 40x) corresponde al mismo caso anterior con numerosos microabscesos cripticos (flechas amarillas) y colitis crónica de base dada por ramificación y acortamiento de criptas e infiltrado inflamatorio denso y difuso en la lámina propia; el diagnóstico corresponde a colitis crónica con acentuada actividad inflamatoria. C (HE, 40x) corresponde a colitis crónica con erosión superficial y numerosos microabscesoscrípticos. D (HE, 200x) muestra ejemplo de criptitis neutrofílica (izquierda) y microabsceso críptico (derecha).
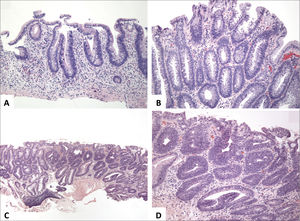
Se identifica inflamación difusa y continua de la mucosa desde el recto hacia proximal, con un límite abrupto entre la mucosa alterada y la sana (A y B tomadas de Odze y cols3). (C, HE, vista escaneada) muestra proceso inflamatorio confinado la mucosa y submucosa con extensas áreas de ulceración y formación de pseudopólipos.
(A) Es un esquema que representa el compromiso segmentario de la enfermedad que alterna con áreas sanas. (B) Corresponde a segmento de intestino grueso con área de engrosamiento de la pared y mucosa irregular en “empedrado” y eritematosa. (C, HE, vista escaneada) corresponde a apéndice vermiforme con inflamación transmural, fibrosis y cúmulos linfoides en el tejido subseroso. (D) Corresponde a íleon terminal y colon derecho con adherencias fibrosas ínter-asas y formación de fístula (estilete) a nivel de la unión íleo-colónica.
A (HE, 200x) corresponde a ileítis crónica inactiva con un granuloma epiteloideo en la lámina propia (flecha negra); nótese la ramificación de algunas criptas (ej: esquina inferior derecha). B (HE, 400x) corresponde a vellosidad intestinal (ileal) con granuloma epiteloideo en la lámina propia.
A (HE, 400x) y B (HE, 400x) muestran inclusiones nucleares en células endoteliales (flecha roja y recuadro); C (HE, 400x) muestra una inclusión nuclear en una célula epitelial glandular de duodeno (flecha y recuadro); D (inmunohistoquímica contra CMV, 400x) muestra positividad para IHC contra CMV en numerosas células endoteliales y estromales.
A (HE, 400x) y B (HE, 400x) muestran inclusiones nucleares en células endoteliales (flecha roja y recuadro); C (HE, 400x) muestra una inclusión nuclear en una célula epitelial glandular de duodeno (flecha y recuadro); D (inmunohistoquímica contra CMV, 400x) muestra positividad para IHC contra CMV en numerosas células endoteliales y estromales.
A (HE, 200x) y B (Van Gieson, 200x) corresponden a colitis colágena con engrosamiento de la lámina colágena subepitelial (∼35μm) la cual se extiende en forma irregular hacia la lámina propia englobando células inflamatorias; nótese leve aumento del infiltrado linfo-plasmocitario y granulocitos eosinófilos en la lámina propia. C (HE, 200x) y D (HE, 600x) corresponden a colitis linfocítica con prominente linfocitosis intraepitelial y mínimo aumento del infiltrado linfo-plasmocitario en la lámina propia.
A (HE, 400x) y B (HE, 400x) muestran inclusiones nucleares en células endoteliales (flecha roja y recuadro); C (HE, 400x) muestra una inclusión nuclear en una célula epitelial glandular de duodeno (flecha y recuadro); D (inmunohistoquímica contra CMV, 400x) muestra positividad para IHC contra CMV en numerosas células endoteliales y estromales.
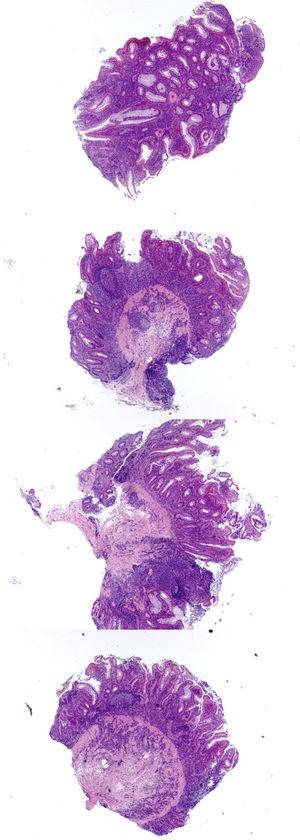
A (HE, 100x) corresponde a displasia bajo grado, no visible, no polipoide, plana en CUI. La muestra fue tomada de un mucosa de colon sin lesiones en un paciente con CUI; la displasia se manifiesta por epitelio con núcleos relativamente grandes e hipercromáticos que ocupan casi la totalidad de la longitud de la cripta con sólo una leve reducción en tamaño en la superficie; hay una leve distorsión arquitectural criptal y leve acortamiento de criptas que son cambios típicos de una colitis curada. B (HE, 100x) displasia de bajo grado polipoide que en la colonoscopía corresponde a una lesión pequeña mal definida sobreelevada en un paciente con EII; las anormalidades citológicas son similares a las descritas en (A), pero las criptas están alongadas y la mucosa expandida. C (HE, 40x) corresponde a displasia de alto grado; las criptas del centro y lado derecho de la muestra resaltan debido a la estratificación del epitelio y núcleos grandes e intensamente hipercromáticos; éstos contrastan con las criptas localizadas abajo y a la izquierda, las que contienen núcleos basales más pequeños y que corresponden a displasia de bajo grado. D (HE, 100x) muestra, a mayor aumento, la pronunciada estratificación nuclear y la proliferación epitelial intraluminal, que se traduce en focos de arquitectura cribiforme.
Tomada de Harpaz y cols21.
Declaración conflicto de interesesDeclaro no tener conflictos de interés respecto al artículo. No ha recibido fondos para este fin.