Diversos virus pueden infectar la piel y las mucosas de los seres humanos, manifestándose en diferentes patologías, de acuerdo a la edad, género y estado inmunológico. Un grupo importante de éstos tiene capacidad de replicar en células epiteliales, originando cuadros clínicos en los cuales se evidencia la destrucción celular o bien la hiperplasia del tejido infectado. Gran parte de estos virus persisten en células infectadas por años y tienen la capacidad de reactivarse y de manifestar nuevamente enfermedades cutáneas o mucosas. En algunos casos, ésta sólo se expresa de manera subclínica en una excreción del virus por secreciones que son fuente de infección. En los últimos años, los avances en técnicas moleculares han permitido contar con metodologías diagnósticas cada vez más sensibles, específicas y rápidas. Así como también el progreso en el área de vacunas y antivirales nos entrega mayores herramientas profilácticas y terapéuticas.
Various viruses can infect the skin and the mucous membranes of human beings, manifesting itself in different diseases, according to age, gender and immune status. An important group has the ability to replicate in epithelial cells, causing clinical manifestations which evidenced the cell destruction either infected tissue hyperplasia. Much of these viruses persist in cells infected by years and have the ability to reactivate and again express cutaneous or mucosal diseases. In some cases, it is only asymptomatically shred in secretions that are a source of infection. In recent years, advances in molecular techniques have allowed to have increasingly sensitive, specific and rapid diagnostic methodologies. As well as, the progress in the area of vaccines and antivirals also gives us greater prophylactic and therapeutic tools.
La piel, incluyendo las mucosas, es un órgano que con mucha frecuencia presenta infecciones virales. Estas infecciones pueden estar localizadas primariamente en la piel o manifestarse a nivel cutáneo-mucoso como parte de un cuadro general. En esta revisión, centraremos la atención en las enfermedades cutáneo-mucoso virales primarias, en las cuales los agentes infecciosos se encuentran replicando en células de piel y/o mucosas y, por lo tanto, originando daño epitelial directo, principalmente en inmunocompetentes.
VerrugasLas verrugas son la manifestación clínica más frecuente de observar, como resultado de la infección por el virus papiloma humano (HPV). Es una infección ampliamente distribuida en el mundo, que se presenta clínicamente desde la edad escolar. Un 10 a 22% de escolares tendrá verrugas alguna vez en su vida, si bien los estudios actuales con técnicas más sensibles muestran que el 100% de las personas están infectadas en la piel con HPV. En recién nacidos se han identificado HPV cutáneos en piel, de igual tipo que sus padres, lo que habla de una rápida y fácil transmisibilidad desde los primeros días de vida. En mucosa genital, constituye la principal ITS a nivel mundial. La transmisión vertical se plantea en menores de 2 años sin evidencias de abuso sexual (1).
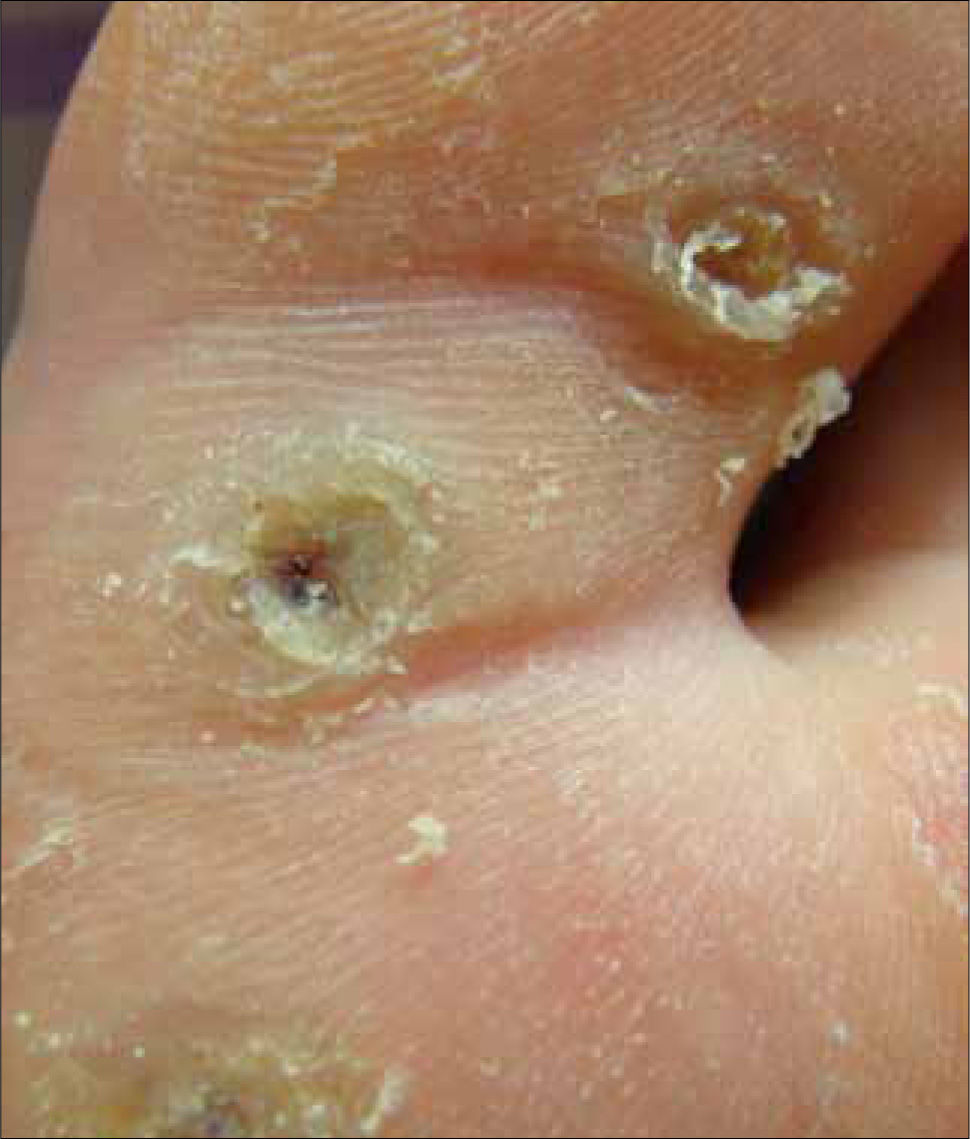
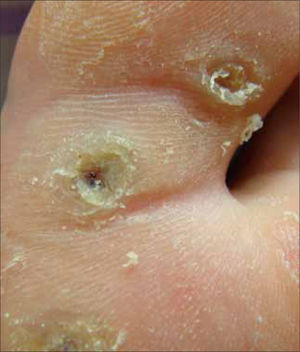
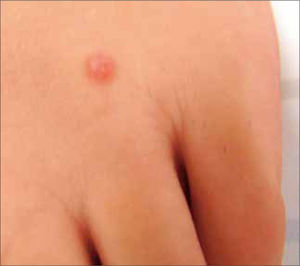
La morfología de las verrugas es variada pudiendo ser clasificadas en: verruga vulgar, verruga filiforme, verruga plana, verruga plantar y verruga genital. La verruga vulgar se observa frecuentemente en dedos y manos, rodillas y codos, pero puede estar en cualquier zona del cuerpo. Presenta hiperqueratosis sin reacción inflamatoria perilesional. Puede ser única o múltiple, aislada o confluente y su tamaño varía de un milímetro a más de un centímetro. Generalmente son causadas por los HPV genotipos 2 y 4. Especial atención se debe poner en las de localización periungueal, dado que pueden alterar la matriz ungueal de manera permanente. La verruga filiforme es una variante morfológica de la verruga vulgar. Se presenta con frecuencia en borde de párpados, nariz o labios y puede llegar a conformar un cuerno cutáneo. La verruga plana se presenta en todas las edades, principalmente en cara, brazos, dorso de manos y cara anterior de piernas. Generalmente son originadas por los HPV tipos 3,10, 28 y 41. Las verrugas plantares se originan frecuentemente en zonas de apoyo y son dolorosas a la presión directa y lateral, dado que habitualmente se trombosan los vasos sanguíneos dérmicos. Miden varios milímetros y en ocasiones confluyen en grandes placas. Se originan generalmente por el HPV tipo 1 (Figura 1). Las verrugas genitales se consideran una ITS y se pueden presentar en mucosa oral queratinizada y lengua, en 0,5% de la población. Su tamaño en variable, pero generalmente mide pocos milímetros. Mayoritariamente son originadas por los mismos genotipos de HPV de la región genito-anal; HPV tipo 6 u 11 (2, 3).
Enfermedad de heck y papilomas laríngeosLa Hiperplasia epitelial focal o Enfermedad de Heck es originada por la infección de los HPV 13 y 32 en mucosa oral y nasal. Está asociada a ciertas etnias y consiste en una proliferación epitelial asintomática benigna, en la forma de múltiples pápulas de color de la mucosa oral normal (4).
Los papilomas laríngeos pueden presentarse en niños cuyas madres están infectadas con HPV y que nacen por parto vaginal o cesárea, lo que sugiere una transmisión in útero. Los HPV 11 están asociados a cuadros más severos de papilomatosis respiratoria recurrente, con mayor riesgo de obstrucción (5).
Epidermodisplasia verruciformeLa Epidermodisplasia verruciforme (EV) es una genodermatosis autosómica recesiva infrecuente, que generalmente se inicia en la infancia y que se caracteriza por lesiones diseminadas planas tipo verrugas y máculas rojizas, hiperpigmentadas o hipopigmentadas, también descritas como lesiones tipo pitiriasis versicolor. Generalmente hay más de un genotipo de HPV en la piel. Frecuentemente ocurre una degeneración maligna de las lesiones en áreas fotoexpuestas, hacia carcinoma in situ, con progresión a carcinoma de células escamosas en la tercera década de la vida.(2)
Virus papiloma humanoEl HPV replica en epitelios pluriestratificados y tiene capacidad de persistir en las células basales infectadas. Algunos genotipos integran su genoma al DNA nuclear, alterando el ciclo celular y originando neoplasia. Estos virus pertenecen a la familia Papillomaviridae, son de pequeño tamaño, 55 nm, poseen un genoma DNA doble hebra lineal de aprox. 8000 kbp, su simetría es icosaédrica y no tienen manto. Existen actualmente más de 100 tipos de HPV humanos, los cuales se han clasificado de acuerdo a su secuencia genética en géneros y, dentro de éstos, en tipos. En términos generales, el género alfa (α HVP) agrupa los HPV asociados a infecciones en mucosas y el beta a los cutáneos y asociados a EV. El DNA de los HPV codifica 9 genes, los cuales se clasifican en 7 regiones tempranas (E1 a E7), dos regiones tardías (L1 y L2) y una región control (LCR). Los genes tempranos se relacionan con proteínas encargadas de la regulación, replicación y transcripción del DNA viral. Los productos de los genes de E6 y E7 son esenciales en el proceso de inducción, inmortalización y transformación celular. Las regiones tardías codifican las proteínas estructurales. Los genes E1, E2, L1 y L2 son particularmente bien conservadas entre todos los miembros de la familia y las mutaciones o recombinaciones son muy infrecuentes. La replicación viral acompaña las etapas de diferenciación de las células epiteliales. Según se les asocie a neoplasias los HPV se clasifican en Alto riesgo (AR), Bajo riesgo (BR) y probablemente carcinogénicos. En los genotipos de α HPV denominados de alto riesgo, el genoma viral se encuentra integrado y la transformación oncogénica se asocia principalmente a la capacidad de E6 y E7 de inhibir dos importantes reguladores del crecimiento celular, p53 y RB respectivamente. La mantención de los queratinocitos en estado replicativo (fase S), impidiendo la apoptosis celular, sería el resultado de alteraciones en la diferenciación terminal de las células y su relación con el cáncer de piel no melanoma estaría ligado a la acción de la luz UV (6).
Patogenia y respuesta inmuneLa infección se adquiere por transmisión directa a través de traumas cutáneos menores, por contacto sexual, por contacto durante el parto y posiblemente por fómites húmedos. En el caso de los β HPV se plantea que puedan ingresar por el canal folicular de la piel. El queratinocito es casi exclusivamente la célula que infectan, encontrándose ocasionalmente en otras células como el trofoblasto. Los β HPV infectan la capa basal de la epidermis y el área eipérmica del folículo piloso. Los receptores celulares que estarían reconociendo son Integrinas alfa 6 – beta 4, proteoglicanos del heparán sulfato o láminina 5. Tiene un período de incubación prolongado, que va de pocas semanas hasta más de un año, con un promedio de 3 meses. La evolución de la infección es variada ya que puede ser asintomática, manifestarse como verruga, presentar lesiones recurrentes, lesiones invasivas y cáncer. La mayoría de las infecciones estarían en estado silencioso, ya que se han encontrado múltiples tipos de HPV en piel clínicamente sana. La respuesta inmune específica es principalmente celular contra las proteínas tempranas (E), seguido por una respuesta humoral contra L1. Esta respuesta es débil y no todos los individuos infectados seroconvierten. El HPV evade la respuesta inmune ya que no hay una fase virémica durante su replicación, las células del estrato espinoso expresan niveles bajos de antígenos virales, no hay destrucción celular que gatille una respuesta inflamatoria y es capaz de persistir en células basales. Su eliminación por la superficie del epitelio impide acceso a vasos sanguíneos o linfáticos y, por ende, a linfonodos. En pacientes con inmunodepresión celular, la prevalencia es más alta. Cuando existe un sistema inmune competente la mayoría de las infecciones desaparecen en 4-20 meses. Las lesiones pueden aumentar en tamaño y número en los inmunocomprometidos, especialmente transplantados de órgano sólido, embarazadas o portador de EV, y ser más refractarias al tratamiento (1, 6, 7).
Diagnóstico, Tratamiento y PrevenciónEs eminentemente clínico, basado en la morfología de las lesiones y puede ser corroborado por un estudio histopatológico (HE). Para la detección del HPV en las lesiones, se pueden utilizar: técnicas inmunohistoquímicas para detectar antígenos virales en la biopsia; PCR, hibridación con sondas y captura híbrida detectan el genoma viral. La PCR puede ser realizada identificando secuencias consenso de la familia viral con posterior genotipificación mediante hibridación, secuenciación y ensayos de arreglos genómicos o bien puede ser tipo específica. La serología sólo se utiliza en proyectos de investigación.
En la elección del tratamiento se deben considerar factores tales como la edad, la localización, estado inmunológico, etc. Las verrugas pueden involucionar espontáneamente en un 30% a los 6 meses y en un 65% a los 2 años (1). Además, la mayoría de los tratamientos tienen mejores resultados que un placebo, especialmente en niños, por lo que se recomienda remover la verruga, evitando cicatrices e inducir inmunidad local para evitar recurrencias. Se debe considerar que ningún tratamiento tiene una alta tasa de curación (60 a 70% en tres meses), teniendo mejor pronóstico los pacientes jóvenes. El nivel de evidencia de los tratamientos se presenta en la Tabla N°1 (8). El Cidofovir es un antiviral, análogo de nucleósido, que inhibe la DNA polimerasa y es activo contra diferentes virus DNA. Su uso tópico está limitado a casos resistentes a otros tratamientos (9).
Tratamientos ensayados en verrugas cutáneas
| TRATAMIENTO | NIVEL DE EVIDENCIA | FRECUENCIA DE APLICACIÓN |
|---|---|---|
| Crioterapia | A, I | Ciclos de congelamiento cada 3-4 semanas |
| Terapia fotodinámica | B, I | 3 tratamientos: ALA 20% + irradiación |
| Acido salicílico (AS) Bleomicina Retinoides | B, II ii | AS 15 a 30% verrugas plantares 25% en verrugas planas uso diario Única aplicación intralesional Tópicos diariamente Sistémicos: acitretin oral x 3 meses |
| Formaldehído | C, II ii | Tópico 0,7% a 3% diario en verrugas en mosaico o placa |
| Electrocauterio Glutaraldehído | C, III | Riesgo de cicatrización Aplicación diaria al 10-20% |
| Cauterio químico Laser CO2 IPL Sensibilización tópica | C, IV | Aplicación 2 veces a la semana Tratamiento único Tratamiento único Sensibilización inicial y luego aplicación semanal tópica en diluciones sugeridas |
| Cimetidina oral Homeopatía | D, I | 3 meses |
| Podofilina Remedios caseros Hipnosis Interferón Imiquimod | Evidencia insuficiente |
(Adaptado de Ref. Nº 8)
No es posible evitar el contagio de los HPV cutáneos. No existe una vacuna que contenga estos genotipos. Es recomendable mantener las verrugas cubiertas con tela adhesiva para evitar su contacto, diseminación y cubrirlas de la LUV, por su efecto inmunodepresor en piel. En áreas pilosas, evitar el rasurado o depilación.
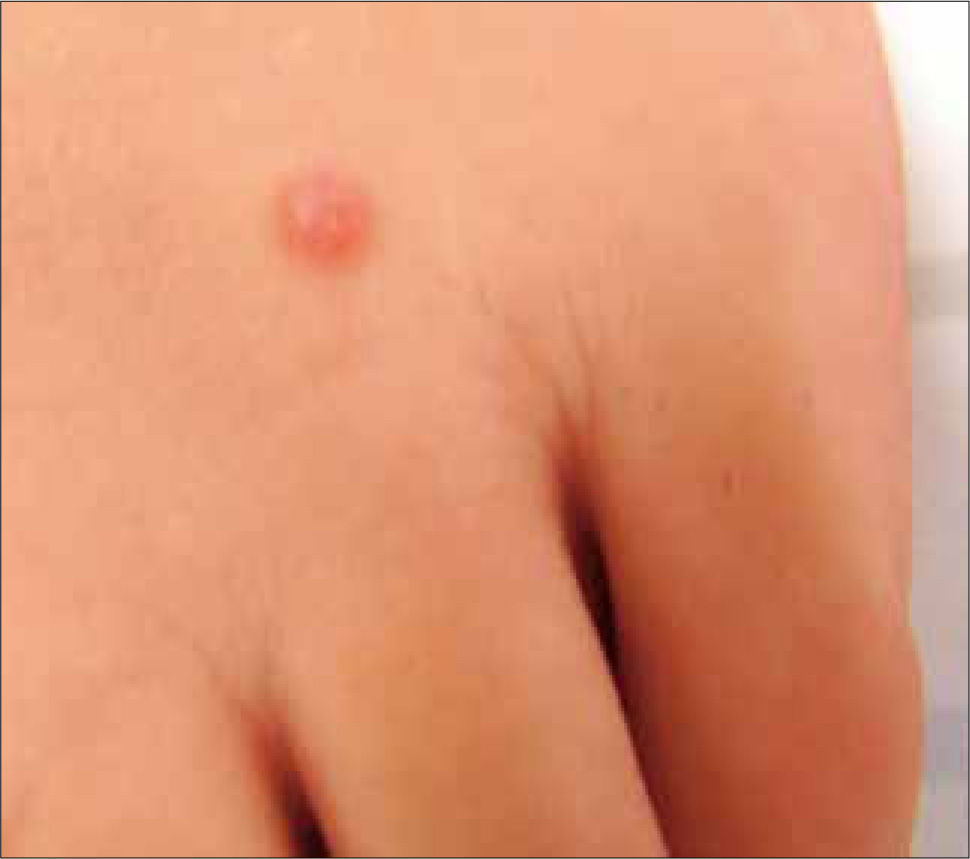
Molusco contagiosoEl Molusco contagioso es causado por el virus del molusco contagioso tipo 1 (VMC-1) y se presenta con mayor frecuencia en menores de 5 años, con una incidencia estimada en 2 a 8% a nivel mundial. En los adolescentes y adultos puede ser transmitido vía sexual. En los pacientes transplantados y con SIDA, la incidencia puede alcanzar el 20% y las lesiones pueden comprometer todo el cuerpo, especialmente la cara. La lesión del molusco comienza clásicamente como una pápula de 1 a 2mm indolora, que puede crecer hasta convertirse en un nódulo, a veces umbilicada en el centro. Al ser comprimidas dan salida a un material blanquecino llamado “cuerpo del molusco”, el cual es altamente contagioso. Única o múltiples, por lo general no presentan reacción inflamatoria perilesional, a menos que la lesión sea traumatizada. En la dermatitis atópica puede presentarse en forma diseminada (10, 11).
Virus del Molusco ContagiosoLos Poxviridae de importancia médica incluyen virus humanos y zoonóticos. La mayoría de los virus pox comparten las propiedades estructurales. Los transmitidos entre humanos son el virus viruela y el VMC, y los transmitidos desde ganado corresponden a los virus vaccinia, Orí y un paravaccinia que origina el Nódulo del ordeñador. Tienen una forma de ladrillo de 250 x 200 x 200 nm, y en algunos casos tienen manto. El DNA doble hebra lineal del VMC contiene 188 a 200 kbp y existen dos subtipos principales. El virus replica en células de la epidermis, provocando una hipertrofia de cada célula y una hiperplasia del tejido que origina la lesión papular o nodular (12).
Patogenia y respuesta inmuneLa transmisión ocurre por contacto directo y también es posible a través de fómites, pudiendo diseminarse por autoinoculación. El período de incubación es de 2 a 7 semanas. La enfermedad es a menudo autolimitada, con resolución espontánea sin cicatriz en el plazo promedio de 18 meses, pero puede tener un curso tórpido en pacientes inmunodeprimidos. Las lesiones no desarrollan una respuesta inmune protectora (12).
Diagnóstico, Tratamiento y PrevenciónEl diagnóstico es generalmente clínico. (Figura 2) Pacientes VIH pueden presentar lesiones faciales múltiples y en estos casos hay que diferenciar de una micosis invasora diseminada (Ej: criptococosis, histoplasmosis, coccidioidomicosis), mediante biopsia de la lesión y estudio histopatológico. Si bien no es utilizado el diagnóstico virológico, el virus se podría identificar mediante microscopía electrónica, real time PCR y secuenciación.
Aunque las lesiones de molusco contagioso generalmente se resuelven en forma espontánea, se indica su remoción por el riesgo de diseminación. Esta puede ser física o química y las formulaciones tópicas pueden ser utilizadas en combinación. Su utilización dependerá de factores del paciente y acceso a las terapias. En pacientes HIV + refractarios se ha usado el Cidofovir tópico, como antiviral (9). Se debe prevenir el contagio evitando el contacto con las lesiones de personas infectadas, cubriendo las lesiones con tela adhesiva y evitar el rasurado de zonas afectadas. Este virus no tiene vacuna.
Ectima contagioso (ORF) humano y nódulo del ordeñadorSon infecciones causadas por Parapoxvirus que infectan normalmente a ungulados (ovejas, cabras, ciervos), en el caso de Orf y a vacunos en el del Nódulo del Ordeñador. Estos virus producen nódulos eritematosos y exudativos alrededor del hocico del animal, y en las ubres de las vacas, los que curan espontáneamente en un mes, dejando inmunidad permanente. Los humanos se infectan por inoculación directa del virus al tocar las lesiones de los animales o a través de fómites, no existiendo transmisión entre humanos. Se presenta preferentemente en pastores, esquiladores, ganaderos, ordeñadores, carniceros y veterinarios. Clínicamente se presentan como una o varias pápulas en las manos, de uno a dos cm, que evolucionan en 6 estados: maculopapuloso, en forma de diana, nódulo exudativo, estado negro regenerativo con puntos negros, papilomatoso y regresión con costra seca. La localización más frecuente es el dorso del dedo índice de la mano derecha. Las lesiones se suelen acompañar de linfangitis, adenopatías, malestar general y fiebre.
La confirmación del diagnóstico se realiza mediante biopsia y estudio histopatológico y microscopía electrónica o PCR. El tratamiento es de apoyo (manejo del dolor y de la sobreinfección), y se espera la curación espontánea en 4 a 6 meses (13).
Gingivo estomatitis herpéticaEste es un cuadro agudo de vesículas y erosiones de la mucosa oral, febril y que se presenta generalmente en el menor de 5 años. Representa la manifestación sintomática de la primoinfección por el virus herpes simplex tipo 1 (HSV-1), la cual se presenta en el 10% a 30% de los infectados. La infección por HSV-1 generalmente es adquirida a temprana edad y su distribución es mundial, con variaciones entre países y niveles socioeconómicos. En general, el rango de prevalencia en población adulta es entre 50 y 90%. En áreas de baja seroprevalencia se observa un aumento de infecciones en la edad de la adolescencia y adulto joven, presumiblemente por contacto sexual. Asimismo, en poblaciones jóvenes de alto riesgo sexual, la prevalencia supera el 97%. Clínicamente se presenta con odinofagia, fiebre y múltiples vesículas y erosiones dolorosas en labios, encías, mucosa oral y porción anterior de la lengua y paladar duro. Habitualmente el paciente presenta sialorrea, halitosis y adenopatías cervicales o submentonianas. La resolución completa se alcanza a la segunda semana de evolución, siendo contagiosa la saliva y las lesiones orales todo el tiempo. En adolescentes se puede manifestar como una Faringoamigdalitis herpética, con lesiones localizadas en faringe posterior. En menos del 10% de los pacientes se asocian a vesículas orolabiales (14, 15).
Herpes labialCuadro vesiculoso que se presenta en el labio y representa la forma más frecuente de recurrencia por HSV-1. El herpes labial se presenta en 38 a 45% de los individuos seropositivos para este virus. Al reactivar el HSV-1 desde el ganglio trigémino hacia la boca, se puede originar una excreción viral asintomática por la saliva o manifestarse clínicamente como un herpes labial. Este se inicia con un pródromo de dolor, ardor u hormigueo y presencia de vesículas agrupadas sobre una base eritematosa, generalmente en el borde del bermellón del labio. Si bien se resuelve en 5 a 7 días, el virus sólo se excreta durante las primeras 72h del cuadro clínico. En inmunocomprometidos las manifestaciones clínicas pueden ser atípicas, con una mayor extensión y agresividad. En estos pacientes se pueden presentar glositis, esofagitis, grandes ulceraciones orales, entre otras (14, 15).
Otras localizacionesLa infección inicial a nivel ocular y las reactivaciones virales en neuronas de la rama oftálmica del V par causan queratitis, queratoconjuntivitis y/o Blefaritis Herpética. Todos estos casos deben ser evaluados precozmente por un oftalmólogo.
El Panadizo Herpético es la infección primaria o recurrente por HSV en los dedos de las manos. Es común en personal de la salud y niños pequeños. Se caracteriza por vesículas periungueales, dolorosas, eritema y edema, que luego evolucionan con erosiones. A veces se acompañan de linfangitis y linfadenopatías axilares sensibles (16).
Eccema herpético (Erupción variceliforme de kaposi)El Eccema herpético o Erupción variceliforme de Kaposi es un desorden cutáneo debido a una infección herpética en piel afectada por otra patología dermatológica de base, (ej. Dermatitis atópica, quemaduras, etc.). Las lesiones se presentan como erosiones monomorfas, múltiples, que rápidamente se diseminan y que pueden volverse hermorrágicas, costrificadas, ulceradas, necróticas o sobreinfectadas. Dura entre 7 a 10 días, pero puede prolongarse hasta por 6 semanas. Puede asociarse con fiebre, malestar general y adenopatías (14).
Virus herpes simplex tipo 1 (HSV-1)Su estructura está compuesta por: un core que contiene una cápsula icosaédrica, en cuyo interior se encuentra la doble hebra lineal de DNA de 152 mil bp.; un tegumento, compuesto por aproximadamente 22 proteínas virales, algunas de las cuales interfieren con funciones celulares e inician la transcripción de genes virales y su envoltura externa tiene 12 glicoproteínas (gp). El virus entra a la célula dada la interacción de las gp virales con una serie de receptores celulares, entre los que se ha identificado un tipo de heparán sulfato de la superficie celular, las nectinas-1 (una molécula de adhesión intercelular encontrada en las uniones adherentes de células epiteliales y sinapsis neuronales) y el receptor de entrada para HSV (HVEM), miembro de la familia de receptores FNT α, que se encuentra principalmente en linfocitos. En la replicación del genoma viral participan una DNA pol y una Timidino Kinasa viral, los cuales son sitios de acción de antivirales. En neuronas, el HSV-1 establece latencia, por lo que persiste sólo su DNA de manera episomal en el núcleo celular. Los procesos involucrados en la latencia y en la reactivación de la replicación no se conocen en su totalidad. (15)
Patogenia e InmunidadEl HSV-1 se contagia por contacto, desde un individuo que presenta lesiones en piel o mucosas o bien que excreta el virus asintomáticamente por la saliva. El período de incubación varía de dos a 20 días aproximadamente El virus replica en el estrato espinoso de la epidermis, provocando lisis, abalonamiento y fusión celular, por lo que puede diseminarse de célula a célula directamente. Al pasar la capa basal, el virus puede infectar endotelio vascular e ingresar a los terminales nerviosos de las neuronas sensitivas y viajar hasta el núcleo neuronal, en donde permanece latente. El HSV-1 puede reactivar periódicamente, gatillado por factores como la luz ultravioleta, estados febriles, estrés, embarazo, entre otros, y viajar por el axón hasta el sitio inicial de la infección o cercano a éste, donde se replica nuevamente en los queratinocitos epidérmicos. Este episodio de reactivación viral puede resultar en una recurrencia clínica con lesiones manifiestas o en una excreción asintomática del virus por las secreciones. Inicialmente los HSV-1 estimulan la respuesta de linfocitos innatos, células NK y células δT en el sitio de la infección. Mediante receptores tipo Toll 9 el DNA viral gatilla la producción de INFα, el cual tiene un potente efecto contra HSV. El INFγ liberado por células T específicas activa factores de transcripción que impiden la síntesis de proteínas virales. En la respuesta específica contra HSV-1 participan LTcd4+, LTcd8+ y anticuerpos. Los LTcd8 específicos son protectores de la enfermedad, pero no impiden que se establezca latencia en neuronas sensitivas. El HSV-1 ha desarrollado diversas estrategias para evadir el sistema inmune del hospedero, dirigidas tanto a la respuesta innata como a la específica (17).
Diagnóstico, tratamiento y prevenciónEl diagnóstico de una infección herpética es frecuentemente clínico. Los exámenes de laboratorio se realizan a partir de muestras de lesiones activas cutáneas o mucosas, o de secreciones. La PCR tiene una sensibilidad y especificidad cercana al 99% y la PCR en tiempo real ha demostrado ser un método cuatro veces mejor que el aislamiento viral en cultivos celulares. Si bien el aislamiento viral permite certificar el diagnóstico (sensibilidad 85%), su rendimiento depende de la acuciosidad en la toma de muestra, así como de la calidad de su trasporte al laboratorio. La detección directa de antígenos virales mediante anticuerpos monoclonales en frotis de secreciones o raspados de lesiones agudas tiene menor sensibilidad (aproximadamente del 75%) que las dos técnicas antes mencionadas. La serología sólo es útil para estudios de seroprevalencia y para identificar a individuos susceptibles. La mayoría de los ensayos presenta una alta reactividad cruzada entre HSV-1 y HSV-2, por lo que se deben utilizar técnicas de ELISA que identifiquen la IgG anti glicoproteína G (18, 19).
El aciclovir, el valaciclovir, el famciclovir y el penciclovir son útiles en el tratamiento de las infecciones por HSV-1. Valaciclovir (prodroga de aciclovir) tiene una biodisponibilidad muy superior a aciclovir, por lo que es el tratamiento oral de elección en los mayores de 12 años. En inmunocomprometidos y casos severos se debe utilizar aciclovir endovenoso. En casos de resistencia antiviral se puede utilizar foscarnet o cidofovir. La condición de infección latente y la frecuencia de excreciones asintomáticas hace muy difícil la prevención de esta infección a temprana edad. Evitar el contacto con mucosa y saliva, al igual que un buen lavado de manos es útil. No existe una vacuna licenciada para la infección por HSV-1 (17, 20).
Herpes neonatalPrincipalmente es originado por el virus herpes simplex tipo 2 (HSV-2). La infección neonatal se presenta en un 45% de los casos con lesiones en piel, boca y ojos; un 35% presentará compromiso del sistema nervioso central y un 20% un herpes diseminado. Las lesiones en piel son vesiculosas o ampollares, pero inicialmente pueden presentarse sólo úlceras orales o corneales. El herpes neonatal se presenta en cifras que van de 1/2.500 hasta 1/15.000 partos en EE.UU y Europa. En jóvenes y en países orientales, el HSV-1 es un agente importante del herpes genital y por lo tanto, puede ocasionar herpes neonatal (21).
Virus herpes simplex tipo 2 (HSV-2)Su estructura es similar al HSV-1, con diferencias en algunas glicoproteínas de envoltura, lo cual permite diferenciarlos en los procesos de diagnóstico de laboratorio. En el ingreso de este virus a las células no habría una interacción con Heparán Sulfato (22).
Patogenia e InmunidadLa infección por HSV-2 es adquirida vía sexual. Al neonato, generalmente es transmitida al momento del parto (85% de los casos). El virus puede estar presente en lesiones de la piel o mucosas de los genitales, o bien puede ser excretado en forma asintomática en secreción vaginal, como consecuencia de una primoinfección genital materna o de una recurrencia desde los sitios de latencia en neuronas de ganglios sensitivos sacros. Los LTCD4+ y el IFNγ son efectores importantes de la respuesta inmune en mucosa. Los LTCD8+ específicos también se agrupan en los sitios de infección y tienen un rol en la replicación y excreción a nivel ganglionar, dado su rol de vigilancia inmunológica y supresión. Los anticuerpos han demostrado tener un rol protector relevante en la transmisión de infección materno-fetal. Sin embargo, la deficiencia aislada de éstos rara vez se correlaciona con primoinfecciones o reactivaciones severas y el alza de anticuerpos que se puede demostrar como respuesta a vacunas no ha sido necesariamente protectora.
El riesgo de transmisión es mayor en la primoinfección (30%) que en una recurrencia genital materna (3%). Con menor frecuencia se contagian en el período postnatal (10%), por lesiones cutáneas maternas o del personal de salud (generalmente por HSV-1). En un bajo porcentaje (5%), el hijo se infecta en el útero, presentando lesiones en la piel al momento de nacer (21, 22).
Diagnóstico, tratamiento y prevenciónEn infecciones de lesiones en el recién nacido resulta especialmente importante obtener resultados rápidos que permitan definir una terapéutica apropiada, por lo que la utilización de la PCR en tiempo real es de gran utilidad, tanto en muestras de fluidos como de tejidos. La serología puede presentar reactividad cruzada entre ambos tipos de HSV (18).
La droga de elección para el tratamiento es el aciclovir ev por 14 ó 21 días, dependiendo del compromiso del sistema nervioso central. Aún no se ha establecido un protocolo de tratamiento en la embarazada que reduzca el herpes neonatal. Se estudian diferentes vacunas anti HSV-2 para el control del herpes genital y la prevención del herpes neonatal (17, 21).
VaricelaLa varicela es una enfermedad generalizada, altamente contagiosa, de curso benigno en la infancia. Es causada por la primoinfección del virus varicella-zoster (VZV). Se presenta inicialmente en la cara y cuero cabelludo, extendiéndose rápidamente al tronco y desde ahí al resto del cuerpo, comprometiendo piel y mucosas. Las lesiones típicamente progresan desde máculas rosadas a pápulas, vesículas de base eritematosa, pústulas y costras. El período eruptivo se prolonga por aproximadamente 10 días, en distintos estados de evolución. La presentación clínica generalmente es más severa en los casos secundarios dentro del hogar, en los adultos y en los pacientes con compromiso de la inmunidad celular. En estos casos la sobreinfección de las vesículas por S aureus y/o S pyogenes es la complicación más frecuente. También pueden presentarse complicaciones derivadas de la propagación de VZV en otros órganos, como neumonitis, ataxia cerebelosa aguda o encefalitis. La varicela en el niño o adulto inmunocomprometido es causa de morbilidad mortalidad importante, especialmente los que padecen leucemia, ya que tienen lesiones más numerosas con base hemorrágica y la curación de las lesiones cutáneas demora casi tres veces más. El 30-50% de los casos presenta complicaciones viscerales (pulmón, hígado, SNC, retina) que pueden ser fatales. En los niños portadores de HIV la complicación más común es la sobreinfección de la lesiones y, cuando los recuentos de CD4 son muy bajos, pueden presentar un síndrome de varicela crónica (23).
La varicela se presenta en niños de 1 a 9 años, aunque puede afectar a individuos susceptibles a cualquier edad, en forma endémica con brotes anuales, especialmente a fines de invierno y principios de primavera, con una incidencia de 13 a 16 casos por 100.000 habitantes. El hombre es el único reservorio. La letalidad por varicela en los niños inmunocompetentes es menor a 2/100.000 casos, riesgo que aumenta 15 veces en los adultos. (23)
Herpes zosterEl herpes zoster representa la manifestación clínica de la reactivación del VZV, que ha quedado persistiendo en forma latente en los ganglios sensitivos, autonómicos y pares craneanos. Este se inicia con sensaciones variables (prurito, ardor, dolor) y el 5 a 20% de los pacientes puede presentar síntomas generales como cefalea, compromiso del estado general, fiebre y adenopatías regionales. Las lesiones del herpes zoster son característicamente unilaterales, no cruza la línea media y se limita a un dermatomo, lo que refleja la vía de infección neural. Se presentan vesículas agrupadas sobre una base eritematosa, las que evolucionan a costra en 2 a 3 semanas. Con frecuencia se observa compromiso del trigémino en su rama oftálmica, o de los segmentos torácicos a la altura de T3 o lumbares en L4. La reactivación del VZV puede originar una viremia durante los primeros días del herpes zoster. En inmunocomprometidos puede presentarse una diseminación cutánea y/o visceral. El herpes zoster durante el embarazo tiene un riesgo muy bajo de transmisión al hijo. La Neuralgia post herpética (NPH) es la complicación más frecuente del herpes zoster. La incidencia global es del 8-15%, siendo la edad el principal factor de riesgo, ocurriendo en el 50% de los mayores de 60 años. El herpes zoster oftálmico puede originar ceguera al comprometer la córnea. El compromiso de la zona media nasal debe alertarnos (signo de Hutchinson). El compromiso del VII par craneal puede originar parálisis facial, la cual puede acompañarse de lesiones en el conducto auditivo externo (Síndrome de Ramsay Hunt). La infección por HIV, las enfermedades malignas linfoproliferativas y los tratamientos inmunosupresores aumentan la incidencia, recurrencia y severidad del herpes zoster (24).
El herpes zoster ocurre de manera esporádica durante todo el año, independientemente de la prevalencia de varicela; afecta alrededor del 20% de la población que ha tenido la infección y su incidencia aumenta en ancianos y en inmunosuprimidos. Tiene una incidencia de 5 a 6,5 casos por 100.000 habitantes en mayores de 60. La probabilidad de sufrir un segundo episodio es menor al 5% y ocurre especialmente en >70 años. La frecuencia de herpes zoster en niños es 5 a 10 veces menor que en los adultos y la presentación clínica en ellos es menos severa. Los factores de riesgo conocidos para presentar herpes zoster en la infancia son el antecedente de varicela materna durante el embarazo y haber presentado varicela durante el primer año de vida (23, 24).
Virus varicella-zosterEl Virus Varicella-Zoster (VZV) es muy similar en morfología y replicación a los demás Alphaherpesvirus. Posee genoma ADN, nucleocápside icosaédrica, tegumento amorfo y manto externo. El genoma de VZV es doble hebra lineal y posee aproximadamente 125 kpb. Estudios moleculares han demostrado 5 genotipos distintos de VZV distribuidos en áreas geográficas específicas. El VZV posee la capacidad de establecer latencia y de reactivarse, manteniendo su genoma circular en número de 2 a 9 copias en el 1 a 7% de las neuronas de un individuo. En el humano se ha demostrado latencia, principalmente en neuronas sensitivas de los ganglios dorsales y de los nervios craneales. La reactivación ocurre con más frecuencia en la tercera edad y en inmunocomprometidos, reflejando una deficiencia inmune específica para VZV (25).
Patogenia e inmunidadPara VZV el contagio es principalmente vía aérea, aunque también se puede adquirir por contacto directo con lesiones activas desde un individuo con varicela (20% potencia infectante) o herpes zoster (0,1% potencia infectante). El VZV entra por vía conjuntival u orofaríngea, se multiplica en el epitelio respiratorio y las amígdalas y enseguida alcanza los ganglios linfáticos regionales, infectando LTCD4+. Luego de su paso a la sangre, continúa su replicación en polimorfonucleares periféricos (células de memoria que expresan antígeno cutáneo de homing y CCR4), los que contribuirían a su diseminación hematógena y llegada a los principales órganos blancos: piel, mucosas y aparato respiratorio. El período de incubación es entre 11 a 21 días. El paciente excreta virus por la mucosa faríngea desde 1-2 días antes de la aparición del exantema hasta 5 días después. En el estrato espinoso de la epidermis, el virus replica, lisa las células e ingresa los axones sensitivos nervios craneales, de la raíz dorsal y nervios autonómicos. Viaja al núcleo neuronal y establece latencia. Al reactivarse, el virus viaja en sentido distal por el nervio sensitivo causando neuritis y es liberado alrededor de las terminaciones nerviosas de la piel. Un 30% de los herpes zoster en adultos son reinfecciones por otros genotipos. Al momento de la reactivación viral y el diagnóstico de herpes zoster hay también excreción a nivel respiratorio, si bien la cantidad de virus es inferior a la cuantificada durante el cuadro agudo de varicela, puede representar una fuente de contagio a considerar dentro de un ambiente donde estén otros pacientes susceptibles a la infección. La respuesta inmune (celular y humoral) limita la infección. La IgG anti VZV persiste en niveles bajos toda la vida, contribuyendo a impedir las reinfecciones. En estudios convacunas se demostró una fuerte reacción de la respuesta inmune celular frente a este virus. El VZV puede ser transmitido vía transplacentaria al feto y originar una varicela congénita, en el 1 a 2% de las infecciones maternas. Existe mayor riesgo durante el 1er y 2° trimestre del embarazo. Los recién nacidos con varicela congénita presentan una erupción a veces hemorrágica y duradera, cicatrices en las extremidades o en dermatomos, hipoplasia de extremidades inferiores, microcefalia y a nivel ocular, catarata, corioretinitis y micro-oftalmia que pueden causar ceguera. Cuando la embarazada presenta varicela desde 4 días antes hasta 2 días después del nacimiento, el recién nacido no posee anticuerpos maternos protectores, por lo que puede desarrollar una varicela neonatal severa, que se presenta 5 a 10 días después de nacido y que puede llevar a la muerte al recién nacido por daño viral a nivel pulmonar y del sistema nervioso central (23-25).
Diagnóstico, tratamiento y prevenciónEl diagnóstico de la varicela y del herpes zoster es clínico. El estudio de laboratorio se realiza para confirmar los casos de presentación atípica o severa. El método más sensible, específico y rápido es la PCR en tiempo real. Las muestras más adecuadas para estudio son los raspados que contengan células de la base de las vesículas. La serología es útil en la identificación de susceptibles a la infección.
El tratamiento precoz de la varicela con aciclovir ha demostrado reducir los síntomas, la duración del cuadro y la severidad de manifestaciones cutáneas y sistémicas. En todo paciente inmunocomprometido y cuadros severos, el tratamiento debe ser endovenoso. El herpes zoster debe ser tratado con valaciclovir, precozmente. En pacientes > 50 años y en cuadros severos se agrega analgesia. Siempre se debe evaluar por especialista y tratar el herpes zoster oftálmico y ótico. En pacientes VIH+ la duración del tratamiento se prolonga hasta que todas las lesiones están resueltas. La inmunoglobulina hiperinmune anti-varicela (IGVZ) está indicada en pacientes con alto riesgo de desarrollar varicela grave que hayan tenido una exposición significativa con una persona que está cursando una varicela o está en período pre-eruptivo (3 días previos). Se debe administrar dentro de las primeras 96hrs después del contacto. La duración de la protección es de 3 semanas. Existe una vacuna a virus atenuado, como profilaxis preexposición. Su uso universal ha mostrado reducción de la morbimortalidad y de las hospitalizaciones por varicela. Hay que considerar que el virus atenuado de la vacuna quedará persistente y que es transmisible. Está contraindicada en inmunocomprometidos (excepto VIH etapa I y pacientes con LLA en etapa de remisión) y embarazadas. La vacuna para prevenir el herpes zoster sólo se diferencia de la vacuna antivaricela en su mayor concentración de partículas virales, dada la menor capacidad de respuesta inmune de los pacientes mayores de 60 años (26-29).
Mano-pie-boca y herpanginaSi bien una variedad de virus que ingresan por boca y replican en el tracto gastrointestinal causan manifestaciones muco-cutáneas, los dos síndromes más característicos son el mano-pie-boca (MPB) y la herpangina, originados principalmente por los virus Coxsackie A.
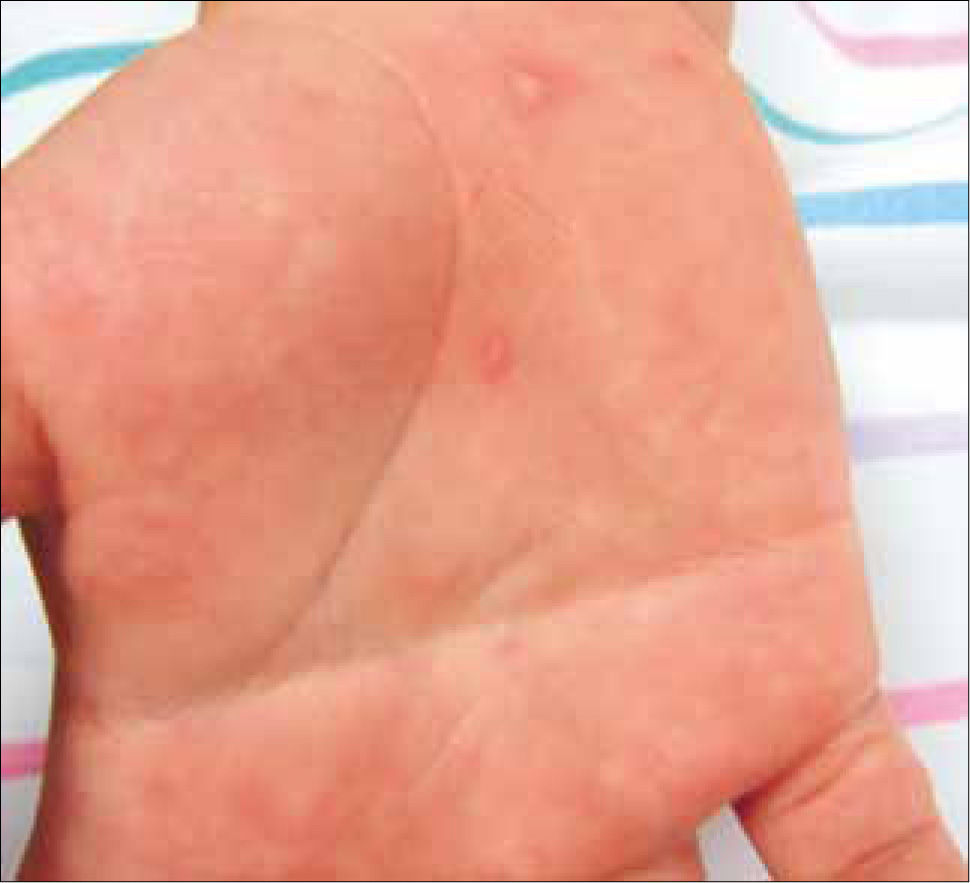
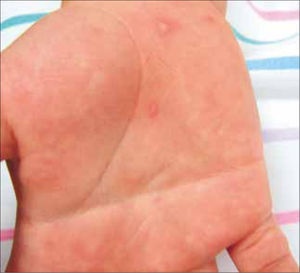
El MPB afecta generalmente a preescolares. Tiene un período de incubación de 3 a 6 días, en los cuales se presenta fiebre baja, malestar general, dolor abdominal o síntomas respiratorios. Doce a 24 horas después se observan lesiones vesiculosas o erosivas en paladar duro, lengua y mucosa bucal, sensibles y con un halo eritematoso. Las vesículas cutáneas aparecen concomitantemente u horas después, principalmente en manos y pies (Figura 3) El cuadro se resuelve en 5 a 10 días.
La herpangina afecta generalmente a niños de 1 a 7 años, tiene igual mecanismo de contagio y comienza en forma brusca con fiebre, odinofagia, disfagia y malestar general. En el paladar posterior, úvula y tonsilas se presentan pequeñas vesículas rodeadas de halo eritematoso, que se erosionan rápidamente. Los síntomas se resuelven en 7 días.
Los virus Coxsackie A pertenecen al género Erteroviridae, de la familia Picornaviridae. Son virus icosaédricos desnudos, de 20 a 30 nm de diámetro, resistentes a condiciones ambientales. El genoma es una hebra de ARN de polaridad positiva, de 7500 nucleótidos. Se diseminan por vía fecal, pero muchos lo hacen por vía aérea la primera semana de la infección, pues se multiplican en la mucosa faríngea. La mayoría de las veces originan infecciones subclínicas, pero pueden asociarse a enfermedades de diversos sistemas: diarreas, erupciones cutáneas, miocarditis, infecciones respiratorias, meningoencefalitis y síndromes febriles puros, entre otras. El diagnóstico generalmente es clínico y en caso de requerir un diagnóstico de laboratorio se puede realizar RT-PCR en tiempo real de muestras tomadas de las lesiones de mucosa. Además, los Enterovirus se pueden detectar en el nasofarinx por 2 semanas y en las deposiciones durante semanas o meses, luego de la infección. No existe un tratamiento antiviral, ni vacuna (30).
La autora declara no tener conflictos de interés, en relación a este artículo.