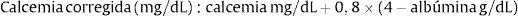Las técnicas de laboratorio de análisis hormonales han experimentado grandes progresos en las últimas décadas, actualmente se pueden realizar determinaciones hormonales con gran precisión y automatización, sin embargo, existen muchos elementos que es necesario tener en consideración al momento de interpretar un examen hormonal. El elegir el examen adecuado para la condición que estamos estudiando, el conocer sus limitaciones y potenciales falsos positivos y negativos es parte del conocimiento que es fundamental tener como clínicos. En este artículo se pretende entregar una breve revisión de las principales determinaciones hormonales, orientado a aspectos que puedan ser de utilidad al médico no especialista en su práctica clínica.
Hormonal assays have achieved great progress in recent decades, currently hormonal tests can be performed with high accuracy and automation, but there are many issues that must be taken into account when we interpretate a hormone test. Choosing the right test for the condition that we are studying, knowing its limitations and potential false positive and negative is part of the knowledge that as clinicians we face. In this article, we give a brief review of the main hormonal determinations oriented to non-specialist physicians considering practical aspects that may be useful in their clinical practice.
El laboratorio clínico en endocrinología tiene un rol crucial, ya que proporciona elementos objetivos que permiten apoyar la apreciación clínica. Prácticamente todos los diagnósticos en la especialidad son establecidos a partir de un cuadro clínico sugerente y elementos bioquímicos compatibles, por lo tanto, el conocimiento de las fortalezas y debilidades de las distintas técnicas de laboratorio permitirán interpretar los resultados de forma certera y así poder establecer diagnósticos y conductas adecuadas con nuestros pacientes.
Las técnicas de laboratorio hormonal han experimentado un gran progreso en las últimas décadas, lo cual ha permitido un desarrollo sostenido de la endocrinología y abre un gran espacio para desarrollar nuevas técnicas, así como perfeccionar las mediciones hormonales existentes.
Hasta el año 1960, los métodos analíticos disponibles eran fundamentalmente de tipo colorimétrico y sólo permitían medir concentración de sustancias en los diferentes líquidos orgánicos del orden de gramos, miligramos y en el mejor de los casos, microgramos (10–6 g). Después se desarrollaron las técnicas de inmunoanálisis, en las que destaca el radioinmunoanálisis (RIA) descrito por Berson y Yallow en 1960 que permitió contar con técnicas para medir en forma rápida, sencilla y confiable concentraciones de sustancias significativamente menores: nanogramos (10–9), picogramos (10–12) y fentogramos (10–15). Con el correr del tiempo, esta metódica que no es sino una técnica de desplazamiento isotópico, se ha ido modificando y así han surgido: la técnica denominada inmunorradiométrica (IRMA), en la cual la sustancia marcada isotópicamente es el anticuerpo, el ensayo inmunoenzimático (ELISA) donde se utiliza enzimas en vez de isótopos como elementos marcadores y el ensayo por quimioluminiscencia, en el que se mide la emisión de ondas luminosas generadas en la reacción. Todas ellas se basan en el principio de desplazamiento siguiendo las leyes de acción de masa y han demostrado ser capaces de determinar concentraciones de sustancias cada vez menores, con alto grado de reproducibilidad y con la incorporación de programas computacionales, ha sido posible su automatización. Esto permite el procesamiento de un gran número de muestras en un tiempo muy breve, no obstante los métodos inicialmente enunciados son necesarios para algunas determinaciones hormonales.
También se utiliza la cromatografía líquida de alta resolución (HPLC), que es el método de elección para medición de catecolaminas y hormonas esteroidales, sin embargo, está disponible solo en algunos centros y posee un elevado costo.
En este artículo se revisarán algunos aspectos prácticos del laboratorio endocrinológico, principalmente orientado a las patologías más frecuentes: estudio tiroideo, hipofisario, suprarrenal y del metabolismo calcio-fósforo.
EJE HIPOTÁLAMO-HIPÓFISIS-TIROIDEOPara una correcta evaluación de la función tiroidea es necesario recordar que esta glándula es parte del eje hipotálamo-hipófisis-tiroides. La biosíntesis y secreción de las hormonas tiroideas se mantienen dentro de márgenes estrechos debido a que los mecanismos que la regulan son muy sensibles a pequeños cambios en las concentraciones de estas hormonas. Cualquier circunstancia que altere este equilibrio, necesariamente provocará un trastorno de toda la unidad funcional.
La célula folicular tiroidea es capaz de sintetizar T3 (triyodotironina) y T4 (tetrayodotironina), siendo este proceso regulado por TSH. A nivel periférico, la T4 es transformada en T3 por enzimas denominadas desyodasas; el proceso de desyodación periférica puede ser alterado en condiciones fisiológicas (feto y ayuno) o patológicas (enfermedades graves, diabetes mellitus descompensada, drogas como corticoides, propiltiuracilo, amiodarona, contrastes yodados, propranolol, etc.), lo que debe ser considerado al interpretar los resultados del laboratorio. La hormona metabólicamente activa es la T3 y ello explica por qué debe producirse la desyodación de T4 a nivel tisular, así T4 es más bien una “prohormona”1,2.
Medición de TSH. Los primeros ensayos RIA permitían medir concentraciones de TSH desde 1μU/mL, por lo cual eran muy útiles para diferenciar un paciente hipotiroideo de un eutiroideo, pero no para el estudio del hipertiroidismo. Con la incorporación de técnicas de segunda (IRMA) y tercera generación (quimioluminiscencia), se ha logrado bajar los límites de detección hasta 0,001μU/mL, por esta razón se los denomina métodos ultrasensibles. De tal forma es posible distinguir también el hipertiroidismo del eutiroidismo con precisión. En condiciones normales, los valores de TSH varían de 0,5 a 4μU/mL; cifras menores de 0,1 son sugerentes de hipertiroidismo y sobre 4,0 se hace el diagnóstico de hipotiroidismo clínico (con T4L baja) o subclínico (con T4L normal). Es importante considerar que el valor normal de TSH aumenta con la edad, en mayores de 80 años el percentil 97 es de 7,5μU/mL, esto es especialmente relevante para el diagnóstico de hipotiroidismo subclínico en el adulto mayor3–5.
Dada la alta precisión que tienen las técnicas actuales para medir TSH, es el examen de elección para tamizaje poblacional. Hay que considerar que la medición de TSH no es útil en pacientes con patología hipofisaria y debe ser interpretada con precaución en pacientes de Unidad de Cuidados Intensivos, en tratamiento con corticoides en dosis altas o con dopamina, los cuales frenan la secreción de TSH6.
Medición de T4 total y T4 libre (T4L). Actualmente se miden por quimioluminiscencia y sus valores normales varían entre 4,5 y 12,5μg/dL y 0,8 a 1,7 ng/dL, respectivamente; estas cifras pueden diferir entre los distintos laboratorios, por lo que es necesario conocer los valores normales para cada centro.
En general la medición de T4 total no es un buen examen de funcionalidad tiroidea, ya que tiene muchas variaciones en el paciente ambulatorio. Especialmente en aquellos individuos que usan medicamentos que alteran los niveles de TBG (thyroxine binding globulin), como es el caso del uso de anticonceptivos orales, terapia hormonal de reemplazo oral para la post menopausia, tamoxifeno, todas las cuales elevan la TBG y darán valores falsamente elevados de T4 total, pudiendo conducir al diagnóstico erróneo de un hipertiroidismo. La medición de TSH y T4L, las cuales no son afectadas por los estrógenos, orientarán en forma más precisa a la condición del paciente3–5.
En la evaluación de la funcionalidad tiroidea en la embarazada es importante tener presente una serie de cambios fisiológicos que alteran la interpretación de los niveles de TSH, T4, T3 y T4L. La TBG aumenta un 50% lo cual eleva las hormonas totales, especialmente en la segunda mitad del embarazo. Por otra parte la T4L disminuye en la segunda mitad del embarazo, por lo que se recomienda su uso solo en la primera mitad y T4 total en la segunda mitad. Los rangos de referencia de T4 total de la mujer no embarazada se multiplican por 1,5 para ajustar a valores de embarazada7.
Múltiples medicamentos influyen tanto en las determinaciones hormonales como en la fisiología tiroidea, hecho que debe ser conocido a fin de no generar una interpretación errónea de los resultados; entre ellos están la fenitoína, ácido salicílico, amiodarona, medios de contraste yodados, glucocorticoides, etc. Todas estas consideraciones han hecho que no se recurra en primera instancia a la medición de T4 total cuando se desea conocer el estado funcional tiroideo. En cuanto a la determinación de la T4 libre, ya se ha mencionado que es mucho más útil que la T4 total y su principal utilidad está en la valoración funcional tiroidea en sujetos con alteración de las proteínas plasmáticas (primera mitad del embarazo, uso de anticonceptivos orales) y en individuos con patología hipofisaria6.
Medición de T3. La medición se hace generalmente por RIA o IRMA y actualmente la utilidad clínica de medir T3 es limitada, lo que no deja de ser un contrasentido si tomamos en cuenta que desde el punto de vista fisiológico es la principal hormona tiroidea metabólicamente activa. Al igual que la T4 total, está sometida a cambios por múltiples factores ajenos a la patología tiroidea. Fisiológicamente está muy disminuida en el recién nacido, en el adulto mayor, por efecto de drogas (amiodarona, medios de contraste yodados) y en cualquier condición clínica grave como el ayuno prolongado, diabetes mellitus descompensada, infarto agudo del miocardio, sepsis de cualquier origen y cirrosis hepática. Si a estos antecedentes agregamos que la sensibilidad y especificidad de T3 para el diagnóstico de hipotiroidismo no es mayor del 50%, es fácil comprender por qué sólo debe solicitarse su medición en situaciones en que se plantea el diagnóstico de un hipertiroidismo subclínico (TSH subnormal con T4L normal) o clínico y para el seguimiento del paciente hipertiroideo tratado con drogas antitiroideas. También podría ser útil para diferenciar un hipertiroidismo gestacional transitorio (T3 estará baja para los valores esperados durante el embarazo) de un hipertiroidismo por enfermedad de Basedow-Graves6,8. (Tabla 1)
Consejos prácticos para el uso clínico de las pruebas funcionales tiroideas
| 1. Para tamizaje (screening) se recomienda solicitar TSH y ocasionalmente T4L. |
| 2. Para el diagnóstico de un hipotiroidismo solicitar TSH y T4L. |
| 3. Para el diagnóstico de un hipertiroidismo solicitar TSH, T4L y T3 total. |
| 4. Un paciente con hipotiroidismo primario en tratamiento con L-tiroxina se controla con TSH y T4L y en hipotiroidismo central solo con T4L (en ambos casos el día del examen no se debe tomar el medicamento). |
| 5. En el seguimiento de un paciente hipertiroideo en tratamiento con drogas antitiroideas solicitar TSH, T4L y T3 total. |
| 6. Para el diagnóstico de hipotiroidismo considerar que los adultos mayores poseen fisiológicamente concentraciones de TSH más altas que la población joven. |
| 7. En embarazadas los valores normales de TSH son <2.5μU/mL en el primer trimestre y <3.0μU/mL en segundo y tercer trimestre. |
Exploración inmunológica. Las alteraciones del sistema inmune constituyen un factor etiopatogénico frecuente en las afecciones tiroideas. Debido a los progresos en los métodos de estudio inmunológico es posible detectar los anticuerpos antimicrosomales (actualmente denominado antiperoxidasa), antitiroglobulina y antirreceptor de TSH, los cuales tienen importancia clínica y pueden ser detectados por métodos de quimioluminiscencia, ELISA, RIA, análisis de radiorreceptores o midiendo la generación de cAMP en cultivo tisular.
Los autoanticuerpos antiperoxidasa (AcTPO) y los antitiroglobulina (AcTg) son considerados marcadores de enfermedad autoinmune del tiroides. El AcTPO es más sensible y específico en el diagnóstico de las tiroiditis autoinmunes (tiroiditis silente, postparto y tiroiditis crónica de Hashimoto). La principal utilidad de los AcTg radica en el seguimiento del paciente con cáncer diferenciado del tiroides, ya que su presencia invalida el resultado de la tiroglobulina sérica, que es una importante herramienta para el seguimiento del cáncer diferenciado de tiroides3,5.
Los autoanticuerpos antirreceptor de TSH (TRAb) constituyen una familia de anticuerpos que tienen la propiedad de ligarse al receptor de TSH, desplazando al TSH endógeno. De acuerdo con su efecto, pueden ser estimulantes o frenadores de la actividad tiroidea. En la enfermedad de Basedow-Graves predominan los efectos estimulantes. Si se determinan por métodos que miden la inhibición de la unión, se los denomina TBII (thyrotropin binding inhibiting immunoglobulins) y los resultados se informan como índice de inhibición o también medirse por ELISA de tercera generación que tiene mucho más sensibilidad y que se expresa en U/L3
La detección de TRAb es útil para la caracterización de un paciente hipertiroideo, pues está presente en un 90% de los pacientes con Basedow-Graves y ausente en los hipertiroidismos de otro origen. Su determinación es necesaria en embarazadas hipertiroideas o con el antecedente de haber tenido un hipertiroidismo tratado con radioyodo, la cual debe realizarse alrededor de la semana 24-26 del embarazo, que es cuando estos anticuerpos atraviesan la barrera placentaria y su presencia podría predecir el desarrollo de hipertiroidismo fetal y neonatal. Su detección podría ser útil también en el seguimiento de pacientes hipertiroideos tratados con drogas antitiroideas, ya que niveles bajos de TRAb podrían ser un factor predictor de remisión de la enfermedad. Otra utilidad es en el diagnóstico diferencial del hipertiroidismo que se presenta en el puerperio, pues su presencia orientaría al diagnóstico de la enfermedad de Basedow-Graves en vez de una tiroiditis postparto7,8.
EJE HIPOTÁLAMO-HIPÓFISIS-ADRENALLas alteraciones del eje hipotálamo-hipófisis-adrenal y en especial el exceso de glucocorticoides endógenos, son patologías que se han hecho cada vez más frecuentes, considerando que el hipercortisolismo puede simular muchos de los cambios fenotípicos productos de la vida moderna, tales como depresión, diabetes mal controlada, alcoholismo activo, síndrome de ovario poliquístico y obesidad mórbida, todos ellos clasificados dentro de lo que se denomina pseudo-Cushing. Si a lo anterior agregamos el uso de nuevas técnicas de imágenes en las cuales se pueden pesquisar tumores hipofisarios y suprarrenales en forma incidental es necesario saber cómo estudiar a un paciente para confirmar o descartar el exceso de glucocorticoides endógenos.
Los glucocorticoides se producen en la zona fascicular de la corteza suprarrenal y su hormona principal es el cortisol. En este capítulo sólo se analizará el estudio funcional pertinente a la producción de glucocorticoides endógenos.
En condiciones normales, existe un fina regulación de la producción de cortisol, comandada por la hormona hipofisaria adrenocorticotropina (ACTH) sobre la corteza suprarrenal. Al aumentar el cortisol se inhibe la producción de CRH (corticotropin-releasing hormone) y ACTH; al disminuir el cortisol, el fenómeno es inverso. Existe un ritmo circadiano del eje, observándose mayores niveles circulantes de cortisol y ACTH en la mañana y una caída de ambos por la tarde y en las primeras horas de la noche.
HipercortisolismoLos niveles de cortisol pueden verse aumentados en ciertas condiciones como el estrés, enfermedades agudas, cirugía mayor, hipoglicemia, síndrome febril entre otros. Las condiciones patológicas que producen hipercortisolismo o síndrome de Cushing, pueden originarse a nivel hipofisario (hiperproducción de ACTH, también llamado enfermedad de Cushing), a nivel suprarrenal (producción autónoma de cortisol) o por tejidos que producen ACTH o sustancias ACTH-símiles (secreción ectópica de ACTH). En todas ellas existe una falla en la regulación normal del eje.
Frente a la sospecha clínica de hipercortisolismo, los objetivos del estudio son confirmar la hiperproducción de cortisol e intentar establecer la causa u origen de éste. Previo a cualquier estudio, hay que preguntar por el uso de corticoides, ya sea oral, inhalado, rectal, tópico o inyectable, con el fin de descartar un hipercortisolismo exógeno. El examen para iniciar el estudio deberá ser altamente sensible y de bajo costo. Muchas veces será necesario recurrir a más de un examen o a otros más específicos. A continuación se revisarán los exámenes más utilizados9.
Determinación de cortisol libre urinario de 24 horas (CLU)Comprende la medición del cortisol libre, no unido a la proteína transportadora llamada Cortisol Binding Globulin (CBG) y por lo tanto, no se afecta su determinación con el uso de los estrógenos orales. El examen consiste en medir la concentración de cortisol en una muestra de orina de 24 horas. Los dos factores más importantes para obtener un resultado válido son la recolección de una muestra completa de 24 horas (medición concomitante de creatininuria) y una técnica de laboratorio confiable. Respecto a los valores esperados de CLU, normalmente no superan los 100μg/día, sin embargo, hay que considerar que puede existir ciclicidad en la secreción de cortisol en ciertos pacientes. Niveles >3-4 veces del valor máximo confirman el hipercortisolismo. Se necesitarán dos valores alterados de CLU para hacer el diagnóstico de hipercortisolismo9–11.
Prueba de frenación con dosis bajas de dexametasona (Test de Nugent)La dexametasona es un esteroide sintético de gran potencia que no es detectado por las técnicas que miden el cortisol plasmático. Cuando existe una producción patológica de cortisol, se pierden los mecanismos finos de control de la secreción y la dexametasona en dosis bajas no es capaz de inhibir el eje hipotálamo-hipófisis suprarrenal. El examen es sencillo y consiste en administrar 1mg de dexametasona por vía oral a las 23 horas y medir el nivel de cortisol plasmático a las 8 AM del día siguiente. En un paciente con un eje normal, se espera un descenso de los niveles de cortisol matinal <1,8μg/dL. Hay que considerar que existen drogas que aumentan el clearance hepático de dexametasona (carbamazepina, fenitoína, fenobarbital o rifampicina) pudiendo dar valores falsos positivos. Otras drogas que interfieren, son los estrógenos orales, los cuales incrementan la CBG, dando valores falsamente elevados de cortisol, por lo que es recomendable suspender los estrógenos orales por un período de 6 semanas. Este examen es considerado de elección para evaluar hipercortisolismo en el contexto de un incidentaloma suprarrenal. Se debe tener precaución con las unidades de medida utilizadas, habitualmente el cortisol plasmático se informa en ug/dL, pero si es informado en nmol/L se debe convertir a ug/dL multiplicando por 0.0369,10.
Cortisol salival nocturnoEs considerado por muchos el mejor examen para definir si existe hipercortisolismo. El cortisol salival está en equilibrio con el cortisol plasmático y el nadir de cortisol nocturno se pierde en pacientes con síndrome de Cushing dando como resultado niveles de cortisol salival nocturno sobre lo normal. Recolectar saliva es sencillo, no invasivo, no requiere hospitalización y es especialmente útil cuando se sospecha síndrome de Cushing cíclico o intermitente. Tampoco es influenciado por el uso de estrógenos orales. Los valores de corte usados para su interpretación varían según los distintos ensayos comerciales. Se acepta que dos mediciones en dos noches consecutivas con valores por sobre el punto de corte del ensayo tiene muy buena especificidad y sensibilidad (92-100%) para confirmar hipercortisolismo; los falsos positivos pueden estar dados por contaminación con sangre, alteración del sueño y fumadores9,10.
En general se recomiendan que dos exámenes de primera línea estén alterados para hacer el diagnóstico de Síndrome de Cushing, idealmente el cortisol salival nocturno y el post dexametasona 1mg9.
Otros exámenes disponible para el estudio de hipercortisolismo son el cortisol plasmático nocturno, ritmo de cortisol, test de frenación con dosis altas de dexametasona fraccionada durante 48 horas (Test de Liddle) u 8mg de dexametasona en dosis única (Test de Tyrrel), pero se utilizan infrecuentemente y en caso de diagnóstico complejo.
Una vez confirmado el hipercortisolismo se debe establecer su origen según los niveles de ACTH. La ACTH se encontrará elevada en origen hipofisario o ectópico y por el contrario muy baja o suprimida cuando es de origen suprarrenal. Es importante señalar que se debe seguir un protocolo riguroso con respecto a la toma de muestra y su conservación en frío, ya que una mala manipulación de ésta puede dar valores falsamente bajos. El resto del estudio de un paciente con hipercortisolismo demostrado debe ser realizado por un endocrinólogo y se escapa de los objetivos de esta revisión.
HipocortisolismoLa falla en la producción de cortisol puede estar determinada por una alteración de la glándula suprarrenal (insuficiencia suprarrenal primaria) o alteración en la secreción de ACTH producto de una lesión hipofisaria (secundaria) o hipotalámica (terciaria). La principal causa de insuficiencia suprarrenal primaria es actualmente la autoinmune (80% de los casos), otras causas son infecciones (tuberculosis, VIH), metástasis, hiperplasia suprarrenal congénita, hemorragias, fármacos inhibidores de la síntesis de cortisol como el ketoconazol. Las causas secundarias y terciarias se deben a tumores del área hipotálamo - hipófisis, post cirugía o radioterapia hipofisaria, apoplejía hipofisaria, que cuando se produce en el posparto se denomina síndrome de Sheehan, craneofaringioma y enfermedades infiltrativas12,13. Es importante mencionar que la ACTH, además de estimular las suprarrenales, tiene un efecto trófico, por lo que niveles de ACTH suprimidos crónicamente, llevan a la atrofia reversible de las suprarrenales (fenómeno observado frecuentemente en pacientes que son tratados con corticoides en dosis elevadas y por tiempo prolongado).
Frente a un paciente en que clínicamente se sospecha hipocortisolismo (astenia, anorexia, baja de peso, hipotensión e hiperpigmentación en insuficiencia suprarrenal primaria), el diagnóstico depende de la demostración de niveles inapropiadamente bajos de cortisol.
Cortisol plasmático matinal 8 AMValores <3μg/dL son altamente sugerentes de insuficiencia suprarrenal y valores >18μg/dL descartan un hipocortisolismo. En general siempre es recomendable confirmar el diagnóstico con el test de estimulación con ACTH, siempre y cuando las condiciones clínicas del paciente lo permitan12,14.
Otros test como el cortisol salival matinal, el ritmo de cortisol y el cortisol libre urinario de 24 horas, no han sido validados como tests para el diagnóstico de hipocortisolismo.
Test de estimulación con ACTHSe realiza con ACTH sintética, permite evaluar la respuesta de las glándulas suprarrenales a ACTH exógena en pacientes con sospecha de hipocortisolismo. Habitualmente se realiza con una dosis estándar de ACTH (250μg de ACTH sintética), se requiere medir cortisol matinal 8 AM, en ayunas y 30 o 60 minutos después de la administración de ACTH iv. Un valor estimulado de cortisol >18μg/dL descarta el diagnóstico de hipocortisolismo12,14. El test de dosis alta es útil en la insuficiencia primaria y en la secundaria, siempre y cuando el daño hipofisario lleve más de tres meses (tiempo requerido para que las glándulas suprarrenales se atrofien y dejen de responder en forma aguda a la inyección de ACTH). En general, la diferenciación entre insuficiencia suprarrenal primaria y secundaria puede hacerse con una buena anamnesis y un cuidadoso examen físico. La medición de ACTH plasmático es el mejor examen disponible en este momento para establecer el origen de la insuficiencia suprarrenal. Los pacientes con una falla suprarrenal primaria presentan altos niveles de ACTH (>100 pg/mL), por el contrario los pacientes con insuficiencia suprarrenal secundaria o terciaria no presentan niveles elevados de ACTH ni compromiso del eje mineralocorticoideo y se acompaña en general de déficit de otras hormonas hipofisarias (hipopituitarismo)13. (Tabla 2)
Consejos prácticos para el diagnóstico de hipo e hipercortisolismo
| 1. Antes de cualquier estudio de hiper o hipocortisolismo descartar uso de corticoides exógenos. |
| 2. Los exámenes de elección frente a la sospecha de exceso de cortisol son: cortisol post dexametasona 1mg nocturno, cortisol libre urinario 24 horas y cortisol salival nocturno |
| 3. El examen que mejor discrimina el origen del síndrome de Cushing es la determinación de ACTH plasmática. |
| 4. En usuarias de anticonceptivos orales el examen de elección es el cortisol salival nocturno. |
| 5. El examen de elección frente a sospecha de déficit de cortisol es el test de estimulación con ACTH sintética. |
| 6. En el estudio de un incidentaloma suprarrenal, el examen de elección para descartar hipercortisolismo es el test de frenación con dexametasona 1mg nocturno (test de Nugent). |
La evaluación del eje gonadal principalmente se refiere al estudio del paciente con hipogonadismo, masculino o femenino.
Hipogonadismo masculinoEl hipogonadismo masculino puede deberse a un desorden testicular primario, en el cual habrán niveles de testosterona bajos, asociado a gonadotrofinas elevadas (LH y FSH) y espermatogénesis disminuida (hipogonadismo primario) o a un desorden a nivel hipofisario o hipotalámico (hipogonadismo secundario y terciario respectivamente) en el cual tendremos gonadotrofinas bajas o inapropiadamente normales para niveles disminuidos de testosterona.
Al evaluar los niveles de testosterona es necesario recordar que su secreción sigue un ritmo circadiano, siempre debe medirse en la mañana, un valor bajo de testosterona debe ser siempre confirmado por una segunda muestra. El gold standard para la determinación de testosterona total es la espectometría de masa, existiendo una buena correlación con los inmunoensayos, lo que no ocurre con la determinación de testosterona libre15,16.
En general valores de testosterona <250 ng/dL se consideran categóricos de hipogonadismo y valores >350-400 ng/dL lo descartan; en situaciones intermedias se recomienda la medición concomitante de SHBG (sex hormone binding globulin) para calcular la testosterona libre, ya que es mucho más confiable calcularla que medirla directamente con las técnicas disponibles. Existen calculadoras especiales para hacer el cálculo o se puede hacer en internet (www.issam.ch). La testosterona libre (no unida a SHBG o albúmina) corresponde al 0.5-3% de la testosterona circulante (valor normal >6.4 ng/dL) y se eleva cuando existen algunas condiciones que disminuyen la concentración de SHBG (obesidad, hipotiroidismo, síndrome nefrótico) así como disminuye en condiciones que aumentan la SHBG (VIH, cirrosis hepática, hipertiroidismo, uso de anticonvulsivantes). Siempre se debe poner atención a las unidades de medida en que se informa la testosterona, si se necesita hacer la conversión de nmol/L a ng/mL se debe multiplicar por 0.2815,16.
Hipogonadismo femeninoEl hipogonadismo femenino se manifiesta por alteraciones del ciclo menstrual y deficiencia de estrógenos. Su origen puede estar en el ovario o a nivel hipofisario o hipotalámico. El estudio hormonal mostrará niveles bajos de estradiol (bajo los rangos normales de la fase folicular del test utilizado) y niveles de gonadotrofinas (FSH y LH) elevados en el caso de falla ovárica y bajos o inapropiadamente normales en el caso de desórdenes hipotalámicos o hipofisarios, en esta última situación siempre se deben evaluar los otros ejes hipofisarios y descartar hiperprolactinemia17. Ante la gran mayoría de injurias hipofisarias uno de los primeros ejes en afectarse es el eje gonadal, por lo que en mujeres postmenopáusicas un valor de FSH elevado puede ser utilizado como marcador de indemnidad hipofisaria.
Otra hormona que es de utilidad en el hipogonadismo femenino es la determinación de la Hormona Antimülleriana (AMH), la que es secretada por células de la granulosa en folículos preantrales y antrales pequeños. La determinación de AMH evalúa la reserva ovárica permitiendo identificar la transición del estado de ovulación normal a la falla ovárica, siendo de utilidad para toma de decisiones en pacientes con infertilidad y sometidas a terapias con quimioterápicos que pueden provocar daño gonadal. Se puede obtener una muestra en cualquier momento del ciclo menstrual18. (Tabla 3).
Consejos prácticos para la evaluación del eje gonadal
| 1. Los niveles de gonadotrofinas (FSH y LH) son cruciales para evaluar el nivel del defecto en el estudio de hipogonadismo masculino o femenino. |
| 2. En la interpretación de los valores de testosterona poner especial atención a las unidades de medida en que se informa el examen (de nmol/L a ng/mL multiplicar por 0.28.) |
| 3. Siempre ante un valor anormal de testosterona total, confirmar con una segunda muestra. |
| 4. Ante valores intermedios de testosterona total o patologías que alteren los niveles de SHBG, medir concomitantemente testosterona total y SHBG y calcular la testosterona libre (no se recomienda medirla directamente). |
| 5. Ante el diagnóstico de hipogonadismo central siempre evaluar los otros ejes hipofisarios, incluyendo la medición de prolactina y estudiar con imágenes de silla turca. |
| 6. En la mujer postmenopaúsica un valor elevado de FSH puede ser utilizado como marcador de indemnidad hipofisiaria. |
| 7. La AMH es un buen indicador de reserva ovárica. |
Déficit de hormona de crecimiento (GH). El déficit de GH puede ser aislado o presentarse junto a insuficiencia de otros ejes hipofisarios, siendo esto último lo más frecuente ya que frente a injurias hipofisarias las células somatotropas y gonadotropas son las más lábiles.
El déficit de GH es particularmente importante en la edad pediátrica debido al rol crucial que cumple la GH en el crecimiento lineal y en la edad adulta su déficit se ha relacionado con alteraciones metabólicas y a nivel de densidad mineral ósea.
La GH se secreta en forma variable durante el día por lo que su medición en condiciones basales no es de utilidad cuando se sospecha deficiencia.
El tamizaje ante la sospecha se realiza con IGF-1 (Factor de crecimiento sintetizado a nivel hepático y dependiente de GH), que debe ser interpretada de acuerdo a los valores normales para edad y sexo, siendo necesario en la mayoría de los casos realizar un test de estimulación para confirmar el diagnóstico. Al momento de interpretar los valores de IGF-1 se debe considerar el estado nutricional y el estado de la función hepática, ya que el deterioro de ésta pueden resultar en niveles falsamente bajos19,20.
En el adulto los niveles de IGF-1 por sí solos no son de utilidad para realizar el diagnóstico de déficit de GH, a no ser que se encuentre en el contexto de un hipopituitarismo, por lo que es necesario realizar test de estimulación, el gold standard es el test de Tolerancia a la insulina (se fundamenta en la provocación de hipoglicemia para inducir la secreción de GH), otras alternativas son el test de GHRH-arginina y el test de glucagón, ninguno de los cuales se encuentra disponible en Chile19,20.
Exceso de GH o acromegaliaCorresponde al exceso de GH en edad adulta cuya etiología en la gran mayoría de los casos es la presencia de un tumor hipofisario productor de GH. Ante la sospecha clínica se debe medir IGF-1 e interpretar el resultado según los valores normales para edad y sexo. Si la medición de IGF-1 resulta elevada se debe realizar un test de frenación de GH con glucosa oral, midiendo GH y glicemia basal y 30, 60, 90 y 120 minutos posterior a la administración de 75 grs de glucosa oral. El nadir de GH debe ser menor a 1 ng/mL en cualquiera de los puntos para descartar acromegalia.
Es importante al momento de evaluar los valores de IGF-1 considerar que la desnutrición, uso de estrógenos orales, diabetes mellitus descompensada e insuficiencia hepática pueden dar valores falsamente bajos21,22, (Tabla 4).
Consejos prácticos para el diagnóstico de déficit y exceso de GH
| 1. El estudio inicial se realiza con IGF-1, siempre teniendo en cuenta el valor normal para edad y sexo. |
| 2. El uso de anticonceptivos orales, insuficiencia hepática, diabetes mellitus descompensada y desnutrición pueden dar valores de IGF-1 falsamente bajos. |
| 3. En caso de déficit de más de 3 ejes hipofisiarios un nivel de IGF-1 bajo es suficiente para establecer el diagnóstico de déficit de hormona del crecimiento, en todos los otros casos se debe realizar test de estimulación. |
| 4. Ante sospecha de acromegalia y niveles de IGF-1 elevados se debe proceder a realizar test de frenación de GH con glucosa (TTGO). |
El exceso de secreción de prolactina es una causa importante de galactorrea, irregularidad menstrual e infertilidad en mujeres y de hipogonadismo en hombres.
Su secreción se encuentra tónicamente inhibida, existiendo muchas condiciones fisiológicas que pueden aumentar la concentración de prolactina, como el embarazo, drogas anti-psicóticas, enfermedades renales y hepáticas, así como otros trastornos endocrinológicos (hipotiroidismo, acromegalia), los cuales hay que considerar al momento de evaluar un paciente con hiperprolactinemia23–25.
Una vez descartadas las causas anteriores, el estudio debe dirigirse a la búsqueda de tumores hipofisarios, tanto productores de prolactina (micro o macroprolactinomas) como tumores hipofisarios no funcionantes que por compresión a nivel del tallo hipofisario pueden producir elevación de sus niveles (rara vez mayor de 150-200 ng/mL)24.
Uno de los elementos a tener en consideración cuando se evalúa un paciente con sospecha de hiperprolactinemia es el “efecto hook”, este se produce ante niveles muy elevados de prolactina que saturan los anticuerpos del inmunoensayo, informando niveles falsamente bajos pudiendo provocar confusión entre el diagnóstico de adenomas no funcionante y prolactinoma; para evitar esto se debe solicitar la prolactina diluida 1:100, principalmente en presencia de macroadenomas25,26.
Otra causa de discordancia entre la clínica y el laboratorio es la presencia de macroprolactina. Dentro de las isoformas circulantes de prolactina existen la monomérica (la más frecuente), dimérica y la macroprolactina, que es básicamente el complejo formado por prolactina e IgG, que tiene baja actividad biológica y que corresponde al 5% de todas las formas de prolactina circulante, sin embargo en pacientes con hiperprolactinemia puede ser la forma circulante predominante. Para determinar su presencia es necesario medir la recuperación de prolactina después de la precipitación con polietilenglicol, lo cual nos evita realizar estudios innecesarios en pacientes con macroprolactinemia27,28 (Tabla 5).
Consejos prácticos para el diagnóstico de hiperprolactinemia
| 1. Ante la presencia de prolactina elevada siempre descartar embarazo, hipotiroidismo, medicamentos, insuficiencia renal y hepática y causas fisiológicas de hiperprolactinemia |
| 2. Ante la presencia de hiperprolactinemia y ausencia de síntomas y signos característicos sospechar la presencia de macroprolactinemia y solicitar su determinación a través de la precipitación con polietilenglicol. |
| 3. Ante la presencia de macroadenomas hipofisiarios solicitar prolactina diluida 1:100 |
Frente a la necesidad de estudiar un cuadro de hipertensión arterial secundaria a alguna causa endocrina, es necesario descartar el hiperaldosteronismo primario que consiste en la producción autónoma de aldosterona independiente de la estimulación de angiotensina II29.
Las guías de la Endocrine Society recomiendan hacer screening en:
- 1)
Hipertensos moderado o severos o con hipertensión resistente.
- 2)
Hipertensos con hipocalemia espontánea o inducida por diuréticos.
- 3)
Hipertensión asociada al hallazgo de incidentaloma suprarrenal.
- 4)
Hipertensión en el contexto de historia familiar de hipertensión o accidente cerebro vascular30.
El diagnóstico de hiperaldosteronismo primario se hará al demostrar un exceso relativo de aldosterona y confirmando su producción anormal usando test de supresión. La relación aldosterona/actividad renina plasmática es el examen de elección para iniciar el estudio. La producción de aldosterona en exceso y en forma autónoma del eje renina–angiotensina asociado a una actividad renina plasmática baja o frenada es lo característico.
Se recomienda la medición de aldosterona y actividad renina plasmática en ayunas, entre 8 y 10 AM, luego de 30 minutos de reposo. Se considera una relación aldosterona/actividad renina plasmática sospechosa cuando es mayor de 25 (con aldosterona mayor a 15 ng/dL.) Cuando la actividad renina plasmática está suprimida se recomienda usar un valor de 0,3 ng/mL/h. para realizar el cálculo.
Es prioritario corregir los niveles de potasio ya que la hipocalemia reduce la secreción de aldosterona, mantener una dieta libre en sodio y evitar fármacos que alteren la medición de aldosterona y de renina plasmática. Se recomienda la suspensión al menos seis semanas antes de fármacos antihipertensivos como los antagonistas del receptor de mineralocorticoides (espironolactona, epleronona) e inhibidores de renina; los inhibidores de enzima convertidora, antagonistas receptor de angiotensina y diuréticos no ahorradores de potasio pueden determinar niveles de actividad renina plasmática falsamente elevadas, estos últimos no necesariamente deben ser suspendidos ya que si a pesar de estar usando estos fármacos la actividad renina plasmática es baja es altamente sospechoso de un hiperaldosteronismo primario. En cambio es posible usar otros antihipertensivos como verapamilo, hidralazina, prazosina y doxazosina31,32.
Cuando la relación aldosterona/actividad renina plasmática es mayor a 25 se pueden realizar exámenes confirmatorios como test de sobrecarga salina, test de fludrocortisona o prueba de captopril30,33.
Dehidroepiandrosterona sulfato (DHEAS)Al evaluar la producción de andrógenos, debemos conocer que el ovario además de testosterona secreta otros andrógenos como dehidroepiandrosterona (DHEA) y androstenediona, y la glándula suprarrenal secreta testosterona junto a androstenediona, DHEAS y DHEA.
En la mujer la DHEAS es el andrógeno más abundante en la circulación, presenta una declinación fisiológica con la edad y se origina exclusivamente en las suprarrenales y es por esta razón que es útil como marcador de hiperandrogenismo de causa adrenal. En general los tumores suprarrenales se asocian a aumento de DHEAS.
Si el nivel de DHEAS es >700μg/dL debe sospecharse el origen tumoral adrenal, niveles levemente elevados pueden verse en hiperandrogenismo funcional ovárico e hiperplasia suprarrenal congénita. Por el contrario niveles disminuidos de DHEAS pueden ser de utilidad en el diagnóstico de insuficiencia suprarrenal primaria34.
17OH progesterona (17OHP)La producción de cortisol en la zona fasciculata de la corteza suprarrenal esta mediado por 5 enzimas, cuando existe deficiencia de algunas de estas enzimas se desarrolla una disminución en la síntesis de cortisol que induce un aumento crónico de ACTH y sobreestimulación de la corteza generando hiperplasia. Cada defecto enzimático produce distintos perfiles hormonales y clínicos.
La deficiencia de 21 hidroxilasa y 11 beta hidroxilasa se manifiestan con exceso de andrógenos asociado a déficit de cortisol35.
El déficit de 21 hidroxilasa (21-OH) es la causa más frecuente de hiperplasia suprarrenal y representa entre el 90 y el 95% de los casos, se produce por mutaciones inactivantes en el gen de 21 hidroxilasa (CYP21A2). Este déficit determina un aumento variable de 17OHP36.
La 17OHP se debe determinar durante la fase folicular donde su valor normal es <2 ng/mL. Valores sobre 10 ng/dL son diagnósticos de hiperplasia suprarrenal. Cuando tenemos valores intermedios se debe realizar un test de estimulación con ACTH, valores sobre 10 ng/mL a los 60min confirman el diagnóstico. Luego se puede realizar el test genético para determinar la lesión molecular específica.
CatecolaminasEl diagnóstico de feocromocitomas y paragangliomas es de suma importancia en la evaluación de un paciente con hipertensión secundaria así como en el estudio de incidentalomas suprarrenales. Son tumores muy poco frecuentes en la práctica clínica pero pueden asociarse a complicaciones cardiovasculares potencialmente letales.
Feocromocitoma es un tumor que se origina en las células cromafines de la médula suprarrenal y que habitualmente produce una o más catecolaminas (epinefrina, norepinefrina, dopamina), los paragangliomas son tumores derivados de células cromafines extradrenales y de los ganglios simpáticos paravertebrales de tórax, abdomen y pelvis. Los paragangliomas de cabeza y cuello generalmente no producen cantidad significativa de catecolaminas.
El tamizaje de feocromocitoma está indicado frente al hallazgo de un incidentaloma suprarrenal, pacientes con predisposición hereditaria y aquellos con sospecha clínica: paroxismos de cefalea, sudoración, taquicardia, palidez, náuseas e hipertensión.
El estudio bioquímico incluye el análisis de metanefrinas que son metabolitos de catecolaminas. El examen de elección es la medición de metanefrinas urinarias fraccionadas (sensibilidad de 97%) o metanefrinas plasmáticas libres con una sensibilidad de 99% (aún no disponibles en Chile) que poseen un mejor rendimiento que la medición de catecolaminas plasmáticas, urinarias o ácido vanililmandélico37.
Pese a la alta sensibilidad diagnóstica de metanefrinas urinarias fraccionadas los falsos positivos se describen entre un 19 a 21%. Incrementos de 3 veces sobre el valor normal es muy improbable que sea un falso positivo38.
Las condiciones de la toma de muestra es importante para evitar falsos positivos o negativos en la evaluación de metanefrinas (siempre medir creatininuria de 24h). Evitar el uso de fármacos simpático miméticos como efedrina, anfetamina, nicotina. Evitar fármacos como labetalol, acetaminofeno, metildopa, antidepresivos tricíclicos, inhibidores de la MAO, teofilinas, hidralazina y minoxidil. Evitar consumo de café, alcohol, bebidas cola, chocolates, tomates, palta, queso, nueces39.
METABOLISMO CALCIO - FÓSFOROEl calcio es esencial para la formación de hueso y función neuromuscular. La mitad del calcio plasmático se encuentra ionizado y el resto unido a complejos principalmente albumina. Los cambios en albúmina plasmática pueden modificar concentraciones de calcio total pero no el calcio iónico. Es por esto que en condiciones de hipoalbuminemia se recomienda ajustar calcemia según la albúmina:
Medir calcio iónico resulta útil en pacientes en diálisis, embarazadas, con transfusiones múltiples o sometidas a circulación extracorpórea40.
El metabolismo del calcio se encuentra regulado por la hormona paratiroidea (PTH) y vitamina D.
La medición de PTH aún es compleja, debido a que aparte de su forma activa (PTH 1–84) existen muchos otros fragmentos circulantes, especialmente en pacientes con falla renal crónica. Los ensayos más ampliamente disponibles corresponden a los de 2° generación (“PTH intacta”) y reconocen en forma variable estos fragmentos de PTH. Los ensayos de tercera generación no los reconocen, pero no están ampliamente disponibles41.
La vitamina D activa (1,25OH vitamina D) aumenta el calcio plasmático estimulando la absorción intestinal de calcio, en riñón aumenta reabsorción de calcio y fosfato en túbulo proximal y en paratiroides inhibe síntesis y secreción de PTH. En hueso activa al osteoblasto y el depósito de matriz ósea.
La 1,25OH vitamina D tiene una vida media muy corta y es difícil su determinación para uso clínico, pero en cambio la 25OH vitamina D es una pro hormona, no es activa, pero dado a que tiene una vida media larga es posible medirla y sirve como marcador de suficiencia de niveles de vitamina D. Se considera deficiencia de vitamina D <20 ng/mL y normal >30ng/mL42, (Tabla 6).
Consejos prácticos para el diagnóstico de trastornos del calcio
| 1. Ante la presencia de hipercalcemia confirmada siempre evaluar niveles de PTH. |
| 2. El hiperparatiroidismo primario y tumores malignos son las principales causas de hipercalcemia. |
| 3. Ante hipercalcemia con niveles de PTH elevados o inadecuadamente elevados se debe sospechar hiperparatiroidismo primario. |
| 4. En caso de hipocalcemia siempre evaluar niveles de vitamina D. |
| 5. En hipocalcemia siempre descartar la presencia de fármacos, uso de corticoides, bifosfonatos, denosumab, diuréticos, medios de contraste, entre otros. |
Ref.40,43.
* Los autores declaran no tener conflictos de interés, en relación a este artículo.