El principal objetivo de la microbiología clínica es identificar el agente etiológico de una infección y determinar la susceptibilidad a determinados antimicrobianos. Para obtener los mejores resultados clínicos, es necesario tener asociaciones sólidas entre el médico tratante y el especialista técnico de laboratorio, fomentando una comunicación abierta.
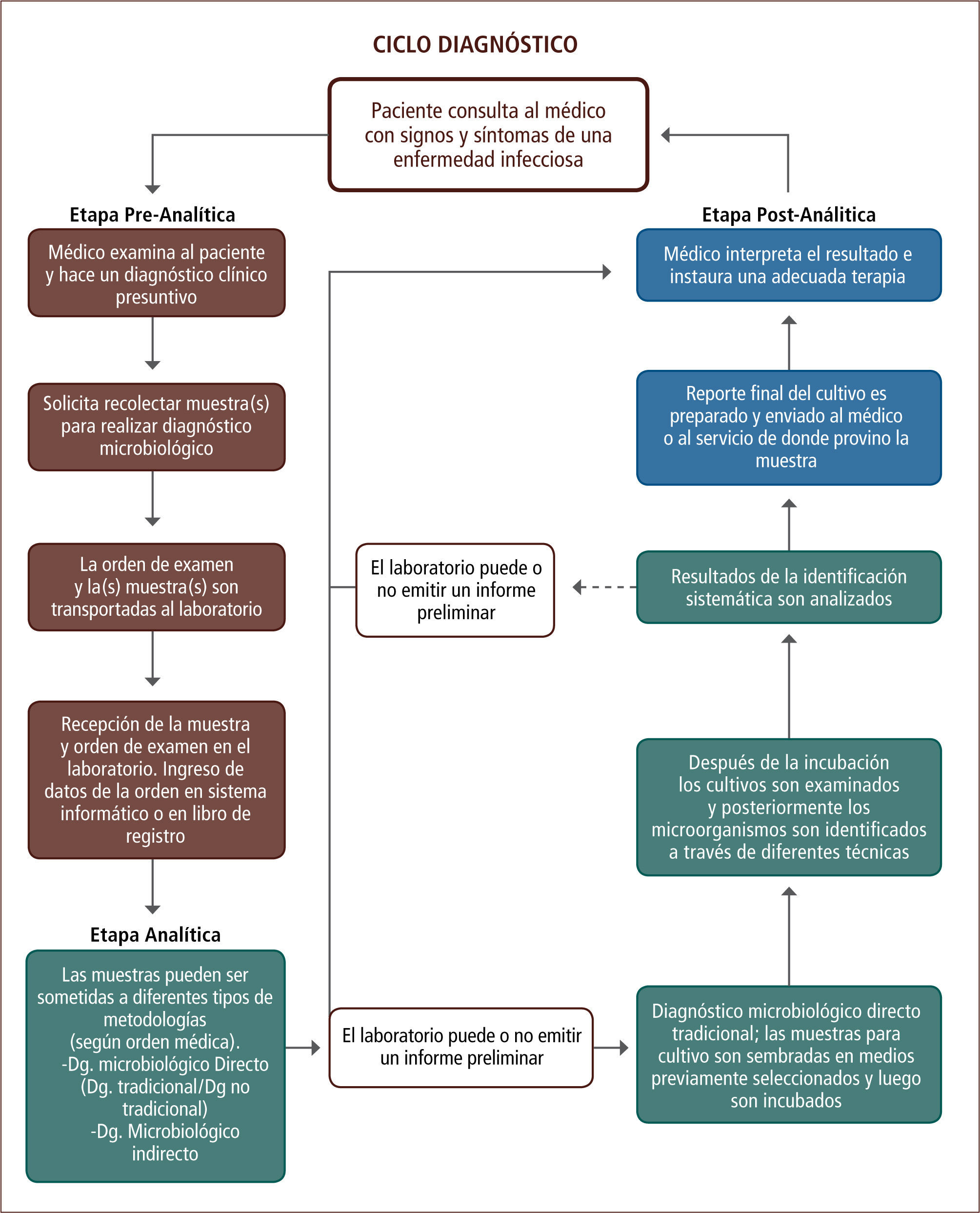
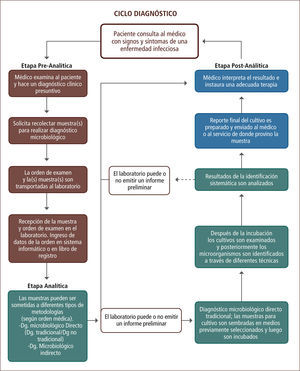
El ciclo diagnóstico de una enfermedad infecciosa inicia con una etapa pre-analítica, en la cual el médico tratante realiza un diagnóstico presuntivo y solicita la recolección de una muestra para realizar un diagnóstico microbiológico. Esta etapa es crítica para obtener resultados válidos. Una vez recibida la muestra en el laboratorio, comienza la etapa analítica o de diagnóstico microbiológico, en la cual la muestra es procesada mediante diferentes metodologías, obteniéndose un resultado final. Luego, en la etapa post-analítica, se prepara un informe con el resultado final que es enviado al médico o al servicio de donde provino dicha muestra.
The main objective of clinical microbiology is to identify the etiologic agent of an infection and determine the susceptibility to certain antibiotics. For best clinical outcomes, it is necessary to have a close communication between the treating physician and the laboratory technical specialist.
The diagnosis of an infectious disease begins with a pre-analytical phase, in which the treating physician, does a presumptive diagnosis and requests the collection of a sample for microbiological diagnosis. The quality of the sample is critical to obtain a reliable and valid result. The microbiological analytical phase begins with the reception of the sample at the laboratory, in which the sample is processed through different methodologies. After this phase comes the post-analytical phase, in which a report with the final result is sent to the doctor or service where that specimen came from.
La microbiología clínica es una ciencia de juicio interpretativo que responde a las necesidades clínicas del médico tratante, con el fin de identificar el agente etiológico de una infección y establecer la actividad in vitro de las drogas antimicrobianas contra el (los) microorganismo (s) identificado (s). Para maximizar el valor clínico de las pruebas diagnósticas microbiológicas, es crucial que exista una estrecha colaboración entre el médico tratante, la enfermera y el laboratorio de microbiología, para lo cual, es necesario que los médicos tratantes confíen en los resultados que entrega el laboratorio de microbiología y así mismo el laboratorio, debe garantizar resultados exactos, significativos y clínicamente relevantes (1–4). Una de las funciones principales del laboratorio de microbiología es garantizar un rápido resultado al clínico, que contribuya a la toma de decisiones en aquellas situaciones que así lo requieran. Para ello, la gran mayoría de los labora torios, utilizan un sistema informático de fácil acceso al clínico, en el que pueda realizar un seguimiento a la muestra. Estos sistemas generalmente documentan el ingreso de la muestra al laboratorio, registran las pruebas en progreso y arrojan reportes preliminares, así como el resultado final (4). Otras funciones esenciales del laboratorio y del médico microbiólogo son: coordinar el aviso telefónico de un resultado crítico al médico tratante o al personal del equipo médico que esté a cargo del paciente en ese momento; desarrollar guías de reporte de resultados de susceptibilidad antimicrobiana en conjunto con el personal médico; y publicar periódicamente los patrones de susceptibilidad antimicrobiano, para ser usados como guía en el tratamiento empírico (2–4).
La interpretación de los resultados obtenidos en el laboratorio de microbiología depende de la calidad de las muestras recibidas, siendo el manejo previo a su recepción en el laboratorio, crítico para la exactitud de los resultados. Esto se debe a que los microorganismos pueden crecer, multiplicarse o morir rápidamente cuando existe una indebida recolección, transporte y conservación de la muestra. Un manejo inadecuado de la muestra puede producir resultados erróneos, los que afectan directamente la salud del paciente e influencian las decisiones terapéuticas. Como consecuencia, habrá un impacto en el tratamiento y control de las infecciones, en la duración de la hospitalización, en los costos hospitalario y en los costos y rendimiento del laboratorio. Por este motivo, los médicos tratantes son los responsables de la selección de la muestra y su recolección, aunque pueden comunicarse con el microbiólogo clínico para su asistencia o consulta. El clínico debe entregar toda la información necesaria para que el microbiólogo haga una correcta interpretación del resultado. Así mismo, debe tener los conocimientos para priorizar la prueba diagnóstica que solicitará en caso de obtener una escasa cantidad de muestra. En esta situación, el médico tratante puede discutir con el director técnico del laboratorio y con el microbiólogo las modificaciones en algunas prácticas realizadas de rutina en el laboratorio, para optimizar el procesamiento de la muestra (3, 4).
Los mejores resultados para los pacientes derivan de las asociaciones sólidas entre el médico tratante y el especialista técnico del laboratorio. Se debe fomentar una comunicación clara y cercana entre médicos, enfermeras y personal del laboratorio (3). Es crucial que el clínico se contacte con el director de su laboratorio y con el médico microbiólogo en las siguientes situaciones: cuando considere que el tiempo de respuesta no contribuye a la toma de decisiones; cuando las políticas del laboratorio causen problemas en la salud del paciente; cuando los resultados sean inconsistentes con la presentación clínica del paciente o; cuando sienta la necesidad de incorporar nuevas pruebas al laboratorio (4).
La siguiente revisión describe brevemente las etapas del ciclo diagnóstico de una enfermedad infecciosa, desde la sospecha clínica hasta la identificación del agente etiológico que causa la infección (figura 1), detallando las pruebas relevantes para el diagnóstico microbiológico, con el fin de dar a conocer al clínico una visión general de las pruebas diagnósticas y de la labor realizada por el laboratorio de microbiología.
Etapa pre-analítica: selección, recolección y transporte de la muestraPara obtener resultados que avalen el diagnóstico de enfermedades infecciosas, es esencial realizar una apropiada recolección y manipulación de la muestra (3, 5–7). Por este motivo las recomendaciones descritas en el manual de toma de muestras del laboratorio del lugar donde trabaja el clínico, deben tenerse presentes y cumplirse cabalmente. El manual de toma de muestras debe estar actualizado en base a las últimas evidencias disponibles (3, 6, 7) y debe detallar:
- I)
El tipo de muestra apropiado para cada caso.
- II)
La forma de recolección de la muestra.
- III)
Las condiciones de transporte hacia el laboratorio (tiempo de transporte ideal, tipo de envase para la recolección de la muestra y temperatura de transporte).
- IV)
Conservación de la muestra.
- V)
Las políticas del laboratorio (por ejemplo: número de muestras que pueden ser sometidas a una determinada prueba y el tiempo de respuesta de cada una).
Idealmente este manual debe estar disponible en el sistema informático de la institución, junto con el menú de pruebas que ofrece el laboratorio de microbiología (4). En todo momento el personal de microbiología puede asistir al equipo médico que lo requiera, para asegurar una buena calidad de la muestra (3, 5).
Las muestras enviadas al laboratorio de microbiología deben ser idealmente obtenidas en el período donde haya mayor excreción del agente infeccioso, desde un sitio representativo de la infección y en una cantidad suficiente que garantice su buen procesamiento en el laboratorio, usando técnicas apropiadas que eviten la contaminación. Se debe procurar obtener la muestra antes de instaurar una terapia antimicrobiana o bien antes de introducir cualquier modificación del tratamiento antimicrobiano, debido a que disminuye el rendimiento de la prueba (3, 5, 7).
Por otro lado, los sistemas de recolección utilizados deben ser estériles, herméticos y apropiados al tipo y volumen de muestra que se desea obtener (3, 5, 7). Las torundas o hisopos de Dracon rayon o algodón, no son un buen método para recolectar una muestra, debido a que recolectan microorganismos contaminantes, mantienen un volumen de muestra extremadamente pequeño (0,05mL), sus fibras dificultan la recolección de bacterias u hongos y el inóculo de la torunda a menudo no es uniforme cuando es sembrada en diferentes placas de agar. Es por este motivo que se utilizan principalmente para la recolección de muestras nasofaríngeas. Actualmente existen las torundas flocadas, las cuales han mostrado ser más efectivas que los otros tipos de torundas, debido a que sus fibras de nylon perpendiculares mantienen un campo electrostático que crea una delgada capa altamente absorbente, con una estructura abierta que permite mantener la muestra cercana a la superficie, para una completa y rápida elución de la muestra. Son utilizadas principalmente para recolectar muestras que son analizadas por metodologías basadas en ácido nucleico (2, 3, 8, 9).
Las condiciones de transporte de las muestras deben ser mantenidas cuidadosamente, desde su recolección hasta su recepción en el laboratorio, ya que permiten mantener su integridad. Éstas deben llegar rotuladas perfectamente y con la información completa, idealmente con una etiqueta adherida al envase, conteniendo los mismos datos de la orden de examen. Se deben incluir en la orden o solicitud de examen, todos aquellos datos del paciente, que permitan elegir el mejor procedimiento para el aislamiento del patógeno. Algunos de estos datos son:
- I)
Antecedentes personales del paciente.
- II)
Diagnóstico presuntivo.
- III)
Sitio específico de recolección y tipo de muestra.
- IV)
Administración previa de antimicrobianos.
- V)
Datos de médico tratante.
- VI)
Alerta en caso de sospecha de un microorganismo altamente patogénico (por ejemplo: Neisseria meningitidis) (2–5, 7).
Una vez recibida la muestra en el laboratorio, el personal verifica su adecuada calidad, el correcto transporte y una completa y concordante rotulación entre el sistema de recolección y la orden de examen. De acuerdo a las políticas establecidas por cada laboratorio, se puede rechazar una muestra si no cumple con los requisitos previamente establecidos en el manual de toma de muestra; debiendo notificar al servicio que la envió o al personal responsable (3, 10, 11). Cuando cumple con todos los requisitos establecidos, se registra en el sistema informático o libro de registro, iniciándose así la etapa analítica. Esta etapa de diagnóstico microbiológico puede ser abordada con diversas estrategias, ya sea realizando una detección directa del agente etiológico a través del diagnóstico microbiológico directo o mediante el diagnóstico microbiológico indirecto, en el cual se detecta la respuesta inmune generada por un microorganismo en el hospedero (2, 11).
1Diagnóstico microbiológico directoEl diagnóstico microbiológico directo permite evidenciar directamente el microorganismo o parte de su estructura en una muestra. Cuando el agente patógeno es recuperado completamente en una muestra a través del cultivo (diagnóstico directo tradicional), es posible caracterizarlo y conocer su susceptibilidad antimicrobiana. Sin embargo, en determinadas ocasiones los microorganismos no son recuperados desde un cultivo o presentan un crecimiento muy lento; en estos casos se utilizan metodologías aplicadas directamente a la muestra (diagnóstico no tradicional), tales como pruebas inmunológicas o pruebas basadas en ácidos nucleicos (2, 4, 11, 12).
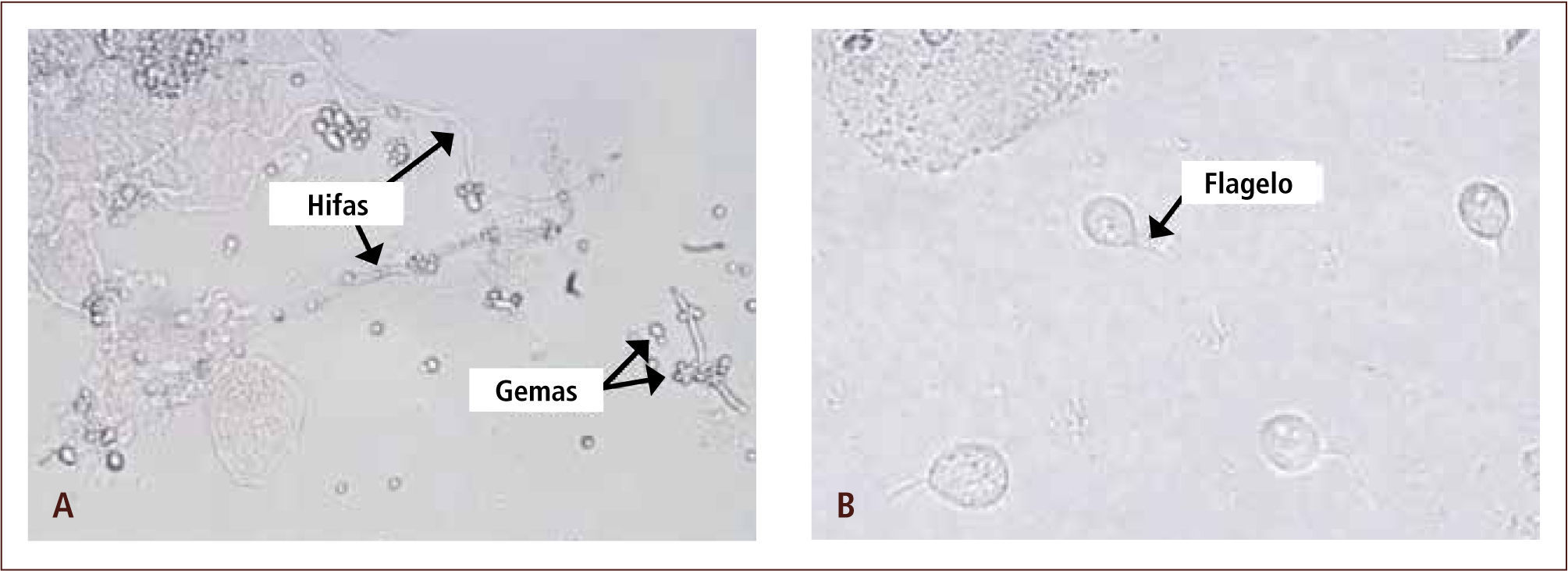
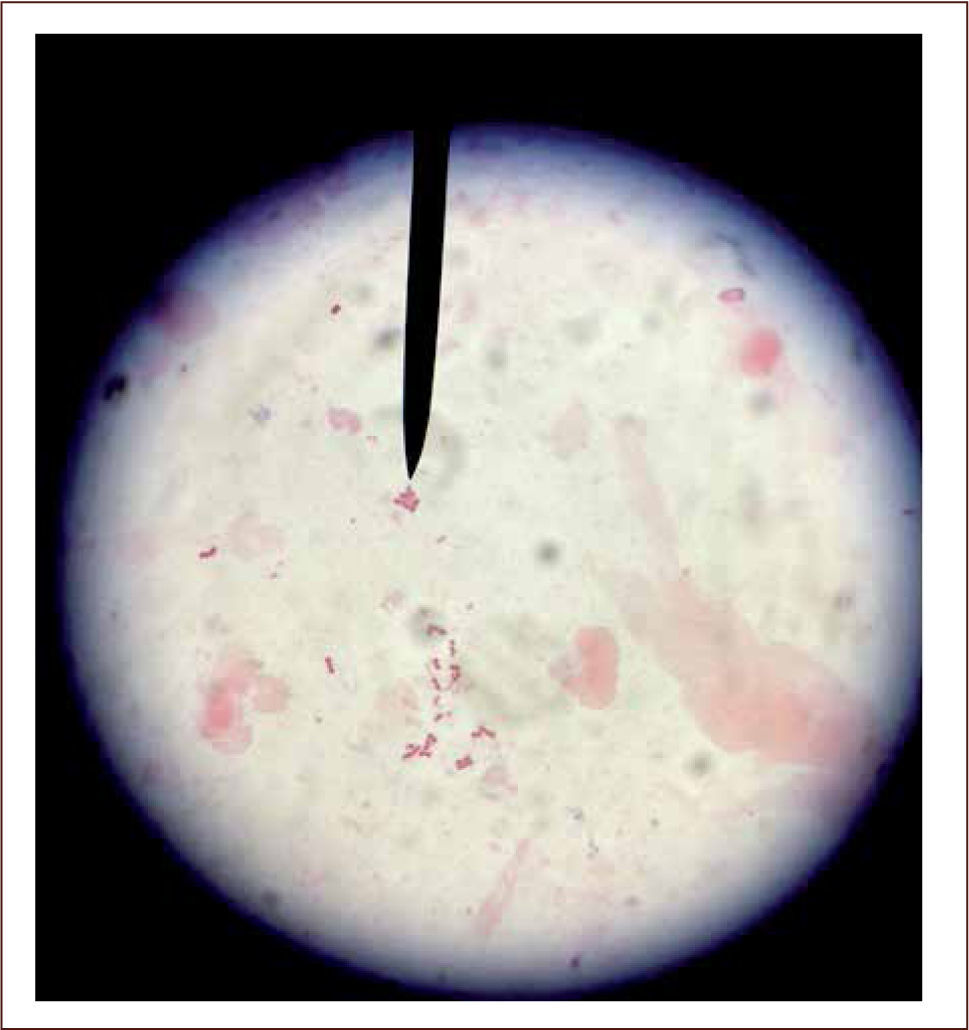
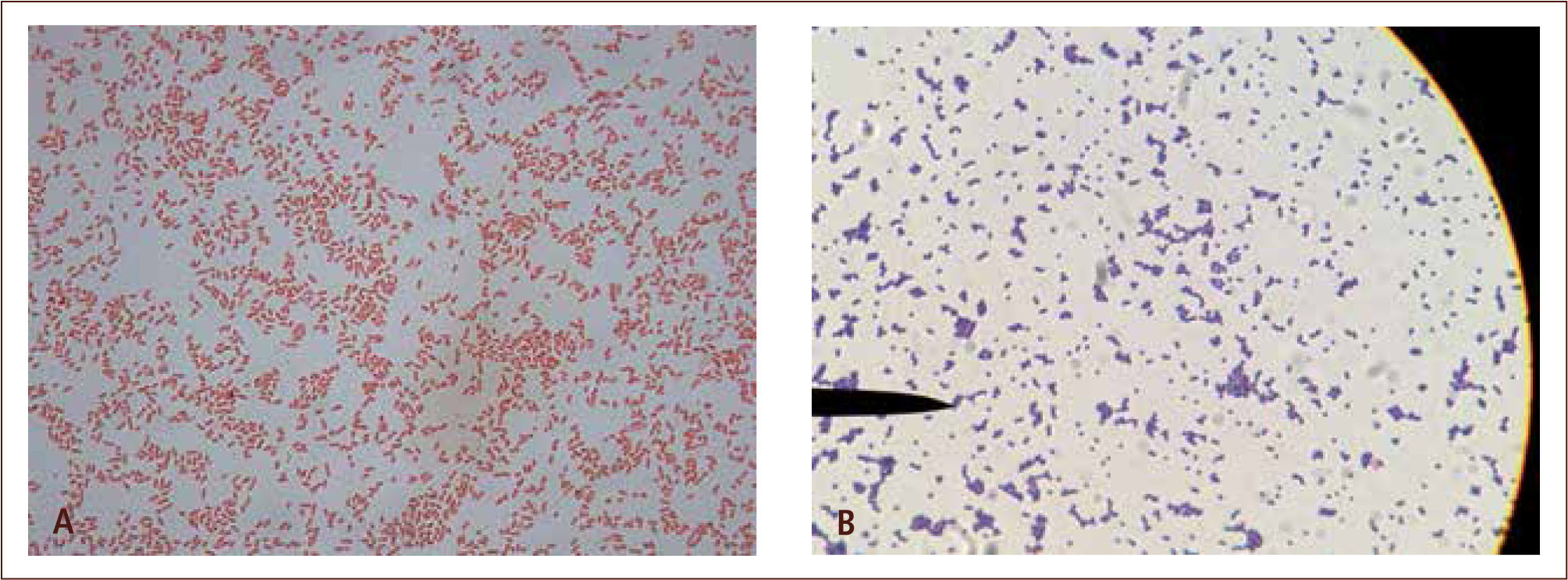
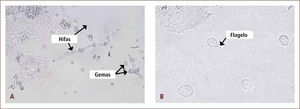
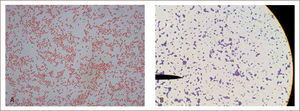
aEl diagnóstico directo tradicional generalmente abarca tres procedimientos: la observación directa de la muestra, su cultivo y la identificación del organismo aisladoI) La observación directa de la muestra entrega una información rápida a través de la examinación microscópica de la misma, donde es posible observar bacterias, hongos, algunas estructuras parasitarias e inclusiones virales. Este procedimiento puede realizarse a través de la microscopía directa al fresco, sin utilizar tinciones (figura 2) o a través de la microscopia directa con tinciones, en la cual, parte de la muestra es extendida en un portaobjeto y posteriormente es sometida a un colorante que tiene afinidad por diferentes estructuras microbianas. Las tinciones en general permiten reconocer las características morfológicas y agrupación de los microorganismos, por lo que en muchas oportunidades, ayudan a orientar el diagnóstico presuntivo del agente patógeno e iniciar terapia antimicrobiana empírica. Adicionalmente, permiten guiar una apropiada selección de medios de cultivo, en los cuales se sembrará la muestra. Una de las tinciones más utilizadas en el laboratorio de microbiología, es la tinción de Gram (figura 3), la cual permite agrupar a las bacterias según su reacción tintorial (Gram negativo o Gram positivo), morfología (cocos, bacilos, cocobacilos) y agrupación (racimo, cadena, diplo, empalizada). La tinción de Gram también permite observar células y levaduras (2, 7, 11–13).
Microscopía directa al fresco
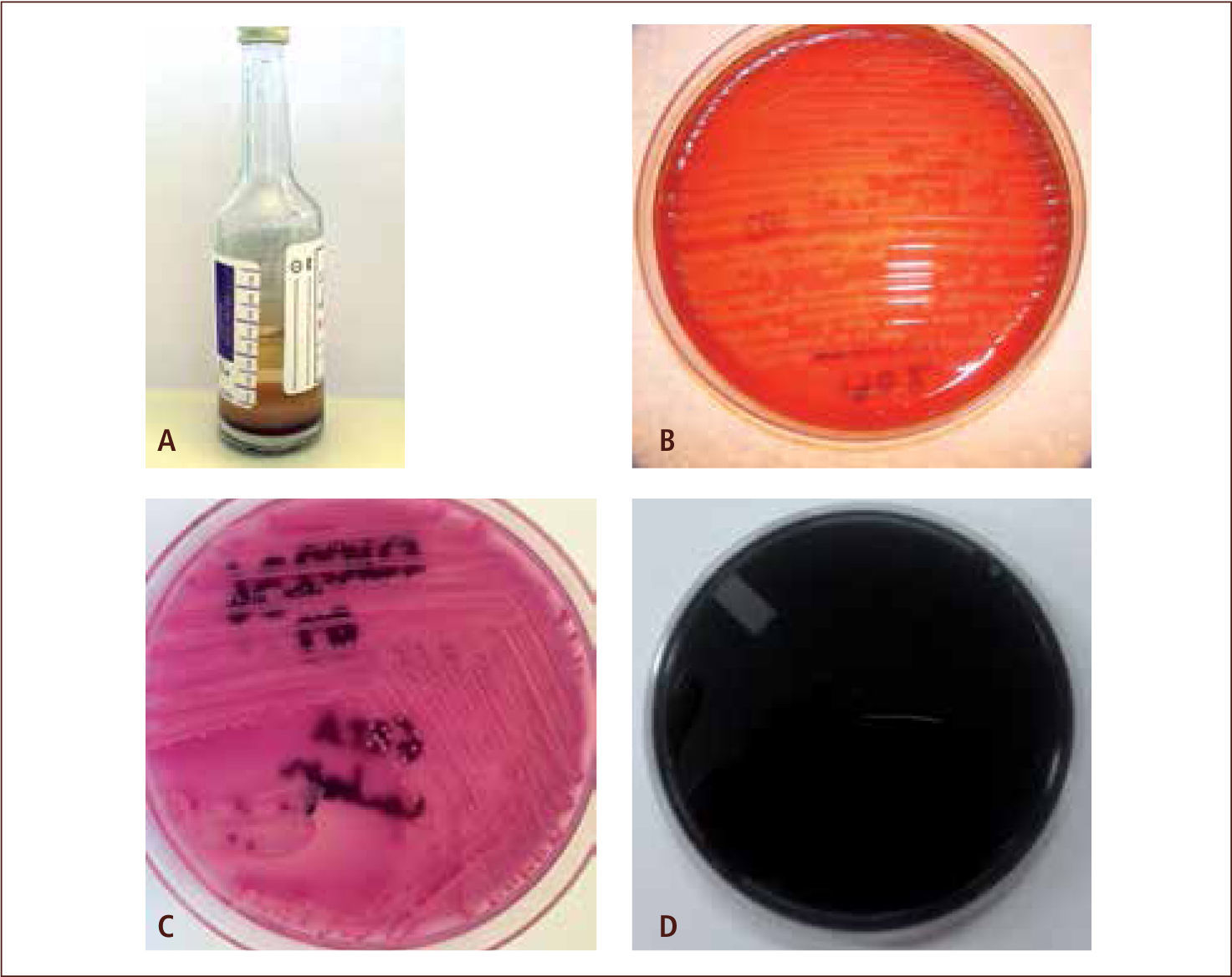
II) El cultivo de la muestra constituye una técnica básica para poder aislar y posteriormente identificar los microorganismos presentes, a través de la siembra e incubación en medios de cultivo artificiales. El éxito del procedimiento es dependiente de las condiciones de incubación (4, 11). En la actualidad existe una variedad de medios de cultivo, incluyendo los medios líquidos o caldos y los medios solidificados con agar; entre los que podemos encontrar medios enriquecidos, medios selectivos, medios diferenciales y medios especializados (figura 4). La selección del medio de cultivo utilizado para realizar el cultivo primario se basa en el conocimiento del diagnóstico presuntivo del paciente, sitio de recolección de la muestra y en la fisiología de las bacterias u hongos que podrían estar causando la infección (2, 4, 11). Cabe destacar que el cultivo microbiano requiere de más tiempo que otras pruebas, debido a que es necesario permitir una reproducción suficiente del microorganismo, para poder evidenciar señales de crecimiento; esto puede llevar desde algunas horas (18 a 48 hrs. en la mayoría de las bacterias) hasta semanas o meses (como sucede en el cultivo de micobacterias y algunos hongos filamentosos). Por otro lado, para llegar a obtener un microorganismo aislado (“puro”) en un cultivo, frecuentemente es necesario realizar subcultivos, lo que puede retrasar el tiempo de respuesta (11, 12). Una vez recuperado el microorganismo puro desde una muestra, éste debe ser identificado.
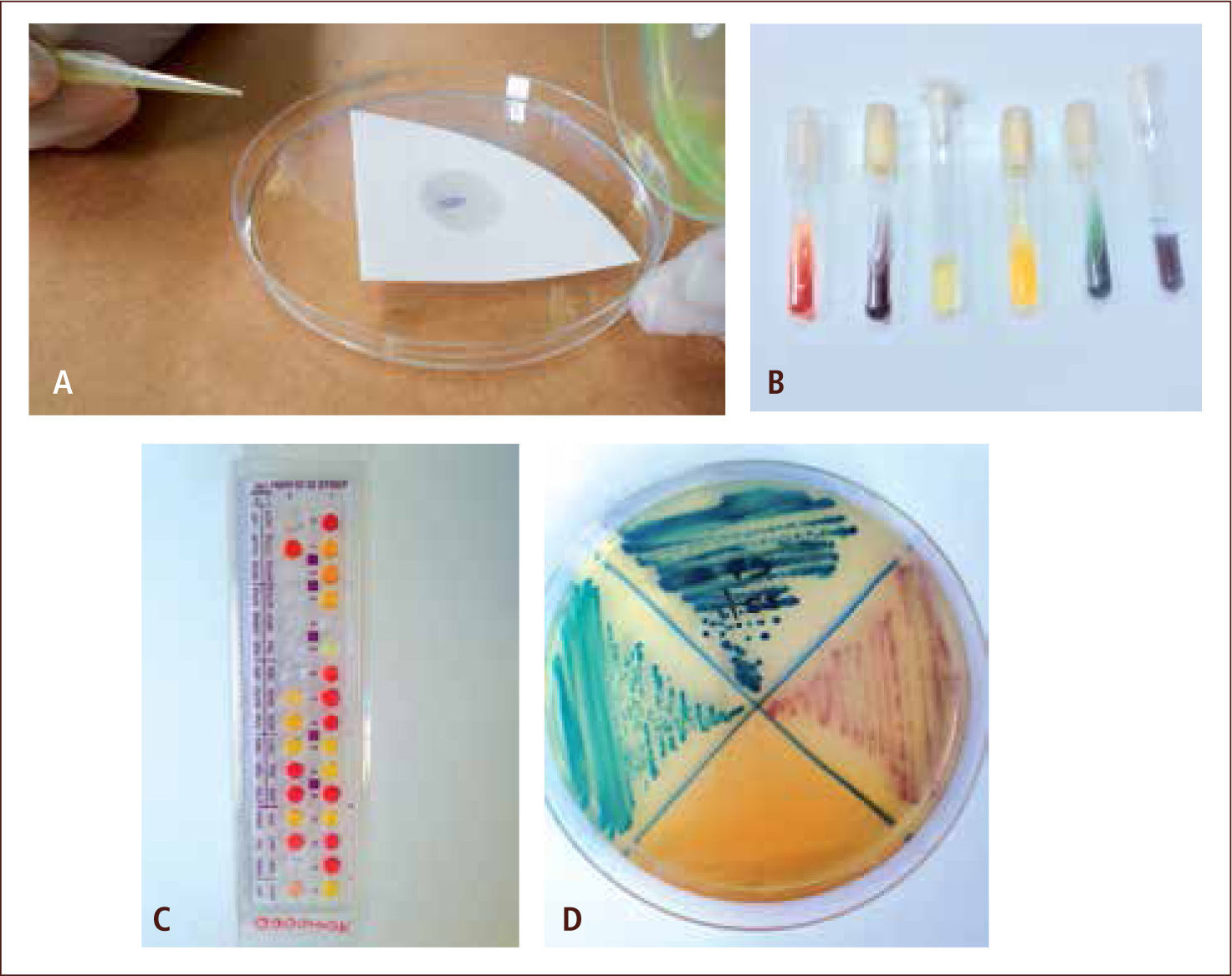
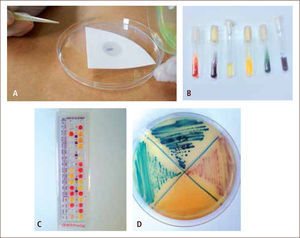
II) La identificación del organismo aislado en un cultivo se realiza a través de diferentes metodologías, tales como, observación de las características macroscópicas de las colonias (morfología de la colonia y reacciones que produce el microorganismo en el agar); observación microscópica con tinción de la colonia (agrupación, afinidad tintorial y morfología del microorganismo) (figura 5); estudio del comportamiento metabólico y bioquímico, a través de la aplicación de pruebas manuales (pruebas directas, baterías bioquímicas, galerías bioquímicas y medios de cultivo cromógenos) (figuras 6) o automatizadas (equipos que realizan las pruebas bioquímicas y metabólicas de manera miniaturizada) (figura 7); pruebas de requerimiento nutricional y pruebas diagnósticas no tradicionales, tales como, pruebas inmunológicas, espectrometría de masa y pruebas basadas en ácidos nucleicos (2, 4, 11, 12).
Posterior al aislamiento e identificación de un microorganismo clínico significativo, se realiza la prueba de susceptibilidad antimicrobiana, con el objetivo de guiar al clínico a elegir una terapia antimicrobiana adecuada. El estudio de susceptibilidad antimicrobiana (antibiograma o antifungigrama), es un método que determina, in vitro, la susceptibilidad de las bacterias y hongos, respectivamente, a los antimicrobianos, bajo condiciones específicas y estandarizadas de laboratorio.
La susceptibilidad antimicrobiana puede ser obtenida a través de tres técnicas:
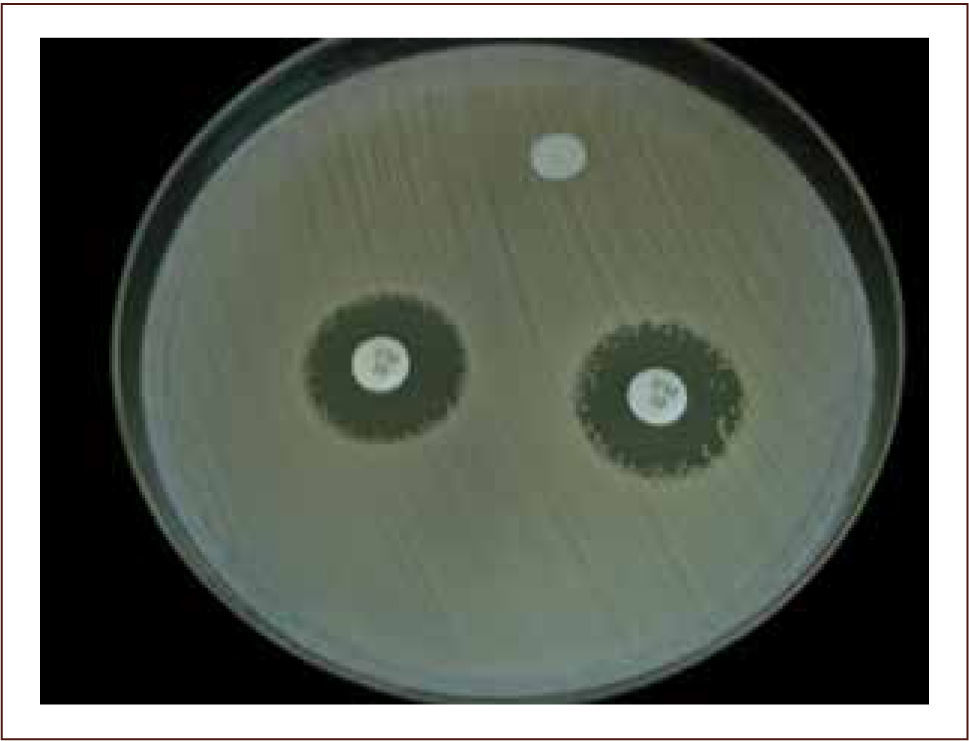
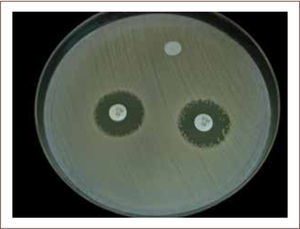
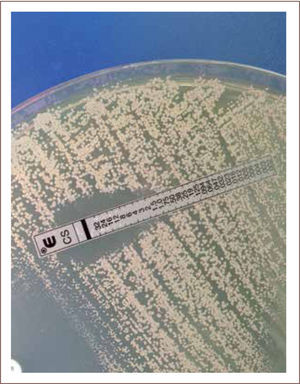
I) La difusión con disco (método de Kirby-Bauer) es una técnica económica, que entrega información cualitativa de la sensibilidad de un microorganismo a un determinado antimicrobiano (sensible, intermedio o resistente). Esta prueba consiste en la difusión de un antimicrobiano impregnado en un disco de papel, sobre la superficie de una placa de agar sembrada previamente con el microorganismo en estudio. Si el microorganismo es sensible al antimicrobiano, sufre una inhibición de su crecimiento alrededor del disco, formando un “halo de inhibición” que es visible y medible luego de 18 hrs. de incubación. El diámetro de la zona de inhibición determina si existe sensibilidad o resistencia al antimicrobiano (figura 8) (2, 7, 14, 15).
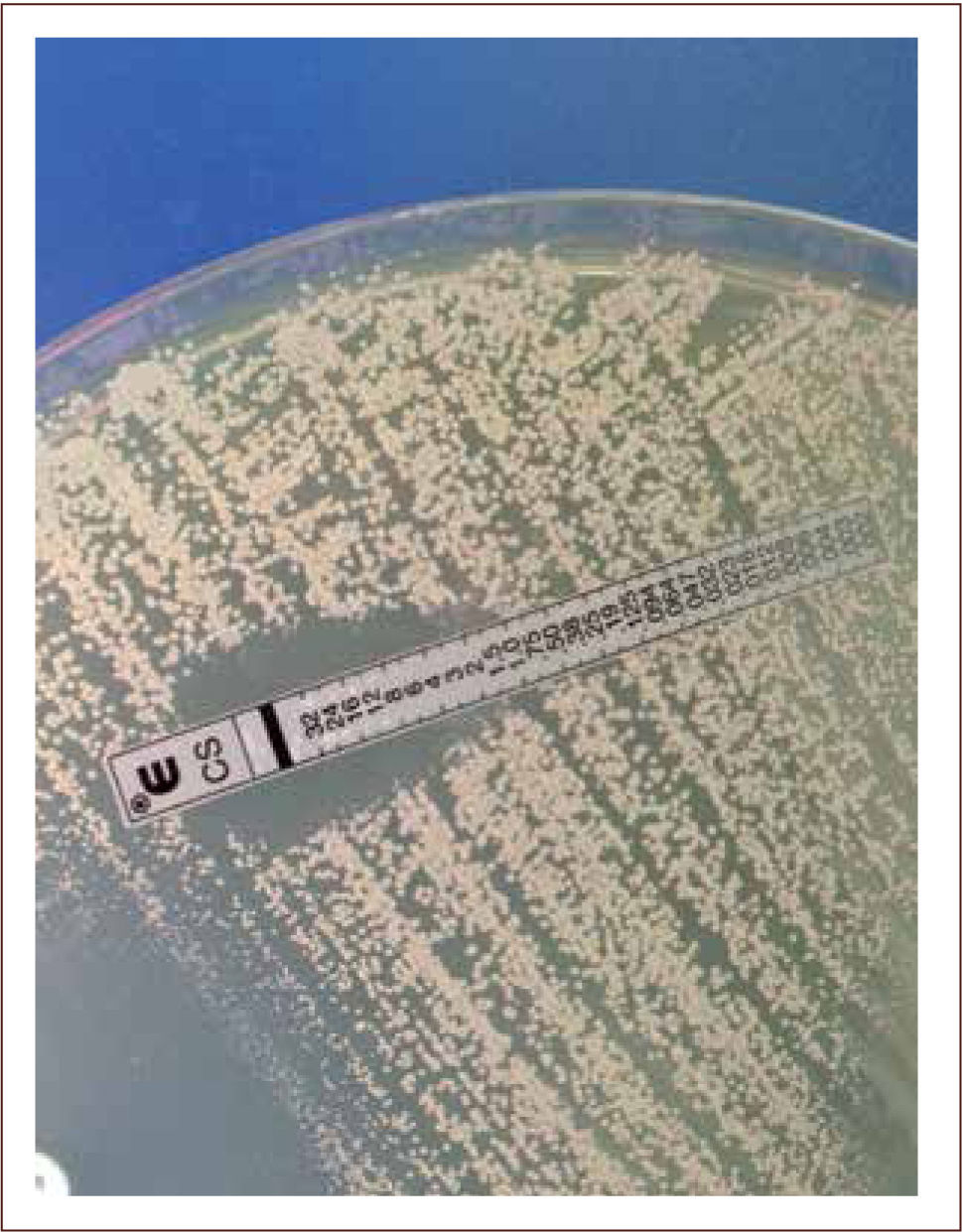
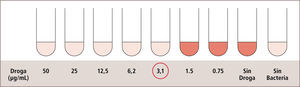
II) La Epsilometría o E-test, entrega información cuantitativa de la sensibilidad del microorganismo, determinando la Concentración Inhibitoria Mínima (CIM) de un antimicrobiano, es decir, la concentración mínima del antimicrobiano que es capaz de inhibir el crecimiento de un microorganismo determinado. Este método consiste en una tira plástica impregnada con concentraciones crecientes del antimicrobiano, la cual es puesta en una placa de agar sembrada previamente con el microorganismo en estudio. El agente antimicrobiano difunde en el agar produciendo inhibición del crecimiento bacteriano alrededor de la tira. La CIM corresponde al punto donde el crecimiento bacteriano alcanza la tira (figura 9) (2, 7, 14, 15).
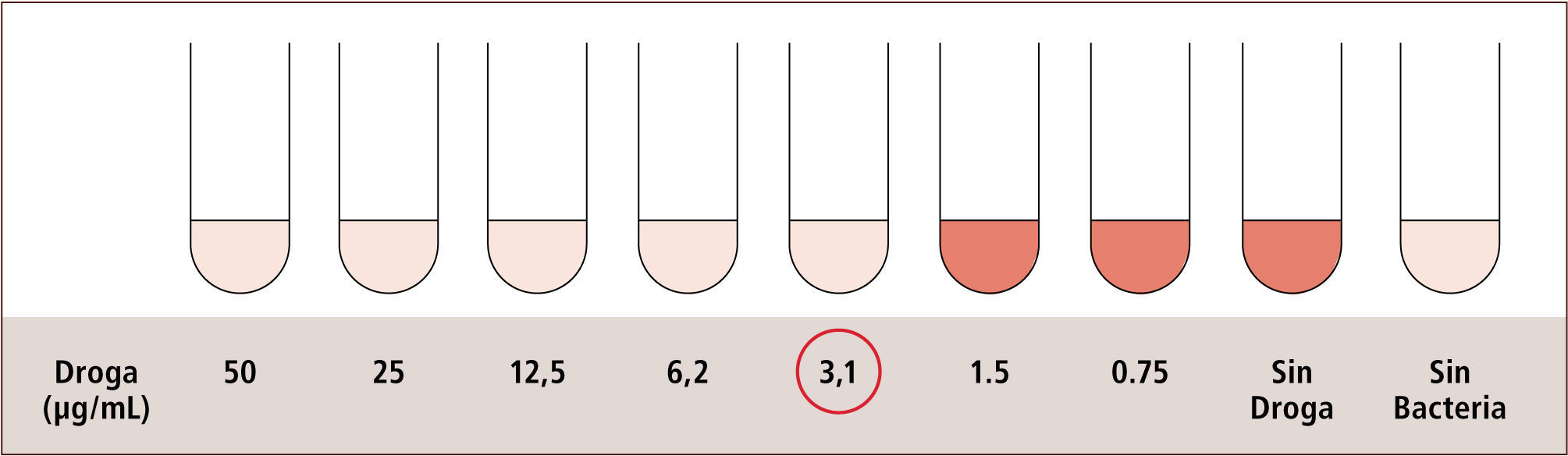
III) La Dilución es la metodología estándar de oro para obtener la susceptibilidad antimicrobiana. Esta metodología entrega información cuantitativa, determinando la CIM. Se basa en la dilución seriada de un antimicrobiano en un medio líquido o sólido, los cuales se ponen en contacto con una concentración estándar del microorganismo en estudio. Luego de incubarlos por 18 hrs. se observa el crecimiento del microorganismo y se establece la CIM, la cual corresponde a la mínima concentración del antimicrobiano donde no se observa crecimiento del microorganismo. En la actualidad existen equipos automatizados que efectúan una dilución en caldo en forma miniaturizada, permitiendo obtener resultados de CIM en forma rápida (figura 10) (2, 7, 14, 15).
cDiagnóstico directo no tradicionalEl diagnóstico directo no tradicional permite realizar la detección del agente etiológico directamente de la muestra o a partir de un microorganismo aislado previamente desde un cultivo. Entre las metodologías utilizadas para realizar un diagnóstico directo no tradicional se encuentran:
I. Los métodos inmunológicos, los cuales detectan antígenos del microorganismo utilizando un anticuerpo específico, el cual está unido a un sistema de detección. Según la técnica de inmunodiagnóstico que se utilice, es posible detectar el antígeno directamente desde la muestra o a partir de un microorganismo ya aislado desde un cultivo. Entre las técnicas más utilizadas en el laboratorio de microbiología se encuentran:
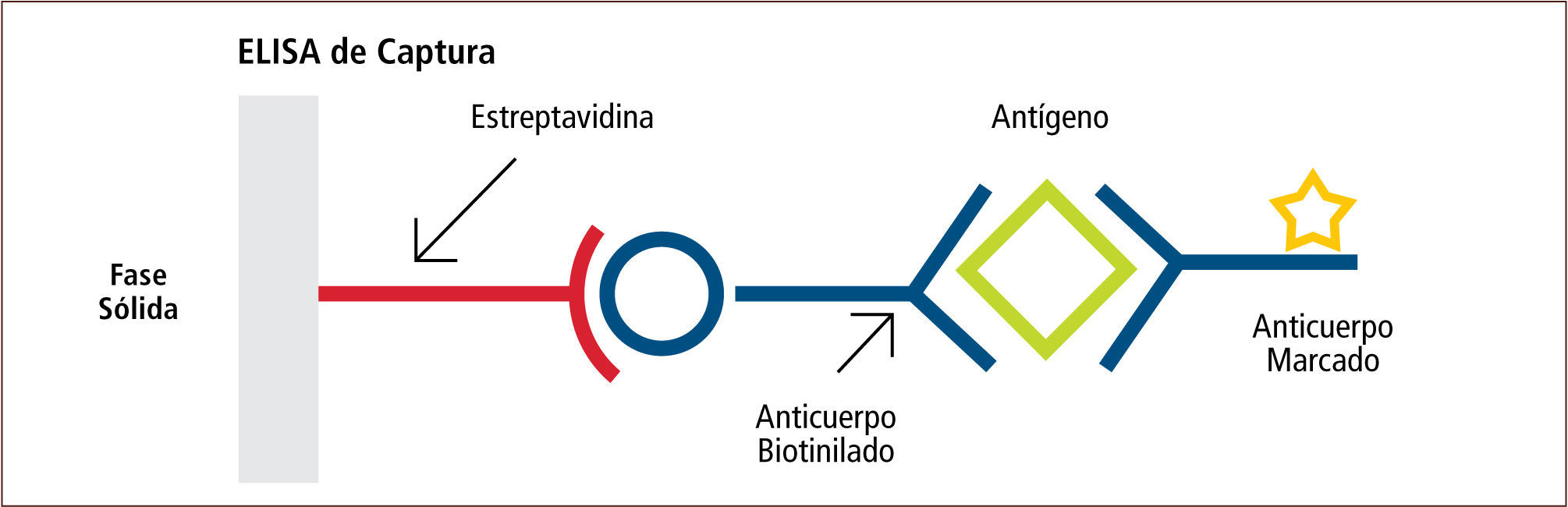
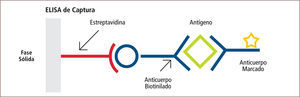
• El Enzimoinmunoensayo (EIA), el cual es una metodología utilizada para detectar antígenos directamente desde la muestra. Una de las técnicas más utilizadas en microbiología es el ensayo por inmunoabsorción ligado a enzima (ELISA) de captura, donde se utiliza un anticuerpo específico del antígeno, el cual es fijado a una fase sólida (placa). El antígeno presente en la muestra se une al anticuerpo específico. Posteriormente se añade un segundo anticuerpo específico contra el antígeno, el cual está unido covalentemente a una enzima. Luego de un periodo de incubación y varios procesos de lavado, el complejo anticuerpo-antígeno-anticuerpo es detectado al añadir el sustrato de la enzima ligada al segundo anticuerpo. La enzima actúa sobre el sustrato produciendo color, el cual puede ser leído a simple vista o mediante un espectrofotómetro (figura 11) (2, 7, 14–16).
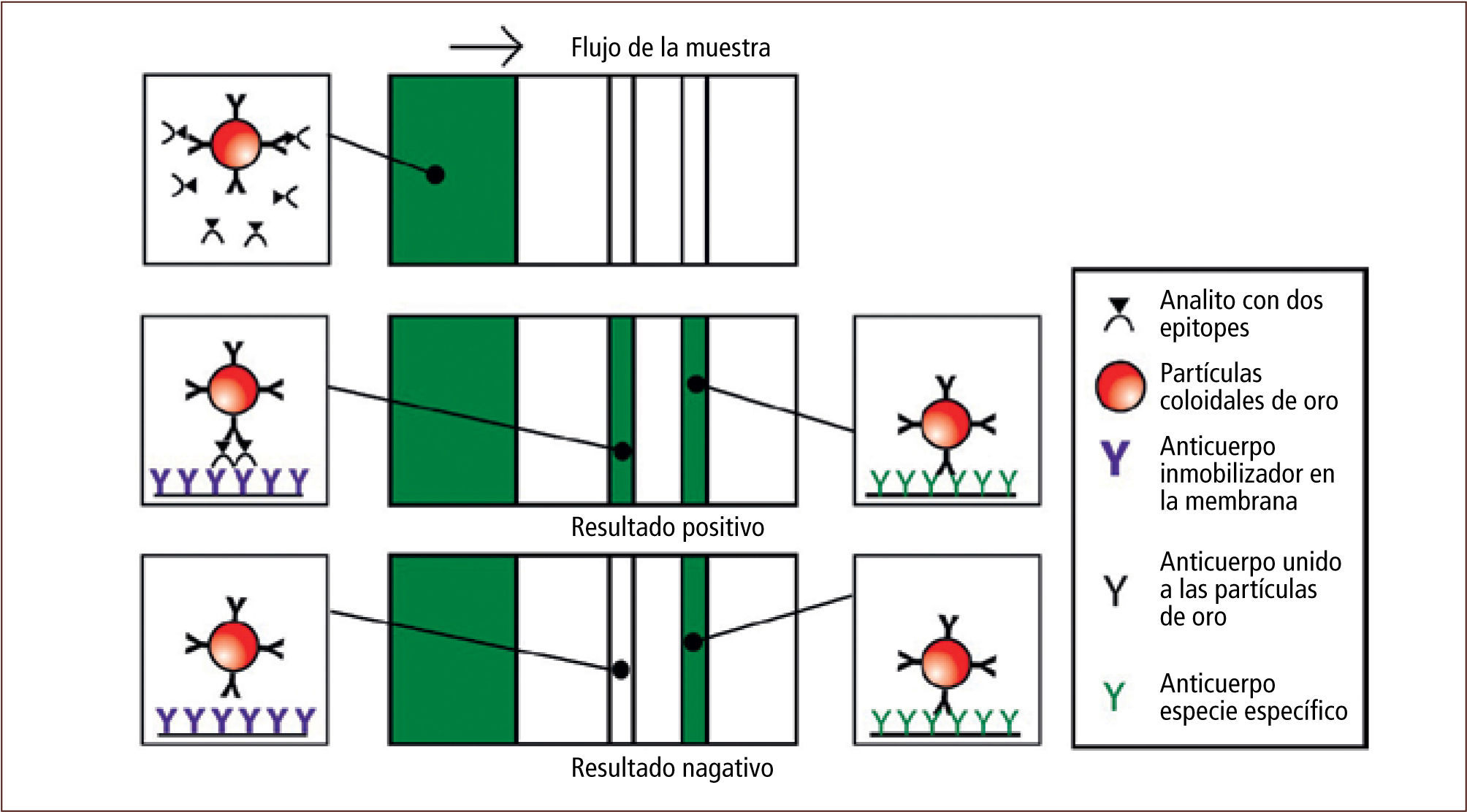
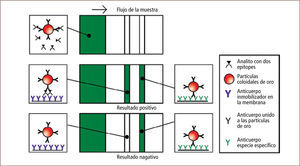
• Inmunocromatografía Otra técnica muy utilizada es la inmunocromatografía (por ejemplo el “test pack” faríngeo Streptococcus pyogenes), la cual permite detectar el agente etiológico directamente desde la muestra. Consiste en una membrana porosa de nitrocelulosa, teflón o nylon, que por debajo presenta una almohadilla de material absorbente, la cual contiene un primer anticuerpo específico contra el antígeno, ligado a partículas de látex o metal coloidal (reactivo detector). La membrana en su parte superior contiene inmovilizado un segundo anticuerpo específico contra el antígeno, que está ligado a un reactivo de captura. Generalmente la membrana y la almohadilla están unidas a un envase plástico desechable, que en su parte inferior presenta un pequeño orificio donde es depositada la muestra. Al depositarla en la parte inferior del envase, la muestra toma contacto y se difunde por la almohadilla absorbente, encontrándose el antígeno de la muestra con el primer anticuerpo. Este complejo se difunde por capilaridad a lo largo de la membrana hasta encontrarse y unirse (en su parte superior) al segundo anticuerpo. Así el reactivo detector y el reactivo de captura se encuentran, produciéndose una línea de color en la zona superior de la membrana (figura 12) (14, 16, 17).
• La aglutinación con partículas de látex, consiste en una lámina donde se unen partículas inertes de látex a un antígeno presente en una muestra o en el microorganismo aislado desde un cultivo, mediante fuerzas eléctricas intramoleculares o uniones covalentes. La aglutinación de estas partículas ocurre cuando existe interacción entre el antígeno y el anticuerpo específico (figura 13). Esta técnica es muy utilizada para detectar Neisseria meningitidis y Haemophilus influenzae b en líquido cerebroespinal y para identificar Staphylococcus aureus desde cultivo (2, 14–16).
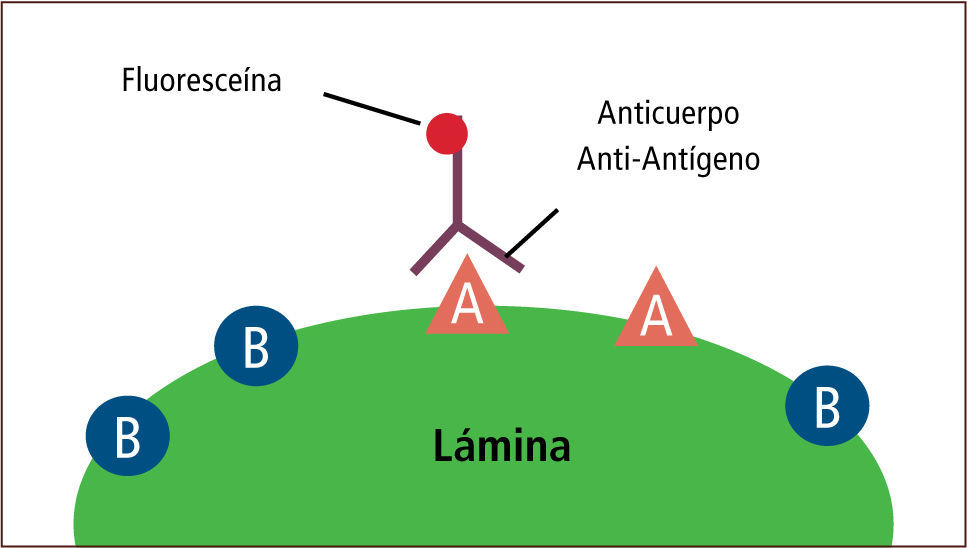
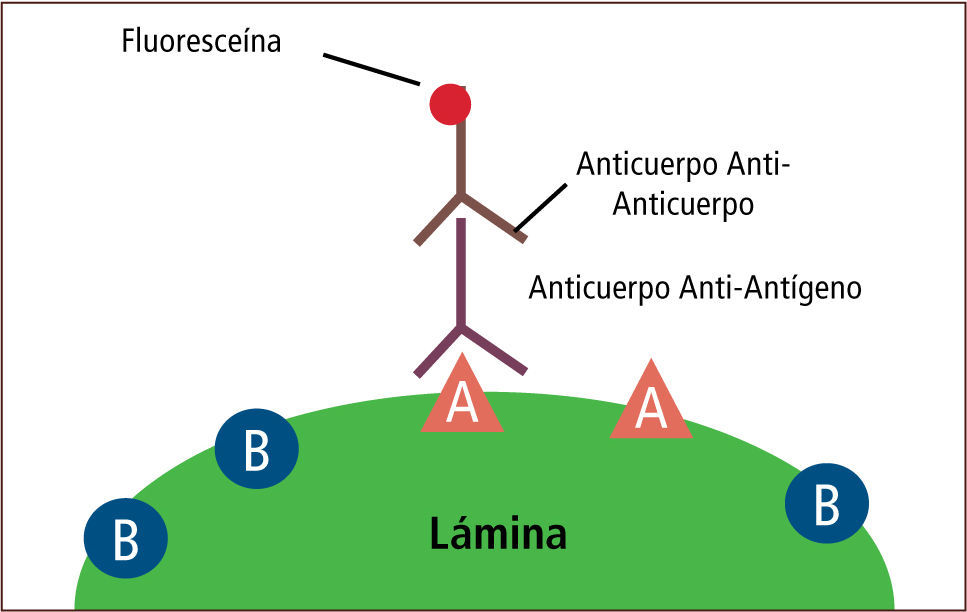
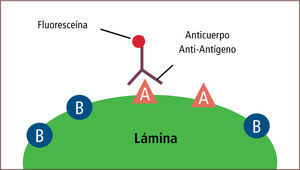
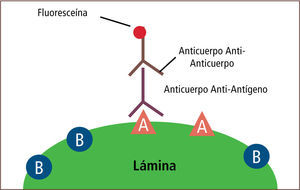
• La inmunofluorescencia es una técnica que permite detectar el antígeno presente en una muestra. Esta técnica tiene dos modalidades. La primera es la modalidad de anticuerpo fluorescente directo (Direct Fluorescent Antibody, DFA) que consiste en una lámina con la muestra del paciente previamente fijada, a la cual se le aplica un anticuerpo específico. Luego de un período de incubación y de varios procesos de lavado, el complejo antígeno-anticuerpo es detectado mediante microscopía de fluorescencia (figura 14). La segunda es la modalidad de anticuerpo fluorescente indirecto (Indirect Fluorescent Antibody, IFA) que consiste en una lámina con la muestra del paciente previamente fijada, a la cual se aplica un anticuerpo específico. Luego de un período de incubación y de varios procesos de lavado, se aplica un anticuerpo anti-humano unido a una fluoresceína. Posterior a varios procesos de lavado, el complejo antígeno-anticuerpo-anti-anticuerpo es detectado mediante microscopía de fluorescencia (figura 15) (2, 14–16).
II. Los métodos basados en ácido nucleico han tenido un gran avance en la última década, apareciendo técnicas altamente sensibles y específicas, capaces de detectar y cuantificar pequeñas cantidades de ADN (Ácido Desoxirribonucleico) o ARN (Ácido Ribonucleico) de microorganismos no cultivables in vitro o desde un microorganismo aislado desde un cultivo. Este avance también ha permitido estudiar los mecanismos de resistencia bacteriana y desarrollar la epidemiología molecular (18, 19). Existen actualmente numerosas variantes de técnicas para amplificar, detectar y secuenciar los ácidos nucleicos. La técnica más utilizada en microbiología para realizar la amplificación de ácidos nucleicos es la Reacción de Polimerasa en Cadena (RPC) en combinación con un variado número de técnicas para detectar esta amplificación, tales como la RPC convencional (detección de la amplificación una vez finalizada la RPC, en un gel de agarosa con un intercalante inespecífico fluorescente) y la RPC en tiempo real (identificación inmediata de la amplificación, principalmente a través de hibridación con sondas marcadas con un fluorocromo y posterior lectura de la fluorescencia emitida por la sonda, en el equipo de amplificación). Se obtienen resultados dentro de 30 minutos a dos horas (14, 15, 18, 19).
La secuenciación de productos de RPC, permite la identificación de bacterias a través de la comparación del resultado de la secuenciación con secuencias ya conocidas en bases de datos. Una de las técnicas más utilizadas para este fin, es la secuenciación del ARN ribosomal 16S, la cual permite detectar e identificar microorganismos no cultivables, fastidiosos o de lento crecimiento (20).
La epidemiología molecular consiste en el estudio de la diseminación de un microorganismo entre pacientes, personal de salud y el entorno ambiental (brote), a través de la comparación de genomas de un microorganismo aislado desde diferentes sitios, mediante múltiples tecnologías tales como, la Electroforesis de Campo Pulsado (PFGE) y el Multilocus Sequence Typing (MLST) (17).
III. La espectrometría de masa es una metodología recientemente incorporada al diagnóstico microbiológico. Ésta permite una rápida detección (pocos minutos) de un microorganismo aislado desde un cultivo (18, 21) a través del análisis de sus proteínas y posterior búsqueda y comparación de su espectro de proteínas en una base de datos, donde se identifica el microorganismo a nivel de género y especie. Recientes estudios han probado utilizar esta metodología directamente desde la muestra con resultados promisorios (21).
2Diagnóstico microbiológico indirectoEl diagnóstico microbiológico indirecto o estudio serológico permite detectar indirectamente un agente patógeno a través de los anticuerpos específicos producidos por el hospedero frente a dicho patógeno. Además permite diferenciar una infección primaria de una reinfección o infección crónica, debido a que la respuesta serológica en cada una de estas situaciones es diferente. Las técnicas empleadas para la detección de anticuerpos utilizan antígenos conocidos, que se unirán de forma específica a los anticuerpos presentes en la muestra del paciente. Los laboratorios de microbiología utilizan principalmente las técnicas de ELISA, inmunofluorescencia indirecta y de floculación (7, 15, 22). La técnica de floculación es utilizada para realizar las pruebas de VDRL y RPR, para diagnosticar infección por Treponema pallidum, una bacteria que no es cultivable. El VDRL detecta el anticuerpo anti-T. pallidum, a través de un antígeno constituido por la mezcla de cardiolipina, lecitina y colesterol; que comienza a aglutinar o agregarse en presencia del anticuerpo anti-T pallidum. El RPR es una modificación de la prueba de VDRL, en la cual, a la mezcla antigénica se adicionan partículas de carbón, permitiendo visualizar la reacción de floculación sin necesidad de utilizar microscopía (15, 23).
Etapa post-analítica: reporte de resultadosEn esta etapa los resultados obtenidos por el laboratorio de microbiología son transferidos al sistema informático, emitiéndose un informe final, el cual debe estar rápidamente disponible para ser visualizado por el personal de las diferentes áreas del laboratorio clínico y por el médico tratante. Se debe asegurar la confidencialidad de los datos del paciente a través de políticas institucionales (11).
Las autoras declaran no tener conflictos de interés, en relación a este artículo.