Estudios recientes en pacientes con cáncer de mama irradiadas y reconstrucción mamaria (RM) con prótesis definitivas han reportado pérdida de la prótesis definitiva en porcentajes que alcanzan el 40,7%.
ObjetivoDeterminar si la preparación del tejido irradiado con lipotransferencia de protección en pacientes a las que se le realizó RM con expansor (previo a la RM definitiva con prótesis) o que sean portadoras de un implante definitivo irradiado, disminuye la frecuencia de pérdida de la prótesis.
Material y métodoEstudio observacional, analítico, comparativo con cohorte histórica. Se estudiaron pacientes tratadas por cáncer de mama efectuándose mastectomía y RM con expansor más radioterapia postoperatoria y luego recambio a prótesis definitiva sin preparación previa con lipotransferencia (LPT) de protección comparándose con pacientes de igual diagnóstico tratadas con mastectomía y RM con expansor o portadoras de un implante definitivo irradiado a las que se le realizó LPT de protección previo recambio a prótesis, evaluando las complicaciones postoperatorias tempranas.
ResultadosSe estudiaron 33 pacientes de las cuales a 21 (63,6%) se le realizó LPT de protección previo recambio a prótesis. El grupo de LPT de protección no tuvo complicaciones comparado con el grupo sin LPT que presentó 2 casos de ulceración con pérdida de implante. La tasa de éxito global en pacientes irradiadas y con LPT fue del 100% en comparación con el 83,4% entre las pacientes irradiadas sin LPT.
ConclusiónLa LPT de protección contribuye a mejorar la calidad y el grosor del tejido disminuyendo a 0% las posibilidades de la pérdida del implante en esta casuística.
Recent studies in breast cancer patients with postmastectomy radiation therapy and implant-based breast reconstruction (BR) have reported up to 40% of extrusion of the implant.
ObjectiveTo determine whether the preparation of the irradiated tissue with protective lipofilling in patients who underwent BR with expander (prior to implant BR) or patients with irradiated implant reconstruction, decreases the frequency of the extrusión of the implant.
MethodsObservational, analytical, comparative study with an historical cohort. Patients treated for breast cancer with mastectomy and breast reconstruction with expander plus postoperative radiotherapy and who then underwent replacement to a definitive prosthesis without prior preparation with lipotransfer (LPT), were compared with those who underwent prior preparation with LPT, to evaluate the early postoperative complications.
ResultsThirty-three patients were studied, of whom 21 (63,6%) underwent protective lipofilling. The protective lipofilling group did not have complications compared with 2 cases in the group without protective lipofilling which presented withulceration with extrusion of the implant. The overall success rate in irradiated patients with protective lipofilling was 100% compared to 83,4% among irradiated patients without protective lipofilling.
ConclusionProtective lipofilling contributes to improve the quality and the thickness of the tissue diminishing to 0%, in our work, the possibilities of extrusion of the implant.
La Organización Mundial de la Salud (OMS), a través de su Agencia Internacional en el Estudio del Cáncer (IARC), estimó una incidencia mundial de 2.300.000 casos de cáncer de mama en el año 2020 (11,7% del total de cánceres). La mortalidad correspondía a 15 por cada 100.000 mujeres. En ese mismo año se informaba que en Chile había 5.331 nuevos casos de cáncer de mama, con una tasa de mortalidad estandarizada por edad (mundial) de hasta el 10,2%1. Es probable que en nuestro país el 40 a 50% de las mujeres con cáncer de mama deba ir a una mastectomía total e idealmente a una reconstrucción mamaria (RM). Esto se deduce de las etapas clínicas que se diagnostican en Chile: 10% de los casos se diagnostican en estadio 0, 16,7% en estadio I, 42% en estadio II y en estadio III 24,7%2.
La RM ha evolucionado en los últimos años con la aparición de técnicas quirúrgicas de menor agresividad, que consiguen excelentes resultados sin alterar los tejidos, y con escasa morbilidad3. Las técnicas de RM pueden agruparse según si se basan en el uso de materiales aloplásticos (expansores e implantes mamarios), si utilizan únicamente tejidos autólogos o una combinación de ambas. Dependiendo de cada caso (si se realizó o no radioterapia, características físicas, preferencia de la paciente, experiencia del cirujano y las disponibilidades del mismo según la infraestructura en la que trabaja), se elegirá una u otra técnica reconstructiva.
Estudios recientes en pacientes con cáncer de mama irradiadas y RM con prótesis definitivas han reportado una alta tasa de complicaciones4. A corto plazo se ha reportado mayor riesgo de hematomas, seromas e infecciones con exposición y pérdida de prótesis definitiva. A largo plazo se ha observado mayor resistencia a la expansión, dolor, contractura capsular, adelgazamiento de la piel y visualización de la prótesis5–7.
La reconstrucción con tejido autólogo tolera mejor la radioterapia que los implantes8. Sin embargo, hay riesgo en los colgajos tanto si se realiza sobre un tejido previamente irradiado como si se irradian tras la reconstrucción. En la reconstrucción con implantes, la radioterapia postoperatoria se asocia a un riesgo de contractura capsular que varía de un 17 a 68%9, lo que constituye un factor de riesgo para el desarrollo de otras complicaciones de mayor gravedad10 y afecta significativamente la calidad de vida de las pacientes11.
El uso de injerto de grasa autógena conocida también como lipotransferencia (LPT), ha sido utilizada desde el año 200212 con un aumento significativo en los últimos 20 años13. Ha mostrado beneficios en las pacientes en que se realiza RM con tejidos irradiados14, disminuyendo las complicaciones antes citadas15,16.
La LPT permite corregir el volumen, el defecto del contorno, las cicatrices y las asimetrías posteriores a las cirugías por RM en cáncer de mama, así como también aumenta el grosor tisular y mejora los tejidos irradiados optimizando el resultado final16,17. A lo largo del tiempo se ha ido perfeccionando su técnica18 y se han publicado numerosos estudios donde se señala la seguridad de la misma19,20.
La complicación más importante al realizar la RM ha sido la pérdida de la prótesis definitiva, que en pacientes con tejidos irradiados alcanza hasta el 40,7%21,22. Al realizar LPT de protección en el tejido irradiado, previo a la reconstrucción mamaria, la pérdida de prótesis definitiva se reduce a cifras similares a las encontradas en pacientes no irradiadas, que son menores al 10%23.
Como técnica quirúrgica, es un procedimiento que ofrece una morbilidad mínima en el sitio donante, de fácil reproductibilidad y con satisfacción del paciente a largo plazo de hasta el 80%24,25. Dentro de las posibles complicaciones de la técnica se encuentran: necrosis grasa, formación de quistes oleosos, colección de grasa necrótica licuada (citoesteatonecrosis), celulitis y absceso, las que son muy poco frecuentes, variando en la literatura del 8 al 12%5–16.
Rigotti et al. en su estudio del año 2007, demostraron una evidente mejoría en la cicatrización de piel y tejidos blandos después del trasplante del fluido lipoaspirado en tejidos con fibrosis y reconstrucciones irradiadas con necrosis. Estos investigadores postularon que las células lipoaspiradas poseían capacidades proangiogénicas favoreciendo la regeneración tisular12.
En Clínica Las Condes (CLC)x se incluyó la técnica de la LPT en pacientes con RM con expansor tratadas con radioterapia, después de una revisión de la literatura donde se reportaba una posible disminución de las complicaciones, especialmente la pérdida del implante.En consecuencia, desde el año 2014, se comenzó a usar esta técnica en estas pacientes comparándolos con aquellas pacientes históricas en las que no se utilizó la LPT.
Se planteó el presente estudio debido a que en la actualidad no se realiza de manera sistemática en la práctica médica la LPT de protección en pacientes irradiadas con RM con expansor, previo a la RM con prótesis definitiva. Es necesario aportar y sustentar la escasa bibliografía en relación al tema. Se estima que nuestra casuística que muestra la experiencia en el uso de LPT de protección con el objetivo de reducir la pérdida de prótesis definitiva en las RM con tejidos irradiados, es un aporte en ese sentido.
2Material y método2.1Tipo y diseño de estudioEstudio observacional, descriptivo, analítico, comparativo con cohorte histórica.
Posterior a su aprobación por la Dirección Académica (DA) y el Comité de Ética Científica (CEC) de CLC, se estudiaron pacientes tratadas por cáncer de mama que se efectuaron mastectomía y RM con expansor más radioterapia postoperatoria y luego recambio a prótesis definitiva sin preparación previa con LPT de protección (enero de 2003 a diciembre de 2011) comparándose con pacientes de igual diagnóstico tratadas con mastectomía y RM con expansor o portadoras de un implante definitivo irradiado a las que se le realizó LPT de protección previo recambio a prótesis (enero de 2014 a mayo de 2018) en el Centro Integral de la Mama (CIM) de Clínica Las Condes, Santiago, Chile. El objetivo principal fue comparar la incidencia de complicaciones tempranas entre ambos grupos.
Se excluyeron los años 2012 y 2013 debido a que se decidió no realizar RM con implante en pacientes con mastectomía más radioterapia debido a la alta tasa de complicaciones reportada en la literatura y la incidencia de pérdida del implante en nuestro centro.
Tanto la técnica como el equipo quirúrgico fueron los mismos en ambos grupos en estudio. Se presentó el caso de cada paciente ante un comité de expertos multidisciplinario para poder determinar el tratamiento adyuvante más adecuado.
2.2Criterios de inclusión y exclusiónSe incluyeron pacientes pertenecientes al Registro del CIM (aprobado por DA y CEC) que cumplieran con los siguientes criterios: pacientes tratadas con mastectomía uni o bilateral con radioterapia en las que se le realizó RM con expansor o prótesis definitiva y luego recambio de implante con o sin LPT previa. Se incluyeron pacientes que tuvieran un mínimo de tiempo de seguimiento de 60 días post operatorios.
Se excluyeron las pacientes que tuviesen diseminación a distancia de su enfermedad al momento del diagnóstico, RM con tejido autólogo, que no hubieran sido irradiadas, pacientes que no hubiesen realizado el tratamiento completo en CLC y pacientes que no tuvieran completos los datos necesarios para el estudio.
2.3Procedimiento de Lipotransferencia de ColemanLa recolección de grasa es precedida por infiltración del sitio donante con una solución tumescente tradicional compuesta de 500 cc de solución de Ringer lactato con una ampolla de epinefrina (1mg). Se inyectan aproximadamente 1 a 2ml de fluido tumescente por cada 1ml de fluido lipoaspirado. La recolección de grasa se realiza con succión manual a través de una jeringa de 20ml.
El fluido lipoaspirado se transfiere a jeringas de 10ml y se centrifuga a 3.000rpm durante 3 minutos.
Después de la centrifugación, cada jeringa se coloca verticalmente donde se observan tres capas: la capa superior (el aceite), la capa media (la grasa) y la capa inferior (el suero). El aceite y el suero se descartan.
La consistencia del fluido lipoaspirado se considera adecuada para el injerto una vez que la grasa se muestra sólida, sin líquido entre los glóbulos de grasa.
El injerto de grasa es transferido a jeringas de 3ml e inyectado en los tejidos utilizando una cánula de infiltración Coleman de 15cm (catálogo Número COL-ASPI; Mentor). En áreas de cicatrización, se realiza LPT previo a liberación de adherencias percutáneas (rigotomías).
2.4Técnica de reconstrucción mamariaDespués de la mastectomía, todas las pacientes fueron reconstruidas con expansores anatómicos de altura media/baja según correspondiera (perfil de contorno de altura media/baja) con cobertura muscular total y colocación de dos drenajes. Los expansores fueron expandidos semanalmente con solución salina hasta obtener el total del volumen deseado.
En 4 pacientes, a las que se les realizó LPT de protección, se utilizó además una matriz dérmica acelular (ADM) al momento de realizar la mastectomía y colocación del expansor. Esto otorgó mayor soporte a la cobertura muscular, evitando la elevación del músculo serrato anterior y mejorando el resultado estético al recrear el surco submamario y el contorno lateral de la mama.
Para reducir el riesgo de seroma alrededor del implante o entre la ADM y los colgajos de piel, se colocó un drenaje junto al expansor, y otro entre la ADM y el colgajo de piel.
El criterio recomendado para retirar los drenajes fue tener un gasto menor a 30ml en 24 horas durante dos días seguidos. En los casos en los que se utiliza ADM los drenajes se mantuvieron por un plazo mayor, que alcanzó hasta dos semanas, durante las cuales se mantuvo tratamiento profiláctico con antibiótico.
Las pacientes recibieron radioterapia después de la mastectomía, o al terminar la quimioterapia adyuvante, cuando estuvo indicada. La radioterapia utilizada sobre la mama reconstruida en nuestras pacientes es de campos tangenciales segmentados con cuñas (forward planning intensity modulated radiotherapy (IMRT)) en una dosis de 50Gy en 25 fracciones en un período aproximado de 5 semanas con o sin irradiación de campos regionales según el compromiso axilar.
Las pacientes del grupo con LPT firmaron un consentimiento informado y aceptaron someterse a controles postoperatorios de rutina con imágenes según correspondiese.
La primera sesión de LPT, bajo anestesia general, se realizó con un mínimo de 2 meses tras la finalización del tratamiento de radiación.
Las inyecciones de grasa se realizaron de forma multidireccional desde capas superficiales a profundas, extendiendo la grasa en toda el área de la mama irradiada. El área inyectada intenta abarcar toda la mama, priorizando la zona que se encuentra 4cm. por encima y 4cm. por debajo de la cicatriz de la mastectomía, desde la región medio esternal hasta la línea axilar anterior.
La cantidad de grasa trasplantada varió de paciente a paciente con un promedio de 100ml de grasa injertada por cirugía por mama, en una sesión, a excepción de una paciente en la que debió repetirse la LPT para lograr una adecuada calidad de la piel. En el caso de retracción cicatricial se realizaron rigotomías para liberar las cicatrices, permitiendo luego el injerto de grasa.
Se planificó luego el intercambio del expansor por la prótesis definitiva tras un mínimo de 3 meses de la LPT, realizándose capsulotomía circunferencial o radiada si se precisaba.
Luego de realizar la incisión sobre la cicatriz previa, se efectuó el intercambio del expansor por prótesis definitiva. Se utilizó un implante anatómico texturizado.
Las pacientes se controlaron periódicamente, sin costos extras, tras el intercambio del expansor o prótesis por implante definitivo, evaluando las posibles complicaciones asociadas a la cirugía.
Se evaluaron las siguientes complicaciones de la RM a corto plazo (60 días posteriores a la cirugía) tanto en el grupo de pacientes con LPT, como en las pacientes sin esta técnica de protección: seroma (acumulación de fluidos alrededor del implante mamario), hematoma (acumulación de sangre cerca del sitio de la cirugía), infección (cuando durante la cirugía las heridas se contaminan con microorganismos), ulceración y pérdida de prótesis definitiva (extracción de la prótesis por cualquiera de las razones anteriormente citadas).
2.5Análisis estadísticoConsiderando que la casuística es aún pequeña, pero similar a las reportadas en otros centros, se utilizaron técnicas descriptivas preliminares de distribución de frecuencia para las variables categóricas y medidas de tendencia central para las variables continuas.
El número de pacientes estudiados no permite la inferencia de significancia estadística, sin embargo, sus resultados muestran significancia clínica.
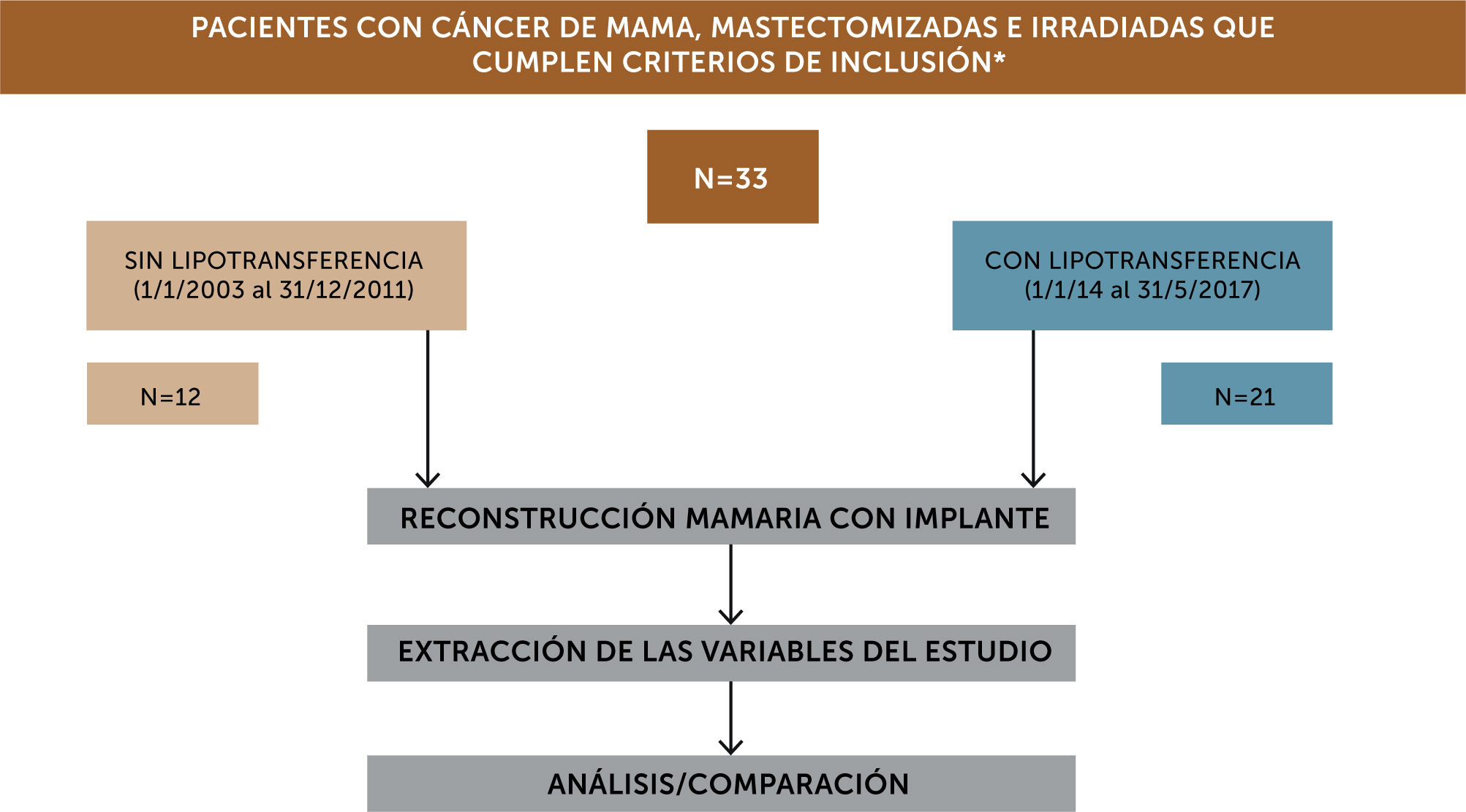
3ResultadosSe estudiaron un total de 33 pacientes, 21 con LPT y 12 sin esta técnica, en los períodos señalados.
En la fig. 1 se presenta el flujograma de inclusión de las pacientes en estudio, según el tipo de RM (con/sin LPT).
Flujograma de trabajo. *Se incluyeron pacientes pertenecientes al Registro del Centro Integral de la Mama (CIM) que cumplían con los siguientes criterios: pacientes tratadas con mastectomía uni o bilateral con radioterapia en las que se le realizó reconstrucción mamaria con expansor o prótesis definitiva y luego recambio de implante con o sin LPT previa. Se incluyeron pacientes que tuvieran un mínimo de tiempo de seguimiento de 60 días post-operatorios.
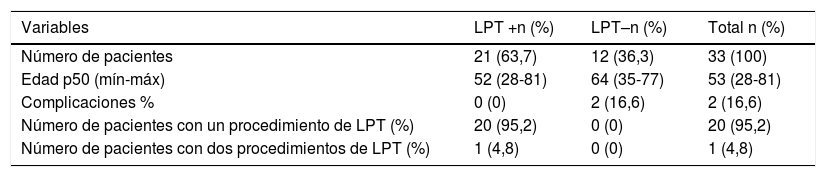
La mediana de edad de las pacientes irradiadas y tratadas con LPT fue 52 años (28-81), en comparación con los 64 años (35-77) en las 12 pacientes irradiadas sin LPT.
En los 60 días de seguimiento, no hubo pacientes con presencia de seroma, infección ni hematomas en ninguno de los dos grupos estudiados.
En las pacientes irradiadas sin LPT (n=12), se encontraron 2 casos de ulceración con pérdida del implante (16,6%), mientras que en las 21 pacientes tratadas con LPT no exhibieron ninguna complicación de este tipo (Tabla 1). En ambos casos las pacientes no intentaron nuevos procedimientos de reconstrucción.
Pacientes con reconstrucción mamaria inmediata con implante+radioterapia con lipotransferencia (LPT+) y sin lipotransferencia (LPT-)
| Variables | LPT +n (%) | LPT–n (%) | Total n (%) |
|---|---|---|---|
| Número de pacientes | 21 (63,7) | 12 (36,3) | 33 (100) |
| Edad p50 (mín-máx) | 52 (28-81) | 64 (35-77) | 53 (28-81) |
| Complicaciones % | 0 (0) | 2 (16,6) | 2 (16,6) |
| Número de pacientes con un procedimiento de LPT (%) | 20 (95,2) | 0 (0) | 20 (95,2) |
| Número de pacientes con dos procedimientos de LPT (%) | 1 (4,8) | 0 (0) | 1 (4,8) |
No hubo pérdidas y ninguna de las complicaciones estudiadas en las 21 pacientes irradiadas y reconstruidas tras el injerto graso, lo que corresponde a una tasa de éxito global del 100% de las tratadas con LPT, comparado con el 83,4% de éxito en las pacientes tratadas sin LPT (Tabla 2).
Complicaciones inmediatas en pacientes en las que se realizó RM inmediata con implante+radioterapia postmastectomía con lipotransferencia (LPT+) y sin lipotransferencia (LPT-)
| Variables | LPT +n (%) | LPT–n (%) | Total n (%) |
|---|---|---|---|
| Número de pacientes n (%) | 21 (63,6) | 12 (36,3) | 33 (100) |
| Infección n (%) | 0 (0) | 0 (0) | 0 (0) |
| Ulceración c/pérdida del implante n (%) | 0 (0) | 2 (16,6) | 2 (6,1) |
| Hematoma n (%) | 0 (0) | 0 (0) | 0 (0) |
| Seroma n (%) | 0 (0) | 0 (0) | 0 (0) |
No hubo complicaciones precoces, dentro de los dos primeros meses, derivadas del procedimiento de LPT en nuestra casuística.
4DiscusiónEl análisis de nuestra casuística de 21 pacientes irradiadas con implantes que recibieron injerto graso, es similar a los resultados de 16 pacientes presentados por el Ribuffo el al. del Cagliari University Hospital (CUH)26. Ambas tienen un éxito global del 100%, sin incidencia de seromas, infecciones, hematomas o pérdidas del implante en el corto plazo26.
En las pacientes irradiadas sin LPT, la incidencia de extrusión del implante en nuestro centro es levemente inferior a la presentada por Ribuffo (16,5% vs. 31,2%), sin embargo, el período de seguimiento de la cohorte italiana es superior (18 meses).
La terapia de radiación postmastectomía (RTPM) y la RM inmediata juegan roles importantes en el tratamiento de pacientes con cáncer de mama. La RTPM aumenta las tasas de curación para subgrupos con riesgos sustanciales de recurrencia locorregional27. La RM parece mejorar significativamente la calidad de vida28 y la RM inmediata reduce los efectos adversos psicosociales asociados a la mastectomía3,29.
Las recomendaciones para RTPM son realizadas después de la cirugía, en la mayoría de las pacientes, basados en los hallazgos anatomopatológicos.
La radioterapia es recomendada, habitualmente, en tumores mayores a 5cm de tamaño (independientemente del estado ganglionar) o con ≥4 ganglios linfáticos positivos (independientemente de tamaño del tumor primario). La RTPM reduce los riesgos de falla locorregional (LRF), cualquier recidiva y mortalidad por cáncer de mama en las pacientes con cáncer de mama T1-2 con uno a tres ganglios axilares positivos (con una disminución en la recidiva locorregional del 27% al 4% (p<0,001) y un aumento correspondiente en la supervivencia global del 48% al 57% (p=0,03)30. Sin embargo, algunos subconjuntos de estas pacientes es probable que tengan un riesgo tan bajo de LRF, que el beneficio absoluto de RTPM sea superado por sus potenciales toxicidades31. Las recomendaciones actuales, sugieren considerar fuertemente la RTPM en tumores menores de 5cm con uno a tres ganglios axilares positivos32.
Pueden afectar el control locorregional las características del paciente y del tumor, como por ejemplo la edad, grado histológico, invasión linfovascular, estado del receptor hormonal, número de ganglios axilares extirpados, y el estado de los márgenes quirúrgicos26.
Es un tema controvertido, el momento de la administración de la radioterapia. Varios estudios han indicado que cualquier retraso en la administración de la irradiación puede comprometer la capacidad de lograr el control de la enfermedad locorregional y la supervivencia global. Recomiendan que la RTPM no se retrase más de 6 meses después de la cirugía33.
Desafortunadamente, se encuentran documentados los pobres resultados a nivel de la RM en pacientes a las que se les realizó RTPM. En pacientes sometidas a RM basada en implantes, la RTPM aumenta las tasas de infecciones, contractura capsular, pérdida de implantes y falla reconstructiva general que requiere cirugías de revisión34,35.
En pacientes sometidas a reconstrucción con tejido autólogo, la RTPM se ha asociado con fibrosis, distorsión de la forma de la mama, pérdida de volumen y necrosis grasa36,37. Las pacientes reportaron resultados más bajos en cuanto a resultado estético, satisfacción general y calidad de vida en RM que reciben RTPM en comparación con quienes no la reciben38.
El grosor del tejido tanto muscular, como de la piel se modifica en gran medida tras realizar RM con expansores e implantes. Se produce progresivamente un adelgazamiento de los mismos productos de la presión producida por el expansor, especialmente en la zona de la cicatriz de la mastectomía39,40. Este daño se ve afectado, además, en gran medida, por la radioterapia postmastectomía. La distribución de dosis no es homogénea siendo las porciones medial y lateral de la mama junto con la zona del lecho operatorio marcada con clips en el procedimiento quirúrgico (donde se aplica a menudo una dosis adicional de 10Gy) las más afectadas. Todo esto genera mayor riesgo de ulceración y la consecuente extrusión del implante41.
Desde el año 2014 hemos comenzado a tratar las RM con expansores irradiados con LPT. El objetivo principal en la realización de la LPT es el tratamiento de los tejidos irradiados mejorando el grosor de los tejidos y la calidad de los mismos. También se utiliza para restaurar el/los defectos en el contorno de la mama producidos por el procedimiento quirúrgico, para liberar las cicatrices de la mama, para aumentar el grosor del tejido subcutáneo y para mejorar la cobertura de los implantes.
Las matrices acelulares (ADM) también se han propuesto como un medio para reducir las complicaciones de las RM con prótesis en el contexto de la RT postoperatoria3. Se utilizan para obtener mejores resultados estéticos al cubrir el polo inferolateral del implante y para prevenir la contractura capsular. Una revisión sistemática encontró que el uso de ADM no predispone a las pacientes irradiadas a tasas más altas de complicaciones cuando se usan para ayudar a la reconstrucción mamaria protésica42.
El protocolo utilizado tiene como objetivo reparar el daño del tejido irradiado disminuyendo el riesgo de ulceración y así evitar la consecuencia más temida en la RM: la extrusión del implante. La LPT de protección regenera los tejidos, aumenta el espesor y calidad de los mismos disminuyendo las complicaciones ocasionadas por la RTPM. Existe escasa literatura que confirme los beneficios de la lipotransferencia de protección15,26.
Los resultados de nuestra casuística, evidencian diferencias clínicamente significativas en la incidencia de complicaciones con o sin el uso de LPT en pacientes con RM sometidas a radioterapia. Será necesario un mayor número de estudios con mayor número de pacientes que permitan confirmar la evidencia de estos hallazgos.
5ConclusionLa RM ha experimentado numerosos cambios durante las últimas décadas. Para muchas de las mujeres que no son candidatas a reconstrucción con tejido autólogo o para aquellas que no desean someterse a procedimientos quirúrgicos con colgajos, la RM inmediata con expansor y posterior colocación de prótesis definitiva, se puede recomendar con seguridad y con resultados exitosos, incluso cuando la paciente ha sido irradiada, con la utilización de LPT.
Basado en la evidencia disponible, la LPT es una poderosa herramienta que ofrece una técnica sencilla, con baja morbilidad del sitio donante y con muy pocas complicaciones en la zona de LPT, que se relacionan generalmente con la colocación excesiva e inadecuada del injerto graso.
En nuestro trabajo se observa una menor frecuencia de pérdida del implante, en las pacientes con cáncer de mama y reconstrucción mamaria con expansores irradiadas, con preparación de LPT previa a la RM con prótesis definitiva, comparado con aquellas que no tuvieron preparación con LPT.
Observamos que la LPT de protección contribuye a mejorar la calidad y el grosor del tejido irradiado disminuyendo a 0% la pérdida de la prótesis definitiva, en RM de pacientes irradiadas.
En pacientes con cáncer de mama y reconstrucción con expansor que van a requerir radioterapia, es necesario una lipotransferencia previa de protección para disminuir, la más importante de las complicaciones, que es la pérdida del implante.
Se requiere seguimiento adicional y un mayor número de pacientes para evaluar los beneficios y las complicaciones a largo plazo.
Declaración de conflicto de interésNinguno de los autores tiene conflicto de interés o ha recibido financiamiento por la publicación de este artículo