El diagnóstico de cáncer es de los más temidos, genera en el afectado que su entorno un sinnúmero de sentimientos negativos que repercute fuertemente en el ámbito personal, social y laboral. El dolor sigue siendo un síntoma no deseado y frecuente en estos pacientes dado principalmente por invasión tumoral y por lo mismo, su repercusión emocional es diferente a la producida por el dolor crónico no oncológico. Resulta imprescindible reconocerlo, valorarlo y tipificarlo para iniciar la terapia. La Escala Analgésica de la OMS es un método efectivo para tratar el dolor de acuerdo a su intensidad, con unas reglas sencillas y dejando margen para atender las características particulares del paciente. El 10% de pacientes que no responde o que lo hace a costa de marcados efectos colaterales, puede beneficiarse de procedimientos invasivos. Paralelamente algunas terapias complementarias han ido ganando sustento para ser usadas en este contexto. Finalmente debe hacerse hincapié en un enfoque multidisciplinario de este problema, con una comunicación efectiva y poniendo en el centro de nuestro quehacer el bienestar del paciente y de su entorno más cercano.
The diagnosis of cancer is one of the most feared, generating in the patient and his environment a host of negative feelings that strongly affects the personal, social and professional life. Pain remains a common and unwanted symptom mainly due to tumor invasion. It is essential to recognize, value and typify pain before the start of therapy. The WHO analgesic ladder is an effective method to treat pain according to their intensity, with simple rules and leaving room to meet the patient’s individual characteristics. The 10% of non-responders may benefit from invasive procedures. Concomitantly some complementary therapies have been gaining support for his use in this field. Finally it should be emphasized an multidisciplinary approach to this problem, with effective communication and where the center of our work is the welfare of the patient and their immediate environment.
Cáncer es de los diagnósticos que más temen los pacientes escuchar. Además de la ansiedad que genera por tratarse de una enfermedad potencialmente letal, la asociación con un dolor inevitable e intratable genera angustia y sufrimiento en el paciente y su entorno. Junto a la enfermedad propiamente tal, el dolor altera la actividad social, el sueño y la capacidad de disfrutar de la vida. El afectado se ve preso de la desesperación, depresión y resignación, que en muchos casos actúa como amplificador del dolor (1).
En Chile y según cifras recientes (2), existe un aumento de la morbimortalidad por enfermedades no transmisibles, tanto agudas como crónicas, siendo el cáncer la segunda causa de muerte, en el grupo de enfermedades crónicas, con una tasa observada de 133,7 por 100.000 habitantes. Es responsable de casi un cuarto del total de muertes.
Según edad, la gran mayoría de las muertes por tumores malignos afecta a adultos y adultos mayores. Respecto al número de casos nuevos, Chile presenta una tasa bruta de incidencia de 217 por 100.000, estimándose como principales localizaciones próstata, estómago, piel no melanoma, aparato respiratorio, colon y testículo en el caso de los hombres y mama, piel no melanoma, vesícula biliar, cuello uterino, estómago y colon en el caso de las mujeres.
Pese a los avances de la medicina, el dolor sigue siendo un síntoma habitual en el paciente oncológico, cuya frecuencia e intensidad varía de acuerdo al tipo de tumor y al estadio en que se encuentra. Entre un 30 a 40% de los pacientes tiene dolor al momento del diagnóstico y en estadios avanzados su frecuencia se eleva a 60 -100% (3), existiendo cierto tipo de tumores asociados con mayor prevalencia de dolor severo, tales como el de próstata, esófago, ginecológico y colorectal.
EtiopatogeniaHay múltiples causas que pueden generar dolor y que pueden dividirse en:
- 1.
Dolor por invasión tumoral, en especial infiltrando tejido nervioso 60-90%.
- 2.
Dolor secundario al tratamiento (polineuropatía, mucositis, necrosis ósea aséptica, dermatitis post RT, etc.) 10-25%.
- 3.
Dolor asociado al tumor (síndrome paraneoplásico, infección micótica, neuralgia postherpética, trombosis venosa, entre otros.) 5-20%.
- 4.
Dolor por enfermedad coincidente (migraña, lumbago, entre otros) 3-10%.
En un mismo período de tiempo el paciente puede tener más de una sola causa o lugar afectado.
A nivel celular, las células tumorales liberan prostaglandinas, citoquinas y factores de crecimiento que atraen células inflamatorias y activan nociceptores. Si el tumor es de rápido crecimiento, se comprimen nervios o bien son lesionados por hipoperfusión o por proteolísis directa. En el caso de las metástasis óseas, el dolor se genera por liberación de prostaglandinas, bradiquinina, sustancia P e histamina junto con la ocupación del espacio por el tumor y la presión ejercida sobre el periostio. Por otro lado, el aumento de la actividad osteoclástica genera disminución del pH, con la activación de nociceptores sensibles a éstos cambios (4).
Barreras que impiden un adecuado manejo del dolorEn el paciente con cáncer, el dolor no resuelto es consecuencia de muchos factores y pueden desglosarse en:
aDel paciente y entorno directo:Miedo a volverse adictos a los analgésicos, creer que los efectos colaterales serán peores que el dolor, desesperanza de poder controlar el dolor, distraer al oncólogo de tratar el cáncer, asociar dolor con progresión de enfermedad, miedo a que los analgésicos potentes son inyectables.
bDel médico:Inadecuada valoración del dolor, renuencia a prescribir opioides.
cDel proceso comunicativo:En un estudio observacional de la interacción entre 10 oncólogos y sus 240 pacientes, 2/3 de la conversación era sobre aspectos médicos o técnicos y solo en un 23% respecto a calidad de vida. Y si bien se habló de dolor en el 75% de las entrevistas, este ocupó sólo un 4% de la comunicación en el caso del médico y un 9,2% en el caso del paciente (5, 6).
Valoración y tipos del dolorUna inadecuada valoración del dolor del paciente es el mayor impedimento para una buena analgesia. El dolor, para ser tratado, debe ser identificado y valorado, lo que requiere de una buena evaluación.
Existen varios métodos confiables y validados para establecer la severidad o intensidad del dolor, entre ellos las escalas numéricas del 0 a 10, las escalas verbales descriptivas -ninguno, leve, moderado, severo, insoportable- y las visuales análogas (0 a 3 leve, 4 a 6 moderado, 7 a 10 severo). Otro tipo de instrumentos se preocupan de algunas dimensiones asociadas a la experiencia dolorosa, como la actividad física, emociones, grado de mejoría y satisfacción con el tratamiento, etc.
Junto con la medición de la intensidad dolorosa, es imperativo establecer el (los) tipo(s) de dolor para guiar la terapia (7):
• Dolor Nociceptivo:Causado por la estimulación de nociceptores. Existen dos tipos:
Somático: Constante, intenso, localizado, opresivo y/o punzante. Se origina en nociceptores de piel, músculo o hueso.
Visceral: Constante, sordo, mal localizado; causado por daño o presión sobre órganos y vísceras.
• Dolor Neuropático:Quemante, punzante, como agujas. Causado por lesión del sistema nervioso periférico o central.
• Dolor Mixto:Con características de dolor nociceptivo y neuropático; es el tipo de dolor más frecuente en el paciente oncológico.
La evaluación del dolor debe ser hecha en forma seriada para establecer su evolución y modificar la terapia en función de ella. Lugar, intensidad, duración, tipo de dolor, respuesta a analgésicos usados, terapia coadyuvante y enfermedades asociadas deben ser analizados y documentados (8).
Hay factores específicos del paciente que deben considerarse por influir la percepción del dolor, y por tanto, dificultar el diagnóstico. Edad, enfermedades asociadas, estado psicológico, factores étnicos, religiosos y culturales deben tenerse en cuenta. Los adultos mayores comparados con los jóvenes, por ejemplo, expresan menos dolor. La ansiedad, cansancio o el insomnio disminuyen el umbral doloroso.
Escala analgesica de la organización mundial de la salud (oms)El año 1981, cuando el oncólogo Jan Stjernwärd se hizo cargo del departamento de oncología de la OMS y fijo como una de sus metas combatir el dolor por cáncer, existía un ambiente de temor ante las consecuencias que podía conllevar el uso de opioides. Stjernwärd organizó el año 82 un encuentro en Milán de expertos en dolor que se repitió dos años más tarde en Ginebra. Entre otros participaron K. Foley de Nueva York, R. Twycross de Londres y John Bonica. El grupo puso a la morfina como eje del manejo del dolor oncológico. Como resultado, el año 1986 se publicó el folleto “Cancer pain relief” que se reeditó en 1990 y 1996 casi sin cambios (9).
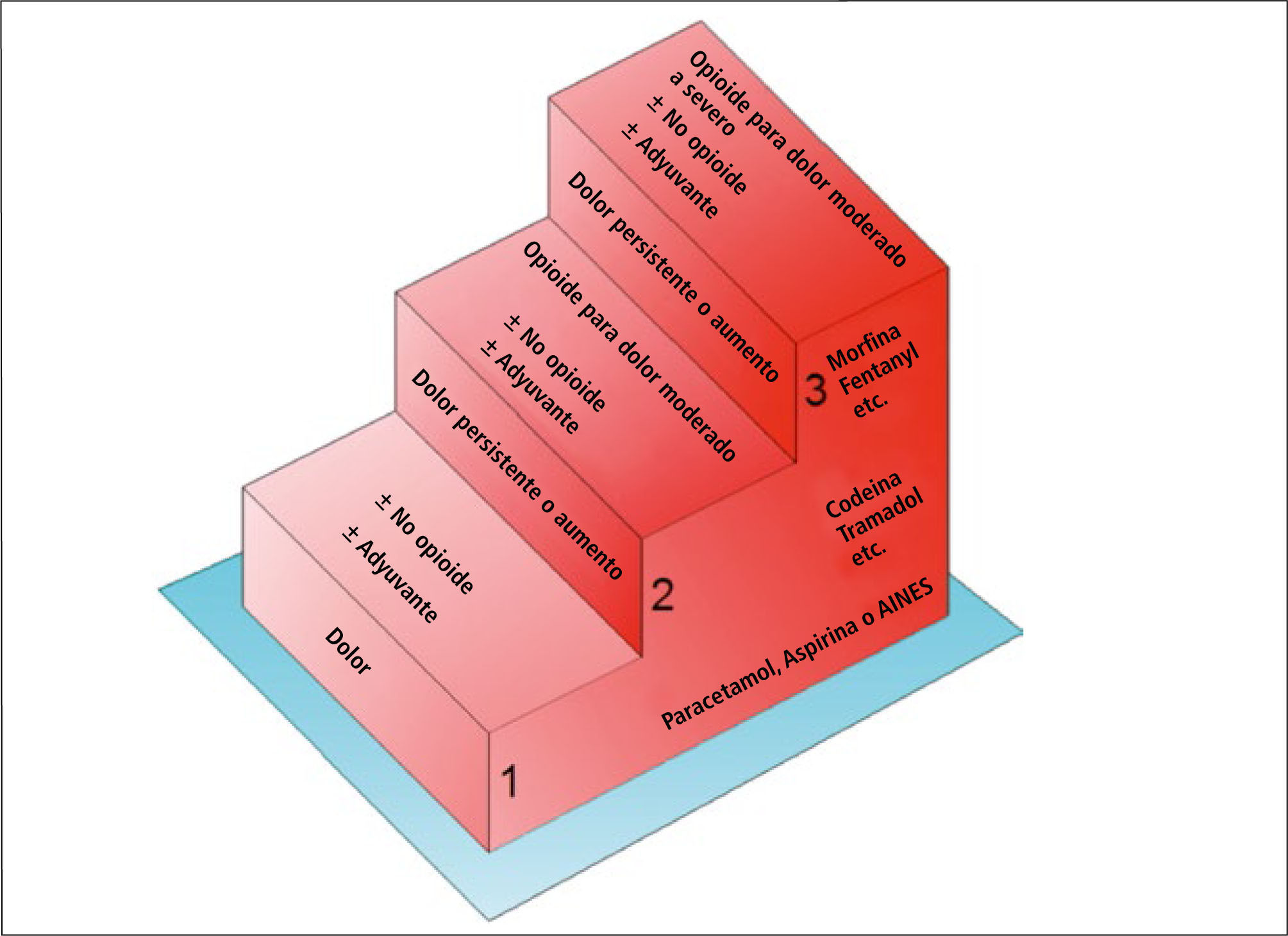
El Método Escalonado de la OMS para Aliviar el Dolor (Figura 1) es una manera simple, poco costosa y efectiva para controlar el dolor oncológico y que, bien llevado, puede otorgar alivio del dolor al 75 a 90% de los pacientes con cáncer. Su aplicación se basa más en la intensidad del dolor que en el mecanismo subyacente o el estadio de la enfermedad y puede ser sintetizado en cinco frases:
“por vía oral”:Siempre que sea posible hay que administrar los analgésicos vía oral, teniendo presente vías alternativas en circunstancias especiales tales como disfagia, vómitos incoercibles, entre otros.
“A la hora exacta”:Los analgésicos deben ser administrados en intervalos regulares de tiempo y de acuerdo a sus características farmacológicas, para evitar períodos sin o con menor actividad antiálgica.
“En forma escalonada”:El Escalón 1 involucra el uso de no-opioides. El Escalón 2 involucra agregar un opioide débil si el dolor persiste. El Escalón 3 sustituye el opioide débil por uno que permita manejar un dolor moderado a severo. En algunos casos, y en cualquier Escalón, se usan medicamentos coadyuvantes.
“para el individuo”:La dosis adecuada es aquella que suprima el dolor con los mínimos efectos colaterales. Considerar la respuesta pasada a determinado opioide por parte del paciente o el efecto techo de alguno de ellos.
“Atendiendo los detalles”:El régimen analgésico debe ser esbozado cuidadosamente al paciente y monitorizado en el tiempo. El medicamento correcto, por la vía, en la dosis e intervalo correctos. Evitar el dolor persistente y el dolor irruptivo, monitorizar efectos colaterales e indeseados.
La escala analgésica de la OMS hace ver las necesidades individuales del paciente. De ésta forma es muy importante seguir el esquema antes mencionado, pero con la debida flexibilidad según las características del paciente y la respuesta al tratamiento. Por ejemplo, en ocasiones nos encontramos con un enfermo con dolor importante EVA > 6/10; en este caso el sentido común indica que se debe tratar de entrada con opioides de la escala 2 o 3.
Para lograr adherencia al tratamiento, los medicamentos deben ser fácilmente aplicables interfiriendo lo menos posible la vida diaria; con pautas escritas entendibles por el paciente y su entorno y procurando que la noche sea un período de real descanso
Si la fuente del dolor se relaciona directamente con el tumor y no hay o hay mala respuesta a los analgésicos, entonces habrá que considerar la cirugía, quimio- o radioterapia. Si el dolor está asociado a infección o trombosis venosa profunda habrá que usar antibióticos o agentes antitrombóticos. Estos ejemplos indirectamente dan a entender la necesidad de una comunicación efectiva entre los miembros del equipo multidisciplinario.
Hay que recordar que los antiinflamatorios no esteroidales, salicilatos y paracetamol del primer peldaño del esquema analgésico de la OMS cumplen un rol muy importante en el dolor oncológico pero deben ser usados con precaución en el paciente con compromiso hematológico, renal o hepático (6).
Los peldaños 2 y 3 recomiendan el uso de opioides de potencia creciente y a todo nivel se preconiza agregar un coadyuvante – medicamento originalmente usado con una indicación que no era dolor pero que ha demostrado utilidad en el manejo de éste-. Es el caso del uso de antiepilépticos o antidepresivos en dolor neuropático, bifosfonatos en caso de dolor óseo y los corticoesteroides en caso de compresión medular o de raíces nerviosas.
Los opioides potentes comparten entre ellos efectos colaterales en general idénticos. No tiene sentido cambiar de opioide para tratar un dolor que no es sensible a éste. Los efectos colaterales más frecuentes de los opioides son náuseas, sedación y enlentecimiento de la motilidad gastrointestinal. Mientras que la constipación requiere medidas a permanencia, las náuseas en general se presentan en los primeros días de uso solamente.
Si la terapia con opioides se realiza con controles periódicos, modificando la analgesia de acuerdo a la respuesta del paciente, el riesgo de una dependencia psíquica es rara. En cambio, una dependencia física sí es frecuente, por lo que debe evitarse su discontinuación brusca (9).
Rotación de opioidesEs el cambio hacia otro opioide cuando: (a) las dosis necesarias para manejar el dolor se van incrementando y se está obligado a acortar los intervalos de administración entre ellas o bien (b) los efectos colaterales se hacen intolerables por parte del paciente.
Mediante tablas se establece la equipotencia entre el opioide administrado con el que se quiere utilizar. Luego se inicia la administración del nuevo opioide a razón de 2/3 de la dosis equipotente calculada modificándola de acuerdo a la respuesta (10).
Dolor irruptivo o también llamado disruptivoEl dolor irruptivo o disruptivo (breakthrough pain) puede definirse como una exacerbación transitoria del dolor basal experimentado por el paciente, que se encontraba estable y adecuadamente controlado o bien puede ser un dolor de etiología diferente del basal.
Su prevalencia oscila entre el 40 y 80%. Su inicio habitual es súbito, con un tiempo promedio para llegar a su máxima intensidad de 3 minutos y una duración total de 30 minutos.
Pueden distinguirse tres variedades: incidental, espontáneo o de final de dosis. El dolor incidental se refiere a aquel que se relaciona con actividades físicas determinadas. El dolor irruptivo de final de dosis se relaciona con factores farmacocinéticos, donde el dolor basal se exacerba antes de la siguiente dosis de analgésico.
Elementos claves para una adecuada valoración incluyen conocer la hora y la frecuencia con que aparecen, tiempo hasta llegar a la máxima intensidad y duración total del episodio, si se asocia a determinada actividad y el tipo de analgésicos que se esta usando. La evaluación física es un componente esencial para establecer su naturaleza e incluye el examen físico tradicional junto a valorar la extensión del cáncer y examinar el área afectada por el dolor.
Para su manejo se recomienda usar un opioide oral de liberación inmediata en una dosis que corresponda aproximadamente al 10% de la dosis total diaria de morfina o su equivalente. La evidencia demuestra una gran dispersión en la dosis efectiva, pero este método tiene la ventaja de su seguridad (11).
En el mercado internacional existe un amplio abanico de preparaciones transmucosas de opioides para manejar este cuadro. Posiblemente la estricta reglamentación nacional para el ingreso de estas sustancias junto a la falta de entusiasmo de las empresas farmacéuticas ha impedido contar con este tipo de medicamentos. Por tanto y en la práctica lo habitual es indicar un antiinflamatorio no esteroidal de absorción sublingual como el ketorolaco y/o morfina subcutánea o metadona, presentación ampolla, vía oral y en la dosis calculada según el esquema mencionado en el párrafo anterior.
Procedimientos invasivosAproximadamente un 10% de los pacientes con dolor oncológico no responden bien a las medidas analgésicas estandarizadas o bien presentan marcados efectos indeseables y por tanto, requieren de opciones intervencionistas de tratamiento, que algunos han definido como “un cuarto escalón” dentro del esquema analgésico de la OMS.
A grandes rasgos podemos dividirlos en no-destructivos y destructivos. En el primer caso se encuentran los bloqueos con agentes farmacológicos reversibles como anestésico local, corticoides, opioides u otros que se colocan por única vez en forma de bolos en algún tegumento o bien a través de catéteres sobre nervios periféricos o autonómicos o cercano a la médula.
Los bloqueos únicos con anéstesico local y corticoide de depósito pueden aliviar total o parcialmente el dolor sobre un área o segmento determinado por un tiempo limitado. Si bien se carece de ensayos controlados, parecen ser de utilidad en el dolor postoperatorio o en casos de dolor agudo, como la fractura patológica de una costilla (12).
Los catéteres puestos en el espacio epidural o espinal permiten otorgar una buena calidad de analgesia con menos efectos colaterales que en el caso de agentes sistémicos. Si el pronóstico de sobrevida no va más allá de 3 meses, se recomienda el uso de un catéter tunelizado con un reservorio por donde se administra el o los agentes seleccionados en forma intermitente. Si la sobrevida supera los 3 a 6 meses, muchos recomiendan un sistema intraespinal asociado a una bomba implantable. Respecto a la elección del analgésico, por lo general se usa morfina sola en el caso del dolor nociceptivo, mientras que para dolores de tipo neuropático o mixto se prefiere la combinación de anestésico local con un opioide. Nuevamente se hace necesario recalcar que estos procedimientos no están exentos de complicaciones y en un paciente desnutrido, inmunodeprimido, con alteraciones de la coagulación, etc., éstas adquieren una importancia mayor. En países en que los conflictos médico-legales se ha extendido, no sólo se explica y documenta en detalle el procedimiento y su(s) beneficio(s), sino que explícitamente se hace mención de riesgos, cuidados, controles e incluso costos implicados y que paciente o el responsable legal debe aceptar.
Una opción por lo general más agresiva la constituyen los procedimientos invasivos destructivos, en los cuales se usan agentes líquidos en dosis tóxicas (alcohol al 50-90%; fenol 5-12%), calor (mediante radiofrecuencia) o frío (crioneurolisis). Mientras que el uso de líquidos permite un efecto extendido, la aplicación de calor limita las eventuales lesiones a tejidos adyacentes. Ejemplos son la fenolización de uno o varios nervios intercostales en caso de fracturas patológicas o del nervio de Arnold, en caso de tumores de cabeza o cuello con compromiso de éste. Procedimientos de mayor envergadura y que requieren experiencia y apoyo imaginológico son el bloqueo neurolítico del ganglio celíaco en el caso del cáncer de cabeza de páncreas; el cervical superior en tumores de cabeza y cuello; el ganglio hipogástrico superior en caso de tumores malignos de la pelvis.
Su efecto puede durar semanas y en la gran mayoría de los casos permite disminuir los analgésicos asociados en, al menos, una fracción significativa. La indicación debe estar sólidamente fundamentada por la posibilidad de complicaciones, algunas de ellas severas (13).
Terapias complementarias y dolor oncológicoEn los últimos años hemos sido testigos del auge del uso de terapias complementarias en diferentes patologías y existe cada vez más evidencia que apoya su uso en el tratamiento del cáncer. Acupuntura, terapias energéticas, masaje y musicoterapia tienen en este momento estudios con nivel de evidencia de al menos I y II en pacientes con cáncer en el manejo de síntomas tales como dolor, náuseas, vómitos y ansiedad. De hecho, dos entidades, dentro de las cuales está la Sociedad Americana del Cáncer, recomiendan que pacientes con dolor igual o mayor de 4/10 puntos después de ajustar la terapia analgésica, reciban tratamiento no farmacológico asociado (14).
Respecto a la acupuntura, área por la cual tengo especial interés, hay un número creciente de ensayos clínicos que han añadido evidencia para su uso en el manejo de síntomas en el paciente oncológico entre los que se cuenta el dolor. La omalgia después de disecciones cervicales y las artralgias asociadas al uso de inhibidores de aromatasa en pacientes con cáncer de mama, son dos ejemplos. Además ha mostrado un excelente nivel de seguridad: Un estudio estimó una tasa de eventos adversos menores de 14 por 10.000 sesiones y de eventos severos de 0,05 por 10.000 sesiones.
Interesantes resultan las recomendaciones de un grupo dedicado al tema respecto a cuando NO usar acupuntura en pacientes oncológicos: (a) recuento de neutrófilos menor a 500/µL; (b) recuento de plaquetas menor a 25.000/µL; (c) estado alterado de conciencia; (d) arritmias cardíacas severas y (e) en otras condiciones médicas de inestabilidad. Piden además la aprobación del oncólogo tratante antes de iniciar la terapia (15).
EpilogoEl paciente con cáncer tiene una alta probabilidad de presentar dolor en algún momento. Dolor, sufrimiento, desesperanza, ansiedad, rabia, depresión, resignación se vuelven componentes importantes desde donde él se relaciona con el mundo. Por lo tanto es primordial, que el médico tratante comprenda la fragilidad del paciente y tratar de establecer un contacto cercano y sincero. Este acercamiento permitirá mitigar la incertidumbre de su pronóstico, calmar la ansiedad y lograr adherencia a las medidas terapéuticas.
Desde un punto de vista más pragmático y centrado en el dolor, es importante establecer causa, tipo e intensidad del dolor (o los dolores) antes de comenzar el tratamiento. Debe darse un enfoque multidisciplinario a su dolencia que incluya al oncólogo, algiólogo, psicólogo, kinesiólogo, psiquiatra, paliativista, fisiatra, etc. Hay que chequear y documentar los resultados y efectos colaterales. Hay que dar preferen cia a la terapia vía oral y ofrecer procedimientos intervencionistas en casos seleccionados. La analgesia debe ser dada por horario y tener previsto el tipo y dosis de medicaciones en caso de dolor irruptivo. El método escalonado de analgesia de la OMS el esquema básico de tratamiento, pero con la suficiente plasticidad para adecuarlo al paciente en particular.
El autor declara no tener conflictos de interés, con relación a este artículo.