Este artículo cubre los diferentes aspectos de la medicina transfusional moderna, una especialidad en su propio mérito. Se discuten elementos de la cadena de abastecimiento de sangre, incluyendo la colecta, el tamizaje y la preparación de componentes, factores que afectan el manejo de inventario e influencias futuras en el abastecimiento de sangre.
Un suministro de sangre seguro y suficiente depende del reclutamiento y retención de donantes voluntarios que tengan bajo riesgo de infección por agentes en la sangre y que se comprometan a donar sangre de manera regular. Las pruebas de tamizaje y la preparación de componentes actuales garantizan un alto grado de seguridad del receptor, pero no pueden detectar a todos los donantes infectados. Los enfoques modernos de pruebas pre-transfusionales en donantes y receptores, los efectos adversos de la transfusión y la hemovigilancia -así como los métodos para reducir el uso inapropiado de la sangre y las alternativas a la transfusión- son también tratados aquí.
This article covers the different aspects of modern transfusion medicine, a specialty in its own right. Elements of the blood supply chain, including collection, testing and component preparation, influences on the demand for blood and blood components, factors affecting blood inventory management and future influences on the blood supply are discussed.
A safe and sufficient blood supply depends upon the recruitment and retention of volunteers with a low risk of infection with blood-borne agents, who have the commitment to regular blood donations. Current screening tests and methods of component preparation assure a high degree of safety for blood transfusion recipients, but cannot detect all infected donors. Modern approaches to pre= transfusion testing of donors and recipients, adverse effects of blood transfusion and haemovigilance, as well as approaches to reduce the inappropriate use of blood and alternatives to blood transfusion are also dealt with.
La medicina transfusional (MT) actual es una especialidad en sí, distinta de la hematología y abarca marketing, epidemiologia, microbiología, biología molecular, inmunología, histocompatibilidad e inmunogénetica, estadística, entre otros. Comprende no sólo la transfusión de componentes sanguíneos, sino que también la terapia celular y de tejidos y la inmunoterapia. Depende de laboratorios cada vez más sofisticados para minimizar los riesgos de transmisión de enfermedades infecciosas y maximizar la compatibilidad entre donante y receptor, de las células y los tejidos, como también para establecer las causas de reacciones transfusionales adversas y evitar su aparición y/o recurrencia.
En el mundo desarrollado, la provisión de componentes sanguíneos y tejidos seguros y los laboratorios de referencia se basan en servicios nacionales de sangre con centros de sangre (CS) que procesan anualmente cientos de miles de unidades de sangre. Un Programa Nacional, con un Plan Anual asegura uniformidad en suficiencia y calidad para todas las unidades de medicina transfusional (UMTs) de los hospitales donde se practica la medicina transfusional.
La provisión de sangre se inicia con el reclutamiento, selección y fidelización de donantes, la colecta y el procesamiento de la sangre para la obtención de componentes sanguíneos, el aseguramiento de la calidad biológica del producto recolectado, incluyendo su conservación, almacenamiento y transporte. Las decisiones frente a las necesidades transfusionales o de trasplante del paciente, las pruebas pre-transfusionales en la sangre de donante y receptor, el uso apropiado de la sangre y tejidos, las alternativas posibles, las consecuencias de la transfusión y la vigilancia post- transfusional, son también parte de la medicina transfusional.
Marco regulatorioPercepciones de riesgo crecientes del público y los medios y litigios sobre la seguridad de la sangre, especialmente en lo referente a transmisión de infecciones, han resultado en un marco regulatorio, convertido en ley, muy estricto para la medicina transfusional europea, fuera de proporción comparado con otras especialidades médicas.
PRODUCCIÓN, ABASTECIMIENTO Y DEMANDA DE SANGRE Y SUS COMPONENTESSatisfacer la demanda de sangre y sus componentes es la meta primaria de los servicios de sangre, realizable a través de buena planificación nacional anual, con donantes voluntarios altruistas, idealmente regulares, manejo efectivo de inventarios, el uso apropiado de la sangre y el conocimiento clínico de las alternativas a la transfusión. La cadena de abastecimiento de sangre incluye al donante voluntario de sangre, los servicios de sangre con Centros de Sangre, las unidades de medicina transfusional del hospital (UMTs) con sus laboratorios y especialistas en medicina transfusional, la prescripción médica, la administración de los componentes y la vigilancia del receptor del componente sanguíneo.
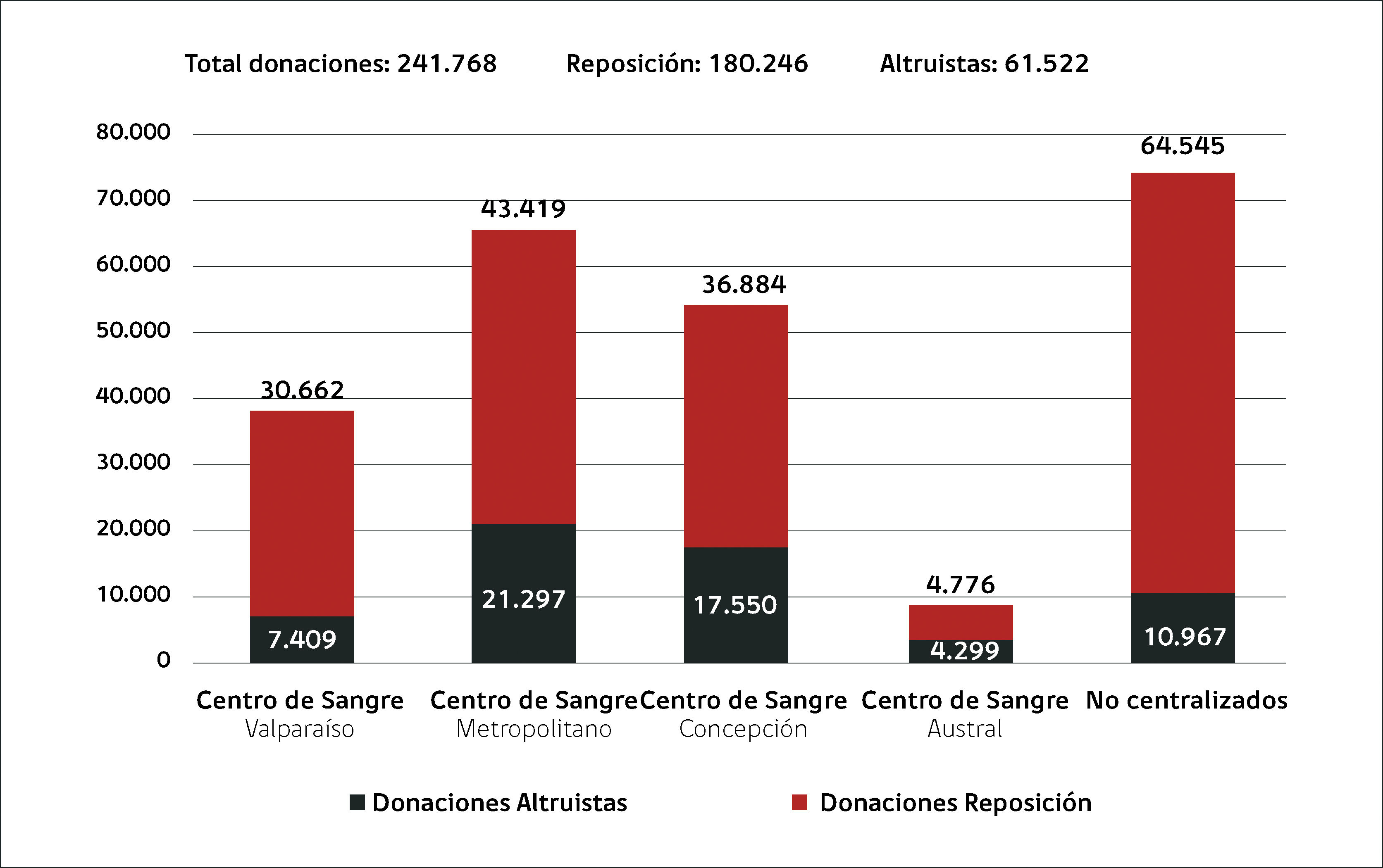
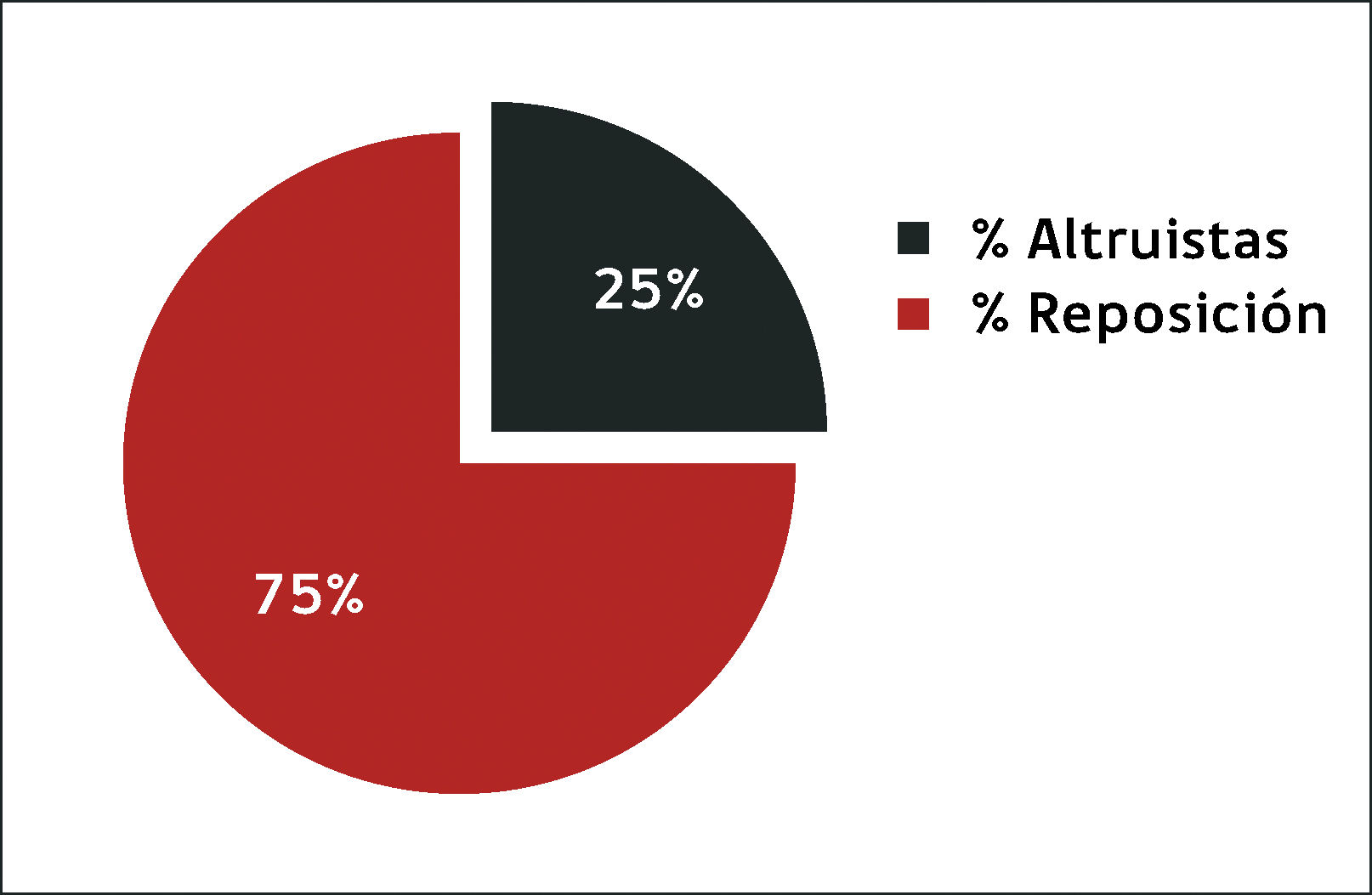
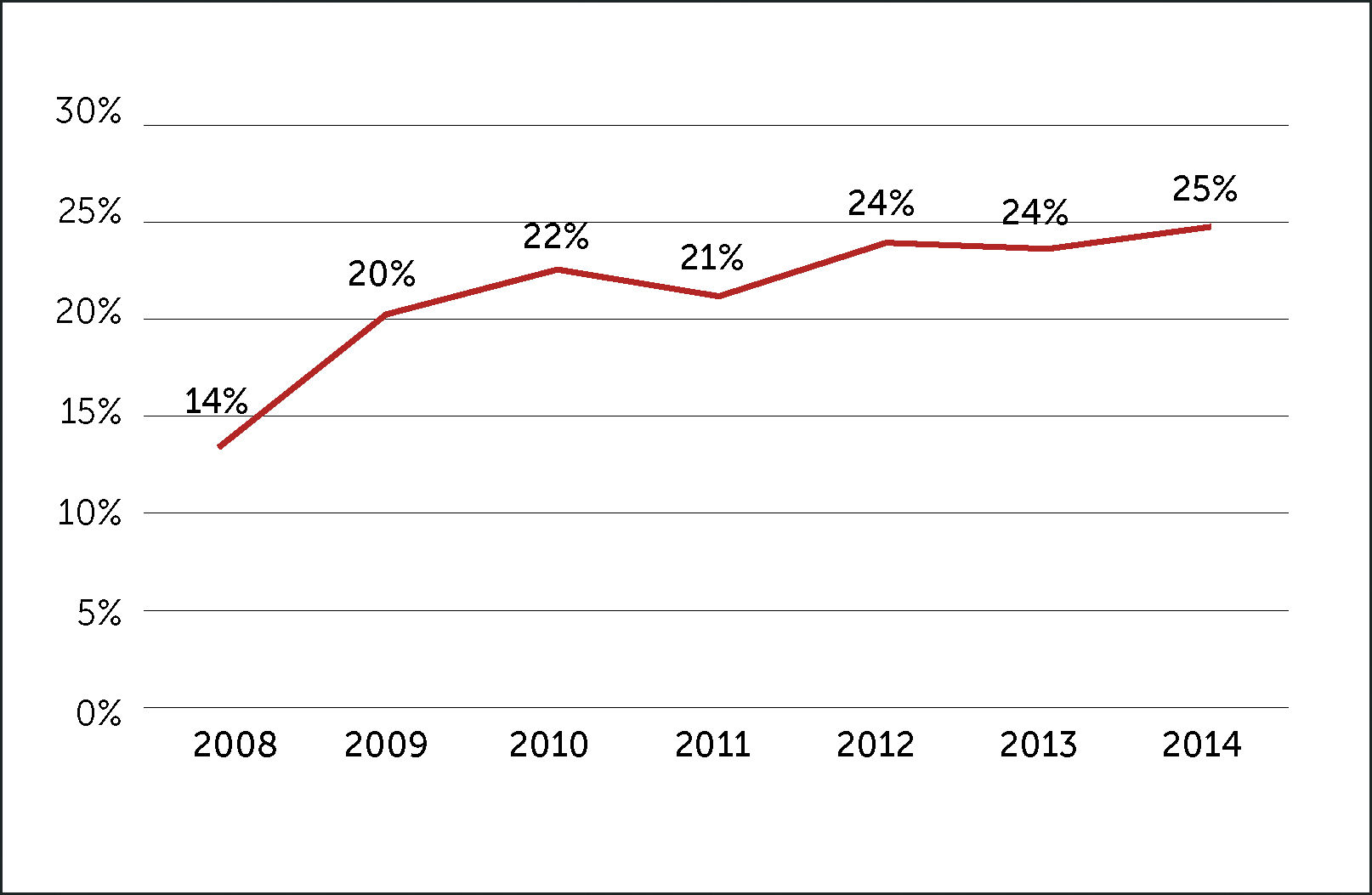
La suficiencia en sangre segura de un país depende de donantes altruistas; los requerimientos varían en cada país de acuerdo a las condiciones de salud de la población y desarrollo de la medicina. En Europa occidental y Norteamérica la tasa de donación, 100% voluntaria, en gran parte repetida, es sobre 35 por mil habitantes, lo que suple en gran parte la demanda y hace que la sangre sea significativamente más segura que en Latinoamérica. En Inglaterra se suple el 100% de la demanda de todos los componentes con 38 donaciones anuales por mil habitantes. Sin embargo, la tasa de donación no es la adecuada en la mayoría de los países de Latinoamérica; en Chile al año 2014 la demanda no fue suplida; se estima una tasa de 17 donaciones por mil habitantes sumando los donantes del sistema público y privado; menos del 25% de los donantes son voluntarios y una minoría regulares (Figuras 1, 2 y 3).
Distribución de donaciones en el sistema público centralizado y no centralizado en chile, año 2014
El total de donaciones fue de 242.549. Si se suma a esta cifra aproximadamente 50.000 unidades colectadas en el sector privado, la tasa nacional de donación es de 17 unidades por mil habitantes.
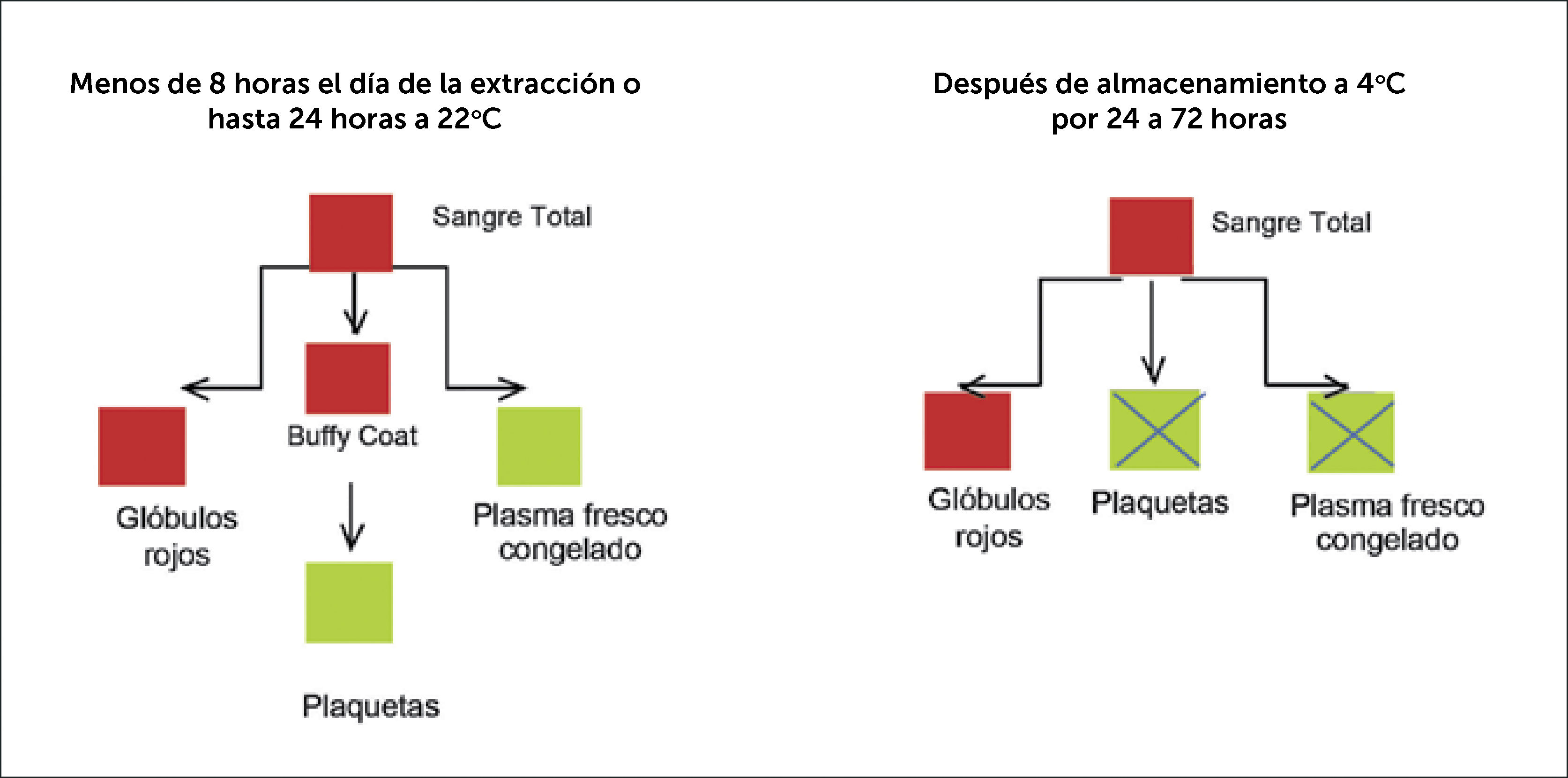
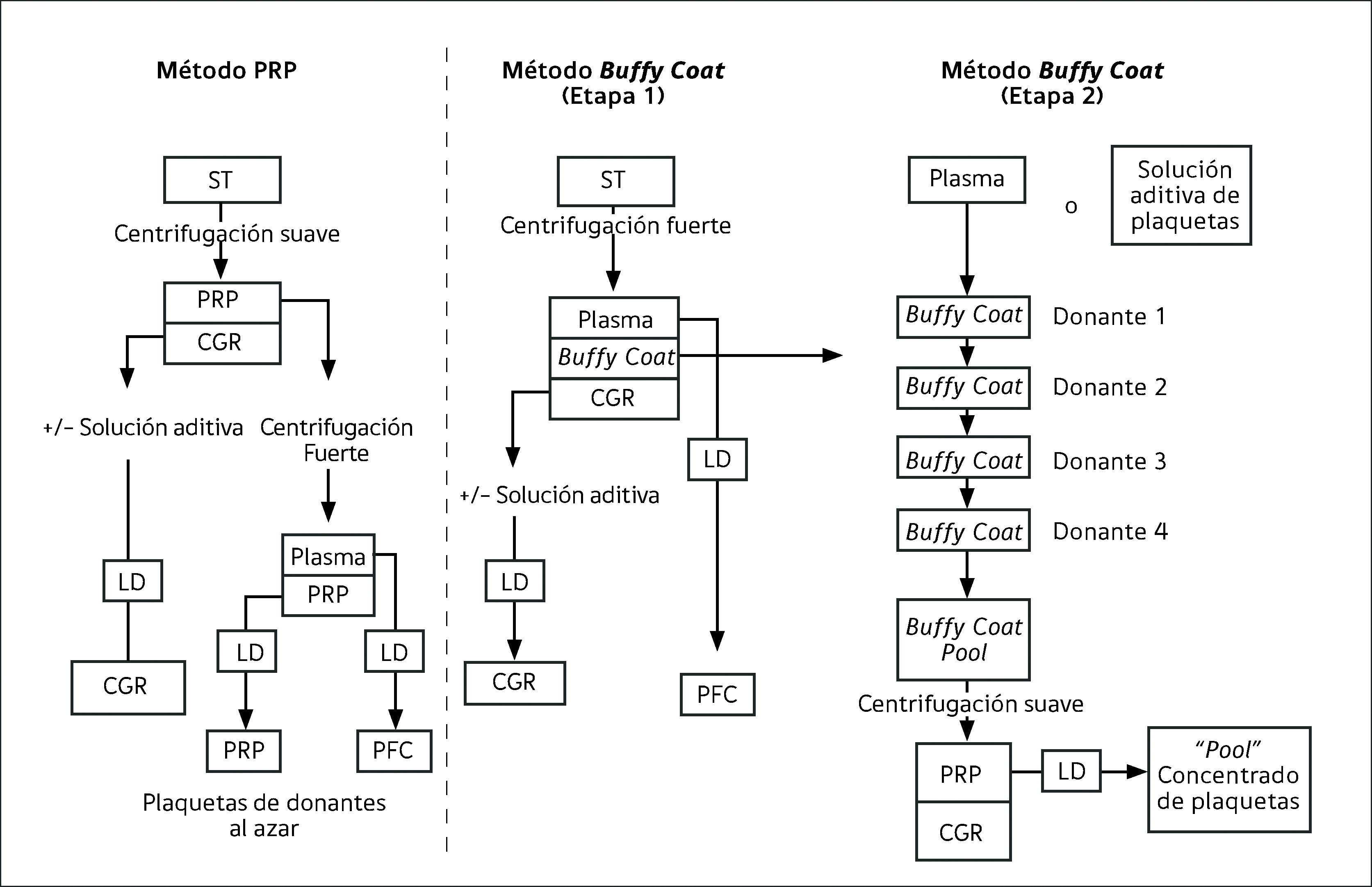
Las donaciones de sangre total se procesan en concentrados eritrocitarios y, de acuerdo con los requerimientos y tiempo de almacenamiento a diferentes temperaturas, en concentrados plaquetarios, plasma fresco congelado y crioprecipitados (Figuras 4, 5 y 6). En el Reino Unido todas las donaciones se colectan en bolsas con salidas en sus partes superior e inferior («top and bottom») lo que permite separar, por centrifugación, el buffy-coat, conteniendo los leucocitos y plaquetas, de los eritrocitos en la parte inferior y el plasma en la parte superior. En Chile, solo una parte de las donaciones se procesan con este método de superior calidad. Gran parte del plasma en el mundo desarrollado, se congela rápidamente y se somete a fraccionamiento industrial para la obtención de factores de coagulación, inmunoglobulinas y albumina.
Preparación de componentes sanguíneos por centrifugación en bolsas múltiples
(ST= sangre total; LD= leucodepleción; PRP= plasma rico en plaquetas; CGR= concentrado de glóbulos rojos; El método de Buffy Coat requiere bolsas especiales «top and bottom» y equipos dedicados, produciendo concentrados de plaquetas leucorreducidos aún antes de la filtración que los leucodepleta aún más. El método PRP es de menor rendimiento, los concentrados plaquetarios son de inferior calidad y contienen más leucocitos (este método se usa en muchos hospitales que aún procesan componentes en Chile). Los Centros de Sangre producen pools de plaquetas por el método buffy-coat (gentileza Dra. Rebecca Cardigan).
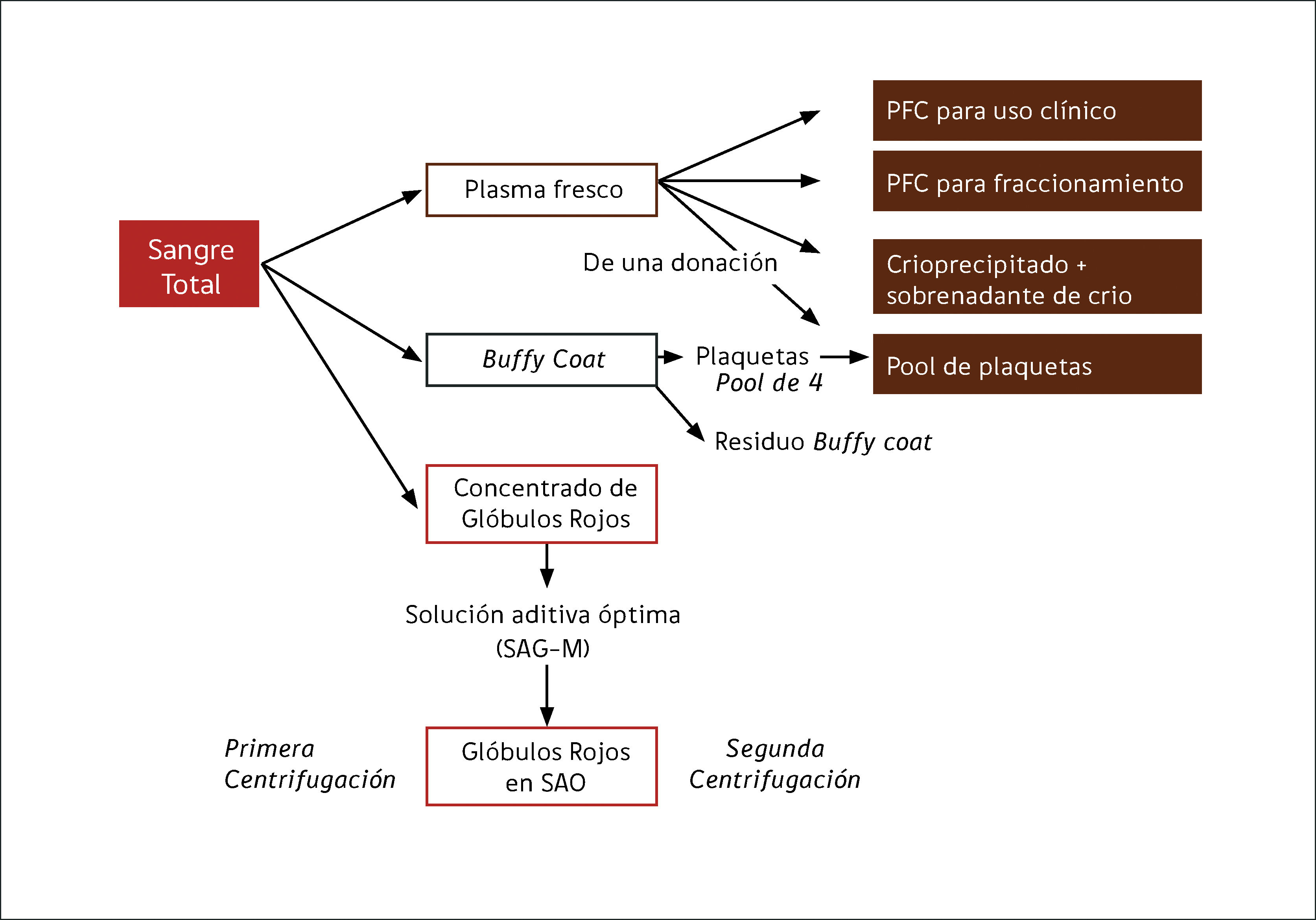
Diagrama de representación de la preparación de componentes a partir de sangre total por método «Top and Bottom» o «Buffy coat»
Los ítems en las celdas representan los componentes finales. Idealmente, el PFC para resuspender el pool de plaquetas, debería ser de donantes masculinos. Tanto los glóbulos rojos como el pool de plaquetas se pueden leucodepletar por filtración.
PFC: Plasma Fresco Congelado.
SAO: Solución Aditiva Óptima.
El concentrado eritrocitario, sin buffy-coat, se suspende en una solución aditiva para mantener la viabilidad de los glóbulos rojos hasta un volumen final de 220 a 340ml; puede almacenarse por un período de 35 a 42 días entre 2 - 4°C. En el RU estos concentrados se leucodepletan por filtración.
Las plaquetas pueden obtenerse de sangre total, ya sea en forma individual o por mezcla (pooles) de buffycoats de cuatro donaciones (Figuras 5 y 6), o por aféresis de donante único. La dosis en adultos es 3×1011. En Inglaterra, aproximadamente el 50% se obtiene por aféresis y el 50% de pooles. Las plaquetas por aféresis se transfunden a pacientes trombocitopénicos candidatos a trasplante de células troncales para reducir el riesgo de inmunización a HLA y también a receptores pediátricos, para reducir el riesgo de infecciones transmitidas por transfusión. Los donantes tipificados para HLA y antígenos plaquetarios pueden ser usados para pacientes con refractariedad inmunológica a las plaquetas y para transfusiones intrauterinas o neonatales en trombocitopenia aloinmune. Las plaquetas se almacenan en plasma (o medio para suspensión de plaquetas) entre 20° a 24°C, hasta por 5 días, en agitadores especiales. El corto tiempo de almacenaje se debe a la pérdida de viabilidad y al potencial de contaminación bacteriana, lo que hace difícil su abastecimiento en feriados y vacaciones. En Europa, los tests para detectar contaminación bacteriana previa a su utilización y la leucodepleción hacen posible la extensión del almacenaje hasta siete días.
El plasma fresco congelado (PFC) puede almacenarse por dos años a <30°C; puede ser sometido a inactivación viral con azul de metileno, solvente detergente, u otros. En el mundo se usa demasiado PFC a pesar de escasas indicaciones basadas en la evidencia.
Los crioprecipitados se preparan a partir de PFC descongelado lentamente a 4°C; en un precipitado quedan, factor VIII:C, factor von Willebrand, fibrinógeno, fibronectina y factor XIII, el que se recongela y almacena a −30°C por dos años máximo. Cada unidad debe contener 70 UI de Factor VIII:C y 140mg de fibrinógeno. Se usan principalmente como fuente de fibrinógeno en CID, falla hepática severa e hipofibrinogenemia. La dosis estándar de adultos es 10 unidades.
Es difícil predecir la demanda en componentes sanguíneos, ya que varía en los diferentes países y es consecuente a los cambios demográficos, políticas de salud y a las estrategias de conservación y uso. En Inglaterra ha disminuido la demanda de 2.5 millones de unidades de glóbulos rojos (GR) a 2 millones en los últimos 10 a 15 años, lo que puede atribuirse a las circulares de «Mejor Transfusión de Sangre» (ver más adelante), al establecimiento del Plan Nacional de Manejo de Inventarios de Sangre (PMES) y al aumento del costo de los componentes sanguíneos.
Manejo de inventarios o de stockLa sangre y sus componentes deben ser un bien nacional para los sectores público y privado. Una política de stock, basada en un servicio nacional, compartiendo unidades entre los diferentes Centros, asegura un abastecimiento justo para todos los enfermos. Para evitar la caducidad y el desperdicio, se requiere equilibrar las necesidades de glóbulos rojos (GRs) para satisfacer la demanda contra el exceso de unidades almacenadas. Si los Centros de Sangre tienen altos niveles de stock, los hospitales recibirán glóbulos rojos de corta vida útil, lo que da al hospital menos tiempo para que las unidades puedan ser usadas, aumentando la caducidad. Los hospitales también requieren equilibrar sus niveles de inventarios para tener suficientes GRs para satisfacer su demanda, evitando la caducidad. Las políticas de laboratorio pueden tener impacto sobre el inventario; un período de reserva de 24 horas posterior a la prueba cruzada es superior a períodos más largos de reserva de 48 a 72 horas. Aún más, los hospitales que han reemplazado la prueba cruzada serológica con pruebas electrónicas (ver más adelante), tienen menor demanda de GRs. El manejo efectivo de inventario de un hospital incluye un período de retención de unidades cruzadas de 24 horas máximo, el uso de crossmatch electrónico y mantención y rotación de un número apropiado de glóbulos rojos de los diferentes grupos ABO y Rh. El manejo de stock de plaquetas es aún más complejo que el de GRs por su corto periodo de almacenaje.
Además del desperdicio por caducidad, pueden ocurrir pérdidas en toda la cadena de abastecimiento por diversas razones, como donaciones incompletas, tamizajes serológicos repetidamente reactivos (menores en donantes altruistas repetidos), sellados defectuosos, etc. Las razones de pérdidas en el hospital incluyen unidades dejadas fuera de temperatura adecuada por más de 30 minutos o fallas en el refrigerador.
En Chile, así como en Latinoamérica, todavía no se ha logrado un adecuado abastecimiento y manejo de inventarios. No hay un Servicio Nacional de Sangre con un inventario nacional de componentes sanguíneos y no están dadas las condiciones de infraestructura para aumentar la donación voluntaria regular a nivel país (Figuras 1, 2 y 3). Se requiere: aumentar la tasa de donación por mil habitantes acorde a la demanda, aumentar los donantes altruistas repetidos (actualmente 75% proviene de donantes familiares o de reposición), gestión de fichero de donantes fidelizados para adaptar la oferta a la demanda por grupo sanguíneo, disminuir las pérdidas por caducidad y las pérdidas de producción por marcadores microbiológicos positivos. Al analizar el stock crítico (de tres días) de GRs O positivo en Chile (según información DEIS del Ministerio de Salud del año 2014) se observa que de las 45 UMTs públicas, 21 tuvieron de 50 a 100 días del año bajo el stock crítico.
El futuro de la suficiencia en sangre segura depende de un Programa Nacional basado en el donante altruista regular, de facilitar el acceso a la donación, con colectas móviles y casas del donante con buena y pronta atención, de correctas acciones de marketing, dando confianza a la población de que su sangre no será usada con fines de lucro.
Aunque se han producido hemoglobinas recombinantes, perfluorocarbonos y cultivos in vitro de eritrocitos en pequeña escala, no hay sustitutos viables y eficientes de eritrocitos ni plaquetas, por lo que un adecuado abastecimiento de componentes sanguíneos, con manejo de stock a nivel nacional, asegurará la provisión de sangre para todos los pacientes que la necesiten. Por el momento, el uso apropiado de la sangre es el mejor «sustituto virtual» (ver más adelante).
EL DONANTE DE SANGRE Y LA SEGURIDAD DEL DONANTE Y RECEPTORUn suministro de sangre seguro y suficiente depende del reclutamiento y retención de donantes voluntarios altruistas que tengan bajo riesgo de infección y que se comprometan a donar sangre en forma regular. Las sofisticadas pruebas de sangre actuales no pueden detectar todos los donantes infectados, debido al periodo de ventana microbiológica entre la infección y la aparición de marcadores en la sangre.
Selección del donanteLa selección del donante tiene dos propósitos: proteger al donante de cualquier daño y al receptor de cualquier efecto patológico de la transfusión. A los donantes potenciales se les debe proporcionar suficiente información para darles la oportunidad de autoexcluirse; se hace una evaluación visual y se les pregunta sobre salud, historial médico y medicamentos y conductas de riesgo para adquirir infecciones transmitidas por la transfusión (ITTs) por medio de un cuestionario y de una entrevista con un profesional. La confidencialidad es clave para alentar a los donantes a respuestas veraces. Todos los donantes deben firmar un consentimiento informado previo a cada donación.
Los donantes deben encontrarse en buen estado de salud, estar dentro del límite de edad permitido y cumplir con los requisitos mínimos de peso, volumen de donación (<13% del volumen sanguíneo), hemoglobina, y frecuencia de donación. Los límites de peso minimizan el riesgo de reacciones vasovagales. Los niveles de hemoglobina exigidos aseguran: la cantidad adecuada de hemoglobina para el receptor y que el donante no quede anémico. De acuerdo a los resultados del estado de salud, el donante potencial puede ser excluido en forma permanente (por ej. enfermedad cardiovascular) o temporal (por ej. anemia).
Efectos adversos de la donaciónEl problema más común es el hematoma o dolor en el brazo en el sitio de punción. En general solo se requieren medidas locales a menos que se complique con infección o daño de un nervio. Uno de cada 75 donantes se siente mareado durante o poco después de la donación y un 15% de éstos sufre un síncope; estos síntomas son más comunes en mujeres jóvenes o donantes de primera vez.
Seguridad del receptor (Tabla 1)La consideración más importante al seleccionar donantes es evitar la transmisión de agentes infecciosos. El donante altruista contribuye a la seguridad del paciente, ya que no hay incentivos para ocultar detalles personales relevantes o de la historia clínica. Los donantes regulares constituyen un factor adicional, comprobado, de seguridad. Es muy importante excluir a los individuos cuyo comportamiento esté asociado con alto riesgo de adquirir el virus de la inmunodeficiencia humana, hepatitis B, o hepatitis C; a todos los donantes se les pregunta sobre estos temas tan personales cada vez que acuden a donar.
Seguridad del receptor de componentes sanguíneos
| Medidas para proteger al receptor | en uso en el RU | en Chile |
|---|---|---|
| Donantes 100% voluntarios | Sí | No |
| Selección de donantes | Sí | Sí |
| Exclusión de donantes | Sí | Sí |
| Limpieza rigurosa, controlada del antebrazo | Sí | Sí (en los CS) |
| Desviación de los primeros 20–30mL sangre | Sí | Sí (en los CS) |
| Tamizaje microbiológico | Sí | Sí |
| Pruebas inmunohematológicas (ABO, Rh, etc) | Sí | Sí (menos completas) |
| Leucodepleción universal | Sí | No |
| Inactivación viral del PFC (SD o AM) | Sí | No |
| Monitoreo de contaminación bacteriana de plaquetas | Sí | No |
| Inactivación fotoquímica de patógenos | No | No |
Medidas para proteger al receptor en uso en el Reino Unido y en Chile. (CS = Centro de Sangre).
En muchos países desarrollados, los componentes sanguíneos se someten a leucodepleción (Figura 5) con filtros especiales para reducir el riesgo remoto de transmisión de vECJ, remover virus asociados a leucocitos (CMV, HTLV) y evitar reacciones febriles severas o el desarrollo de anticuerpos contra HLA.
Pruebas de laboratorio en donaciones:A.- Inmunohematológicas. De rutina se determina el grupo ABO y RhD en cada ocasión. En el RU todas las donaciones se tipifican para los otros antígenos Rh (C, E, c, e) y K. Un número limitado de unidades se tipifica para otros antígenos como Fy, Kk, MNSs para tener stock listo para pacientes aloimnmunizados y así evitar retrasos en la transfusión. Los donantes de plaquetas por aféresis son tipificados para HLA y antígenos plaquetarios HPA por técnicas moleculares.
B.- Microbiológicas. La mayoría de las infecciones transmisibles por transfusión que presentan un riesgo para el paciente se caracterizan por infección crónica persistente inaparente. Es por esto que un donante de sangre que parece saludable puede ser transmisor de una infección.
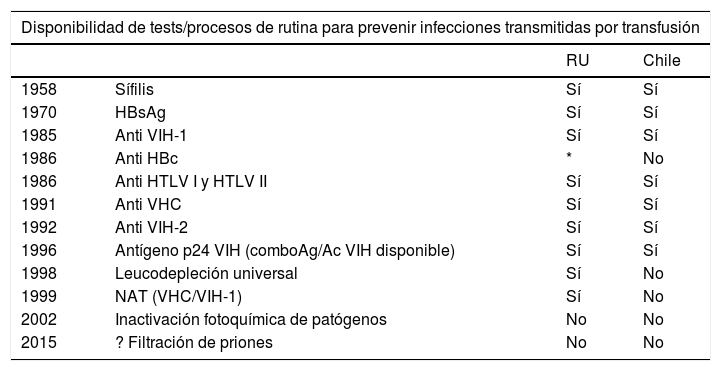
Aunque en el mundo desarrollado, el riesgo de infecciones transmitidas por transfusión nunca ha sido tan bajo, las exigencias de seguridad a través de selección rigurosa de los donantes y exámenes adicionales, cada vez más complejos y caros, nunca han sido tan grandes (Tabla 2).
Tests y procesos para prevenir las infecciones transmitidas por transfusión (ITTs)
| Disponibilidad de tests/procesos de rutina para prevenir infecciones transmitidas por transfusión | |||
|---|---|---|---|
| RU | Chile | ||
| 1958 | Sífilis | Sí | Sí |
| 1970 | HBsAg | Sí | Sí |
| 1985 | Anti VIH-1 | Sí | Sí |
| 1986 | Anti HBc | * | No |
| 1986 | Anti HTLV I y HTLV II | Sí | Sí |
| 1991 | Anti VHC | Sí | Sí |
| 1992 | Anti VIH-2 | Sí | Sí |
| 1996 | Antígeno p24 VIH (comboAg/Ac VIH disponible) | Sí | Sí |
| 1998 | Leucodepleción universal | Sí | No |
| 1999 | NAT (VHC/VIH-1) | Sí | No |
| 2002 | Inactivación fotoquímica de patógenos | No | No |
| 2015 | ? Filtración de priones | No | No |
Ab = antibody (anticuerpo); Ag = antigen (antigen); HBsAg = hepatitis B surface antigen (antígeno de superficie de la hepatitis B); Anti HIV-1 = human immunodeficiency virus antibody (anti-VIH-1); Anti HBc = hepatitis B core antibody (anti- hepatitis B core); HTLVI = human T-cell lymphotropic virus antibody; Anti HCV = hepatitis C virus antibody (anti- VHC); Anti HIV-2 = human immunodeficiency virus antibodies (anti-VIH-2); HIV p24 = human immunodeficiency virus p24 antigen (antígeno p24 del VIH); NAT = nucleic acid testing (prueba de ácidos nucleicos o pruebas mole-culares).
Tests para Malaria y Chagas en algunos países, dependiendo del riesgo.
En Chile, tests para Chagas es obligatorio.
Actualmente en Chile son mandatorios los tests para detectar:
- •
Infección por VIH con pruebas de detección combinadas antígeno/anticuerpo
- •
Detección de Antígeno de superficie de VHB
- •
Infección por VHC con pruebas que detectan anticuerpos
- •
Infección por treponema, a través de detección de anticuerpos específicos
- •
Infección por HTLV, por medio de prueba de anticuerpos
- •
Detección de anticuerpos contra T. cruzi o Chagas
Todas estas pruebas obligatorias deben llevarse a cabo en todas las donaciones, utilizando reactivos estándares validados a nivel nacional, con control total del proceso. Es posible que a algunos donantes y bajo circunstancias especiales se les realicen tests suplementarios. En Inglaterra, la necesidad de estos tests se decide tomando en cuenta la epidemiología de una infección y el riesgo que presenta la población de donantes. Por ejemplo, las pruebas de anti HBc se llevan a cabo en los donantes que tienen mayor riesgo por reciente exposición a VHB, por ejemplo por piercing o tatuajes. También se indican pruebas adicionales en donantes seleccionados para evidenciar anticuerpos contra la malaria, como marcador de una exposición previa o de una posible infección actual. Existen otras infecciones que pueden presentar un riesgo especial para solo un subconjunto de receptores, por ej. el citomegalovirus (CMV), que representa un riesgo para los pacientes inmunodeprimidos.
A pesar de una selección cuidadosa del donante y de las pruebas de tamizaje serológico, el riesgo de infección, aunque mucho menor, todavía existe y es mayor en países como Chile donde la minoría de los donantes son altruistas, con mínimo porcentaje de donantes repetidos. Esto hace que el riesgo de donaciones en el periodo de ventana epidemiológica sea mayor. En el 2014 en el RU, con tests moleculares de mucha mayor sensibilidad, la positividad para VIH y VHB fue de 1 en 167.272 donaciones y 1 en 31.978 respectivamente. En Chile, estas cifras fueron mucho más altas; 1 en 2.197 donaciones y 1 en 12.996 donaciones, respectivamente en los tres Centros de Sangre. El riesgo de infecciones virales transmitidas por transfusión en Chile es alarmante, dada la alta seropositividad para VIH.
PRÁCTICA TRANSFUSIONAL DE LABORATORIO Y CLÍNICATodos los hospitales deben tener Comités Hospitalarios de Transfusión (CHT), responsables de la transfusión frente a la Dirección del hospital, con representación multidisciplinaria de las áreas clínicas, de laboratorio y de gestión, responsables de la implementación de las guías y normas, de las auditorías y la capacitación de todo el personal involucrado en la transfusión. El equipo de transfusión, compuesto del médico especialista en Medicina Transfusional, el especialista en transfusión (tecnólogo médico o enfermera) y el jefe técnico de la UMT, desempeñan las actividades diarias para lograr los objetivos del CHT.
En el RU las directivas europeas y la ley no solo regulan a los Centros de Sangre, sino también a la práctica transfusional hospitalaria. El director de cada hospital debe rendir un informe anual de cumplimiento con las Regulaciones sobre Seguridad y Calidad de la Sangre. Las UMTs son inspeccionadas por la Autoridad Regulatoria y en el caso de deficiencias serias, pueden ser suspendidas o clausuradas. Los requisitos de las UMTs pueden verse en la Tabla 3.
Requisitos esenciales de las UMTs en el Reino Unido
| Requisitos esenciales de las UMTs en el Reino Unido |
|---|
| Un sistema comprensivo de manejo de calidad basados en los principios de «buena práctica», con requisitos estrictos para el almacenamiento y distribución de componentes, con énfasis en manejo de la «cadena fría». |
| Trazabilidad del destino final de cada unidad de componentes sanguíneo (incluyendo el nombre e identificación del paciente), con registros mantenidos por 30 años. |
| Educación y capacitación de todo el personal involucrado en transfusión, con mantención de registros de capacitación. |
| Hemovigilancia, con informes de todos los eventos adversos de la transfusión. |
| Si la UMT realiza procesamiento de componentes o irradiación, deberá postular a una licencia igual que los centros de sangre. |
UTMs: Unidades de Medicina Transfuncional.
Esto se hace con equipos automatizados, con control computarizado de la identificación de muestras y transferencia de resultados.
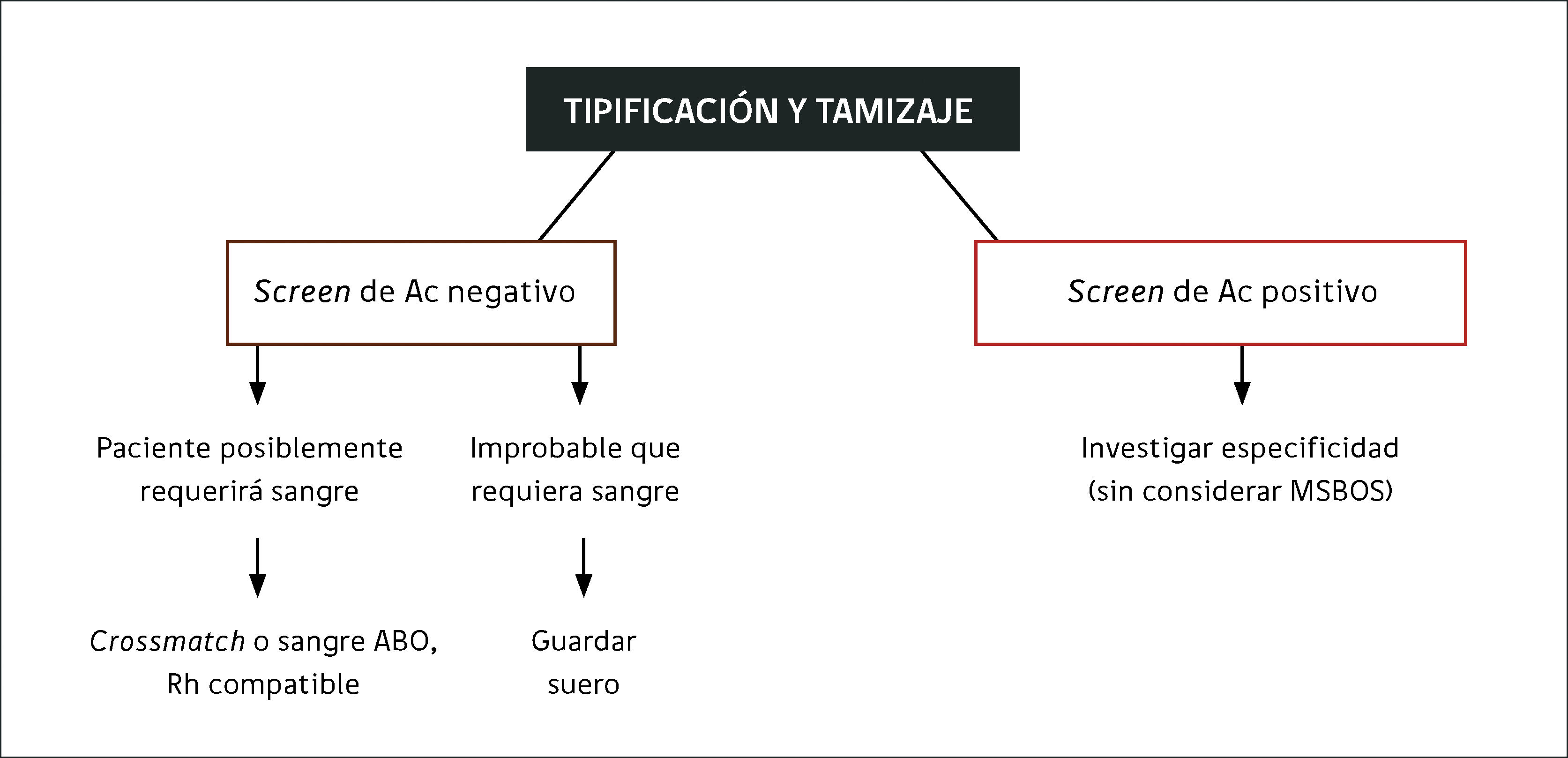
El grupo ABO y RhD de todos los receptores potenciales debe ser determinado debido a la presencia universal de anticuerpos ABO en todos aquellos que carecen del antígeno correspondiente y a la alta inmunogenicidad del antígeno D. Debido a la posibilidad de errores, se recomienda que a todo paciente nuevo se le tome y examine una segunda muestra pre-transfusional.
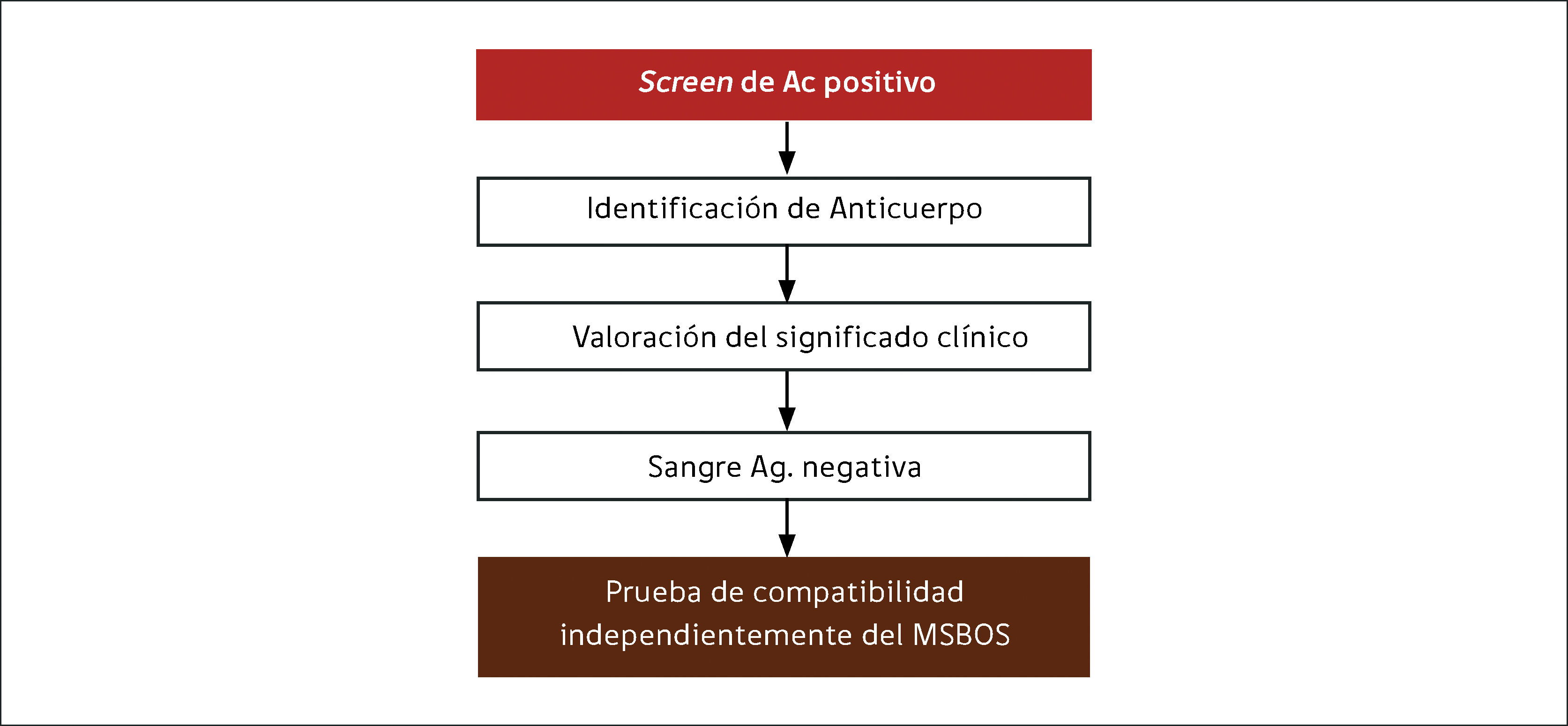
Las dos muestras de plasma del paciente deben ser investigadas por separado, para detectar anticuerpos de significado clínico por la prueba de antiglobulina indirecta. Si el resultado es negativo, se proveen GRs ABO y RhD compatibles, según necesidad. Si el resultado es positivo, se identifica el anticuerpo/s con un panel de 8 – 10 células o más, para eventualmente proveer GRs negativos para el antígeno/s correspondiente para la prueba de compatibilidad o crossmatch por técnica de antiglobulina indirecta. Para todas las mujeres en edad fértil se recomiendan GRs K-negativos para evitar la formación de anti-K y eventual enfermedad hemolítica del recién nacido.
Una política de «group and screen», usada en combinación con un esquema «MSBOS» (maximum surgical blood ordering schedule - MSBOS) puede reducir el número de pruebas cruzadas (crossmatch), ahorrando tiempo y disminuyendo el número de unidades reservadas. Cada hospital debe acordar su propio MSBOS entre la UMT, los cirujanos y anestesistas en el CHT. El MSBOS se basa en una comparación retrospectiva del número de unidades sometidas a crossmatch y el número efectivamente transfundido para cada procedimiento de cirugía electiva. Así se puede acordar cuáles son las operaciones que podrán requerir sangre, para tener stocks adecuados en caso necesario.
Cross-match electrónicoVarios hospitales con sistemas electrónicos e inmunohematológicos robustos y códigos de barra para identificación de pacientes, muestras y componentes sanguíneos, usan esta modalidad. Al paciente se le efectúan dos «group and screen» en ocasiones separadas y, si no hay anticuerpos y no ha habido transfusiones en ese periodo, se despacha sangre ABO y Rh compatible directamente por computadora. Esto disminuye la retención innecesaria de sangre y el trabajo innecesario en la UMT.
COMPLICACIONES TRANSFUSIONALES, RECONOCIMIENTO Y MANEJOLas complicaciones de la transfusión se clasifican en agudas y retardadas, inmunológicas y no inmunológicas (Tabla 4).
Complicaciones Transfusionales
| AGUDAS O INMEDIATAS (MINUTOS/ HORAS) |
|---|
| NO INMUNOLÓGICAS• Bacterianas: sepsis aguda o shock endotóxico (esp. por plaquetas)• Hipotermia (transfusión masiva)• Hipocalcemia (neonatos y transfusión masiva)• Sobrecarga circulatoria asociada a la transfusión (TACO) |
| INMUNOLÓGICAS• Reacciones transfusionales febriles no hemolíticas, RTFNH (esp. por leucocitos)• Reacciones hemolíticas transfusionales (RHT) agudas: Intravasculares (IgM); Extravasculares (IgG)• Reacciones alérgicas (urticaria)• Reacciones anafilácticas• Daño pulmonar agudo relacionado con la transfusión (TRALI) |
| TARDÍAS (DÍAS O AÑOS) |
|---|
| NO INMUNOLÓGICAS (INFECCIOSAS)• VIH, VHB, VHC, CMV• Otras: Chagas, Parvovirus B19, VHA, VHE, WNV, sífilis, dengue, malaria, brucelosis, vECJ. |
| INMUNOLÓGICAS• Reacciones hemolíticas retardadas (r. anamnéstica)• Púrpura post-transfusional (PPT)• Enfermedad de injerto contra huésped asociada a la transfusión (EICH-AT) |
La hemolisis inmediata intravascular es la más peligrosa, asociada con la activación completa del complemento por anticuerpos IgM y prácticamente siempre se debe a incompatibilidad ABO (anti-AB, anti-A o anti-B presentes en el receptor).
Las razones por las que la incompatibilidad ABO es tan importante son:
- 1)
Anti-AB, anti-A y anti-B son los anticuerpos de grupos sanguíneos más frecuentes.
- 2)
En casos de error de administración de sangre, la posibilidad de incompatibilidad es alta, dada la frecuencia de los grupos sanguíneos.
- 3)
Los anticuerpos son IgM de amplio rango térmico, activadores de complemento, especialmente potentes en gente joven de grupo O.
En los receptores de GRs ABO-incompatibles con reacciones severas, los síntomas son dramáticos; la mayoría se deben a anafilatoxinas C3a y C5a, liberando aminas vasoactivas e hidrolasas de mastocitos y granulocitos. Las interleucinas 1 (IL-1), IL-8 y el factor de necrosis tumoral (FNT) causan inflamación, agregación plaquetaria, aumento de la permeabilidad capilar, e hipotensión. El sangramiento se debe a CID, activada por procoagulantes liberados del estroma eritrocitario y por activación directa de la coagulación por complemento.
La gran mayoría de las transfusiones ABO incompatible son asintomáticas; solo el 20–25%, especialmente receptores grupo O, tienen síntomas de variable severidad, con un 5 – 8% de mortalidad. La hemólisis es menos severa cuando se transfunden GRs grupo A, a un receptor grupo B, o vice versa, ya que los sujetos grupo B y A tienen anticuerpos ABO menos potentes que los O. Típicamente, a menos de una hora de inicio de la transfusión, el paciente se queja de calor o dolor en la vena puncionada, latidos en las sienes, enrojecimiento facial, dolor en el pecho, náuseas y dolor lumbar, seguidos de escalofríos, fiebre, taquicardia e hipotensión. En los casos severos hay shock y falla renal; también puede haber CID. Se libera hemoglobina en la circulación y al saturarse la haptoglobina, hay hemoglobinuria. Los síntomas se modifican en pacientes anestesiados o sedados; en ellos los primeros signos serán CID, hipotensión o hemoglobinuria.
La hemólisis intravascular es menos frecuente cuando por error se transfunde plasma grupo O a receptores A, B o AB. Se debe seleccionar para todos los receptores, plasma fresco congelado, plaquetas y crioprecipitados ABO compatibles, especialmente para los niños.
En el Sistema de Hemovigilancia (SHOT) del Reino Unido, aproximadamente el 30% de las transfusiones de componentes sanguíneos incorrectamente transfundidos se deben mayoritariamente a errores de registro o técnicos en el laboratorio de la UMT. El resto son errores de registro o administrativos en el pabellón, retiro de la sangre del banco de sangre, al tomar las muestras de sangre, o en el chequeo al retirar las unidades del refrigerador o transfundir la sangre.
La hemólisis extravascular es mediada por anticuerpos IgG (IgG1 e IgG3). Los GRs recubiertos por anticuerpo tipo Rh, son removidos (por fagocitosis o citotoxicidad) por las células fagocíticas mononucleares, predominantemente en la pulpa roja del bazo donde hay hemoconcentración. Los glóbulos rojos sensibilizados con ciertos anticuerpos IgG, como anti-K, anti-Fy, pueden activar el complemento, pero sólo hasta C3b, lo que potencia la hemólisis predominantemente en el hígado, donde hay profusión de células fagocíticas mononucleares.
Los síntomas y signos son menos dramáticos que en la hemólisis intravascular y aparecen después de una hora o más del inicio de la transfusión. Puede no haber ni signos ni síntomas del todo. Puede haber hiperbilirrubinemia, fiebre e incapacidad de lograr el aumento esperado de hemoglobina y, ocasionalmente, en casos severos, hemoglobinemia. La falla renal es muy rara. Los síntomas son atribuidos en gran parte a la liberación de citoquinas por parte de las células fagocíticas mononucleares y a la liberación de C3a. La mortalidad es extremadamente baja.
El manejo de las RHT inmediatas consiste en la interrupción de la transfusión en cuanto aparecen los típicos síntomas y signos; chequear la identificación del paciente y las unidades transfundidas; tomar muestras para estudio; informar inmediatamente a la UMT; retornar a la UMT las bolsas de las unidades transfundidas; estudiar las muestras pretransfusionales en paralelo con las post-transfusión; medir la orina de las primeras 24 horas y buscar hemoglobina; restaurar el volumen sanguíneo circulante y mantener la presión sanguínea y el flujo urinario usando soluciones cristaloides y furosemida. Podrá ser necesario un monitoreo en una unidad de cuidados intensivos. Si el flujo urinario es pobre (<1mL/kg por hora) se debe involucrar en forma precoz al equipo de nefrología y es probable que se requiera diálisis. En caso de CID, instaurar terapia adecuada de componentes sanguíneos.
Reacciones hemolíticas transfusionales retardadas (RHTRs)No son predecibles o prevenibles y siempre causadas por anticuerpos IgG, llevando a hemólisis extravascular. El paciente se ha sensibilizado previamente a antígenos eritrocitarios por transfusiones o embarazos, pero el anticuerpo no es detectable en los tests pretransfusionales y la transfusión que contiene el antígeno al cual el receptor ya está sensibilizado, provoca una respuesta anamnéstica, con reaparición del anticuerpo y hemólisis a los 5–10 días. Los hallazgos clínicos son los mismos, pero menos severos que en una RHT extravascular inmediata. La posibilidad de una RHT retardada refuerza la importancia de usar muestras recientes para la detección de anticuerpos irregulares, tests de antiglobulina directa (TAD) y pruebas de compatibilidad, si se ha administrado una transfusión con un plazo mayor a 72 horas. El conocimiento de esta complicación puede evitar estudios innecesarios para excluir una infección cuando aparece fiebre pocos días después de la transfusión. La historia clínica es importante, ya que anticuerpos formados previamente (por. ej. Anti-Kidd) pueden hacerse indetectables con el tiempo.
Ante la sospecha de una RHT retardada, los estudios incluyen hemograma completo con recuento de reticulocitos, frotis sanguíneo, bilirrubina plasmática, test de función renal y test de lactatodeshidrogenasa (LDH). Los estudios serológicos deberían incluir repetición de grupos sanguíneos y detección de anticuerpos (en muestras del paciente pre- y post-transfusionales), TAD y elución de anticuerpos de los GRs post- transfusión para su identificación.
El tratamiento de la reacción transfusional hemolítica retardada es habitualmente de soporte; a veces requiere una transfusión adicional.
Reacción transfusional febril no hemolítica (RTFNH)Se caracterizan por fiebre >38°C, con aumento >2°C de la línea base y son más frecuentes con componentes sanguíneos que contienen leucocitos en pacientes sensibilizados, habitualmente a antígenos HLA y, a veces, a granulocitos y antígenos plaquetarios específicos por transfusiones previas o embarazos. A menudo se acompañan de escalofríos, dolor muscular y náuseas. Son mucho menos frecuentes desde la introducción de componente sanguíneos leucorreducidos por remoción del buffycoat o leucodepletados. Pueden aparecer hasta dos horas después de la transfusión y son más comunes en los pacientes poli-transfundidos.
Daño pulmonar agudo relacionado con la transfusión (TRALI)Es un edema pulmonar no cardiogénico que se presenta dentro de las seis horas de la transfusión, con severa dificultad respiratoria acompañado de tos, fiebre y escalofríos. A menudo se asocia con hipotensión. La radiografía de tórax muestra sombras nodulares bilaterales en los campos pulmonares con tamaño cardiaco normal, saturación baja de oxígeno y presión venosa central baja o normal. Puede ser confundido con un síndrome de distress respiratorio agudo de otras causas, o con falla cardíaca aguda por sobrecarga circulatoria (TACO). El tratamiento es fundamentalmente de soporte; si fuese necesario, en una unidad de cuidados intensivos con soporte ventilatorio. La terapia esteroidal no es efectiva. Con un tratamiento adecuado, la tasa de sobrevida es alta y la mayoría de los pacientes se recupera dentro de un plazo de 1 a 3 días, sin secuelas.
La reacción se debe a la transferencia pasiva de leucoaglutininas (la mayoría anti-HLA clase I o II o, raramente, a anticuerpos a granulocitos) en el plasma del donante, que reaccionan con los granulocitos en el pulmón del receptor, provocando la activación del complemento, daño endotelial y epitelial, daño alveolar y cambios inflamatorios, mediados por anafilatoxinas, citoquinas y otros mediadores inflamatorios. EL TRALI aparece después de la infusión de componentes que contienen plasma; los donantes implicados son habitualmente mujeres multíparas. La incidencia ha disminuido, en el RU desde que se producen el PFC y plasma para suspender el pool de plaquetas a partir de donantes masculinos.
Enfermedad injerto contra huésped asociada a la transfusión (EICH- AT)Es una complicación muy rara, pero habitualmente fatal, causada por la transfusión de linfocitos viables, HLA compatibles del donante, con injerto y expansión en el receptor. Se caracteriza por fiebre, erupción cutánea, diarrea, alteración de la función hepática y pancitopenia, 7 a 14 días después de la transfusión. Los pacientes en riesgo son los fetos que reciben transfusión intrauterina, y los pacientes profundamente inmunosuprimidos como los trasplantados con células hematopoyéticas.
El diagnóstico se hace en biopsias de los órganos afectados, con detección de células derivadas del donante o DNA en la sangre del paciente o tejidos. Dada la consecuencia fatal del la EICH-AT es esencial asegurar que todos los pacientes a riesgo reciban GRs y plaquetas gama - irradiados.
Púrpura Post-transfusional (PPT)Es una complicación rara; se caracteriza por brusca aparición de trombocitopenia severa 7–10 días después de la transfusión, habitualmente de GRs. La mayoría de los pacientes son mujeres con transfusiones previas o embarazos. La causa más frecuente es anticuerpos (anti-HPA-1a o HPA-5b) en el receptor contra antígenos plaquetarios del donante. El PPT es auto limitado pero, en casos severos, una terapia precoz con inmunoglobulina endovenosa logra una buena respuesta. No se recomienda la transfusión de plaquetas salvo que exista un sangramiento con riesgo vital.
Reacciones alérgicas levesEstas aparecen en aproximadamente el 1% de las transfusiones y son mediadas por anticuerpos IgE, habitualmente contra proteínas plasmáticas u otros alérgenos en el plasma del donante. Los síntomas son urticaria y prurito, sin cambios en los signos vitales. Se presentan con mayor frecuencia en los pacientes que reciben componentes sanguíneos ricos en plasma.
Las reacciones urticariales leves pueden ser tratadas con antihistamínicos. Los componentes estándares se pueden continuar administrando a no ser que los síntomas sean recurrentes y severos, en cuyo caso se indican GRs lavados.
Reacción severa anafilácticaLa anafilaxis es una emergencia rara, grave, aguda, que compromete la vida, asociada con shock o hipotensión severa, broncoespasmo, estridor por el edema laríngeo, angioedema y síntomas gastrointestinales incluyendo espasmos abdominales. Ocurren en los raros pacientes severamente deficientes en IgA con anti-IgA que reacciona con el IgA presente en el plasma del componente transfundido. El tratamiento consiste en la administración urgente de epinefrina intramuscular. Posteriormente se pueden administrar corticoides parenterales.
Una pequeña minoría de pacientes con deficiencia severa de IgA y clara historia de reacción anafiláctica severa a componentes sanguíneos, requiere componentes sanguíneos de donantes IgA deficientes. Esto solo es posible, en países con servicios de sangre bien desarrollados. De otro modo, se indicarán GRs lavados y plaquetas lavadas resuspendidas en solución aditiva. En extrema urgencia se indica la transfusión de componentes sanguíneos estándares con la menor cantidad de plasma, administrados con monitoreo cuidadoso.
Contaminación bacteriana de los componentes sanguíneosEsta complicación, en forma de septicemia o shock endotóxico, puede ser rápidamente fatal y ocurre particularmente con plaquetas, ya que son almacenadas entre 22°C–24°C. El paciente puede presentar colapso, fiebre muy alta, shock y CID. El diagnóstico diferencial es con una RTH inmediata por transfusión ABO incompatible.
Las medidas adoptadas para reducir la contaminación bacteriana con limpieza rigurosa del antebrazo del donante, derivación de los primeros 20-30ml de sangre colectada y monitoreo microbiológico de las plaquetas (Tabla 1) han reducido en forma significativa este riesgo en el RU, pero es esencial hacer una detección precoz y tratamiento adecuado inmediato. La(s) unidad(es) implicadas deben ser investigadas y cultivadas en el laboratorio de microbiología. Se deben tomar muestras para cultivos del paciente e iniciar inmediatamente el tratamiento para el shock con antibióticos endovenosos de amplio espectro contra bacterias Gram-negativas y Gram-positivas. El Centro o el Banco de Sangre deben ser informados sin retardo a fin de que cualquier componente asociado a la donación implicada pueda ser retirado antes que sea transfundido a otro paciente.
Sobrecarga circulatoria asociada a la Transfusión - Transfusion Circulatory Overload (TACO)Consiste en edema pulmonar agudo que aparece dentro de las 6 horas de la transfusión con distress respiratorio agudo, taquicardia, elevación de la presión arterial y evidencia de sobrecarga circulatoria. Puede ser grave (Tabla 5). Los factores de riesgo incluyen edad >70 años, comorbilidad con falla cardíaca, alteración de la función renal e hipoalbuminemia. Los pacientes de bajo peso, como ancianos y niños, tienen un riesgo mayor de recibir un volumen inapropiado o una transfusión muy rápida que los predisponga al TACO. Una evaluación pretransfusional cuidadosa, con atención especial a la velocidad y volumen, monitoreo del balance de fluidos y el uso de diuréticos cuando corresponda, puede prevenir el TACO. En adultos frágiles, de bajo peso, se debe considerar la transfusión de una sola unidad o la prescripción en mililitros (como en pediatría). El tratamiento consiste en detener la transfusión, administrar oxígeno y diuréticos, en una unidad de terapia intensiva según se requiera.
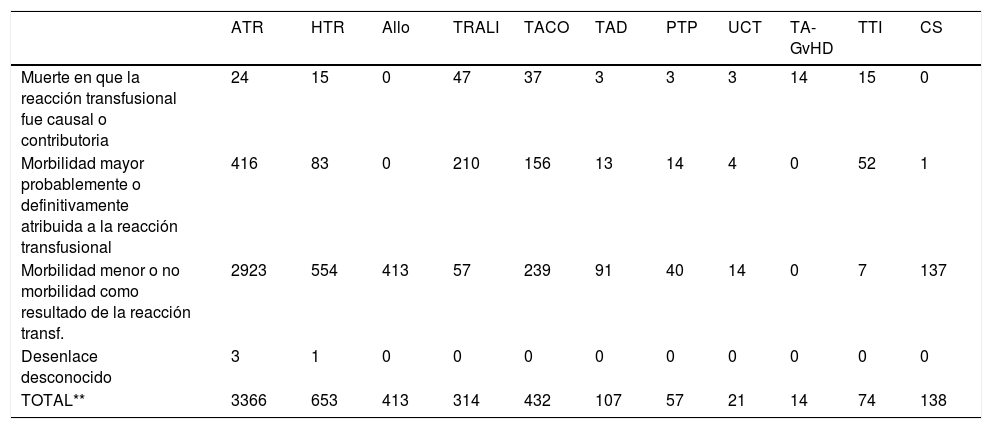
Datos cumulativos de mortalidad/ morbilidad, según informes a SHOT desde 1996 a 2014
| ATR | HTR | Allo | TRALI | TACO | TAD | PTP | UCT | TA-GvHD | TTI | CS | |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Muerte en que la reacción transfusional fue causal o contributoria | 24 | 15 | 0 | 47 | 37 | 3 | 3 | 3 | 14 | 15 | 0 |
| Morbilidad mayor probablemente o definitivamente atribuida a la reacción transfusional | 416 | 83 | 0 | 210 | 156 | 13 | 14 | 4 | 0 | 52 | 1 |
| Morbilidad menor o no morbilidad como resultado de la reacción transf. | 2923 | 554 | 413 | 57 | 239 | 91 | 40 | 14 | 0 | 7 | 137 |
| Desenlace desconocido | 3 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| TOTAL** | 3366 | 653 | 413 | 314 | 432 | 107 | 57 | 21 | 14 | 74 | 138 |
* Casos con un potencial para mayor morbilidad se incluyen en morbilidad menor o no morbilidad.
** Total excluye 7 casos no clasificados de 1998-1999. CS= rescate de células autólogas intraoperatorio
(Fuente: Serious Hazards in Transfusion (SHOT), www.shotuk.org, reproducido con permiso).
Para abreviaciones, ver Figura 10.
TACO, TAD y CS se incluyeron solo a partir del 2008. HSE y ADU se separaron de IBCT en el 2004. Aloinmunización (Allo) es una categoría nueva desde el 2010 en el que se separo de HTR o RHT.
Es una complicación seria de la transfusión profiláctica de plaquetas, en trasplantes de células madres, debida principalmente a anticuerpos HLA presentes en plaquetas y leucocitos. Se previene con componentes leucodepletados. Se trata con plaquetas de aféresis, HLA compatibles de un panel de donantes tipificados o compatibilizadas por pruebas de ELISA o inmunoflurescencia.
HemosiderosisEs una complicación de transfusiones repetidas en pacientes con anemias crónicas como los talasémicos. La sobrecarga de hierro se presenta aproximadamente después de 50 unidades transfundidas, en un adulto de talla promedio. De rutina se administran quelantes del fierro a los pacientes dependientes de transfusión.
Infecciones transmitidas por transfusión (ITTs)Adicional a los efectos adversos de la transfusión descritos anteriormente, están todas las infecciones transmisibles por transfusión, bacterias, parásitos, virus y priones (Tabla 4). La variante de la enfermedad de Creutzfeld Jakob (vECJ) se considera un riesgo potencial de la transfusión de sangre, especialmente en el RU. Sólo ha habido 4 casos de posible transmisión de vECJ en más de 50 millones de compontes transfundidos desde 1996 hasta hoy.
HEMOVIGILANCIAA pesar del gran desarrollo de la Medicina Transfusional desde la aparición del VIH, no había sistemas de vigilancia para medir la incidencia y prevalencia de los riesgos reales de la transfusión. Hemovigilancia es un concepto que nació en Francia en 1994 y se expandió a Europa Occidental y otros países. Se define como «el conjunto organizado de procedimientos de seguimiento relacionados con acontecimientos serios o inesperados, o de reacciones en donantes o receptores de sangre, y el seguimiento epidemiológico correspondiente de donantes». Su fin es recoger y evaluar información sobre los efectos serios inesperados e indeseables resultantes de la transfusión de componentes sanguíneos lábiles y de prevenir su ocurrencia/ recurrencia. Es una actividad esencial para desarrollar estrategias respecto a los servicios de sangre y la transfusión de componentes sanguíneos y restablecer la confianza en la seguridad de la sangre. Educa acerca de los riesgos reales de la transfusión en un país o región y ayuda a priorizar las medidas de seguridad.
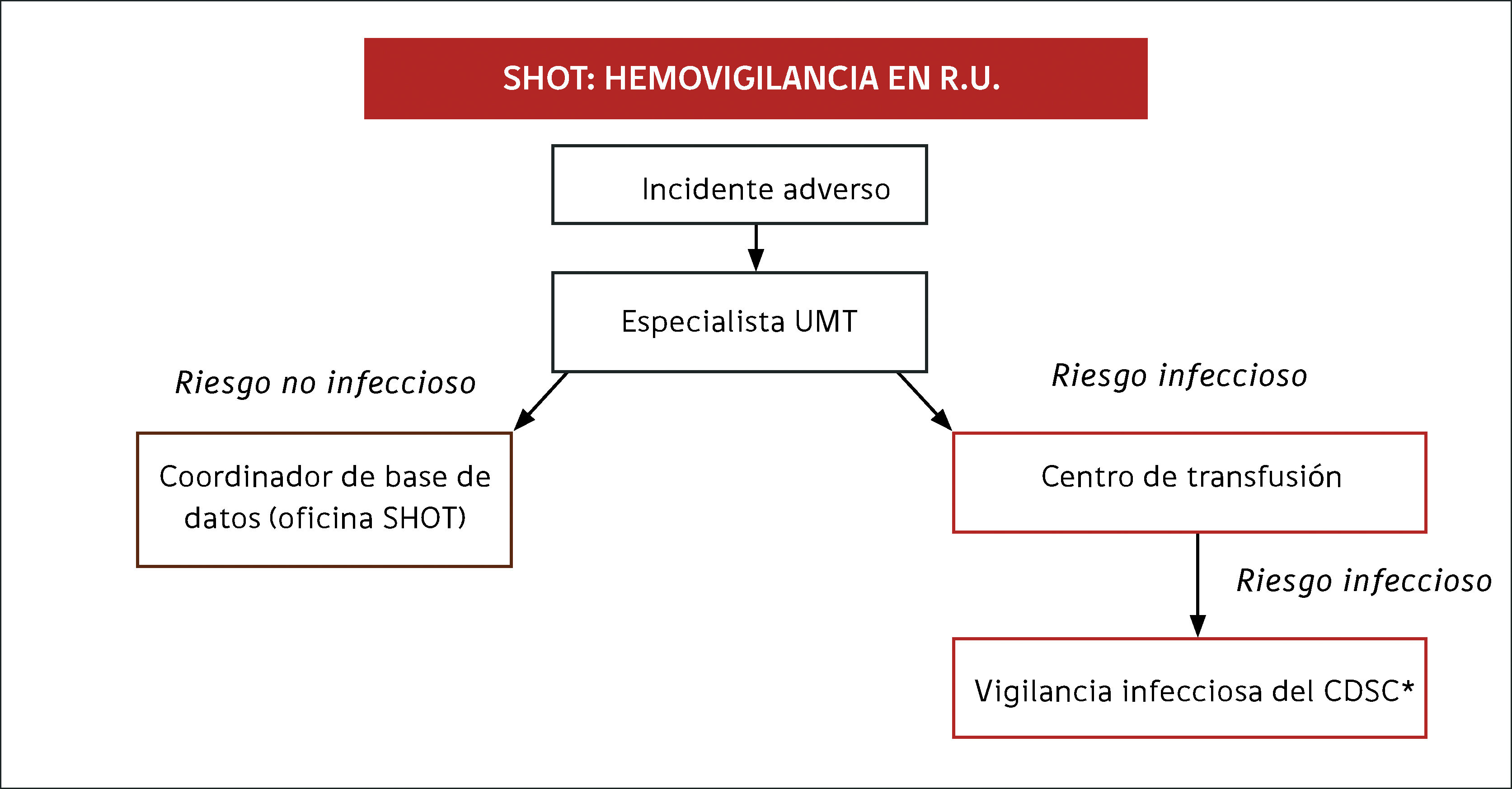
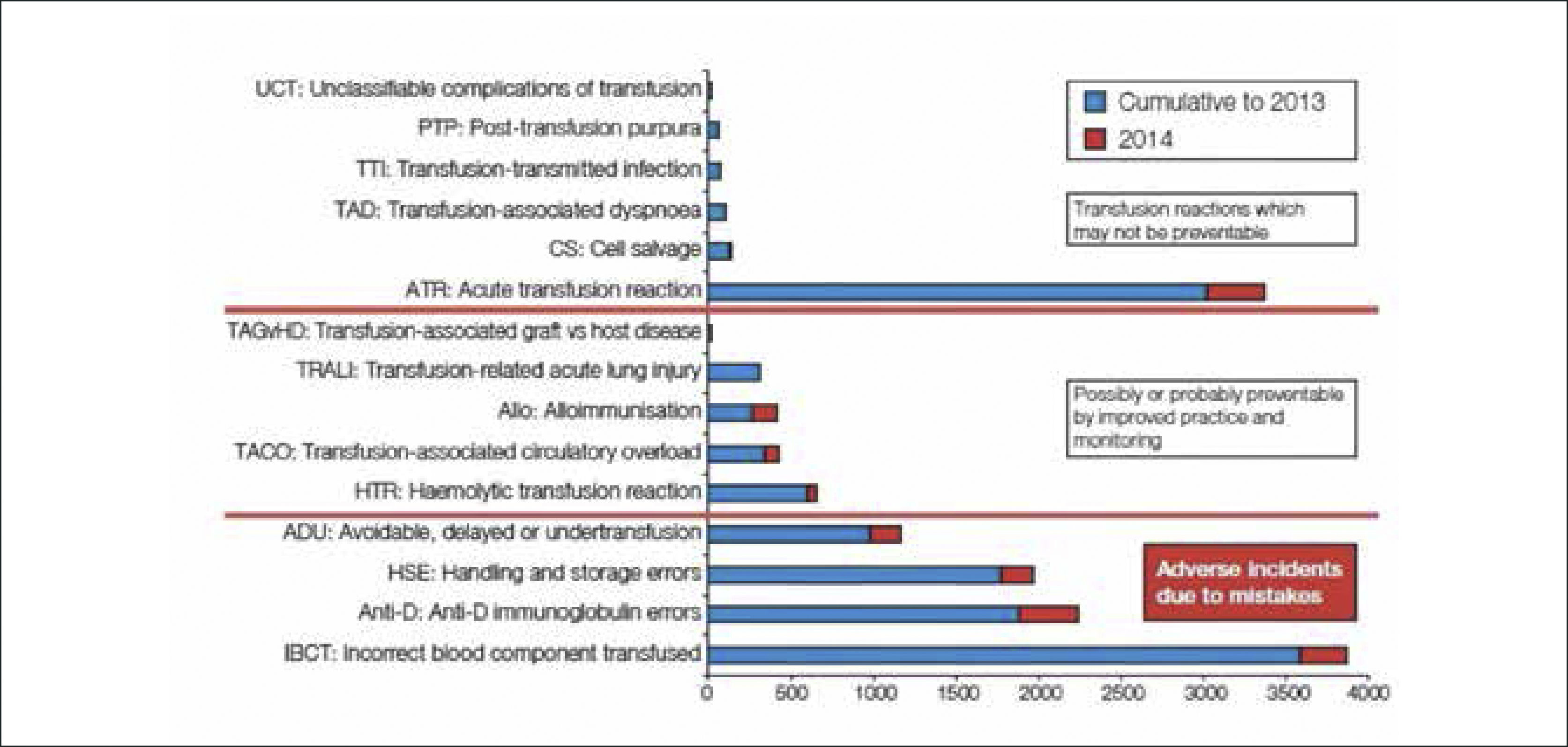
SHOT, el sistema de hemovigilancia británico, se inició en 1996, definiendo los eventos notificables, con participación voluntaria, la que ahora es obligatoria, por ley, con una estructura de reportaje clara (Figura 9). SHOT, a través de los años, ha demostrado que los riesgos de ITTs en el Reino Unido son bastante escasos, comparados con riesgos mucho mayores como errores en la administración de sangre y TRALI (Figura 10 y Tabla 5). Los informes han conducido al Departamento de Salud a tomar medidas dirigidas a disminuir dichos riesgos, con muy buenos resultados.
Datos cumulativos par las categorías de SHOT desde 1996/7 al 2014. Total de 14.822 informes
UCT: complicaciones no clasificables de la transfusión; PTP: Purpura pos-transfusional (PPT); TTI: infecciones transmitidas por la transfusión (ITT); TAD: disnea asociada a la transfusión; CS; rescate intraoperatorio de células; ATR; reacción transfusional aguda (RTA); TAGVHD: enfermedad de injerto contra huésped asociada a la transfusión (EICH- AT); TRALI: daño pulmonar agudo relacionado con la transfusión; Allo: Aloinmunización; TACO: sobrecarga circulatoria asociada a la transfusión; HTR: reacción hemolítica transfusional (RHT); ADU: prevenible, retrasada o sub-transfusión; HSE: errores de manejo y almacenamiento de componentes sanguíneos; Anti-D: errores en la administración profiláctica de inmunoglobulina anti-D; IBCT: componente sanguíneo transfundido incorrectamente.
En azul: datos cumulativos hasta el 2013; En rojo: 2014; Sección superior del gráfico: Reacciones transfusionales no prevenibles.
Sección media: Posiblemente o probablemente prevenibles por mejor practica o monitoreo.
Sección inferior: Incidentes adversos debidos a errores.
Fuente: Serious Hazards in Transfusion (SHOT), www.shotuk.org. Reproducido con permiso.
Un servicio nacional de sangre bien organizado, es un pre- requisito para un programa de hemovigilancia en un país. Se requiere, como mínimo:
- •
Buena comunicación entre los proveedores de componentes sanguíneos y los usuarios clínicos.
- •
Estándares para los servicios de sangre y los usuarios, y definiciones nacionales consensuadas de reacciones adversas.
- •
Trazabilidad de los componentes desde el donante hasta su destino final, con sistemas informáticos confiables.
- •
Organización que permita:
- 1)
El informe estandarizado a una oficina central que compile y analice los datos.
- 2)
Comités de transfusión en todos los hospitales.
- 3)
La investigación de los eventos adversos.
- 4)
El compromiso de las autoridades para actuar con medidas que disminuyan los riesgos serios de la transfusión.
- 1)
De lo dicho, se desprende que en la gran mayoría de los países de Latinoamérica no se dan las condiciones para establecer programas de hemovigilancia efectivos.
Uso y manejo APROPIADO de la sangre del paciente (Patient Blood Management)
En el RU, tres circulares del SNSalud ‘Mejor Transfusión de Sangre’ (1998, 2002 y 2007) promueven la transfusión segura en los hospitales, con énfasis en el uso apropiado de los componentes en todas las áreas clínicas. Los principios de las circulares ahora forman parte de «Patient Blood Management (PBM)» o Manejo de la Sangre del Paciente, un enfoque multidisciplinario basado en la evidencia para el manejo de los pacientes que puedan necesitar transfusión.
Hay mucho por lograr en cuanto a educar a quienes prescriben la sangre para evitar una transfusión innecesaria y considerar estrategias alternativas (Tabla 6). La revisión de la práctica transfusional mediante auditorías nacionales y regionales del empleo de componentes sanguíneos, así como normas de referencia sobre el uso de componentes sanguíneos en cirugía y en medicina, son necesarios para la seguridad del paciente y lograr un correcto abastecimiento de sangre.
Medidas y alternativas para evitar o minimizar la transfusión de componentes sanguíneos alogénicos
| MEDIDAS Y ALTERNATIVAS PARA EVITAR O MINIMIZAR LA TRANSFUSIÓN DE COMPONENTES SANGUÍNEOS ALOGÉNICOS | |
|---|---|
| BIOLÓGICAS | Factores de coagulación recombinantes (VIII,IX) |
| rEPO (600UI semanales por 4 semanas pre-op) | |
| Fibrinógeno y PCC (complejo protrombina) | |
| Cola fibrina | |
| rVIIa | |
| FARMACOLÓGICAS | Ácido tranexámico |
| DDAVP | |
| Fe oral e IV y otros hematínicos (B12, ac. Fólico) | |
| OPERACIONALES | Uso apropiado de la sangre; umbrales reducidos, transfundir de una unidad a la vez |
| Rescate intraoperatorio de GRs | |
| Trasplante de células madres | |
| Cuestionar viejas convenciones / triggers | |
| Suspender aspirina, clopidogrel, otras drogas antiplaquetarias y anticoagulantes preoperatorio | |
| Tratar anemia preoperatoria de manera oportuna | |
| Técnicas quirúrgicas y anestésicas (instrumentos de alta frecuencia: láser, microondas, US, etc) | |
| Muestras pequeñas (microtécnicas) para lactantes | |
| Tromboelastógrafo (near patient testing) | |
La preocupación creciente sobre el impacto de la transfusión en relación a la mortalidad y morbilidad en los pacientes muy comprometidos, por ejemplo impacto potencial en la tasa de infección post operatoria y estadía más prolongada en el hospital post cirugía, han conducido a prácticas transfusionales más restrictivas y el uso de alternativas a la transfusión, especialmente el buen manejo del paciente quirúrgico (Tabla 7), obstétrico y médico.
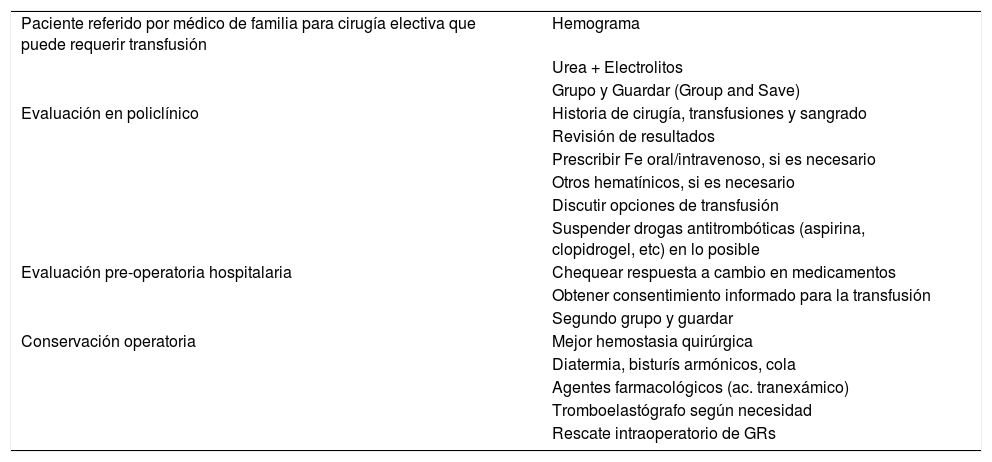
Manejo de la sangre del paciente en Cirugía Electiva
| Paciente referido por médico de familia para cirugía electiva que puede requerir transfusión | Hemograma |
| Urea + Electrolitos | |
| Grupo y Guardar (Group and Save) | |
| Evaluación en policlínico | Historia de cirugía, transfusiones y sangrado |
| Revisión de resultados | |
| Prescribir Fe oral/intravenoso, si es necesario | |
| Otros hematínicos, si es necesario | |
| Discutir opciones de transfusión | |
| Suspender drogas antitrombóticas (aspirina, clopidrogel, etc) en lo posible | |
| Evaluación pre-operatoria hospitalaria | Chequear respuesta a cambio en medicamentos |
| Obtener consentimiento informado para la transfusión | |
| Segundo grupo y guardar | |
| Conservación operatoria | Mejor hemostasia quirúrgica |
| Diatermia, bisturís armónicos, cola | |
| Agentes farmacológicos (ac. tranexámico) | |
| Tromboelastógrafo según necesidad | |
| Rescate intraoperatorio de GRs |
(Gentileza del Dr Dafydd Thomas).
El uso de la sangre en cirugía en el RU y otros paises ha disminuido por diversos factores como: evaluación clínica previa (por lo menos 1 mes antes) con tratamiento para corregir la anemia; mejores técnicas de cirugía y de anestesia; uso de agentes antifibrinolíticos como el ácido tranexámico, rescate celular durante y posterior a la cirugía (la transfusión autóloga pre-depósito ha dejado de usarse por su alto costo e ineficiencia) y protocolos de transfusión. El uso creciente de GRs en pacientes oncológicos y hematológicos puede reducirse con hierro endovenoso, eritropoyetina, vitamina B12 y ácido fólico según sea necesario. Estudios aleatorios controlados recientes han demostrado que en la mayoría de los casos una política transfusional restrictiva tiene mejores o iguales resultados que políticas liberales. Actualmente se recomienda un umbral transfusional para la mayoría de los pacientes de 70–80g/L de Hb. Un umbral más alto se indica en pacientes con síndromes coronarios agudos.
Sin duda el abordaje más lógico para reducir el riesgo transfusional es únicamente el uso de componentes sanguíneos cuando es estricta y clínicamente necesario y cuando no existe otra alternativa.
Agradecemos la cooperación técnica de Eliseo Zapata, EU del Centro de Sangre de Concepción.
Las autoras declaran no tener conflictos de interés, en relación a este artículo.