El objetivo de este artículo es revisar la información nacional disponible en relación a la prevención y diagnóstico precoz del melanoma en Chile. Y luego, discutir las estrategias para revertir la tendencia al aumento de la incidencia de la enfermedad y las estrategias para lograr un diagnóstico en sus etapas iniciales susceptibles de ser tratadas con terapias más efectivas, con menor riesgo de morbilidad y secuelas, y de un significativo menor costo.
The goal of this article is to review the available national information in relation to the prevention and early diagnosis of melanoma in Chile. And then, discuss strategies to reverse the trend to increase the incidence of the disease and strategies to achieve a diagnosis in its initial stages that can be treated with more effective therapies, with lower risk of morbidity and sequelae, and a significant lower cost.
El melanoma maligno es el responsable de la mayoría de las muertes por cáncer de piel. En Chile constituye un problema de salud pública significativo con una incidencia y mortalidad por esta causa en aumento. El método más efectivo para evitar el desarrollo del melanoma es minimizar la exposición a fuentes naturales o artificiales de rayos ultravioletas, pero para observar los beneficios de esta estrategia se requiere de años de campañas educacionales que logren cambiar los hábitos actuales de exposición solar. La detección y tratamiento precoz de la enfermedad tiene un impacto directo inmediato en la disminución de la mortalidad, con el beneficio adicional de requerir terapias menos agresivas y de menor costo. Los profesionales de la salud tenemos una gran oportunidad de aportar en esta tarea, identificando a las poblaciones de alto riesgo, invirtiendo tiempo en educación, realizando un examen completo de la piel o, si no es posible, derivando a centros donde se pueda realizar evaluación clínica, estudio histopatológico y tratamiento en forma expedita.
El objetivo de este trabajo es llamar la atención sobre la situación nacional en aspectos relacionados con la prevención y diagnóstico precoz del melanoma.
EPIDEMIOLOGÍA MUNDIALEl melanoma constituye entre el 1 y 4% de los cánceres de piel, sin embargo es responsable de la mayoría de las muertes por esta causa1. El año 2016 en Estados Unidos se estima en más de 75000 casos nuevos diagnosticados y aproximadamente 10000 muertes por melanoma2.
A nivel mundial, la Organización mundial de la salud estimó que el año 2012 se diagnosticaron 232130 casos nuevos de melanoma, con una incidencia de 1.7 casos por cada 100000 habitantes y una tasa de incidencia estandarizada por población mundial de 3 casos por 100000 habitantes. Se estimó además para el mismo año, 55488 defunciones por melanoma, con una tasa cruda mortalidad de 0.7 muertes por 100000 personas (tasa estandarizada de 0.9 muertes por cada 100000 habitantes).
La IARC (International Agency for research on Cancer) estima que para el 2020 habrá 279983 nuevos casos de melanoma y 67809 muertes por esta causa3.
Un estudio realizado en California, encontró que las tasas de incidencia han continuado aumentando entre los años 1998 y 2012, y que las tasas relativas más altas se observan en la enfermedad regional, distante y ulceradas, especialmente en hombres de nivel socioeconómico bajo. Concluyeron que teniendo en cuenta el grosor y la etapa del tumor como indicadores del tiempo hasta la detección y el nivel socioeconómico como una aproximación del acceso a servicios de salud, este patrón refleja un aumento sostenido y real en la ocurrencia de melanoma, en oposición a que el fenómeno tumoral simplemente haya aumentado por un mejor acceso a la salud4.
Por otra parte, en Australia se ha observado un aumento en la incidencia de melanoma de 17% entre los años 1987 y 2007 (0.9% promedio anual), sin embargo la mortalidad ha disminuido un 11% (0.6% promedio anual) en el mismo periodo. Este hecho se ha atribuido a la detección precoz y campañas de prevención primaria realizadas en ese pais durante 1981 y 19895. Lo mismo se observo en Alemania, luego del proyecto SCREEN realizado en el estado de Scleswig-Holstein. Hubo un aumento en la incidencia de de melanoma invasivo de 34% durante el programa de detección precoz y una disminución de la mortalidad por melanoma 5 años después de este (hombres: observada 0.79 por 100000 y esperada 2.00 por 100000; Mujeres: observada 0.66 por 100000 y esperada 1.3 por 100000)6. Los mismos autores realizaron otro estudio que comparó la mortalidad por melanoma en distintos estados e Alemania, y observó que las tasas de mortalidad habian permanecido estables en todos los estados menos en Scleswig-Holstein donde se había realizado la campaña de etección temprana, demostrando así la efectividad de éstas en la reducción de mortalidad7.
EPIDEMIOLOGÍA NACIONALDado que en Chile no existe un sistema de registro nacional de Cáncer y que no se han realizado estudios en población general no consultante, hay escasas cifras que revelan nuestra realidad nacional. Todos los estudios se han realizado en base a registros hospitalarios de casos de melanoma y registro nacional de defunciones. Por lo tanto, sus resultados no son del todo confiables, debido a todos los posibles sesgos que tienen este tipo de estudios.
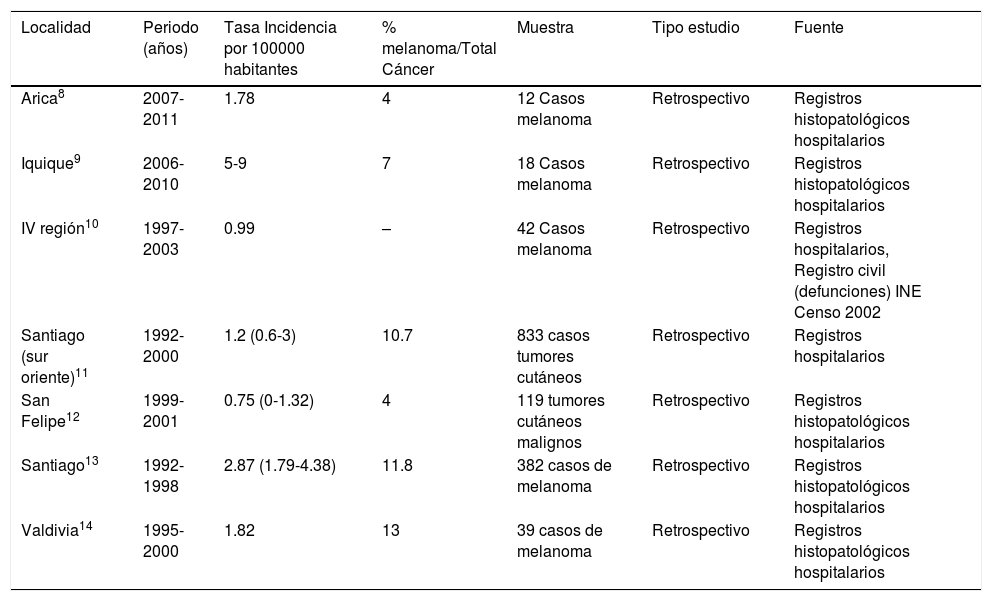
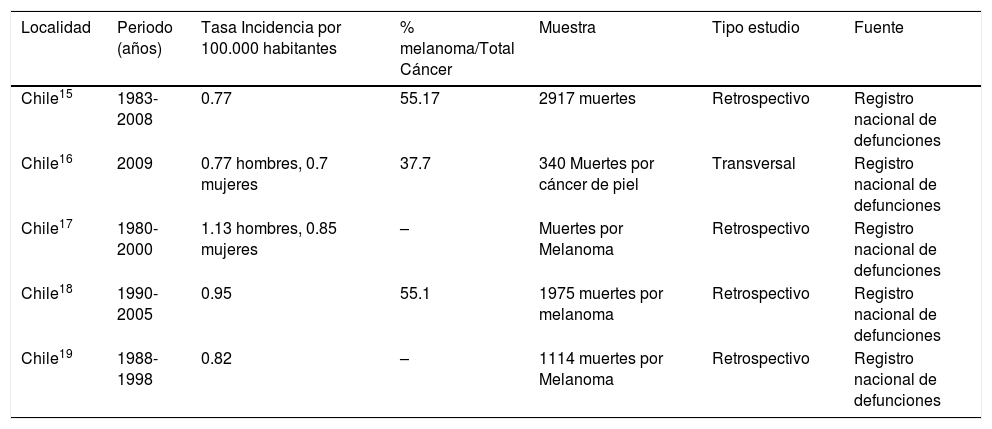
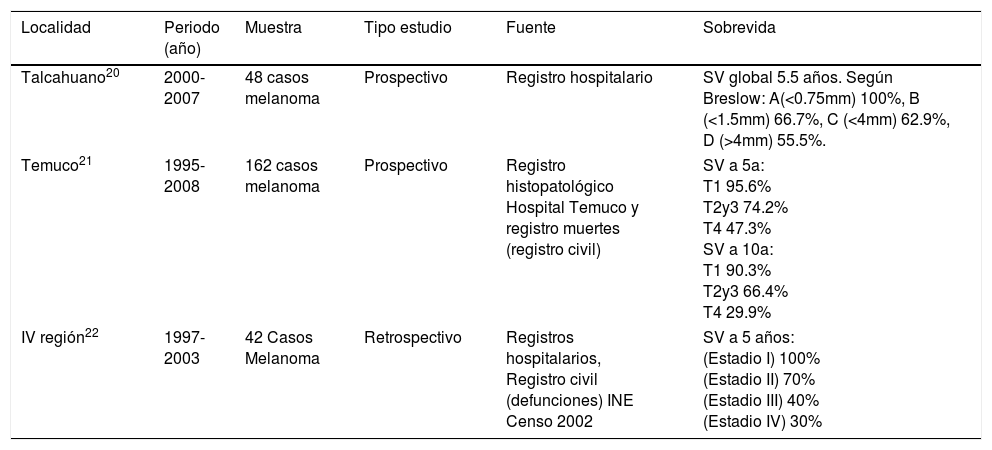
Se describen a continuación los estudios locales realizados a nivel nacional, con respecto a tasas de incidencia (Tabla 1), mortalidad (Tabla 2) y sobrevida (Tabla 3). En otra tabla se presentan estudios descriptivos de series clínicas de melanoma publicados en Chile (Tabla 4).
Estudios nacionales de incidencia de melanoma maligno
| Localidad | Periodo (años) | Tasa Incidencia por 100000 habitantes | % melanoma/Total Cáncer | Muestra | Tipo estudio | Fuente |
|---|---|---|---|---|---|---|
| Arica8 | 2007-2011 | 1.78 | 4 | 12 Casos melanoma | Retrospectivo | Registros histopatológicos hospitalarios |
| Iquique9 | 2006-2010 | 5-9 | 7 | 18 Casos melanoma | Retrospectivo | Registros histopatológicos hospitalarios |
| IV región10 | 1997-2003 | 0.99 | – | 42 Casos melanoma | Retrospectivo | Registros hospitalarios, Registro civil (defunciones) INE Censo 2002 |
| Santiago (sur oriente)11 | 1992-2000 | 1.2 (0.6-3) | 10.7 | 833 casos tumores cutáneos | Retrospectivo | Registros hospitalarios |
| San Felipe12 | 1999-2001 | 0.75 (0-1.32) | 4 | 119 tumores cutáneos malignos | Retrospectivo | Registros histopatológicos hospitalarios |
| Santiago13 | 1992-1998 | 2.87 (1.79-4.38) | 11.8 | 382 casos de melanoma | Retrospectivo | Registros histopatológicos hospitalarios |
| Valdivia14 | 1995-2000 | 1.82 | 13 | 39 casos de melanoma | Retrospectivo | Registros histopatológicos hospitalarios |
Estudios nacionales de mortalidad por melanoma maligno
| Localidad | Periodo (años) | Tasa Incidencia por 100.000 habitantes | % melanoma/Total Cáncer | Muestra | Tipo estudio | Fuente |
|---|---|---|---|---|---|---|
| Chile15 | 1983-2008 | 0.77 | 55.17 | 2917 muertes | Retrospectivo | Registro nacional de defunciones |
| Chile16 | 2009 | 0.77 hombres, 0.7 mujeres | 37.7 | 340 Muertes por cáncer de piel | Transversal | Registro nacional de defunciones |
| Chile17 | 1980-2000 | 1.13 hombres, 0.85 mujeres | – | Muertes por Melanoma | Retrospectivo | Registro nacional de defunciones |
| Chile18 | 1990-2005 | 0.95 | 55.1 | 1975 muertes por melanoma | Retrospectivo | Registro nacional de defunciones |
| Chile19 | 1988-1998 | 0.82 | – | 1114 muertes por Melanoma | Retrospectivo | Registro nacional de defunciones |
Estudios nacionales de análisis de sobrevida de melanoma maligno
| Localidad | Periodo (año) | Muestra | Tipo estudio | Fuente | Sobrevida |
|---|---|---|---|---|---|
| Talcahuano20 | 2000-2007 | 48 casos melanoma | Prospectivo | Registro hospitalario | SV global 5.5 años. Según Breslow: A(<0.75mm) 100%, B (<1.5mm) 66.7%, C (<4mm) 62.9%, D (>4mm) 55.5%. |
| Temuco21 | 1995-2008 | 162 casos melanoma | Prospectivo | Registro histopatológico Hospital Temuco y registro muertes (registro civil) | SV a 5a: T1 95.6% T2y3 74.2% T4 47.3% SV a 10a: T1 90.3% T2y3 66.4% T4 29.9% |
| IV región22 | 1997-2003 | 42 Casos Melanoma | Retrospectivo | Registros hospitalarios, Registro civil (defunciones) INE Censo 2002 | SV a 5 años: (Estadio I) 100% (Estadio II) 70% (Estadio III) 40% (Estadio IV) 30% |
Estudios descriptivos realizados en Chile de series clínicas de melanoma
| Lugar | Periodo (año) | Muestra | Edad (Media (rango o DE)) | Sexo Femenino (%) | Localización Anatómica | Tipos Histológico | Breslow |
|---|---|---|---|---|---|---|---|
| Santiago23 | 1992-2001 y 2005-2009 | 70 Casos de Melanoma acral de Hospitales públicos | 66.6 (32-96) | 51.4 | Acral: 100% | Nodular 31.4% Lentiginoso acral 27.1% Extensivo superficial 10% Léntigo maligno 2.9% No clasificado 28.6% | I: 15.7% II: 14.3% III: 30% IV: 22.9% No consignados: 17.1% |
| Santiago24 | 2006-2012 | 561 casos de Melanoma centro de referencia privado | 54.14 (±16.4) | 60.61 | EEII: 34.33% Tronco: 25.7% Cabeza y cuello: 21.68% EESS: 18.27% | Melanoma in situ 52.88% Melanoma infiltrante 47.12%: | I: 32.68% II: 6.68% III: 4.82% IV: 2.97% |
| Iquique9 | 2006-2010 | 18 casos de Melanoma Hospital regional | 64.7 (±15) | 22.3 | EE: 38.8% Cabeza: 33.33% Tronco: 11.1% No especificado: 16.67% | – | II y III: 44,4% IV: 22.2% No informado: 33.3% |
| Santiago25 | – | 556 casos de Melanoma de Hospitales públicos | 60.32 (±16.6) | 62.77 | Cara: 23.7% hombres y 29.7% mujeres Pie: 22.8% hombres y 13.3% mujeres Pierna: 9.8% hombres y 20.3% mujeres Tronco: 14.4% hombres y 10.3% mujeres. | – | – |
| Osorno26 | 2006-2011 | 20 casos melanoma | 62.1 (20-85) | 60 | EEII: 45% Cabeza y cuello: 20% Abdomen: 15% Tórax: 15% Dorso: 5% EESS: 5% | – | – |
| Santiago27 | 1982-1993 | 113 casos de melanoma | 52 (±17) | 60.2 | EEII: 40.7% Tórax: 17.7% EESS 14.16% Cabeza y cuello: 13.27% Abdomino-lumbar: 4.42% Mucosas 0.88% | Extensión superficial: 35.8% Nodular: 29.6% Acrolentiginoso: 21% Léntigo Maligno: 7.4% Mixto: 4.9% Mucoso: 1.2% | I: 20.35% II: 13.27% III: 11.5% IV: 4.42% No especificado: 50.44% |
| Santiago28 | – | 90 casos de melanoma | 50 | Zonas fotoexpuestas: 57.78% Zonas no fotoexp: 42.22% | Tumores histológicamente agresivos: 54.4% | ||
| Santiago29 | 1976-2001 | 569 casos melanoma | 51.8 (1-96 años) | 54.5 | Cabeza: 36% EEII: 31% Tronco: 18% EESS: 13% Otros: 2% | In situ: 24.6% Invasor: 24.6%: Extensivo superficial: 27.4% Nodular: 17% Lentigo Maligno: 12.3% Lentiginoso Acral: 9.5% Otros: 5.8% No clasif: 3.3% | Melanoma invasor: promedio 1.2 mm. |
| Temuco21 | 1995-2008 | 170 casos melanoma | 59 (13-93) Mujeres, 61 (17.87) Hombre | 48,8 | Cabeza y cuello: 26.47% EESS: 11.18% Tronco: 9.41% EEII: 45.88% Desconocido: 7% | Nodular: 35.29% Acral lentiginoso: 19.41% Extensivo superficial: 27.06% Lentigo Maligno: 12.35% Desconocido: 5.88% | Nivel de Clark: I: 16.47% II: 9.41% III: 12.94% IV: 35.29% V: 18.82% Desconocido 7% |
| Santiago30 | 1992-2001 1994-2008 | 1148 casos de MM (575 casos Hosp. Público y 573 casos de clínicas privadas) | 51.9 (16.3) en Clínica privada y 60.3 (16.7) en Hospital público | 60 | Cabeza y cuello: 23.43% Tronco: 19.6% EESS: 10.8% EEII: 29.09% Desconocido: 17.07% | – | – |
| Santiago31 | 1996-2002 | 446 tumores cutáneos (37 melanoma) | 59.3 (28-96) | 64.9 | – | – | – |
Dada la relación que existe entre exposición solar y cáncer cutáneo, desde hace décadas se han estudiado los hábitos de exposición solar de los individuos. Ya en la primera encuesta nacional de salud norteamericana (NHANES I) realizada entre 1971 y 1974, se estimó el grado de radiación solar recibido por los sujetos examinados. Un dermatólogo clasificó como leve, moderada y alta, la exposición solar recibida por el individuo examinado, según su ocupación y la cantidad de horas en que desarrolla actividades al aire libre. Se encontró que los hombres tienen 1.7 veces más exposición alta comparado con las mujeres, esto tanto para raza blanca (21.8% vs 12.8%) como para raza negra (20.1% vs 11.5%)32. Posteriormente se evaluó la presencia de episodios de quemaduras solares, a través de una encuesta telefónica a estadounidenses mayores de 18 años de todos los estados en los años 1999, 2003 y 2004. El reporte de quemaduras solares fue de 31.8% en 1999, 33.6% el 2003 y 33.7% el 2004. Las quemaduras solares fueron más frecuentes en hombres y blancos no hispanos, en los tres años de encuesta33.
También se midió el antecedente de quemaduras solares en Inglaterra en 1999, observándose que un 43% de los hombres y 35% de las mujeres las había presentado en el último año. Los factores asociados a quemaduras solares encontrados fueron ser hombre, fototipo claro y ser joven. Además de lo anterior se encontró que un 34% de los hombres y 39% de las mujeres tenían la intención de broncearse, y esto se correlacionó con haber presentado quemaduras solares34.
En Chile, posterior a que Valdés y cols. demostraron que la mortalidad por cáncer de piel aumentó un 62% entre 1987 y 199835, Molgó y cols. realizaron una encuesta de hábitos de exposición solar a 1143 sujetos en balnearios ubicados entre la II y X región, durante Enero y Febrero del 200436. El 37% de los encuestados señaló exponerse más de 2 horas durante el horario de más riesgo, entre las 11 y 16 horas. Las mujeres y menores de 25 años fueron los grupos de mayor exposición solar durante ese periodo de mayor riesgo (p 0.009 y p 0.013). Con respecto a medidas de fotoprotección el 54% refirió usar algún medio físico (sombrero, quitasol o ropa oscura), 50% protección ocular (lentes de sol) y 70% crema con filtro solar. En todas estas medidas los menores de 25 años, son los que menos las utilizan, y los hombres usan menos protección ocular y crema con filtro solar. El 38% de los individuos reconoció haber presentado más de una quemadura solar en los últimos 2 años, éstas fueron más frecuentes en los menores de 15 años (p<0.001) y en mujeres, lo que difiere a lo reportado en Estados Unidos33 y Reino Unido34, en donde se observó mayor frecuencia en hombres.
En otro estudio chileno37, realizado en 265 estudiantes de la salud chilenos, se observó que sólo un 26.4% de ellos declaró que estar bronceado es dañino para la salud, 87.2% lo considera atractivo y un 22.3% de los estudiantes considera que estar bronceado es saludable. En relación con las quemaduras solares, 85% de los estudiantes reportó haberse quemado al menos una vez y 27.2% cinco o mas veces en su vida. El 21.1% refirió quemaduras en el último verano, cifra inferior a lo encontrado en Estados Unidos (33.7%) y el Reino Unido (39%), lo que podría explicarse por diferencias en el fototipo predominante de cada país. El uso de bloqueador solar fue reportado por 23% de los estudiantes sólo en verano, 55.8% declaró usarlo sólo cuando acude a una playa o piscina al aire libre y 9.8% refirió que nunca lo usaba. Similar a otros países el uso de crema con filtro solar fue mayor en mujeres que en hombres (p<0.05)37.
Por otra parte, Castrillon y cols durante el 200838, realizaron una encuesta en un centro de atención primaria de Santiago de Chile a 437 padres o cuidadores para analizar el conocimiento acerca de exposición solar y sus conductas de protección para sus niños. Encontraron que un 14.2% de los niños han presentado al menos una quemadura solar durante el último verano, cifra menor que otros estudios en niños, como el de Irlanda en donde el 46.1% de ellos presentó quemaduras solares, exponiéndose mas de 2 horas diarias al sol durante el último verano39. Cabe destacar que en esta población un 59.3% es de fototipo I y II a diferencia del estudio chileno con un 46%, lo que podría explicar esta diferencia. Se observó que un 43.2% de los niños usan bloqueador solar en el verano frecuentemente, sin embargo un porcentaje bastante menor (16.4%) declara usarlo tres veces al día, como es lo correcto. Un porcentaje importante de niños (31.4%) declaró estar bajo el sol en verano durante las horas de más calor38.
Durante el año 2016 se realizó un estudio en población agrícola chilena donde se observó que los hombres y las personas de nivel educacional bajo tenían peores hábitos de protección a la radiación solar. Sin embargo, las personas de nivel educacional alto, habían sufrido mayor cantidad de veces en su vida quemaduras solares graves, lo que podría explicarse por su mayor acceso a días de vacaciones en playas o piscinas, donde existe generalmente una exposición más prolongada al sol40. A pesar de que los hábitos y medidas de protección han mejorado con los años36, aún existe una brecha según el nivel educacional, por lo que sigue siendo de vital importancia insistir en los programas educativos sobre los riesgos de la exposición solar.
La exposición a fuentes artificiales de rayos ultravioleta con fines estéticos es una práctica bastante extendida en Chile. Existen numerosos centros que ofrecen esta prestación a pesar de ser considerada como un potente carcinógeno cutáneo. Específicamente, en relación a melanoma, en una revisión sistemática de la literatura se estableció que con una exposición a solarium antes de los 35 años de edad se aumenta significativamente el riesgo de melanoma (Riesgo Relativo: 1.75; IC 95%: 1.35-2.26)41.
La evidencia actual sugiere que a pesar de que existe conocimiento sobre los efectos nocivos de la exposición solar, sigue existiendo un número importante de personas que se exponen en exceso al sol y presentan quemaduras solares durante el último año, por lo cual es imperativo aplicar campañas de salud pública con el fin de mejorar estas cifras, evitar los efectos dañinos del sol y frenar el aumento en la incidencia de cáncer de piel que se ha observado en los últimos años.
Se debe concientizar a la población en que el bronceado de la piel produce fotodaño y no es una actividad saludable, y entregar información sobre la importancia de la fotoprotección, tanto en el uso de filtros químicos como físicos,. Es fundamental aplicar una cantidad adecuada de fotoprotector en forma repetida, con el fin de asegurar la eficacia del producto. Se recomienda aplicar al menos una cucharadita de té por cada extremidad, 30 minutos antes de la exposición y repetir cada 2 horas, o mas frecuentemente en caso de sudoración escesiva o baño. En varios países existe ropa especial que otorga protección tanto para niños como adultos. Como obtenerla tiene algunos costos, una alternativa es utilizar ropa manga larga, idealmente de colores oscuros, y sombreros de ala ancha. Ademas de lo anterior es importante fomentar una cultura de fotoprotección, buscando siempre la sombra y no exponiéndose al sol en el horario peak de radiación entre las 11 y 16hrs.
DIAGNÓSTICO PRECOZSituación en ChileEn las etapas iniciales de la enfermedad el espesor de la lesión primaria es el factor pronóstico más relevante. Se observan sobrevidas sobre 90% en los melanomas diagnosticados in situ o de menos de 0.75mm de espesor20.
En los estudios descriptivos del área pública en Chile el diagnóstico en estas etapas iniciales es poco frecuente. En el estudio retrospectivo de 170 casos de melanoma maligno tratados entre los años 1995 y 2008 en el Hospital Hernán Henríquez Aravena de Temuco la frecuencia de melanoma in situ fue de 12.4% en los hombres y 23.4% en las mujeres. El espesor máximo según Breslow mostró un promedio entre los hombres de 5.5mm, y en las mujeres de 5.84 mm21 (Tabla 5).
Espesor máximo según Breslow de melanomas distribuidos según sexo21
| MUJER | HOMBRE | |||||
|---|---|---|---|---|---|---|
| Variable n | X (mm) | Desv. Std | n | X (mm) | Desv. Std | Valor p |
| 68 | 5.55 | ±4,81 | 59 | 4.81 | 5.84 | 0.127 |
En el estudio de la Dra Zemelman de 70 casos de melanoma maligno acral en la población consultante de hospitales públicos de Santiago se observó melanoma in situ en el 14.3% de los casos e invasivo en el 62.9%, el 22.9% no estaba clasificado. El espesor fue mayor de 1.7mm en el 52.9% de los casos en que esta información estaba consignada23.
En el área privada de Santiago la situación es diferente. En el análisis descriptivo de 561 biopsias con diagnóstico de melanoma entre los años 2006 y 2012 en un laboratorio de dermatología de la región metropolitana, el diagnóstico histológico fue melanoma in situ en el 52.88% de los pacientes e infiltrante en 47.12%. Este último grupo se analizó en base al índice de Breslow, observando que el 32.687% de los pacientes se encontraba en etapa T1 (menos de 1mm de espesor)24.
Se han diseñado múltiples estrategias para mejorar el diagnóstico precoz. Estas incluyen identificación de poblaciones de alto riesgo para aplicar, en este grupo, programas especiales de educación y de pesquiza precoz, y en la población general, enseñar y estimular el autoexamen de la piel, aumentar la frecuencia del examen cutáneo completo en el contexto de una evaluación médica rutinaria42.
Los pacientes con antecedentes personales de melanoma constituyen un grupo de alto riesgo. En el estudio de la base de datos prospectiva del Memorial Sloan Kettering se observó un riesgo acumulativo a 5 años de desarrollar un segundo tumor de 11.4% (95% CI, 10.2%-12.6%), con más de la mitad del riesgo concentrado en el primer año de seguimiento. Cuando el paciente ha desarrollado un segundo melanoma la incidencia acumulada a 5 años de un tercer melanoma es de 30.9%, y la mitad de los casos se observan durante el primer año de seguimiento. En los pacientes con melanoma múltiple se observó una mayor prevalencia en relación a la población general de historia familiar de melanoma y de nevos displásico al examen físico. Cuando estas características están presentes el riesgo de desarrollar un segundo o tercer melanoma es aún mayor43.
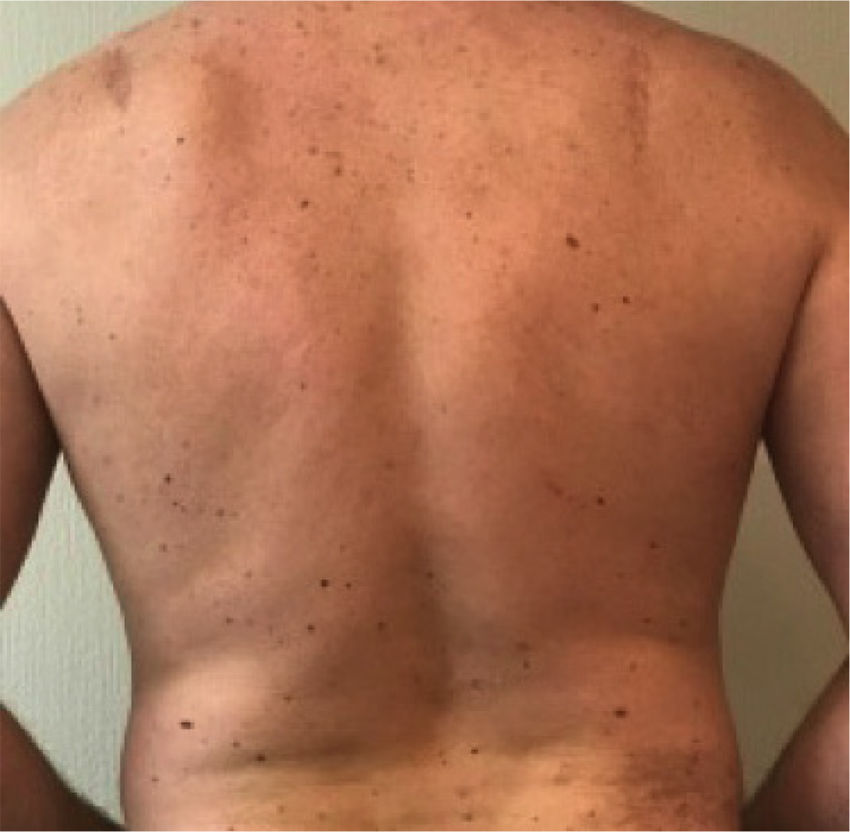
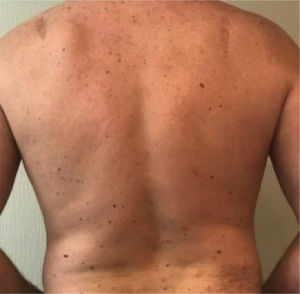
Otro grupo de alto riesgo son los miembros de familias con predisposición al desarrollo de melanoma, muchas veces asociado al fenotipo de nevos displásicos múltiples (Figura 1) y en algunas familias al desarrollo de otras neoplásica (Ej. Adenocarcinoma de páncreas). El riesgo de melanoma en los miembros de estas familias aumenta entre 30 a 70 veces en relación a la población general. Si además de una fuerte historia familiar de melanoma tiene nevos displásicos, el riesgo de desarrollar melanoma durante su vida puede llegar al 80%. En los portadores de mutaciones que pertenecen a familias CDKN2A (+) la penetrancia es en promedio de 30% a los 50 años y 67% a los 80 años44.
Estos grupos de alto riesgo que deben incluir a pacientes inmunodeprimidos o portadores de enfermedades genéticas que predisponen al desarrollo de melanoma deberían ser incluidos en programas con educación continua para estimular la aplicación de medidas de protección solar y el autoexamen, además de consultar regularmente para un examen periódico de toda la piel.
En la población general los pacientes juegan un rol importante en el diagnóstico de melanoma. Se ha reportado que más del 72% de los melanomas es detectado por el paciente o sus familiares. Alertar a la población de los signos sospechosos de melanoma contribuye al diagnóstico precoz de las lesiones. Hace ya varios años se ha instaurado el acrónimo del ABCDE (Asimetría, Borde irregular, más de dos Colores, Diámetro mayor a 6mm. y Evolución en el tiempo) para recordar los signos de un nevo que deben llamar la atención a la población. A pesar de no ser tan sensible, se recomienda ampliamente por su simpleza y buena concordancia interobservador45. Un componente importante de la educación es el autoexamen de la piel, es una herramienta barata, no invasiva y hay múltiples reportes que han demostrado su eficacia. Las lesiones que se detectan en los pacientes que realizan regularmente un autoexamen son de menor espesor42. El médico es el instructor ideal para enseñar y promover la ejecución regular del autoexamen46.
El examen completo de la piel durante una evaluación rutinaria tiene un rol clave en la detección precoz del melanoma. El médico puede detectar lesiones sospechosa con cambios sutiles o lesiones que escapan al campo visual del paciente. En promedio las lesiones detectadas por médicos son de espesor significativamente menor que las detectadas por los pacientes42. Además es una oportunidad valiosa para educar al paciente en el autoexamen y en el reconocimiento de características que hacen sospechar la presencia de un melanoma. Desafortunadamente existen múltiples barreras para que esta sea una práctica habitual: falta de tiempo, falta de entrenamiento para reconocer lesiones, falta de énfasis durante la educación médica del valor de esta práctica clínica, condiciones inadecuadas de luz y temperatura en la sala de examen, entre otros.47,48 Muchos pacientes en el momento del diagnóstico de un melanoma relatan haber sido evaluados médicamente por otros motivos durante el último año.
En centros especializados se puede agregar dermatoscopía que ayuda a discriminar entre lesiones benignas y malignas evitando biopsias innecesarias. La dermatoscopía usa un microscopio de mano llamado dermatoscopio que está equipado con un lente de aumento y una fuente de luz. Permite al clínico visualizar estructuras por debajo el nivel del estrato córneo a la profundidad de la dermis superficial. En otras palabras, la dermatoscopia ha abierto una nueva dimensión en la evaluación morfológica de las lesiones cutáneas al revelar colores y estructuras que normalmente no son visibles a simple vista49.
También el mapeo de lunares, que consiste en el registro fotográfico de toda la superficie cutánea de un individuo, con el objetivo de evaluar las lesiones preexistentes a través del tiempo. El procedimiento se realiza según un protocolo que estandariza las posiciones corporales adecuadas y mantiene condiciones de luz, fondo y distancia repetibles. El conjunto de imágenes obtenidas se utiliza como una referencia al momento de examinar al paciente en controles futuros. Estudios que han evaluado la utilidad del método han reportado que su principal utilidad sería mejorar la detección de lesiones nuevas y lesiones con cambios morfológicos significativos, aumentando la probabilidad de detectar melanomas en estadíos más precoces en que el único elemento sospechoso es la aparición tardía de una lesión pigmentada o cambios sutiles en una lesión preexistente. El mapeo de lunares es de mayor utilidad en pacientes con nevos atípicos múltiples (Figura 1) o en pacientes con nevos múltiples y riesgo de melanoma50–52.
CONCLUSIÓNLos datos presentados confirman la necesidad de intensificar los esfuerzos para disminuir la mortalidad por melanoma en Chile mediante campañas de alerta poblacional que incentiven el autocuidado en relación a la exposición solar, el autoexamen periódico y el reconocimiento y consulta precoz por lesiones sospechosas de melanoma. Además se debería reforzar durante la educación médica la participación en los esfuerzos de educación de la población, el valor del examen completo de la piel, el reconocimiento de las manifestaciones iniciales de un melanoma cutáneo, y la identificación de grupos de alto riesgo para su derivación oportuna a centros especializados.
DECLARACIÓN DE INTERESESLos autores declaran no tener conflictos de interés, no existen vínculos con empresas farmacéuticas o de dispositivos médicos y no se recibió financiamiento para la escritura del artículo.