La neumonía adquirida en la comunidad es una enfermedad frecuente en todas las edades. Los agentes “atípicos” Mycoplasma pneumoniae, Chlamydophila pneumoniae y Legionella pneumophila constituyen un grupo de bacterias con características microbiológicas y clínicas particulares que se deben conocer para lograr un diagnóstico oportuno y un tratamiento antibiótico adecuado.
Community-acquired pneumonia is a common disease in all ages. The “atypical” agents Mycoplasma pneumoniae, Chlamydophila pneumoniae and Legionella pneumophila constitute a group of bacteria with particular microbiological and clinical characteristics that must be known for a timely diagnosis and adequate antibiotic treatment.
La neumonía adquirida en la comunidad (NAC) sigue siendo una enfermedad común, potencialmente grave y mortal, especialmente en niños del tercer mundo. El agente causal más frecuente de neumonía bacteriana continúa siendo Streptococcus pneumoniae, sin embargo, en las últimas décadas los agentes etiológicos detectados han variado debido a la introducción de vacunas conjugadas y al uso de técnicas de biología molecular que han permitido la identificación de nuevos patógenos1.
El término “neumonía atípica” fue usado por primera vez por Reimann en 1938 cuando describe varios casos de “neumonía severa, difusa, atípica”, que se diferenciaban clínicamente de las neumonías clásicas2. Eaton en 1944, aisló por primera vez desde una muestra de esputo, un microorganismo que ocasionaba una neumonía severa, difusa y no condensante, que correspondía a lo que en ese momento definió como neumonía atípica3. Fue Chanock en 1963 quien cultivó exitosamente este microorganismo, lo clasificó como una bacteria del género Mycoplasma y más tarde recibió su nombre completo, Mycoplasma pneumoniae4.
Los avances en las técnicas de diagnóstico microbiológico y de biología molecular han permitido mejorar la descripción del cuadro clínico y aislar otros agentes infecciosos capaces de provocar una neumonía con presentación clínica similar.
ETIOLOGÍALos microorganismos atípicos representan hasta un tercio de las NAC5,6. Mycoplasma pneumoniae es la principal causa de neumonía atípica7, le sigue en frecuencia Chlamydophila pneumoniae8 y en forma casi anecdótica Legionella pneumophila que tiene mayor incidencia en Europa. Los virus respiratorios y otros agentes infrecuentes como la Coxiella burnetii (Fiebre Q) escapan a esta revisión.
MYCOPLASMA PNEUMONIAEMicrobiología-EpidemiologíaMycoplasma pneumoniae es una bacteria pequeña, con DNA de doble hebra, pleomórfica, sin pared celular y agente intracelular obligado. Causa entre el 10 y el 40% de las neumonías adquiridas en la comunidad en niños9, encontrándose en el grupo de mayores de 5 años, las frecuencias más elevadas (cercanas al 40%). La infección ocurre durante todos los meses del año, observándose cierto aumento en otoño y primavera cuando los virus respiratorios han disminuido. Se observan brotes epidémicos cada 4 a 7 años que se han atribuido a la disminución de la inmunidad de rebaño y a la introducción de nuevos subtipos en la población10.
La incidencia de infección es 4 por 1000 niños por año, siendo mayor en poblaciones cerradas o en familias numerosas11. La infección del tracto respiratorio inferior es más común comenzando la edad escolar (5 años), pero está siendo cada vez más reconocida en niños pequeños. Un estudio realizado en Italia entre octubre 2005 y agosto 2006, en 866 niños con diagnóstico de infección del tracto respiratorio inferior, detectó -mediante PCR en muestra faríngea- 102 casos positivos para Mycoplasma pneumoniae. De ellos, un 38% correspondía a menores de 5 años, incluyendo 8 lactantes menores de 8 meses de edad12.
Las reinfecciones por Mycoplasma pneumoniae pueden ocurrir, sin embargo estos episodios habitualmente son de menor gravedad que la primoinfección. Se ha descrito además que tras un primer cuadro grave, las reinfecciones son menos probables11.
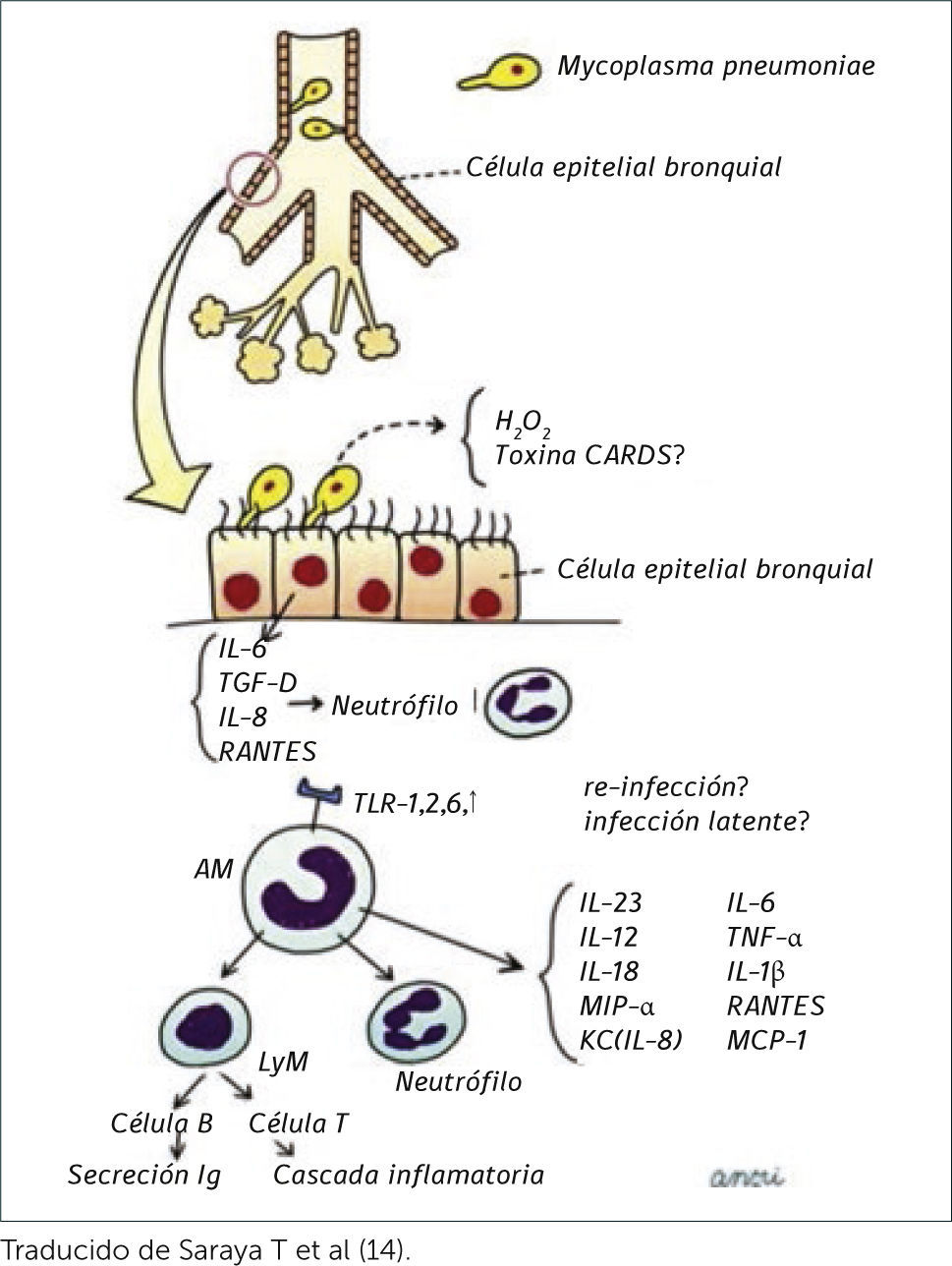
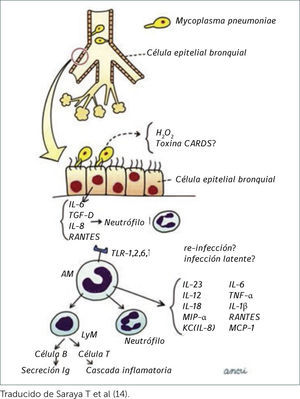
PatogeniaLa evolución clínica dependerá de la virulencia del agente y de la respuesta inmune del huésped. El mecanismo de contagio por Mycoplasma pneumoniae ocurre de persona a persona mediante transmisión por gotitas, con un período de incubación de 2 a 3 semanas. Figura 1.
ESQUEMA DE LA PATOGÉNESIS DE LA NEUMONÍA PRODUCIDA POR MYCOPLASMA PNEUMONIAE.
Traducido de Saraya T et al14.
Una vez inhalado se une al epitelio respiratorio donde progresivamente desencadena un proceso inflamatorio13. La bacteria se adhiere a la mucosa a través de un organelo especializado, la ausencia de pared celular del Mycoplama pneumoniae facilita el contacto estrecho con la célula huésped garantizando el intercambio de los componentes necesarios para su crecimiento y proliferación, luego radicales peróxido y superóxido producen stress oxidativo celular. Una ADP-ribosiltransferasa conocida como toxina del síndrome de distress respiratorio adquirido en la comunidad (CARDS) se une a la proteína A del surfactante y penetra en la célula huésped por endocitosis. Esta toxina produce ciliostasis, fragmentación nuclear y estimula la producción de citoquinas y una reacción inflamatoria celular aguda produciendo daño en la vía aérea. La cantidad de toxina producida se correlaciona con la severidad de la enfermedad10.
Otro importante factor de virulencia del Mycoplasma pneumoniae es la presencia de lipoproteínas con potentes propiedades inflamatorias: MALP-2, P48 y M161Ag. Estas lipoproteínas modulan la respuesta inmune del huésped vía receptores tipo Toll, cuya estimulación se relaciona con la producción de citoquinas que promueven la migración de linfocitos y neutrófilos y la inflamación en el tejido pulmonar14.
Mycoplasma pneumoniae también puede estimular linfocitos B y T e inducir la formación de autoanticuerpos que reaccionan con variados tejidos del huésped. La bacteria puede ser opsonizada por el complemento o anticuerpos. Los macrófagos activados migran hacia el sitio de la infección. Neutrófilos, linfocitos T CD4+, linfocitos B y células plasmáticas infiltran el pulmón y una intensa respuesta inmune humoral produce anticuerpos contra varias proteínas y lípidos inmunogénicos. La producción de anticuerpos puede estar ausente en pacientes inmunocomprometidos10.
La localización intracelular del Mycoplasma pneumoniae puede ser responsable de la protección de la bacteria frente a anticuerpos y antibióticos, lo que sumado a la inmunomodulación del huésped, permite que se establezcan infecciones persistentes y fenómenos autoinmunes15.
Manifestaciones clínicasMycoplasma pneumoniae puede producir infección en pacientes de todos los grupos etarios16. Si bien es cierto que los escolares y adolescentes son el grupo característicamente afectado, estudios realizados en Europa durante la epidemia del 2010-2011 sugieren altas tasas de infección en niños menores de 4 años10.
Aproximadamente el 20% de las infecciones son asintomáticas11. La presentación clínica habitual se caracteriza por odinofagia, fiebre baja y tos persistente, síntomas que son lentamente progresivos1. Los vómitos y la diarrea pueden afectar hasta el 20% de los pacientes. En el examen físico destacan los crépitos (40 a 73%) y sibilancias (53%)12,13.
Mycoplasma pneumoniae también produce manifestaciones extrapulmonares que son ocasionadas por propagación de la infección o mecanismos autoinmunes. Se han descrito otitis media, sinusitis, erupciones mucocutáneas llegando incluso a un síndrome severo similar al síndrome de Stevens-Johnson, miocarditis, pericarditis, anemia hemolítica, artritis séptica, glomerulonefritis y manifestaciones del sistema nervioso como meningitis aséptica, encefalitis, ataxia, mielitis transversa, neuropatía periférica, psicosis y síndrome de Guillain-Barré17.
La severidad de los síntomas tiende a ser mayor en escolares y adolescentes, quienes pueden tener más días de fiebre y patrones de neumonía más condensantes; los más pequeños tienen más síntomas respiratorios altos y gastrointestinales16. Ocasionalmente la infección puede ser fulminante e incluso fatal, no sólo en pacientes con inmunodeficiencias sino también en individuos sanos14.
Métodos diagnósticosEn niños ante la sospecha clínica de infección por Mycoplasma pneumoniae habitualmente se indica tratamiento empírico. Sin embargo, en pacientes hospitalizados, inmunosuprimidos, con comorbilidades o mala respuesta clínica al tratamiento, es necesaria la confirmación etiológica10. La historia clínica y la edad del paciente son los mejores predictores para establecer la causa de la neumonía1.
El hemograma no tiene características específicas. Existen estudios que han mostrado valores normales de recuento de glóbulos blancos y otros leucopenia con linfopenia. Se ha descrito también trombocitosis en algunos pacientes, fenómenos que pueden observarse en infecciones por virus y otros agentes que producen neumonías16.
En la radiografía de tórax los hallazgos son variables. En un estudio en niños hospitalizados con infección por Mycoplasma pneumoniae lo observado más frecuentemente fueron opacidades lineares perihiliares (60%), infiltrados reticulonodulares (40%) y consolidación segmentaria o lobar (28%). En algunos estudios la consolidación ha sido mencionada como el hallazgo más común. El derrame pleural se encuentra en alrededor de un 8% de los pacientes12,18,19.
Existen varios métodos para detectar la infección incluyendo cultivo, serología y estudio molecular. El cultivo se realiza excepcionalmente, debido a que se necesita un tiempo prolongado de incubación, tiene baja sensibilidad y disponibilidad limitada10,14. La serología fue por muchos años el método diagnóstico de elección10. Se basa en la detección de anticuerpos IgM que generalmente aparecen 7 a 10 días después de la infección y anticuerpos IgG que se pueden encontrar aproximadamente luego 3 semanas. La presencia de anticuerpos IgM indica infección reciente, pero pueden persistir por varios meses. La producción de anticuerpos puede estar ausente en pacientes inmunocomprometidos9,11.
Actualmente los test de amplificación de ácidos nucleicos son cada vez más utilizados, pueden ser obtenidos de una muestra nasofaríngea o faríngea y entregan resultados en forma rápida y con una alta sensibilidad (90-95%), lo que constituye una ventaja sobre la serología, ya que disminuye el uso excesivo de antibióticos, lo que a su vez previene la selección de cepas resistentes9,10,14.
Se ha sugerido que una combinación de IgM y reacción de polimerasa en cadena (PCR) serían el método diagnóstico óptimo, sin embargo, aumentan los costos de laboratorio10. No se debe olvidar que la coinfección de Mycoplasma pneumoniae con otras bacterias y/o virus no es rara, lo que debe ser considerado en el estudio.
TratamientoLos macrólidos son el tratamiento de elección en niños1. La resistencia a macrólidos causada por una mutación puntual en el dominio V de 23S rRNA emergió en Asia y se propagó a Europa y Norteamérica. Actualmente se han documentado tasas de resistencia de 46-93% en Japón, 69-97% en China, 30% en Israel, 9.8% en Francia y 8.2% en Estados Unidos.
Otra alternativa son las fluoroquinolonas que no se usan habitualmente en niños10. Según las guías de la Sociedad Americana de Enfermedades Infecciosas, en adolescentes pueden usarse levofloxacino o moxifloxacino debido a que han completado su maduración esquelética, pero los antibióticos de elección siguen siendo los macrólidos20.
Los beneficios de los corticoides sistémicos en infecciones graves han sido bien documentados en niños y adultos21,22.
Mycoplasma pneumoniae y AsmaEl asma es una enfermedad caracterizada por la presencia de infiltrado celular inflamatorio en la mucosa de la vía aérea y engrosamiento de la membrana basal epitelial23. Se ha demostrado que el microbioma de pacientes asmáticos es diferente al de individuos sanos en cuanto al número y diversidad de bacterias10.
La infección por Mycoplasma pneumoniae y el asma se relacionan estrechamente; el asma produce inflamación tipo Th2 en la vía aérea facilitando la infección y colonización por Mycoplasma pneumoniae. Por otro lado, esta bacteria produce inflamación, obstrucción bronquial, hiperreactividad y deterioro de la función pulmonar24.
Es importante diferenciar 2 conceptos: el rol del Mycoplasma pneumoniae en las exacerbaciones y su influencia en la hiperreactividad crónica de vía aérea. Con respecto al primer punto, existe fuerte evidencia de la infección por Mycoplasma pneumoniae como causa de exacerbaciones en pacientes asmáticos. La inflamación producida en la infección aguda es un factor gatillante de crisis durante al menos 6 meses10,23–25.
Por otro lado, en un estudio realizado en Taiwan publicado recientemente, se encontró que la infección por Mycoplasma pneumoniae en pacientes adultos, con y sin antecedente de atopia, podría inducir la aparición de la enfermedad, aumentando el riesgo independiente de la edad, sexo y comorbilidades estudiadas23. Otros autores ponen en duda esta relación, argumentando que es posible que en esos pacientes el asma no hubiera sido diagnosticada previamente o que tenían una enfermedad subclínica24.
El asma es una enfermedad heterogénea y compleja, la identificación de diferentes fenotipos ha permitido comprender parcialmente su fisiopatología, respuesta a tratamiento y pronóstico. La relación causa-efecto es difícil de demostrar, el rol de la infección por Mycoplasma peumoniae todavía no es claro.
CHLAMYDOPHILA PNEUMONIAEMicrobiología-EpidemiologíaChlamydophila pneumoniae es un patógeno intracelular obligado con una pared celular que contiene lipopolisacáridos, similar a las bacterias gram negativas. Tiene 2 formas características durante su ciclo de desarrollo: una forma intracelular, los cuerpos reticulares y una forma extracelular, infectante y metabólicamente inactiva, los cuerpos elementales26.
Es un patógeno común del tracto respiratorio, que afecta a todos los grupos etarios y con una amplia distribución geográfica. No hay evidencia de estacionalidad en cuanto a la frecuencia de infección, sin embargo, se describen epidemias cada 4 a 5 años26.
La edad más frecuente de primoinfección está entre los 5 y 15 años en regiones templadas y desarrolladas, pero puede ocurrir precozmente en regiones tropicales o menos desarrolladas. Estudios mediante serología han documentado el aumento de tasas de prevalencia en escolares llegando a 30-45% en adolescentes. Se estima que un 2 a 5% de los niños y adultos son portadores asintomáticos en nasofaringe26.
Diversos grupos han descrito la detección de Chlamydophila pneumoniae en casos de infecciones respiratorias bajas. Algunos han documentado ausencia de detección, otros en cambio, han encontrado Chlamydophila pneumoniae hasta en 44% de los casos. Es probable que estas variaciones se deban a diferencias en las características demográficas y a las técnicas de diagnóstico utilizadas en dichos estudios27,28.
PatogeniaLa infección se transmite por secreciones respiratorias de persona a persona o por fómites. Tiene un periodo de incubación de 21 días. Luego de la infección, los cuerpos elementales atacan la célula huésped por un proceso de unión electrostática y entran a la célula por endocitosis. Se forma un fagosoma donde los cuerpos elementales se diferencian en cuerpos reticulares. A las 36 a 48 horas que siguen a la inoculación, la multiplicación se detiene retornando a la forma infecciosa. Chlamydophila pneumoniae es un potente gatillante de inflamación que produce hipereactividad bronquial mediada por IgE. Además puede permanecer en estado de infección persistente donde la actividad metabólica se reduce, produciéndose infecciones subclínicas prolongadas26.
Manifestaciones clínicasLa mayoría de las infecciones por Chlamydophila pneumoniae son asintomáticas o leves. La infección a menudo comienza con un pródromo no específico de odinofagia, malestar general, cefalea, fiebre baja y tos. El curso es prolongado (2 a 6 semanas) y a menudo bifásico. Puede presentarse con síntomas respiratorios altos como faringitis, laringitis o sinusitis, pudiendo desarrollar bronquitis o neumonía. En el examen físico pueden aparecer faringitis no exudativa, sibilancias y crépitos. La edad está relacionada con la severidad de la enfermedad, los adolescentes desarrollan más frecuentemente infección del tracto respiratorio inferior.
Infecciones severas pueden complicarse con neumatoceles, derrame pleural, neumotórax, fibrosis intersticial y abscesos pulmonares. Otras complicaciones que han sido descritas incluyen otitis media aguda, eritema nodoso, artritis reactiva, síndrome de Guillain-Barré, meningoencefalitis, miocarditis y endocarditis.
Chlamydophila pneumoniae se ha relacionado con esclerosis múltiples, síndrome de fatiga crónica y enfermedad ateroesclerótica cardiaca, lo que no ha sido confirmado.
En relación a asma, se ha demostrado el rol de Chlamydophila pneumoniae en exacerbaciones, por lo que algunos sugieren incluirla en el screening de pacientes descompensados28. Un estudio donde se buscó IgE específica para Chlamydophila pneumoniae mostró una fuerte asociación entre ésta y la severidad de la enfermedad30. La mortalidad se asocia con comorbilidades o infecciones secundarias.
Métodos diagnósticosNo existen hallazgos de laboratorio o radiológicos específicos. El recuento de leucocitos es a menudo normal o levemente elevado. La VHS está típicamente elevada. La radiografía muestra habitualmente un patrón intersticial sin consolidación. El derrame pleural es infrecuente.
Como método diagnóstico puede realizarse cultivo de nasofaringe, esputo o líquido pleural, sin embargo, el cultivo tiene limitaciones debido a su complejidad técnica, disponibilidad limitada y rendimiento variable. Con respecto a la serología, los anticuerpos IgM aparecen en 2 a 3 semanas y los anticuerpos IgG 6 a 8 semanas después de la infección. Aunque la RPC es prometedora, aún no existen pruebas comerciales validadas y estandarizadas27.
TratamientoChlamydophila pneumoniae es susceptible a macrólidos, tetraciclinas y quinolonas, sin embargo estas 2 últimas opciones no están recomendadas como primera elección en niños. Se sugiere el uso de eritromicina por 14 días, claritromicina por 10 días o azitromicina por 5 días.
LEGIONELLA PNEUMOPHILAMicrobiología-EpidemiologíaLegionella pneumophila fue identificada por primera vez en 1977 cuando un grupo de legionarios que concurrían a un congreso en Philadelphia comenzaron a enfermar de neumonía. De los 182 pacientes documentados, 19 (16%) murieron. Es una bacteria gram negativa, con requerimientos de crecimiento estrictos y que infecta a los seres humanos cuando se exponen a fuentes de aguas contaminadas.
Rara en niños, su incidencia exacta es desconocida, se le atribuyen el 2 a 9% de las NAC, aunque se piensa que existe un subdiagnóstico de la enfermedad. Existe variación estacional, 62% de los casos se produce en verano y a principios de otoño30.
PatogeniaSe transmite por la inhalación de aerosoles contaminados. Tiene un periodo de incubación de 2 a 14 días. Legionella pneumophila serogrupo 1 es la especie con mayor virulencia. La bacteria se adhiere a la célula huésped, donde se multiplica en forma intracelular. Factores de virulencia incluyen varias citocinas, proteínas de shock caliente, fosfolipasas, lipopolisacáridos, que se asocian con absorción de fierro, metaloproteasas y beta lactamasas30–32.
Manifestaciones clínicasLegionella pneumophila causa síntomas variables. La neumonía puede tener presentación clínica similar a la neumonía por Streptococcus pneumoniae. Puede existir un pródromo manifestado por cefalea, mialgias, astenia y anorexia. La fiebre es frecuente, aunque puede estar ausente en inmunocomprometidos. Además se describen síntomas gastrointestinales como diarrea, nauseas, vómitos y dolor abdominal y síntomas neurológicos que pueden llegar a obnubilación, convulsiones y síntomas de focalización. En pacientes inmunocomprometidos la neumonía es la presentación clínica habitual con una alta mortalidad.
En una pequeña proporción de casos se han descrito síntomas extrapulmonares como esplenomegalia, ruptura esplénica, pericarditis, miocarditis, endocarditis, infecciones de heridas, artritis e infecciones de sistema nervioso central. La fiebre Pontiac es una enfermedad febril, sin neumonía, generalmente benigna, asociada a la exposición a la bacteria.
Métodos diagnósticosHallazgos no específicos de laboratorio que pueden encontrarse son hiponatremia, hipofosfemia, aumento de creatinkinasa, mioglobinuria, leucocitosis con linfopenia relativa, proteína C reactiva y VHS elevadas, aumento de la ferritina sérica y hematuria microscópica.
La radiografía de tórax no tiene características patognomónicas. El patrón en parches es el más común, con infiltrados que progresan a la consolidación, sin embargo, se han descrito infiltrados pulmonares de todo tipo. El derrame pleural se observa en 15 a 50% de los pacientes hospitalizados30.
La detección de antígeno urinario es una técnica de diagnóstico rápida y ampliamente utilizada. El test es positivo a las 48-72 horas de inicio de los síntomas, pudiendo mantenerse positivo por varias semanas o meses. Tiene una sensibilidad de 56 a 99%30. También están disponibles las técnicas de amplificación de ácidos nucleicos en esputo, orina o sangre, que son más sensibles que el cultivo y tienen una alta especificidad. Sin embargo, se necesita mayor experiencia en el uso clínico de esta técnica32.
TratamientoMacrólidos, tetraciclinas y quinolonas son efectivas. La duración recomendada es de 3-5 días de azitromicina o 5-10 días levofloxacino, se recomienda extender la duración del tratamiento en inmunosuprimidos30.
Los autores declaran no tener conflictos de interés, en relación a este artículo.