La osteoporosis es una enfermedad compleja que resulta de la interacción de células del sistema óseo, principalmente osteoblastos, osteoclastos y osteocitos, que está regulada por varias hormonas y citokinas que interactúan sobre un variado sistema de transducción de señales que derivan en reabsorción o formación de hueso.
En varias enfermedades reumáticas este delicado balance se pierde por efecto de la enfermedad misma, aunque también influye poderosamente el tratamiento empleado.
En este artículo se revisa el mecanismo general de la fisiología del tejido óseo y su alteración por la inflamación, que son la base de las enfermedades reumáticas. También se revisa la pérdida de masa ósea inducida por esteroides y su tratamiento.
Osteoporosis is a complex disease that results from the interaction of cells in the bone marrow, mainly osteoblasts, osteoclasts and osteocytes, which is regulated by several hormones and cytokines that interact on a variety of signal transduction system that lead to bone resorption or formation.
In several rheumatic diseases this delicate balance is lost due to the disease itself, but also strongly influenced by the treatment used.
This article reviews the general mechanism of bone physiology and its alteration by inflammation, which are the basis of rheumatic diseases. We also review the bone loss induced by steroid and its treatment.
La osteoporosis es una enfermedad caracterizada por una disminución de la densidad mineral ósea con alteraciones de la microarquitectura y aumento del riesgo de fractura. Es de origen multifactorial participando en su etiología factores genéticos y ambientales. Se la clasifica en primaria cuando depende de procesos fisiológicos como la menopausia y el envejecimiento normal, o secundaria cuando está condicionada por otras patologías directamente o en relación a medicamentos como es el caso de las osteoporosis secundarias a enfermedades reumáticas y la osteoporosis inducida por glucocorticoides (OIG).
El recambio óseo es un proceso intrincado mediado principalmente por células que forman hueso, los osteoblastos y otras que reabsorben hueso, los osteoclastos. Se sabe desde hace mucho, que este acoplamiento de formación y reabsorción ósea se altera en los procesos inflamatorios crónicos como sucede por ejemplo, en las enfermedades reumáticas. Sabemos que la relación entre inflamación y recambio óseo es compleja. Ciertas enfermedades inflamatorias como la artritis reumatoide se caracterizan principalmente por pérdida de masa ósea, otras como la espondiloartritis anquilosante, se caracterizan por neoformación ósea, entesitis y osteoporosis.
Fisiología del recambio óseoLa formación de hueso comienza en la etapa fetal y continúa durante la infancia y adolescencia hasta la madurez esquelética, mediante diversos procesos de osificación. En la adultez, el esqueleto se remodela continuamente por un mecanismo de resorción y formación de hueso que permite regenerar el tejido óseo para mantenerlo biológica y estructuralmente sano, y permite además realizar movimientos de iones de calcio y fósforo. La “unidad de remodelamiento óseo” involucra a cada uno de los grupos de células activadas coordinadamente para ello y los estrógenos tienen un rol en todas las etapas de este proceso.
Cada ciclo de remodelamiento óseo es iniciado por la activación de precursores osteoclásticos que se fusionan formando osteoclastos multinucleados maduros. Luego, éstos forman el borde rugoso en su membrana y se adhieren a la superficie ósea, creando un microambiente aislado del espacio extracelular, y liberan enzimas proteolíticas y radicales libres, entre otros. Luego de 2 a 4 semanas desaparecen los osteoclastos de la zona de remodelación, apareciendo los preosteoblastos que se diferencian a osteoblastos maduros y sintetizan osteoide que rellena la cavidad generada por la acción osteoclástica. Uno de los principales inhibidores fisiológicos del reclutamiento, diferenciación y sobrevida de los osteoclastos son los estrógenos, ejerciendo un trascendental rol antiresortivo óseo. Además, son un potente estímulo para el reclutamiento y activación osteoblástica, permitiendo la formación y recambio de hueso.
La matriz ósea así sintetizada, formada en 90% por colágeno tipo 1, posteriormente se mineraliza con cristales de hidroxiapatita bajo la influencia de la vitamina D y de proteínas osteoblásticas. Luego de esta fase, los osteoblastos quedan en etapa de reposo como células de recubrimiento en la superficie de los huesos, o quedan atrapados en la matriz mineralizada diferenciándose a osteocitos.
El ciclo de remodelación ósea dura habitualmente 3 a 4 meses. En condiciones normales, en los adultos jóvenes el balance de este proceso es neutro, es decir la masa ósea total no cambia, los estrógenos mantienen el acoplamiento entre formación y pérdida: remodelamiento acoplado. La activación excesiva de estas unidades, en número o en intensidad de resorción como ocurre con la deficiencia estrogénica, desacopla la remodelación ósea hacia un aumento de la resorción, y se asocia a fragilidad y a aumento del riesgo de fracturas.
La regulación del metabolismo óseo está determinada por múltiples hormonas y mediadores sistémicos y todos éstos ejercen su acción sobre la resorción y la formación ósea a través de reguladores locales. Las hormonas más importantes involucradas son:
- •
Hormonas sexuales, fundamentalmente estrógenos.
- •
Hormonas reguladoras del metabolismo fosfocálcico: hormona paratiroidea (PTH), calcitonina y vitamina D.
- •
Glucocorticoides.
- •
Hormonas tiroideas.
- •
Hormona de crecimiento.
- •
Otros factores de crecimiento sistémicos.
El activador del receptor del factor nuclear (RANK: Receptor Activator of Nuclear factor Kappa beta) se expresa en la superficie de los osteoclastos y está involucrado en su activación mediante la unión al ligando de RANK (RANK-L). A su vez, RANK-L se expresa en los osteoblastos y en las células estromales de la médula, y es el encargado de la activación del receptor RANK del sistema osteoclástico, gatillando el reclutamiento, diferenciación y activación de ellos y previniendo su apoptosis (1). Para equilibrar este proceso, también participa la osteoprotegerina. Esta es una proteína soluble secretada por los osteoblastos, que se une al RANK-L impidiendo que se una al receptor RANK de los osteoclastos, bloqueando esta interacción. La osteoprotegerina ejerce así un rol inhibidor de la actividad osteoclástica (2).
Todas las hormonas sistémicas actúan sobre los osteoblastos y sobre el sistema RANK/RANKL y, según el efecto que predomine, será el balance neto de formación o resorción ósea en el proceso de remodelado.
Los estrógenos en particular, además de inhibir la activación del remo-delamiento óseo, actúan directa e indirectamente inhibiendo la resorción ósea, aumentando la osteoprotegerina y disminuyendo el RANK-L (3). Diversos factores que regulan la proliferación y diferenciación celular participan también en la remodelación ósea, y los estrógenos también juegan un rol en esta regulación (4). Por un lado, citokinas de tipo interleukinas (IL-1, IL-6,) y TNF-α, y prostaglandinas estimulan la actividad osteoclástica y, por ende, resortiva ósea; los estrógenos inhiben la producción de citokinas, especialmente TNF-α, de conocido efecto resortivo en la postmenopausia y en otras condiciones fisiopatológicas en que ocurre inflamación. Por otro lado, factores como el TGF-β inducen apoptosis osteoclástica y probablemente activación osteoblástica.
Los osteocitos están interconectados a través de procesos dendríticos en los canalículos del hueso y juegan un rol fundamental en la salud esquelética. De hecho, los osteocitos representan aproximadamente el 95% de las células óseas. Estos son sensibles a la carga mecánica por lo que se han llamado los mecanorreceptores del hueso. En respuesta a cambios en la carga mecánica o en relación a microfracturas, los osteocitos activan procesos de resorción y formación ósea.
Estas acciones están mediadas por un sofisticado sistema descrito recientemente: la señalización del sistema Wnt como uno de los más importantes reguladores del modelado (formación) y remodelado esquelético otorgando gran importancia a los osteocitos en el anabolismo óseo. De acuerdo a este modelo, la regulación de la diferenciación y actividad osteoblástica ocurre por estímulo directo del mensaje dado por los osteocitos en respuesta a la percepción de los cambios de carga sobre los huesos y en la detección de microdaños. Las diversas formas de las proteínas Wnt se unen al receptor “frizzled” o fzl cuyo co-receptor es el LRP-5 en la membrana osteoblástica y juntos traducen las señales de Wnt. La LRP-5 es la proteína relacionada 5 del receptor de lipoproteínas de baja densidad pero, a pesar de su nombre, está relacionada con el metabolismo óseo y no lipídico. En un proceso complejo, esta activación lleva a la estabilización de la (β-catenina que a su vez promueve la multiplicación y diferenciación osteoblástica (5, 6). La proteína soluble Dickkopf (Dkk) y el producto del gen SOST (esclerostina), originado en los osteocitos, antagonizan este proceso.
Existe evidencia que β-catenina son importantes en la capacidad del osteocito de funcionar como un mecanorreceptor, es decir para responder a los cambios dependientes de la carga mecánica.
En síntesis, la estimulación del sistema RANK favorece el reclutamiento, actividad y sobrevida osteoclástica. Este sistema es contrarrestado por la osteoprotegerina producida por los osteoblastos. Por otra parte, la activación del sistema Wnt, lleva a la activación de osteoblastos, con aumento de reclutamiento de precursores, maduración y activación. Esta actividad es antagonizada por la esclerostina, proteína derivada del gen SOST y producida por los osteocitos.
Efectos de la inflamación en el recambio óseoCitokinas y pérdida de masa óseaEl medioambiente de citokinas determina en gran medida, los efectos de la inflamación sobre el hueso. Así, el Factor de Necrosis Tumoral Alfa (TNF), la Interleukina 1 y la interleukina 6 favorecen la resorción ósea, al promover directa o indirectamente la osteoclastogènesis. La Interleukina 17 aumenta la expresión de RANKL que es a su vez un muy importante factor en la osteoclastogénesis.
El TNF actúa en las vías de señalización pro inflamatorias dentro de la articulación que influye en el recambio óseo, al mismo tiempo que parece central en el desarrollo de erosiones óseas y osteoporosis. Esta citoquina expande la población de células preosteoclásticas que expresan RANK, promueve la sobreexpresión de RANKL respecto de la osteoprotegerina e inhibe la maduración y función de los osteoblastos, en parte porque aumenta la expresión en los fibroblastos sinoviales, del antagonista de la vía de señalización Wnt, el Dickkopf-1 (DKK1) (7).
Citokinas y formación de huesoEn contraste con lo bien establecido de la relación de citokinas pro inflamatorias y resorción ósea, la relación entre el medioambiente de citokinas y la formación de hueso, ha sido menos estudiada. Se sabe que la IL-4, IL-12, IL-18 y el Interferón β promueven la formación ósea por aumentar la relación OPG/RANKL inhibiendo así la osteoclastogénesis. Por otro lado, el osteoblasto es una célula que produce citokinas. En su estado inmaduro, son productores de RANKL por sobre OPG en tanto que maduros, es a la inversa. El estado de maduración de los osteoblastos termina siendo central en la relación del proceso inflamatorio y la masa ósea. Citokinas proinflamatorias como el TNF afectan la maduración de los osteoblastos lo que es balanceado por el TGF-β, que promueve la proliferación de los osteoblastos (8).
Pérdida de masa ósea en enfermedades reumáticas específicasLos enfermos con padecimientos autoinmunes crónicos tienen un riesgo aumentado de desarrollar osteoporosis tanto por alteraciones específicas que inciden en el metabolismo óseo, con inducción de pérdida y en ocasiones por inhibición de formación, y por tener factores de riesgo clásicos como son el predominio de mujeres, poca actividad física por su enfermedad de base, tabaquismo, bajo índice de masa corporal, déficit de vitamina D, etc.
Artritis reumatoide (AR)Estos enfermos tienen un riesgo de fracturas de columna y de cadera, que es dos a tres veces mayor que en la población general. La osteoporosis en esta enfermedad es inducida por elevados niveles sistémicos de TNFα, de IL-1, IL-6 y de IL-17. Hemos visto como el TNF, que es una citokina central en la inflamación de la AR, influye a través de distintos mecanismos en la osteoclastogénesis. Por otra parte, al bloquear esta citokina con los nuevos tratamientos biológicos, la masa ósea comienza a recuperarse.
Espondiloartritis anquilosante (EAA)Estos enfermos tienen una frecuencia de fracturas vertebrales que es cinco veces mayor que la población general. Aquí el problema es más difícil de explicar, porque junto con la osteoporosis sistémica hay neoformación ósea especialmente en columna. En esta enfermedad, el TNF alfa también tiene un papel fundamental en su patogenia y se pone en marcha los mecanismos que hemos comentado para la AR, pero la neoformación ósea, probablemente está ligado a una sobrexpresión del sistema Wnt que se ha encontrado sobreactivado en esta enfermedad (8). El uso de anticuerpos monoclonales anti TNF ha sido importante en el control de la inflamación y en la recuperación de la masa ósea.
Lupus eritematoso sistémico (LES)La osteoporosis también se manifiesta en esta enfermedad, aunque probablemente acá se asocia más con los tratamientos que afectan directamente al hueso o con la falla ovárica inducida por algunos inmunosupresores (10). En el LES se encuentran altos niveles de Interferón Alfa y Beta, que protegen de la pérdida de masa ósea.
Aparte de la AR, en la cual los mecanismos proinflamatorios de la enfermedad favorecen la aparición de osteoporosis, la razón principal tras esta complicación de muchas enfermedades autoinmunes, es el uso de esteroides.
Osteoporosis inducida por esteroidesHarvey Cushing fue el primero en describir en 1932, la asociación entre el exceso de corticoides endógenos y las fracturas. Pocos años después de la introducción de la Prednisona para tratar la AR por Hench y cols, se publicaron los efectos deletéreos asociados con su uso, incluyendo fracturas vertebrales (11).
Sabemos en la actualidad, que las fracturas ocurren en un 30% a 50% de los enfermos que son tratados con esteroides por períodos largos de tiempo. La presencia de osteoporosis y fracturas, no sólo depende de la dosis diarias de esteroides, sino que también de otros factores, como la edad, el sexo, la densidad mineral ósea (DO) basal, el estado hormonal, los niveles de Vitamina D, la enfermedad subyacente y probablemente de diferencias individuales en la sensibilidad a los esteroides.
PatogeniaEl hallazgo patológico más común en la osteoporosis inducida por glucocorticoides (OIG) es una disminución de la masa ósea, especialmente en el hueso esponjoso, aunque el hueso cortical también resulta afectado. La OIG tiene dos fases, la primera, que es rápida, 6 a 12% de pérdida en un año, en la que hay un aumento de la osteoclastogénesis y luego una fase tardía, con un 3% de pérdida anual, en la que hay disminución de formación de hueso. Sin embargo el riesgo de fractura aumenta hasta un 75% dentro de los primeros tres meses después de iniciado el tratamiento, característicamente antes que haya una pérdida significativa de masa ósea, lo que sugiere que hay efectos adversos de los esteroides sobre el hueso, que no son detectados por la medición de masa ósea (12).
Los esteroides tienen un efecto directo e indirecto sobre el hueso y afectan tanto la formación como la resorción ósea.
Dentro de los efectos indirectos está la disminución de la absorción de calcio por el intestino y el aumento de la calciuria, que condicionan un hiperparatiroidismo secundario con la consiguiente resorción ósea (13). Además, disminuyen los esteroides sexuales, estradiol y testosterona, y disminuyen la fuerza muscular que es un condicionante de la formación ósea.
En los últimos años, se ha reconocido el efecto que el sistema de la 11 β–hidroxiesteroide deshidrogenasa (11β HSD) tiene en la osteoporosis. Dos isoenzimas catalizan la conversión entre los componentes glucocorticoides activos (cortisol, prednisolona) y los inactivos. Los esteroides aumentan la 11-β HSD1 que es activadora. Esta isoenzima también aumenta con la edad (14).
Dentro de los efectos directos está el aumento de la expresión de RANKL y la disminución de la expresión de OPG en los osteoblastos y células estromales. Los esteroides aumentan la expresión de IL-6 que estimula la osteoclastogénesis y disminuyen la del Interferón β, que es un inhibidor de la osteoclastogénesis. También los corticoides suprimen la vía del Wnt que es un regulador de la osteoblastogénesis y la de la proteína morfogenética del hueso, que está involucrada en la diferenciación del osteoblasto. En la OIG se observa un aumento en la apoptosis de osteocitos, lo que puede llevar a acumulación de micro daño óseo, disminuyendo la calidad y fortaleza del hueso, independiente de la densidad mineral (15).
Factores de riesgoUno de los factores de riesgo importantes es la dosis diaria más que la dosis acumulada de glucocorticoides. El riesgo de fractura vertebral aumenta exponencialmente para dosis diarias mayores de 20mg de Prednisolona (16). El riesgo de OIG parece ser igual en hombres y mujeres, y también entre distintos grupos étnicos. En un estudio se comparó la prevalencia de fracturas asintomáticas en 551 mujeres post menopáusicas tratadas con corticoides por distintas enfermedades. La prevalencia en general fue de 37%. Cuando se controló por edad, dosis de corticoides acumulada, duración del tratamiento y por historia personal de fracturas, la prevalencia ajustada de fractura vertebral fue de 30,7% para el LES, 33,7% para la AR, 43,3% para la Polimialgia Reumática y 43,36 para otras enfermedades autoinmunes (17).
El instrumento de evaluación de riesgo de fracturas de la organización mundial de la salud WHO-FRAX, es un algoritmo que calcula la probabilidad de fractura en base a factores de riesgo clínicos. Este algoritmo calcula la probabilidad a diez años de presentar una fractura mayor por osteoporosis. Este cálculo se realiza para ambos sexos a partir de los 40 años y toma en cuenta la edad, sexo, índice de masa corporal, presencia o ausencia de historia familiar de fractura en padre o madre, historia personal de fractura después de los 40 años, tabaquismo actual, consumo de alcohol, uso de glucocorticoides, artritis reumatoide y otras causas de osteoporosis secundarias. Se puede agregar la DO de cuello femoral, lo que mejora la predicción.
Factores de riesgo para osteoporosis inducida por glucorticoides (OIG)
| Mayor Edad | |
| Índice de masa corporal bajo | |
| AR, Polimialgia, EBOC, Enf. Infl. Intest | Son factores de riesgo independientes |
| Fracturas anteriores, cigarrillo, alcohol en exceso, caídas frecuentes, historia familiar de fractura de cadera | Son factores de riesgo independientes |
| Genotipo del receptor de glucocorticoides | Puede haber polimorfismos que regulen la sensibilidad |
| Expresión aumentada de la 11β-HDS1 | Aumenta con la edad y con los corticoides. |
| Dosis altas de esteroides | El riesgo aumenta con la dosis diaria y con la acumulada |
| Baja densidad ósea mineral al comienzo del tratamiento con glucocorticoides |
De acuerdo con este índice, los enfermos pueden ser categorizados en 3 niveles.
- 1.-
Riesgo bajo, si el riesgo es < 10%
- 2.-
Riesgo mediano, si el riesgo está entre 10% y 20%
- 3.-
Riesgo alto, si el riesgo es mayor a 20%
En el caso de la osteoporosis inducida por esteroides, el índice FRAX no es tan válido, porque puede subestimar el riesgo de fractura.
TratamientoLos pacientes que ingresan a un tratamiento a largo plazo con glucocorticoides, debieran tener datos basales de niveles de Vitamina D, Creatinina y DO. La DO en los enfermos que están en tratamiento esteroidal no es tan confiable como en otras formas de osteoporosis, porque hay una disparidad entre cantidad y calidad del hueso en la OIG, pero es útil tener una determinación basal de estos valores para compararlos en la evolución.
Medidas no farmacológicasDentro de los consejos que estos enfermos deben recibir al comienzo de su tratamiento, está la suspensión del cigarrillo y del alcohol. Hay que evaluar el riesgo de caídas e indicar ejercicios que fortalezcan la musculatura de las extremidades inferiores. Los corticoides pueden producir miopatías que aumentan la debilidad muscular y el riesgo de caídas y fracturas.
Medidas farmacológicasCalcio y vitamina DDebido a que los glucocorticoides disminuyen la absorción intestinal de calcio y aumentan su excreción urinaria, se recomienda como prevención la administración de calcio elemental 1.200mg/día y vitamina D 800 a 2000 UI/día, junto con actividad física regular para favorecer los efectos esqueléticos y musculares de la vitamina D (18).
En un estudio de 65 enfermos con AR tratados crónicamente con corticoides, se distribuyó al azar durante dos años, entre tratamiento con carbonato de calcio más 500 UI de ergocalciferol vs placebo. Los tratados activamente tuvieron una ganancia de masa ósea de 0,7% en columna lumbar y 0,9% en el trocánter mayor, en tanto que el grupo placebo tuvo una pérdida de 2% y 0,9% en estos dos sitios (19). El calcio y la vitamina D deben ser considerados necesarios, pero no suficiente para los enfermos que reciben esteroides crónicamente, ya que el uso de bisfosfonatos y de teriparatide reduce mucho más el riesgo de fractura en estos enfermos.
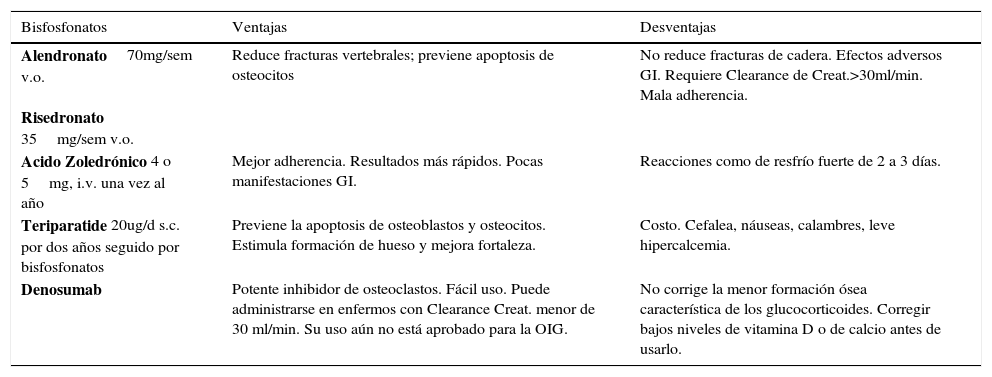
BisfosfonatosEstos medicamentos reducen en alrededor de 40% el riesgo de fracturas vertebrales en la OIG (Tabla 2). El riesgo de osteonecrosis de la mandíbula es de 1 caso por 10.000 a 100.000 enfermos-año. Se recomienda una revisión odontológica previa al inicio del tratamiento con estos fármacos. Deben usarse con un clearance de creatinina mayor de 30ml/min.
Tratamiento de la osteoporosis inducida por esteroides.
| Bisfosfonatos | Ventajas | Desventajas |
|---|---|---|
| Alendronato70mg/sem v.o. | Reduce fracturas vertebrales; previene apoptosis de osteocitos | No reduce fracturas de cadera. Efectos adversos GI. Requiere Clearance de Creat.>30ml/min. Mala adherencia. |
| Risedronato 35mg/sem v.o. | ||
| Acido Zoledrónico 4 o 5mg, i.v. una vez al año | Mejor adherencia. Resultados más rápidos. Pocas manifestaciones GI. | Reacciones como de resfrío fuerte de 2 a 3 días. |
| Teriparatide 20ug/d s.c. por dos años seguido por bisfosfonatos | Previene la apoptosis de osteoblastos y osteocitos. Estimula formación de hueso y mejora fortaleza. | Costo. Cefalea, náuseas, calambres, leve hipercalcemia. |
| Denosumab | Potente inhibidor de osteoclastos. Fácil uso. Puede administrarse en enfermos con Clearance Creat. menor de 30 ml/min. Su uso aún no está aprobado para la OIG. | No corrige la menor formación ósea característica de los glucocorticoides. Corregir bajos niveles de vitamina D o de calcio antes de usarlo. |
Los bifosfonatos, por sus efectos antiresortivos, son considerados la droga de elección en la OIG, tanto para prevención como tratamiento, dado que aumentan la DO y disminuyen la incidencia de fracturas vertebrales (20). Numerosos estudios han demostrado la efectividad de alendronato, risedronato y ácido zoledrónico para la prevención de osteoporosis por glucocorticoides y se sugiere mantenerlos al menos mientras dure el tratamiento o se mantengan condiciones de riesgo para la salud ósea. Es controvertido su uso en mujeres premenopáusicas en edad fértil dada la recirculación de estos medicamentos y el paso placentario en caso que ocurra un embarazo durante o posterior a su uso (21-23).
TeriparatideExiste evidencia de la efectividad de la PTH intermitente en la mejoría de la masa ósea de pacientes en tratamiento esteroidal y en la disminución de las fracturas vertebrales (24). Basados en el conocimiento de la fisiopatología, teriparatide sería particularmente efectiva en pacientes con OIG con alto riesgo de fractura aunque su alto costo limita su uso.
En el estado actual de evidencia otros antiresortivos como el Denosumab, que es un anticuerpo monoclonal humanizado dirigido en contra del ligando de RANK (RANKL), no tiene evidencias publicadas que lo haga ser de primera elección en el tratamiento de la osteoporosis por glucocorticoides o inducida por la inflamación inherente a enfermedades reumatológicas. Sin embargo, su mecanismo de acción sugiere que pudiera tener un importante rol terapéutico en el futuro (14).
ConclusionesSe debe considerar tratar enfermos que tienen indicación de esteroides por más de tres meses y que presentan un score de T menor de 1,5. Esta indicación varía en distintas organizaciones de salud, pero este plazo y esta dosis parece ser la más aceptada. Los enfermos de mayor edad tienen mayor riesgo de fracturarse. El empleo del algoritmo FRAX no parece útil en esta condición, porque subestima el riesgo de fractura.
Los autores declarna no tener conflictos de interés, con relación a este artículo.