Los exámenes metabólicos con PET (Positron Emission Tomography) han experimentado un notable desarrollo tecnológico y expansión de su uso clínico en las últimas décadas. Gran parte de la utilidad clínica del PET se ha centrado en el estudio de patología oncológica, donde ha demostrado alto rendimiento diagnóstico y adecuada relación costo/beneficio, permitiendo diagnósticos más rápidos, certeros e integrales, con reconocido ahorro de tiempo y recursos. En el área pediátrica, el PET ha mostrado un crecimiento exponencial en los últimos años, debido principalmente al advenimiento de equipos tecnológicamente más avanzados y de adquisición híbrida como el PET/CT (Positron Emission Tomography/Computed Tomography), que han permitido disminuir las dosis de radiación y los tiempos de examen, con significativa elevación del rendimiento de la técnica. Por otro lado, la rápida masificación de equipos PET/CT ha hecho posible reducir notablemente los costos del examen. En este trabajo se revisan aspectos técnicos del PET/CT, preparación para el examen, indicaciones, rendimiento y utilidad por patología, haciendo una revisión de la literatura disponible.
Metabolic studies with PET (Positron emission tomography) have undergone a remarkable technological development, expanding its clinical use in the last decade. Most part of clinical utility of PET scan has been focused in oncology, where it has shown high diagnostic accuracy and suitable cost/benefit rate. PET allows quick, accurate and integral diagnosis, saving time and resources. In paediatric area PET has shown an exponential growth in last years, due mainly to the advent of technologically more advanced equipments and hybrid PET/CT. The former has allowed decreasing the radiation exposure and time of scanning, improving performance of PET scan. Furthermore, the exponential growth in numbers of PET/CT machines has made possible to reduce the costs of the exam. In this article we review PET/CT technical aspects, patient previous preparation, indications of scan and utility by type of pathology, doing a review of available literature.
En los últimos 25 años la técnica PET (Positron Emission Tomography) ha mostrado un notable progreso tecnológico, lo que la ha acercado a la población pediátrica (1), ofreciendo exámenes más rápidos, de menor irradiación, y de mejor resolución de imagen y sensibilidad.
Un antiguo PET de transmisión-emisión tenía una duración de aproximadamente 90minutos, donde un niño en ayunas y muchas veces asustado o irritable debía permanecer en la camilla del PET sin moverse. El desarrollo de detectores más eficientes y sensibles, y con mayor campo de vista, han hecho posible disminuir el tiempo de adquisición y el número de “camas”, logrando adquisiciones de cuerpo entero de gran calidad en tiempos menores a 12min (1). Por otro lado, el advenimiento de la técnica híbrida PET/CT (Un detector PET adosado a un tomógrafo computado) ha permitido una significativa reducción en el tiempo del examen ya que reemplaza el antiguo PET de transmisión (hasta 20min) necesario para corrección de atenuación por una adquisición espiral de escasos segundos.
Estos nuevos equipos cuentan con sistemas de detección 3D, que además de acortar los tiempos de adquisición, permiten disminuir las dosis administradas debido a que aumentan la sensibilidad del sistema (1).
El ensamble de dos equipos completamente distintos en un solo gantry hace posible contar con información metabólica del PET y morfológica de la tomografía computada (TC) de todo el cuerpo en un solo examen, con imágenes que se pueden acoplar y fusionar en distintos planos. Esto implica, sin embargo, una logística compleja desde el punto de vista técnico y profesional dado su carácter multidisciplinario que involucra áreas de la radiología y de medicina nuclear, requiriendo indispensablemente de un trabajo en equipo afiatado y colaborativo (2). El lugar físico donde ubicar el equipo y los tecnólogos a capacitar son sólo algunos de las interrogantes logísticas que han surgido al habilitar un equipo PET/CT (2).
PET Con fluorodeoxiglucosa (FDG)La glucosa marcada con Flúor 18 (F18-FDG) es un análogo de la glucosa que se introduce a las células del cuerpo por transporte activo acorde a su demanda de azúcar. Una vez dentro de la célula, el F18-FDG fosforilado es bloqueado en su degradación y se acumula en el citoplasma (3). Esto permite obtener imágenes desde los 45-60min de la inyección del radiofármaco. En condiciones normales la glucosa marcada se concentra mayormente en el encéfalo, y en menor medida en anillo de Waldeyer, cuerdas vocales, corazón y asas intestinales. El radiofármaco que no fue captado se elimina por vía urinaria, por lo que es habitual observar contraste fisiológico de riñones, uréteres y vejiga. En los niños es frecuente además encontrar cierta captación del timo y de la grasa parda, no patológica (3). Esta última corresponde a tejido adiposo de alto metabolismo implicado en la generación de calor corporal, y se activa en situaciones de frío ambiental (4).
Preparación del pacienteLa preparación comienza el día previo al examen, realizando una dieta sin muchos carbohidratos, y evitando actividad física intensa (deportes, entrenamiento, educación física). El día del examen se requiere ayunas de entre 4 a 6 hrs dependiendo de la edad y condiciones del niño (2, 3). En pacientes con nutrición parenteral ésta se debe interrumpir mínimo 6 hrs previo a la inyección de la F18-FDG. En pacientes que están siendo sometidos a quimioterapia se requiere un lapso mínimo de 6 hrs entre el fin del ciclo y la inyección (2).
El procedimiento debe ser explicado a los padres y el paciente, mencionando en qué consiste, cuánto dura y los potenciales riesgos que implica. La posibilidad de utilizar sedación o realizar cateterismo vesical durante el examen debe ser comentada a los padres. Es esencial dar un tiempo para que ellos hagan preguntas y resuelvan sus dudas antes de comenzar el examen. Disminuir la ansiedad o preocupación es muy importante para lograr pacientes y padres tranquilos y colaboradores.
Para poder realizar el examen se necesita una glicemia no superior a 150 mg/dl ya que niveles mayores podrían disminuir su rendimiento. En pacientes diabéticos debe estabilizarse la glicemia antes de realizar el estudio. Durante y después de la administración endovenosa de la F18-FDG es necesario que el paciente esté tranquilo, en un ambiente grato y a temperatura adecuada.
La opción de administrar contraste oral y/o endovenoso para la tomografía computada (TC) debe ser tomada en conjunto con el médico tratante de acuerdo a la indicación del examen y lo que desea evaluar. Ambos tipos de contraste no afectan en absoluto la interpretación de la imagen del PET (1).
En niños que no pueden permanecer en la camilla del PET suficientemente quietos para la adquisición será necesario utilizar grados de sedación anestésica (al igual que en otros exámenes como la resonancia magnética). La sedación suave suele no resultar en niños que ya vienen asustados y excitados, por lo que se sugiere en estos casos utilizar técnicas anestésicas más profundas (1). En la mayoría de los casos la sedación se realizará solo durante la adquisición (toma de imágenes) del estudio, es decir un periodo de entre 10 a 20min (3).
El cateterismo vesical está indicado en situaciones en que la vejiga llena o el pañal contaminado no permitan evaluar adecuadamente una estructura adyacente ubicada en la pelvis o el periné, y cuando se aplica anestesia general (1, 3) (Tabla 1).
Indicaciones de apoyo anestésico y cateterización vesical en pet/ct:
| Cuándo se necesita anestesia: |
| • Pacientes que no puedan tolerar el examen |
| • Pacientes con retardo o deterioro mental |
| • Pacientes claustrofóbicos |
| Cuándo se necesita cateterización vesical: |
| • Necesidad de reconocer estructuras cercanas a la vejiga |
| • Urgencia miccional que signifique interrumpir la adquisición |
| • Paciente sin control de esfínter en que el pañal contaminado obscurezca un área a evaluar |
| • Paciente con anestesia prolongada |
Para disminuir la captación de grasa parda se han propuesto algunos protocolos que consideran la administración de medicamentos (Fentanyl, Diazepam, Propanolol), especialmente en centros que no cuenten con equipos híbridos (5). Sin embargo, la mayoría de las veces una adecuada regulación de la temperatura ambiental en la sala de inyección suele ser suficiente.
PET Dedicado vs técnica híbrida PET/CTDiversos estudios han comprobado la superioridad diagnóstica de la técnica híbrida PET/CT respecto a la funcional pura del PET dedicado, tanto en adultos como en población pediátrica. Esto se debe por un lado a que la información aportada por ambos estudios tiene un carácter fuertemente complementario y su adquisición simultánea permite un análisis correlativo exacto voxel a voxel, con posibilidad de reconstrucciones multiplanares de ambas imágenes fusionadas.
Kleis et al (5) estudiaron un grupo de pacientes pediátricos con neoplasias malignas, describiendo una menor sensibilidad del PET dedicado, respecto el PET/CT en detección del tumor primario (73% vs 95%), compromiso ganglionar (61% vs 83%) y metástasis a distancia (37% vs 91%). Como es de esperar, el PET/CT demostró ser superior al PET dedicado en evaluación de metástasis pulmonares debido al aporte de las imágenes de la TC, y de mayor especificidad que la TC en detección de metástasis pulmonares > 5mm y ganglios & 10 mm. El 28% de los falsos positivos del PET o TC se resolvieron con la técnica híbrida PET/CT.
En una revisión de pacientes con Sarcoma de Ewing, Gerth et al encontraron que el PET/CT detectó 20% de lesiones adicionales no vistas por el PET tradicional, 65% de ellas ubicadas en los pulmones (6).
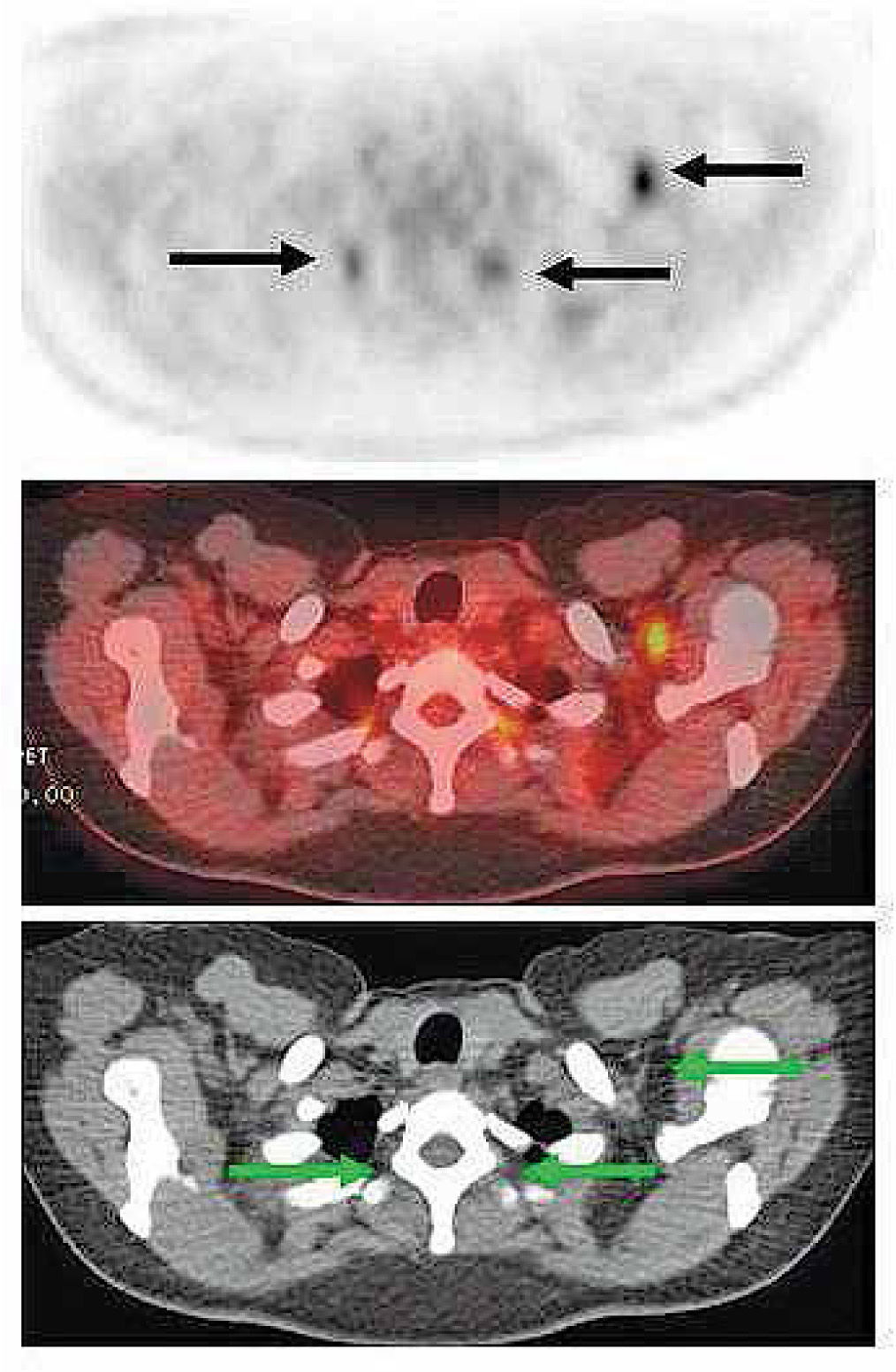
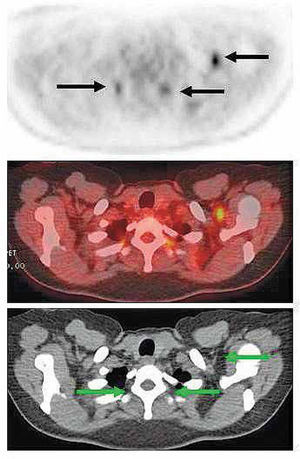
Uno de los problemas más comunes del PET en población pediátrica es la identificación de la grasa parda, que puede ser confundida con captación anormal en mediastino, axila y regiones supraclavicular y paravertebral (5) (Figura 1). La imagen híbrida PET/CT es capaz de identificarla correctamente en la mayor parte de los casos.
Diversos trabajos que comparan el rendimiento comparativo del PET y PET/CT en población pediátrica recomiendan finalmente adoptar la técnica híbrida por su mayor sensibilidad y especificidad, su capacidad de localizar mejor las lesiones y su menor duración (6).
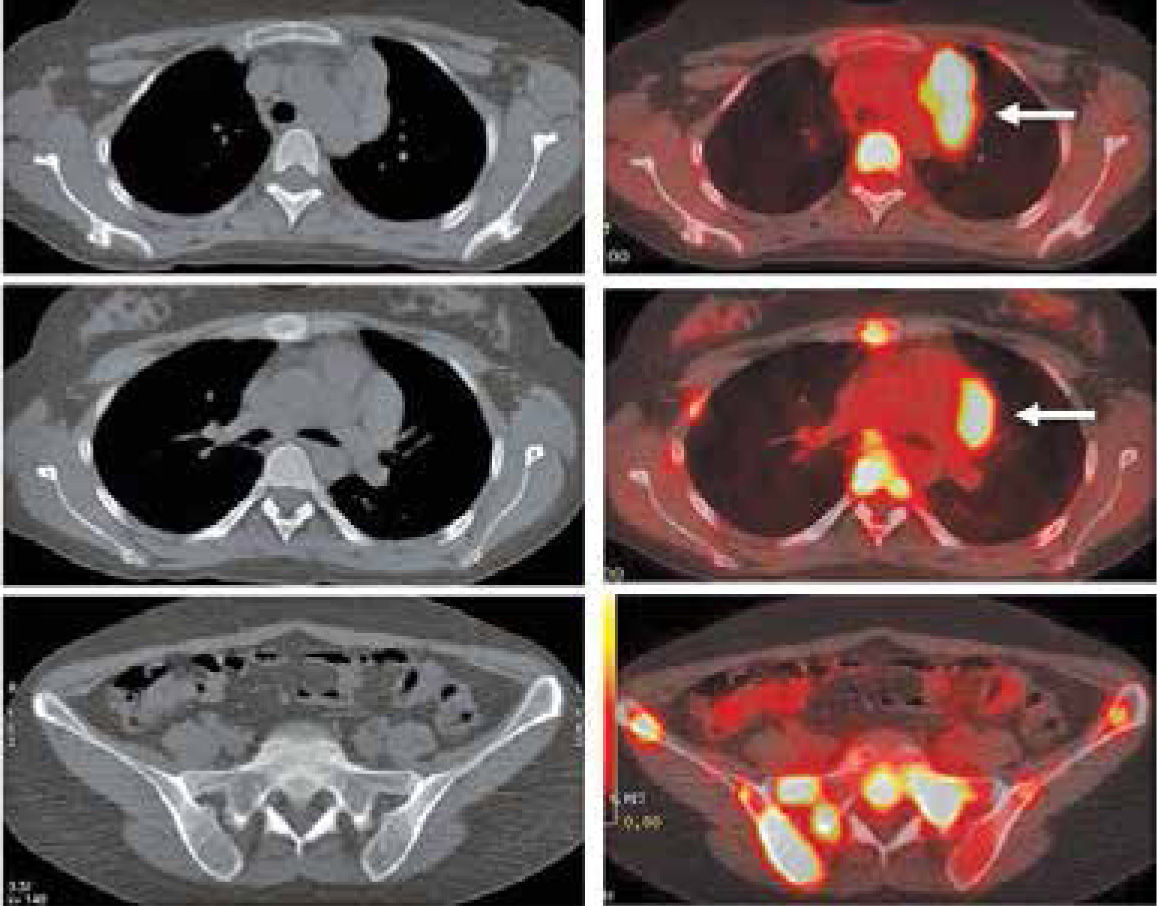
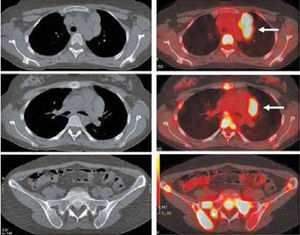
PET/CT vs Estudios tradicionalesEl PET/CT aporta información adicional a la Ecotomografía (Eco), TC y Resonancia Magnética (RM) en 34% de los casos, principalmente descartando compromiso en masas residuales inactivas que son positivas con TC o RM, detectando lesiones ganglionares pequeñas hipermetabólicas (negativas a la TC), y detectando metástasis óseas, esplénicas y hepáticas no visibles con otros métodos (7) (Figura 2).
Paciente con Linfoma de Hodgkin en etapificación. En el PET/CT se identifica masa adenopática mediastínica prevascular, hipermetabólica (flechas). Extenso compromiso esquelético a nivel costal, vertebral, esternal y en huesos de la pelvis, sin representación en imágenes de Tomografía Computada (no detectables con TC).
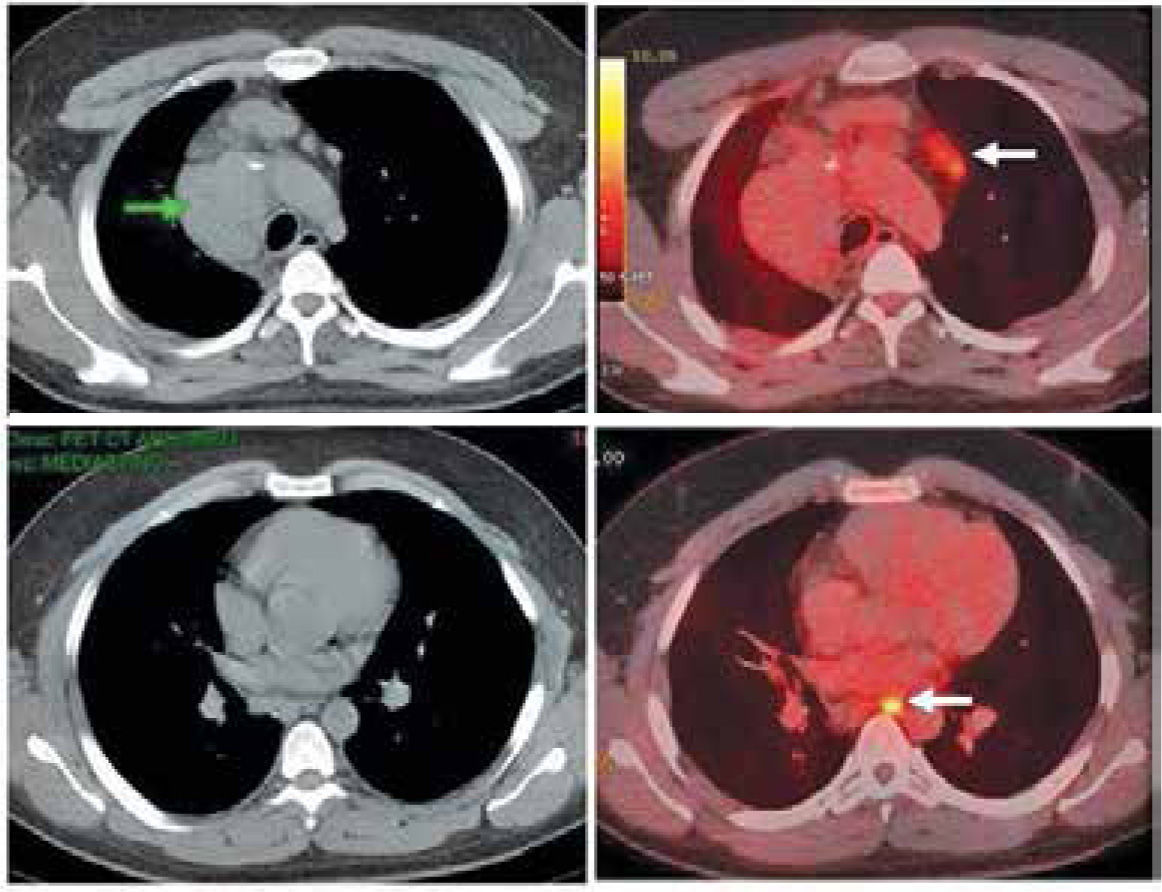
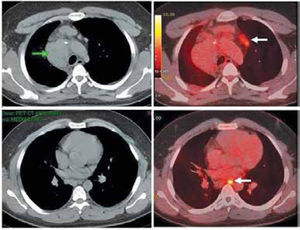
El PET/CT muestra mejor rendimiento que los estudios tradicionales en neoplasias pediátricas, con una asertividad diagnóstica de 90% (7). Esto es particularmente evidente en Linfoma, donde el 23% de las lesiones visibles en PET fueron catalogadas como negativas con las otras técnicas (8), y en controles post tratamiento donde el PET claramente es superior en determinar el significado de lesiones o masas residuales post terapia (9) (Figura 3).
Paciente con linfoma de Hodgkin tratado con quimio y radioterapia (de mediastino) finalizadas hace varios meses. La Tomografia Computada (imágenes a la izquierda) muestra una masa mediastínica alta derecha (flecha verde), sin otras alteraciones. En el PET/CT (imágenes a la derecha) se observa que la masa mediastínica no concentra FDG y es sugerente de corresponder a tejido fibróticoresidual, y que los pequeños ganglios prevasculares y paraesofágico (flechas blancas), no sospechosos según criterios de TC, sí captan significativamente FDG lo que sugiere recaída. Los pequeños ganglios fueron biopsiados con resultado positivo para recidiva del linfoma. La muestra histológica de la masa mediastínica no mostró células neoplásicas.
En estudio de metástasis óseas, el PET muestra significativa mayor sensibilidad (90%) que la RM de cuerpo completo (82%), y ambos son superiores al cintigrama óseo (CO) Tc99m-MDP SPECT (71%) en población pediátrica, aun en lesiones menores de 1 cm (10). En este estudio los autores concluyen que una RM cuerpo completo más un CO proporcionarían similar sensibilidad que el PET.
Las limitaciones del PET en cuanto a detección de lesiones en cráneo (por intensa actividad del cerebro) se resuelven en parte utilizando la técnica híbrida que permite correlación anatómica.
IndicacionesEl PET ha mostrado utilidad en:
- •
Diagnóstico diferencial de tumor benigno vs maligno
- •
Elección del sitio de biopsia
- •
Etapificación de neoplasias
- •
DD fibrosis vs tu residual en lesiones post tratamiento
- •
Evaluación de respuesta a terapia
- •
Planeación de radioterapia
El grado de actividad metabólica que traduce la intensidad de captación de FDG se relaciona con la probabilidad de esa lesión de ser maligna. A mayor captación mayor posibilidad de malignidad, y en caso de malignidad, mayor desdiferenciación celular y agresividad del tumor y peor pronóstico (11). Sin embargo, esta relación es más clara en unos órganos que en otros. Por ejemplo, en algunas lesiones óseas existe signifcativa sobreposición de patología benigna y maligna en grados de captación intermedia, determinados principalmente por lesiones benignas de tipo histiocítico y tumor de células grandes (12,13) que pueden presentar actividad glucídica significativa.
Existe una relación entre el grado de agresividad de un tumor y el consumo de glucosa de sus células. Se ha descrito una mayor captación de FDG en aquellos tumores de crecimiento rápido y comportamiento agresivo, y menor concentración de glucosa marcada en aquellos de evolución más lenta (11).
Una fuente importante de falsos positivos son los procesos inflamatorios, principalmente aquellos de tipo granulomatoso (TBC, sarcoidosis, vasculitis granulomatosas, reacción a cuerpo extraño, etc). Para una adecuada diferenciación en estos casos es útil cuantificar la captación con índices como el SUV (Standarized Uptake Value) (14).
Dentro de los tumores malignos de baja captación destacan los linfomas de bajo grado, cáncer de próstata, hipernefroma y otros. Las neoplasias malignas pediátricas por lo general presentan altos niveles de actividad metabólica, lo que tiende a coincidir con su agresividad clínica.
Elección del sitio de biopsiaEl estudio histológico o citológico es uno de los pilares fundamentales del diagnóstico y tratamiento de los tumores malignos, y hay distintas maneras de llevarlo a cabo, desde una punción con aguja fna hasta resección quirúrgica de la lesión. En ocasiones en que existen múltiples lesiones es posible que algunas de ellas sean de acceso más fácil o menos riesgoso que otras, por lo que realizar un “mapeo” de todas las lesiones existentes es de gran utilidad. Para esto el PET/CT es el examen de elección ya que permite evaluar todo el cuerpo de manera integral y con una alta sensibilidad, incluyendo todos los órganos y sistemas de una sola vez.
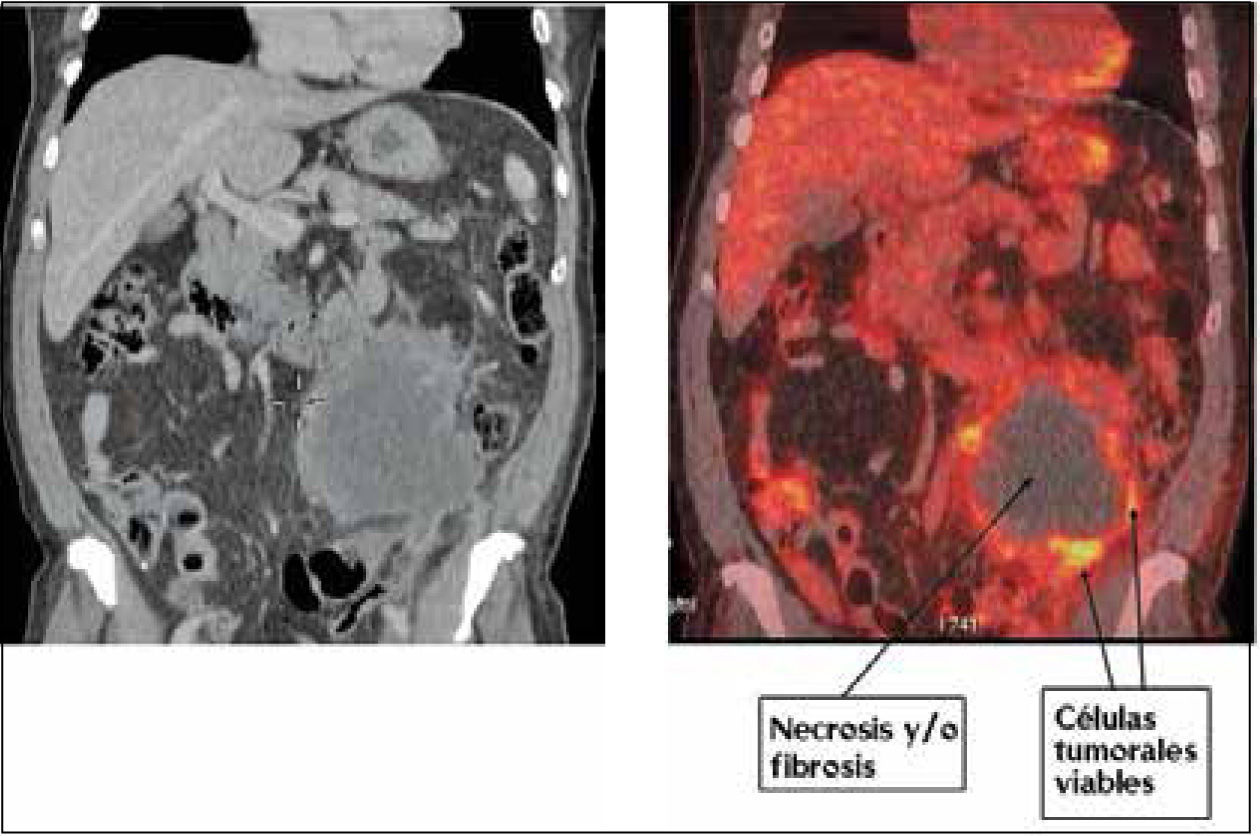
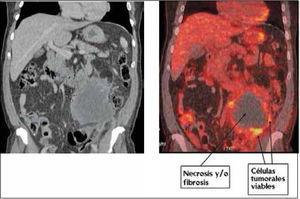
Al realizar una toma de biopsia percutánea de una lesión es necesario obtener una muestra representativa con suficientes células neoplásicas que permitan una correcta interpretación. En tumores con componente necrótico es vital recoger muestras de las zonas que tienen células tumorales viables, y evitar aquellas áreas necróticas o fibróticas, que no tendrán utilidad diagnóstica (Figura 4).
Masa abdominal en estudio. La imagen de Tomografía Computada (izquierda) y fusión PET/CT muestran una masa en hemiabdomen izquierdo con zona central hipodensa sin captación de FDG, sugerente de necrosis y/o fibrosis. Sólo la periferia de la lesión capta azúcar marcada, lo que indica viabilidad tumoral. En esta zona debe ser tomada la biopsia.
La mayor experiencia en estudios PET en pediatría se ha dado en el Linfoma de Hodgkin (LH) y no Hodgkin (LNH), y tumores cerebrales. También se ha investigado la utilidad del PET en osteosarcoma, sarcoma de Ewing, rabdomiosarcoma, neuroblastoma (2). El rol de los estudios metabólicos en fiebre de origen desconocido (15) e infección por VIH ha sido destacado en varias publicaciones (16, 17).
LinfomaEl PET FDG fue aprobado por los sistemas de cobertura en EE.UU. (Medicare) en julio de 1999 en adultos, y ha ido reemplazando paulatinamente al Galio-67 en el estudio de Linfoma (Diagnóstico, Etapificación, Reetapificacion) (18). El PET es un método más sensible que el Galio-67 en etapificación y reetapificación de LH y LNH (19), y su uso produce un cambio en la etapificación en al menos un 10% de los casos estudiados con técnicas tradicionales (20, 21).
Hoy en día, la experiencia acumulada indica que el PET con FDG es superior a las modalidades de imagen tradicionales en la evaluación del linfoma, con mayor sensibilidad y especificidad que el CT y Galio-67 (9). Estudios utilizando técnica híbrida (PET/CT) han mostrado diferencias aún mayores (Sensibilidad PET: 100% vs Ga-67: 72%) tanto en LH como LNH (22).
Existe mucho interés en el potencial valor del PET como indicador precoz de respuesta a terapia en linfoma. Al controlar tratamiento el PET puede modificar la terapia de acuerdo a la respuesta metabólica del tejido tumoral, cambiando a un esquema más agresivo en respuestas pobres, y evitando algunos tratamientos adicionales en respuestas favorables (9). Por otro lado la respuesta precoz a tratamiento medida después de los primeros ciclos de QMT reflejará fehacientemente la respuesta definitiva una vez finalizado el tratamiento (23).
Las recomendaciones del “International Harmonization Project” en el manejo del linfoma incluyen los siguientes puntos (24):
- -
De preferencia realizar PET o PET/CT previo a tratamiento en todos los linfomas ávidos de glucosa (L. difuso de celulas B grandes, L. folicular, L. de células del manto, LH). Si bien estos linfomas siempre muestran alta captación, para controlar adecuadamente un tratamiento es deseable contar con un PET basal.
- -
Siempre realizar PET o PET/CT previo a tratamiento en todos los linfomas de captación variable (L. de células T, L. de zona extranodal marginal, L. MALT y L. linfocítico pequeño). Como la captación de estos tipos de linfoma es variable, es mandatario tener un estudio basal para comparar.
Las imágenes funcionales juegan un importante rol en la evaluación del neuroblastoma, tanto en el diagnóstico inicial y etapificación, como en la respuesta a terapia y detección de recurrencia. El I123-MIBG (Metaiodobenzylguanidina) y el cintigrama óseo han sido utilizados ampliamente en el estudio de estos pacientes. El uso del PET F18-FDG en esta patología ha aumentado exponencialmente en los últimos años, aunque su rol exacto aun no está completamente claro.
Sharp et al (25) encontraron que el PET F18-FDG es superior al I123-MIBG en el estudio inicial del neuroblastoma etapa I y II, logrando definir e individualizar mejor las lesiones de tronco (tórax, abdomen y pelvis). Sin embargo, el I123-MIBG detectaría más lesiones que el PET en etapa IV.
El uso conjunto rutinario de PET y MIBG no se recomienda tanto por asuntos económicos como por la dosis de radiación acumulada, particularmente en etapas precoces de la enfermedad (I y II) (25).
Se recomienda el uso del PET FDG en los siguientes casos:
- -
Neuroblastoma con baja captación de MIBG (26).
- -
Discordancia clínica o de la RM o TC con el MIBG (lesiones al TC que no captan MIBG, o sospecha clínica con MIBG negativo) (27, 28).
- -
Control con PET previo a transplante de células madre (enfermedad residual no vista con MIBG) (25).
El desarrollo de nuevos radiofármacos emisores de positrones específicos para el neuroblastoma (marcados con F18, C11 u otro isótopo) está siendo evaluado por varios grupos (29-31).
Tumor de wilmsEl PET/CT es de utilidad en etapificación de Tumor de Wilms, y puede diferenciar entre restos nefrogénicos benignos, nefroblastomatosis y Tumor de Wilms (32). Además permite detectar lesiones activas no visibles con técnicas tradicionales (33). Sin embargo, el impacto del PET en diagnóstico, etapificación, respuesta a tratamiento y sobrevida de estos paciente está aun en estudio.
SarcomasEl PET ha demostrado utilidad en etapificación y reetapificación de sarcomas pediátricos, y especialmente en control y seguimiento post terapia (19). La mayor parte de los estudios se han centrado en osteosarcoma y Sarcoma de Ewing, aunque la utilidad en otros tumores como el rabdiomiosarcoma también ha sido demostrada (34).
Estudiando diferentes sarcomas en población pediátrica, Völker et al (11) encontraron que el PET dedicado fue superior en detección de compromiso ganglionar y metástasis óseas que el estudio tradicional utilizando CT, RM y CO, y fue menos eficiente en detección de metástasis pulmonares. Ellos concluyen que el PET aporta importante información adicional al estudio tradicional, y representa un impacto significativo en el manejo terapéutico de estos pacientes.
La respuesta histológica a la quimioterapia neoadyuvante es uno de los factores pronósticos más importantes en Osteosarcoma y sarcoma de Ewing (35,36). La RM es de limitado valor en determinación de necrosis post quimioterapia (salvo la RM dinámica con gadolinio) y solo sirve para objetivar cambios de tamaño, variable muy poco específica de respuesta a quimioterapia (36). Un método confiable para su estudio es el PET con análisis semicuantitativo. Costelloe et al (37) describieron que el índice de captación SUVmax presenta estrecha correlación con el porcentaje de necrosis tumoral en osteosarcoma. La captación pretratamiento y postratamiento en el tumor mostró un poderoso valor pronóstico de sobreviva global y libre de recurrencia (37). Un SUVmax ≥ 15gr/ml pretratamiento y ≥ 5gr/ml postratamiento se asoció a progresión de la enfermedad.
En el seguimiento de sarcomas los métodos de imagen convencionales como la TC y RM no son capaces de distinguir entre tejido tumoral necrótico o vital con suficiente eficiencia, y no pueden excluir mínimos residuos malignos viables (38). Controles periódicos con PET/CT son capaces de detectar precozmente rediviva tumoral, con una sensibilidad mayor a los métodos tradicionales.
Tumores del SNCComo se mencionó anteriormente, el cerebro presenta una captación de FDG habitualmente alta, lo que dificulta en muchos casos la visualización de lesiones neoplásicas que pueden ser enmascaradas por la actividad presente en la corteza cerebral. Eso hace que la sensibilidad del PET en el SNC sea menor que en el resto del cuerpo.
Este problema se soluciona en parte con la técnica híbrida que permite contar con imágenes de TC, que con el uso de contraste yodado endovenoso complementa bastante bien al examen metabólico, y hace posible ver pequeñas lesiones difíciles de individualizar en la imágenes del PET.
En el estudio de los gliomas, se ha observado que el grado de captación tumoral de FDG parece ser un buen predictor de su comportamiento biológico y agresividad (39), y muestra una correlación con el grado histológico (40). A mayor concentración de azúcar en el tumor, mayor grado histológico, de tal manera que los gliomas de bajo grado muestran captación baja similar a la sustancia blanca y los de alto grado presentan casi invariablemente captaciones altas mayores que la sustancia gris (40).
Kosaka et al (41) demostraron la utilidad de PET FDG en el diagnóstico diferencial de lesiones cerebrales que presentaban realce con gadolinio en la RM, logrando distinguir los linfomas de los gliomas de alto grado y de las metástasis en base a su captación de FDG.
Posiblemente el rol más claro del PET en estos pacientes sea en la etapa post-tratamiento. Una vez que el tumor fue resecado e irradiado, el PET es el mejor estudio para descartar recidiva local y diferenciar tumor residual vs radionecrosis y/o fibrosis (40). Por otro lado, el seguimiento metabólico con PET permite detectar precozmente transformación anaplásica hacia un tumor de alto grado (40).
Planificación y control del tratamientoHillner et al (42) en una extensa revisión prospectiva de diversos tipos de cáncer señala el gran impacto que tuvo el PET en el manejo de los pacientes oncológicos, cambiando el tipo de tratamiento (curativo vs paliativo vs sin tratamiento) en el 50% de los pacientes con neoplasias en etapificación y el 40% de los pacientes en reetapificación y estudio de recurrencia. En el 32 % de estos pacientes el PET favoreció el tratamiento (paliativo o curativo) en pacientes que antes del PET no iban a recibir terapia.
En individuos que van a ser sometidos a radioterapia, el PET/CT proporciona información invaluable del tejido neoplásico a irradiar, permitiendo reducir la dosis y el volumen de radiación, y por lo tanto la toxicidad del tratamiento. Por otro lado, el PET identifica áreas activas no visualizadas con técnicas tradicionales, y ayuda a definir aquellas lesiones dudosas con TC o RM (43).
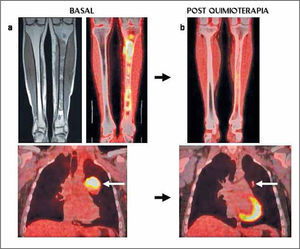
La utilidad del PET/CT como evaluador de respuesta al tratamiento permite medir su efecto biológico en la masa tumoral, independiente de las variaciones morfológicas del tumor (Figura 5). La persistencia de similar actividad metabólica en una lesión que ha sido tratada con quimio o radioterapia indica escaso o nulo efecto biológico en las células tumorales, y hace necesario plantear el cambio de la estrategia terapéutica.
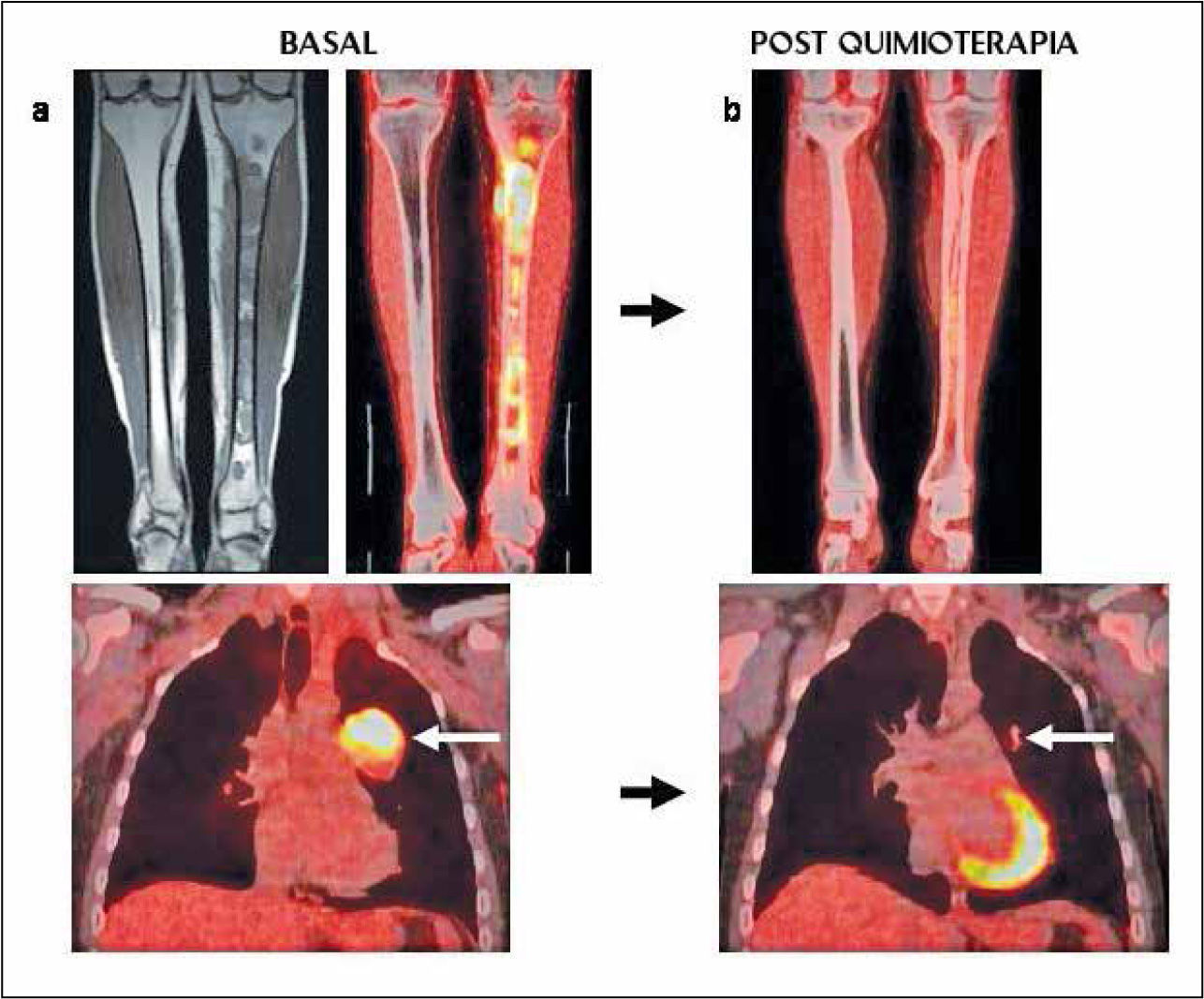
Paciente con sarcoma de Ewing en tibia izquierda. a) RM y PET/CT que muestran extensa lesión medular tibial con extensión a partes blandas en cara medial de tibia proximal (imágenes superiores), con alta captación de FDG. El PET demostró metástasis pulmonar izquierda hipercaptante (flecha blanca). b) Luego de la quimioterapia se observa significativa reducción del metabolismo glucídico en tibia, y regresión completa de la lesión pulmonar, lo que traduce una excelente respuesta a quimioterapia.
El momento adecuado para realizar el PET de control post tratamiento es materia de discusión, y se han establecido plazos mínimos para evitar los cambios inflamatorios propios de la terapia.
Se ha sugerido esperar al menos 2-3 sem post cirugía (2), 3-4 semanas (preferiblemente 6-8 sem) después de quimioterapia o quimioinmunoterapia, y 8-12 semanas después de radioterapia o quimioradioterapia (44).
Kaste et al (2) indican que el mejor momento para controlar un tratamiento es justo antes de comenzar el curso de la nueva terapia, con el objetivo de disminuir al máximo la ocurrencia del fenómeno “fare” observado después de quimioterapia, administración de factor estimulante de colonias, radioterapia o radioablación.
No se ha establecido aún el tiempo mínimo necesario para controlar con PET luego de administrar factor estimulante de colonias (25), aunque al menos 4 semanas sea un lapso prudente (45).
DosimetríaLa exposición a radiación es un factor de vital importancia en la imagenología diagnóstica actual, y ha sido motivo de diversas publicaciones enfocadas a los efectos estocásticos de ésta. En pediatría éste es un tema crítico y sin duda ha restringido el uso de exámenes que utilizan dosis mayores de radiación como la tomografía computada.
Los rápidos avances tecnológicos que ha experimentado la técnica PET, con detectores más eficientes, procesadores más poderosos y la posibilidad de realizar exámenes de mejor calidad con menor dosis han acercado los estudios metabólicos a la población pediátrica. Por otro lado, el advenimiento de la técnica híbrida PET/CT ha significado no solo un examen de mayor rendimiento que el antiguo PET dedicado, sino un acortamiento de los tiempos de adquisición, un factor clave en el ámbito pediátrico.
La dosimetría del examen PET/CT ha sido evaluada en diversas publicaciones, y las cifras expuestas varían considerablemente de acuerdo a la antigüedad de los equipos usados y protocolos de adquisición utilizados. Si consideramos que la dosis efectiva promedio de una tomografía computada con contraste endovenoso realizada a un adulto es de 12mSv (rango 3 a 24mSv) (5), y que la dosis efectiva de una dosis habitual de FDG de 300 MBq (en un adulto de 70kg) es de 5,7mSv (46), es posible inferir que la dosimetría de un PET/CT con contraste yodado en un adulto será aproximadamente la suma de ambas. Debido a que la dosis de radiofármaco (F18-FDG) es calculada de acuerdo al peso del paciente, es de esperar que la exposición a radiación en niños pequeños o adolescentes sea mucho menor a la del adulto. Por ejemplo a un niño de 10kg le será administrado una dosis de aproximadamente 50 MBq, 6 veces menos que la de un adulto. Por otro lado, los protocolos de TC empleados en pediatría reducen significativamente la exposición a radiación modificando la técnica y las fases de la adquisición.
La dosis efectiva de un PET/CT sin contraste correspondería a la suma de la dosis entregada por una dosis de FDG calculada por Kg de peso más la dosis de una TC de corrección de atenuación (1,3 a 2,4mSv) (46). Es decir un PET/CT de cuerpo entero en un paciente de 10Kg sería equivalente a una dosis efectiva de 2,3 a 3,4mSv.
La posibilidad de contar con equipos PET/CT de última generación que permiten disminuir las dosis de FDG administradas sin perjudicar la calidad de la imagen, y el uso de protocolos especiales de baja dosis para población pediátrica han redundado en una significativa disminución de la irradiación del examen, lo que hace el procedimiento bastante seguro en condiciones actuales.
Nuevos radiotrazadores (no glucosados) para PETEl PET utilizando F18-Fluoride permite visualizar el esqueleto de manera análoga al cintigrama óseo con MDP-Tc99m, aunque en menos tiempo de examen, y con una mayor sensibilidad y resolución de imagen propias de la técnica PET (47). El F18-Fluoride se distribuye en el esqueleto de acuerdo a la actividad osteoblastica y flujo sanguíneo en el tejido óseo, fjándose el F18-fluoride a los cristales de hidroxiapatita del hueso (48). Dado la rápida captación en el tejido óseo, las imágenes pueden ser tomadas desde los 15minutos, con una duración total del examen de menos de 1 hora, lo que es una gran ventaja comparativa, particularmente en población pediátrica. En equipos híbridos PET/CT las imágenes de la tomografía computada proporcionan valiosa información complementaria a las imágenes funcionales del PET, y aumentan el rendimiento del método. Las indicaciones oncológicas y no oncológicas son similares a las del cintigrama óseo (47).
El Ga68-DOTATOC es un radiotrazaodor con afinidad por los receptores de somatostatina, que son sobre-expresados en algunas lesiones derivadas de la cresta neural como los tumores neuroendocrinos (49). Gabriel et al evaluaron 84 pacientes con tumores neuroendocrinos (principalmente carcinoides) con PET Ga68-DOTATOC, obteniendo una sensibilidad, especificidad y eficiencia de 97%, 92% y 96%, respectivamente (50). Ellos concluyen que el PET es significativamente superior a la cintigrafia y SPECT convencionales, tanto en el diagnóstico inicial, como en la etapificación y el seguimiento. Esto se explica principalmente por la mejor resolución espacial del PET que permite detectar lesiones más pequeñas y tumores con menor densidad de receptores. Además destacan sus ventajas prácticas (examen de menor duración) y dosimétricas.
El Galio 68, isótopo emisor de positrones, permite marcar también otras moléculas específicas como peptidos melanocortin, usados en el estudio de melonomas, y derivados bombesin, utilizados en cáncer de próstata y mama (51).
La 18F-fluoro-L-dihydroxyphenylalanine es un análogo DOPA marcado con F-18 (LDOPA-F18), y fue descrito inicialmente en el diagnóstico de tumores endocrinos pancreáticos (52). Muestra gran utilidad en el estudio de tumores neuroendocrinos, proporcionando información que modifica el manejo de los pacientes hasta en un 25% de los casos, particularmente en carcinoide y tumores endocrinos ocultos (53). En este último grupo frecuentemente representa el único método de imagen que detecta correctamente la lesión neoplásica (53).
La correcta y precisa localización preoperatoria del foco a resecar es de vital importancia en cuadros de hiperinsulinismo congénito, donde hasta un 50% de los casos se trata de formas focales de la enfermedad, que son potencialmente curables con cirugía (54). Por otro lado, las formas focales son difíciles de identificar por el cirujano y no son detectables por técnicas de imagen convencional (55). La RM aunque no permite diferenciar eficientemente las formas focales de las difusas, pudiera ser útil en la evaluación preoperatorio para coregistro con las imágenes del PET F18-LDOPA en adenomas de la cola pancreática (56).
ConclusiónLos estudios metabólicos con PET F18-FDG son actualmente un pilar fundamental de la oncología, recomendándose su uso en el estudio inicial y seguimiento de todos los tumores sólidos. Los avances tecnológicos y el advenimiento de la técnica híbrida PET/CT han permitido disminuir la exposición a radiación y los tiempos del examen, lo que ha acercado este estudio a la población pediátrica. Dado las características únicas del PET/CT que permite evaluar el metabolismo de los tumores y estudiar su fisiopatología, y al mismo tiempo contar con imágenes anatómicas aportadas por la tomografía computada, es posible que esta técnica siga ganando espacio en la pediatría así como lo ha hecho en otras áreas médicas.
El autor declara no tener conflictos de interés, en relación a este artículo.