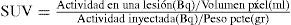A pesar del amplio uso actual del PET/CT en patología oncológica, su expansión en urología ha sido bastante más lenta, debido principalmente a la excreción fisiológica de la F18-Fluorodeoxiglucosa (F18-FDG) por vías urinarias y a la baja captación de F18-FDG de varios de los tumores urológicos, principalmente renales y prostáticos. Debido a las mejoras técnicas del PET/CT y al desarrollo de nuevos radiotrazadores distintos al F18-FDG, su uso en oncología urológica ha aumentado en los últimos años. En cáncer testicular, es el método de elección en masas residuales post quimioterapia. En cáncer vesical muestra un aumento progresivo en su uso tanto para etapificación como para seguimiento post tratamiento. En cáncer renal es útil en sospecha de recidiva local y vigilancia post tratamiento. En cáncer de próstata, gracias al advenimiento de radiotrazadores específicos como la F18/C11-Colina y G68-PSMA, es de amplio uso en pacientes que se han realizado tratamiento curativo y que presentan recidiva bioquímica. El desarrollo de nuevos radiotrazadores y de la técnica híbrida PET/MR posiblemente potenciarán aún más las aplicaciones en urología oncológica.
In spite of extensive use of PET/CT in general oncology, its expansion in urological oncology has been quite slower, due principally to F18-Fluorodeoxiglucosa (F18-FDG) physiological urinary excretion and low F18-FDG uptake of several of urological tumors, mainly renal and prostatic tumors. Owing to PET/CT technical improvements and the development of new radiopharmaceuticals different than F18-FDG, the use of PET/CT in oncological urology has increase last years. In testis cancer, it represents the best choice for assessment of residual mass post chemotherapy. Its clinical use has progressively increased for staging and follow up of patients with bladder cancer. In renal cancer, PET/CT is useful for suspicion of local relapse and surveillance. In prostate cancer, owing to advent of specific radiotracers as F18/C11-Choline and G68-PSMA, PET/CT is extensively used in patients which have undergone curative treatment and present biochemical relapse. Development of new radiotracers and the advent of hybrid PET/MR scans possibly will increase even more their applications in oncological urology.
El PET/CT (Positron Emission Tomography/Computed Tomography) es una técnica híbrida que se emplea rutinariamente en el estudio de diversos cuadros oncológicos. El radiotrazador más utilizado en oncología es la glucosa marcada con Flúor-18, denominada F18-Fluorodeoxiglucosa (F18-FDG), que luego de ser administrado por vía endovenosa, es captada por las células neoplásicas, con grados de avidez dependientes del tipo de tumor y su consiguiente consumo de glucosa, expresado entre otros factores por la densidad de receptores GLUT en la superficie celular, particularmente receptores GLUT 1 y GLUT 3 (1). Así como hay neoplasias que muestran alta captación de F18-FDG, hay otras que pueden presentar bajo consumo de glucosa y por lo tanto, baja sensibilidad del PET/CT al utilizar este radiotrazador. Este es el caso de varias neoplasias urológicas, entre las que se encuentran el cáncer prostático, cáncer renal, tumores neuroendocrinos y algunos adenocarcinomas (2). Solucionando en parte esta situación, se han desarrollado radiotrazadores específicos para algunas de estas patologías, los que además de proporcionar mayor sensibilidad que el F18-FDG, son más específicos.
Por otro lado, el F18-FDG que no logra fijarse en los tejidos después de ser administrado, es excretado normalmente en la orina, produciendo el contraste del sistema excretor desde los cálices renales hasta la vejiga. Dicha excreción fisiológica es un factor crítico en el estudio de tumores de las vías urinarias, ya que puede enmascarar la lesión primaria, disminuyendo drásticamente la sensibilidad del método en su detección.
El objetivo de esta revisión, es proporcionar una puesta al día respecto a la utilidad del PET/CT en la evaluación de las diversas neoplasias urológicas, centrándose tanto en su uso reconocido y avalado en las guías clínicas, como también en las proyecciones futuras.
PET/CTEl examen consiste en la adquisición de un PET de cuerpo completo y una Tomografía Computada (TC) de baja dosis del mismo campo, la que servirá para corrección de atenuación de la imagen del PET y como referencia anatómica de ésta. Se adquieren una seguida de la otra, sin mover al paciente de la camilla del equipo PET/CT. Luego de esto, puede efectuarse una TC con contraste endovenoso de la región que se desee, también susceptible de fusionar con la imagen de PET.
Para realizar el examen se requiere ayunas de 4-6 hrs, y una glicemia no mayor de 200 mg/dl (3). Su única contraindicación es el embarazo. No genera alergias ni reacciones anafilácticas. En caso de realizarse una TC contrastada luego del PET/CT, se deben considerar las precauciones, reacciones adversas y contraindicaciones de ésta.
La intensidad de captación del radiotrazador en una lesión es de gran utilidad diagnóstica y pronóstica, y puede objetivarse con diversos índices y fórmulas, de las cuales las más utilizada es el SUV (Standarized Uptake Value) que corresponde a una fórmula que divide la actividad en una lesión por la dosis inyectada en un volumen de distribución, según la fórmula (3):
El SUVmax, del cual se hablará más adelante, corresponde a la actividad/volumen del vóxel más “caliente” de una lesión determinada, aplicada a la fórmula antes descrita. La ventaja de este índice es que es altamente reproducible tanto intra como interobservador y permite objetivar el efecto metabólico de determinadas terapias (3).
PET/CT en urologíaA pesar del explosivo desarrollo del PTE/CT en oncología en general, su penetración clínica en urología ha sido más lenta, debido principalmente a la excreción normal del F18-FDG por las vías urinarias, lo que dificulta la visualización de las lesiones ubicadas en el eje cáliz-pelvis-uréteres-vejiga y a la baja captación de F18-FDG por varios de los tumores urológicos, particularmente los renales y prostáticos. La expansión del uso del PET/CT en los últimos años se debe a las mejoras técnicas en las máquinas PET/CT y especialmente al desarrollo de nuevos radiotrazadores específicos para ciertos tumores. A continuación se mencionan las patologías oncológicas urológicas más relevantes y el aporte del PET/CT en cada una de ellas.
Cáncer RenalEl carcinoma de células renales (CCR) representa aproximadamente el 3% de las neoplasias malignas en humanos (4). Se estima que para el año 2020 ocurrirán en Chile 1748 casos nuevos de cáncer de células renales (5).
El tipo histológico más frecuente es el carcinoma de células claras (60-80%), siendo menos frecuentes los de tipo papilar (10%), cromófobo-oncocítico (5%), sarcomatoide, escamoso y leiomiosarcoma (6). El diagnóstico precoz de tumores pequeños a través de técnicas de imagen como la ecografía y TC, permiten el tratamiento quirúrgico curativo en la gran mayoría de los casos. En caso de diagnósticos más tardíos, con enfermedad localmente avanzada o metastásica, el tratamiento curativo es bastante menos probable.
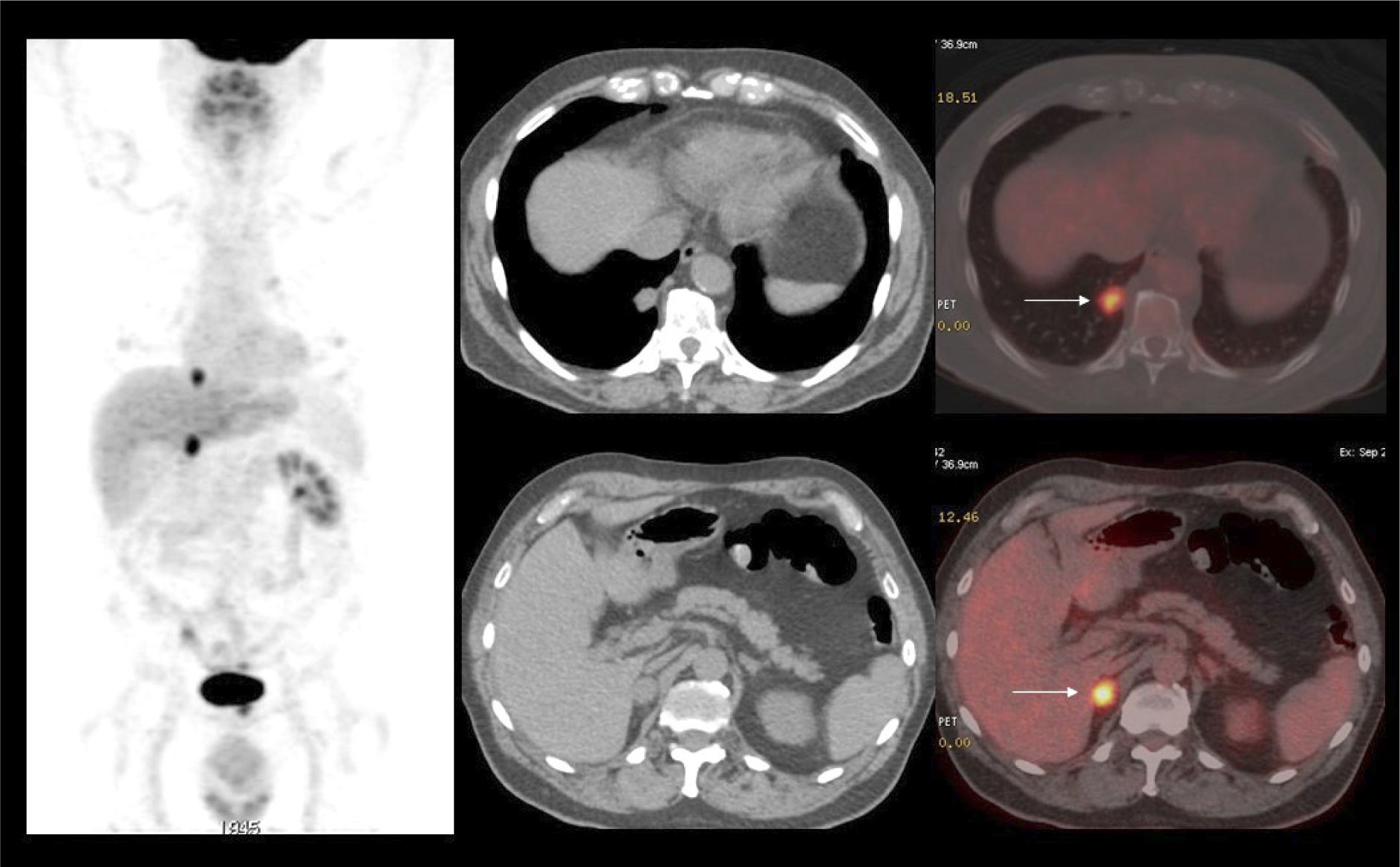
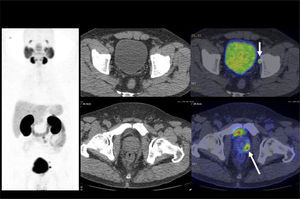
PET/CT en el estudio inicialDebido a que gran parte de los CCR presentan baja captación de F18-FDG, su presencia se ve enmascarada por la leve captación basal del parénquima renal normal, dada por el tránsito del radiotrazador por la corteza renal (filtración) hacia los cálices, dando como resultado que el tumor aparece de similar actividad que la corteza renal no tumoral (Figura 1) (6). Es por este motivo que el PET/CT no ha jugado un rol significativo en el estudio inicial del CCR, aunque en la actualidad hay algunas publicaciones que sugieren su utilidad en ciertos tipos histológicos que muestran mayor captación de F18-FDG como el papilar y el sarcomatoide (6). A esta baja sensibilidad en la detección del tumor primario, se suma su baja especificidad, ya que algunos tumores benignos como el oncocitoma pueden presentar captación de F18-FDG (7). Dado que ante el hallazgo de una masa renal sólida, ni la ecografía, la TC, la RM ni el PET/CT logran excluir razonablemente la posibilidad de un CCR, la exploración quirúrgica o biopsia es el método diagnóstico de elección. Una excepción a esta regla, es demostrar grasa macroscópica dentro de la masa sólida, lo que apoya fuertemente que se trate de un angiomiolipoma (8).
Una potencial indicación poco explorada del PET/CT en CCR es su utilidad pronóstica pre tratamiento, la que sí ha sido consistentemente demostrada en otras neoplasias. En una serie de 60 pacientes con CCR, Ferda et al describe una peor sobrevida en pacientes con tumores renales con SUVmax ≥10, en comparación a aquellos con tumores renales de menor captación (9).
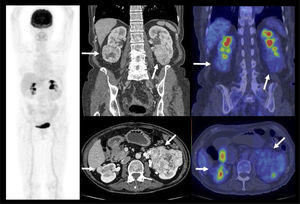
PET/CT en etapificación N y MEn caso de tumores mayores de 3 cm, con riesgo de compromiso ganglionar o siembra a distancia, el PET/CT representa una herramienta útil, ya que logra detectar pequeños ganglios retroperitoneales que pueden resultar negativos o dudosos a la TC y metástasis a distancia adicionales al estudio tradicional, particularmente lesiones óseas en huesos largos, no poco frecuentes en estas neoplasias. Ferda et al encontró que el PET/CT aportó información extra a la etapificación tradicional en 85% de los pacientes con CCR localmente avanzados, representados mayormente por metástasis fuera del campo de estudio habitual de la TC (9). Por otro lado, ayuda a caracterizar mejor aquellas lesiones pulmonares sospechosas, aumentando la especificidad de la TC en la detección de metástasis pulmonares (8).
Un factor importante a considerar es la mayor sensibilidad del PET/CT en las metástasis respecto al tumor renal primario, por cuanto la siembra secundaria a distancia suele presentar mayor captación de F18-FDG, que puede ser explicada por cambios en la biología del tumor, con aumento de la expresión de receptores GLUT 1 respecto a la lesión primaria renal (8).
Control de tratamientoEl CCR comúnmente no responde a la quimioterapia convencional, por lo que para su tratamiento se emplean otras terapias sistémicas como las basadas en inhibidores de la tirosina quinasa u otras terapias “target” (4). A diferencia de la quimioterapia, la efectividad de estas terapias nuevas no se refleja en la reducción de tamaño de las lesiones, sino en la actividad biológica del tumor. Un TC con persistencia de las lesiones, o aún con crecimiento de ellas, puede significar un tratamiento exitoso (10). Es por eso que los criterios RECIST no proporcionan una sensibilidad adecuada para evaluar el tratamiento y deben utilizarse métodos de imagen funcionales como el PET/CT, que determinen la viabilidad metabólica del tumor (4).
En una serie de 35 pacientes con CCR metastásico tratados con inhibidores de tirosina quinasa (Sunitinib n=19 o Sorafenib n=16), Ueno et al (11) mostraron una mejor sobrevida global y sobrevida libre de enfermedad en aquellos pacientes con reducción ≥20% de SUVmax al comparar PET/CT basal vs PET/CT realizado un mes post inicio del tratamiento. En otro estudio, Chen et al describen que la reducción de captación de F18-FDG a las dos semanas de inicio del tratamiento con Everolimus tiene valor pronóstico de sobrevida global y sobrevida libre de enfermedad en pacientes con CCR metastásico (12). En general, mientras mayor sea la disminución de captación de las lesiones en el PET/CT interino (intraterapia), mayor será la mejoría en las tasas de sobrevivencia (10).
Es interesante destacar que el análisis de la literatura disponible apunta a que la capacidad del PET/CT para predecir respuesta a tratamiento no es afectada por el agente terapéutico empleado (sorafenib vs sunitinib) ni por el tipo histológico de tumor renal, siendo relativamente transversal en todos los casos (10).
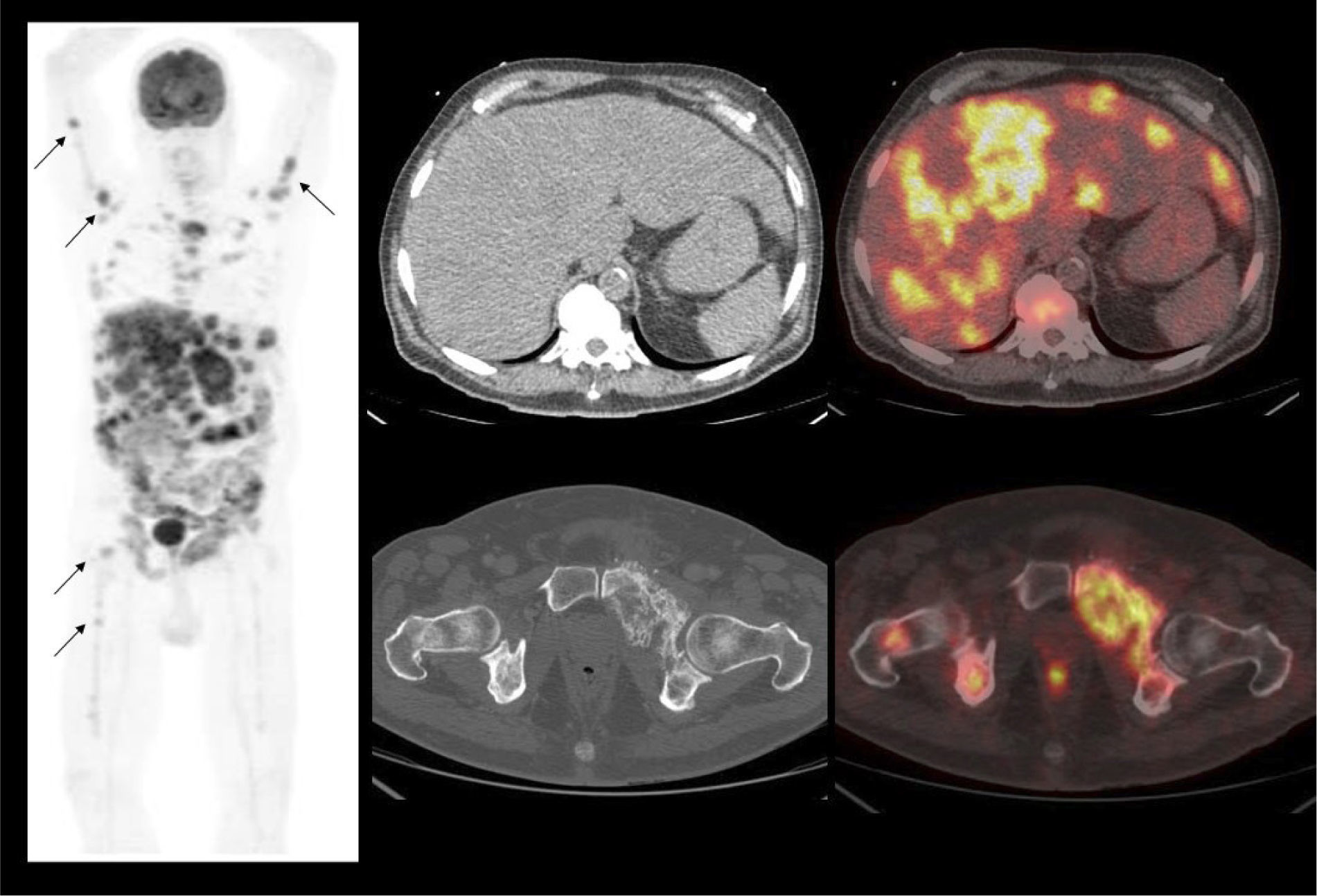
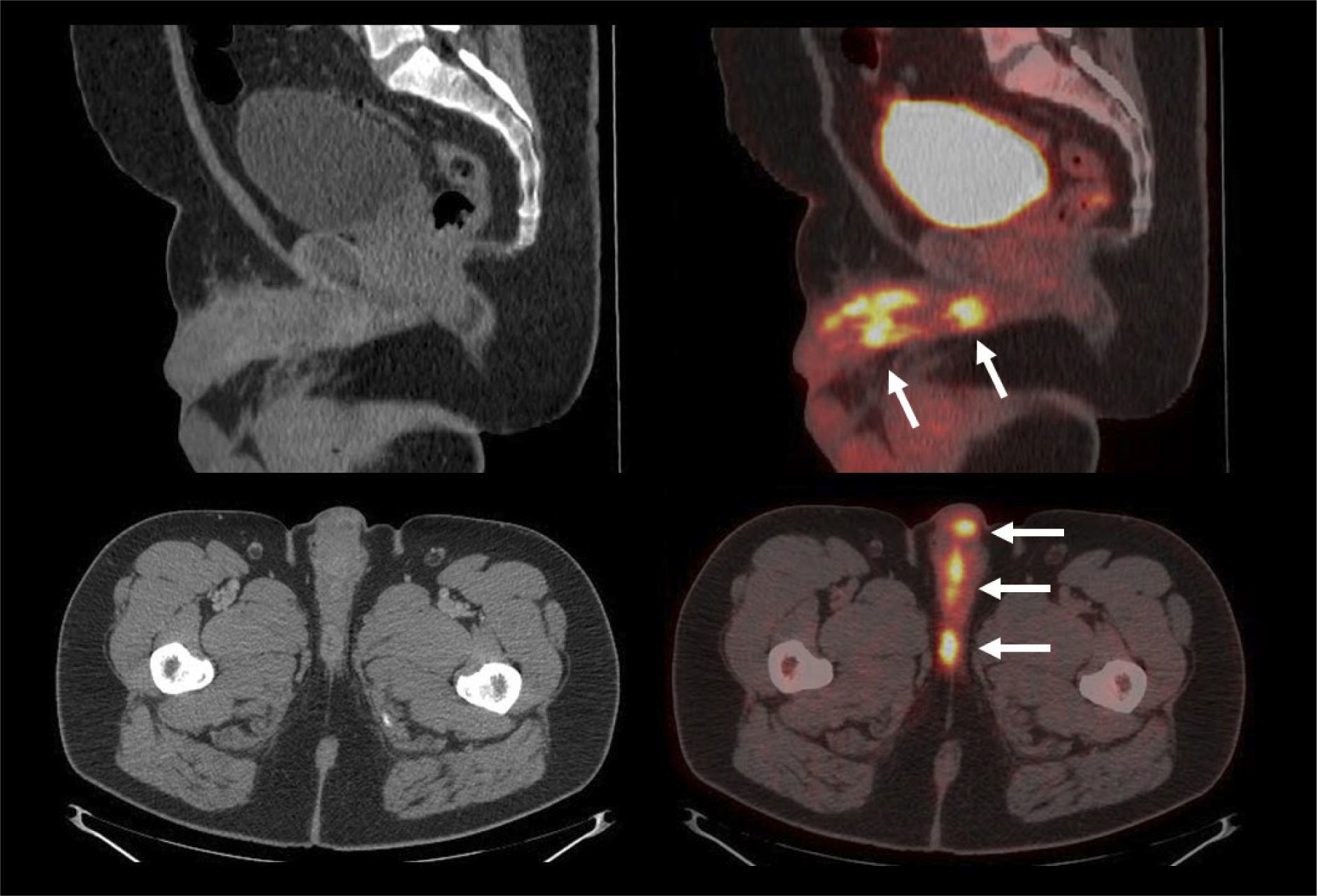
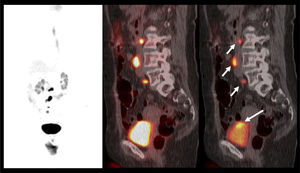
La vigilancia post tratamiento de un CCR suele ser prolongada, ya que las metástasis pueden aparecer varios años después de la cirugía (8). El PET/CT tiene especial valor en la detección precoz de dichas lesiones, permitiendo muchas veces plantear la opción de tratamiento quirúrgico curativo en algunos casos de oligometástasis (Figura 2).
Cáncer de vías urinariasCorresponde a un grupo de neoplasias localizadas desde los cálices renales hasta la vejiga. El tipo más frecuentes es el cáncer de vejiga, siendo las neoplasias del tracto urinario alto (cálices, pelvis renal, uréter) de significativa menor incidencia, aproximadamente 5-10% de todos los carcinomas uroteliales (13).
El cáncer vesical es la 11a neoplasia maligna más frecuente en el mundo, con una incidencia de 430 mil casos durante el año 2012 (5). Se estima que para el año 2020 ocurrirán en Chile 1314 casos nuevos de cáncer de vejiga (5).
Un 90-95% de los cánceres de vejiga corresponden a carcinoma de células transicionales (4,6). Tumores menos frecuentes son el carcinoma escamoso, adenocarcinoma vesical, variantes sarcomatoides y carcinoma de células pequeñas (14).
EtapificaciónAdemás de la cistoscopía, que es mandatoria en todos los pacientes, hay consenso en que aquellos pacientes mayores de 60 años con hematuria, deben estudiarse además con exámenes de imagen (15). La ecografía pelviana, aunque es recomendada por algunas guías clínicas, tiene un rol limitado en el diagnóstico y etapificación de las neoplasias vesicales, por cuanto posee una sensibilidad reducida en lesiones infiltrativas y no es capaz de evaluar adecuadamente la profundidad del tumor y el eventual compromiso ganglionar (15,16).
El método de imagen estándar recomendado actualmente es la TC contrastada trifásica, que utiliza imágenes sin contraste, y contrastadas precoces y tardías de excreción (16), llamada “uroTAC” en nuestro medio (15). Este examen permite además evaluar las vías urinarias altas, que siempre deben ser exploradas en estos pacientes.
La RM con gadolinio puede ser utilizada en pacientes con alergia al medio de contraste iodado o con pobre función renal siempre que tenga una tasa de filtración glomerular (TFG) >30 ml/ min/1.73m2(16). Es útil principalmente en etapificación T, ya que puede determinar la profundidad del tumor y la invasión de la grasa perivesical u órganos vecinos con una alta resolución de contraste (17).
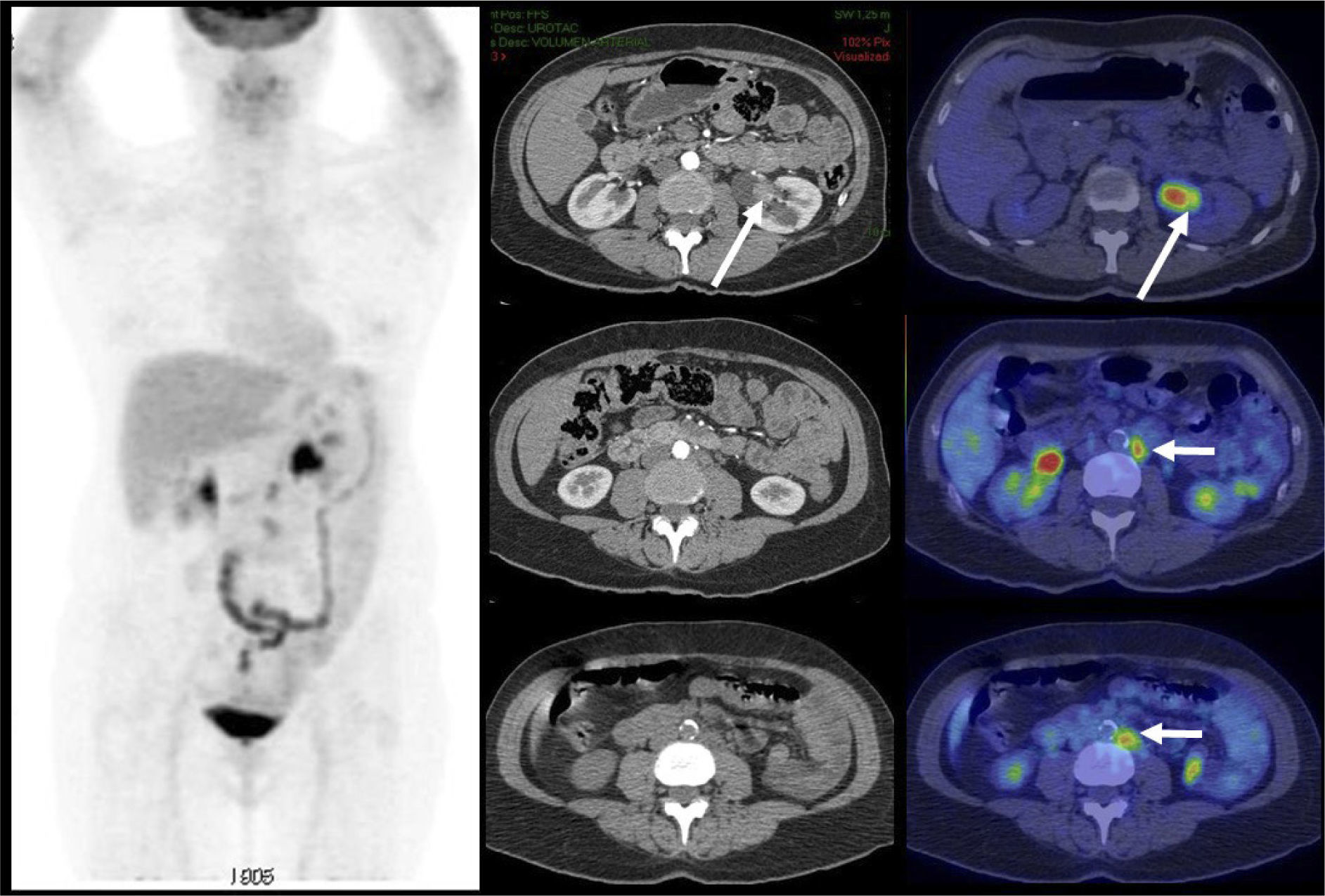
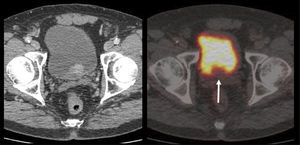
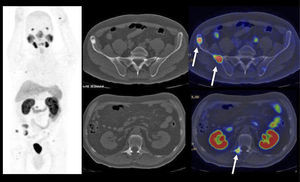
El PET/CT utilizando F18-FDG, dado la excreción fisiológica por vías urinarias del radiotrazador, no es propicio para la evaluación de los tumores primarios (16). Cuando los tumores muestran similar captación de F18-FDG que el contenido urinario, pueden no ser visibles salvo en las imágenes de TC (15). En cambio, si el tumor es más captante que la orina (Figura 3), o menos (Figura 4), puede ser detectado realizando un adecuado ventaneo de la imagen del PET.
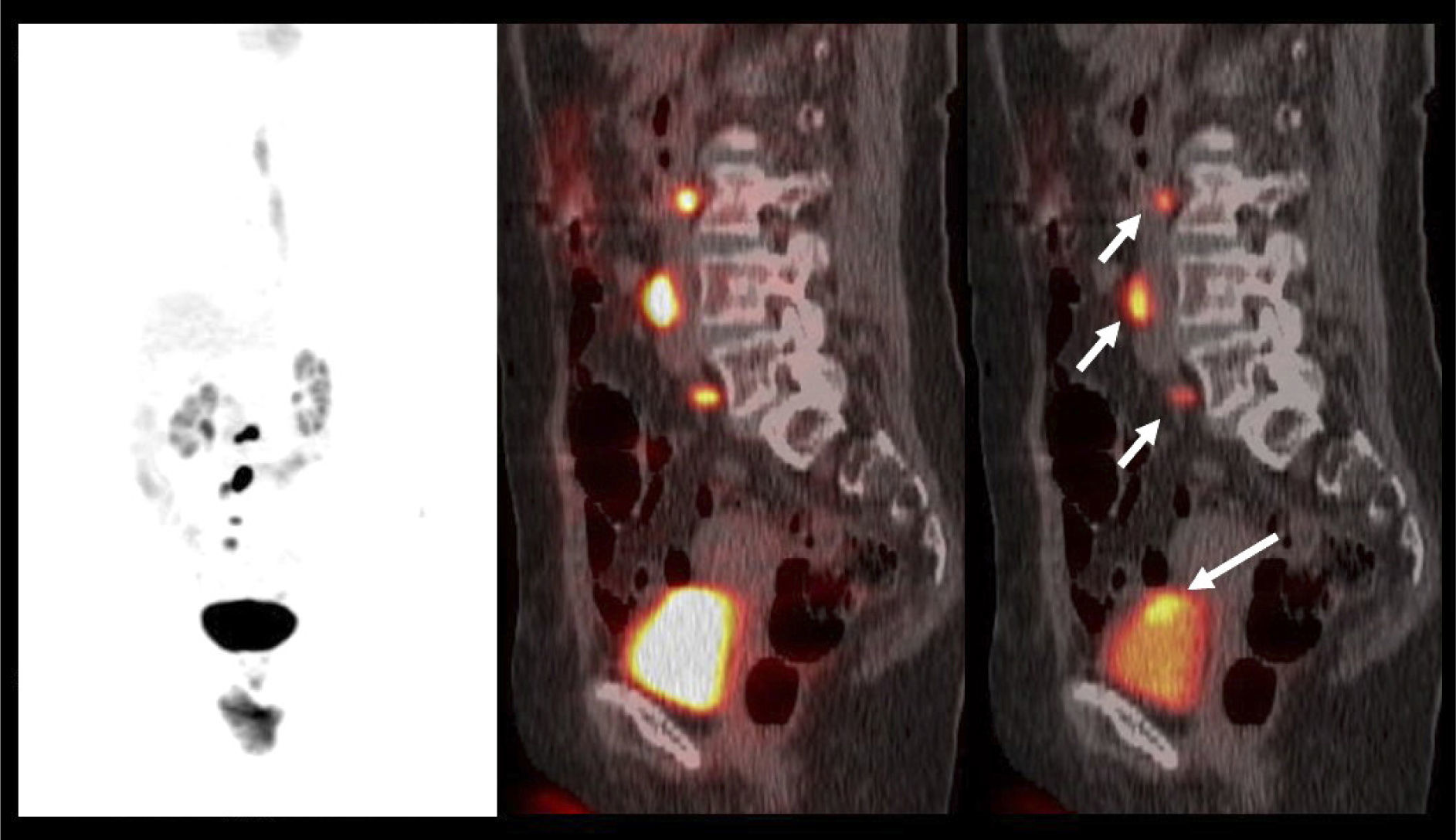
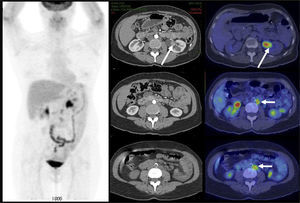
El contraste fisiológico de las vías urinarias no es un problema respecto a la detección de compromiso ganglionar y a distancia, que representa el verdadero aporte del PET/CT en estos pacientes, al detectar pequeños ganglios que no constituyen adenopatías en el UroTAC (Figuras 4 y 5), y pesquisar siembra secundaria a distancia con mayor sensibilidad que las técnicas convencionales (17).
Los escasos reportes de la utilidad del PET/CT en etapificación nodal en cáncer vesical apuntan a una mayor sensibilidad del PET/CT (46-57%) respecto a la TC contrastada (33-46%), con una similar especificidad para ambas técnicas (18,19).
Respecto al estudio de diseminación a distancia, las guías recomiendan exploración ósea y pulmonar dirigida desde etapas T2 (invasión muscular) en adelante, para lo cual puede utilizarse cintigrama óseo, TC de tórax y/o PET/CT (16).
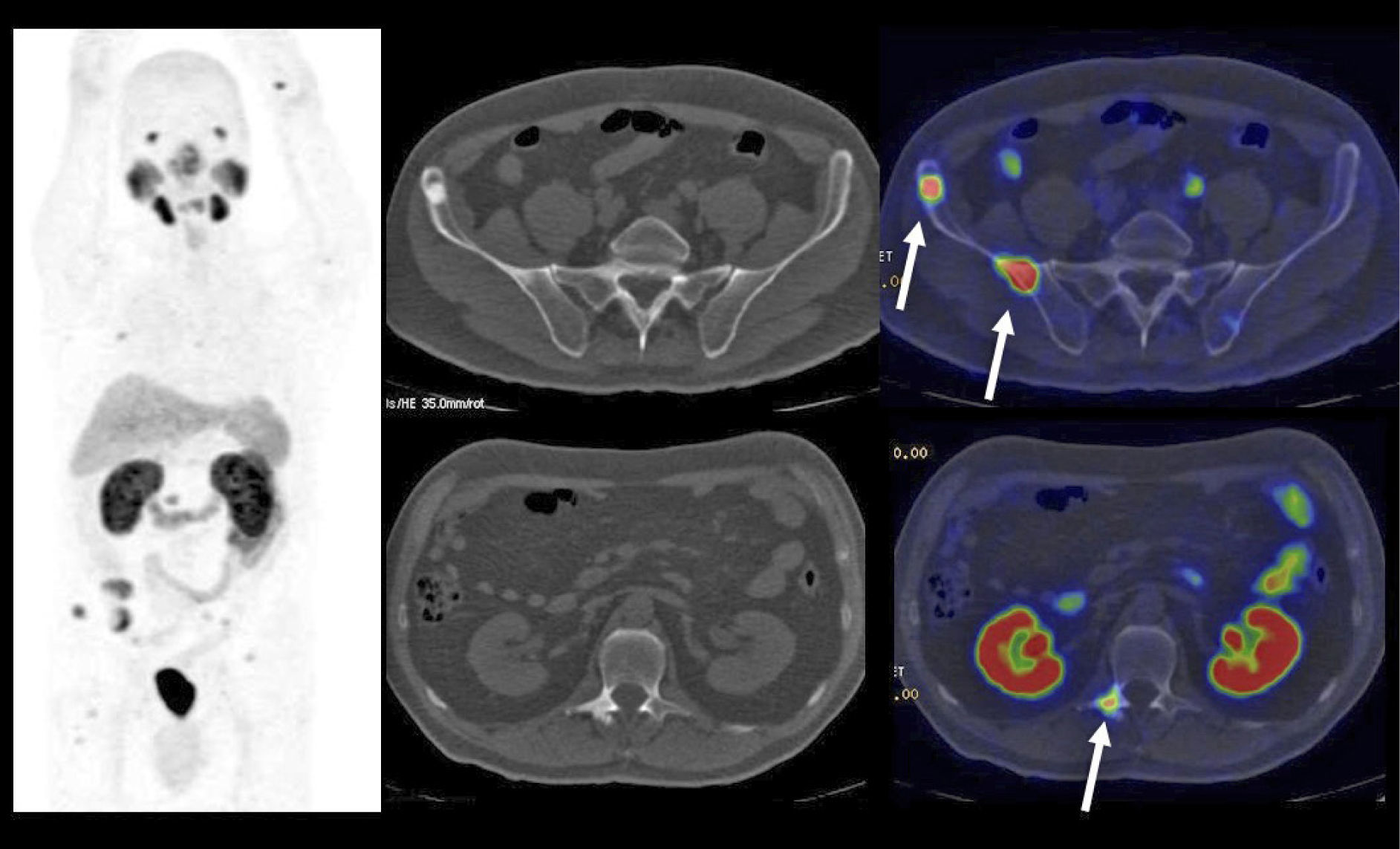
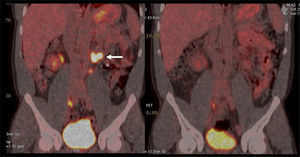
En cáncer vesical con invasión muscular, las metástasis ganglionares y a distancia son de alta frecuencia (Figura 6). En un grupo de 150 pacientes en etapa pT2-4, Shinagare et al (14) describieron un 69% de compromiso secundario ganglionar, 47% óseo, 37% pulmonar, 26% hepático y 16% peritoneal.
Un tema de especial interés es entonces la ocurrencia de metástasis a distancia, ya que pueden cambiar radicalmente el manejo de los pacientes, especialmente la posibilidad de optar o no a cirugía curativa. Ya que las lesiones secundarias óseas son las más frecuentes, es mandatorio optimizar su detección. El PET/CT presenta varias ventajas en esta materia, ya que tiene alta sensibilidad en lesiones líticas, de alta frecuencia en estas neoplasias, y permite evaluar conjuntamente esqueleto axial y apendicular, ya que las metástasis a huesos largos no son poco frecuentes en estas neoplasias (14,20) (Figura 6).
Cáncer de próstataEl cáncer de próstata es el cuarto cáncer más frecuente en el mundo y el segundo más frecuente en hombres (5). El año 2012 se estima que 1.1 millón de hombres fueron diagnosticados con cáncer prostático en el mundo, con 307 mil fallecimientos por esa causa ese año (5). En Chile, se estima la ocurrencia de 7900 nuevos casos de cáncer de próstata para el año 2020 (5).
Dado la amplia utilización de métodos de tamizaje en cáncer de próstata, cuales son el tacto rectal y la medición del antígeno prostático específico (APE), es frecuente la detección de neoplasias en etapas precoces, con tumores confinados a la próstata y sin metástasis, lo que permite ofrecer un tratamiento curativo (21). En una revisión local de 155 pacientes con etapificación completa, Martínez y cols (21) encontraron sólo un 16% de pacientes metastásicos al momento del diagnóstico, con alta correlación entre el riesgo estimado pre-test y la ocurrencia de siembra secundaria. Esto hace necesario seleccionar cuidadosamente los casos que requerirán imágenes adicionales enfocadas a descartar diseminación.
EtapificaciónLa etapificación en busca de compromiso ganglionar y a distancia debiera reservarse a aquellos pacientes de mayor riesgo, es decir con mayor invasión glandular, niveles de APE alto y Gleason elevado (16). Los pacientes con lesiones T2b, APE >10ng/ml o Gleason ≥7 ya presentan cierto riesgo de metástasis, lo que justificaría el estudio de diseminación (21). Para estos efectos, las guías actuales recomiendan el uso de la TC o RM de pelvis y del cintigrama óseo (16).
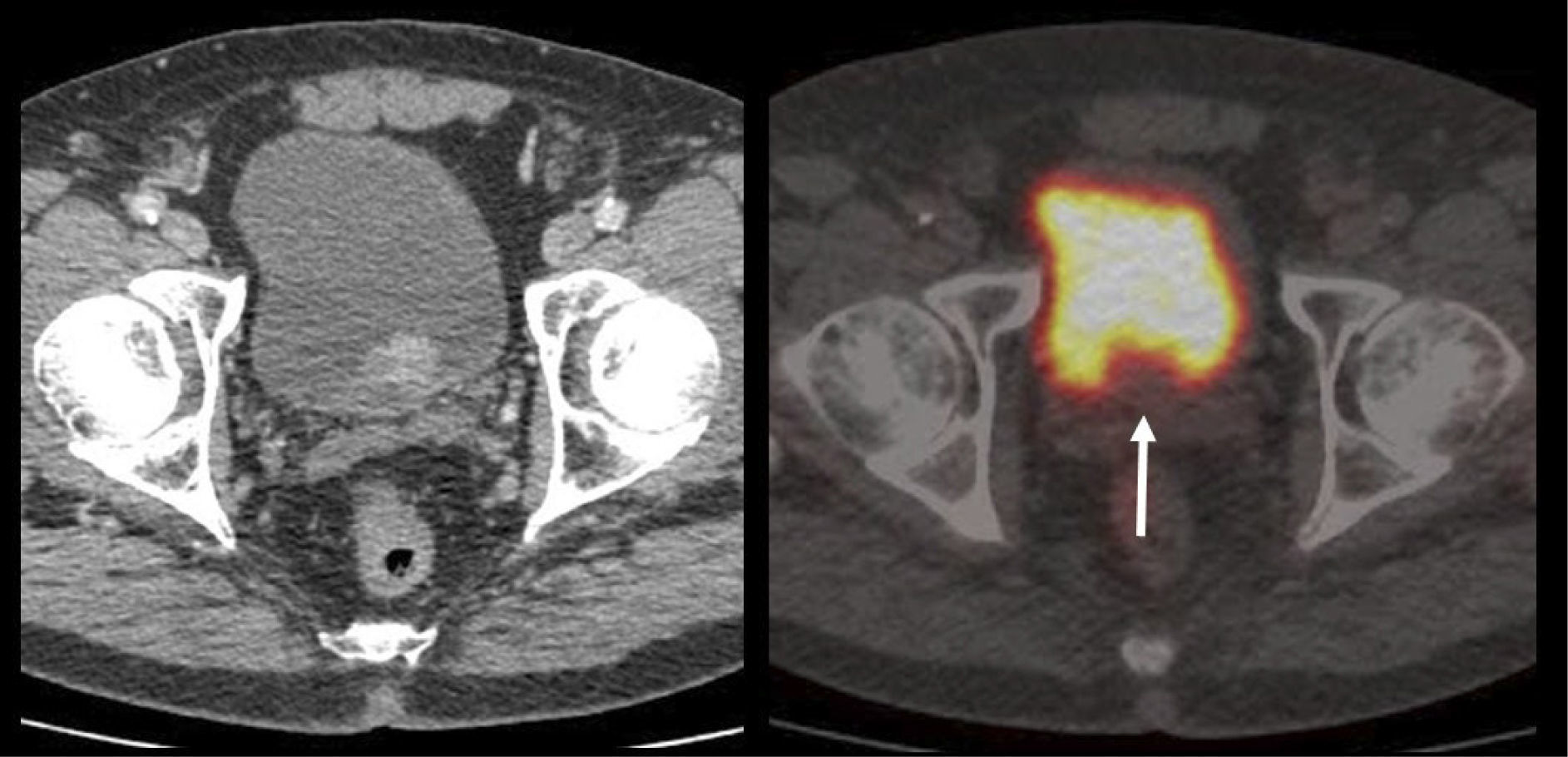
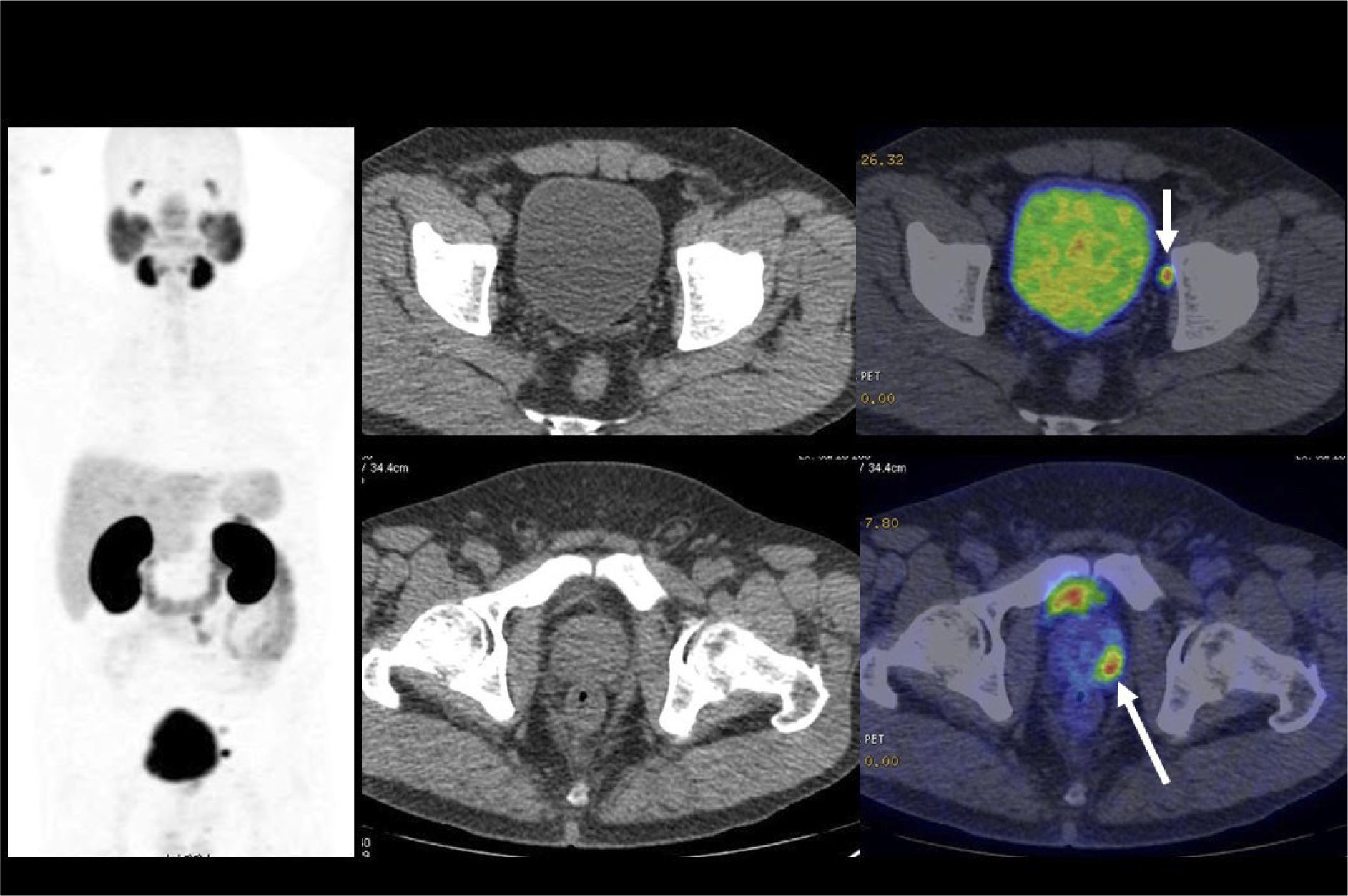
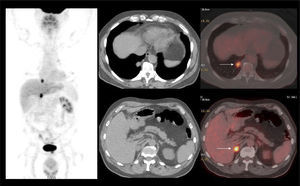
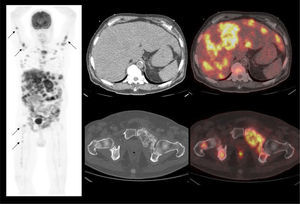
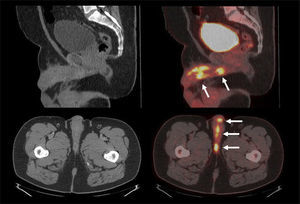
Aunque el PET/CT no figura en el algoritmo habitual de estudio de etapificación, ha ganado terreno rápidamente gracias a ciertos radiotrazadores específicos desarrollados en los últimos años, principalmente aquellos basados en el trazador PSMA (Prostate Specific Membrane Antigen) (22). Varias publicaciones destacan la alta correlación del PET/CT Ga68-PSMA con la RM de próstata al evaluar el tumor primario (23), y su superioridad diagnóstica en etapificación N, al detectar pequeñas adenopatías regionales que pasan inadvertidas con TC o RM (Figura 7) (24). Al estudiar preoperatoriamente a pacientes de riesgo intermedio y alto, Van Leeuwen et al encontraron una sensibilidad de 64% y especificidad de 95% en detección de linfonodos, todos ellos <10 mm, es decir negativos a la TC (25). Ellos sugieren que el PET/CT Ga68-PSMA debiera reemplazar en el futuro a los métodos tradicionales de etapificación N. Los falsos negativos obtenidos corresponden mayormente a ganglios metastásicos <5 mm, los que siguen siendo un desafío diagnóstico para las técnicas de imagen actuales.
Evaluación de recidiva bioquímicaRespecto a pacientes operados que presentan alza de los niveles de APE, las guías actuales recomiendan una serie de exámenes de imagen que comprenden radiografía de tórax, TC de abdomen y pelvis, RM pelvis, ultrasonografía transrrectal, cintigrama óseo-SPECT, PET/CT óseo con NaF, PET/CT con C11/F18-Colina y últimamente PET/CT con Ga68-PSMA (16,22). Dichos estudios, aunque son en parte complementarios, no se pueden efectuar conjuntamente, y debe optarse por aquellos que logren la mejor relación costo/eficiencia (22). Dado que los sitios de recidiva más frecuentes son el lecho prostático, los ganglios regionales y el esqueleto axial (26), un estudio ideal deberá abarcar estos territorios, con un adecuado rendimiento diagnóstico y un costo no muy elevado.
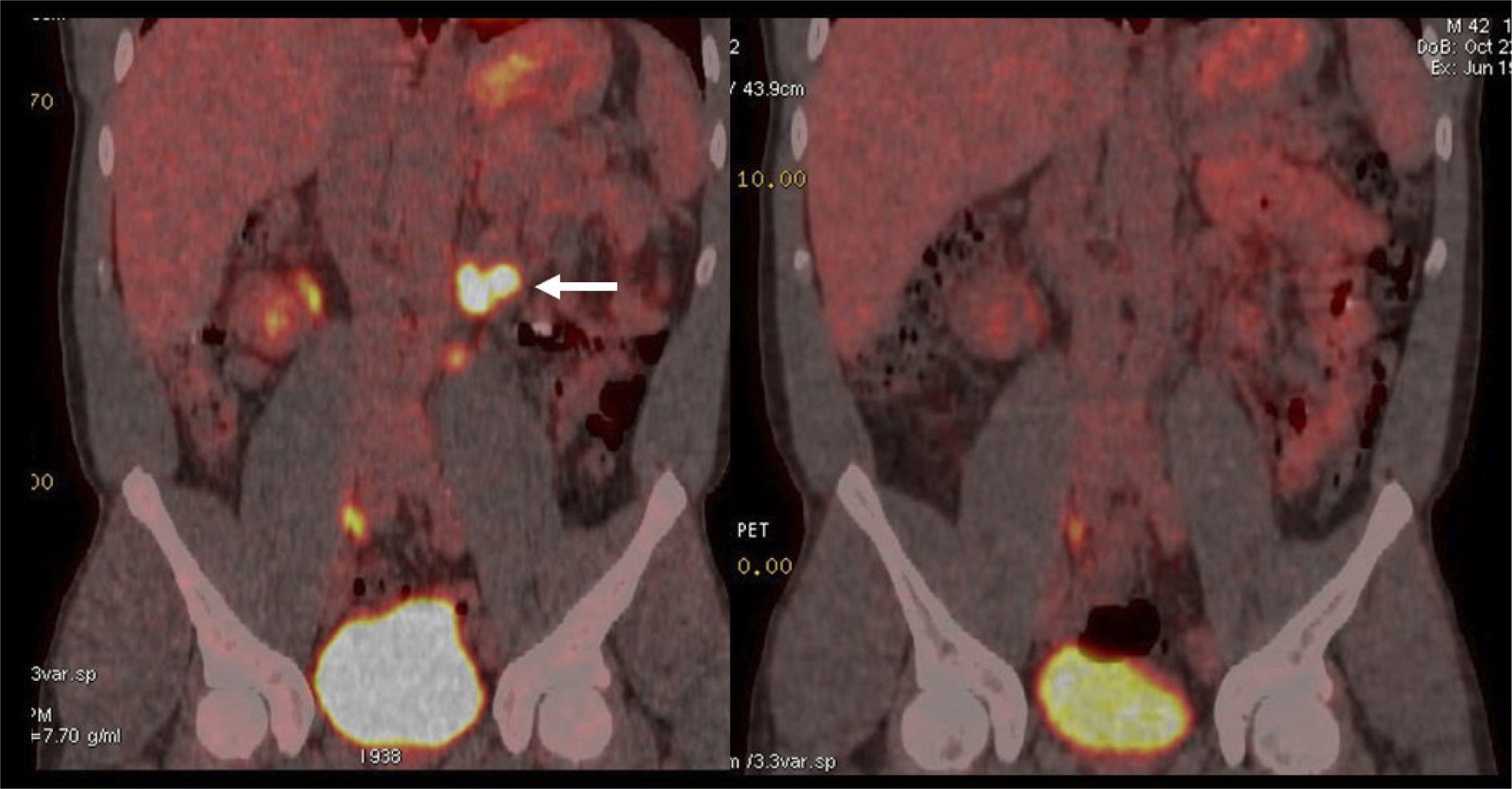
La capacidad de las imágenes moleculares de detectar recidiva de manera más precoz que las imágenes morfológicas como la TC, especialmente en áreas con anatomía alterada por la cirugía y/o radioterapia, ha impulsado el uso del PET/CT en estos pacientes. La vasta experiencia en PET/CT utilizando C11 o F18-Colina ha permitido acumular evidencia suficiente para poder incluirlo en las guías clínicas actuales (16). Sin embargo, otros radiotrazadores nuevos como el Ga68-PSMA, que han presentado un desarrollo explosivo gracias a su alto rendimiento diagnóstico, aún mayor que el del PET/CT con Colina, especialmente a niveles bajos de APE, hacen pensar que prontamente las guías clínicas lo incorporarán en sus sugerencias (27) (Figura 8).
En un grupo de pacientes operados que presentaron posteriormente recidiva bioquímica, Morigi et al (26) demostró una significativa mayor sensibilidad del PET/CT Ga68-PSMA comparado al PET/CT F18-Colina para niveles de APE bajos, lo que estaría explicado en parte por la mejor resolución de contraste del Ga68-PSMA, proporcionando una relación lesión/fondo tres veces mayor respecto a F18-Colina. Ellos obtuvieron una sensibilidad de 50% con APE <0.5ng/ml, 69% con APE 0.5-2.0ng/ml y 86% con APE >2.0ng/ml, vs 13%, 31% y 57% para F18-Colina, respectivamente.
Resultados similares exhiben Eiber et al en un análisis de 248 pacientes con alza del APE post prostatectomía radical, con una sensibilidad de 57.9% con APE <0.5ng/ml, 72.7% con APE 0.5-1.0ng/ml, 93.0% con APE 1-2ng/ml, y 96.8% con APE >2.0ng/ml (28).
La síntesis de radiotrazadores nuevos como el PSMA marcado con F18 ([18F]DcFpyl), y el advenimiento del PET/MR plantean nuevos desafíos respecto a la forma de enfrentar el estudio del paciente con cáncer de próstata, que podrían seguir cambiando en el futuro (27).
Cáncer testicularEl cáncer testicular representa aproximadamente al 1% de los tumores malignos en hombres, afectando mayormente adultos jóvenes (29). Constituye el tumor sólido maligno más frecuente en hombres jóvenes entre 20 y 34 años (16). Se estima que para el año 2020 ocurrirán 665 nuevos casos de cáncer testicular en Chile (5).
El 95% de los tumores testiculares malignos corresponden a tumores de células germinales, los que pueden ser de tipo seminoma (40%) o no seminoma (60%) (4,16). Los seminomas ocurren en pacientes entre 35 y 45 años, y los no seminomas en población más joven, entre 15 y 35 años (29). En su diagnóstico inicial la imagen de elección es la ecografía testicular (16).
Según las guías actuales, la etapificación clínica de estos pacientes se lleva a cabo mediante el examen clínico, las imágenes (TC de tórax, abdomen y pelvis) y marcadores tumorales (LDH, beta-hCG, AFP). Las guías también mencionan la radiografía de tórax para evaluar la diseminación torácica (16), a pesar de su conocida baja sensibilidad en la detección de nódulos pulmonares pequeños, especialmente aquellos menores de 10mm (30). Por otro lado, el compromiso ganglionar supradiafragmático no es poco frecuente en presencia de enfermedad retroperitoneal, y se considera como enfermedad metastásica (M1a), lo que apoya el uso de imágenes avanzadas del tórax (29).
La etapificación ganglionar por imágenes se basa fuertemente en la presencia de ganglios retroperitoneales aumentados de tamaño, que determinaría una etapa II. Para ganglios con diámetro ≥10mm en su eje menor, la TC tiene una especificidad de 100%, aunque una sensibilidad de 37% (31). La RM no ha mostrado mejor rendimiento que la TC en el estudio de diseminación ganglionar (29). Los linfonodos pequeños con compromiso inicial, que pueden ser pasados por alto con la TC y RM, sí pudieran ser visibles con técnicas de imagen molecular como el PET/CT (32).
El PET/CT no está considerado como examen de primera línea en la etapificación de estos pacientes (16). La captación de F18-FDG por estos tumores es variable, con un rango que va desde alta avidez para los seminomas, hasta baja o nula captación para los teratomas maduros (33). No obstante esta variabilidad en el metabolismo glucídico de los diferentes tipos histológicos, el PET/CT ha demostrado mejor rendimiento diagnóstico que la TC, particularmente en la evaluación ganglionar y de metástasis extrapulmonares.
Utilizando en equipo PET no híbrido, Cremerius et al (32) obtuvo una mayor sensibilidad en la detección de metástasis ganglionares y a distancia que la TC (87% vs 73%), sin diferencias significativas en su especificidad (94% para ambas técnicas). Estudios posteriores con equipos híbridos PET/CT han ampliado esa diferencia, mejorando tanto la especificidad como la sensibilidad, debido al aumento de sensibilidad y resolución espacial de los nuevos equipos híbridos, que además permiten contar con imágenes anatómicas otorgadas por la TC. En un grupo de 49 pacientes con cáncer testicular, Sterbis et al (34) obtuvo una sensibilidad y especificidad de 93% y 97% para detección de metástasis, significativamente superior a la TC (60% y 82%, respectivamente). Ellos destacan la utilidad diagnóstica de la imagen fusionada del PET y TC, como una herramienta adicional que aumenta el rendimiento de la técnica.
En evaluación de tratamiento, el PET/CT estaría indicado en seminomas con compromiso ganglionar que presentan masas residuales >3cm en la TC realizada post quimioterapia, que en caso de presentar actividad metabólica debieran ser biopsiadas o resecadas (16) (Figura 9). Esto se podría extrapolar a tumores no-seminomatosos, teniendo presente que dichas lesiones presentan diferentes grados de avidez de F18-FDG, y que en ciertos tumores como los teratomas maduros puede no existir hipercaptación por el tumor. El control con PET/CT post tratamiento es considerado el “gold standard” en la determinación de tejido tumoral viable (4), con sensibilidad de 82%, especificidad de 90%, y eficiencia de 88% (35). Se ha observado un significativo mayor rendimiento diagnóstico si el PET/CT se realiza al menos 6 semanas después de finalizada la quimioterapia, con menor número de falsos positivos y falsos negativos que los controles más precoces (35). Es posible que en el futuro el PET/CT adquiera mayor protagonismo como examen de primera línea en evaluación de tratamiento de pacientes en etapa II y III, dado su reconocido alto rendimiento en detección de tejido tumoral viable, y su creciente disponibilidad en los últimos años (4).
La vigilancia y seguimiento de los pacientes se basa en la clínica, marcadores tumorales y en imágenes, con esquemas de seguimiento muy variables según el tipo histológico del cáncer y el riesgo estimado de recidiva (29). Las imágenes recomendadas son la TC abdomino-pelviana y radiografía de tórax, efectuadas en forma trimestral, semestral o anual según el caso, durante los primeros 5 años. El seguimiento sistemático con PET/CT no es recomendado y sólo sería de utilidad en casos de mayor riesgo (16,29).
Cáncer de uretra y peneEl cáncer de uretra y pene representan menos del 1% de las neoplasias malignas en población adulta (36). Los estudios de imagen son indispensables en estos pacientes, ya que el tipo de tratamiento ofrecido depende fuertemente de las características del tumor primario, y de la presencia de compromiso ganglionar y a distancia al momento del diagnóstico (36).
Debido a su biología, estos tumores suelen presentar alta captación de F18-FDG (Figura 10). Sin embargo, existe muy poca evidencia publicada acerca del uso de PET/CT en estas neoplasias, con resultados que apuntan a una posible utilidad en etapificación N y M, sin un aporte sustancial en etapificación T (36).
En cáncer de pene, Graafland et al (37) describen una sensibilidad de 90% y una especificidad de 100% en evaluación de compromiso ganglionar inguinal, con mayor rendimiento diagnóstico que la punción con aguja fina (PAF) guiada con ecografía (40% y 100%, respectivamente) (38). La sensibilidad de ambos métodos estaría limitada por el tamaño de los linfonodos, especialmente de la PAF que no es posible en linfonodos muy pequeños (36). Por otro lado, las técnicas tomográficas (TC, RM, PET/CT) tendrían la ventaja comparativa de evaluar los territorios ganglionares intrapelvianos, donde la PAF guiada por ecografía no logra llegar. Dichos ganglios suelen estar comprometidos en lesiones del glande o del cuerpo peneano (36).
Dado que la TC, PET/CT y RM, incluso RM empleando nanopartículas linfotrópicas, no logran detectar las micrometástasis ganglionares, la biopsia del ganglio centinela seguirá siendo el método de mayor sensibilidad para etapificación N en cáncer de pene (36).
Las metástasis a distancia están presentes en 5% de los pacientes con cáncer de pene y 30% de los pacientes con cáncer de uretra al momento del diagnóstico (36). La literatura es escasa respecto al valor del PET/CT en evaluación de metástasis en estos pacientes. En un reporte aislado, Zhang et al obtienen una sensibilidad de 85% y especificidad de 86% en detección de metástasis a distancia en 48 pacientes con cáncer de pene, ubicadas mayormente en ganglios no regionales, pulmón y hueso (39). Ellos describen un cambio de conducta terapéutica en 57% de los pacientes luego del PET/CT.
Es posible que el PET/CT juegue un rol potencial en etapificación M en estos pacientes, aunque no hay evidencia suficiente en cáncer de pene y uretra que apoye esta afirmación.
El autor declara no tener conflictos de interés, en relación a este artículo.