El adenocarcinoma ductal de páncreas (PDAC, por sus siglas en inglés) es una de las enfermedades neoplásicas con tendencias crecientes tanto en la incidencia como en la mortalidad. Dado que se trata de una neoplasia agresiva y que la mayoría de los pacientes se presentan en etapas avanzadas, fuera de indicación quirúrgica; el tratamiento del PDAC, se beneficiaría de una estrategia de detección precoz que permitiera identificar más pacientes en etapas iniciales de la enfermedad.
Los métodos de detección actualmente disponibles en pacientes con sospecha clínica incluyen exámenes de imagen como tomografía computada y resonancia magnética (RM) y el uso de biomarcadores como CA 19-9. En casos de duda diagnóstica, se dispone del ultrasonido endoscópico (EUS, por sus siglas en inglés), que permite además obtener material histológico para análisis anatomopatológico.
La baja incidencia del PDAC hace poco factible el uso de estrategias de tamizaje en la población general, ya que estas tienen un bajo rendimiento y alto costo. Por este motivo, los esfuerzos se han centrado en la identificación de grupos de riesgo clínico y genético en quienes la vigilancia activa tiene un mejor rendimiento. Estos grupos incluyen el cáncer pancreático familiar, pacientes portadores de mutaciones hereditarias específicas, y pacientes portadores de lesiones quísticas mucinosas del páncreas. La diabetes de reciente diagnóstico (DM-RD) en mayores de 50 años y la pancreatitis crónica son también considerados como factores de riesgo clínico. En los pacientes con indicación de cribado, los protocolos de seguimiento incluyen el uso periódico de RM o EUS.
El desarrollo de nuevos biomarcadores moleculares o genéticos, aislados o en combinación, son un área de fuerte investigación que busca mejorar las capacidades diagnósticas para el PDAC y mejorar la actual ausencia de estrategias efectivas de cribado.
El objetivo del presente artículo es describir las estrategias actualmente disponibles para la pesquisa precoz del cáncer de páncreas, incluyendo las áreas de desarrollo más prometedoras para el futuro próximo.
In western countries, pancreatic ductal adenocarcinoma (PDAC) has shown a rising incidence and is currently one of the leading causes of cancer related mortality. Due to its aggressive biology, most patients diagnosed with PDAC present with advanced disease not suitable for curative treatment. An early detection strategy could potentially improve results by detecting more PDAC patients within the initial stages of the disease.
Currently, diagnosis of PDAC is mostly based in cross sectional imaging, including computed tomography and magnetic resonance imaging (MRI) as well as biomarkers such as CA 19-9. Selected cases might be further studied using endoscopic ultrasound (EUS) with the option of EUS guided biopsy if histology is needed to confirm diagnosis.
Due to its low incidence, screening general population for PDAC has been shown to be an ineffective and expensive approach. For this reason, efforts have shifted towards surveillance of specific groups of patients known to be at risk for development of PDAC. In these groups, screening has shown to have a higher yield for early cases and improved results in terms of resection rates and survival. These groups include carriers of certain oncogenic germline mutations, patients with strong family history for PDAC, and patients diagnosed with mucinous cystic neoplasms of the pancreas. Patients over 50 years old diagnosed with new-onset diabetes and patients living with chronic pancreatitis are also considered to be at risk for PDAC development. Patients selected for surveillance should be included in screening protocols including periodic imaging with MRI or EUS.
Development of biomarkers is an area of active research in the field of pancreatic cancer. New genetic or molecular biomarkers, to be measured in an isolated or combined manner, are an interesting approach looking to improve current diagnostic capabilities and to provide new tools for effective screening in wider groups of patients.
The aim of this article is to describe strategies currently available for early detection of PDAC, including promising research areas for the near future.
El adenocarcinoma ductal de páncreas (PDAC, por sus siglas en inglés) es en la actualidad una de las enfermedades neoplásicas con tendencias crecientes tanto en la incidencia como en la mortalidad1. Se estima que 467 409 personas fallecieron de esta enfermedad en 20222. Si bien su incidencia a nivel mundial ajustada por edad es relativamente baja con 4,7 casos por 100 000 habitantes3, su letalidad es alta ya que sólo un 20% de los pacientes se presenta con enfermedad susceptible de tratamiento curativo, y la mayoría de los pacientes se presenta con enfermedad irresecable o metastásica. Chile no es la excepción a esta tendencia, diagnosticándose cada año alrededor de 1 900 nuevos casos, la mayoría de ellos en etapa avanzada4,5.
El tratamiento moderno del cáncer de páncreas es multimodal incluyendo combinaciones de cirugía, quimioterapia y radioterapia. No obstante, la piedra angular del tratamiento con intensión curativa continúa siendo la cirugía. Dado que se trata de una neoplasia agresiva, el tratamiento del cáncer de páncreas se beneficiaría de una estrategia de detección precoz que permitiera identificar más pacientes en etapa inicial susceptible a terapia con intención curativa. La relativamente baja incidencia del cáncer de páncreas y su curso inicial asintomático en la mayoría de los pacientes, hace poco factible realizar estrategias de tamizaje en la población general, ya que estas han mostrado un bajo rendimiento y alto costo. Por este motivo, los esfuerzos se han centrado en la identificación de grupos de riesgo clínico y genético en quienes la vigilancia activa tiene un mejor rendimiento6.
En este artículo describiremos las estrategias actualmente disponibles para la pesquisa precoz del cáncer de páncreas, incluyendo las áreas de desarrollo más prometedoras para el futuro próximo.
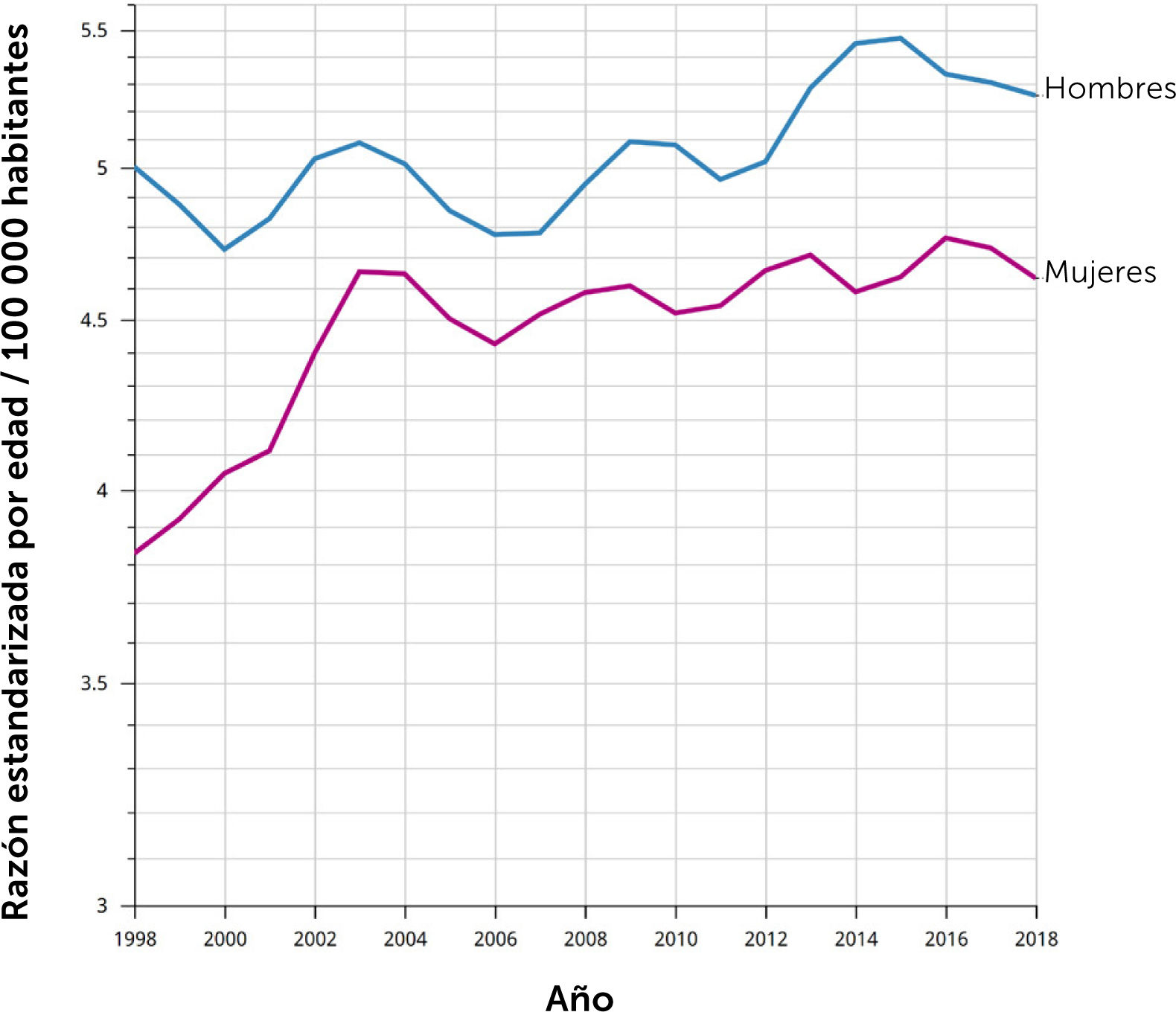
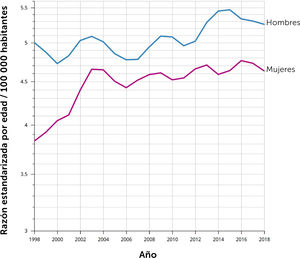
Epidemiología del cáncer de páncreasEl cáncer de páncreas es una enfermedad en aumento en el mundo, y se espera que en los próximos años se ubique en los primeros lugares de causa de muerte por cáncer1. El 90% de los tumores malignos del páncreas son adenocarcinomas de tipo ductal, siendo ésta la neoplasia pancreática de comportamiento más agresivo6. Estadísticas del National Cancer Institute muestran que en EE.UU. se esperan 64 000 nuevos casos y 50 500 defunciones por esta causa en 20237. Es un tumor relativamente poco frecuente ocupando el 10° lugar incidencia en EE.UU., sin embargo, dado que una fracción menor de los pacientes son susceptibles a tratamiento curativo su mortalidad alcanza el 3er lugar8. En Chile, la situación se asemeja progresivamente al mundo anglosajón, con una tasa de mortalidad de 5,1 x 100 000 habitantes en 2022, tasa que ha ido en progresivo aumento los últimos años (gráfico1). La mayoría de los casos se ubica en la cabeza del páncreas, sitio anatómicamente complejo ya que se ubica en el retroperitoneo, adyacente a los vasos mesentéricos superiores, arteria hepática, duodeno y la raíz del mesenterio. Este hecho determina invasión temprana de estructuras anatómicas críticas, volviéndose rápidamente irresecable4–11.
Mortalidad por cáncer de páncreas en Chile 1998-2018. Tasa ajustada por edad
Fuente: © International Agency for Research on Cancer, Cancer over time.
Tasa estandarizada por edad (mundial) por 100 000
Las tasas se muestran en una escala semilogarítmica.
Las líneas se suavizan mediante el algoritmo de regresión LOESS (ancho de banda: 0,25)
Cancer Over time | IARC - Data version: 1.0.
El páncreas es un órgano abdominal retroperitoneal, no palpable, radiolúcido, y rodeado por vísceras huecas como son el estómago, duodeno y colon. Por este motivo, los tumores pancreáticos no son pesquisables al examen físico de rutina o con exámenes radiológicos de uso masivo como es la radiología simple o la ecografía abdominal. No es hasta la presencia de una masa tumoral propiamente tal cuando es posible identificar signos clínicos secundarios como son la baja de peso relacionado a insuficiencia pancreática exocrina10, ictericia secundaria a compromiso de la vía biliar, vómitos secundarios a obstrucción duodenal o dolor dorsal secundario a la infiltración del plexo celíaco.
El tamizaje es el proceso de identificar individuos aparentemente sanos en una población, que tienen una enfermedad en etapa precoz y asintomática o un alto riesgo de desarrollarla11. Un test de cribado debe ser idealmente un examen sencillo de practicar, disponible en forma masiva y altamente sensible para no pasar por alto casos portadores de la enfermedad, aunque entregue algunos casos falsamente positivos que serán posteriormente descartados con un método más específico de confirmación11.
La incidencia a nivel poblacional del cáncer de páncreas es baja, lo que implica que, al aplicar una prueba de cribado la probabilidad pre-test de encontrar un caso disminuye y aumenta la probabilidad de falsos positivos (FP). Por este motivo, organizaciones como el US Prevention and Screening Task Force han determinado no realizar cribado de cáncer pancreático en población general, ya que podría generar más daño que beneficios por el número de exámenes de confirmación innecesarios, estrés psicológico en los pacientes FP, necesidad de realizar procedimientos invasivos, y el elevado gasto de recursos necesario para encontrar un caso subclínico12.
Por otra parte, el cáncer de páncreas carece de un biomarcador de alto rendimiento utilizable en población general asintomática (como lo es el antígeno prostático en cáncer de próstata) y los biomarcadores hasta ahora estudiados solo han sido aprobados para pacientes sintomáticos con sospecha clínica de cáncer pancreático13.
Por todos estos motivos, las estrategias actuales de detección precoz del cáncer de páncreas se han alejado del tamizaje en población general y se han focalizado en la vigilancia de grupos de riesgo, quienes tienen mayor frecuencia de esta enfermedad y en quienes los exámenes actualmente disponibles tienen mejor rendimiento y menor probabilidad de generar daño colateral.
Exámenes actualmente disponibles para el diagnóstico de cáncer de páncreasAnte la sospecha clínica de un cáncer de páncreas, los exámenes de primera línea incluyen exámenes de imagen como tomografía computada y resonancia magnética (RM), y el uso de biomarcadores en sangre como CA 19-9. En casos de duda diagnóstica se dispone del ultrasonido endoscópico (EUS), y biopsia por punción en casos seleccionados.
La tomografía computarizada de abdomen con contraste (TC) continúa siendo el principal examen para el estudio de un posible tumor pancreático. Es un examen ampliamente disponible, no es operador dependiente, su costo actual es relativamente bajo y tiene una excelente resolución espacial. El uso de equipos modernos multicorte y con protocolos específicos de adquisición para páncreas permite realizar el estudio en forma rápida, realizar reconstrucciones mutiplanares y estudiar dirigidamente la presencia de compromiso vascular. El rendimiento diagnóstico de la TC descrito en la literatura incluye sensibilidad de 82-94% y una especificidad de 81-91%14. Dentro de las desventajas de esta técnica están el uso de radiación ionizante, necesidad de contraste iodado, y la presencia de un 5 a 11% de tumores isodensos no visibles por este método15.
La RM es un examen de mayor complejidad, que entrega al radiólogo más herramientas de evaluación y mejor diferenciación entre distintos tipos de tejido gracias a la adquisición de diferentes secuencias. Esto le entrega a la RM mejor rendimiento frente a la TC para visualizar un tumor pancreático primario, en especial lesiones isodensas a la TC y menores de 2cm. La RM también ha demostrado mejor rendimiento en detección de lesiones secundarias a nivel hepático16, permitiendo además la reconstrucción de la vía biliar y el conducto pancreático (colangio-pancreatografía) mediante el uso de secuencias T2, útiles para el diagnóstico y planificación quirúrgica. Por este motivo, la RM es el examen de elección para pacientes alérgicos al contraste iodado o para complementar casos en que la TC no es claramente diagnóstica. Sus principales desventajas incluyen mayor costo, artefactos de movimiento debido a un tiempo de adquisición más prolongado, y la intolerancia de algunos pacientes debido a claustrofobia. La sensibilidad y especificidad reportados son 93% y 89% respectivamente17.
El CA19-9 es un biomarcador medible en sangre tradicionalmente utilizado en PDAC con fines diagnósticos y pronósticos. CA 19-9 es un antígeno del grupo sanguíneo Lewis presente en 95% de la población, que se eleva anormalmente en casos de PDAC, y también en otras neoplasias hepatobiliares como el colangiocarcinoma, hepatocarcinoma, cáncer colorrectal y algunas enfermedades benignas como pancreatitis y coledocolitiasis. La sensibilidad del CA 19-9 para PDAC es de 79-81% y especificidad es de 82-90% en pacientes sintomáticos18. Al existir diagnósticos diferenciales que también elevan este marcador, la elevación de CA 19-9 en forma aislada no permite hacer diagnóstico, y requiere confirmación mediante estudio de imágenes13.
El EUS es un examen que utiliza un ecógrafo en la punta de un endoscopio de visión lateral. Una vez ubicado en posición gástrica o duodenal permite estudiar el páncreas en su totalidad mediante la adquisición de imágenes de ultrasonido de alta resolución, sin el artefacto del gas intestinal presente en la ecografía de superficie. En condiciones óptimas, el EUS puede detectar lesiones pancreáticas desde 2-3mm19. Es el examen con mejor rendimiento diagnóstico, con una sensibilidad de 72-90% y especificidad de 72-90%20, rendimiento que mejora al agregar elastografía. Adicionalmente, permite obtener tejido para biopsia mediante aspiración con aguja fina y punción con aguja core en casos seleccionados.
La tomografía por emisión de positrones (PET/CT, por sus siglas en inglés) con fluorodesoxiglucosa F-18 (FDG) no es un examen de uso rutinario en el diagnóstico de PDAC. La presencia de FP en masas de origen inflamatorio o autoinmune y de falsos negativos por tumores no ávidos por FDG hace que su especificidad en evaluación del primario no sea superior a otros métodos de imagen. Su principal ventaja es como estudio de estadificación, ya que es un examen de cuerpo completo que tiene mejor sensibilidad para detección de linfonodos y metástasis a distancia, logrando cambiar la etapa en 26% de los casos21. Por esta razón, está indicado en casos con alto riesgo de enfermedad metastásica.
Grupos de riesgo para cáncer de páncreasPara mejorar el rendimiento de los exámenes diagnósticos y reducir las colateralidades negativas del tamizaje, la estrategia actual de diagnóstico precoz del PDAC es la vigilancia de grupos denominados de alto riesgo, es decir, pacientes que tienen un riesgo >5% de desarrollar un PDAC durante su vida. Se han identificado grupos particulares con un riesgo superior al de la población general como son el cáncer pancreático familiar, pacientes con mutaciones hereditarias específicas, y pacientes portadores de lesiones quísticas mucinosas del páncreas. En menor medida, condiciones como la pancreatitis crónica, y pacientes mayores de 50 años con DM-RD también son considerados como grupos de riesgo.
Cáncer pancreático familiar y hereditarioSe ha evidenciado que cerca del 80% de los casos de PDAC son esporádicos, es decir, no se ha identificado en ellos un componente genético hereditario sino que su patogénesis se debe a la acumulación de mutaciones somáticas específicas en ciertos genes driver22. De esta manera, solo una fracción de los casos de cáncer pancreático son atribuibles a un componente genético trasmisible, similar a lo descrito para la mayoría de los síndromes asociados a cáncer hereditario. Un estudio sistemático de la arquitectura genética del cáncer de páncreas publicado en el 2019 estimó que la heredabilidad era del 21,2%, confirmando estos hallazgos23.
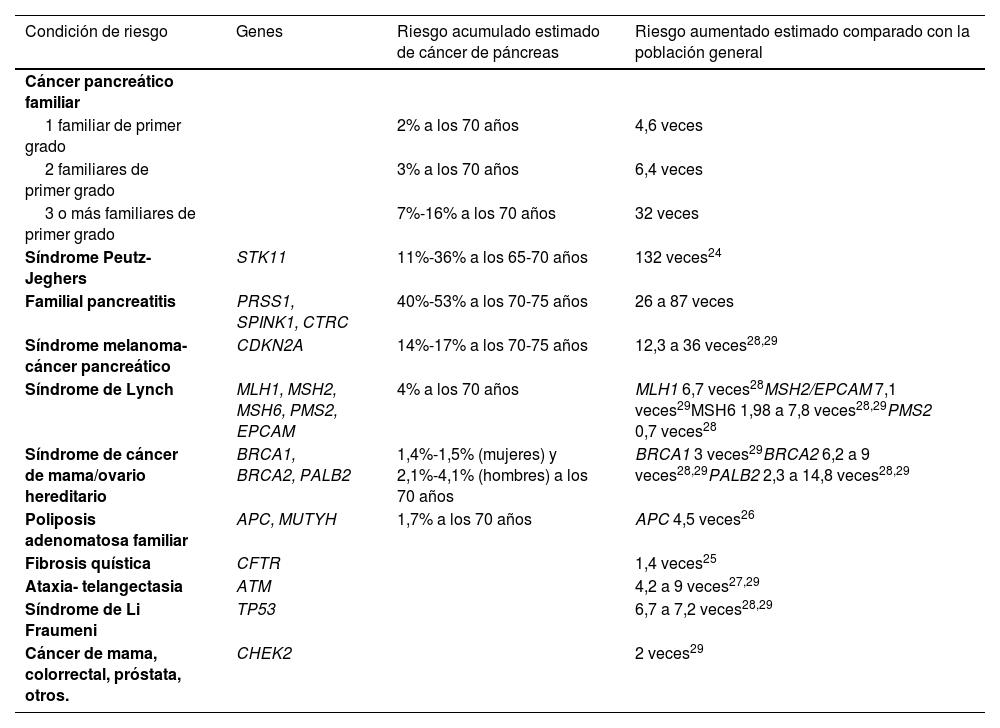
Los principales genes hereditarios asociados al desarrollo de cáncer de páncreas son parte de síndromes hereditarios que aumentan la susceptibilidad para distintos tipos de cáncer22. Es por ello que se ha definido a los síndromes de cáncer de páncreas hereditario, como síndromes de predisposición genética hereditaria relacionados con el cáncer de páncreas. La mayoría de los cánceres de páncreas hereditarios se asocian a genes supresores de tumor que presentan una herencia autosómica dominante, lo que presenta un 50% de probabilidad de que la variante patogénica (mutación) se transmita a la siguiente generación. Estas variantes patogénicas otorgan un riesgo mayor que la población general para el desarrollo de cáncer, y por ello son grupos de interés para cribado y vigilancia activa para PDAC. Estos síndromes y los principales genes involucrados, así como el riesgo asociado a PDAC, se detallan en la tabla 124–29.
Condiciones de riesgo, genes involucrados y riesgos de PDAC
| Condición de riesgo | Genes | Riesgo acumulado estimado de cáncer de páncreas | Riesgo aumentado estimado comparado con la población general |
|---|---|---|---|
| Cáncer pancreático familiar | |||
| 1 familiar de primer grado | 2% a los 70 años | 4,6 veces | |
| 2 familiares de primer grado | 3% a los 70 años | 6,4 veces | |
| 3 o más familiares de primer grado | 7%-16% a los 70 años | 32 veces | |
| Síndrome Peutz-Jeghers | STK11 | 11%-36% a los 65-70 años | 132 veces24 |
| Familial pancreatitis | PRSS1, SPINK1, CTRC | 40%-53% a los 70-75 años | 26 a 87 veces |
| Síndrome melanoma-cáncer pancreático | CDKN2A | 14%-17% a los 70-75 años | 12,3 a 36 veces28,29 |
| Síndrome de Lynch | MLH1, MSH2, MSH6, PMS2, EPCAM | 4% a los 70 años | MLH1 6,7 veces28MSH2/EPCAM 7,1 veces29MSH6 1,98 a 7,8 veces28,29PMS2 0,7 veces28 |
| Síndrome de cáncer de mama/ovario hereditario | BRCA1, BRCA2, PALB2 | 1,4%-1,5% (mujeres) y 2,1%-4,1% (hombres) a los 70 años | BRCA1 3 veces29BRCA2 6,2 a 9 veces28,29PALB2 2,3 a 14,8 veces28,29 |
| Poliposis adenomatosa familiar | APC, MUTYH | 1,7% a los 70 años | APC 4,5 veces26 |
| Fibrosis quística | CFTR | 1,4 veces25 | |
| Ataxia- telangectasia | ATM | 4,2 a 9 veces27,29 | |
| Síndrome de Li Fraumeni | TP53 | 6,7 a 7,2 veces28,29 | |
| Cáncer de mama, colorrectal, próstata, otros. | CHEK2 | 2 veces29 |
Modificado de NCCN Guidelines Version 1.2024. Pancreatic Adenocarcinoma. NCCN.org.
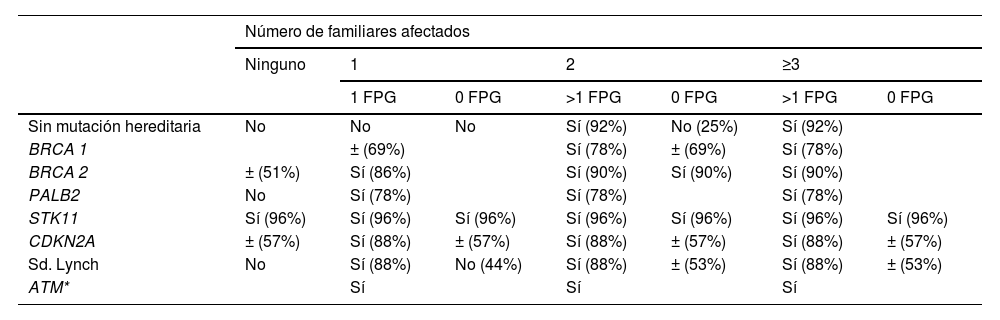
Traducido de Hart et al.54., y modificado* de Goggins et al.52.
Porcentajes corresponden a votación del panel de expertos del International Cancer of the Páncreas Screening Consortium para recomendar cribado: Sí (>75%), Indeterminado (±) (50-74%), No recomienda (< 50%).
El cáncer de pancreas familiar se define como el caso de cáncer pancreático que surge en un paciente con al menos dos familiares de primer grado afectados por la misma enfermedad, en ausencia de genes conocidos de susceptibilidad. El riesgo en estos pacientes aumenta mientras mayor sea el número de familiares afectados, siendo 6,4 veces mayor con dos familiares y 32 veces mayor con tres familiares. Por esto, también son grupos de interés para cribado para PDAC. Se piensa que otros factores como genes de baja penetrancia, procesos epigenéticos y exposición a similares factores ambientales podrían explicar la agregación familiar en esto casos.
Lesiones quísticas mucinosas del páncreasLos quistes mucinosos del páncreas incluyen los cistoadenomas mucinosos y las neoplasias mucinosas papilares intraductales (IPMN, por sus siglas en inglés), y representan desde el punto de vista oncológico un doble problema. Por un lado, son tumores quísticos con reconocido potencial de progresión hacia adenocarcinoma y se piensa originan hasta 2,4 a 14% de los PDAC30. Esto obliga a su evaluación, seguimiento y, en algunos casos, tratamiento quirúrgico. En segundo lugar, la presencia de lesiones quísticas tipo IPMN se ha correlacionado con mayor riesgo de desarrollo de adenocarcinoma ductal sincrónico, es decir, no proveniente de un quiste malignizado31,32. La mayor disponibilidad de estudios de imagen como TC y RM ha generado un aumento significativo en el diagnóstico incidental de estas lesiones. Un 20% de las RM son informadas con presencia de un quiste del páncreas, cifra que aumenta a un 40% en pacientes mayores de 80 años. La mitad de estas lesiones corresponderán a lesiones tipo IPMN33,34.
Los cistoadenomas mucinosos corresponden a lesiones quísticas uniloculares, más frecuentemente ubicadas en la cola del páncreas, en pacientes de sexo femenino, en promedio de 50 años de edad. Histológicamente, se caracterizan por la presencia de estroma ovárico alrededor de un quiste mucinoso unilocular. El potencial de malignización de estas lesiones se relaciona con su tamaño, situación que aumenta con diámetro sobre 4cm. Independiente del tamaño, y dado que es un quiste que aparece en pacientes jóvenes en ubicación distal, se recomienda su resección quirúrgica más que el seguimiento indefinido, lo que habitualmente implica una pancreatectomía distal35.
Las IPMN son un grupo de neoplasias quísticas mucinosas que se subdividen en IPMN de ducto principal (MD-IPMN), IPMN de rama secundaria (BD-IPMN), y las lesiones mixtas (MT-IPMN)36–38. Se reconoce en todas estas lesiones la potencialidad de una progresión desde un epitelio ductal normal, pasando por la displasia de bajo (LGD) y alto grado (HGD), hasta llegar al carcinoma invasor (PDAC)38. Los MD-IPMN son lesiones que se originan en el ducto pancreático principal, generando una dilatación de este (>5mm) secundario a la producción de mucina. Corresponden a un 15-20% de los IPMN y son los que tienen el mayor potencial de malignización, alcanzando al 20 a 80% de los casos resecados36–38. Los BD-IPMN son los IPMN más frecuentes, correspondiendo al 40-60%. Se presentan como lesiones uniloculares o multiquísticas agregadas “en racimo de uva”, adyacentes y comunicadas a un ducto pancreático principal de calibre normal. Son frecuentemente multifocales y tienen un potencial de malignización de 1 a 36% en los casos seleccionados para resección37. Los MT-IPMN son lesiones que combinan ambos tipos de quistes, presentando malignidad en 20 a 60% de los casos resecados37,38.
Los IPMN son neoplasias más frecuentes en pacientes de tercera edad, siendo la edad en si un factor relacionado a la presencia de PDAC34. Dado que para su tratamiento los IPMN catalogados de alto riesgo requerirán una resección pancreática, la indicación de cirugía en cada caso particular debe considerar las condiciones del paciente, la morbi-mortalidad de la resección propuesta y la probabilidad de encontrar carcinoma invasor39. Finalmente, aquellos pacientes que no son, o que durante el seguimiento dejan de ser candidatos a cirugía, no deberían ser sometidos a seguimiento estrecho o exámenes invasivos39,40. Esto se basa en que aquellos pacientes que, por edad, comorbilidades y/o deterioro de condición general no son candidatos a cirugía, no podrán ser operados ante una eventual progresión a HGD o PDAC y por ende no modificarán su pronóstico global.
Dada la alta frecuencia de las lesiones quísticas tipo IPMN, en particular BD-IPMN de tamaño pequeño y de diagnóstico incidental, el desafío actual es identificar que lesiones tienen alto riesgo de malignización para su resección oportuna antes de su progresión a carcinoma invasor y separarlas de las lesiones de comportamiento benigno41. La ausencia de síntomas en la mayoría de los casos implica una evaluación basada en una combinación de elementos clínicos (edad, ictericia, pancreatitis), radiológicos (tamaño, nódulos murales, septos hipercaptantes, atrofia distal), y en casos seleccionados, análisis del fluido del quiste obtenido por punción bajo EUS36,40.
A partir de la evidencia publicada, múltiples sociedades científicas a nivel mundial han generado consensos de manejo con criterios clínicos-radiológicos identificados como de alto riesgo para malignización36,40–43. Si bien no existe homogeneidad en estas guías, la mayoría reconoce la presencia de nódulo mural y septos engrosados como las características que más correlacionan con la presencia de neoplasia invasora. El tamaño del quiste también se ha relacionado a la probablidad de malignización, sin embargo se considera un predictor imperfecto cuando se usa en forma aislada. De acuerdo a la presencia de factores preocupantes, las diferentes guías proponen esquemas de seguimiento imagenológico anual, semestral o trimestral, proponiendo el uso de EUS y análisis de fluido obtenido por punción en los casos más sospechosos.
Diabetes de reciente diagnóstico (DM-RD) en mayores de 50 añosLa diabetes mellitus (DM) y PDAC son enfermedades conocidamente relacionadas, y se considera que los diabéticos de larga data tienen un aumento de 1,5 a 2 veces en el riesgo de PDAC. Sin embargo, al momento del diagnóstico aproximadamente un 50% de los pacientes portadores de PDAC tienen glicemia en ayunas alterada, cifra que aumenta sobre el 60% si se utiliza test de tolerancia a la glucosa19. Un estudio poblacional en Minnesota, EE.UU., mostró que solo un 9% de los pacientes diagnosticados con PDAC tenían un metabolismo de la glicemia normal44. Estudios de seguimiento muestran que la alteración de la glicemia precede en más de 30 meses el diagnóstico de PDAC, superando el umbral de diabetes en los 6 a 12 meses previo al diagnóstico44. Por otro lado, la alteración de la glicemia ocurre antes de la existencia de un tumor detectable, y mejora en muchos pacientes posterior a la resección, por lo que la alteración metabólica en estos pacientes no se explica por un fenómeno meramente mecánico de obstrucción-atrofia pancreática44. Modelos experimentales han mostrado que factores solubles derivados de las células tumorales inducen disfunción de las células beta, como un mecanismo para-neoplásico. De esta manera, sabemos que la diabetes mellitus ocurre en la mayoría de los pacientes con PDAC, es de reciente aparición (dentro de 36 meses previo al diagnóstico), ocurre previo a la presencia de un tumor visible o de la atrofia pancreática, y por ende podría considerarse como un biomarcador para PDAC19.
La DM-RD en mayores de 50 años es entonces un grupo de interés para vigilancia de PDAC, y corresponde al único grupo de riesgo conocido para PDAC esporádico45. Un estudio poblacional mostró que la incidencia de PDAC en este grupo es 0,85%, 6 a 8 veces mayor que la población general46. Esta incidencia, si bien significativa, implica que la mayoría de las DM-RD no son secundarias a un PDAC, por lo que no lo que no es suficientemente específico como para justificar una estrategia de vigilancia. Debido a esto, se ha incluido la DM-RD dentro de algoritmos de predicción clínico como el Enriching New-onset Diabetes for Pancreatic Cancer (ENDPAC) que incluyen también otras variables clínicas de relevancia para clasificar a los pacientes como de riesgo bajo, intermedio o alto de desarrollar PDAC. En la cohorte original, los pacientes de alto riesgo (puntaje >2) tenían una prevalencia de PDAC de 3,6% y se propuso realizar vigilancia dirigida sobre este grupo con estudios de imagen47. Si bien es interesante, esta estrategia implicaría estudiar aproximadamente un 25% de los DM-RD, lo cual implica un gran número de exámenes y elevado costo. Además, estudios posteriores de validación han encontrado un menor rendimiento de esta herramienta que la cohorte original, lo que ha limitado su uso45. Nuevas estrategias de vigilancia con biomarcadores en sangre podrían mejorar la costo-efectividad de esta aproximación, sin embargo, hasta la fecha no hay biomarcadores autorizados para el uso masivo en cribado.
PancreatitisLa presencia de inflamación crónica en el páncreas aumenta 16 veces el riesgo de desarrollar cáncer de páncreas, lo que ocurre en promedio 1 o 2 décadas posterior al diagnóstico de pancreatitis crónica. Sin embargo, menos de un 5% de los portadores de pancreatitis crónica desarrollará un cáncer de páncreas lo cual es considerado bajo48. Por otro lado, un 5% de los tumores pancreáticos se presentan como pancreatitis aguda, siendo el riesgo de diagnóstico de cáncer de páncreas posterior a un episodio de pancreatitis aguda de un 1% durante los primeros 2 años49.
Por este motivo, si bien pacientes con antecedente de pancreatitis aguda o crónica presentan mayor frecuencia de cáncer de páncreas que la población general, se debe asociar a otros factores de riesgo para incluirlos como un grupo de alto riesgo para cribado activo.
Estrategias de detección precoz: a quienes, con que técnica y con qué frecuenciaConsiderando los malos resultados del cribado poblacional para PDAC con los métodos de estudio actualmente disponibles, los esfuerzos se centran en la detección de lesiones precursoras y PDAC en etapa precoz mediante vigilancia de individuos de alto riesgo50. Estudios de vigilancia de cohortes de alto riesgo han mostrado tasas interesantes de detección de enfermedad, mejores tasas de resección y beneficios en pronóstico cuando los pacientes son diagnosticados en etapa asintomática y contexto de seguimiento51.
En los pacientes con cáncer de páncreas familiar, el Consorcio Internacional de Cribado para PDAC (CAPS, por sus siglas en inglés) recomienda tamizaje en sujetos con al menos 2 familiares afectados por PDAC, siendo al menos uno de ellos familiar de primer grado52. Familias con edad de diagnóstico bajo los 50 años tienen también riesgo adicional53. Pacientes portadores de síndromes genéticos pueden tener riesgo muy elevado de desarrollo de PDAC y a edades de presentación menores a los 50 años como en el caso del Sd. de Peutz-Jeghers o pancreatitis hereditaria, por lo que se recomienda cribado independiente de su historia familiar52. Otras mutaciones pueden tener penetrancia variable o incompleta, y por ello la indicación de cribado debe también considerar la presencia de historia familiar de PDAC50. La recomendación de cribado de acuerdo a historia familiar y perfil genético se resume en la tabla 254.
Recomendaciones de cribado de acuerdo a historia familiar y perfil genético
| Número de familiares afectados | |||||||
|---|---|---|---|---|---|---|---|
| Ninguno | 1 | 2 | ≥3 | ||||
| 1 FPG | 0 FPG | >1 FPG | 0 FPG | >1 FPG | 0 FPG | ||
| Sin mutación hereditaria | No | No | No | Sí (92%) | No (25%) | Sí (92%) | |
| BRCA 1 | ± (69%) | Sí (78%) | ± (69%) | Sí (78%) | |||
| BRCA 2 | ± (51%) | Sí (86%) | Sí (90%) | Sí (90%) | Sí (90%) | ||
| PALB2 | No | Sí (78%) | Sí (78%) | Sí (78%) | |||
| STK11 | Sí (96%) | Sí (96%) | Sí (96%) | Sí (96%) | Sí (96%) | Sí (96%) | Sí (96%) |
| CDKN2A | ± (57%) | Sí (88%) | ± (57%) | Sí (88%) | ± (57%) | Sí (88%) | ± (57%) |
| Sd. Lynch | No | Sí (88%) | No (44%) | Sí (88%) | ± (53%) | Sí (88%) | ± (53%) |
| ATM* | Sí | Sí | Sí | ||||
Respecto a los pacientes con lesiones quísticas mucinosas del páncreas las diferentes guías clínicas de manejo recomiendan vigilancia de este grupo según el tipo de lesión (ducto principal, secundario, mixto, cistoadenoma mucinoso), tamaño de la lesión mayor y presencia de características radiológicas preocupantes. Ante la sospecha de displasia de alto grado o malignización se indica resección quirúrgica de la lesión con márgenes negativos.
Pacientes de alto riesgo familiar o genético que desarrollan DM-RD debiesen ser estudiados e ingresados a un protocolo de cribado. Considerando el bajo rendimiento y los posibles efectos negativos, no se recomienda vigilancia de rutina en pacientes DM-RD o pacientes con pancreatitis crónica cuando estas condiciones se presentan en forma aislada. Existen en este momento protocolos de investigación en curso que incluyen pacientes con DM-RD >50 años en conjunto con otros factores de riesgo conocido como edad, tabaquismo, baja de peso, deterioro metabólico acelerado, raza o historia de pancreatitis, para identificar individuos de alto riesgo que podrían beneficiarse de vigilancia activa.
Respecto a la edad para iniciar el cribado, la edad promedio de presentación del PDAC es 68 años, cifra que disminuye a 55 años en pacientes con cáncer familiar52. En esta línea, las guías clínicas de la Sociedad Americana de Gastroenterología han sugerido iniciar la vigilancia en pacientes sobre 50 años o 10 años antes de la edad de presentación en pacientes con cáncer familiar. Ciertos síndromes clínicos de alto riesgo requieren inicio de vigilancia a edades más precoces como son los portadores de mutación de los genes PRSS1 o CKDN2A (40 años) o Peutz-Jeghers (35 años)50.
¿Qué técnica de diagnóstico utilizar?Las modalidades de diagnóstico utilizadas en protocolos de cribado en la actualidad son la resonancia magnética (RM) y el EUS. Son exámenes de alta sensibilidad que permiten diagnóstico de lesiones solidas o quísticas en todo el páncreas, y en casos seleccionados permiten obtener tejido para biopsia mediante punción bajo EUS. Una revisión sistemática del US Preventive Services Task Force analizó 13 estudios, incluyendo a 1 317 pacientes predominantemente de alto riesgo para PDAC por sus antecedentes familiares o clínicos. El rendimiento del cribado usando EUS fue 0 a 68,2 casos de PDAC por 1 000 personas, y el de la RM fue 0 a 75 casos por 1 000 personas, encontrando 18 casos en 1 156 pacientes evaluados. Además, se reportaron 38 pacientes con lesiones premalignas como son neoplasia pancreática intraepitelial (PAN-IN) o lesiones tipo IPMN12.
¿Con que frecuencia controlar?No existe a la fecha evidencia que indique la frecuencia ideal de control para cribado de PDAC, pero, considerando que la ventana terapéutica del cáncer de páncreas es ajustado, la mayoría de los protocolos en individuos de alto riesgo utilizan intervalos entre exámenes entre 6 a 12 meses50. Cuando un examen muestra hallazgos preocupantes, frecuentemente los protocolos recomiendan seguimiento estrecho (3 a 6 meses). En pacientes con lesiones quísticas mucinosas del páncreas el esquema de seguimiento recomendado por diferentes guías clínicas es variable, sin embargo, la mayoría recomienda control permanente, cada 1-2 años en lesiones <1cm, y aumentando la frecuencia a seguimiento estrecho en lesiones de tamaño >3cm (cada 3 a 6 meses)36. El hallazgo de características preocupantes también implica seguimiento estrecho, siendo recomendado el uso de EUS con obtención de tejido y fluido del quiste en los casos correspondientes.
Biomarcadores, la apuesta al futuro del cribado para cáncerLa Organización Mundial de la Salud (OMS) define biomarcador como la sustancia, estructura o proceso que puede medirse en el organismo e influenciar o predecir la incidencia o resultado de una enfermedad55. El desarrollo de nuevos biomarcadores moleculares o genéticos, aislados o en combinación, son un área de fuerte investigación que busca mejorar nuestras capacidades diagnosticas para el PDAC y mejorar la actual ausencia de estrategias de cribado efectivo. El objetivo debe ser el desarrollo de exámenes utilizables en práctica clínica que permitan la detección de PDAC en etapa subclínica, que mejoren la exactitud diagnóstica frente a lesiones pancreáticas de características inciertas y entreguen marcadores serológicos o en biopsia que permitan personalizar la terapia sistémica de estos pacientes.
En PDAC, el CA19-9 es un biomarcador medible en sangre tradicionalmente utilizado con fines diagnósticos y pronósticos. Se ha ensayado extender su uso como método de cribado en población general con resultados desalentadores. Un estudio realizado en Corea midió CA 19-9 en 70 000 sujetos asintomáticos, encontrando 1 063 exámenes elevados y solo 4 pacientes con PDAC. Si bien la sensibilidad en este estudio fue de 100%, el valor predictivo positivo fue inferior al 1%56. Otras experiencias han mostrado resultados similares, por lo que no se considera el uso de CA 19-9 en forma aislada como un buen examen de cribado.
Nuevas técnicas capaces de detectar material genético circulante en sangre periférica han permitido identificar cambios epigenéticos secundarios al desarrollo tumoral. Por ejemplo, alteraciones en el nivel de metilación de áreas promotoras del DNA inducen cambios en la expresión de ciertos genes sin modificar la secuencia de DNA en si11. La comparación del perfil de metilación de una batería de genes de interés en pacientes portadores de PDAC vs controles sanos ha permitido identificar patrones específicos y con ello desarrollar test con valor diagnóstico y pronóstico. Otra área de interés es el estudio de la expresión de micro-RNA, encargados de regular la expresión génica a nivel post transcripcional. Mediante técnicas de RT-PCR se ha logrado identificar cambios en el perfil de expresión de micro-RNA que permite diferenciar la enfermedad pancreática benigna y maligna13. Finalmente, el análisis de nucleosomas libres (complejos DNA-histonas) en plasma se ha ensayado como test diagnóstico, ya que altos niveles de nucleosomas libres se han detectado en diferentes enfermedades neoplásicas incluyendo PDAC13.
Otro enfoque es la combinación de baterías de biomarcadores (multimarker panels), que combinan la medición de marcadores conocidos como CA 19-9 con otras proteínas, enzimas o moléculas de señalización con el fin de mejorar sensibilidad y especificidad11. Se han identificado múltiples biomarcadores de interés en cáncer, y combinaciones de moléculas como TIMP-1 u osteopontina han mostrado mejor rendimiento diagnóstico para PDAC cuando se combinan con CA 19-9, permitiendo diferenciar neoplasia de enfermedades inflamatorias del páncreas o individuos sanos57. Un enfoque interesante es estudiar la capacidad de estas baterías de biomarcadores en pacientes asintomáticos para evaluar su utilidad como método de cribado. Un estudio aplicó una batería de 67 biomarcadores en muestras de suero de una cohorte multicéntrica de 152 000 pacientes en cribado para cáncer entre 1993 y 2001. Se identificó los pacientes que desarrollaron PDAC en el seguimiento y se identificó dentro de la cohorte controles con similares características. La medición de marcadores se realizó en muestras de suero hasta 36 meses previo al diagnóstico, y mostró que la combinación CA 19-9, citoqueratina 21 y antígeno carcino-embrionario tenía una sensibilidad de 30% y especificidad de 95%, logrando mejor rendimiento para la detección de PDAC precoz que el uso de CA 19-9 en forma aislada57.
ConclusionesEl cáncer de páncreas es una neoplasia relevante por su creciente incidencia y mortalidad. Su baja frecuencia en la población general a nivel mundial y alta tasa de casos esporádicos hace que, en la actualidad, no sea eficaz ni costo-efectivo realizar tamizaje en población general. Experiencias en el seguimiento de poblaciones de alto riesgo genético han mostrado resultados positivos en términos de detección precoz y mejores tasas de tratamiento efectivo. El tamizaje de grupos de alto riesgo clínico, es decir, pacientes que acumulan factores de riesgo para PDAC está en desarrollo, pero aún requiere examinar un alto número de individuos sanos para encontrar un caso nuevo. El desarrollo de nuevos biomarcadores es una de las áreas de fuerte investigación para mejorar el diagnóstico y tratamiento de esta compleja enfermedad.
Conflicto de InterésLos autores no declaran conflicto de interés.