La insuficiencia intestinal se define como la pérdida de la autonomía nutricional debido a disfunción intestinal. Su única opción de tratamiento adecuado es la Nutrición Parenteral Total Central. El trasplante de intestino se presenta como una alternativa de tratamiento.
Los resultados iniciales del trasplante de intestino evidenciaron una alta incidencia de rechazo, infección y complicaciones técnicas que frenaron el desarrollo de esta técnica, sin embargo con la disminución de los problemas técnicos por la experiencia acumulada y la mejoría de los tratamientos inmunosupresores los resultados mejoraron en forma importante. Si bien en Chile la experiencia es limitada la indicación para su realización existe y aumenta debido al interés creciente por los buenos resultados demostrados a nivel mundial.
En este breve artículo se revisan las indicaciones y contraindicaciones del procedimiento, el estudio del receptor y del donante, la técnica de procuramiento y se analizan los resultados actuales y las perspectivas futuras.
Intestinal insufficiency is defined as the loss of nutricional autonomy as a result of intestinal malfunction. The only adequate treatment option is Total Central Parenteral Nutrition. Intestinal transplantation is proposed as a treatment alternative.
Initial intestinal transplantation results showed a high incidence of rejection, infection and technical complications that stunted the development of this technique. Results have however greatly improved with the enhancement of immunosuppressive therapy and increased experience which has led to a subsequent decrease in technical problems.
Even though Chile has limited experience, the demand for intestinal transplantation exists and increases due to a rising interest brought about by the good results presented worldwide.
This short article addresses the indications and contraindications of this procedure, receptor and donor studies, the procurement technique and also analyzes current results and future prospects.
La insuficiencia intestinal se define como la pérdida de la autonomía nutricional debido a disfunción intestinal. Esta puede deberse a un problema netamente anatómico, como es el caso de los pacientes con intestino corto por cualquier causa, o a un problema funcional como malabsorción o dismotilidad (1, 2). En estos pacientes la única opción de tratamiento adecuado es la Nutrición Parenteral Total Central (NPTC) que además de presentar un alto costo, trae consigo un alto índice de complicaciones potencialmente fatales de tipo vasculares, infecciosas y metabólicas que obligan a buscar otra alternativa de manejo (3–5).
A pesar de que el trasplante de intestino fue uno de los primeros realizados a mediados del siglo pasado, inicialmente en forma experimental por Lillihei en 1959 en un modelo canino y luego en humanos, por Deterling en 1964 y luego Lillihei en 1967, los resultados evidenciaron una alta incidencia de rechazo, infección y complicaciones técnicas, frenaron el desarrollo de esta técnica (2, 6, 7).
Con la mejoría de los tratamientos inmunosupresores primero con el uso de la Ciclosporina y posteriormente de los regímenes basados en FK506, demostrado en el trasplante de otros órganos, se retoma el interés en el trasplante de intestino. Es así como en 1988 Deltz en Alemania realiza el primer trasplante considerado exitoso. El receptor se mantiene libre de NPTC durante 4 años hasta que presenta rechazo crónico del injerto. Posteriormente, impulsados por este exitoso resultado nuevos grupos en París, Canadá y Londres establecen programas de trasplante de intestino, para luego extenderse a todo el mundo (6).
Debido a la experiencia acumulada en este tiempo, la disminución de los problemas técnicos iniciales y la inmunosupresión adecuada, en la década pasada los resultados mejoraron en forma importante, realizándose sólo en EE.UU. más de 1800 trasplantes de intestino, con sobrevida que alcanza al 90% en centros experimentados, haciendo este procedimiento ya no experimental sino una realidad que puede ser ofrecida con seguridad a los pacientes con fallo intestinal (2, 8–11).
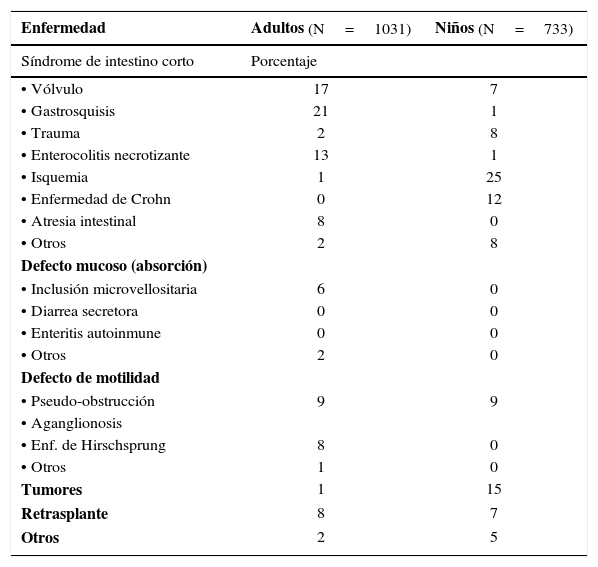
Si bien en Chile la experiencia es limitada, a la fecha se han realizado 2 trasplantes de este tipo, la indicación para su realización existe y aumenta debido al interés creciente por los buenos resultados demostrados a nivel mundial y a la presencia de muchos pacientes tanto pediátricos como adultos con insuficiencia intestinal en NPTC con múltiples complicaciones, alto costo y mala calidad de vida. Las enfermedades que se asocian a la insuficiencia intestinal pueden ser divididas en causas quirúrgicas (anatómicas) y no quirúrgicas (funcionales) (1, 2, 12, 13). Los primeros presentan pérdida de intestino por resecciones o estrecheces y fístulas, como en la enfermedad de Crohn, todos ellos presentan un síndrome de intestino corto. Las causas no quirúrgicas tienen su origen en trastornos de motilidad o absorción en los cuales la longitud del intestino puede ser normal (Tabla 1).
Indicaciones de trasplante
| Enfermedad | Adultos (N=1031) | Niños (N=733) |
|---|---|---|
| Síndrome de intestino corto | Porcentaje | |
| • Vólvulo | 17 | 7 |
| • Gastrosquisis | 21 | 1 |
| • Trauma | 2 | 8 |
| • Enterocolitis necrotizante | 13 | 1 |
| • Isquemia | 1 | 25 |
| • Enfermedad de Crohn | 0 | 12 |
| • Atresia intestinal | 8 | 0 |
| • Otros | 2 | 8 |
| Defecto mucoso (absorción) | ||
| • Inclusión microvellositaria | 6 | 0 |
| • Diarrea secretora | 0 | 0 |
| • Enteritis autoinmune | 0 | 0 |
| • Otros | 2 | 0 |
| Defecto de motilidad | ||
| • Pseudo-obstrucción | 9 | 9 |
| • Aganglionosis | ||
| • Enf. de Hirschsprung | 8 | 0 |
| • Otros | 1 | 0 |
| Tumores | 1 | 15 |
| Retrasplante | 8 | 7 |
| Otros | 2 | 5 |
Las contraindicaciones para realizar este procedimiento se relacionan con la existencia de patología médica asociada de alto riesgo quirúrgico o aquellas en la cual a pesar del éxito del procedimiento la expectativa de vida o calidad de esta no mejore. Del mismo modo la existencia de una infección activa, Neoplasia, SIDA, o potencial falta de cuidados postoperatorios contraindican el trasplante (2, 6).
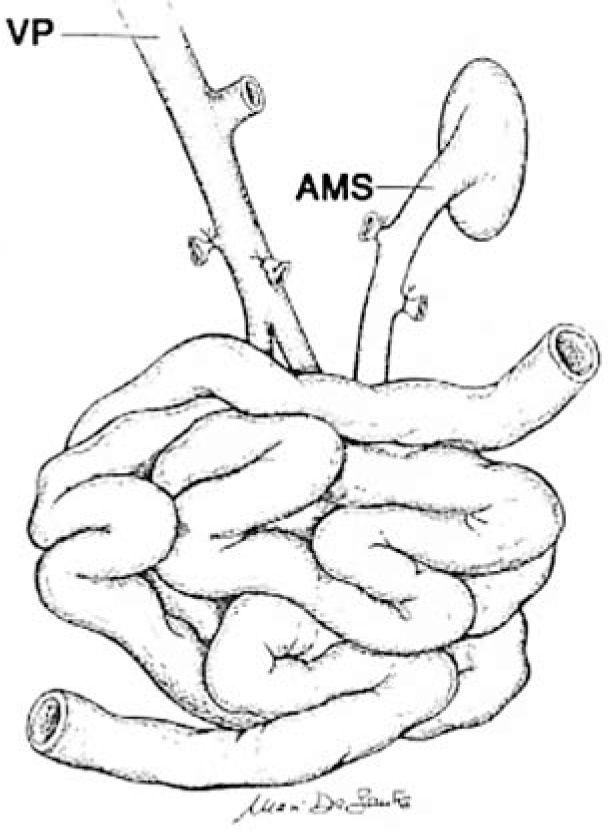
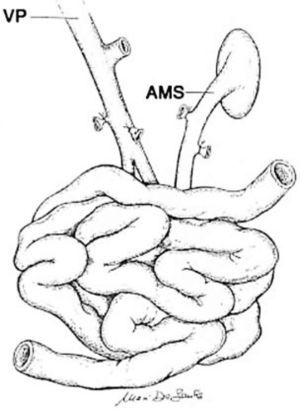
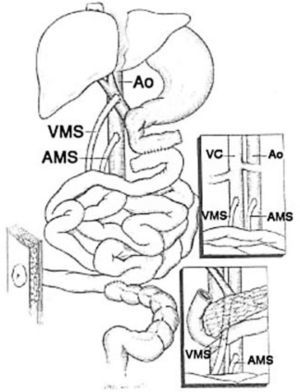
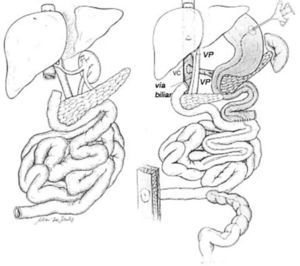
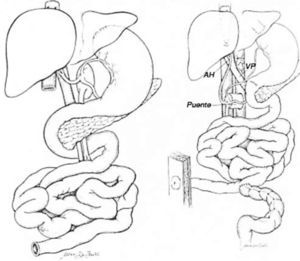
El trasplante de intestino comprende en todos los casos intestino delgado (yeyuno-íleon). Este segmento puede ser trasplantado en forma solitaria o en algunas ocasiones otros órganos deben ser injertados en forma simultánea a un mismo paciente. Cuando se presenta un daño hepático avanzado este órgano puede acompañar al intestino trasplantado. Esto puede realizarse en conjunto o en forma separada. El páncreas y el duodeno son ocasionalmente incluidos para facilitar el procedimiento y obviar la reconstrucción biliar, particularmente en pacientes pediátricos pequeños. Algunos pacientes pueden requerir el reemplazo de todo el tracto gastrointestinal debido a trastornos intestinales coexistentes o enfermedad de otros órganos (2, 6, 14, 15). Por ejemplo pacientes con resecciones gástricas o colónicas previas, pancreatitis crónica, falla renal, etc. En estos casos se denominan trasplante multivisceral (Figura 1–4).
A continuación se describe las evaluaciones y estudios necesarios a realizar a los potenciales receptores de intestino y los criterios de selección a los potenciales donantes vivos y cadavéricos, y la técnica habitual de procuramiento utilizada.
Estudio del receptorTodos los pacientes con diagnóstico de insuficiencia intestinal y potenciales candidatos a trasplante deben ser derivados a un equipo multidisciplinara de trasplante acreditados y reconocidos para tales efectos, que incluya a cirujanos, gastroenterólogos, nutriólogos, anestesistas, psiquiatras, enfermeras y asistentes sociales. Se debe seguir un exhaustivo proceso de evaluación y selección, considerando la condición clínica del paciente, los exámenes pertinentes, su condición social y psiquiátrica. Evaluaciones por otras especialidades deben considerarse caso a caso, dependiendo de las necesidades propias del paciente (1, 2, 14, 16, 17).
La entrevista inicial debe incluir una detallada anamnesis, examen físico exhaustivo, con un diagnóstico general del estado de enfermedad. Se debe incluir además educación de la patología que deriva la necesidad de trasplante, los beneficios y potenciales riesgos del procedimiento, la necesidad de tratamiento y control posterior al trasplante. Esta educación debe reforzarse en todos los aspectos necesarios hasta el final del proceso para lograr un consentimiento informado adecuado.
Los estudios imprescindibles comprenden:
Estudio de laboratorio
- •
Hemograma
- •
- •
Pruebas de coagulación
- •
Grupo ABO y Rh
- •
Tipificación HLA
- •
Cross match para linfocitos B y T con donante
- •
Función Renal
- •
Pruebas hepáticas
- •
Evaluación nutricional
- •
Serología Epstein-Barr y Citomegalovirus
Evaluaciones adicionales
- •
Radiografía de tórax
- •
ECG
- •
Estudio radiológico del tracto gastrointestinal
- •
Endoscopía digestiva alta y baja
- •
Estudio vascular del abdomen con Angio TAC
- •
Otros estudios de acuerdo a las necesidades de cada paciente
La incorporación en la lista de espera debe realizarse por el equipo de trasplantes una vez finalizado el proceso de evaluación. Posteriormente se debe realizar la coordinación necesaria con su centro de origen para realizar un manejo adecuado para que el paciente esté a tiempo y condiciones de ser operado cuando aparezca un donante según la prioridad que le corresponda.
Los pacientes deben ser evaluados al menos cada tres meses para determinar cualquier cambio en su estado, deterioro de función hepática o renal, o desarrollo de problemas médicos adicionales que sea necesario tratar o que contraindiquen el trasplante. Debe existir una monitorización cercana de la NPTC para minimizar el riesgo de desarrollo de esteatosis hepática o fibrosis, para estos efectos debe mantenerse un adecuado balance de carbohidratos y lípidos en las soluciones administradas. Se deben chequear frecuentemente los accesos vasculares de tal forma de pesquisar y tratar las complicaciones asociadas, tales como infección y trombosis. El balance hidroelectrolítico es fundamental mantenerlo en rangos adecuados, lo que presenta dificultades principalmente en aquellos pacientes que se mantienen con ingesta oral de comidas o líquidos debido a la frecuente pérdida de estos elementos en un paciente con escasa o nula capacidad de absorción intestinal y pérdidas excesivas por el intestino residual, en fin este tipo de enfermos requiere una monitorización permanente debido a las múltiples posibilidades de complicaciones.
Seleccion de donantesDonantes cadavéricosTodos los donantes cadavéricos son potenciales donantes de intestino (6, 14, 18) (TABLA 2). Los donantes cadavéricos deben ser ABO compatibles con el receptor. En la mayoría de los casos, la cavidad peritoneal del receptor se encuentra disminuida por resecciones intestinales previas por lo que se requiere un match de un 50 a 75% del peso del donante, ahora bien, esto es relativo pues se pueden reducir parcialmente el tamaño de intestino a trasplantar.
Se deben descartar aquellos donantes con antecedentes de enfermedades gastrointestinales significativas. Como en todos los órganos donados no debe existir inestabilidad hemodinámica significativa, sepsis, historia de malignidad o infecciones crónicas, hipoxia o acidosis severa y la serología para HIV, Hepatitis B y C deben ser negativas. Un cross match debe ser realizado utilizando técnica de citotoxicidad estándar o citometría de flujo y este debe ser negativo para linfocitos B y T. Si bien es cierto que hay grupos de vasta experiencia, no solicitan crossmatch previo al trasplante, creemos que esta información es vital para minimizar el riesgo de rechazo hiper agudo, principalmente en pacientes hipersensibilizados.
Otra consideración importante es el estado serológico CMV y EBV del donante y receptor. El trasplante de un donante seropositivo en un receptor negativo a CMV puede traer consecuencias desastrosas. Además del riesgo de la infección sistémica por CMV, se puede producir una enteritis por CMV que puede llevar a la pérdida del injerto. Del mismo modo, por el alto nivel de inmunosupresión necesario en este tipo de trasplantes, una nueva infección por EBV presenta un alto riesgo de desarrollar una enfermedad linfoproliferativa post trasplante.
Si el donante es considerado adecuado, se debe instalar una SNG para administrar antibióticos por esa vía, con la finalidad de disminuir la carga bacteriana del injerto. Habitualmente se han utilizado Anfotericina B, Neomicina y Eritromicina previo al inicio del procuramiento multiorgánico. Una preparación formal del intestino por lo general no esta indicado. Algunos centros consideran útil la administración de Timoglobulina en el donante para disminuir el número de linfocitos en el injerto previo al trasplante. La real utilidad de esta conducta no ha sido demostrada.
Como de mencionó anteriormente, se debe minimizar el tiempo de isquemia fría a menos de 6 horas, por lo que debe existir una coordinación adecuada entre procuramiento y trasplante para no exceder este tiempo crítico.
Donantes vivosSi se considera un potencial donante vivo, éste debe ser evaluado por un equipo multidisciplinario de forma similar a la evaluación descrita previamente en relación al estudio del receptor. Es necesario realizar una extensa y clara educación sobre el procedimiento y sus potenciales complicaciones. El trasplante debe estar enmarcado dentro de un contexto ético, donde el único incentivo debe ser la motivación altruista y solidaria del donante hacia el receptor, descartándose cualquier beneficio pecuniario de por medio (6, 14, 19).
Si existe más de un potencial donante, debe elegirse el que presente la mejor compatibilidad en el HLA. Obviamente al igual que en el trasplante con donante cadavérico, el donante y el receptor deben tener el mismo grupo ABO, aunque en algunas circunstancias combinaciones ABO compatibles pueden ser consideradas.
Los donantes deben estar libres de cualquier patología gastrointestinal significativa, ser sanos, descartándose donantes con antecedentes de Diabetes, infecciones crónicas o malignidad. Cualquier problema psiquiátrico significativo, así como el abuso de drogas y Alcohol contraindica la donación. Debe estudiarse la infección por HIV y virus de Hepatitis B y C, pues en caso de positividad la donación debe descartarse. La serología para CMV y EBV debe considerarse y descartarse la donación de aquellos donantes positivos a receptores negativos.
El estudio de laboratorio no difiere significativamente del estudio del receptor, incluyendo exámenes de laboratorio de rutina, hemograma, electrolitos, pruebas de función hepática y renal, coagulación y perfil bioquímico. Debe tomarse de rutina ECG y Rx de tórax y ser evaluado por un cardiólogo y anestesiólogo para precisar el riesgo quirúrgico. Un estudio endoscópico del tracto gastrointestinal y en ocasiones estudios radiológicos del mismo permiten descartar patología asintomática que contraindique la donación. Finalmente la anatomía mesentérica arterial y venosa es estudiada con un Angio TAC con reconstrucción vascular.
El día previo a la cirugía el potencial donante es mantenido con una dieta líquida, administrándose Neomicina 1 gramo y Eritromicina 1 gramo vía oral 3 veces al día para disminuir la carga bacteriana al momento del trasplante. Además es ideal realizar una preparación formal del tracto gastroeintestinal con Polietilenglicol o similar.
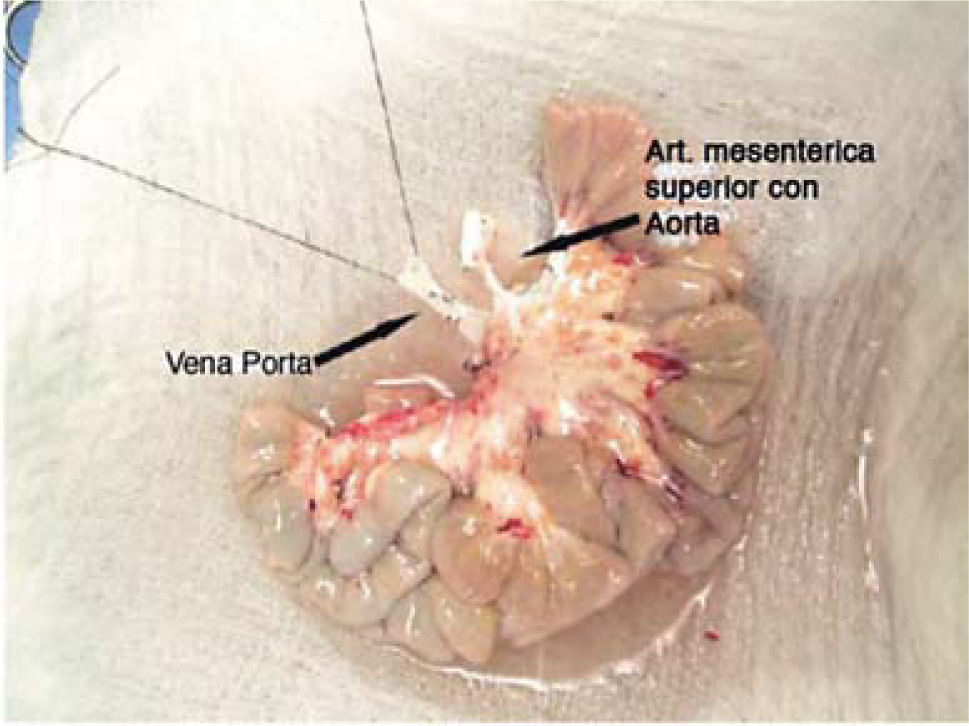
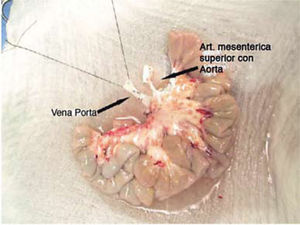
Técnica de procuramientoEs importante que exista una adecuada coordinación entre los distintos equipos quirúrgicos que realizan el procedimiento de extracción de órganos, principalmente en los casos de extracción multiorgánica. Al iniciar el procedimiento debe definirse la sección de los elementos vasculares tales como vena mesentérica superior como arteria mesentérica superior (14, 19, 20). De cualquier modo es necesario extraer segmentos extras de arteria y vena del receptor, para esto se extraen los vasos iliacos para realizar posteriormente las reconstrucciones vasculares que se requirieran. Para la perfusión de la solución de preservación (solución de Wisconsin), se utiliza la misma técnica que para otros órganos abdominales, esto es por vía aórtica y la salida por vía cava inferior. Debe ser embalado en condición de asepsia y enviado al centro de trasplante (Figura 5).
Resultados y perspectivas futurasLos resultados del procedimiento han mostrado una mejoría importante en la última década. La sobrevida del injerto desde el año 1997 al 2005, aumento de un 52 a un 75% al año y la sobrevida de los pacientes de un 57 a un 80%. La expectativa a más largo plazo es aún modesta alcanzando un 61% a 3 años y sólo un 47% a 5 años. Estos resultados varían ampliamente entre distintos centros, alcanzado en algunos con más experiencia sobrevidas al año sobre el 90% lo que puede traducirse en mejores resultados a largo plazo (2, 8, 9). Los pacientes admitidos desde su hogar para el trasplante, los de menor edad, los que reciben su primer trasplante y los que reciben terapia de inducción con anticuerpos o de mantención con Sirolimus muestran mejores sobrevidas. Estos hallazgos enfatizan la importancia de la referencia precoz para ingresar pacientes en mejores condiciones que permitan el manejo domiciliario en la espera del trasplante y toleren regímenes de inducción más agresivos (2, 21, 22).
En relación a la nutrición posterior al trasplante logran independizarse del soporte parenteral un 80% de los pacientes, lo que claramente se traduce en una mejoría en su calidad de vida. La función intestinal luego del trasplante es prácticamente normal, sólo requiriendo algunas restricciones. Los alimentos ricos en hidratos de carbono o fibras pueden provocar síntomas de dumping precoz. Por lo tanto la dieta debe modificarse por un médico especialista de acuerdo a la tolerancia del paciente. En los pacientes con segmentos de colon remanente largo, la función intestinal puede mejorar, pero es habitual el uso de medicamentos antidiarreicos. La absorción de vitaminas, minerales y micronutrientes es normal por lo que por lo general no se requiere suplementación. Los pacientes quedan con una ileostomía en asa con la finalidad de evaluar el débito, débito alto va relacionado con rechazo celular agudo, pero además nos permite un seguimiento endoscópico seriado. Esta ostomía se mantiene por los primeros seis meses (2, 6, 23–25).
ComentarioCada año muere por sepsis un número importante de pacientes con isquemia intestinal, enterocolitis necrotizante, vólvulos u otros trastornos que llevan a la insuficiencia intestinal en los cuales se cancela una resección intestinal. Esta práctica puede cambiar si se tiene en cuenta los buenos resultados en calidad de vida de la nutrición parenteral domiciliaria y posterior trasplante, con potencial reinserción a la vida laboral. Si bien el número de trasplantes de intestino es menor comparativamente con otros, los buenos resultados actuales permiten pronosticar un aumento en número y en indicaciones. Es importante que los médicos internistas, pediatras y cirujanos generales conozcan e incorporen este procedimiento como una alternativa válida para el tratamiento de los enfermos con insuficiencia intestinal en NPTC, además es de vital importancia que se contacten con centros de trasplantes capacitados en esta técnica con la finalidad de manejar en conjunto tan complejo enfermo.
Los autores declaran no tener conflictos de interés, en relación a este artículo.