Es común que individuos sanos y afectados con antecedentes familiares de alguna condición manifiesten ansiedad y requieran información acerca de sus riesgos y los riesgos de sus parientes cercanos. El asesoramiento genético nace de la necesidad de ayudar a los individuos y a las familias con un diagnóstico o con riesgos de una condición genética hereditaria a comprender y adaptarse a las implicancias de los resultados de estudios genéticos, los que pueden determinar un diagnóstico definitivo de un síndrome o una predisposición a desarrollar una condición en el adulto. En las últimas décadas, la necesidad de conocer dicha información es cada vez mayor gracias a los avances de la genética y genómica y al desarrollo de técnicas de secuenciación masiva que han facilitado el acceso a estudios genéticos moleculares para la prevención, diagnóstico y manejo de síndromes hereditarios. Sin embargo, aparte de los beneficios existen limitaciones y riesgos asociados a los resultados, siendo limitada la capacitación formal de profesionales de la salud en asesoramiento genético en Chile y en Sur América. El presente artículo pretende definir en qué consiste el asesoramiento genético en oncología y los requisitos básicos de conocimientos, habilidades y actitudes para su práctica clínica junto con mostrar la necesidad de educar a profesionales de la salud en esta disciplina.
It is common for healthy and affected individuals with a family history of a condition to manifest anxiety and require information about their risks and the risks of their close relatives. Genetic counseling arises from the need to help individuals and families with a diagnosis or with risks of a hereditary genetic condition to understand and adapt to the implications of the results of genetic studies that may determine a diagnosis of a syndrome or a genetic predisposition to develop an adult condition. In the last decades the need to know this information is increasing thanks to advances in genetics and genomics and the development of massively-parallel sequencing (MPS) techniques that have facilitated access to molecular genetic studies for the prevention, diagnosis and management of hereditary syndromes. However, in addition to the benefits, there are limitations and risks associated with the results, and formal training of health professionals in genetic counseling in Chile and South America is limited. This article aims to define genetic counseling in oncology and the basic requirements of knowledge, skills and attitudes for its clinical practice together with demonstrating the need to educate health professionals in this discipline.
El término “asesoramiento genético” fue propuesto en 1947 por el Dr. Sheldon Reed.
Para el Dr. Reed la función primordial del asesoramiento genético era el de proveer a las personas un entendimiento de los problemas genéticos en sus familias, delineando tres requisitos fundamentales de este asesoramiento que incluyen:
- 1.
Conocimiento de genética humana.
- 2.
Respeto a las sensibilidades, actitudes y reacciones de los clientes.
- 3.
Enseñar y proporcionar información genética en toda su extensión 2.
La importancia de los aspectos psicosociales del asesoramiento genético han sido reconocidos desde sus inicios. Condiciones genéticas hereditarias evocan sentimientos de culpa, impotencia y estigmatización. Aparte de Reed, el médico genetista J. A. Fraser Roberts reconoce que el asesoramiento va más allá de proveer información sobre riesgos revelando que los pacientes pueden ser ayudados a disipar sus sentimiento de culpa, a racionalizar sus problemas, y a enfrentar la realidad que les toca 3.
Otro genetista en valorar el asesoramiento y apoyo psicoemocional en el proceso fue el Dr. Robert Tips, que a comienzos de los años 60 ve la necesidad de extender las habilidades y destrezas de asesoramiento con una capacitación especial para evaluar el impacto psicológico del proceso 4. Sin embargo, la capacitación específica que sugiere Roberts no se incorpora en la profesión médica, y solo fue impulsado con el establecimiento en 1969 del primer programa de postgrado de Sarah Lawrence College en Nueva York, Estados Unidos. El programa enfatiza por primera vez la capacitación formal de profesionales no médicos en asesoramiento genético en donde la interacción psicológica toma principal relevancia. El modelo de asesoramiento se basó en gran medida en la filosofía humanista “centrada en el cliente” del psicólogo Carl Rogers con la aceptación incondicional y práctica empática hacia el paciente.
El programa de postgrado junto a otros que pronto siguieron en los Estados Unidos, educa a los estudiantes para ser profesionales únicos de la salud, ayudando a los pacientes a lidiar con los aspectos médicos y psicosociales del riesgo genético y la enfermedad. Los consejeros genéticos consideran que sus responsabilidades no sólo implica la provisión de información sobre el riesgo genético, sino también el trabajar con las familias para ayudarles a entender su condición, sus opciones de tratamiento, facilitar la toma de decisiones y proporcionar servicios de apoyo psicosocial.
Los asesores genéticos son profesionales de la salud egresados de magíster en genética humana con conocimientos de genética médica y habilidades en educación, comunicación interpersonal y en asesoramiento para prestar ayuda a los pacientes y sus familias para un conjunto diverso de indicaciones genéticas o genómicas.
Asesores genéticos trabajan en equipos multidisciplinarios de salud en distintas especialidades clínicas 5.
En respuesta a la mayor demanda de servicios de genética y de asesoramiento genético, en 1975 la Sociedad de Genética Humana publica por primera vez la definición del asesoramiento genético reconociendo los aspectos más importantes de ser un proceso de comunicación y de empoderar a los pacientes 6.
En el año 2003, la Sociedad Nacional Americana de Consejeros Genéticos (NSGC) discute la necesidad de una nueva definición que refleje los cambios de los últimos 30 años de la genética y de los servicios de asesoramiento genético. En el año 2006, con el advenimiento de la medicina genómica y la necesidad de una práctica común de asesoramiento genético, se publica una nueva definición publicada por el grupo de trabajo de consejeros genéticos vigente en la actualidad 7.
DEFINICIÓNEl asesoramiento genético es el proceso de ayudar a las personas a comprender y adaptarse a las implicaciones médicas, psicológicas y familiares de las contribuciones genéticas a la enfermedad.
Este proceso integra lo siguiente:
- •
La interpretación de los antecedentes médicos y familiares para evaluar el riesgo de ocurrencia o de recurrencia de una enfermedad.
- •
La educación sobre la herencia, pruebas genéticas, manejo, prevención, recursos e investigación.
- •
El asesoramiento y apoyo psico-emocional para promover decisiones informadas adaptándose de la mejor manera al riesgo o condición genética.
Uno de los roles de mayor crecimiento del asesoramiento genético en las últimas décadas, ha sido en cáncer hereditario. El descubrimiento de genes que confieren alto riesgo hereditario de desarrollar cáncer, impulsó el asesoramiento genético hacia el campo de la oncología en los años 90. El proceso del asesoramiento genético en cáncer es similar al de otras áreas de la salud con la diferencia que la educación es sobre las posibilidades de desarrollar cáncer, la evaluación de riesgos es sobre antecedentes personales y familiares de cáncer y el promover la toma de decisiones informadas sobre estudios genéticos disponibles, opciones de seguimiento y manejo de la prevención del cáncer 8.
¿CÓMO REALIZAR EL ASESORAMIENTO GENÉTICO EN ONCOLOGÍA?La consulta de asesoramiento genético se diferencia de otras consultas médicas en que no solo se enfoca en el paciente que viene a la entrevista sino también tiene implicancias para la familia. Los motivos de consulta pueden variar desde una inquietud por los antecedentes familiares de cáncer de una paciente sana, o por la preocupación del riesgo de los familiares de una paciente afectada con cáncer. Además, considerando que las opciones de manejo para los pacientes portadores de mutaciones en genes que confieren un alto riesgo hereditario incluyen cirugías de reducción de riesgo o terapias dirigidas, los pacientes pueden ser derivados para obtener información del estudio genético puesto que los resultados asistirán en la toma de decisiones de seguimiento y manejo médico.
Durante la evaluación de los antecedentes familiares de cáncer, puede revelarse información sobre otras condición genéticas con predisposición hereditaria, información sobre riesgos de familiares directos (padres, hijos, hermanos), información que puede afectar decisiones reproductivos o decisiones de vida de otros individuos. Por otro lado, la interpretación y las implicancias de resultados de estudios genéticos utilizando nuevas técnicas de secuenciación masiva pueden revelar información incierta o información inesperada no relacionada a los antecedentes de cáncer en la familia.
Debido a lo complejo y al impacto que puede provocar la información, el proceso de asesoramiento genético involucra componentes o etapas esenciales que dependiendo de la condición pueden tomar lugar en una o varias entrevistas siendo los aspectos psicosociales centrales a lo largo de todo el proceso.
La tabla 1 enumera estas etapas desde la preparación antes de la entrevista de asesoramiento genético hasta el seguimiento a corto o largo plazo después de la entrega de resultados.
COMPONENTES/ETAPAS DEL PROCESO ASESORAMIENTO GENÉTICO
| Preparación de la consulta - Revisión exámenes, estudios e historial médico y familiar. - Identificación de posibles diagnósticos, derivaciones y estudios genéticos. |
| Estableciendo buenas relaciones con los pacientes: expectativas y motivaciones de los pacientes - Revisión del motivo de consulta, expectativas y motivaciones - Evaluación de los conocimientos previos del paciente - Establecer una agenda |
| Recolección de antecedentes médicos personales y familiares - Construcción de la genealogía (al menos 3 generaciones) - Edades de diagnóstico/curso de la enfermedad/causas de muerte |
| Educación sobre genes, mutaciones, herencia y riesgos - Herencia mendeliana - Herencia multifactorial - Otros mecanismos de herencia |
| Evaluación de riesgos en base a los antecedentes - Identificación de criterios de alto riesgo (banderas de alerta) - Evaluación en base a criterios cualitativos (bajo, moderado y alto riesgo) - Evaluación en base a modelos empíricos/estadísticos (BRCApro, Tyrer-Cusick, etc.) |
| Asesoramiento genético pre-test - Disponibilidad y opciones de estudios genéticos - Determinación del individuo más apropiado de realizar el estudio - Implicancias de los posibles resultados - Consentimiento informado (beneficios, limitaciones y riesgos de estudios genéticos) - Opciones de seguimiento y manejo médico - Promoción de autonomía y toma de decisiones - Entrega de resumen y material educativo |
| Asesoramiento Post-test - Entrega e interpretación de los resultados - Discusión de seguimiento y recomendaciones de manejo médico - Seguimiento a corto y largo plazo - Opción de asesoramiento y estudio genético a familiares en riesgo - Entrega de resumen y material educativo. |
La preparación de la consulta antes de la entrevista implica revisar los registros médicos, exámenes y estudios pertinentes que asisten en la evaluación de riesgos y en la identificación de posibles diagnósticos además de conocer las posibles expectativas y motivaciones del paciente sobre la consulta.
Desde el inicio de la consulta es importante establecer una buena relación con los pacientes que en lengua inglesa se denomina “contracting”. Esto implica conocer cuáles son las motivaciones, expectativas de los pacientes sobre la consulta corroborando a la vez qué conocimientos previos poseen los pacientes. Es aquí donde corresponde aclarar el propósito, malinterpretaciones y qué es lo que se llevará a cabo durante la sesión. De esta manera, se establece desde el inicio un acuerdo y una agenda que evita confusión y permite una mejor comunicación y entendimiento.
La recolección de los antecedentes médicos y familiares, previo al momento de la entrevista es ideal, puesto que le ofrece más tiempo al paciente de obtener información relevante difícil de recordar sin anticipación (tipo y edades de diagnóstico, causas de fallecimiento, relación de parentesco, etc.). A su vez, permite delinear la genealogía, facilitando la evaluación de riesgos antes de la consulta, siendo relevante verificar y completar la información junto con los pacientes teniendo en cuenta las reacciones emocionales que puede generar dicha información (fallecimientos, relaciones interpersonales, etc). Para la recolección de antecedentes, Trepanier et.al (2004) 8 detalla las preguntas a realizar a pacientes sanas y afectadas (Tabla 2). También existen herramientas electrónicas para la recolección de historia familiar disponibles en internet, una de ellas es la herramienta del retrato familiar de los Cirujanos Generales de Estados Unidos 9.
RECOLECCIÓN DE LOS ANTECEDENTES PERSONALES Y FAMILIARES CON CÁNCER8
| PREGUNTAS PARA TODOS LOS PACIENTES | PREGUNTAS PARA PACIENTES O PARIENTES CON CÁNCER |
|---|---|
| • Edad | • Órgano donde se desarrolló el tumor |
| •Antecedentes personales de tumores benignos o malignos | • Edad de diagnóstico |
| • Enfermedades severas | • Número de tumoresa |
| • Hospitalizaciones | • Patología, estadio y grado del tumor |
| • Cirugías | • Patología de tumores benignos |
| • Número de biopsias | • Tratamientos (cirugía, quimoterapia,radioterapia) |
| • Antecedentes reproductivosb | |
| • Vigilancia de cáncer | |
| •Exposición a factores de riesgo ambientales |
Para pacientes que desarrollaron más de un tumor es importante discriminar si los tumores adicionales fueron primarios, recurrencia o el resultado de una metástasis.
Especialmente importante para mujeres con un mayor riesgo de cáncer de mama, ovario o de endometrio. Preguntar sobre edad de menarquia, edad del primer recién nacido vivo, antecedentes de anticonceptivos orales, tratamiento de infertilidad o terapia de reemplazo hormonal, incluyendo dosis y duración, edad de menopausia.
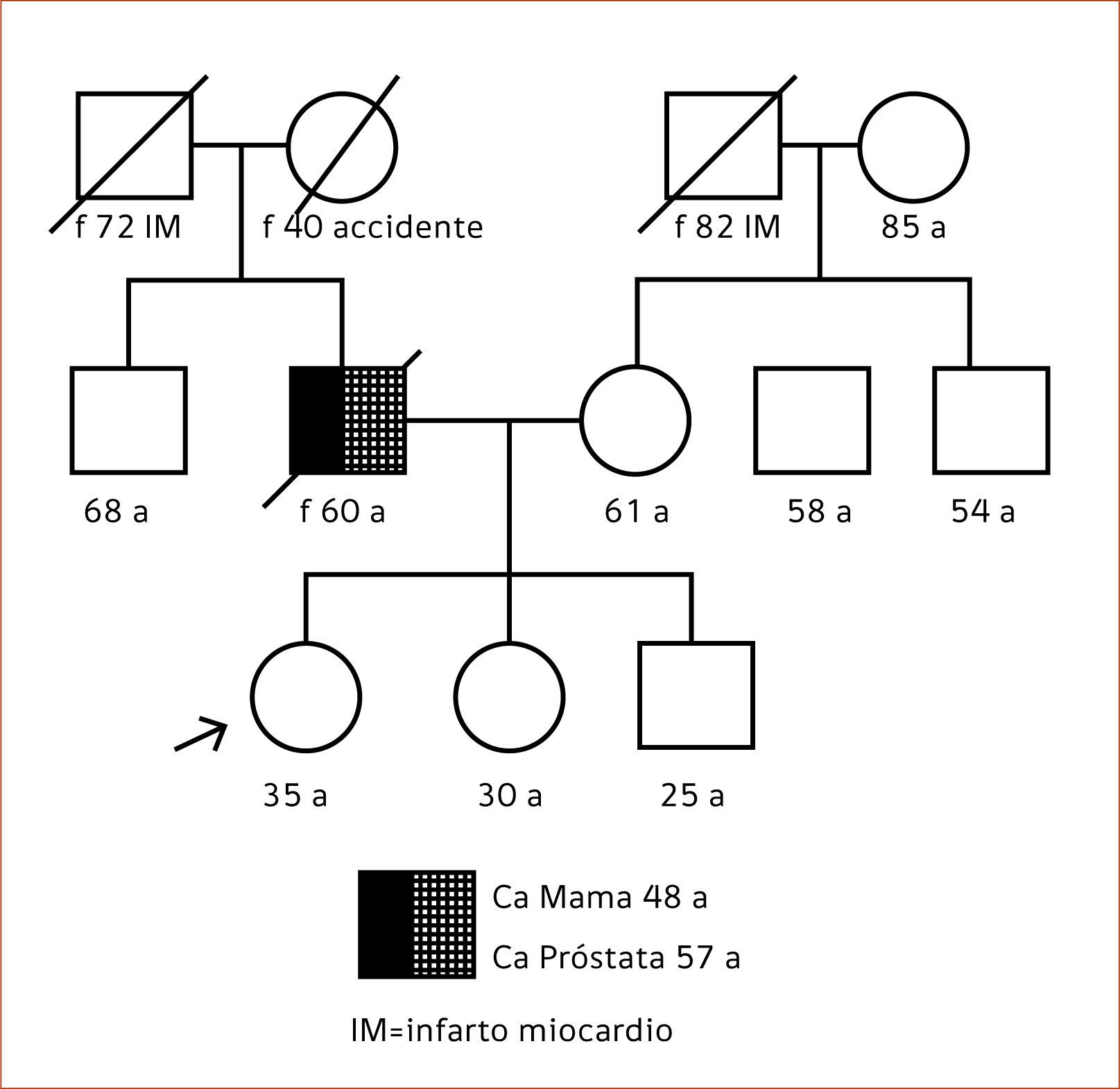
La genealogía es uno de los instrumentos más antiguos de pesquisa para identificar a las familias de mayor riesgo a enfermedades, sin embargo en la práctica clínica diaria su aplicación es limitada a ciertos contextos y muchas veces no hay claridad en el uso de la información obtenida. En base a los antecedentes recolectados se construye una genealogía de al menos tres generaciones, la cual permite visualizar a los integrantes de la familia, señalando a afectados y sanos, como si fuese una fotografía (Figura 1). La evaluación de la genealogía permite discriminar los factores de riesgo genéticos (hereditarios) de los factores ambientales (estilo de vida, exposición a tóxicos, etc.) siendo de gran utilidad como herramienta de educación en la promoción en salud y la prevención de enfermedades.
La tabla 3 enumera los factores de riesgo más comunes o claves de alerta que amerita una derivación al asesoramiento genético, entre los cuales se destaca: la edad de diagnóstico precoz de una condición del adulto mayor, 50 años o antes de los 50 años, el tener dos o más parientes afectados del mismo lado de la familia (materno o paterno); diagnóstico severo de una condición; tumores poco comunes, múltiples cánceres en el mismo individuo, condición diagnosticada en el sexo menos común (por ejemplo: cáncer de mama en un varón); y pertenecer a un grupo étnico de alto riesgo (Judío Askenazí).
FACTORES DE RIESGO GENÉTICO O CLAVES DE ALERTA
| • Edad de diagnóstico precoz de una enfermedad común del adulto (> 50 años) • Dos o más parientes cercanos afectados del mismo linaje (materno o paterno) • Diagnóstico de tumores poco comunes • Severidad de la condición • Condiciones multifocales o bilaterales • Ocurrencia de la condición en el sexo menos común (cáncer de mama en un hombre). • Antecedentes familiares de un síndrome hereditario • Patrón sugerente de una herencia mendeliana • Ausencia de estilo de vida o factores de riesgo ambientales • Pertenecer a un grupo étnico de alto riesgo |
En el ejemplo de genealogía en la figura 1, la consultante sana de 35 años señalada con una flecha posee antecedentes familiares del padre afectado con cáncer de mama a los 48 años y cáncer de próstata a los 57 años. En este ejemplo se identifican varios factores de alto riesgo hereditario:
- 1.
Antecedente de diagnóstico de cáncer antes de los 50 años.
- 2.
Pariente de primer grado (padre) afectado con cáncer.
- 3.
Tipo de cáncer en el sexo menos común (mama en hombre).
- 4.
Dos cánceres en el mismo individuo (mama y próstata).
Otro factor a considerar es que se trata de una familia pequeña con mayor proporción de parientes hombres. Mientras se tengan más factores de riesgo, más es la sospecha de la presencia de un síndrome hereditario. De todas maneras, se recomienda la derivación a una consulta de asesoramiento genético cuando exista tan solo un factor de riesgo para realizar una evaluación más detallada de los antecedentes.
De acuerdo a la Sociedad Americana Clínica de Oncología se recomienda ofrecer un estudio genético en cáncer hereditario cuando se apliquen las siguientes condiciones:
- a)
Un individuo tiene antecedentes personales o familiares que sugieren un síndrome de cáncer hereditario.
- b)
El análisis genético puede ser interpretado adecuadamente.
- c)
Los análisis genéticos influirán en el manejo médico del paciente u otros familiares 10.
Si la evaluación de riesgos confirma que los antecedentes cumplen con criterios de alto riesgo hereditario se procede al asesoramiento genético pre-test. En esta etapa se determina cuál sería el estudio genético recomendable, donde se explican los beneficios, limitaciones y riesgos antes de la toma de muestra. Existe la creencia que obtener asesoramiento pre-test equivale a la toma de muestra para el estudio genético cuando en realidad es el obtener información y educar sobre los riesgos, las implicancias de los resultados y medidas de prevención y manejo de manera no directiva. El estudio genético es optativo y voluntario, respetando su autonomía los pacientes pueden decidir realizar el estudio genético o declinar una vez obtenida toda la información. Es frecuente que pacientes decididos a tomarse la muestra prefieren postergarlo después de la consulta de asesoramiento genético ya sea para compartir la información con los familiares o médico tratante o para reflexionar sobre el plan de manejo adecuado lo que refleja la toma decisiones informadas.
Se recomienda comenzar el estudio genético con la persona más “informativa” de la familia. En el ejemplo de la genealogía de la figura 1, la persona más adecuada a estudiar sería el padre de la paciente al estar afectado con dos cánceres sería el individuo con más probabilidad de obtener un resultado positivo “informativo”. Es importante que los pacientes que consultan comprendan por qué se estudia primero a un pariente afectado. Si se obtiene un resultado positivo, se conoce la probable causa del cáncer familiar y se ofrece a los demás familiares en riesgo la opción de estudiar si heredaron o no la mutación. En el caso de que el padre decline realizarse el estudio genético, la paciente puede realizar el estudio siempre y cuando comprenda las limitaciones de un resultado negativo “no informativo”, donde se recomienda el seguimiento de alto riesgo en base a los antecedentes familiares. Para explicar el modo de herencia y el significado de los posibles resultados se utiliza material educativo y posibles escenarios del significado de los resultados como lo ilustra la Tabla 4.
IMPLICANCIAS DE LOS RESULTADOS
| RESULTADOS | BENEFICIOS | RIESGOS |
|---|---|---|
| Positivos (variante patogénica o probable patogénica) | • Intervención Precoz • Identificación de familiares de riesgo • Reduce la incertidumbre • Comportamiento saludable | • Impacto psicosocial • Dinámica Familiar • Incertidumbre – Penetrancia • Discriminación • Confidencialidad |
| Negativos “no informativo” o Variante de significado incierto | • Clarificación por medio de investigaciones en el futuro • Reforzar el comportamiento saludable | • Incertidumbre • Falsa seguridad • Mala adherencia a las medidas preventivas • Ansiedad y Frustración |
| Negativo “informativo” (mutación familiar identificada) | • Alivio emocional • Evita intervenciones innecesarias • Re-aseguramiento a los hijos | • Reacciones psicológicas “survivors guilt” • Mala adherencia a las medidas preventivas de la población en general |
La interpretación de resultados de variantes es relevante puesto que pueden haber discordancias incluso entre laboratorios altamente calificados. Los asesores genéticos se basan en las recomendaciones publicadas por la Asociación Americana del Colegio Médico de Genética 11 para la clasificación de variantes. De acuerdo a ello se recomiendan cinco categorías de clasificación de variantes, patogénica, probable patogénica, variante incierta, probable benigna y benigna. Es importante discutir las limitaciones en la interpretación de los posibles resultados antes durante el asesoramiento pre-test y después una vez obtenidos los resultados. De esta manera los pacientes comprenden las limitaciones del estudio genético y posible plan de manejo.
Durante el asesoramiento post-test se realiza la entrega de resultados que se recomienda realizar en persona de manera que se aclaren las dudas, las preocupaciones y se entregan recomendaciones de seguimiento y manejo de acuerdo a los resultados. Esta sesión puede realizarse junto al médico tratante sobre todo si los resultados son positivos, confirmando el riesgo hereditario, los riesgos de recurrencia del 50% a los familiares directos y las opciones de manejo recomendables. En el asesoramiento post-test se entrega un resumen de las recomendaciones y material educativo para compartir con los familiares y de establecer una relación abierta en caso de más preguntas o consultas.
NECESIDAD DE CAPACITAR A PROFESIONALES DE LA SALUD EN LATINOAMÉRICATradicionalmente realizar un estudio genético implicaba analizar uno o dos genes a la vez, sin garantía de obtener resultados informativos, por lo que continuaba la odisea diagnóstica de más estudios y de alto costos. En la actualidad, con el desarrollo de técnicas de secuenciación de nueva generación se pueden analizar un mayor número de genes a la vez, existiendo la opción de estudiar desde paneles multigénicos hasta el estudio completo del exoma que incluye todos los genes codificantes en el genoma, de cada vez mayor acceso en un tiempo relativamente corto y a un costo menor.
Los médicos tratantes necesitan determinar si amerita o no ofrecer el estudio genético, cuál sería el estudio genético adecuado, a qué individuo en la familia sería apropiado estudiar y cómo interpretar los resultados en el contexto familiar. Sin embargo, la capacitación en genética y asesoramiento es muy limitada y la gran mayoría de los profesionales de la salud están poco familiarizados con las técnicas moleculares como para discriminar cuáles son los laboratorios confiables con acreditación adecuada.
Desde la creación del primer programa de magíster en asesoramiento genético en 1969 en Sarah Lawrence, cerca de 40 programas acreditados existen actualmente en EE.UU. 12 y a la vez se han desarrollado programas de magíster en asesoramiento genético de manera global con 6 países con acreditación de consensus internacional 13.
En Chile, como en la mayoría de los países latinoamericanos, no existe la capacitación en asesoramiento genético como una disciplina clínica independiente. Y programas formales de capacitación de postgrado son escasos. El asesoramiento genético en general es proporcionado por genetistas, médicos con formación en genética clínica, lo que no alcanza a cumplir con las necesidades en todas las áreas médicas 14. Genetistas clínicos tienen formación adecuada y algunos son pediatras de formación, sin embargo no llegan a cubrir la demanda en las diferentes áreas de la medicina (oncología, perinatal, neurología del adulto, entre otros.). Ante esta situación, deberían haber profesionales capacitados de apoyo al recurso existente para cubrir la demanda del país. Sin ser excluyente, se requiere más capacitación de profesionales de la salud no médicos, mediante la promoción de cursos de educación continúa, diplomados y eventualmente el desarrollo de un magíster en asesoramiento genético con acreditación internacional.
La capacitación en asesoramiento genético permitirá a los profesionales de la salud adquirir la experiencia y las habilidades necesarias para ser actores claves en evaluar los riesgos y determinar cuáles son los laboratorios calificados para realizar éstos estudios. A la vez, a través de la práctica en el área de comunicación podrán traducir información compleja en un lenguaje comprensible no solo a los pacientes y sus familias sino también orientando al equipo de salud en como proceder cuando se trata de condiciones genéticas hereditarias.
CONCLUSIÓNAnte la demanda de estudios genéticos y necesidad de información de los pacientes, las familias y los médicos tratantes, existe una escasez de profesionales de la salud calificados que cuenten con capacitación en asesoramiento genético en oncología. El asesoramiento genético permite integrar de la mejor manera los nuevos conocimientos del genoma en cuanto a diagnóstico, manejo y prevención. A su vez, ayuda a que las familias se adapten a condiciones genéticas hereditarias mediante el apoyo psicosocial. El desarrollo de cursos, diplomados y eventualmente de un magíster con consenso internacional en asesoramiento genético permitirá a los profesionales de la salud no médicos trabajar en equipos multidisciplinarios para asistir a las familias de mayor riesgo en las distintas áreas clínicas.
Agradecimiento al Dr. Guilllermo Lay-Son por su apoyo incondicional en la revisión de este artículo.
La autora declara no tener conflictos de interés, en relación a este artículo.