El manejo actual de los pacientes traumatizados, que constituyen un desafío, se realiza en varias fases, en función de las características de las lesiones y la capacidad de los equipos de rescate y reanimación. La hemorragia masiva constituye la principal causa de muerte en estos pacientes y la reposición de volumen debe enfocarse con una variedad de productos, comenzando con los cristaloides y en función de la evolución y respuesta a estos, la utilización de coloides y finalmente los Hemoderivados. Cada uno de estos productos presenta ventajas y problemas, y continúa siendo el juicio clínico el principal criterio en su utilización ya que, en el contexto de esta situación de emergencia, el laboratorio suele ir detrás de la realidad. El control de la hemorragia es uno de los principales objetivos a lograr, sin el cual ninguna otra medida médica evitará la muerte de estos pacientes.
Trauma patients represent a challenge for health providers. Clinical management has to be provided accordignly to their medical conditions, injuries and also to the level of experience of the emergency room team. Because massive bleeding is the main cause of death in this group of patients, volume reposition has to be one of the most important goals in order to improve their survival outcome. This is the reason why it is important in health providers a solid knowledge of volume replacement algorithms in trauma cases.
Volume reposition algorithms usually recommend starting with cristaloid solutions, following with coloids and finally hemoderivatives. All these products have their own advantages but also disadvantages, being the clinical judgement the most important tool in order to know when and how to use them. In the trauma field, the laboratory tests are often not available or their results are too slow to wait for. We still need to set in the future the advantages of oxygen carrying substances (or substitutes) to improve survival rates in the field of trauma.
El trauma es la principal causa de muerte en las primeras cuatro décadas de vida, dando cuenta del 43% de las muertes en los individuos de 1 a 4 años, 48% en el tramo comprendido entre los 5 a 14 años y un sorprendente 62% en los individuos de entre 14 a 25 años (1).
Aspectos históricosLa historia del manejo del trauma es muy antigua. Gran parte del tratamiento actual del trauma deriva del manejo militar que se ha desarrollado en los cinco grandes conflictos armados: Las dos guerras mundiales, la guerra de Corea, la guerra de Vietnam y, en el último tiempo, los conflictos de Afganistán e Iraq.
Durante la primera guerra mundial se limitó el uso de fluidos endovenosos y productos sanguíneos durante la hemorragia, ya que se pensó que la inyección de fluidos capaces de aumentar la presión arterial podrían aumentar las pérdidas sanguíneas, ya que los pacientes en shock sangran menos gracias a la contención del sangrado por la formación de coágulos y trombos. La presión sistólica diana se fijó en los 70 a 80 mmHg, la que se logró con la infusión de una solución hipertónica de cristaloides o coloides. También se demostró que la mortalidad secundaria al trauma era del 10% para los pacientes tratados dentro de la primera hora versus un 75% de mortalidad en los tratados durante las primeras 8 horas. Esta observación acuñó el principio de la hora dorada en el manejo del trauma.
Este mismo paradigma se consolidó durante la segunda guerra mundial. En el período posterior a ésta se formó un segundo paradigma, que pretendió una agresiva reanimación con grandes volúmenes de cristaloides, de tal forma de repletar no sólo el espacio intravascular sino también el espacio extravascular, en un intento de reanimar completamente al paciente antes de la cirugía. En los años 60 se llegó al clásico 3:1 (reponer 3 ml. de cristaloides por cada ml. de pérdidas sanguíneas) como guía de reanimación, el que fue utilizado en la guerra de Vietnam. La ATLS incorporó este paradigma, por lo que la recomendación inicial de acuerdo a esta guía es administrar 2 litros de cristaloides a toda víctima de trauma que se encuentre en estado de hipotensión. Si el paciente no logra alcanzar presiones sistólicas de 90 mmHg, la reanimación se mantiene con cristaloides y productos sanguíneos a fin de lograr la estabilización, previo al traslado a pabellón o sala de angiografía para el manejo definitivo.
Desde el inicio de los conflictos armados se ha mantenido una tasa estable de los muertos en acción del 20%. Sin embargo, el mejor manejo de los heridos ha permitido disminuir paulatinamente la mortalidad de este último grupo. Esto hasta las guerras de Afganistán e Iraq, en las que el tipo de armamento y el mayor tiempo de traslado a los centros hospitalarios ha aumentado súbitamente la mortalidad en los heridos, demostrando que la hemorragia no controlada sigue siendo la principal causa de muerte en el campo de batalla. Así, se ha formado un tercer paradigma de la reanimación, que enfatiza el control de la hemorragia por sobre el manejo agresivo de la reposición de volumen, en oposición a lo dictado por el algoritmo de manejo del ATLS.
El primer paso en la evaluación del trauma es la etapificación de la severidad de las alteraciones fisiológicas, que pueden ir desde la normalidad al shock. El shock se define como la inadecuada perfusión u oxigenación tisular. Si no es tratado, se produce una deuda de oxígeno y, en el largo plazo, la falla orgánica.
La hemorragia es la principal causa de shock en los pacientes traumatizados. Esta puede ser clasificada de acuerdo a criterios clínicos y hemodinámicos del paciente de acuerdo al esquema del American College of Surgeons. Además de las hemorragias externas, se pueden producir pérdidas sanguíneas secundarias a fracturas, que, en el caso de comprometer las extremidades inferiores, pueden llegar a ser de 750 a 1500 ml y, en las fracturas de pelvis, pueden producir hematomas retroperitoneales de varios litros.
También los tejidos pueden capturar líquidos mediante el aumento de la permeabilidad capilar postraumático, secundario a alteraciones generalizadas de la barrera endotelial, que producen una fuga endotelial difusa y cambios de fluidos desde el intravascular al compartimento intersticial.
Es necesario reconocer otras causas no hipovolémicas de shock en el paciente politraumatizado
- 1.
Shock cardiogénico: Puede estar presente en caso de trauma cerrado, taponamiento cardiaco e infarto agudo del miocardio.
- 2.
Shock Neurogénico: Puede ocurrir en el caso de traumatismo espinal.
- 3.
Neumotórax a tensión: En caso de traumatismo torácico cerrado.
- 4.
Otras: Falla suprarrenal y síndrome compartimental abdominal.
Respecto de la administración de fluidos en el politraumatizado, podemos señalar que ésta debe iniciarse simultáneamente con la llegada del equipo de rescate al lugar del accidente. Sin embargo no hay que olvidar que los fluidos intravenosos corresponden a medicamentos que deben ser utilizados de acuerdo al criterio clínico. Para ayudar a este proceso se han desarrollado diferentes guías. A continuación resaltaremos las normas inglesas de administración de fluidos en el contexto extrahospitalario (2).
En general no es necesario administrar fluidos en adultos y niños mayores si el pulso radial puede ser palpado. En caso de que no se pueda palpar el pulso radial, se deben administrar bolos de 250 ml de fluidos y luego reevaluar al paciente. Esta administración de volumen no debe retrasar el traslado del paciente a un centro hospitalario y de elección se utilizará alguna solución de cristaloides.
Existen dos aproximaciones a la administración de fluidos prehospitalarios en el traumatismo:
- 1.
La primera es administrar fluidos, lo que puede reducir el daño orgánico y tisular y mejorar la sobrevida. El riesgo de esta medida es retardar el traslado del paciente al hospital y elevar la presión del enfermo, lo que puede aumentar la hemorragia.
- 2.
El otro enfrentamiento es posponer el tratamiento hasta la llegada al hospital, lo que permite un traslado más rápido y, se cree, disminuye el sangrado del paciente causado por la ruptura de los coágulos y la dilución de los factores de coagulación que pudiera ocurrir cuando se administran grandes volúmenes de fluidos intravenosos (IV).
Hasta el momento no existe evidencia sólida que permita elaborar una recomendación respecto del momento de iniciar la terapia IV.
Reposición de volumen en el caso de hemorragia no controladaRespecto de la reposición de volumen en hemorragia no controlada hay dos tendencias.
La primera indica un manejo conservador, con administración moderada de volumen en un intento de evitar la coagulopatía dilucional y evitar la ruptura de los coágulos en formación, lo que favorece la hemorragia secundaria (aumento de pérdidas sanguíneas). Al aplicar este enfoque se corre el riesgo de producir un colapso hemodinámico y falla multiorgánica irreversible. El otro enfoque es administrar grandes volúmenes de fluidos para normalizar el transporte de oxígeno.
Lamentablemente, hay escasa literatura prospectiva en humanos que ayude a avalar una u otra estrategia, por lo que el primer enfoque debe ser considerado una situación experimental más que un estándar de cuidado. (1).
Tipos de soluciones: Clásicamente se han utilizado dos grandes grupos de fluidos en la reposición de volumen en los pacientes politraumatizados: Los derivados sanguíneos y los cristaloides / coloides.
A continuación se entregarán las principales características de cada grupo de estos fluidos.
CristaloidesLos cristaloides rápidamente se equilibran en el espacio intra y extracelular, por lo que reestablecen los déficit de ambos compartimentos asociados a una hemorragia. Esta rápida distribución es lo que justifica la ya clásica fórmula de Shires y Moore de administrar 3 ml de cristaloide por cada ml perdido de sangre. Tanto Ringer Lactato como el Suero Fisiológico han demostrado igual efectividad en mantener el volumen circulatorio.
A pesar de ser extremadamente seguros, su uso no está exento de potenciales complicaciones como el aumento en la presión intersticial, lo que puede contribuir a un síndrome compartimental abdominal, aumentar la translocación bacteriana del tracto digestivo, disminuir el flujo sanguíneo capilar e interferir con el intercambio de gases.
Ringer Lactato: Es una solución de electrolitos similar al fluido extracelular. Es hipotónico y el lactato es metabolizado en el hígado a bicarbonato. Además posee un buffer que produce la formación de dióxido carbono.
Es el fluido de elección en pacientes con trauma cerrado y penetrante sin compromiso craneano.
Normal salino: Este fluido es isotónico, isosmótico y no posee buffer. Es de elección en pacientes con traumatismo cerebral y al no tener potasio es también una buena elección en los pacientes con hiperkalemia. Puede producir acidosis hiperclorémica si es administrado en grandes volúmenes, lo que puede empeorar una acidosis láctica previa. Esta acidosis se atribuyó inicialmente a la dilución del bicarbonato y a la pérdida renal de éste; sin embargo, hay estudios que muestran que la administración de salino en cirugías largas no produce cambios en el volumen del plasma, de tal forma que los cambios son secundarios a sus propiedades fisicoquímicas.
Es por eso que es también el fluido de elección en la alcalosis hipoclorémica.
Salino hipertónico: Su uso está principalmente documentado en neurocirugía, como agente osmótico usado para disminuir el edema intracraneano. Sin embargo, recientemente se ha estudiado como un agente de uso para trauma, siendo las preparaciones más clásicas el hipertónico con NaCl al 3% y al 7.5%.
Su gran cualidad es que teóricamente se requiere de un menor volumen para lograr una estabilidad hemodinámica. Dentro de las complicaciones destacan las convulsiones, coma, edema cerebral de rebote, falla cardiaca por aumento del volumen circulante, hipokalemia, alteraciones en los factores de coagulación y agregación plaquetaria.
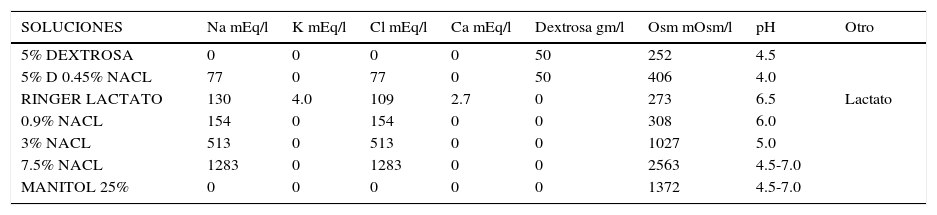
Composición de los cristaloides
| SOLUCIONES | Na mEq/l | K mEq/l | Cl mEq/l | Ca mEq/l | Dextrosa gm/l | Osm mOsm/l | pH | Otro |
|---|---|---|---|---|---|---|---|---|
| 5% DEXTROSA | 0 | 0 | 0 | 0 | 50 | 252 | 4.5 | |
| 5% D 0.45% NACL | 77 | 0 | 77 | 0 | 50 | 406 | 4.0 | |
| RINGER LACTATO | 130 | 4.0 | 109 | 2.7 | 0 | 273 | 6.5 | Lactato |
| 0.9% NACL | 154 | 0 | 154 | 0 | 0 | 308 | 6.0 | |
| 3% NACL | 513 | 0 | 513 | 0 | 0 | 1027 | 5.0 | |
| 7.5% NACL | 1283 | 0 | 1283 | 0 | 0 | 2563 | 4.5-7.0 | |
| MANITOL 25% | 0 | 0 | 0 | 0 | 0 | 1372 | 4.5-7.0 |
Dada la importancia de la patología, vale la pena realizar un pequeño paréntesis respecto del traumatismo encéfalo craneano (TEC), que causa importante de morbi/mortalidad en adultos jóvenes. Las causas más frecuentes de TEC son las colisiones en vehículos, accidentes en bicicleta, motos, atropellos, caídas (especialmente en ancianos y niños), asaltos y actividades deportivas.
Por lo general, el TEC produce un aumento de la presión intracraneana cuya fisiopatología es compleja y depende de los mecanismos de edema cerebral, volumen de los componentes intracraneanos, integridad de la barrera hematoencefálica y presión de perfusión cerebral. En condiciones normales, la barrera hematoencefálica (BHE) impide el paso de sustancias al parénquima cerebral mediante una capa semipermeable, pero en el caso de ruptura se facilita el paso de proteínas y electrolitos a través de esta membrana y la presión hidrostática pasa a ser la fuerza dominante del flujo de fluidos. Esto produce edema cerebral, con aumento de la presión intracraneana, disminución de la presión de perfusión, hipoxia cerebral y daño cerebral secundario. Romper este círculo es la base del tratamiento del trauma encéfalo craneano.
La terapia osmótica produce un “encogimiento” del cerebro mediante la salida de agua desde el tejido cerebral. El agente osmótico ideal establece una fuerte gradiente osmótica mediante una larga estadía intravascular. Es inerte, no tóxico y con mínimos efectos secundarios. El agente de elección ha sido el manitol, que produce cambios en la reología de la sangre, aumenta el gasto cardíaco, mejora la oxigenación cerebral, lo que induce la vasoconstricción y reducción en el volumen sanguíneo cerebral y presión intracraneana.
La deshidratación moderada es deseada y pudiera ayudar a resolver el edema cerebral. Además disminuye la formación de líquido cefalorraquídeo a la mitad.
Sin embargo, tiene sus limitaciones como la hiperosmolaridad, diuresis osmótica que puede desencadenar hipotensión y aumentos en la PIC de rebote por la acumulación de manitol en el tejido cerebral.
Es por esto que se ha utilizado como alternativa el suero hipertónico, que posee una baja permeabilidad de la BHE al sodio, con lo que se produce una gran gradiente osmótica entre los compartimientos intravascular e intercelular / intersticial, con lo que hay una contracción del tejido cerebral (donde la BHE está intacta) con un coeficiente de reflección mayor que el del manitol. El suero hipertónico aumenta el volumen circulante, la presión arterial media, restaura el potencial de membrana de las neuronas, mantiene la indemnidad de la BHE y modula la actividad inflamatoria mediante la reducción de la adhesión de los leucocitos al endotelio.
Tiene además efecto en la circulación cerebral y en el metabolismo. Existe evidencia animal de que el efecto en la reducción de la PIC es más duradero en el caso del suero hipertónico respecto del manitol, con una disminución de la PIC más estable.
En trauma el suero hipertónico no ha demostrado una mejora en la sobrevida; sin embargo, en el subgrupo de shock hemorrágico y TEC sí ha demostrado una disminución de la mortalidad y una presión arterial media mayor a la llegada al servicio de urgencia.
ColoidesLa controversia entre cristaloides o coloides viene desde la primera guerra mundial. En teoría, la mayor necesidad de volumen en el caso de los pacientes reanimados con cristaloides versus los reanimados con coloides y la mantención de la presión oncótica hace que sean una interesante opción en los pacientes traumatizados. Esta presión oncótica es ejercida ya que el tamaño de los poros vasculares de aproximadamente 65 Å, por lo que todas las moléculas con peso molecular (PM) mayor a 10000 daltons están impedidas de cruzar al espacio intersticial y de ese modo ejercen su presión oncótica. Existen cuatro tipos de coloides utilizados en clínica.
Albúmina: Es el coloide prototipo, contra el cual es comparado el resto de los coloides. Es una proteína sintetizada en el hígado (representa el 50% de la síntesis hepática: 0,2 g/Kg/día) y que normalmente da cuenta de un 80% de la presión oncótica del plasma. Su pool es de 5g/Kg. Las preparaciones comerciales se obtienen de plasma humano que es calentado y esterilizado por filtración y posteriormente disuelto en suero fisiológico. Lo así obtenido es una solución monodispersa, es decir todas las moléculas poseen el mismo tamaño (69000 KDa).
La infusión de albúmina al 5% resulta en la expansión plasmática del 0.75% del volumen infundido, mientras que la albúmina al 25% expande el plasma 4 a 5 veces. Las ventajas teóricas incluyen la estabilización de la membrana secundario a la neutralización de los radicales libres y el aumento de la capacidad de transporte de algunas drogas y moléculas endógenas. Esto no ha logrado ser demostrado en clínica y no hay una ventaja clara en este aspecto respecto a la utilización de otro tipo de coloide. Su administración se encuentra prácticamente libre de efectos secundarios importantes, sin embargo su alto costo y su riesgo teórico de transmitir enfermedades infecciosas ha llevado al desarrollo de otras macromoléculas con poder oncótico, los denominados coloides sintéticos que tienen menores costos de producción y son moléculas polidispersas, es decir con diferentes pesos moleculares, por lo que se denominan de acuerdo a su peso molecular medio.
Dextranes sintéticos: Son polisacáridos monocuaternarios de origen bacteriano. Existen preparaciones disponibles al 6% de dextran de 70 KDa (peso molecular medio) y 10% dextran de 40 KDa. La expansión de volumen es de 80% y 175%, respectivamente. El efecto intravascular es de 3 a 5 horas y tiene un uso limitado en el manejo del trauma, ya que tiene propiedades antitrombóticas inherentes, pues disminuye la adhesividad plaquetaria y disminuye la actividad del factor VII, con aumento, del tiempo de sangría luego de la administración de 1,5 g/kg de dextran. Además disminuye la viscosidad sanguínea, por lo que es utilizado en situaciones de bajo flujo a nivel microcirculatorio.
Puede desencadenar reacciones de hipersensibilidad.
Gelatinas: Son moléculas colágenas bovinas modificadas, tienen una vida intravascular de 1 a 3 horas y una capacidad de expansión de 70%. Tienen una alta tendencia a las reacciones de hipersensibilidad, sin embargo no alteran la coagulación y no se conocen efectos adversos sobre la coagulación.
Hidroxietilalmidones (HES): Son polímeros de glucosa creados a partir de amilopectinas provenientes de maíz o trigo. Estos polímeros son rápidamente metabolizados por amilasas plasmáticas, por lo que deben ser esterificadas o hidroxiladas en diferentes posiciones de la molécula para permitir una mayor sobrevida intravascular. El porcentaje de moléculas hidroxietiladas presentes en la solución determinará el grado de sustitución molar (una mayor sustitución molar se correlaciona con una mayor vida media). Un segundo factor que determina la vida media de estas moléculas es la posición de la hidroxietilación, ya que la que ocurre en el carbono 2 (C2) es la más frecuente y la más resistente a la degradación, lo que se expresa en la razón C2/C6. Taxonomía de los HES: Dado que existen diferentes moléculas y diferentes orígenes, se ha acordado que lo más razonable es identificar a los diferentes HES de acuerdo a su PM y su grado de sustitución molar, de tal forma que un HES 450/0.7 indica una solución de PM medio de 450 KDa y 70% de molecular hidroxietiladas.
La duración del efecto expansor depende entonces directamente de la tasa de Hidroxietilación, por lo que los HES con grados de sustitución molar de 0.7 pueden tener una vida media de 24 horas. Diversos estudios han mostrado que los efectos de los HES sobre la coagulación son producidos por las moléculas de gran tamaño, que son difíciles de eliminar y están presentes en los HES de PM alto y alto grado de hidroxietilación. Estas alteraciones son un aumento en el tiempo de sangría y disminución del factor VIII.
El efecto de los HES de PM intermedio y bajo grado de hidroxietilación (HES 200/0.5) sobre la coagulación es prácticamente nulo y no sería causa de problemas hemorragíparos. Tienen una vida media de 3 a 6 horas. Estudios militares demuestran que 1 litro de solución ringer expande el plasma en 250 ml luego de 1 hora, mientras que 500 ml de HES expande 800 ml en el mismo periodo de tiempo. Dentro de las ventajas se encuentra una oferta teóricamente ilimitada, sin riesgos de infecciones, bajo costo y efectos secundarios mínimos (escaso efecto anticoagulante, falla renal y acumulación).
Respecto de la disminución de la mortalidad con el uso de coloides en pacientes críticos, se ha realizado una revisión Cochrane. Se argumentó que los coloides de alto peso molecular tendrían una mayor sobrevida en el intravascular, comparado con gelatinas y albúmina. Sin embargo, esto no se refleja en un aumento en la sobrevida con ningún tipo de coloide. Si se reconoce que hay un efecto favorable en cuanto a la mortalidad con el uso de coloides en cristaloides hipertónicos, sin embargo estos resultados pueden ser el resultado del azar.
El estudio SAFE 2004 demostró un riesgo de la albúmina similar al del suero salino y no entregó ningún beneficio extra al uso de albúmina. Además el estudio SAFE desmintió la creencia de que se necesitan menores volúmenes de albumina respecto que a los de cristaloides (la razón fue de 1:1.4). Hay que considerar el alto costo de la albúmina. También existe una revisión Cochrane que pretendió establecer ventajas respecto de algún coloide, sin que quede claro cuál es el que tiene menos complicaciones ni cuál mejora la sobrevida, a pesar de utilizar un criterio duro (mortalidad). Una tercera revisión reciente respecto del uso de coloides en pacientes críticos concluye que tienen un mayor riesgo de falla renal si son administrados en pacientes depletados de volumen, pacientes críticos o con sepsis.
Transfusión de hemoderivados en el politraumatismoNo podemos dejar de mencionar en esta revisión el aporte de hemoderivados, ya que constituyen un pilar en el manejo del volumen en el trauma. Dada la frecuencia y amplia utilización de éstos, nos orientaremos a los productos más utilizados en el contexto de la reanimación, Glóbulos Rojos y Plasma, pero se omitirá los demás porque tienen relación con otro tema que no es objeto de este artículo, la coagulopatía del paciente traumatizado.
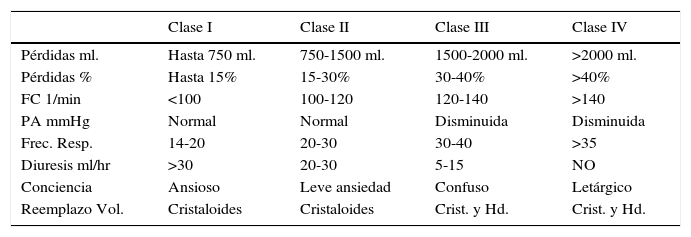
Concentrado de glóbulos Rojos (GR)En la primera fase, el concepto es mantener una volemia suficiente, que permita lograr una presión de perfusión tisular adecuada, lo cual se puede lograr sin necesidad de hemoderivados. En la siguiente tabla se puede observar la orientación clínica de manejo de soluciones de reemplazo sugerida por el ATLS (Tabla 2).
Clasificación atls de pérdidas sanguíneas en base a criterios clínicos
| Clase I | Clase II | Clase III | Clase IV | |
|---|---|---|---|---|
| Pérdidas ml. | Hasta 750 ml. | 750-1500 ml. | 1500-2000 ml. | >2000 ml. |
| Pérdidas % | Hasta 15% | 15-30% | 30-40% | >40% |
| FC 1/min | <100 | 100-120 | 120-140 | >140 |
| PA mmHg | Normal | Normal | Disminuida | Disminuida |
| Frec. Resp. | 14-20 | 20-30 | 30-40 | >35 |
| Diuresis ml/hr | >30 | 20-30 | 5-15 | NO |
| Conciencia | Ansioso | Leve ansiedad | Confuso | Letárgico |
| Reemplazo Vol. | Cristaloides | Cristaloides | Crist. y Hd. | Crist. y Hd. |
Vol. Abrev. FC= Frecuencia Cardíaca, PA= Presión Arterial, Frec. Resp.= Frecuencia Respiratoria, Críst.y Hd.= Cristaloides y Hemoderívados.
No existe una cifra de Hemoglobina recomendada, pero numerosos estudios sugieren un objetivo de Hemoglobina plasmática entre 7 y 9 grs./dl. ya que en esta situación incluso los exámenes de laboratorio no reflejan la realidad cuando el paciente sangra descontroladamente.
Existen algunos estudios y casos clínicos publicados que muestran una alteración en la entrega de oxígeno con hemoglobina de 5 grs.(17), pero si un paciente sangra profusa y rápidamente se sugiere tratar de mantener niveles de hemoglobina de encima de 8 grs./dl., ya que con cantidades inferiores se producen trastornos de la función plaquetaria dada la relación de ésta con la concentración de GR a nivel capilar. Por otra parte, la enzima elastasa de la superficie de los glóbulos rojos participa en la activación del Factor IX, lo que explica otro de los factores de la participación de los GR en la hemostasia. Una situación particular la constituyen los pacientes con trauma de cráneo, en quienes una Hemoglobina cercana a 10 grs./dl mejoraría la oxigenación cerebral (18). Es posible que un paciente, en que la causa de la hemorragia se controla con rapidez como ocurre en algunas situaciones en que el sitio de la hemorragia es fácilmente controlable, se sea más conservador y se pueda aspirar a objetivos de hemoglobina de 6 a 7 grs. sólo manteniendo la volemia sin necesidad de hemoderivados. Es importante recordar que, en todo centro que recibe pacientes traumatizados o realiza grandes cirugías, es indispensable disponer de equipos para recuperar GR del campo quirúrgico para un adecuado manejo transfusional en situación de emergencia. Permite ahorrar transfusiones y disminuir el error transfusional que, en este escenario, posiblemente es mayor pero no sabemos realmente su magnitud porque estos pacientes tienen alta morbimortalidad y probablemente los errores transfusionales no se detectan como causas de complicaciones. Los concentrados de GR además aportan citrato, potasio en altas concentraciones y restos celulares, todo lo cual contribuye a la acidosis, hiperkalemia e hipotermia ya que son almacenados a 4ºC en el laboratorio. Estos elementos deben ser considerados al decidir la transfusión y al utilizar los equipos recuperadores, se pueden verter al equipo las unidades homólogas para lavar los GR con solución fisiológica a 20-25ºC y de esta forma atenuar los efectos deletéreos de la transfusión de GR ya mencionados. La hipocalcemia secundaria a la transfusión de altas concentraciones de Citrato disminuiría, a pesar de que no hay publicaciones específicas en relación a este tópico.
En la condición de emergencia y a pesar de todos los medios tecnológicos, muchas veces necesitamos transfundir GR sin clasificación, en este caso se recomienda GR grupo 0 positivo, y en mujeres 0 negativo.
Plasma fresco congelado (PFC)Todos los pacientes que presentan hemorragias masivas en algún momento de su evolución presentan serios trastornos de la coagulación por pérdida de los factores plasmáticos. Si hay tiempo, esto se puede evidenciar con el apoyo del laboratorio, pero en muchos casos no hay tiempo y debemos proceder al reemplazo de este con transfusiones de PFC en dosis de 15 a 20 ml/Kg. Recientes estudios sugieren administrar precozmente PFC en relaciones incluso de 1:1 con glóbulos rojos, sin embargo, no existen estudios controlados en población civil que permitan entregar una recomendación categórica a este respecto, ya que varios de los estudios se realizaron en población militar y son retrospectivos en su mayoría (24).
El control clínico es importante, ya que esta es una situación extraordinariamente dinámica y la mayoría de las veces el laboratorio va detrás de la clínica. Además debemos considerar que el proceso de descongelación del PFC requiere a lo menos 30 minutos, por lo cual debemos tomar esta decisión precozmente para no retardar el proceso.
Objetivos del reemplazo de volumenEl objetivo primario es garantizar una hemodinamia estable y asegurar una microcirculación suficiente mediante la estabilización del volumen circulante.
Existen diferentes parámetros utilizados para evaluar la eficiencia de la entrega de oxígeno a los tejidos. Estos parámetros pueden ser divididos en tres clases: clínicos, hemodinámicos - transporte de oxígeno y marcadores de laboratorio.
Signos clínicos: Los signos clínicos usados en la evaluación del reemplazo de volumen son la frecuencia cardiaca, la presión arterial y el débito urinario. La hipotensión es un signo tardío que aparece luego de un 40% de pérdida de la volemia. La normalización de estos signos no puede tomarse como una meta en la reanimación, ya que hasta en un 85% de los pacientes que sufren de trauma estos parámetros pueden estar normales (presión arterial normal y débito urinario entre 0,5 y 1 mL/Hg/h). La razón es que el trauma desencadena respuestas neurohormonales que pueden ser suficientes por sí mismas para mantener la presión y frecuencia cardiaca en rangos normales.
Hemodinámicos / transporte de oxígeno: Estos datos se obtienen mediante el uso de catéteres venosos centrales, el Catéter de Arteria Pulmonar y la Ecocardiografía.
Estos entregan datos respecto de llene ventricular o precarga, gasto cardíaco o índice cardíaco, saturación venosa mixta e índice de consumo de oxígeno. La optimización de la entrega de oxígeno y su consumo no ha demostrado mejorar la sobrevida de los pacientes traumatizados en la fase inicial antes de mejorar la causa de la hemorragia.
Laboratorio: La severidad del déficit de base al momento de la admisión se ha correlacionado con mortalidad y morbilidad en pacientes traumatizados. La imposibilidad de barrer acido láctico o disminuir el déficit de base se asocia con el desarrollo de infecciones, síndrome de distrés respiratorio, falla orgánica múltiple y mortalidad.
Soluciones transportadoras de O2Si bien aún se encuentran en fase experimental, es importante recordar que existen soluciones de hemoglobina libre de estroma, con capacidad de transporte de O2 y efecto osmótico. Estas soluciones adolecen de una adecuada capacidad de entrega de O2 a por su gran afinidad a esta molécula. No obstante estas dificultades, constituyen el futuro en el manejo de pacientes con pérdidas hemorrágicas importantes, con soluciones estériles disponibles en la escena del trauma, sin las complicaciones de las transfusiones y con costos no demasiado altos.
DiscusiónLos pacientes traumatizados constituyen un permanente desafío para los equipos de salud. Los sistemas de atención han sido diseñados para lograr un rápido traslado a los centros hospitalarios para poder controlar las hemorragias, que constituyen la principal causa de muerte en estos pacientes. La reposición de fluidos en todas sus formas sigue siendo motivo de discusión entre distintos investigadores.
Sin embargo, poca discusión cabe cuando debemos mantener la hemodinamia en la fase inicial del control de los graves traumatizados y el conocimiento adecuado de las distintas opciones terapéuticas, donde los fluidos en todas sus formas tienen lugar en la mantención de la hemodinamia sumado a otras maniobras como mantener la temperatura corporal y equilibrio ácido-base, permitirán pasar a una fase posterior en la cual sí debemos realizar un análisis más riguroso en relación a la calidad de fluidos a utilizar para evitar daño secundario e incidir en la morbi mortalidad de estos pacientes.
Los autores declaran no tener conflictos de interés, en relación a este artículo.