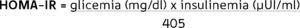La resistencia a la insulina es una condición prevalente generalmente asociada a un estilo de vida no saludable. Se expresa en diferentes vías metabólicas y aumenta el riesgo de patologías de diferentes órganos y sistemas. Las manifestaciones clínicas son esenciales para el diagnóstico de la condición, no siendo necesario los test específicos de laboratorio. La reducción del sobrepeso y el estilo de vida saludable son las medidas terapéuticas más importantes, reservándose el uso de metformina a los casos con alto riesgo de desenlaces clínicos.
Insulin resistance is a prevalent condition commonly associated with unhealthy lifestyle. Such condition affects several metabolic pathways, which increases the risk of abnormalities at different organ and systems level. Clinical findings are essential for the diagnosis of the condition, not being necessary blood testing. Weight reduction in obesity and acquisition of a healthy lifestyle are the most important therapeutic tool. Metformin should be prescribed to individuals at high risk of disease according to clinically validated outcomes.
Se define como resistencia a la insulina (RI) la disminución de la acción de la insulina a nivel celular, lo que produce alteraciones en el metabolismo glucídico, lipídico y proteico. Frente a la RI el páncreas aumenta la secreción de insulina produciendo un estado de ⿿hiperinsulinismo⿿ compensatorio.
Puede ser fisiológica (embarazo, pubertad, adulto mayor) o patológica. En este último caso las causas pueden ser múltiples, incluyendo genéticas, ambientales y secundarias a fármacos o algunas patologías. En general, en aquellas situaciones en que la etiología primaria es genética se presenta con gran severidad y variadas manifestaciones desde temprana edad.
A nivel poblacional la RI está fuertemente asociada a la obesidad, especialmente de predominio abdominal, al sedentarismo y a dietas poco saludables. En este caso existe un aumento en la producción de citoquinas inflamatorias por parte del adipocito visceral (TNF-α, IL-6, PAI-1, resistina, angiotensinógeno) y una disminución de la adiponectina, la que tiene un rol insulinosensibilizante. En este caso la unión de la insulina a su receptor se mantiene conservada, observándose una alteración en la señal post-receptor por efecto de los mediadores inflamatorios mencionados. Finalmente, si bien la vía ⿿metabólica⿿ de la acción insulínica se encuentra comprometida, la vía ⿿anabólica⿿(o mitótica), donde la MAPquinasa juega un rol fundamental, no está afectada, pudiendo incluso exacerbarse 1,2.
La RI participa de la fisiopatología de la diabetes mellitus tipo 2 (DM 2), la dislipidemia aterogénica (colesterol HDL bajo, hipertrigliceridemia y partículas de colesterol LDL pequeñas y densas), la hipertensión arterial esencial (HTA), el sindrome de ovario poliquístico (SOP) y la enfermedad por hígado graso no alcohólico (EHGNA). A través del síndrome metabólico (SM) y el estado proinflamatorio generado por adipoquinas aumenta el riesgo cardiovascular. Con respecto a SOP, la asociación es frecuente (hasta 75% de los casos), pero no se incluye en los criterios diagnósticos y puede no estar presente 3⿿6.
La RI es altamente prevalente y se estima que un tercio de la población adulta occidental la presenta. Este dato es concordante con nuestra última Encuesta Nacional de Salud, en la que un 35% de los adultos la presentan 7.
Su pesquisa se justifica en individuos con riesgo para el desarrollo de DM 2, frente a la presencia de factores de riesgo cardiovascular, en sospecha de EHGNA y en mujeres con SOP.
Es importante aclarar 3 conceptos sobre la condición:
- 1.
No es una enfermedad; si bien su presencia se asocia al desarrollo de diversas patologías, no tiene síntomas específicos y algunos de sus portadores no presentarán problemas asociados.
- 2.
No es lo mismo que ⿿prediabetes⿿; para desarrollar DM 2 no solo se requiere de RI sino de una secreción pancreática de insulina deficiente. Este estado corresponde a la glicemia alterada en ayuno (GAA) y a la intolerancia a la glucosa (IG). A grandes rasgos, 1 de 3 insulino-resistentes desarrolla la enfermedad, siendo generalmente aquellos individuos con antecedentes familiares en primer grado y/o obesidad los de mayor riesgo 8.
- 3.
No es lo mismo que SM; el cual corresponde a la confluencia de varios factores de riesgo cardiovascular asociados fisiopatológicamente a la RI, en un mismo individuo. Para su diagnóstico es recomendable utilizar el criterio ⿿armonizado⿿, que corresponde a la presencia de 3 de los siguientes elementos: alteraciones de la glicemia, colesterol HDL bajo, hipertrigliceridemia, HTA y obesidad abdominal 9. Ya que existe una alta correlación entre RI y SM, generalmente se extrapola la incidencia de SM a la presencia de RI en una población específica, lo que favorece la confusión entre ambos términos.
Este debe establecerse a través de la presencia de manifestaciones (clínicas y de laboratorio) de la condición 10. Estas son:
- a.
Obesidad abdominal: circunferencia abdominal 90cm. para hombres y 80cm. para mujeres.
- b.
Acantosis nigricans
- c.
Hiperglicemia: GAA, IG, DM 2 o diabetes mellitus gestacional (DMG) previa.
- d.
Hipertrigliceridemia: triglicéridos plasmáticos > 150mg/dl (o en tratamiento).
- e.
EHGNA: ya sea imagen radiológica confiable o estudio histológico.
- f.
SOP.
- g.
HTA esencial.
- h.
Colesterol HDL bajo: < 40mg/dl en hombres y < 50mg/dl en mujeres (o en tratamiento).
La presencia de obesidad abdominal junto a cualquiera de ellas, o bien la hiperglicemia sumada a una hipertrigliceridemia, tiene una excelente correlación con RI determinada por clamp euglicémico hiperinsulinémico, método de oro para el diagnóstico de la condición.
En ausencia de datos nacionales, el punto de corte para circunferencia abdominal recomendado actualmente por el Ministerio de Salud es el equivalente al sudeste asiático 9.
Con respecto a los test diagnósticos, estos han sido desarrollados para la investigación y su uso en la práctica clínica debe evitarse. Aún así, en nuestro medio la realización de estos test es habitual. Los más utilizados son el test HOMA (homeostasis model assessment) y la insulinemia post sobrecarga a la glucosa (2hrs. post 75g. de glucosa).
El HOMA, está basado en la medición de la glicemia e insulinemia en un estado basal (ayuno), lo que permite el cálculo de un índice de RI (HOMA-IR) a través de la fórmula:
Para la población chilena se ha determinado que el valor de normalidad se encuentra aproximadamente en 2,6 11.
Con respecto a la medición de insulinemias postcarga, existe consenso en que no debe utilizarse debido su gran variabilidad y ya que los puntos de corte no están validados. En un estudio nacional el punto de corte de 60μUI/ml a las 2hrs., sobrediagnóstica RI en 25% de los individuos 12.
También puede ser utilizada la medición de la insulinemia en ayuna, la que está basada en la respuesta compensatoria pancreática. Se considera a niveles sobre 15μUI/ml como alterados 10.
En caso de embarazo y en menores de 18 años, estos test no están suficientemente validados y generan confusión ya que al ser la RI una situación fisiológica en estos casos, no se conocen los valores que indican una situación patológica.
Con respecto a las técnicas de medición para la insulinemia, presentan una alta variabilidad, por lo que es recomendable mantener una técnica (o laboratorio) cuando se utilicen estos test como objetivos intermedios del tratamiento 13. Por este motivo y dada la evidencia de que en ausencia de manifestaciones de la condición cualquier test tiene baja correlación con el clamp, un valor alterado de cualquiera de ellos no debe ser interpretado como indicador de la condición, siendo necesaria la presencia concomitante de una de las manifestaciones previamente mencionadas para plantear el diagnóstico. (Ver resumen de conceptos en Tabla 1).
CONCEPTOS BÿSICOS SOBRE RI
| 1. A nivel poblacional es una ⿿condición⿿ fisiopatológica, no una enfermedad. |
| 2. Es altamente prevalente, por lo que no debemos sobreactuar en su presencia. |
| 3. En embarazo, pubertad y adultos mayores tiene carácter fisiológico. |
| 4. Se asocia a la aparición de varias patologías ⿿cardiometabólicas⿿. |
| 5. Su pesquisa se justifica en pacientes con estas patologías, o con factores de riesgo para presentarlas. |
| 6. El diagnóstico debe basarse en manifestaciones clínicas o de laboratorio. |
| 7. Los test específicos para la medición de RI están diseñados para la investigación. |
| 8. Estos test deben ser evitados en la práctica clínica rutinaria, ya que su interpretación individual es compleja y puede generar sobrediagnóstico. |
| 9. En ausencia de manifestaciones características, un test alterado no debe interpretarse como indicador de la presencia de la condición. |
Previo a cualquier tratamiento, debe fijarse la meta u objetivo terapéutico. Para RI tradicionalmente se establecen objetivos intermedios tales como disminución de HOMA-IR, circunferencia abdominal, triglicéridos plasmáticos, glicemia, cifras de presión arterial niveles de transaminasas en EHGNA o bien aumento en los niveles de colesterol HDL y mejoría en la ciclicidad ovárica en SOP. También pueden definirse objetivos basados en ⿿desenlaces clínicos⿿, tales como prevención de DM 2, mejoría de la histología hepática (para EHGNA) y fertilidad (para SOP). En la actualidad se cuenta con evidencia suficiente para recomendar los tratamientos que han demostrado efectividad en estos desenlaces.
Debe recalcarse que en SM, el tratamiento específico de la RI, no se ha asociado a una reducción de los eventos cardiovasculares (excepto en diabéticos), por lo que el tratamiento intensivo de cada uno de sus componentes es de gran relevancia. En este caso se recomienda niveles de hemoglobina glicosilada (HbA1c) <7%, niveles de presión arterial óptimos y un colesterol LDL a lo menos <100mg/dl 9.
MEDIDAS NO FARMACOLÿGICASLa reducción del exceso de peso y la promoción del ejercicio físico son las medidas terapéuticas más importantes tanto en objetivos intermedios como en desenlaces clínicos. Se considera como satisfactoria una pérdida del peso corporal de a lo menos 7%.
La evidencia avala este postulado. En los estudios de EE.UU. (DPP) y Finlandia (Finish DPP) para prevención de DM 2, los cambios intensivos de estilo vida se tradujeron en una reducción del riesgo de desarrollar la enfermedad cercano al 60% en un seguimiento de aproximadamente tres años. Los pacientes eran prediabéticos, con obesidad y/o RI y fueron randomizados a alimentación saludable (ajuste calórico, restricción de grasas saturadas y aumento de aporte de fibra dietética) y actividad física aeróbica a lo menos 150 minutos semanales. Estos cambios significaron bajas de peso aproximadas de 6 a 7 kilos el primer año y 4 kilos al finalizar el estudio. En el DPP la reducción de riesgo fue superior a la obtenida con metformina (31%) y se producía en todos los subgrupos estudiados 14,15.
Ya que la RI tiene un carácter crónico, estas medidas deben ser instauradas por tiempo indefinido. (Ver resumen de conceptos de medidas no farmacológicas en Tabla 2.
CONCEPTOS BÿSICOS SOBRE LAS MEDIDAS NO FARMACOLÿGICAS
| 1. La reducción del sobrepeso y la actividad física regular son la medidas más importantes. |
| 2. Es probable que la restricción de grasas saturadas sea el aspecto más importante en los cambios dietarios. En lo posible deben ser reemplazadas. |
| 3. Las dietas bajas en carbohidratos y las basadas en el índice glicémico, son útiles en objetivos intermedios, pero su efectividad en desenlaces clínicos no ha sido demostrada. |
| 4. El alto consumo de fructosa se asocia a la presencia de RI, por lo que su ingesta debe ser moderada. |
| 5. La dieta mediterránea es una excelente opción para pacientes de alto riesgo cardiovascular y metabólico. |
| 6. En pacientes normopeso la actividad física es primordial y supera en efectividad a los cambios dietarios. |
| 7. Con respecto al ejercicio, la recomendación es 150 minutos de actividad aeróbica semanal, idealmente asociada a 2 a 3 sesiones semanales de actividad anaeróbica de corta duración. |
| 8. El ejercicio interválico y de alta intensidad es útil en objetivos intermedios, pero su efectividad en desenlaces clínicos no ha sido demostrada. |
El aporte diario de calorías dependerá del estado nutricional y la actividad física realizada. Para promover pérdida de peso, se recomienda una reducción del aporte calórico en 500 a 1.000cal/día con respecto a las necesidades energéticas. Esta restricción permite una baja de peso de 0.5 a 1kg. por semana hasta la estabilización.
2. Proporción de macronutrientesa. Grasas: Dada su alta densidad energética, su aporte dentro de la dieta debe ser prudente, siendo recomendable no superar más del 30% de las calorías totales diarias. No ha logrado demostrar un efecto independiente en RI ya que en la mayoría de los estudios su restricción se asocia a disminución de peso. En general, aportes menores al 40% de las calorías dietarias no afectan la insulinosensibilidad. Por otro lado, la influencia del tipo de grasa predominante en la dieta sí ha sido establecida. Existe evidencia de que la grasa saturada y trans aumentan la RI y que su restricción favorece una mejoría en la insulinosensibilidad y previene desenlaces clínicos. En los estudios para prevención de DM 2, el aporte de grasas saturadas era <10% de las calorías dietarias, y fue el cambio dietario más importante asociado al éxito de la intervención. Por otro lado, la reducción de los niveles séricos de colesterol LDL secundaria a esta indicación es recomendable para individuos con riesgo cardiovascular. Con respecto a las otras grasas dietarias, las monoinsaturadas mejoran la insulinosensibilidad y tienen un efecto modesto en el perfil lipídico (reducen el colesterol LDL y triglicéridos y elevan el colesterol HDL). Este tipo de grasas se encuentra en paltas, aceitunas, frutos secos y aceite de oliva. Dietas caracterizadas por alto aporte de grasas monoinsaturadas se traducen en una mejoría de la insulinosensibilidad en comparación a un empeoramiento para aquellas con alto aporte de saturadas 16. Se puede obtener un efecto similar reemplazando la grasa saturada por poliinsaturada, aunque con menor impacto sobre RI y lípidos. El aporte de omega 3 (a través de la dieta y no en suplementos) es importante por su efecto reductor en triglicéridos y parámetros inflamatorios.
BENEFICIOS CLÿNICOS DE METFORMINA EN RI (PARA NO DIABÿTICOS)
| Demostrados: |
|---|
| - Prevención de DM 2 en prediabéticos |
| - En SOP reduce los niveles de andrógenos, aumenta el número de embarazos y disminuye el riesgo de OHSS |
| - Mejoría en objetivos intermedios como glicemia, lípidos sanguíneos, niveles de transaminasas y parámetros inflamatorios |
| Controversial: |
| - En SOP, disminución de aborto espontáneo temprano y restauración de ciclicidad ovárica |
| No demostrado: |
| - Mejoría en trastornos cutáneos asociados a hiperandrogenismo como hirsutismo o acné |
| - Mejoría de acantosis nigricans |
| - Baja de peso en normoglicémicos |
| - Prevención eventos cardiovasculares en no diabéticos |
| - Prevención de DM diferentes a la tipo 2 |
| - Mejoría de histología hepática en EHGNA |
b. Carbohidratos (CHO): Este aspecto tiene puntos de alta controversia.
b.1. Cantidad de CHO: La utilización de dietas con bajo aporte de CHO (<40% de las calorías totales diarias) ha demostrado mayor baja de peso a corto plazo en comparación a dietas estándar o con bajo contenido de grasas. Existe evidencia de sus beneficios a nivel de objetivos intermedios como reducción de la glicemia, insulinemia, niveles de transaminasas, triglicéridos y parámetros inflamatorios. Paralelamente, aumenta los niveles de adiponectina y colesterol HDL. Sin embargo, al comparar la baja de peso a largo plazo con dieta baja en grasas o mediterránea, la magnitud es similar. Por otro lado, no existen estudios que avalen su uso en desenlaces clínicos mayores como prevención de DM o eventos cardiovasculares.
b.2. Indice glicémico (IG): Probablemente el aspecto más controversial. Categoriza a los alimentos que contienen CHO según su capacidad de incrementar los niveles de glicemia (e indirectamente de insulinemia). Se determina comparando un alimento determinado con uno de referencia en condiciones isoglucídicas. Se agrupan en 3 categorías: alto, intermedio y bajo. Su medición presenta gran variabilidad inter e intraindividual y depende del tipo de comida donde el alimento es incluido, es decir, un alimento de alto IG puede disminuir su valor al ser incluido en una comida mixta que contenga fibra. Su implementación es compleja y en ocasiones su costo puede resultar elevado. Debe diferenciarse de ⿿carga glicémica⿿ (CG) que representa el impacto de una porción habitual de un alimento con un determinado IG 17. Al respecto, un metanálisis reciente describe una asociación entre la CG y el riesgo de DM 2.
Las dietas basadas en alimentos de bajo IG producen baja de peso significativa a corto plazo y mejorías en parámetros de RI. Al igual que las dietas de bajo contenido de CHO, su efecto a largo plazo en pérdida de peso es similar a la estándar y no ha demostrado efectividad en prevenir eventos clínicos. En el tratamiento para DM 2, la Asociación Americana de Diabetes (ADA) reconoce un efecto modesto, aunque significativo.
b.3 Fructosa: Junto con la glucosa forma la sacarosa (azúcar). Se ocupa ampliamente en bebidas gaseosas y otros productos artificiales endulzados. También se incluye en alimentos denominados ⿿libres de azúcar⿿. Numerosos estudios asocian su consumo con obesidad, RI, dislipidemia aterogénica, riesgo de DM 2 y enfermedad cardiovascular 18. En pacientes diabéticos puede aumentar la glicemia postprandial. Sin embargo, muchos de estos estudios son cuestionados ya que existe asociación entre alto consumo de fructosa y factores de estilo de vida como exceso de calorías totales o sedentarismo. Metaanálisis revelan que su consumo moderado no tendría un efecto negativo para la salud, especialmente en el contexto de un estilo de vida saludable. Consumos de un 13% de las calorías totales diarias pueden ser aceptados.
b.4 Fibra dietética: Está contenida casi exclusivamente en productos vegetales, incluyendo productos de tipo ⿿integrales⿿. Comprende la fibra soluble e insoluble. Se recomienda un consumo de 1:3 entre ellas. Genera disminución de la glicemia e insulinemia después de una carga de glucosa y disminuye los niveles de colesterol LDL, en especial la de tipo soluble. En estudios clínicos ha demostrado beneficios en control metabólico de DM 2, prevención de obesidad y objetivos intermedios para RI. En los estudios DPP su consumo era aproximadamente 15 grs./1.000cal., lo que asociaba a la prevención de DM.
En general, existe consenso en privilegiar el tipo de CHO sobre la cantidad, prefiriendo los de tipo complejo y restringiendo los refinados. Esta recomendación se asocia a un alto consumo de fibra y a una baja CG.
3. Dieta mediterráneaSe caracteriza por un alto aporte de frutas, verduras, frutos secos, legumbres y cereales, bajo consumo de carnes rojas y grasas lácteas, alto consumo de pescados y aceites monoinsaturados (principalmente como aceite de oliva) y un consumo moderado de vino (acompañando las comidas). En los últimos años se ha posicionado como una opción frente a las dietas estándar para el manejo del riesgo cardiometabólico.
Su uso en estudios prospectivos ha demostrado:
- a.
Con ajuste calórico, la reducción de peso es similar a la obtenida con dietas bajas en grasas o CHO a largo plazo.
- b.
Mejoría en parámetros metabólicos como lípidos sanguíneos e insulinemia y parámetros inflamatorios como PCR y niveles de adipoquinas.
- c.
Previene aparición de EHGNA, SM y DM 2. En este último caso el beneficio es independiente de la baja de peso 19.
- d.
En el estudio PREDIMED es efectiva en prevención primaria cardiovascular en pacientes de alto riesgo (incluyendo el subgrupo de obesos abdominales y a los diabéticos tipo 2) y en el estudio de Lyon demostró similar efecto en prevención secundaria 20.
La actividad física es probablemente la medida (aislada) más efectiva para reducir la RI.
Induce la expresión y traslocación del transportador GLUT-4, lo que favorece la utilización periférica de la glucosa. Por otro lado, a través de la producción de mioquinas específicas podría favorecer la secreción de insulina.
Existen múltiples recomendaciones sobre la duración, tipo e intensidad del ejercicio con objetivos terapéuticos, sin embargo el principal problema de nuestro medio es la alta tasa de sedentarismo, por lo que el abandono de este hábito y la introducción de la actividad física es el objetivo principal.
Previo a la recomendación, definiremos brevemente los 2 tipos principales de ejercicio:
- Ejercicio anaeróbico o de fuerza: ejercicios breves pero intensos, basados en la fuerza muscular. Ya que el metabolismo se limita al músculo utilizado y a sus reservas de energía (con bajo requerimiento de oxígeno), la fatiga muscular es de rápida aparición. Ejemplo, levantamiento de pesas.
- Ejercicio aeróbico o cardiovascular: se trata de una actividad de menor intensidad, pero de duración prolongada y con escasas interrupciones. La fatiga muscular es tardía. Ejemplo: trote.
1. Beneficios clínicos de la actividad físicaEs parte del tratamiento integral de cualquier tratamiento para perder peso. Su valor es relativo en etapas tempranas, pero es clave en el periodo de mantención. Esta mantención es más efectiva cuando se combinan ejercicios aeróbicos con anaeróbicos, en comparación al uso exclusivo del primero. En el caso de ejercicio anaérobico exclusivo, existe poca evidencia con respecto a pérdida de peso, pero puede ser una alternativa en mejoría de factores de riesgo cardiovascular.
Es de gran importancia en la prevención de DM 2 en individuos de alto riesgo (prediabéticos). En los estudios DPP y DPS se practicaba actividad física aeróbica 30 minutos a lo menos 5 veces por semana y en el estudio Da Qing se comparó con una intervención dietaria, obteniendo un 46% vs 31% de reducción de riesgo para desarrollo de la enfermedad 21.
Finalmente, el impacto sobre parámetros metabólicos es mayor que el esperado para la pérdida de peso, por lo que en individuos de peso normal es la medida más eficaz para la corrección de RI. Similar situación ocurre en los casos de aumento significativo de peso o grasa corporal dentro de rangos de IMC normal, donde puede ser más efectiva que la restricción calórica.
2. Recomendaciones generalesPrevio a una indicación de actividad física, debe evaluarse la capacidad funcional, la condición física y descartar patología cardiovascular en individuos de riesgo. Esto es fundamental para que el trabajo indicado sea adecuado, cumpla el objetivo terapéutico y no se presenten complicaciones.
En general:
- a.
Deben practicarse 150 minutos de actividad física aeróbica moderada, como caminata enérgica, trote liviano, ciclismo recreativo, o equivalente.
- b.
En lo posible debe asociarse a ejercicio anaeróbico. Este puede ser implementado en 2 a 3 sesiones semanales de corta duración con sets de 8 a 10 repeticiones con una intensidad mayor del 60% de 1-RM (que corresponde a la máxima carga que puede ser levantada de una vez a través de un rango completo del movimiento). Esta práctica permite una mejor relación masa grasa/magra, con conservación del último compartimento.
- c.
Existen otras alternativas de mayor intensidad, tales como el ejercicio interválico (por ejemplo, carreras y pausas de recuperación por 20 minutos) y de sobrecarga (por ejemplo, 5 ejercicios diferentes de sobrecarga durante 1 minuto, 3 veces por sesión). Se realiza 2 veces por semana. Su utilidad radica en el poco tiempo requerido y sus efectos en factores de riesgo cardiovascular. En mujeres prediabéticas con exceso de peso, un estudio nacional demostró mejoría significativa de la capacidad funcional, glicemia, insulinemia y HOMA-IR, pese a no observarse pérdida significativa de peso 22.
Finalmente discutiremos brevemente el uso de fármacos para RI. Los insulinosensibilizantes disponibles son metformina y las tiazolidinedionas (o glitazonas).
La metformina aumenta los niveles de AMPK (AMP-activated protein kinase) lo que conduce a la traslocación del transportador GLUT-4, aumentando la captación muscular de glucosa. Además disminuye la producción hepática de la misma y disminuye algunos de los parámetros proinflamatorios alterados en RI. Se asocia a baja de peso solo en pacientes con DM 2 y prediabetes. Su principal reacción adversa es la intolerancia digestiva y está contraindicada si el clearence de creatinina es <30ml/min.
Las glitazonas (rosiglitazona y pioglitazona) son agonistas de los receptores nucleares PPAR-gamma y promueven la expresión de diversos genes involucrados en el metabolismo de la glucosa y de lípidos. De esta forma favorecen la maduración del adipocito, disminuyendo los viscerales y aumentado los periféricos, lo que conlleva una disminución de ácidos grasos libres. Aumentan los niveles de adiponectina y GLUT-4. Tienen variadas reacciones adversas tales como retención hídrica, aumento de peso, anemia leve y mayor riesgo de fracturas. Para pioglitazona se ha descrito aumento del riesgo de cáncer vesical y para rosiglitazona un controversial aumento del riesgo cardiovascular en diabéticos tipo 2.
Pese a la alta efectividad de las glitazonas en RI (prevención de DM 2 en una magnitud similar al estilo de vida saludable y mejoría de histología hepática en EHGNA), dado su costo y reacciones adversas su uso se reserva a pacientes diabéticos y casos especiales 23,24. De esta forma, el fármaco de elección es la metformina.
La indicación de metformina en diabéticos tipo 2 es indiscutible, pero su utilización en otras situaciones es controversial. Recomendamos su uso en aquellos casos donde ha demostrado mejoría en desenlaces clínicos:
- a.
Prevención de DM 2 en prediabéticos, especialmente en menores de 45 años y/o IMC35kg/mt215,25.
- b.
En SOP, cuando se asocie a RI y exista deseo de fertilidad. En este caso aumenta la posibilidad de embarazo y disminuye la aparición del síndrome de hiperestimulación ovárica (OHSS). Si bien reduce los niveles de andrógenos su uso no se justifica en todas las pacientes 26⿿28.
En ambos casos debe indicarse la dosis terapéutica (1,5 a 2g.) o bien la mayor dosis tolerada. Se recomienda iniciar dosis bajas y aumentarla paulatinamente, ya que induce una mejor tolerancia digestiva.
En prediabéticos debe utilizarse por tiempo indefinido y en SOP debe iniciarse previo a la concepción, pudiendo ser mantenida durante todo el embarazo (fármaco categoría B). En menores de 12 años la metformina está aprobada solo para ser usada en diabéticos tipo 2 y sobre los 10 años de edad.
CONCLUSIONESLa RI es una condición fisiopatológica asociada al desarrollo de diferentes patologías cardiometabólicas. El diagnóstico no debe basarse en test específicos sino en la presencia de manifestaciones clínicas y de laboratorio. Aunque no debe ser considerada una enfermedad, deben instaurarse medidas terapéuticas para reducir el riesgo de eventos clínicos. La evidencia muestra que la reducción del sobrepeso, la alimentación saludable y la actividad física son altamente efectivas con este objetivo. El uso de metformina es útil en pacientes prediabéticos y en mujeres con SOP que busquen fertilidad.
El autor declara no tener conflictos de interés, en relación a este artículo.