La restricción del crecimiento intrauterino es una importante causa de morbilidad y mortalidad perinatal, con consecuencias que pueden tener implicancias hasta en la vida adulta. No existen estrategias terapéuticas a la fecha por lo que, su manejo consiste principalmente en su diagnóstico y seguimiento para definir el momento de finalizar el embarazo, equilibrando los riesgos de prematurez con la morbimortalidad esperada para cada condición fetal. En el presente artículo se describen las claves del diagnóstico, clasificación y seguimiento de acuerdo a estándares actuales que permitan el adecuado manejo clínico.
Intrauterine growth restriction is a major cause of perinatal morbidity and mortality with consequences that may have implications even in adulthood. No treatment have currently available, so, management is mainly based in diagnosis and monitoring in order to choose the right time to delivery, balancing the risks of prematurity with the expected morbidity and mortality. A precise diagnosis, classification and fetal surveillance according to current standards is discussed.
El crecimiento fetal anormal durante la gestación ha sido asociado a mayor morbimortalidad perinatal, causada como consecuencia directa de los cambios fisiopatológicos que determinan esta condición así como la prematuridad asociada a su manejo. Un adecuado diagnóstico y vigilancia antenatal son fundamentales para disminuir su impacto perinatal a mediano y largo plazo.
El crecimiento fetal normal está regulado por factores maternos, fetales y placentarios. El normal comportamiento de estos tres factores permite al feto obtener un crecimiento en talla y peso genéticamente predeterminado.
Paralela a la morbilidad perinatal, existe evidencia que asocia la restricción de crecimiento intrauterino con importantes alteraciones en la vida adulta tanto metabólica como cardiovascular (1). Incluso ya en la infancia ha sido posible observar alteraciones en el desarrollo neurológico y cardiovascular (2).
Históricamente el manejo de esta condición se ha centrado en evitar resultados perinatales severos, como muerte fetal in utero(3). En la medida que se tenga el conocimiento y conciencia sobre cómo es posible interferir además, en resultados no neonatales, se estará en presencia de un cambio de concepto y manejo de la restricción de crecimiento.
DefiniciónSe define como Restricción de Crecimiento Fetal (RCF), la condición por la cual un feto no expresa su potencialidad genética de crecimiento. En términos operativos, existe consenso en incluir como grupo estudio a todos aquellos fetos cuyo percentil de crecimiento sea menor a 10, sub clasificándolos en diferentes categorías según su fisiopatología y severidad (4).
ClasificaciónFisiopatológicamente, se debe diferenciar a los fetos constitucionalmente pequeños -que serán denominados Pequeños para Edad Gestacional (PEG)- de aquellos cuyo potencial genético de crecimiento se ha visto limitado (patológicos), descritos con el nombre Restricción del Crecimiento Fetal (RCF). Del grupo patológico se debe diferenciar entre el secundario a insuficiencia placentaria y los secundarios a daño fetal o placentario intrínseco, como genopatías o infecciones.
El grupo de principal interés en el manejo perinatal es el secundario a insuficiencia placentaria. Este grupo, según la edad gestacional de presentación, se clasifica en:
- a)
Precoces a aquellos cuadros evidenciados antes de las 34 semanas y
- b)
Tardíos, cuando ocurren después de esa edad gestacional. La fisiopatología, monitorización, finalización de la gestación y pronóstico de las restricciones del crecimieto fetal precoces y tardías son diferentes.
Los casos de inicio precoz tienden a ser más severos, representan un 20–30% de las RCF, se asocian a preeclampsia hasta en 50% y su morbilidad y mortalidad perinatal es alta, dado la prematurez asociada. Destacan dos principales causas: una que agrupa infección, anomalías cromosómicas o genéticas como factores patológicos intrínsecos del feto y otra, la secundaria a insuficiencia placentaria severa. En estos casos el Doppler umbilical presenta muy buena sensibilidad siendo útil para su diagnóstico y monitorización. Son casos graves, que generan prematuridad, con mal pronóstico y por lo tanto, el desafío es la monitorización y decisión de cuándo finalizar la gestación, equilibrando mortalidad versus prematuridad.
Los de aparición tardía, de más de 34 semanas y en especial los de término, representan el 70–80% de las RCF. Su asociación con preeclampsia es baja (10 %), tienen habitualmente su origen en una insuficiencia placentaria leve y en este subgrupo el Doppler umbilical tiene una sensibilidad baja (<30%) y habitualmente es normal. En este grupo, el principal reto es el diagnóstico, considerando que puede explicar hasta un 50% de las muertes perinatales cercanas al término por su baja tolerancia a la hipoxia. Están asociados a mayor morbilidad, en especial metabólica y neurológica en la vida adulta y pueden pasar clínicamente desapercibidos.
De este modo, la RCIU precoz es de diagnóstico fácil y su reto es la monitorización y la RCIU tardía, el desafío está en el diagnóstico. Las principales diferencias de estas dos condiciones se muestran en la tabla 1.
Diagnostico y clasificación de retardo de crecimiento fetal
| Rciu precoz | Rciutardío |
|---|---|
| Problema: Manejo | Problema: Diagnóstico |
| Alto grado insuficiencia placenta ria | Bajo grado insuficiencia placentaria |
| Hipoxia franca: Adaptación cardiovascular sistémica | Hipoxia moderada: Adaptación cardiovascular central |
| Feto inmaduro con tolerancia hipoxia alta: historia natural | Feto maduro con tolerancia hipoxia baja: escasa o nula historia natural |
| Baja prevalencia, pero alta mortalidad y morbilidad | Baja mortalidad, pero causa mayor de FMIU y alta morbilidad neurológica, alta prevalencia |
Francesc Figueras Eduard Gratacós. Update on the Diagnosis and Classification of Fetal Growth Restriction and Proposal ofa Stage-Based Management Protocol. Fetal Diagn Ther. 2014 Jan 23.
Nos concentraremos exclusivamente en la fisiopatología de la RCF por insuficiencia placentaria. Una anomalía en la placentación determina un déficit de transporte de oxígeno y nutrientes y activa en el feto una serie de mecanismos de adaptación no perfectamente entendidos y que incluyen cambios metabólicos, endocrinos, hematológicos, cardiovasculares y también en el comportamiento fetal. Entre los eventos hemodinámicos, se puede observar una vasodilatación de territorio cerebral que busca privilegiar flujo sanguíneo altamente oxigenado hacia en territorio encefálico. Paralelamente y conforme ocurre un mayor deterioro fetal, el flujo de la Arteria Umbilical (AU), varía desde la normalidad a un aumento de resistencia mediante la disminución progresiva del flujo en diástole, que puede progresar hasta el flujo diastólico cero y finalmente el flujo diastólico reverso.
Un aumento de la postcarga del ventrículo derecho sumado a una disfunción ventricular, llevan a un significativo aumento de la precarga, que tiene su expresión clínica en la alteración de flujos venosos precordiales como ductus venoso y vena umbilical. La alteración en estos vasos pone el sello diagnóstico de disfunción cardiaca fetal en etapas avanzadas de deterioro fetal.
PredicciónPara predecir RCF se han utilizado diferentes estrategias como historia obstétrica previa, hallazgos en el embarazo actual, estudio Doppler de arterias uterinas (AUt) en primer y segundo trimestre y pruebas bioquímicas en sangre materna en primer trimestre, así como combinaciones de las anteriores.
Factores de riesgo en la historia son antecedente de RCF en embarazo previos, historia de pérdida reproductiva, en especial en segundo y tercer trimestre, enfermedad crónica que cause potencial daño vascular como diabetes, hipertensión crónica, lupus eritematoso sistémico u otras mesenquimopatías, trombofilias, consumo de tabaco y otras drogas, desarrollo de algunas infecciones maternas en especial citomegalovirus, toxoplasma y rubeola, pobre ganancia de peso durante el embarazo, hemoglobinopatías, embarazo múltiple, aneuploidias, anomalías placentarias como placenta previa y hemangiomas placentarios (5).
La persistencia de valores elevados en índices de resistencia de las arterias uterinas han sido asociados a desarrollo de RCF junto a preeclampsia y otros resultados adversos como muerte fetal in utero, desprendimiento prematuro de placenta normoinserta y parto prematuro. Desafortunadamente su sensibilidad para RCF es limitada por lo que, se ha intentado mezclar con otros factores para mejorar la sensibilidad (6).
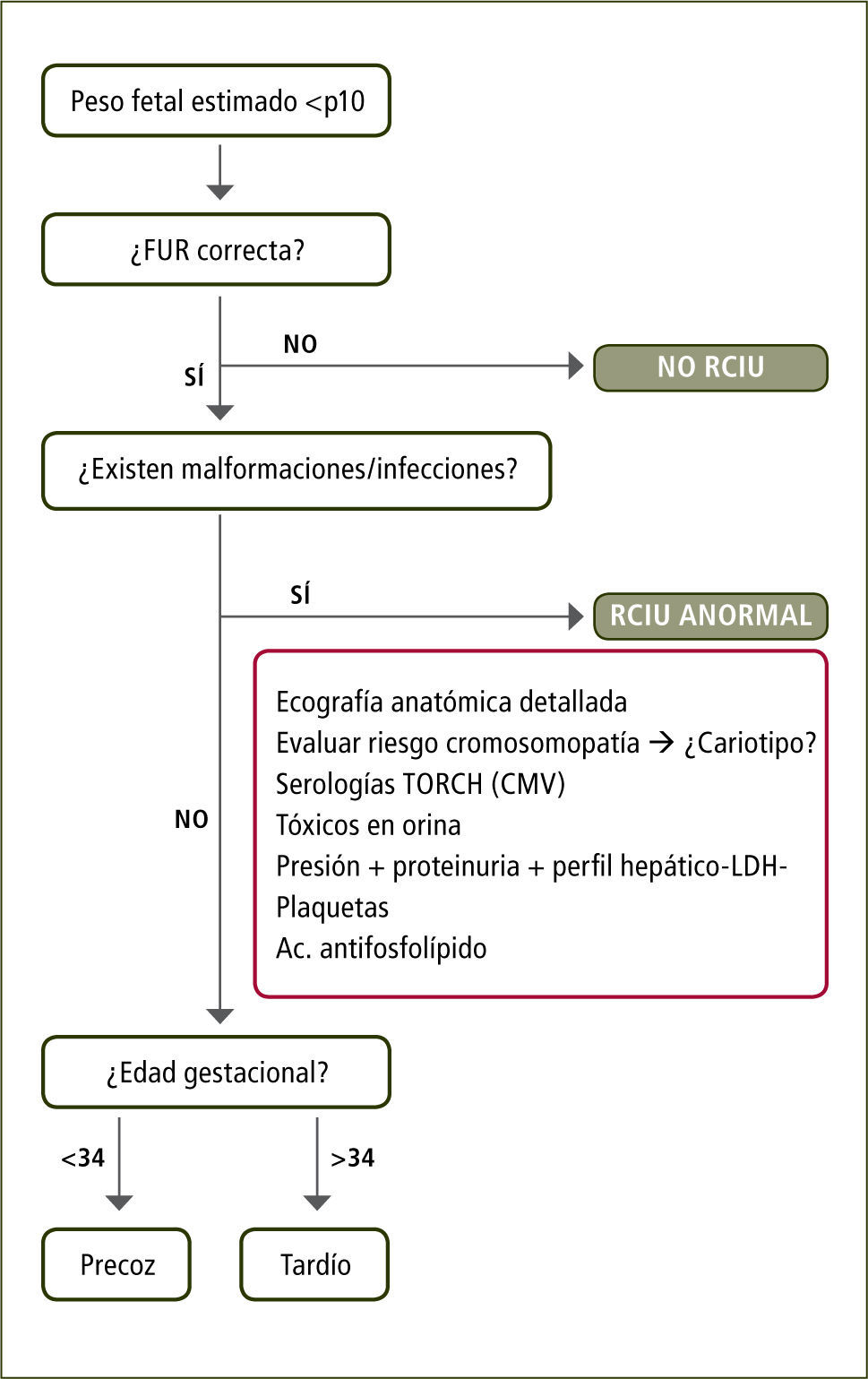
DiagnósticoUn elemento fundamental para formular el diagnóstico de RCF es el cálculo adecuado de la edad gestacional.
El examen clínico de la altura uterina ha sido históricamente utilizado como screening sin embargo, su sensibilidad para RCF es sólo del 30%. Su uso masivo se justifica considerando que su costo es muy bajo.
La ecografía de rutina y su utilización, en conjunto con tablas de crecimiento adecuadas para la población estudiada, es el estándar de oro para la valoración de peso fetal. La mejor tabla de crecimiento para uso como referencia, es la creada con datos locales propios de la población en estudio idealmente con curvas de peso fetal y no neonatal (7).
Una vez establecido un peso fetal estimado bajo el percentil 10, es necesario diferenciar entre pequeño sano, denominado Pequeño para la Edad Gestacional (PEG) o patológico, denominado Restricción del Crecimiento Fetal (RCF) (8).
El primer paso es descartar patología intrínseca fetal o placentaria mediante una valoración anatómica detallada, incluyendo evaluación acuciosa de corazón fetal, revisión de resultados en ecografía de 11–14 semanas, incluyendo el aspecto de la placenta.
En casos severos se debe descartar etiología infecciosa, estudiando rubeola, toxoplasma y citomagalovirus. Se debe considerar un estudio cromosómico, en especial cuando el tamizaje para aneuploidias 11–14 es sospechoso y más aún, en presencia de alguna malformación asociada con polihidroamnios.
Es importante completar la historia materna buscando descartar hipertensión arterial asociada y preeclampsia asociada.
Si bien la evidencia no justifica un estudio sistemático en todos las RCF, el estudio de anticuerpos antifosfolípidos u otras trombofilias, debe ser considerado en los casos muy severos, en especial si aparecen otros elementos sugerentes en la historia como antecedentes familiares, fenómenos trombóticos previos, antecedente de pérdida reproductiva, historia de desprendimiento de placenta normoinserta o concomitancia con preeeclampsia de inicio precoz.
Históricamente el estudio por velocimetría Doppler se basó en Arteria Umbilical (AU) considerando que existe evidencia suficiente para afirmar que su utilización mejora el pronóstico perinatal en este grupo de pacientes. La evidencia actual sugiere que la utilización de resistencia en arteria cerebral media (ACM), la relación cerebro/ placentario (ACM/AU), arterias uterinas (AUt) y crecimiento fetal bajo el percentil 3, permite mejorar la identificación de los verdaderos RCF, es decir, aquel grupo de fetos bajo el percentil 10 que tienen resultado perinatal adverso. Posiblemente en el futuro se agregarán otros marcadores para RCF dentro del grupo de PEG que permitan mejorar la clasificación, considerando que este grupo también reporta resultado perinatal adverso en comparación con los fetos adecuados para la edad gestacional (AEG).
En resumen se pueden diferenciar tres grupos:
- •
Pequeño para Edad Gestacional (PEG) normal, creciendo entre percentiles mayor a 3 y menor a 10 con estudio Doppler normal
- •
PEG anormal cuando existe una anomalía intrínseca fetal como causa genética o infecciosa
- •
Restricción de Crecimiento Fetal (RCF), cuando existe Doppler alterado o curva de crecimiento bajo percentil 3
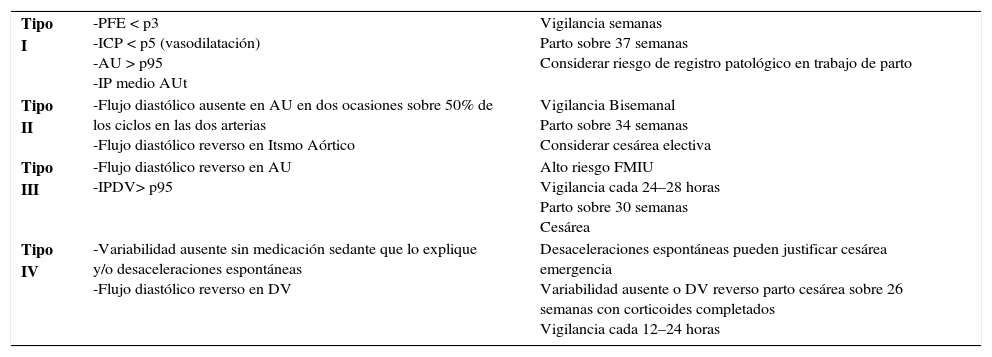
Dentro del grupo de RCF se han sugerido varias clasificaciones, como la utilizada por el grupo de trabajo del Hospital Clinic de Barcelona (tabla 2).
Clasificación restricción de crecimiento fetal y manejo sugerido
| Tipo I | -PFE < p3 -ICP < p5 (vasodilatación) -AU > p95 -IP medio AUt | Vigilancia semanas Parto sobre 37 semanas Considerar riesgo de registro patológico en trabajo de parto |
| Tipo II | -Flujo diastólico ausente en AU en dos ocasiones sobre 50% de los ciclos en las dos arterias -Flujo diastólico reverso en Itsmo Aórtico | Vigilancia Bisemanal Parto sobre 34 semanas Considerar cesárea electiva |
| Tipo III | -Flujo diastólico reverso en AU -IPDV> p95 | Alto riesgo FMIU Vigilancia cada 24–28 horas Parto sobre 30 semanas Cesárea |
| Tipo IV | -Variabilidad ausente sin medicación sedante que lo explique y/o desaceleraciones espontáneas -Flujo diastólico reverso en DV | Desaceleraciones espontáneas pueden justificar cesárea emergencia Variabilidad ausente o DV reverso parto cesárea sobre 26 semanas con corticoides completados Vigilancia cada 12–24 horas |
PFE: Peso Fetal Estimado. p3: percentil 3. IP: Índice Pulsatilidad. AU: Arteria Umbilical. ACM: Arteria Cerebral Media. AUt:Arterias uterinas. ICP: Índice Cerebroplacen-tario. DV: Ductus Venoso. Todos los Doppler deben ser confirmados en dos evaluaciones, idealmente separadas por al menos 12 horas. Intervalos de evaluación recomendados son en ausencia de preeclampsia severa. Edad gestacional 26 semanas o menos se puede adaptar de acuerdo a expectativas de padres y/o estadísticas de sobrevida locales.
Aquellos fetos PEG con Doppler normal, en los cuales fueron descartadas anomalías estructurales así como marcadores fetales o placentarios que orienten a causa genética o infecciosa, podrán ser citados a control de crecimiento fetal en dos semanas para nueva valoración de ausencia de patología.
En caso de PEG anormales se debe orientar el manejo y consejería según el diagnóstico obtenido. El eje central del manejo de la RCF consistirá en valorar en qué momento el término del embarazo aporta un beneficio mayor que la prematuridad. El seguimiento y control se basa en parámetros biofísicos y velocimetría Doppler. Existe evidencia de alteración secuencial de estos parámetros de manera paralela al estado acido base fetal. La respuesta fetal a la hipoxia secundaria a disfunción placentaria puede ser subdividida en temprana y tardía.
Arteria umbilicalLa arteria umbilical ha sido el parámetro históricamente más utilizado en el manejo de RCF, por ser útil tanto en su diagnóstico para los casos severos como en el seguimiento. Presenta un deterioro progresivo y predecible conforme disminuye la superficie de intercambio placentaria, que va desde el aumento de resistencia hasta el flujo diastólico ausente o reverso. El uso de arteria umbilical en RCF ha sido asociado a menor mortalidad perinatal.
En las RCF precoces existe una buena correlación temporal y progresiva entre el flujo diastólico ausente o reverso y los eventos finales antes de la muerte fetal. Cercanos al término estos cambios vasculares pueden ser menos evidentes. Su normalidad se asocia a ausencia de mortalidad perinatal pero se debe tener en cuenta que muchas de las respuestas adaptativas ya han comenzado antes de visualizar cambios en la arteria umbilical (9).
Arteria uterinaSu principal utilidad radica en la predicción y orientación diagnóstica de RCF, considerando que el eje central de la fisiopatología de la RCF por insuficiencia placentaria se puede identificar a través de la resistencia al flujo anormalmente elevado en la ecografía de cribado. Por otro lado, en el grupo de fetos que crecen bajo el percentil 10, su anormalidad ha sido asociada con peor resultado perinatal y por tanto, posiciona a esos fetos en el grupo de RCF (24).
Arteria cerebral media (ACM) y relación cerebro/placentaria (RCP)Permite identificar el fenómeno de redistribución de flujos ante la hipoxia fetal, objetivando vasodilatación del territorio cerebral.
De gran valor en el manejo de RCF tardía, identifica fetos con resultado perinatal adverso con incremento del riesgo de cesárea de urgencia por registro patológico o menor competencia en desarrollo sicomotor a los dos años de vida (10).
Su valoración se puede interpretar de manera aislada como índices de resistencia menores al percentil 5 para la edad gestacional o en combinación con arteria umbilical en el denominado Índice Cerebro Placentario (ICP). Este último mejora la sensibilidad, considerando que el proceso de aumento de resistencia umbilical (placentaria) y de vasodilatación son continuos (11,12).
Flujos venososEl ductus venoso es una buena forma de evaluar la disfunción cardiaca derecha asociada a hipoxia y acidemia durante la contracción atrial, donde el flujo anterógrado de la onda “a” puede verse progresivamente comprometido hasta llegar a cero o reverso. Es el mejor predictor de riesgo de muerte fetal en RCF. Onda “a” ausente o reversa se relaciona con mortalidad perinatal independientemente de la edad gestacional por lo que, se considera una indicación de parto para toda edad gestacional si los corticoides han sido administrados. En un 90% de los casos predice entre 48 y 72 horas el deterioro del perfil biofísico. El aumento de resistencia sobre p 95 del ductus venoso también se asocia a alto riesgo de mortalidad pero con menor consistencia que onda “a” reversa o ausente (13). Su valoración es de gran utilidad en el manejo de RCF precoces con alteración de la arteria umbilical.
Itsmo aórtico (IAO)Normalmente el itsmo aórtico tiene flujo anterógrado. En la medida que disminuye la resistencia en territorio cerebral (vasodilatación) y aumenta la resistencia en territorio placentario puede aparecer flujo reverso en diástole, lo que ha sido asociado con mal resultado perinatal (14). Si bien en RCF temprano está asociado a mayor morbilidad neurológica y puede preceder a la alteración del ductus venoso, su utilidad clínica en este grupo aún es limitada. Por el contrario en RCF tardío, si bien se afecta con menor probabilidad es un promisorio diferenciador de conducta perinatal (15).
Registro electrónico fetalA pesar de que su interpretación ha sido objeto de múltiples intentos de estandarización, mantiene una importante variabilidad intra e interobservador. Su utilidad clínica es dada principalmente por su alto valor predictivo negativo para ausencia de hipoxemia sin embargo, un resultado anormal “no reactivo” se debe considerar como inespecífico dada su alta tasa de falsos positivos. Cuando se utiliza registro computarizado, la disminución de variabilidad a corto plazo ha sido relacionada con acidosis (16).
Perfil biofísico fetalEstá basado en un conjunto de variables biofísicas, junto al registro electrónico de la frecuencia cardíaca fetal. Se asocia con acidemia fetal pero con altas tasas de falsos positivos. Su eficacia no ha sido mostrada en evaluación de embarazos de alto riesgo y su utilidad es discutible cuando se dispone de evaluación por Doppler (17–19).
ManejoLas estrategias de manejo deben considerar como eje central un equilibrio entre el riesgo de mortalidad intrauterina y secuelas asociadas de corto a largo plazo versus la morbimortalidad por prematuridad potencial (20). Diferentes estrategias de manejo han sido propuestas en base a lo anterior. En edades gestacionales extremas es especialmente necesario considerar las expectativas de los padres. La figura 1 presenta una estrategia de manejo.
PrevenciónMúltiples estrategias han sido propuestas en la prevención de RCF como patología isquémica placentaria. A la fecha, sólo la aspirina (100mg/día) iniciada antes de la semana 16 en pacientes con riesgo de preeclampsia, ha generado beneficios de interpretación variable en la prevención de RCF (21–23).
El autor declara no tener conflictos de interés, en relación a este artículo.