El síndrome antifosfolípido (SAF) es una enfermedad autoinmune caracterizada por la aparición de trombosis, complicaciones obstétricas y la presencia de anticuerpos antifosfolípidos. El objetivo de este estudio fue evaluar los resultados obstétricos en gestantes diagnosticadas de síndrome antifosfolípido, así como evaluar las condiciones que podrían influir en estos resultados.
Material y métodosSe realizó un estudio retrospectivo de gestantes con diagnóstico previo de SAF, que fueron atendidas en nuestro centro entre los años 2007 y 2017.
ResultadosEn el período de estudio se recogieron 35 gestantes con SAF, con un total de 50 gestaciones. Se empleó heparina en el 100% de las gestaciones y ácido acetilsalicílico en el 96%. La aparición de alguna complicación obstétrica ocurrió en el 34% de las gestaciones estudiadas. El perfil de anticuerpos triple positivo se asoció a mayor porcentaje de partos prematuros. La presencia de anticoagulante lúpico de forma aislada no se asoció a peores resultados obstétricos.
DiscusiónLa gestación en la mujer con SAF supone un importante reto, que precisa de un manejo multidisciplinar por parte del obstetra y el reumatólogo. Por otro lado, el perfil de anticuerpos antifosfolípidos podría detectar a las pacientes con mayor riesgo con el fin de adecuar el tratamiento y mejorar los resultados obstétricos.
The antiphospholipid syndrome (APS) is an autoinmune disease characterized by the occurence of thrombosis, obstetric morbidity and the presence of antiphospholipid antibodies. The aim of this study was to evaluate the obstetric outcomes in pregnant women diagnosed of antiphospholipid syndrome, as well as examine the conditions which may influence in those results.
Materials and methodsA retrospective study was undertaken with pregnant women diagnosed of APS, who were attended in our hospital between 2007 and 2017.
ResultsDuring the period of study 35 patients with APS and a sum of 50 pregnancies were gathered. Heparin was used in all pregnancies and acetylsalicylic acid in 96%. Any adverse obstetric outcome occurred in 34% of the pregnancies in the study. The triple positivity of antiphospholipid antibodies was associated to higher percentage of premature deliveries. The lupus anticoagulant alone was not related to worse obstetric outcomes.
ConclusionsPregnancy in APS patients means a challenge, requiring a multidisciplinary management by Obstetricians and Rheumathologists. On the other hand, the antiphospholipid antibodies profile could help to recognize those patients at risk, in order to adequate treatment and improve obstetric results.
El síndrome antifosfolípido (SAF) es una enfermedad autoinmune reumatológica sistémica que se caracteriza por la presencia de anticuerpos antifosfolípidos (AAF), la aparición de trombosis arteriales y/o venosas y el desarrollo de complicaciones obstétricas. Su incidencia es relativamente baja, afectando con mayor frecuencia a mujeres jóvenes en edad fértil1. Habitualmente, se presenta como una patología aislada (SAF primario) pero puede asociarse a otra enfermedad autoinmune (SAF secundario), generalmente el lupus eritematoso sistémico (LES)2.
La gestación en la mujer con SAF supone un importante reto. El conocimiento sobre la seguridad de los fármacos, el efecto de la gestación sobre la enfermedad, la influencia de la enfermedad sobre el embarazo, el asesoramiento preconcepcional y la participación de un equipo multidisciplinario constituyen los pilares básicos para brindar una atención obstétrica y médica efectiva y segura. Por ello, el manejo precoz del síndrome antifosfolípido en la gestación resulta de gran importancia ya que permite realizar un adecuado control de las pacientes y minimizar las posibles complicaciones mediante el tratamiento temprano con ácido acetilsalicílico (AAS) y heparina de bajo peso molecular (HBPM) así como por un estrecho control por parte del obstetra y el reumatólogo3.
El objetivo de este estudio fue evaluar los resultados obstétricos en gestantes con diagnóstico de síndrome antifosfolípido previo a la gestación, así como evaluar las condiciones que podrían influir en estos resultados.
2MATERIAL Y MÉTODOSSe realizó un estudio descriptivo retrospectivo sobre una serie de 35 gestantes con diagnóstico de SAF. La información fue recogida a partir de los datos registrados en las historias clínicas de las pacientes y los datos ecográficos prenatales en el programa informático Astraia (Astraia Software GmbH, Occamstr. Munich, Germany).
En la mayoría de los casos, los criterios utilizados para el diagnóstico de SAF fueron los establecidos por la Sociedad Internacional de Trombosis y Hemostasia en la reunión celebrada en Sydney en el año 2006 (Tabla 1). Concretamente 30 pacientes cumplían con al menos 1 criterio clínico junto con al menos 1 de laboratorio para su diagnóstico4.
Criterios de clasificación del SAF actualizados por la Sociedad Internacional de Trombosis y Hemostasia en Sydney
| CRITERIOS CLÍNICOS | |
|---|---|
| Trombosis vascular | Episodio de trombosis arterial, venosa o de pequeños vasos en cualquier tejido u órgano. La trombosis debe ser confirmada por criterios objetivos validados: hallazgos inequívocos de diagnóstico por imagen o mediante examen histológico, sin evidencia significativa de vasculitis. |
| Complicaciones obstétricas | Aborto recurrente: ≥3 abortos espontáneos consecutivos no explicados de fetos anatómicamente normales, <10 semanas de gestación tras haber excluido alteraciones maternas anatómicas, hormonales, así como alteraciones cromosómicas maternas y paternas. |
| Al menos 1 muerte no explicada de un feto morfológicamente normal de ≥10 semanas de gestación, con morfología fetal normal documentada por ultrasonidos o por examen directo del feto. | |
| Al menos 1 nacimiento prematuro de un recién nacido morfológicamente normal y de edad gestacional <34 semanas, debido a eclampsia o preeclampsia grave o hallazgos reconocidos de insuficiencia placentaria. | |
| CRITERIOS DE LABORATORIO | |
| Anticoagulante lúpico (AL) | En el plasma, detectado de acuerdo con las Guías de la Sociedad Internacional de Trombosis y Hemostasia. |
| Anticuerpos anticardiolipina (aCL) | Isotipo G o M en suero o plasma a títulos medios o altos (>40 GPL ó MPL ó>99 percentil) y determinados por un test ELISA estandarizado. |
| Anticuerpos antiß2-glicoproteína I (aß2-GPI) | Isotipo G o M en suero o plasma a título>99 percentil, determinados por un método ELISA estandarizado. |
También se incluyeron cinco pacientes con SAF seronegativo, diagnosticadas tras haber presentado de forma recurrente manifestaciones obstétricas del SAF, sin otra patología subyacente a pesar de no cumplir los criterios de laboratorio clásicos. La existencia de pacientes SAF seronegativas aparece reflejada en la literatura, basándose en el conocimiento de otros anticuerpos antisfosfolípidos (anticuerpos antifosfatidilserina /protrombina tipo IgG/IgM, anticuerpos anticardiolipinas o anticuerpos anti-ß2-glicoproteína I de tipo IgA, anticuerpos anti-ß2-glicoproteína I dominio 1 IgG), que pueden causar las manifestaciones características del SAF aunque aún no existen pruebas suficientes para recomendar su determinación rutinaria. Los últimos estudios muestran una evidencia creciente a cerca de la importancia de su estudio, para conseguir en un futuro próximo que estas pacientes se beneficien de forma precoz de un manejo óptimo5–8.
Todas las pacientes firmaron un consentimiento previa información del estudio para el análisis de los datos referentes a su gestación y resultado perinatal.
Estas gestantes fueron atendidas en la unidad de reumatología y la unidad de medicina fetal del Hospital Universitario “Virgen de las Nieves” de Granada, desde enero del 2007 hasta septiembre del 2017.
Su seguimiento y manejo se ajustó al protocolo hospitalario de gestantes con SAF. Realizando al menos una visita preconcepcional, controles analíticos trimestrales durante la gestación y exploraciones clínicas periódicas para despistaje de complicaciones maternas, adaptando su frecuencia a la edad gestacional y evolución del embarazo. En cuanto al control ecográfico obstétrico, en todas las pacientes se realizó el screening del primer trimestre, estudio morfológico de la semana 20 y controles mensuales posteriores, aumentando la frecuencia de ecografías en torno a la semana 36 o ante la aparición de complicaciones. El tratamiento recomendado en estas pacientes fue ácido acetilsalicílico (AAS) y heparina de bajo peso molecular (HBPM), concretamente enoxaparina. La posología recomendada de AAS fue de 100mg cada 24 horas desde el inicio del embarazo hasta la semana gestacional 36. La HBPM se prescribía tras confirmación de la gestación por ecografía, manteniéndose durante todo el embarazo y al menos 6 semanas postparto, habitualmente a dosis profilácticas ajustadas según el peso de la paciente, mientras que en pacientes con antecedente de trombosis la dosis empleada era a niveles terapéuticos. En ausencia de complicaciones obstétricas, la gestación se finalizaba de forma electiva en torno a la semana 39.
Se incluyeron en el análisis las características epidemiológicas y antecedentes obstétricos, el perfil de anticuerpos antifosfolípidos y la presencia concomitante de trombofilias. Los datos registrados de cada gestación fueron la edad materna, tratamiento realizado durante la gestación, la vía del parto y su modo de inicio, la edad gestacional en el momento del parto, el peso del recién nacido, el sexo fetal, la patología obstétrica y la presencia de complicaciones perinatales. En cuanto al periodo puerperal se recogió el empleo de heparina y la aparición de complicaciones maternas.
Se definió la variable de malos resultados obstétricos como la aparición de alguna de las siguientes complicaciones: preeclampsia-eclampsia, desprendimiento prematuro de placenta normoinserta (DPPNI), muerte fetal, prematuridad, crecimiento intrauterino retardado (CIR) o recién nacido de bajo peso.
Para el estudio de los perfiles de anticuerpos antifosfolípidos, se crearon dos grupos con relevancia clínica: triple positivo9–11 y triple positivo de alto riesgo12–14. Se definió la variable triple positivo como la presencia de anticoagulante lúpico (AL), anticuerpos anticardiolipina (aCL) y anticuerpos antiß2-glicoproteína I (aß2GPI); y la variable triple positivo de alto riesgo cuando además de la positividad de los tres anticuerpos, los aCL y aß2GPI son de tipo IgG.
Se realizó un análisis descriptivo de las variables de estudio, calculando la mediana y su intervalo mínimo-máximo para las variables numéricas y las frecuencias absolutas y relativas para las categóricas. Por otro lado, se contrastaron los resultados obstétricos con sus posibles factores condicionantes mediante un análisis bivariante; utilizando el test chi-cuadrado de Pearson para las variables cualitativas, o Fisher en los casos que no se cumplieron las condiciones de aplicabilidad. Para las variables numéricas se empleó el test de Student, o el de Mann-Whitney cuando no se cumplieron las condiciones para aplicar aquel. La normalidad de las variables se contrastó con el test de Shapiro Wilks. Igualmente, se compararon los subgrupos de SAF primario y SAF secundario en relación con los resultados obstétricos utilizando los mismos test nombrados previamente. Para todos los análisis se consideró un nivel de significación p<0,05. Los cálculos se realizaron con el software IBM SPSS Statistics 21.
3RESULTADOSSe incluyeron en el estudio un total de 35 pacientes con diagnóstico de SAF de las cuales 30 presentaban un SAF primario y 5 gestantes un SAF secundario (4 con diagnóstico concomitante de lupus eritematoso sistémico y 1 con enfermedad mixta del tejido conectivo). El número total de gestaciones fue de 50.
La mediana de edad materna en el momento del parto fue de 34,5 años (rango 21-45) con un porcentaje de gestantes mayores de 35 años de 42%. Un 44% de las gestantes incluidas eran nulíparas y 56% multíparas.
Durante la gestación se empleó heparina de bajo peso molecular (HBPM) en el 100% de las gestaciones y ácido acetilsalicílico (AAS) en el 96% interrumpiéndose éste en torno a la semana gestacional 36.
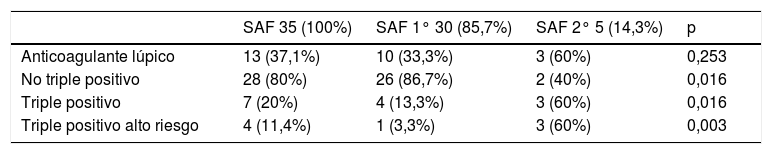
En el estudio del perfil de anticuerpos antifosfolípidos se detectó la presencia de anticoagulante lúpico en el 37,1% (13/35) de las gestantes, de las cuales 20% (7/35) eran triple positivo y el 11,4% (4/35) triple positivo de alto riesgo. El perfil de anticuerpos triple positivo y triple positivo de alto riesgo fue más frecuente en el grupo de SAF secundario (Tabla 2).
Perfil de anticuerpos antifosfolípidos
| SAF 35 (100%) | SAF 1° 30 (85,7%) | SAF 2° 5 (14,3%) | p | |
|---|---|---|---|---|
| Anticoagulante lúpico | 13 (37,1%) | 10 (33,3%) | 3 (60%) | 0,253 |
| No triple positivo | 28 (80%) | 26 (86,7%) | 2 (40%) | 0,016 |
| Triple positivo | 7 (20%) | 4 (13,3%) | 3 (60%) | 0,016 |
| Triple positivo alto riesgo | 4 (11,4%) | 1 (3,3%) | 3 (60%) | 0,003 |
Valores expresados como n (%).
Significación estadística p<0.05.
Hubo un 25,7% de gestantes con diagnóstico previo de trombofilia, aunque en el 77,7% de los casos se trató de heterocigosidad a la metilentetrahidrofolato reductasa (MTHFR), no habiendo ningún caso de trombofilia de alto riesgo trombótico como déficit de antitrombina III o trombofilias combinadas (Tabla 3).
Registro de trombofilias
| Trombofilia | Número de casos | MTHFR |
|---|---|---|
| Heterocigosidad a la MTHFR | 5 | 5 |
| Heterocigosidad a la MTHFR y Factor XII | 1 | 1 |
| Heterocigosidad a la MTHFR y heterocigosidad protrombina | 1 | 1 |
| Heterocigosidad FV Leiden | 1 | 0 |
| Heterocigosidad trombina | 1 | 0 |
| 9/35 (25,7%) | 7/9 (77,7%) |
Datos expresados como n/N (%).
La aparición de alguna complicación catalogada como malos resultados obstétricos ocurrió en el 34% de las gestaciones estudiadas. Se diagnosticó preeclampsia en el 8% de las gestaciones y hubo un caso de desprendimiento prematuro de placenta normoinserta (2%). No hubo ningún caso de muerte fetal.
La mediana de edad gestacional al momento del parto fue de 38 semanas, evidenciando una tasa de prematuridad por debajo de la semana gestacional 37 de 22%, de los que un 36,4% fueron prematuros anteriores a las 34 semanas de gestación. La mediana de peso del recién nacido fue de 2910g (1635g - 4200g). El porcentaje de fetos con peso inferior al percentil 10 fue del 16%. El 58% de los recién nacidos fueron de sexo femenino.
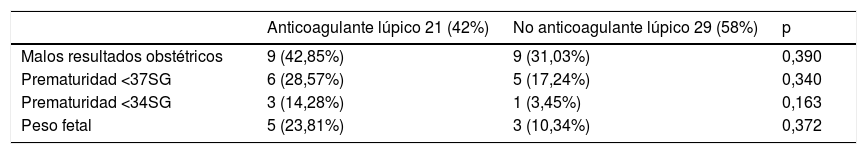
La presencia de un perfil de anticuerpos triple positivo se asoció a mayor porcentaje de partos prematuros por debajo de las 37 así como antes de las 34 semanas de gestación (Tabla 4). En el caso de las pacientes con un perfil triple positivo de alto riesgo también hubo un mayor número de partos prematuros antes de la semana de gestación 37. También hubo un mayor número de partos prematuros anteriores a la semana gestacional 34 en comparación a las pacientes que no presentaban este perfil de alto riesgo, aunque el resultado no alcanzó la significación estadística (Tabla 4). Por otro lado, la presencia de anticoagulante lúpico de forma aislada no se asoció a peores resultados obstétricos (Tabla 5).
Asociación perfil de anticuerpos triple positivo y triple positivo de alto riesgo con prematuridad
| Triple positivo 13 (26%) | No triple positivo 37 (74%) | p | Triple positivo alto riesgo 8 (16%) | No triple positivo alto riesgo 42 (84%) auto sin mascarilla | p | |
|---|---|---|---|---|---|---|
| Prematuridad <37SG | 6 (46,15%) | 5 (13,51%) | 0,015 | 5 (62,5%) | 6 (14,28%) | 0,003 |
| Prematuridad <34SG | 3 (23,07%) | 1 (2,7%) | 0,015 | 2 (25%) | 2 (4,76%) | 0,053 |
Datos expresados como n (%).
Significación estadística p<0.05.
Resultados obstétricos en función de la presencia de anticoagulante lúpico
| Anticoagulante lúpico 21 (42%) | No anticoagulante lúpico 29 (58%) | p | |
|---|---|---|---|
| Malos resultados obstétricos | 9 (42,85%) | 9 (31,03%) | 0,390 |
| Prematuridad <37SG | 6 (28,57%) | 5 (17,24%) | 0,340 |
| Prematuridad <34SG | 3 (14,28%) | 1 (3,45%) | 0,163 |
| Peso fetal | 5 (23,81%) | 3 (10,34%) | 0,372 |
Abreviatura: SG: semana gestacional.
Datos expresados como n (%).
Significación estadística p<0.05.
Al comparar las tasas de prematuridad obtenidas con respecto a los datos registrados de la población general en el año 2016 en el Hospital Universitario “Virgen de las Nieves”, las pacientes con SAF presentaron tasas de prematuridad por debajo de las 37 semanas significativamente más altas (22% vs 9,33%, p<0,005). No se observaron estas diferencias en las tasas de prematuridad por debajo de las 34 semanas (8% vs 3,06%, p=0,11).
En cuanto a otras complicaciones obstétricas en la población general del hospital en el año 2016, la tasa de preeclampsia registrada alcanzó el 4,17% y la tasa de fetos con peso inferior al percentil 10 fue del 10,44%. Aunque estas complicaciones resultaron más frecuentes en las pacientes con SAF (8% vs 4,17% y 16% vs 10,44%, respectivamente), no se encontraron diferencias significativas.
El parto fue de inicio inducido en el 44%. La indicación de la inducción fue la patología materna en el 50% de los casos, el 31,8% fue por rotura prematura de membranas y el 18,2% restante por motivos fetales entre los que se incluye el crecimiento intrauterino retardado. La finalización fue en el 48% de los partos de forma eutócica, 44% terminaron en cesárea y 8% en partos instrumentales. Al analizar la indicación de la cesárea, el 45,4% fueron de forma electiva, 36,4% por distocia del parto y el 18,2% por riesgo de pérdida del bienestar fetal. En las indicaciones de cesárea electiva se incluyen los antecedentes obstétricos de la gestante que contraindicaban la vía vaginal, presentación podálica o fetos con CIR y estudio Doppler anómalo que contraindica la inducción del parto.
Se encontraron diferencias significativas respecto a la tasa de inducciones del año 2016 en el Hospital Universitario “Virgen de las Nieves” que se realizaron en el 29,69% del total de partos (44% vs 29,69%, p=0,041). La tasa de cesáreas general del hospital en el año 2016 supuso el 20,16% del total de partos, siendo esta diferencia estadísticamente significativa (44% vs 20,16%, p<0,05).
En el puerperio, el tratamiento con heparina se continuó en el 100% de los casos, a pesar de ello, hubo 1 caso de trombosis venosa profunda. Este episodio de trombosis sucedió tras una cesárea en una paciente del grupo SAF secundario, que presentaba como factores de riesgo antecedente de 3 trombosis previas y perfil de anticuerpos triple positivo de alto riesgo.
4DISCUSIÓNEl síndrome antifosfolípido es una enfermedad autoinmune con gran repercusión en el ámbito obstétrico puesto que con frecuencia conlleva la aparición de abortos de repetición y malos resultados obstétricos. Por otro lado, la evidencia disponible indica que un manejo adecuado de estas pacientes puede mejorar significativamente los resultados obstétricos15–18. Aunque se trata de una enfermedad infrecuente, en el presente estudio se consiguió recabar información de un total de 50 gestaciones de pacientes con un diagnóstico previo de SAF.
Dentro del grupo de pacientes en estudio hay un elevado número de gestantes con edad superior a los 35 años probablemente en relación con el retraso de la maternidad debido a los malos antecedentes obstétricos y otros antecedentes clínicos que presentan las pacientes con SAF.
No se pudo realizar una evaluación de los beneficios del tratamiento profiláctico con heparina de bajo peso molecular y ácido acetilsalicílico dado que prácticamente la totalidad de las pacientes lo recibieron desde el inicio de la gestación. Dicho tratamiento se realizó de forma protocolaria puesto que existe evidencia de la importancia del tratamiento profiláctico en este grupo de pacientes19–24. Según los resultados de Deguchi et al.25, el uso del tratamiento profiláctico combinado durante la gestación se asocia a menores tasas de prematuridad, menor restricción del crecimiento, menor número de abortos y mayores tasas de recién nacidos vivos. Basándonos en los resultados de Khalid Abd Aziz et al.26 y Zheng et al.27, incluso parece existir una reducción en el riesgo de preeclampsia.
En el análisis comparativo entre los grupos SAF primario y secundario, se observaron más pacientes triple positivo y triple positivo de alto riesgo en el grupo de SAF secundario. Estos resultados discrepan con los estudios publicados por Vianna et al.28 y por Camps García et al.29, donde no se encontraron diferencias en las manifestaciones clínicas ni en las pruebas de laboratorio características del síndrome. En otro trabajo posterior, llevado a cabo por Singh hubo un mayor número de episodios de trombosis en el SAF secundario, aunque las pacientes con SAF primario presentaban peores resultados obstétricos30.
En el presente estudio y en concordancia con los resultados observados por Deguchi et al.25, la presencia de un perfil de anticuerpos triple positivo se asoció a una mayor tasa de prematuridad. En los estudios de Saccone et al.31 y de Zheng et al.27, la positividad a dos o más anticuerpos antifosfolípidos además se asoció a mayor riesgo de preeclampsia, restricción del crecimiento fetal, menor tasa de recién nacidos vivos y más muertes fetales. Posiblemente, la menor incidencia de estas variables en la población, asociado al tamaño muestral reducido de este estudio no permitió establecer dichas diferencias en nuestro grupo de estudio.
La positividad para el anticoagulante lúpico de forma aislada no se asoció a peores resultados obstétricos. Aunque en la literatura, trabajos como el de Lockshin et al., defienden que el anticoagulante lúpico es el mejor predictor de malos resultados obstétricos32,33.
Observamos que el grupo general de gestantes con SAF presenta una alta tasa de prematuridad en comparación con la población general atendida en el mismo medio; resultado que es más frecuente en el grupo de pacientes con perfil de anticuerpos triple positivo y triple positivo de alto riesgo y, por lo tanto, también en las gestantes con SAF secundario. De igual forma, se aprecia una tendencia de dichas pacientes a una mayor tasa de prematuridad por debajo de la semana gestacional 34 aunque los resultados no son estadísticamente significativos probablemente por el bajo número de casos.
También resulta interesante comentar el alto porcentaje de inducciones detectadas en las gestantes con SAF con respecto a la población general. Dicho hallazgo se explica no sólo porque en el protocolo específico de nuestro centro la gestación en estas pacientes se finaliza de forma electiva sobre la semana gestacional 39; sino también por las complicaciones obstétricas asociadas al SAF como el retraso del crecimiento, que obligan a una finalización más temprana de la gestación.
La tasa de cesáreas detectada en este trabajo fue significativamente superior a la tasa media en nuestro centro para la población general. Este resultado parece deberse a diversos factores como el importante número de inducciones, los malos antecedentes obstétricos o la presencia de complicaciones perinatales como la restricción del crecimiento intrauterino severo.
A raíz de todos estos resultados, se pone de manifiesto la importancia del perfil de anticuerpos antifosfolípidos para el diagnóstico y estratificación del riesgo de estas pacientes. Por otro lado, existe evidencia suficiente sobre la eficacia de los tratamientos profilácticos durante la gestación en las pacientes con síndrome antifosfolípido. Por todo ello, resulta fundamental la evaluación preconcepcional de la paciente y el manejo multidisciplinar de estas gestaciones por obstetras y reumatólogos.
Para atender estas necesidades, en nuestro centro, el servicio de medicina fetal trabaja junto con el servicio de reumatología a través de una consulta especializada en gestantes con enfermedades autoinmunes. De esta manera, se intenta conseguir un control óptimo de las pacientes desde el momento preconcepcional y posteriormente, durante la gestación y el puerperio. A través de esta consulta especializada, se pretende informar a las pacientes, asesorar sobre los riesgos, adecuar el tratamiento y realizar un control estrecho en caso de embarazo.
En resumen, la gestación en las pacientes con SAF continúa siendo una entidad de alto riesgo que supone un reto a enfrentar por un equipo multidisciplinar para brindar una atención obstétrica y médica efectiva y segura.
Declaración de conflicto de interés
Los autores declaran no presentar ningún conflicto de interés en el momento de la redacción del manuscrito.
Este es un artículo Open Access bajo la licencia CC BY-NC-ND.