El desarrollo y uso masivo de técnicas de fecundación asistida desde hace 30 años ha permitido el nacimiento de más de 3 millones de niños en el mundo; sin embargo, estos procedimientos no están exentos de riesgos. La complicación más frecuente es el embarazo múltiple determinado por el desarrollo de múltiples folículos en la inseminación intrauterina y la transferencia de 2 ó más embriones en la fecundación in-vitro. El síndrome de hiperestimulación ovárica constituye una complicación menos frecuente, pero potencialmente grave para la cual detallamos las estrategias de prevención y manejo clínico. Se discuten además las complicaciones derivadas de la aspiración folicular tales como hemorragia e infección entre otras.
The widespread use of fertility treatments such as in-vitro fertilization has determined the birth of more than 3 million babies worldwide, however, these procedures can derive into medical complications. The most frequent complication of assisted reproductive techniques is multiple pregnancy. Single embryo transfer has been avdocated as the best strategy to prevent this complication. Ovarian hyperstimulation syndrome constitutes a life threathening complication of ovarian stimulation. Detailed information on prevention and treatment strategies are given. Other complications after oocyte retrieval such as bleeding and infection are also discussed.
El desarrollo de la fecundación in vitro desde fines de la década de los 70 revolucionó el tratamiento de la pareja infértil permitiendo el nacimiento de más de tres millones de niños en el mundo. La hiperestimulación ovárica controlada constituye parte esencial de los tratamientos de infertilidad ya sea en ciclos de inseminación intrauterina como de fecundación in vitro (FIV). El objetivo primordial de esta estrategia es buscar el desarrollo de múltiples folículos a través de la administración de gonadotrofinas o la combinación de citrato de clomifeno con gonadotrofinas. En el caso de la FIV los ovocitos son aspirados por vía transvaginal para su inseminación, cultivo in-vitro y transferencia uterina.
Tal como todo procedimiento médico, estas terapias no están exentas de riesgos derivados de los procesos de hiperestimulación ovárica, aspiración folicular y transferencia de múltiples embriones.
El objetivo del presente documento es presentar una revisión de la literatura con respecto a las complicaciones derivadas del tratamiento de la pareja infértil.
Embarazo múltipleEl embarazo múltiple constituye la principal complicación iatrogénica de las terapias de reproducción asistida, ya que conlleva un elevado riesgo de morbimortalidad perinatal y complicaciones maternas tales como parto pretérmino, restricción de crecimiento fetal, y síndrome hipertensivo del embarazo (1).
El desarrollo multifolicular secundario a la estimulación ovárica asociado a inseminación intrauterina determina un significativo aumento en la tasa de embarazo múltiple (desde un 3 a un 17% de los ciclos concepcionales) (2). Con respecto a los ciclos de FIV/ICSI los datos obtenidos desde centros en Estados Unidos, donde no existe una limitación al número de embriones a transferir, demuestran una tasa de embarazo doble de un 32% y de un 6% para embarazos triples (3). En concordancia con estos datos, el último reporte de la Red Latinoamericana de Reproducción Asistida demuestra una tasa de embarazo doble de un 24,2% cuando 2 embriones son transferidos, y de un 25,1% y un 8% de embarazo doble y triple respectivamente cuando 3 embriones son transferidos (4).
Múltiples estrategias se han propuesto para reducir esta complicación, siendo el modelo más exitoso el de transferencia de embrión único (TEU) iniciado en los países escandinavos a fines de la década de los noventa llegando incluso a generar políticas públicas restrictivas ligadas al financiamiento de los ciclos de FIV (5,6). La decisión del número óptimo de embriones a transferir depende de la edad de la mujer, etiología de la infertilidad, número de ciclos previos y calidad embrionaria. La principal desventaja de la TEU es la reducción en la tasa de recién nacido vivo, sin embargo esta disminución puede ser revertida a través de la transferencia de embriones congelados-descongelados (7).
El éxito de la estrategia basada en la TEU depende de múltiples variables:
1) Generar conciencia del problema; 2) Lograr acuerdos en torno a la selección adecuada de la paciente y las características embrionarias previo a la TEU; 3) Educar a las pacientes sobre los beneficios de la TEU; 4) Proveer una cobertura económica adecuada a estos tratamientos (5).
Síndrome de hiperestimulaciín ováricaEl síndrome de hiperestimulación ovárica (SHO) constituye una complicación iatrogénica potencialmente mortal que se expresa como una respuesta exagerada a la estimulación ovárica con gonadotropinas (8). Excepcionalmente ha sido descrito asociado al uso de citrato de clomifeno e incluso en embarazos concebidos espontáneamente (9, 10). El SHO es un desorden autolimitado, sin embargo puede prolongarse hasta por 12 semanas en caso de producirse un embarazo. La prevalencia de esta complicación oscila entre un 1-10% de los ciclos de FIV, siendo severa en un 0.2 a 5% de los ciclos de FIV (11). La mortalidad descrita en la literatura es de 1 en 400.000 a 500.000 ciclos (12).
Los principales factores de riesgo de SHO se presentan en la Tabla 1.
Factores de riesgo para el desarrollo de sho
| Edad (< 30 años) |
| Bajo peso (IMC <) |
| Síndrome de ovario poliquístico |
| Uso de dosis elevadas de gonadotropinas |
| Alza brusca del nivel de estradiol plasmático o niveles sobre 5000pg/ml el día de hCG |
| Mayor o igual a 20 folículos de mm el día de hCG |
| Suplementación de fase lútea con hCG |
| Antecedente de SHO |
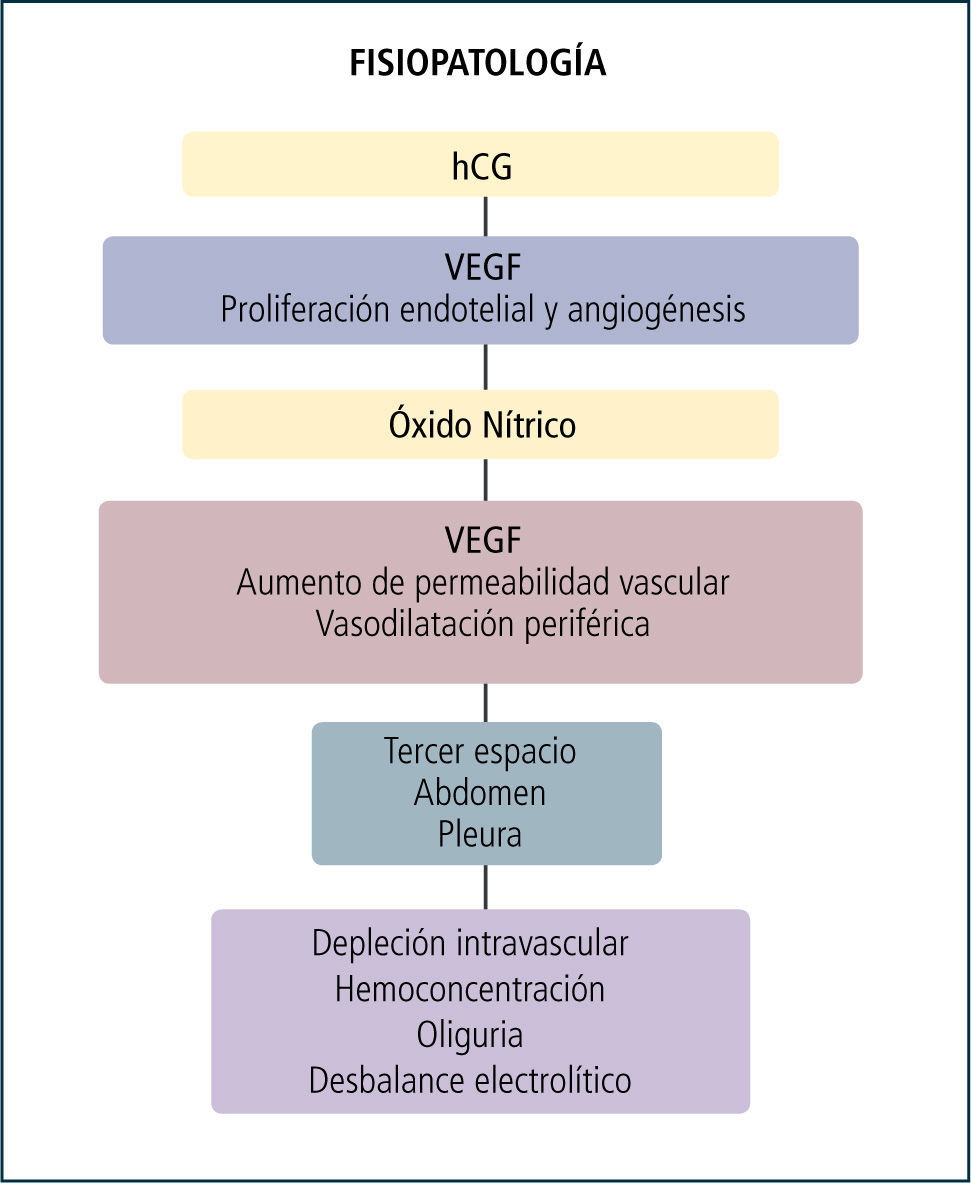
Los mecanismos que desencadenan el síndrome de hiperestimulación ovárica son desconocidos, sin embargo se ha establecido que existe un incremento en la permeabilidad vascular con extravasación del intravascular a compartimentos de tercer espacio tales como peritoneo y pleura. Múltiples mediadores han sido evaluados siendo el factor de crecimiento endotelial (VEGF) el más aceptado en la actualidad (13). El VEGF es una citoquina angiogénica con un efecto estimulador del endotelio vascular siendo participe del proceso de crecimiento folicular, desarrollo del cuerpo lúteo y angiogénesis ovárica. Múltiples estudios han correlacionado los niveles del VEGF con la severidad de SHO (14). Por otro lado estudios en modelos animales han logrado reproducir el síndrome mediante el uso de este mediador (15).
El VEGF es producido como consecuencia de la administración de gonadotrofina coriónica (hCG) previo a la aspiración folicular debido a su acción luteotrófica y larga vida media. La figura 1 resume la secuencia de eventos fisiopatológicos que llevan a depleción intravascular con hemoconcentración y la formación de tercer espacios.
Clínica y clasificaciónEl SHO es un cuadro clínico autolimitado que dura 10 a 14 días cuando no se ha producido embarazo y hasta las 12 semanas de gestación cuando este se produce. Se han descrito dos presentaciones del SHO en relación a la administración de la gonadotrofina coriónica (16).
- 1
- Precoz: antes de 10 días de la administración de hCG.
- 2
- Tardío: ≥ 10 días después de la administración de hCG. Múltiples clasificaciones han sido descritas siendo la de Golan y cols la más utilizada (17).
Leve: molestia abdominal transitoria, náuseas, vómitos y/o diarrea.
Moderado: síntomas de SHO leve asociado a la presencia de ascitis a la ultrasonografía.
Severo: síntomas de SHO moderado más evidencia clínica de ascitis y/o hidrotórax. También se incluye el aumento en la viscosidad sanguínea secundario a hemoconcentración, anomalías de la coagulación y disminución en la perfusión y función renal.
Las complicaciones asociadas al SHO incluyen la torsión ovárica (16% de mujeres embarazadas y 2.3% en no embarazadas), derrame pericárdico, tromboembolismo (0,2% ciclos de FIV y 10% de casos de SHO), distress respiratorio y falla hepatorenal (11).
Estrategias de prevenciónLa cancelación del ciclo de estimulación evitando la administración de hCG es la única estrategia que logra la completa prevención del SHO. No obstante, se han descrito múltiples alternativas terapéuticas destinadas a disminuir la incidencia y severidad del SHO.
- a)
Individualización de dosis de gonadotrofinas: identificar factores de riesgo con monitoreo hormonal y ultrasonográfico del ciclo.
- b)
Reducción en la dosis de hCG: sólo un estudio observacional demostró tasas similares de obtención de ovocitos maduros, fertilización y embarazo con dosis de 5000 y 3300UI. No obstante, esta estrategia no permite prevenir el desarrollo de SHO (18).
- c)
Uso de agonista de GnRh: El uso de agonista de GnRh para desencadenar la maduración ovocitaria en reemplazo de la hCG constituye actualmente una de las líneas de investigación más interesantes, ya que en teoría permitiría prevenir la cascada fisiopatológica del SHO manteniendo las posibilidades de embarazo en un ciclo fresco. Desafortunadamente los estudios randomizados efectuados a la fecha han demostrado bajas tasas de embarazo con una elevada tasa de aborto cuando la transferencia es efectuada en el ciclo fresco, sin embargo, este efecto deletero desaparece si los embriones son transferidos en un ciclo congelado-descongelado (19, 20). Esta diferencia se debe probablemente a un marcado defecto de fase lútea al utilizar el agonista de GnRh con la subsecuente alteración en la receptividad endometrial (19). La reciente publicación de similares tasas de embarazo comparadas con el uso convencional de hCG en ciclo fresco mediante la suplementación lútea con 1500UI de hCG el día de la aspiración folicular parece constituir el camino correcto para subsanar los pobres resultados previos (21).
- d)
Albúmina: el uso profiláctico de albúmina descrito en 1993 (22) pretende aumentar la presión oncótica disminuyendo la extravasación al espacio extravascular. El único metaanálisis publicado en 2002 concluye que el uso de albúmina comparado con placebo disminuye en forma significativa el riesgo de SHO severo OR 0.28: 95% CI 0.11-0.73 (23). En contraposición con estos resultados el grupo de IVI publicó en 2003 un estudio randomizado incluyendo 976 pacientes con elevado riesgo de SHO no encontrando diferencias significativas en la incidencia de SHO moderado y severo (24).
- e)
Cabergolina: recientemente se ha ensayado el uso de agonistas dopaminérgicos para inactivar el receptor de VEGF con la subsequente prevención de aumento de la permeabilidad vascular y disminución del SHO (25). El único estudio prospectivo randomizado doble ciego en pacientes donantes de ovocitos con riesgo de SHO demostró que el uso de cabergolina en dosis de 0,5mg al día por 8 días iniciando el día de administración de hCG, redujo significativamente los parámetros hematológicos (hematocrito y hemoglobina), ascitis y permeabilidad vascular en aquellas pacientes pertenecientes al grupo tratado (25). Si bien no se encontró una diferencia estadísticamente significativa en la incidencia del SHO severo, sí se redujo significativamente la incidencia de SHO moderado (25). Se requieren más estudios para validar la efectividad de esta terapia.
Las pacientes con SHO leve a moderado pueden ser manejadas en forma ambulatoria. Las principales indicaciones son ingerir a lo menos 1 litro de líquidos al día y control diario de peso y diuresis. La actividad física debe ser limitada evitando el reposo estricto en cama por el riesgo trombótico. El dolor pélvico y abdominal es manejado con analgésicos orales.
HospitalizaciónLa hospitalización está indicada en la mayoría de los casos severos debiendo ser considerada cuando uno o más de los siguientes criterios clínicos se presenten:
- •
Dolor abdominal severo o signos peritoneales
- •
Náuseas o vómitos intratables
- •
Oliguria o anuria
- •
Ascitis a tensión
- •
Disnea o taquipnea
- •
Hipotensión, mareos o síncope
- •
Desbalance hidroelectrolítico
- •
Hematocrito > 45%
- •
Leucocitos >15.000
- •
Hiponatremia <135meq/l; Hiperkalemia >5meq/l
- •
- •
Disminución de clearance de creatinina (creatinina >1.2; clearence creatinina <50ml/min)
Las indicaciones médicas durante la hospitalización deben incluir el control de peso diario, medición diaria de la circunferencia abdominal, balance hídrico estricto y ultrasonografía seriada. Los examenes de laboratorio deben incluir: hemograma, electrolitos plasmáticos, creatinina plasmática y enzimas hepáticas (9).
El manejo de fluidos se inicia con la administración intravenosa de un bolo de 500 a 1000ml de solución fisiológica. Si se alcanza una diuresis normal se administra solución glucosada 5% 125-150ml/hora repitiendo el hematocrito en 4 horas. Si la oliguria es persistente se administra albúmina 25% 200ml en 4 horas. El uso de diuréticos como la furosemida puede considerarse cuando el hematocrito ha disminuido a menos de un 38% (8).
La paracentesis ha sido asociada con una mejoría en la hemoconcentración, síntomas respiratorios y oliguria a través de la descompresión intraabdominal reduciendo la presión sobre la vena cava con el consecuente aumento del gasto cardiaco. Otra indicación de la paracentesis es el dolor abdominal asociado a ascitis a tensión (8).
Complicaciones derivadas de la culdocentesisLa administración de dosis suprafisiológicas de gonadotrofinas con el fin de lograr un mayor número de folículos y ovocitos constituye parte fundamental de la FIV. Inicialmente, la obtención de ovocitos se realizó mediante la aspiración folicular bajo visión endoscópica (26). Sin embargo, en el año 1985 Wikland y cols. describieron por primera vez la aspiración folicular guiada a través del ultrasonido transvaginal (27), siendo considerada en la actualidad como un procedimiento altamente eficiente y mínimamente invasivo con una baja tasa de complicaciones (<1%).
Numerosas publicaciones han reportado diversas complicaciones derivadas de la aspiración folicular, siendo la hemorragia de los sitios de punción, infección pélvica, hemorragia ovárica y el daño de estructuras pelvianas como uréteres, intestino y vasos pelvianos las más frecuentemente descritas (28, 29).
Complicaciones HemorrágicasLa hemorragia vaginal proveniente de los sitios de punción corresponde a la complicación más frecuente derivada de este procedimiento, observándose hasta en un 8,6% de las aspiraciones foliculares (28, 29). Sin embargo existe subjetividad al momento de cuantificar el sangrado proveniente de los sitios de punción vaginal y hasta hoy no existe consenso en cuánto sangrado puede ser considerado como complicación, siendo probablemente sobreestimada. Un ejemplo de esto es la serie publicada por Ludwig y cols., la cual incluyó más de 1000 aspiraciones foliculares donde la presencia de sangrado vaginal fue considerada como aquella que requiriera compresión del sitio de punción de una duración mayor a un minuto, situación que es considerada como normal para muchos centros de FIV, presentándose en el 2,7% de los casos (30).
Además de los vasos vaginales, la aguja de aspiración folicular puede también lesionar el pedículo ovárico, arterias uterinas, vasos iliacos y sacros medios (31). En la serie reportada por Benett y cols., la frecuencia de hemoperitoneo sintomático (dolor abdominal) ocurrió en el 0,07% de los casos y la lesión de vasos ilíacos estuvo presente en el 0,04% de un total de 2670 aspiraciones foliculares (28). Sin embargo, la frecuencia de sangrado intraabdominal podría ser incluso mayor, dados los resultados publicados por Bodri y cols., donde en un programa de donantes de ovocitos esta complicación estuvo presente en el 0,35% de los casos en 4052 ciclos de aspiración folicular, de los cuales un 0,12% requirió cirugía laparoscópica para su resolución (32). El daño de los vasos pelvianos puede también presentarse como hematomas retroperitoneales y/o del ligamento ancho en sus porciones inferiores (33).
Se ha propuesto que la visualización concomitante de imagen doppler color en casos seleccionados podría disminuir la posibilidad de daño vascular. La mantención de la aguja de aspiración en una posición lateral al transductor transvaginal podría ser también útil (34).
Infección pélvicaLas infecciones pelvianas corresponden a la segunda complicación más frecuente de este procedimiento, observándose en el 0,6% de las aspiraciones foliculares (35). En una serie que incluyó 623 casos de aspiraciones foliculares Van Hoorde y cols., reportaron una frecuencia de 0,6% de infecciones pelvianas, cifra que es compartida por Benett y cols. después de 2.670 procedimientos (36,28). Otros reportes han encontrado una frecuencia de infecciones pelvianas de un 0,24% (37), 0,4% (38) y hasta un 1,3% (33). Otro estudio comunicó seis casos de proceso inflamatorio pelviano de un total de 2.495 aspiraciones foliculares (37). En ninguno de ellos fue necesario realizar una exploración quirúrgica y todos fueron tratados con antibióticos endovenosos. A diferencia de estos estudios la publicación realizada por Bodri y cols., incluyendo más de 4.000 aspiraciones foliculares no tuvo casos de infección pélvica (32). Un posible argumento para explicar esta baja incidencia es el uso rutinario de antibióticos profilácticos.
La presencia de endometrioma ovárico ha sido asociado a un aumento en la probabilidad de absceso pelviano, cuya presentación suele ser tardía (35). Otros factores de riesgo son la presencia de adherencias pélvicas, procesos inflamatorios pélvicos previos y/o cirugías pelvianas previas (39).
Otra complicación infecciosa menos frecuente es la apendicitis aguda producto de una perforación apendicular provocada por la aguja de aspiración folicular, lo cual ha sido descrito en dos oportunidades (36, 40).
Daño al tracto urinarioLa lesión de las estructuras urinarias ubicadas a nivel pelviano, vejiga urinaria y uréteres, son excepcionales. Considerando que la ubicación del uréter a su llegada a la vejiga es inmediatamente lateral a los fondos de saco vaginales, es sorprendente que esta complicación haya sido solamente reportada en algunos casos (29, 34, 41, 42, 43). Sólo un caso se presentó en el estudio de Ludwig y cols., quienes analizaron más de 1100 aspiraciones foliculares (30), y ningún caso fue reportado en las series de Benett y cols. (28), Roest y cols., (37), Govaerts y cols., (38) y Bodri y cols., (32), los cuales incluyeron entre 1000 y 4000 ciclos. Ninguno de estos estudios reportó casos de lesión vesical. Es muy probable que la vejiga no sea un sitio habitual de complicaciones derivadas de este procedimiento debido principalmente a la ubicación anterior y superior con respecto a los sitios de punción vaginal, sumado al hecho de que su vaciamiento previo a la punción permite evitarla.
El cuadro clínico de una lesión ureteral secundaria a una aspiración folicular es variado y dependerá de lo precoz o tardío de la presentación. La presentación aguda puede incluir dolor pélvico, disuria y pérdida de orina por vía vaginal (34, 41, 43). En el caso de las presentaciones tardías se suele sumar fiebre, signos de irritación peritoneal y puño percusión positiva (29, 42).
Dentro del estudio a realizar en una paciente con sospecha de lesión ureteral, está la realización de una cistoscopia, la que permite además visualizar directamente lesiones intravesicales y en forma indirecta lesiones ureterales distales (34). La realización de una pielografía de eliminación y de una tomografía computada de pelvis con fase excretora permiten definir con exactitud el nivel y complejidad de la lesión ureteral (44).
Otras complicacionesTorsión anexialLa torsión ovárica posterior a una hiperestimulación ovárica es una complicación excepcional (37). El cuadro clínico está dado por dolor abdominal intenso asociado a náuseas y vómitos y signos de irritación peritoneal. En una serie de 2495 ciclos de FIV presentada por Roest y cols., sólo 2 casos de torsión ovárica fueron reportados, debiéndose en uno de ellos realizar una anexectomía y en el otro una ooforectomía debido al extenso daño ovárico al momento del diagnóstico (37). Esta complicación y resolución quirúrgica radical no son la regla, como puede inferirse del estudio de Govaerts y cols., donde de un total de 1 500 aspiraciones foliculares, la torsión anexial estuvo presente solo en el 0,13% de los casos, de los cuales uno se resolvió laparoscópicamente y el otro en forma espontánea (38).
Embarazo ectópicoEl primer embarazo obtenido producto de una FIV fue un embarazo ectópico (45). La incidencia general de embarazo ectópico en la población general es de aproximadamente 1,4% (46), y en el caso de las pacientes bajo un tratamiento de reproducción asistida la frecuencia reportada varía entre 2%-11% (37, 47, 48). A pesar de que la frecuencia de embarazos ectópicos es mayor en las pacientes bajo un tratamiento de FIV, sólo en la serie reportada por Roest y cols. se incluyó como complicación producto de estos tratamientos, reportándose una frecuencia de 2,1% en 2.495 ciclos de FIV (37). Esta diferencia y mayor riesgo de esta complicación en estas pacientes podría explicarse debido a la mayor frecuencia de disfunciones tubarias en la población bajo tratamientos de reproducción asistida de alta complejidad, como también a la posibilidad no probada de favorecer su localización tubaria producto de la transferencia embrionaria (37).
Perforación vaginalCho y cols., reportaron el caso de una perforación vaginal con el transductor transvaginal durante una aspiración folicular en una paciente que había sido sometida a 5 aspiraciones previas (49). Los autores explican que esto podría ser la consecuencia de tejido cicatrizal en los fondos de saco vaginales producto de las numerosas aspiraciones previas. No existen otros reportes de esta complicación en la literatura.
Los autores declaran no tener conflictos de interés, en relación a este artículo.