El sueño es fundamental para una serie de funciones corporales, incluyendo el metabolismo de radicales libres, secreción hormonal y fijación de la memoria. Existen evidencias crecientes de que la simple restricción en el número de horas de sueño puede ser perjudicial para el sistema cardiovascular. Por ejemplo, estudios de cohorte sugieren que dormir menos de 5 horas/noche puede aumentar el riesgo de desarrollar hipertensión arterial sistémica (HAS), infarto agudo del miocardio (IAM) y accidente vascular cerebral (AVC). Otro creciente foco de interés en la medicina actual son los trastornos respiratorios del sueño. En este artículo, nos enfocaremos a los trastornos respiratorios del sueño de mayor interés para el cardiólogo, el síndrome apnea obstructiva del sueño (SAOS) y la apnea central asociada a la respiración de Cheyne-Stokes. Además de extremadamente comunes, existen evidencias de que estos trastornos respiratorios del sueño, una vez presentes, pueden contribuir al desarrollo o empeoramiento de las enfermedades cardiovasculares.
Sleep is essential for several physiological functions, including free radical metabolism, hormone secretion, and memory. There is growing evidence that restricting the number of hours of sleep can be harmful to the cardiovascular system. For example, cohort studies suggest that sleeping less than 5hours/night may increase the risk of developing systemic arterial hypertension, acute myocardial infarction and strokes. Another growing focus of interest in current medicine is sleep respiratory disturbances. In this article, we will focus on the respiratory sleep disorders of greatest interest to the cardiologist, obstructive sleep apnea syndrome and central Cheyne-Stokes respiration-associated apnea. In addition, there is evidence that breathing sleep disorders are extremely common and once present can contribute to the development or worsening of cardiovascular disease.
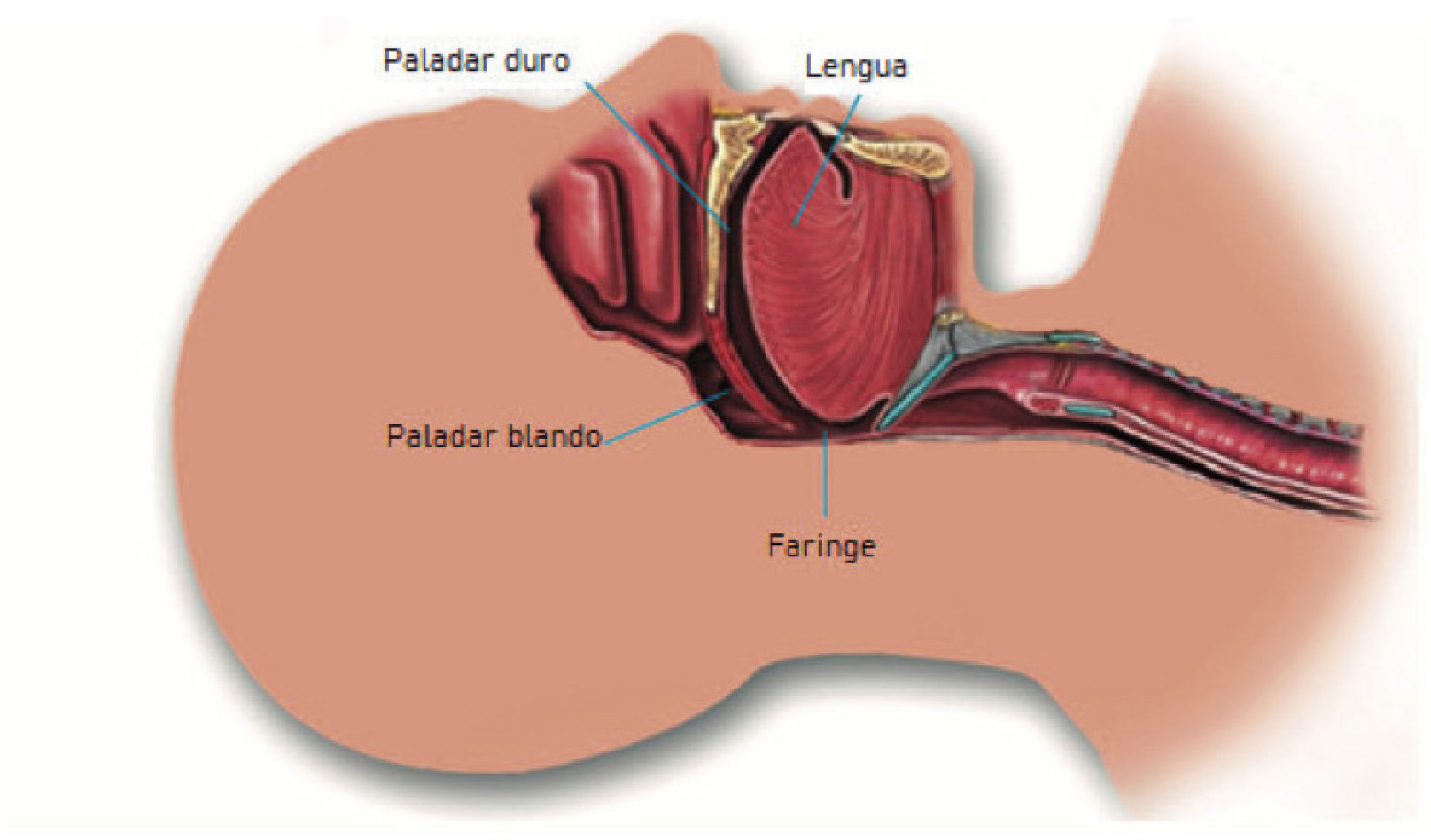
El Síndrome de Apnea Obstructiva del Sueño (SAOS) es un trastorno caracterizado por episodios recurrentes de pausas completas o parciales de la respiración durante el sueño, desencadenando eventos respiratorios denominados apneas o hipopneas, respectivamente1. Los eventos respiratorios son secundarios a la obstrucción de la faringe, tubo sustentado por musculatura que se torna particularmente susceptible al colapso durante el sueño, cuando existe relajamiento de la musculatura (Figura 1).
El principal resultado obtenido a partir de la polisomnografía de interés para la caracterización de los trastornos respiratorios del sueño es el índice de apnea e hipopnea (IAH) que describe el número de eventos respiratorios (apneas+hipopneas) por hora de sueño. Se considera como ausencia de SAOS un IAH de 0 a 4,9; SAOS leve de 5 a 14,9; SAOS moderada de 15 a 29,9; y SAOS grave un índice mayor o igual a 30 eventos/hora de sueño.
Las consecuencias inmediatas de estos eventos nocturnos son esfuerzos respiratorios exagerados en el intento de mantener la ventilación, lo que genera reducción de la presión intra-torácica y caídas cíclicas de la saturación de oxígeno (hipoxia intermitente). Los eventos respiratorios terminan típicamente con un despertar, causando un sueño fragmentado y superficial1. Los microdespertares son, en su mayoría, imperceptibles por el paciente. Existen evidencias de que la hipoxia intermitente es el principal mediador de las consecuencias cardiovasculares adversas de los trastornos respiratorios del sueño2.
Prevalencia del SAOSLlama mucho la atención la alta prevalencia del SAOS en la población general. Estudios epidemiológicos iniciales, realizados hace más de 30 años, sugirieron que su incidencia en adultos variaba de 1,2 a 7,5%3. Sin embargo, con los avances en la tecnología para la detección de eventos respiratorios y el mejor entendimiento de esta patología, asociada a la epidemia mundial de sobrepeso y obesidad, el escenario cambió radicalmente. Hoy se sabe que muchos pacientes tienen síntomas absolutamente atípicos o hasta pueden ser asintomáticos.
Si el SAOS es común en la población en general, la prevalencia de esta patología alcanza números alarmantes entre los pacientes con enfermedades cardiovasculares ya establecidas. Por ejemplo, entre aquellos individuos con hipertensión arterial sistémica (HAS), la frecuencia del SAOS estimada está entre el 30 y 56%, alcanzando porcentajes de hasta 64 a 83% en los hipertensos resistentes4.
Fisiopatología del saos y enfermedades cardiovascularesLos mecanismos primarios, aquellos que ocurren durante los eventos respiratorios, son:
- 1.
Químicos: derivados de la asfixia intermitente que ocurre durante los eventos obstructivos.
- 2.
Mecánicos: aparecen por la generación de presión negativa intra-toráxica y el esfuerzo exagerado para respirar contra una vía aérea superior colapsada.
- 3.
Neurológicos: despertares al final de los eventos respiratorios, generando fragmentación y desaturación de la macro-estructura del sueño.
La hipoxia intermitente es el principal y más importante mecanismo vinculado al SAOS y enfermedades cardiovasculares. La obstrucción de la vía aérea causa asfixia, caracterizada no solamente por la hipoxia intermitente, sino también por la retención de anhídrido carbónico. Existen evidencias de que la hipercapnia contribuye a una respuesta cardiovascular exacerbada con la consecuente hiperactividad simpática5. La generación de presión intra-toráxica negativa durante los eventos obstructivos aumenta el retorno venoso del lado derecho del corazón y también eleva la pos-carga del ventrículo izquierdo (VI)6. Ese mecanismo ha sido utilizado para ayudar a explicar la hipertrofia del VI observada en pacientes con SAOS6. Los micro-despertares que ocurren al final de los eventos respiratorios pueden activar el sistema nervioso simpático7,8 y dificultar o evitar que el paciente alcance el sueño delta (fase 3).
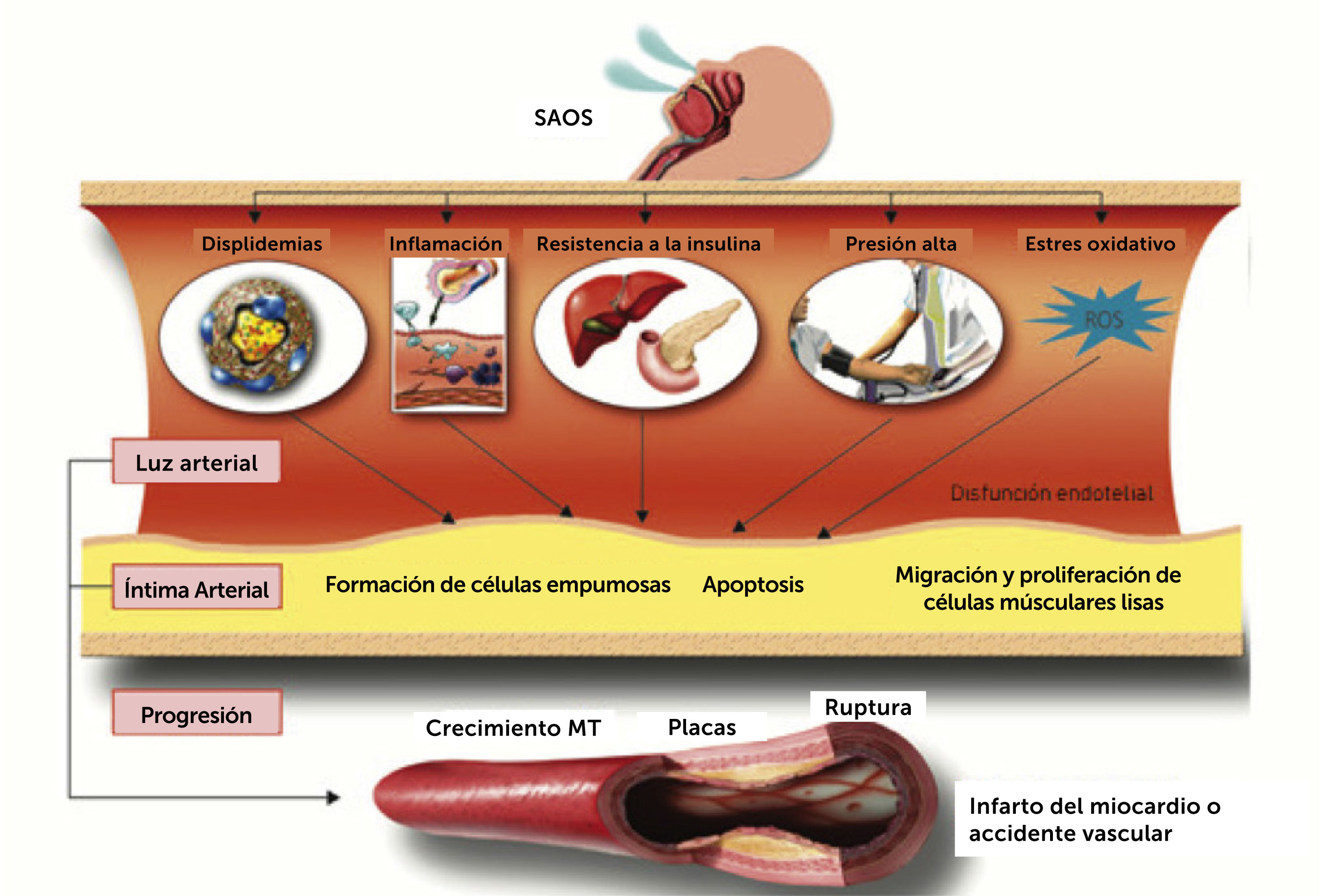
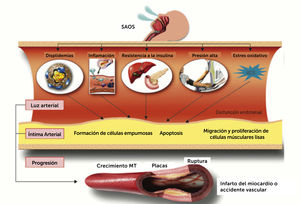
Los tres mecanismos primarios descritos disparan una cascada de reacciones potencialmente perjudiciales al sistema cardiovascular, que incluyen, activación del sistema nervioso simpático, estrés oxidativo, inflamación sistémica, disfunción endotelial y resistencia a la insulina (Figura 2)9. Es interesante notar que las consecuencias perjudiciales del SAOS no se restringen al periodo nocturno, y persisten a lo largo de las 24 horas del día.
Principales mecanismos que relacionan el SAOS a las enfermedades cardiovasculares.
Fuente modificada de Drager LF, Polotsky VY, Lorenzi-Filho G, 201110.
El aumento de la actividad simpática tiene un papel central en la relación existente entre el SAOS y las enfermedades cardiovasculares8,11, siendo el mejor documentado hasta el momento. El aumento del tono simpático en el SAOS está aparentemente vinculado con la activación de los quimiorreceptores, mecanismo dominante en la regulación de la respuesta ventilatoria y circulatoria en los cambios del contenido arterial del oxígeno (O2) y anhídrido carbónico (CO2)11,12. Esta activación simpática mediada a través de quimiorreceptores da como resultado la elevación de la frecuencia cardiaca (FC), presión arterial (PA) y el volumen minuto (VM)13. Los pacientes con SAOS tienen niveles plasmáticos y urinarios aumentados de catecolaminas14.
Existen evidencias de que los dos principales mecanismos de hiperlipidemia, (1) aumento de la secreción de lipoproteínas por el hígado y (2) disminución del cleareance de lipoproteínas, pueden ser inducidos por la hipoxia intermitente15. La hipoxia intermitente aumenta la formación de especies reactivas de oxígeno en la pared vascular, induciendo la peroxidación lipídica y formación de LDL oxidado16. En macrófagos expuestos para hipoxia intermitente, se observa un aumento en la absorción de lípidos y formación de las foam cells17. La mayoría de los estudios han mostrado que el SAOS aumenta la peroxidación lipídica y niveles de LDL oxidado18,19. Algunos estudios demostraron que el tratamiento del SAOS con continuous positive airway pressure (CPAP) puede tener un efecto benéfico sobre el perfil lipídico. La hipoxia intermitente puede desencadenar disfunción endotelial por varios mecanismos. Además de los factores indirectos descritos (dislipidemia, aumento de la PA y resistencia a la insulina), el SAOS puede provocar un aumento de varios marcadores inflamatorios, incluyendo TNF-alfa, proteína C-reactiva, interleuquinas: IL-6 e IL-8 y moléculas de adhesión (ICAM 1, VCAM 1, L-selectinas, E-selectina, P-selectina)21,22. A pesar de que no se conocen los mecanismos exactos, se sabe que participan especies reactivas de oxígeno y de inflamación22, disminuyendo la biodisponibilidad de óxido nítrico (NO) y, paralelamente, aumentando la producción de substancias vasoconstrictoras. Esos factores pueden contribuir en el aumento de la apoptosis y en la disminución de la capacidad de regeneración de las células endoteliales23,24. En contraste, el NO, cuya acción vasodilatadora es bien conocida, se encuentra reducida en portadores de SAOS25 y aumenta después del uso de CPAP26. Existen numerosos estudios que demuestran una asociación independiente entre SAOS y señales de ateroesclerosis en diferentes lechos arteriales, en particular en la carótida y las coronarias27–29; sin embargo, la mayoría de estos estudios incluyeron únicamente pacientes típicos con SAOS en que varios factores de riesgo co-existían. Para evitar confusión entre ellos, Drager et al. diseñaron un estudio que separó los pacientes en un grupo de adultos de sexo masculino con SAOS aparentemente saludables (sin hipertensión, diabetes, tabaquismo) y que no usaban medicaciones29, y los comparó con un grupo control pareado en edad e índice de masa corporal. Los pacientes con SAOS presentaron un aumento significativo de marcadores de re-modelamiento vascular y aterosclerosis, incluyendo la velocidad de onda de pulso, espesor íntima-medial carotidea y diámetro de la carótida. Además, se observó que la gravedad de todos los marcadores vasculares estudiados se correlacionan con la gravedad del SAOS29. Con el propósito de evaluar el tratamiento de SAOS sobre los marcadores de lesión vascular, Drager et al. realizaron un estudio aleatorizado, evaluando los efectos de 4 meses de tratamiento con CPAP sobre los marcadores precoces de aterosclerosis y rigidez arterial, proteína C-reactiva en el plasma y catecolaminas en pacientes con SAOS grave30. Después de este periodo, hubo una mejora significativa de los marcadores de aterosclerosis y de rigidez arterial en estos pacientes.
Apnea obstructiva del sueño e hipertensión arterial sistémica (HAS)La relación mejor estudiada entre el SAOS y las enfermedades cardiovasculares es la hipertensión arterial sistémica (HAS). La mayor parte de los mecanismos fisiopatológicos descritos, en particular la activación del sistema nervioso simpático, tiene implicaciones centrales en la génesis de la HAS. Pacientes con SAOS presentan aumentos cíclicos de la PA asociados al término de los episodios de apnea8. Estos pacientes, frecuentemente, no presentan el descenso nocturno de la PA y son considerados como non-dippers31, patrón considerado de mayor riesgo para la aparición de enfermedades cardiovasculares. Sin embargo, la alteración del descenso nocturno no es específico del SAOS, pudiendo ser atribuido a otras causas32. Recientemente fue demostrada una asociación entre SAOS y lesiones en órganos-diana normalmente atribuidas a hipertensión15. Pacientes normotensos con SAOS presentan alteraciones estructurales cardíacas y rigidez arterial en la misma proporción que pacientes hipertensos; como resultado, la asociación de esos dos factores tuvo un efecto aditivo en el aumento de la rigidez arterial, en la masa del ventrículo izquierdo y, consecuentemente, en el porcentaje de hipertrofia ventricular15. Un estudio detallado de polisomnografía con evaluación clínica basal que se realizó durante 4 años a 709 individuos de la cohorte de sueño de Winsconsin, demostró una asociación independiente entre la presencia del SAOS en la evaluación inicial y el desarrollo de HAS durante el seguimiento33. Los autores observaron una relación dosis-respuesta entre la gravedad del SAOS y el riesgo a desarrollar HAS.
Apnea obstructiva del sueño y arritmias cardíacasVarios factores descritos en la fisiopatología que vinculan el SAOS y la enfermedad cardiovascular pueden contribuir a la aparición de arritmias cardiacas e incluyen: activación del sistema autonómo, remodelación cardíaca y aumento de los marcadores inflamatorios34. Las arritmias más comunes durante el sueño en pacientes con SAOS son las extrasístoles ventriculares, fibrilación auricular, bloqueo auriculoventricular de segundo grado y taquicardia ventricular no sostenida35. Evidencias recientes sugieren que el SAOS puede estar presente en aproximadamente el 50% de los individuos portadores de fibrilación auricular36. En el subgrupo de pacientes portadores de fibrilación auricular que fueron derivados para cardioversión eléctrica electiva, la frecuencia del SAOS alcanzó niveles cercanos a 81%37. Curiosamente, apenas un tercio de estos pacientes tenía somnolencia excesiva diurna, lo que puede contribuir al sub-diagnóstico de SAOS en esta población37.
En un estudio observacional, Gami et al. compararon la frecuencia del SAOS, por medio del cuestionario de Berlín, en 151 pacientes con fibrilación auricular y 312 pacientes sin fibrilación auricular. Los autores demostraron, después del análisis multivariado controlado para edad, sexo e índice de masa corporal, un mayor porcentaje de individuos con riesgo aumentado de SAOS en el grupo con fibrilación auricular comparado con el grupo control (49% vs. 33%, p=0,0004) y una fuerte asociación entre el SAOS y la fibrilación auricular (odds ratio (OR) 2,2, p=0,0006)36. En otro estudio reciente, Pedrosa et al. verificaron una alta prevalencia de SAOS en portadores de miocardiopatía hipertrófica. Los portadores de SAOS tenían un diámetro auricular izquierdo mayor y la presencia de fibrilación auricular fue 5 veces más prevalente que el grupo control. Además, el índice de gravedad del SAOS fue el único factor asociado a la presencia de fibrilación auricular en la población estudiada38. Otro estudio de relevancia evaluó cerca de 3.500 adultos sin historia previa o actual de fibrilación auricular, sometidos a polisomnografía nocturna en Mayo Clinic; este estudio encontró que la presencia de SAOS es un fuerte predictor de riesgo de fibrilación auricular en el análisis univariado (OR=2,18, p=0,002). En el análisis multivariado, cuando se controlaron los posibles factores de confusión, el nivel de desaturación de oxígeno durante el sueño fue un factor predictor independiente de riesgo de fibrilación auricular en un periodo de seguimiento medio de 5 años (OR para cada 1% de disminución en la saturación nocturna de oxígeno=3,3; p=0,009)39.
La aparición de bradicardia asociada a eventos de apnea e hipopnea reflejan una hiperactivación parasimpática en el sentido de reducir el consumo de oxígeno por el músculo cardiaco en un contexto de hipoxemia. A pesar de estar el SAOS comprobadamente relacionado con el aumento de la actividad simpática cardíaca y periférica, el sistema autonómico cardíaco sufre diferentes influencias durante y después de la apnea8,40,41. Cuando ocurre hipoxemia en ausencia de ventilación, la estimulación de los quimiorreceptores carotideos tiene un efecto vagotónico causando bradicardia. Cuando la ventilación es reiniciada, todavía en presencia de hipoxemia, la activación de los receptores de adaptación lenta (pulmonares de estiramiento) inhibe la estimulación vagal, lo que resulta en taquicardia mediada por la descarga simpática cardiaca no antagonizada. Además, la apnea simula el “reflejo de buceo”, que se asocia con bradicardia derivada de hiperactivación parasimpática, revertida por el uso de atropina42. En el consenso del Colegio Americano de Cardiología sobre el SAOS y las enfermedades cardiovasculares publicado en 2008, se estima que la prevalencia de bradiarritmias secundarias a los trastornos del sueño es de aproximadamente 10%42.
En pacientes con SAOS que fueron monitorizados continuamente con Implantable Loop Recorder (grabador de ciclo implantable), se observó una reducción del número de bradiarritmias en las primeras 8 semanas de terapia con CPAP, y el beneficio fue progresivo en los 6 meses siguientes43. Recientemente, Abe et al. evaluaron la respuesta al CPAP en 316 pacientes con SAOS e IAH >20 eventos/hora y observaron una mejora significativa en la aparición de bradiarritmias44. De este modo, se cree que muchos implantes de marcapasos convencionales podrían ser evitados si el SAOS fuese diagnosticado y tratado precozmente.
En el año de 2007, el European Multicenter Polysomnographic Study que incluyó 98 pacientes portadores de marcapasos por diferentes indicaciones, observó que 59% de los pacientes con marcapasos presentaban diagnóstico de SAOS, principalmente del tipo sintomático45.
La presencia de arritmias ventriculares es más prevalente en individuos con SAOS en comparación con los individuos sin SAOS. En los primeros, el IAH y el grado de desaturación nocturna están asociados con la densidad de las arritmias. Individuos con SAOS y corazón estructuralmente normal, que fueron sometidos a ablación de arritmias ventriculares (taquicardia ventricular y extrasístoles ventriculares), presentaron mayores recidivas de estas arritmias en comparación con los pacientes sin SAOS46. Una vez que los pacientes con SAOS presentan gran cantidad de comorbilidades, como hipertensión arterial, obesidad y enfermedad coronaria, se hace difícil individualizar el papel del SAOS como factor de riesgo independiente para el desarrollo de arritmias ventriculares. En este sentido, Mehra et al.47 publicaron los resultados de la prevalencia de arritmias ventriculares en un gran estudio poblacional americano, donde se demostró un aumento de taquicardia ventricular no sostenida (5,3 vs. 1,2%) y extrasístoles ventriculares complejas (25 vs. 14,5%) en individuos con y sin SAOS, respectivamente.
Apnea obstructiva del sueño y síndrome metabólicoEl síndrome metabólico (SM) se caracteriza por ser un conjunto de anormalidades cardiometabólicas asociadas entre sí por la resistencia a la insulina y el alto riesgo de desarrollar enfermedades cardiovasculares48. De acuerdo con el Third Report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Panel III-ATP III)49, individuos que cumplen con tres o más de los siguientes criterios pueden ser clasificados como portadores de este síndrome: 1) obesidad central: circunferencia de la cintura ≥120cm en hombres y ≥88cm en mujeres; 2) hipertrigliceridemia ≥150mg/dL; 3) HDL colesterol <40mg/dL en hombres y <50mg/dL en mujeres; 4) hipertensión arterial sistémica ≥130/85mmHg; 5) glicemia en ayunas ≥100mg/dL.
Los pacientes con SAOS presentan características clínicas similares a los pacientes con SM, como obesidad, principalmente visceral, más prevalente en la pos-menopausia y en el sexo masculino; y efectos sistémicos como hipertensión arterial, resistencia a la insulina, diabetes tipo 2 y dislipidemias. Simplemente por la superposición de factores de riesgo sería esperable una prevalencia extremadamente alta de SAOS entre los pacientes con diagnóstico de SM. De hecho, la prevalencia está en torno al 60% cuando se consideran apenas los casos moderados a graves de SAOS50. Es sabido que pacientes portadores de estos dos trastornos presentan más criterios de SM que los pacientes con SAOS aislada50. En el mismo estudio, el SAOS se asoció independientemente con dos criterios de SM: aumento de triglicéridos y de glicemia50.
Saos y eventos cardiovascularesVarios estudios de cohorte publicados en revistas de alto impacto demostraron recientemente que la forma importante del SAOS está independientemente asociada con un riesgo aumentado de infarto de miocardio, accidente vascular cerebral (ACV) y muerte por enfermedades cardiovasculares51 Uno de los estudios mostró incluso, que mujeres con SAOS severo tuvieron mayor mortalidad51. Un reciente meta-análisis que abarcó estos estudios encontró un hazard ratio de 2,21 para mortalidad cardiovascular (IC 95% 1,61-3,04; p=0.000). Sin embargo, en el análisis individual no se constató un aumento de la mortalidad cardiovascular en pacientes con SAOS moderada (hazard ratio 1,40; IC 95%, 0,77-2,53), sino solamente para el SAOS importante (hazard ratio 2,65; IC 95%, 1,82-3,85)52.
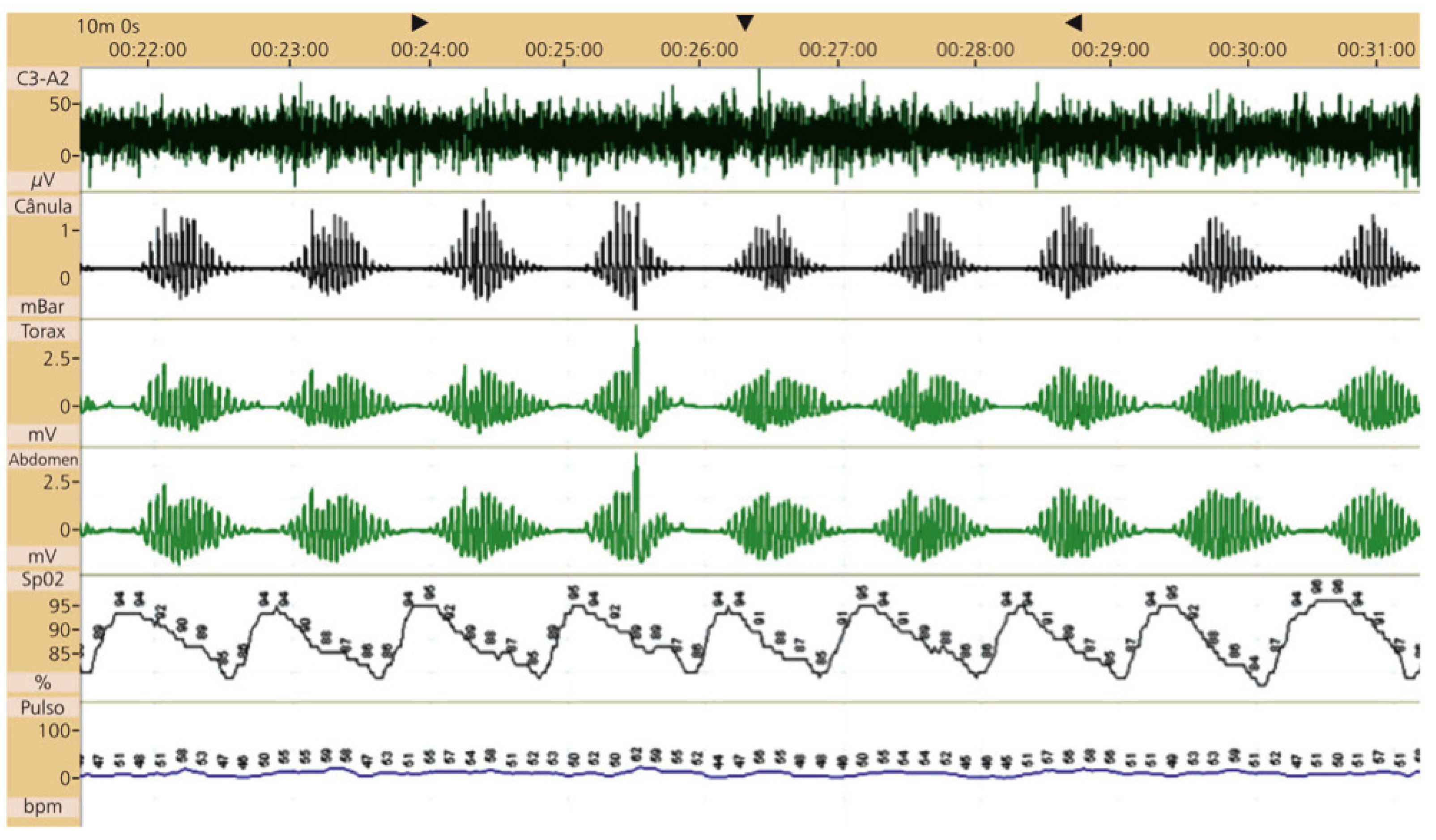
Respiración de cheyne-stokes y apnea centralLa respiración de Cheyne-Stokes (RCS) es caracterizada por periodos cíclicos de hiperventilación que ocurren de forma creciente-decreciente interpuestos por apneas o hipopneas de origen central53,54 (Figura 3). El patrón de hiperventilación prolongada denota un retraso circulatorio y es, por tanto, una característica exclusiva de los pacientes con insuficiencia cardiaca congestiva (ICC). Pacientes con ICC grave, aunque estables, frecuentemente presentaron tanto SAOS como apnea central asociada a RCS. Ellos pueden convertir apneas obstructivas en centrales a lo largo de una única noche. La RCS constituye un patrón específico de apnea del sueño y está asociado al sueño fragmentado, hipoxia recurrente, constituyéndose en marcador independiente de mortalidad en pacientes con ICC.
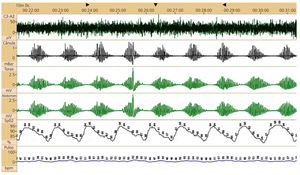
Polisomnografía de un paciente con insuficiencia cardiaca congestiva (ICC) y respiración de Cheyne-Stokes (RCS)
Análisis de 10 minutos. Observe el patrón creciente-decreciente del flujo aéreo y del esfuerzo respiratorio asociado a la oscilación de la saturación de la oxi-hemoglobina (SpO2). C3-A2: electroencefalografía (micro-volts); cánula: flujo respiratorio por sensor de presión nasal (mili-Bar); tórax/abdomen: cintas para monitorización del movimiento torácico y abdominal (10mm=1mV); SpO2 oximetría de pulso. Pulso: latidos por minuto (BPM).
Fuente modificada de Drager LF, Polotsky VY, Lorenzi-Filho G, 201110.
Varios estudios demostraron que pacientes con ICC y RCS presentaron hipocapnia, tanto despiertos como durmiendo55. La RCS puede ocurrir durante la vigilia, sin embargo, es más común durante el sueño, cuando el centro respiratorio pasa a depender del control de los quimiorreceptores y se torna inestable56. Formas leves de inestabilidad respiratoria con un patrón de ventilación periódica sin interposición de apneas e hipopneas también pueden ocurrir durante el ejercicio físico, siendo su presencia un marcador independiente de mortalidad55. Cuando la presión parcial de anhídrido carbónico en sangre arterial (PaCO2) alcanza niveles inferiores al umbral de apnea durante el sueño, se desencadena apnea central. Esta, a su vez, causa hiperventilación, y una nueva apnea central57.
Pacientes con RCS presentan oscilaciones periódicas de la saturación de oxígeno (SaO2), de la FC y de la PA. El patrón cardiovascular parece ser principalmente dependiente de las oscilaciones de la ventilación, pues puede ocurrir aún en individuos saludables que simulan un patrón de RCS58. Además del sueño fragmentado, pacientes con RCS presentan aumento de la actividad simpática, arritmias ventriculares y aumento del riesgo de muerte59.
TratamientoYa que la RCS es probablemente la principal manifestación clínica de congestión pulmonar, la optimización del tratamiento para ICC puede ser la intervención inicial; sin embargo, a pesar de esta intervención, muchos pacientes continúan presentando RCS. El tratamiento que mejor ha sido evaluado para RCS es el uso de CPAP durante el sueño; cuando se realiza por periodos de 1 a 3 meses, se asoció con mejora de la RCS, disminución de la actividad simpática, aumento de la fracción de eyección del ventrículo izquierdo y mejora de la calidad de vida60. Una nueva modalidad de ventilación no invasiva con uso de dos niveles de presión fue desarrollada para la RCS (ventilación servo-controlada). Esta modalidad elimina casi instantáneamente la RCS, pues ofrece una presión de soporte variable que es menor cuando el paciente hiperventila y mayor cuando el paciente hipoventila61. Además de estabilizar la ventilación, la ventilación servo-controlada tiene el potencial de mejorar los resultados cardiovasculares. Sin embargo, un estudio multicéntrico grande no mostró impacto positivo de la servo-ventilación en la mortalidad general de pacientes con RCS y fracción de eyección ventricular baja62. Cuando se analizaron los subgrupos, el uso de servo ventilador se asoció con aumento de mortalidad cardiovascular y por todas las causas63. Los mecanismos exactos por los que la servo-ventilación puede estar asociada al aumento da la mortalidad no fueron esclarecidos. Sin embargo, los resultados son extremamente preocupantes, y la servo-ventilación está formalmente contraindicado en pacientes con insuficiencia cardiaca con fracción de eyección reducida hasta que este tema sea esclarecido.
Conclusiones y perspectivasExisten evidencias crecientes de que los trastornos del sueño son bastante comunes y pueden generar consecuencias importantes al sistema cardiovascular. Obviamente, muchas áreas todavía carecen de una evidencia definitiva del papel de SAOS en la modulación del riesgo cardiovascular. El problema es que la mayoría de los pacientes permanecen sin diagnóstico y, consecuentemente, sin tratamiento. Otra barrera es la baja disponibilidad del principal tratamiento para los casos más graves del SAOS en nuestro medio. El CPAP (y toda la estructura necesaria para la adaptación y su uso a largo plazo) no está accesible para la mayoría de la población.
De esta forma, algunos desafíos que deben ser abordados en esta área son:
- 1.
Los especialistas en medicina del sueño y los cardiólogos deben actuar conjuntamente para que los pacientes con SAOS puedan ser tratados adecuadamente.
- 2.
Se debe ampliar el uso de monitores portátiles para el diagnóstico de SAOS y la estimación de su gravedad.
- 3.
Se debe mejorar y facilitar el acceso a la terapia con equipos de presión positiva continua en la vía aérea (CPAP).
Los autores declaramos que no tenemos ningún conflicto de interés.
Referencia no citada20.