La falla hepática fulminante (FHF) y falla hepática aguda sobre crónica (ACLF, por sus siglas en inglés) son entidades de alta morbimortalidad, siendo el trasplante hepático, en la mayoría de los casos, la única alternativa terapéutica efectiva. La escasez de donantes hace necesario contar con sistemas de soporte de función hepática que permitan mantener al paciente en condiciones adecuadas hasta el trasplante o hasta la mejoría. Pese al mayor conocimiento de la fisiopatología de la FHF, ACLF y los avances tecnológicos, no contamos aún con sistemas de soporte hepático artificial extracorpóreos que permitan reemplazar completamente la función hepática. Hoy en día, actúan principalmente como terapias paliativas o sintomáticas en espera del trasplante hepático. Los sistemas disponibles actualmente combinan diferentes métodos que purifican toxinas y moléculas de distinto tamaño y tipo, basados en diálisis enriquecida con albúmina. En los últimos años se han desarrollado nuevos filtros de adsorción promisorios y las técnicas convencionales, como el recambio plasmático, se encuentran en reevaluación. Sin embargo, aún no hay consenso en cuanto a la terapia ideal. El objetivo de este artículo es ofrecer una visión actualizada del estado del arte, tecnologías disponibles y resultados de las diversas técnicas en diferentes escenarios clínicos.
Fulminant hepatic failure (FHF) and acute on chronic liver failure (ACLF) are entities with high morbidity and mortality, with liver transplantation being, in most cases, the only effective therapeutic alternative. The shortage of donors makes it necessary to have liver function support systems, which allow the patient to be kept in adequate conditions until transplantation or improvement. Despite greater knowledge of the pathophysiology of FHF, ACLF, as well as technological advances, we still do not have extracorporeal artificial liver support systems that allow complete replacement of liver function, acting mainly as palliative or symptomatic therapies while awaiting liver transplantation. The systems currently available combine different methods that purify toxins and molecules of different sizes and types, based on dialysis enriched with albumin. In recent years, promising new adsorption filters have been developed and conventional techniques, such as plasma exchange, are under reevaluation. There is still no consensus, however, regarding ideal therapy in different clinical scenarios. The objective of this article is to offer a state of the art view of available technologies and results in different clinical scenarios.
El hígado es un órgano fundamental para el metabolismo, cumpliendo múltiples funciones; tales como síntesis de proteínas y factores de coagulación, biotransformación de fármacos y otras sustancias endógenas y eliminación de sustancias hidrosolubles (como amonio), liposolubles (como ácidos biliares y bilirrubina), mediadores inflamatorios y citoquinas. Además, es fundamental en la respuesta inflamatoria sistémica, mediante la producción de reactantes de fase aguda.
La insuficiencia hepática aguda, como resultado de un daño hepatocelular agudo, se presenta en el contexto de múltiples patologías tanto virales, autoinmunes, enfermedades de depósito y exposición a tóxicos como el acetaminofeno. En esta situación, el hígado pierde funciones metabólicas y de síntesis de proteínas. Existe liberación de mediadores inflamatorios a la circulación esplácnica y posteriormente a la sistémica. Dentro de estas sustancias se encuentra el amonio, múltiples citoquinas proinflamatorias como IL-1, IL-6 y TNF-alfa y proteínas asociadas a daño molecular. Lo anterior contribuye a disfunción hemodinámica, deterioro de otros sistemas y finalmente a falla multiórgánica1.
Existen dos situaciones de disfunción hepática de interés clínico: la falla hepática fulminante (FHF) y la falla hepática aguda sobre crónica (ACLF, por sus siglas en inglés), en las que con frecuencia ocurre disfunción orgánica múltiple. En ambos casos, la liberación de sustancias proinflamatorias a la circulación propicia la disfunción de otros sistemas llevando a una elevada morbimortalidad. La terapia médica convencional no suele ser suficiente, siendo habitualmente el trasplante hepático la alternativa terapéutica definitiva2.
En Chile y en otros países del mundo, la cultura de donación de órganos dista de ser ideal. En Chile, la mejor tasa de donación de órganos ha sido de 10 donantes por millón de habitantes. Según datos del sitio web del “Sistema Integrado de Donantes y Trasplantes”, al 2019 el número de pacientes en lista de espera para trasplante hepático era de 154, de los cuales 143 lograron ser trasplantados3. La escasez de donantes y las dificultades inherentes a la procuración, preparación y transferencia del injerto hacen necesario contar con técnicas de soporte de las funciones hepáticas, principalmente las relacionadas con la depuración de sustancias tóxicas, como terapia puente hasta realizar el trasplante hepático.
Múltiples sistemas de soporte hepático extracorpóreo han sido descritos, tanto biológicos como no biológicos. Los primeros están basados en el uso de líneas celulares que pueden suplir las funciones del hepatocito, a los que no nos referiremos en este artículo. En los no biológicos, existe como principio básico una técnica de remoción de sustancias tóxicas mediante técnicas de aféresis de alto volumen, diálisis o adsorción. Estas técnicas no biológicas pueden ser utilizadas de manera aislada o combinada, como también conectados a otros sistemas de soporte extracorpóreo.
En la actualidad, las técnicas disponibles incluyen diálisis enriquecidas con albúmina de un solo paso y otros sistemas más complejos como el sistema de recirculación con adsorbentes moleculares (MARS, por sus siglas en inglés), el sistema de separación y adsorción de plasma fraccionado Prometheus® y DIALIVETM, sistema que incluye dos filtros que permiten realizar manejo de pacientes con ACLF. Si bien la utilidad de estos sistemas en FHF y ACLF ha sido demostrada en distintos estudios, aún hay controversia en cuanto a su indicación. A continuación, se ofrecerá una visión más detallada de las diversas modalidades de soporte extracorpóreo.
1Modalidades de soporte hepático de una sola técnicaHemodiálisis, hemofiltración y hemodiafiltraciónEl principio de utilizar estas modalidades radica en la remoción de sustancias hidrosolubles como el amonio, lo que tendría impacto en la encefalopatía hepática4. Por otra parte, permite resolver desórdenes hidroelectrolíticos y remueve otras sustancias como fósforo, productos nitrogenados y creatinina, sin generar un importante efecto en la hemodinamia, ni producir variaciones agresivas del medio interno, reduciendo el riesgo de mielinolisis. Dado que la urea y el amonio comparten similitudes en términos de su cinética de eliminación, la terapia de reemplazo renal (TRR) es una excelente alternativa para su depuración4.
En la FHF asociada a disfunción renal, se recomiendan técnicas de reemplazo renal continuo (CRRT, por sus siglas en inglés) por sobre técnicas intermitentes, dado su impacto en la disminución del edema cerebral y la hipertensión intracraneana5.
La hiperamonemia con niveles superiores a 150μmol/l, se ha visto como un predictor de la ocurrencia de encefalopatía hepática, edema cerebral y, en consecuencia, de hipertensión intracraneana5. La TRR, principalmente en su modalidad continua, ha demostrado ser eficaz en generar reducciones de niveles de amonio en pacientes con FHF y ACLF, mejorando la sobrevida libre de trasplante a 21 días en este grupo de pacientes6.
Dentro de sus ventajas destaca ser de bajo costo y de acceso extenso en las unidades de cuidados intensivos, con baja tasa de efectos adversos, siendo los más habituales los asociados a la instalación de accesos vasculares.
Fuentes7, en su artículo en este número, aborda complementariamente el tema de TRR en pacientes críticos agudos.
Hemofiltración de alto volumen y membranas de cut-off elevadoLa hemofiltración de alto volumen (HVHF, por sus siglas en inglés) se caracteriza por flujos elevados y su administración puede ser intermitente o continua. En el caso de terapias continuas los flujos son del orden de 50 a 70ml/kg/h. Se constituye como una alternativa a la CRRT por su capacidad de remover moléculas de peso molecular intermedio entre los 5 a 60 kDa, donde se ubican múltiples moléculas hidrosolubles y citoquinas. La ultrafiltración se encuentra potenciada, logrando mejor remoción de amonio. Esta característica genera la desventaja de producir pérdida de albúmina, antimicrobianos y nutrientes.
El uso de membranas de cut-off elevado, representa un paso más adelante en la remoción de moléculas de pesos moleculares intermedios. Su diseño, permite un límite de peso molecular de 60 KDa, lo que permite remover citoquinas como IL-6, IL-8 y TNF-alfa. Su principal limitación es el alto costo de las membranas, lo que restringe su disponibilidad8.
Hemoperfusión o perfusión plasmáticaEs una técnica depurativa que permite reducir los niveles de citoquinas y otros mediadores inflamatorios en plasma. Su fundamento es el contacto de sangre del paciente con una membrana adsorbente mediante un circuito extracorpóreo. Según la condición del paciente, esta técnica puede ser combinada con otras modalidades de soporte hepático extracorpóreo. La modalidad más citada es el Cytosorb®, un filtro de hemoperfusión directa que permite eliminar toxinas hidrofóbicas, citoquinas y otros mediadores inflamatorios. Este sistema permitió inicialmente optimizar el manejo del shock séptico grave, estados inflamatorios severos tales como pancreatitis y grandes quemados9 y mostró utilidad en pacientes con COVID-19 en situaciones de tormenta de citoquinas10. El Cytosorb® remueve albúmina, amonio, ácidos biliares, proteína C reactiva, entre otros. Su perfil de seguridad y facilidad de uso lo hacen una alternativa interesante, si bien limitada por su costo. Se debe tener en cuenta que puede generar trombocitopenia y remover sustancias de interés clínico, como citoquinas inmuno-moduladoras o medicamentos como antimicrobianos. Kemeny et al. relatan su experiencia con Cytosorb® en una cohorte de pacientes en nuestra institución11.
Sistema de adsorción molecular de plasma doble (DPMAS)Este sistema (DPMAS, por sus siglas en inglés) integra la perfusión plasmática posterior a la separación plasmática, combinando dos sistemas de adsorción molecular. El plasma del paciente se separa y filtra a través de dos columnas de hemoperfusión, para luego ser recirculado al organismo. Esto posibilita la eliminación de macromoléculas y moléculas de tamaño intermedio, así como de moléculas unidas a proteínas, como la bilirrubina, ácidos biliares, amonio, fenol, mercaptano y moléculas inflamatorias12. Esta capacidad podría contribuir a mejorar el pronóstico en pacientes con falla hepática. Entre sus ventajas se incluye la ausencia de necesidad de reemplazo plasmático, la rápida eliminación de bilirrubina y plasma exógeno sin requerir de plasma externo, como también la posibilidad de intensificar el tratamiento ajustando la columna adsorbente según la necesidad. Una limitación de este sistema radica en la falta de suplementación de albúmina o factores de coagulación, lo que podría llevar a un aumento en el riesgo de sangrado. La frecuencia de su aplicación dependerá de la gravedad y la causa de la enfermedad12. En la actualidad, se está llevando a cabo un ensayo clínico cuyo protocolo está publicado en BMJ Open que incluirá el uso de DPMAS asociado a recambio plasmático de bajo volumen en pacientes con hepatitis B y ACLF13 (Tabla 1).
Modalidades de soporte hepático con técnicas combinadasDentro de las técnicas combinadas de soporte han proliferado las que implican realizar diálisis extracorpórea con albúmina (ECAD, por sus siglas en inglés), que permite reducir los niveles de sustancias hidrosolubles y liposolubles unidas a albúminas, incluidas citoquinas proinflamatorias que se encuentran elevadas en FHF y ACLF. Los sistemas actualmente disponibles son el de diálisis con albúmina de paso único (SPAD, por sus siglas en inglés), MARS, y Prometheus®. De estos, el MARS es el más estudiado y utilizado a nivel mundial.
Diálisis con albúmina de paso único (SPAD)Esta técnica considera el uso de un equipo de diálisis o hemofiltración convencional. Se realiza el paso de la sangre del paciente en contacto con una membrana de alto flujo que a su vez contacta un líquido de diálisis enriquecido con albúmina. Esta técnica puede utilizarse de manera aislada, o al adicionar un filtro de hemofiltración de alto flujo puede realizarse hemodiálisis continua. Genera un gran consumo de albúmina, dado que la albúmina es eliminada junto con las sustancias tóxicas que son removidas. Esto aumenta su costo, el cual puede ser mitigado utilizando diluciones de albúmina al 3-5% (a diferencia del MARS que utiliza albúmina al 20%). La evidencia disponible a la fecha para SPAD sólo comprende reportes de casos14 y se ha comparado con MARS, donde si bien la eficacia parece ser similar, la metodología utilizada no permite sacar conclusiones al respecto15.
Sistema de recirculación con adsorbentes moleculares (MARS)Está técnica permite remoción semi-selectiva de toxinas ligada a albúmina. Consta de dos circuitos: un circuito de alto flujo impermeable a albúmina y un circuito cerrado de albúmina al 20%. La albúmina pasa por el circuito de dializado del filtro sanguíneo y se regenera circulando por un dializador, primero contra una solución de dializado con bicarbonato y posteriormente, a través de una columna con resina de intercambio aniónico y otra columna de carbón activado. A diferencia de la diálisis convencional, el dializado está enriquecido con albúmina, uniendo sustancias hidrofóbicas. Es más selectivo que el recambio plasmático, porque excluye moléculas mayores de 30 KDa. El mecanismo de depuración es difusión a través de la membrana semi-selectiva y el movimiento se produce por gradiente de concentración. El gradiente se mantiene mediante la recirculación constante de albúmina en el dializado, que es regenerada en línea mediante diálisis y paso por filtros de carbón activado (Figura 1).
En términos de la capacidad de remoción de sustancias, MARS remueve muchas de las sustancias dañinas en ACLF como bilirrubina, ácidos biliares, amonio, aminoácidos aromáticos, fenol, mercaptano, lactato, glutamina, mediadores de estrés oxidativo, ácidos grasos, benzodiazepinas endógenas, citoquinas proinflamatorias y mediadores vasoactivos, mejorando la hemodinamia hepática16.
El uso de esta técnica puede ser intermitente, en intervalos de 6 a 8 horas diarias, o continua. La velocidad de flujo es de 150-250ml/min, dependiendo del estado de la hemodinamia del paciente. Se ha utilizado en varios tipos de patología hepática: FHF, ACLF, falla hepática post trasplante, prurito refractario, sobredosis de drogas y disfunción hepática secundaria a patología crítica. En relación a sobrevida, múltiples estudios han evaluado este punto. En un estudio aleatorizado controlado publicado en 2013, se reclutaron 102 pacientes con FHF que cumplían criterios de trasplante hepático, 49 recibieron tratamiento estándar y 39 MARS, con al menos 1 sesión de 5 horas o más de terapia. La sobrevida a 6 meses fue 75,5% con tratamiento convencional y 84,9% con MARS. Al analizar el grupo con FHF por paracetamol las diferencias de sobrevida fueron más marcadas, con 68,4% en grupo de terapia estándar versus 85% en el grupo tratado con MARS17. El estudio RELIEF aleatorizó 95 pacientes a recibir MARS y terapia estándar, vs terapia estándar (94 pacientes), mostrando mejoría en la encefalopatía y disminución de la creatinina en la rama de MARS. Sin embargo, no mostró diferencia en sobrevida a 28 días18. Por otra parte, el grupo estadounidense de estudio de falla hepática fulminante, realizó un estudio que incluyó 104 pacientes con FHF versus 416 controles, mostrando que los pacientes con 3 o más sesiones de MARS tuvieron aumento significativo de la posibilidad de sobrevida libre de trasplante a 21 días (OR 1,90; 95% CI, 1,07-3,39; p=0,030). El efecto fue particularmente notorio en los pacientes con FHF secundaria a acetaminofeno19. Esto sugiere que en aquellos lugares con baja tasa de donación, MARS podría tener beneficio en sobrevida pre-trasplante.
En pacientes con enfermedades colestásicas y colestasia grave, el manejo del prurito intratable puede ser una indicación de apoyo con sistemas extracorpóreos, principalmente para el uso de MARS™. Dentro de las primeras aproximaciones en 2010, en una serie de 20 pacientes con prurito intratable, el uso de esta técnica redujo en un 72% el prurito, determinado por una escala visual y más del 50% de los pacientes refirieron mantener el efecto a los 30 días de haber sido sometidos a la técnica20. El efecto sobre el prurito fue independiente de la causa de la colestasia. La mayoría de la evidencia es de estudios retrospectivos con bajo número de pacientes, como fue publicado en una revisión sistemática publicada este año, donde MARS™ fue reportado como una alternativa para el manejo del prurito intratable en más de 5 estudios retrospectivos21.
Sistema de separación y adsorción de plasma fraccionado (FPSA- Prometheus®)Este sistema está compuesto por dos circuitos en serie, el primero fracciona selectivamente la albúmina mediante un filtro AlbuFlow®. Posteriormente se realiza depuración de la albúmina mediante adsorción, la cual se realiza mediante resina neutra y de intercambio iónico. La albúmina depurada retorna a la circulación del paciente, para posteriormente pasar a un circuito de alto flujo donde se realiza la depuración de moléculas hidrofílicas mediante hemodiálisis. Su ventaja es que, al ser un método de extracción directo, requiere menos albúmina que la utilizada por sistemas de diálisis de albúmina. Se ha objetivado disminución estadísticamente significativa de bilirrubina, ácidos biliares, creatinina, urea y amonio. Sin embargo, en relación a la eliminación de citoquinas, los resultados son contradictorios22,23.
En cuanto a sobrevida, el estudio HELIOS (Prometheus®), un estudio controlado aleatorizado multicéntrico europeo utilizando FPSA, evaluó la sobrevida de 145 pacientes con descompensación aguda de su daño hepático crónico. Se incluyeron pacientes con score de Child Pugh>10 y bilirrubina>5mg/dl y se comparó uso de FPSA y terapia convencional versus terapia médica convencional. La sobrevida a 28 días no fue estadísticamente significativa (66% en FPSA y 63% en grupo control, p=0,7). Cabe destacar que en el seguimiento a 90 días, se observó mayor sobrevida en el grupo tratado, en particular, los subgrupos con síndrome hepatorrenal tipo 1 (HRS-1, por sus siglas en inglés) o con MELD (model for end-stage liver disease) score>3024.
Los efectos adversos descritos se relacionan con el acceso vascular (infección, disfunción, trombosis o sangrado), y alteraciones intra-procedimiento tales como hipotensión, hemolisis, alteraciones hidroelectrolíticas, leucocitosis sin infección y trombocitopenia.
Plasmafiltración acoplada a adsorciónEsta técnica integra adsorción con hemofiltración o hemodiálisis. Utiliza una resina de intercambio neutra y una de intercambio aniónico. La remoción de sustancias se realiza por dos columnas de hemoperfusión que posteriormente se recircula al organismo. Logra remoción eficiente de varias macromoléculas, moléculas de tamaño molecular intermedio y toxinas unidas a proteínas plasmáticas, además, logra remover eficientemente bilirrubina, ácidos biliares, amonio, fenol, mercaptano y citoquinas12,25. Dentro de los beneficios, no requiere aporte de plasma o reposición de fluido durante el tratamiento, lo que reduce su riesgo de reacciones anafilácticas. Dentro de sus desventajas, dado que la depuración no es selectiva y que no es posible la reposición de albúmina y plasma, pueden existir sangrados y otras alteraciones de coagulación. Desafortunadamente, hay falta de evidencia que respalde el uso de esta técnica en pacientes con FHF y ACLF22.
Otras modalidadesRecambio plasmático/recambio plasmático selectivoLa plasmaféresis o recambio plasmático de alto volumen (HVPE, por sus siglas en inglés) basa su utilidad en el reemplazo del plasma del paciente por plasma fresco congelado (FFP, por sus siglas en inglés). Es una técnica que se encuentra disponible en la mayoría de las unidades de terapia intensiva. Requiere de un soporte de banco de sangre importante. Su uso permite la remoción de múltiples sustancias, de diversos pesos moleculares y unidas a proteínas plasmáticas. No está recomendado en pacientes con encefalopatía hepática pre-existente, debido a que se producen cambios agresivos en el medio interno, alcalosis metabólica secundaria al FFP y variaciones del poder oncótico del plasma que pueden generar mayor deterioro de la encefalopatía.
La frecuencia de su aplicación, dependerá de las condiciones de paciente y debe considerar la vida media y distribución del agente a depurar y la severidad de la enfermedad primaria. Es posible guiar la terapia por el nivel de bilirrubina, como marcador de respuesta terapéutica. Su implementación es rápida, sin embargo, requiere de un acceso vascular de alto flujo. Sus principales reacciones adversas están relacionadas con la instalación de accesos vasculares, como sangrados en sitio de punción, infecciones, coagulopatía y reacciones alérgicas de diversa gravedad, secundarias al uso de FFP.
La plasmaféresis es la técnica con mayor evidencia de efectos positivos en el desenlace clínico de los pacientes. De la evidencia disponible, un estudio clínico aleatorizado multicéntrico que incluyó 182 pacientes, comparó intercambio plasmático de alto volumen (HPVE, por sus siglas en inglés) con tratamiento estándar; observando mejoría de sobrevida global intrahospitalaria de 58,7% versus 47,8% a favor de HPVE (HR 0,56; 95% CI 0,36-0,86; p=0,008). Sin embargo, no hubo diferencia en mortalidad previo al trasplante. En pacientes que no fueron candidatos a trasplante por presentar alguna contraindicación; la sobrevida fue superior a los que recibieron tratamiento estándar26.
Un metaanálisis publicado en 2021, comparó las diversas estrategias de soporte extracorpóreo en ACLF, donde se evaluó sobrevida a 30 y 90 días. En ambos análisis la sobrevida fue superior con el uso de plasmaféresis: sobrevida a 30 días: RR 0,51 (IC 0,12-2,4) sobrevida a 90 días, RR 0,74 IC 0,6-0,9420.
Finalmente, un grupo DELPHI de expertos internacionales emitió un guía clínica de uso de las terapias extracorpóreas, donde posiciona a la HPVE como una excelente alternativa para el manejo de los pacientes, reafirmando los beneficios en sobrevida hospitalaria y sobrevida libre de trasplante, convirtiéndola en la alternativa con mayor evidencia como terapia puente al trasplante hepático27 (Tabla 2).
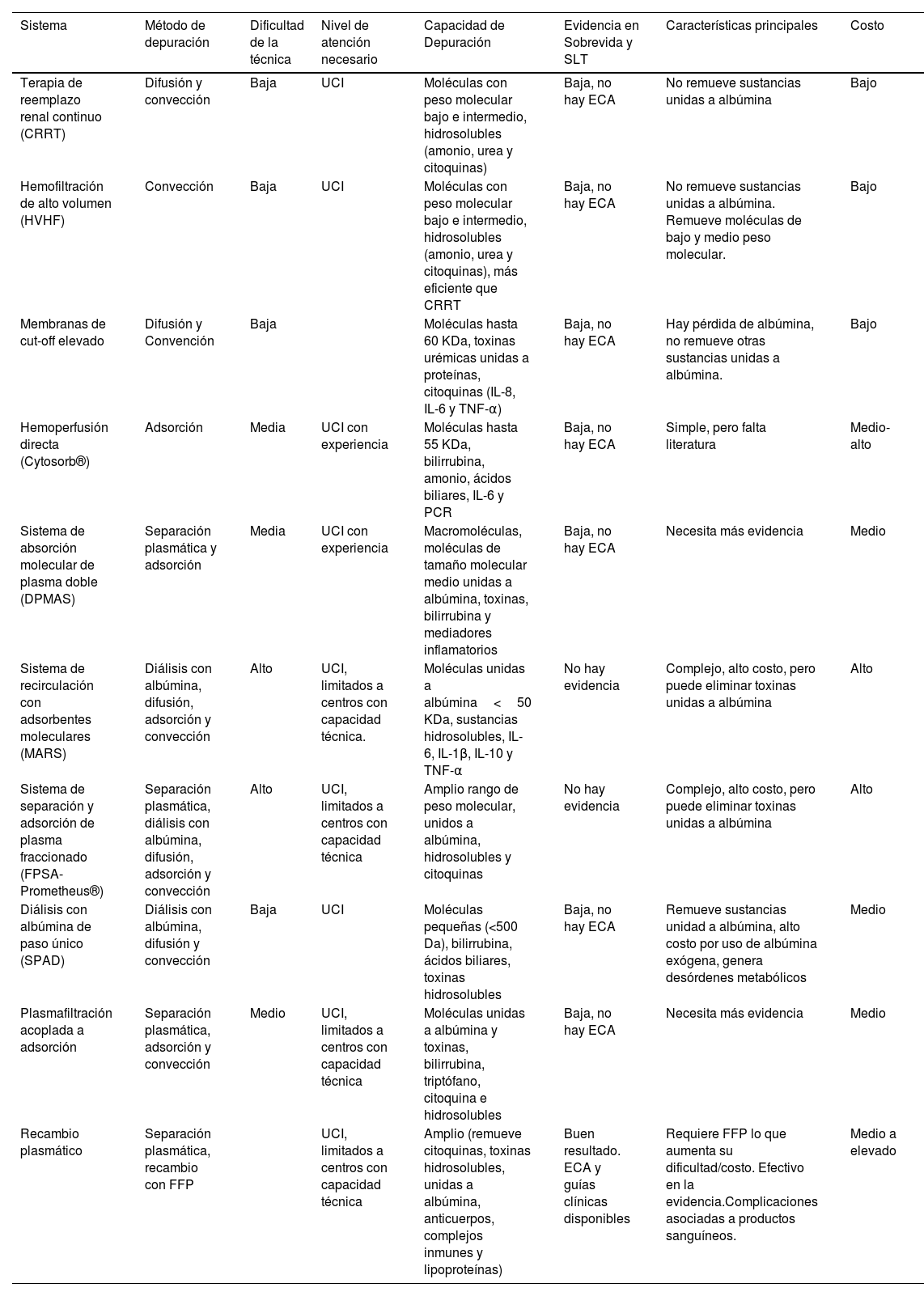
Comparación de los diferentes sistemas de soporte hepático extracorpóreo
| Sistema | Método de depuración | Dificultad de la técnica | Nivel de atención necesario | Capacidad de Depuración | Evidencia en Sobrevida y SLT | Características principales | Costo |
|---|---|---|---|---|---|---|---|
| Terapia de reemplazo renal continuo (CRRT) | Difusión y convección | Baja | UCI | Moléculas con peso molecular bajo e intermedio, hidrosolubles (amonio, urea y citoquinas) | Baja, no hay ECA | No remueve sustancias unidas a albúmina | Bajo |
| Hemofiltración de alto volumen (HVHF) | Convección | Baja | UCI | Moléculas con peso molecular bajo e intermedio, hidrosolubles (amonio, urea y citoquinas), más eficiente que CRRT | Baja, no hay ECA | No remueve sustancias unidas a albúmina. Remueve moléculas de bajo y medio peso molecular. | Bajo |
| Membranas de cut-off elevado | Difusión y Convención | Baja | Moléculas hasta 60 KDa, toxinas urémicas unidas a proteínas, citoquinas (IL-8, IL-6 y TNF-α) | Baja, no hay ECA | Hay pérdida de albúmina, no remueve otras sustancias unidas a albúmina. | Bajo | |
| Hemoperfusión directa (Cytosorb®) | Adsorción | Media | UCI con experiencia | Moléculas hasta 55 KDa, bilirrubina, amonio, ácidos biliares, IL-6 y PCR | Baja, no hay ECA | Simple, pero falta literatura | Medio-alto |
| Sistema de absorción molecular de plasma doble (DPMAS) | Separación plasmática y adsorción | Media | UCI con experiencia | Macromoléculas, moléculas de tamaño molecular medio unidas a albúmina, toxinas, bilirrubina y mediadores inflamatorios | Baja, no hay ECA | Necesita más evidencia | Medio |
| Sistema de recirculación con adsorbentes moleculares (MARS) | Diálisis con albúmina, difusión, adsorción y convección | Alto | UCI, limitados a centros con capacidad técnica. | Moléculas unidas a albúmina<50 KDa, sustancias hidrosolubles, IL-6, IL-1β, IL-10 y TNF-α | No hay evidencia | Complejo, alto costo, pero puede eliminar toxinas unidas a albúmina | Alto |
| Sistema de separación y adsorción de plasma fraccionado (FPSA- Prometheus®) | Separación plasmática, diálisis con albúmina, difusión, adsorción y convección | Alto | UCI, limitados a centros con capacidad técnica | Amplio rango de peso molecular, unidos a albúmina, hidrosolubles y citoquinas | No hay evidencia | Complejo, alto costo, pero puede eliminar toxinas unidas a albúmina | Alto |
| Diálisis con albúmina de paso único (SPAD) | Diálisis con albúmina, difusión y convección | Baja | UCI | Moléculas pequeñas (<500 Da), bilirrubina, ácidos biliares, toxinas hidrosolubles | Baja, no hay ECA | Remueve sustancias unidad a albúmina, alto costo por uso de albúmina exógena, genera desórdenes metabólicos | Medio |
| Plasmafiltración acoplada a adsorción | Separación plasmática, adsorción y convección | Medio | UCI, limitados a centros con capacidad técnica | Moléculas unidas a albúmina y toxinas, bilirrubina, triptófano, citoquina e hidrosolubles | Baja, no hay ECA | Necesita más evidencia | Medio |
| Recambio plasmático | Separación plasmática, recambio con FFP | UCI, limitados a centros con capacidad técnica | Amplio (remueve citoquinas, toxinas hidrosolubles, unidas a albúmina, anticuerpos, complejos inmunes y lipoproteínas) | Buen resultado. ECA y guías clínicas disponibles | Requiere FFP lo que aumenta su dificultad/costo. Efectivo en la evidencia.Complicaciones asociadas a productos sanguíneos. | Medio a elevado |
Acrónimos - CRRT: terapia de reemplazo renal continuo; HF: hemofiltración; ECA: ensayo clínico aleatorizado; UCI: Unidad de Cuidados Intensivos; PCR: proteína C- reactiva; MARS: Molecular Adsorbent Recirculating System; Prometheus®: separación y adsorción de plasma fraccionado; SLT: sobrevida libre de trasplante; FFP: plasma fresco congelado.
Este sistema combina la diálisis con dos filtros que realizan depuración de sustancias tóxicas críticas. Su diseño se basa en el conocimiento de los mecanismos involucrados en ACLF, la eliminación de albúmina disfuncional y patrones moleculares asociados a daño y patógenos (DAMPs y PAMPs, por sus siglas en inglés). Un primer filtro elimina toxinas sanguíneas, incluidos productos de muerte celular y toxinas bacterianas, y otro que elimina la albúmina dañada y posteriormente la reemplaza por albúmina nueva. Un estudio aleatorizado controlado que evaluó DIALIVE™ en pacientes con ACLF versus terapia estándar, tuvo como objetivo principal evaluar la seguridad de la técnica. Se incluyeron 32 pacientes con ACLF secundario a abuso de alcohol, edad promedio 49 años, un tercio tenía al menos una comorbilidad y un score MELD-Na en torno a 27 puntos. Los pacientes del grupo intervenido fueron sometidos a DIALIVETM con una mediana de 3 días, con sesiones de duración entre 8 y 12 horas, siendo evaluados al décimo día de tratamiento. Se observó una reducción significativa del tiempo de resolución de la ACLF. Para medir el resultado utilizaron score pronósticos validados y marcadores de inflamación sistémica como IL-8 o endotoxinas derivadas de disfunción celular como citoqueratina 18, expresión de TLR4 (toll like receptor 4) e inflamosomas. En el estudio se evidenció que todos estos marcadores mejoraron con el uso de la técnica comparado con el tratamiento estándar. A su vez, se observó una reducción de la ocurrencia de falla orgánica múltiple28.
ConclusiónLa aplicación de las técnicas de soporte hepático extracorpóreo descritas, requiere una evaluación multidisciplinaria que involucre al intensivista, hepatólogo, nefrólogo y al equipo de trasplante. La correcta evaluación de la condición clínica del paciente y la experiencia del equipo clínico en la aplicación de la técnica es determinante en los resultados. Se debe considerar la disponibilidad de insumos y factores económicos al momento de definir la mejor alternativa terapéutica, con miras a maximizar las oportunidades de acceder a un trasplante y a reducir los efectos adversos y complicaciones.
La elección del sistema de depuración dependerá del objetivo terapéutico. De este modo, si se requiere realizar remoción de bilirrubina, se debe optar por sistemas que depuren moléculas de tamaño mediano y elevado. Si existe coagulopatía asociada, preferir sistemas que puedan aportar plasma exógeno como el HVPE. En pacientes con encefalopatía, preferir sistemas como el DPMAS o hemodiafiltración, incluyendo modalidades de soporte renal en HRS-1 o cuando existan alteraciones ácido base severas o de difícil corrección.
Basado en el consenso de expertos en referencia al soporte hepático artificial, los métodos de diálisis extracorpórea con albúmina como MARS™ estarían indicados en pacientes que cumplen con criterio de enlistado para trasplante hepático con insuficiencia hepática grave en su fase inicial, con el objetivo de detener la cascada inflamatoria, encefalopatía hepática grado 2-3 y HRS-1, ambos refractarios a terapia médica durante 24 a 48 horas. Los resultados son promisorios especialmente si la falla hepática es secundaria a intoxicación por paracetamol. Dentro de las contraindicaciones, no se recomienda su uso en pacientes con sepsis grave o shock séptico26.
Se debe realizar una evaluación dinámica de las condiciones del paciente, evaluar MELD, complicaciones, y en caso de mejoría, suspender terapia.
En nuestra experiencia, realizamos hemofiltración veno-venosa continua de alto flujo acoplado a Cytosorb®, en contexto de pacientes con inestabilidad hemodinámica en distintas situaciones clínicas, incluido FHF y ACLF11. No contamos con experiencia suficiente en los otros sistemas descritos como para emitir recomendaciones categóricas de su uso, si bien consideramos que las distintas técnicas de apoyo hepático extracorpóreo, son promisorias en miras de optimizar el manejo de pacientes con ACLF y FHF candidatos a trasplante hepático. Consideramos necesario seguir adquiriendo experiencia en la técnica así como observar la evolución de la tecnología para superar las limitantes actuales. Se requiere mayor investigación y desarrollo de estudios clínicos prospectivos aleatorizados, y generación de protocolos que combinen las distintas técnica disponibles de acuerdo a las necesidades de cada paciente.
FinanciaciónLos autores no han recibido financiamiento de agencias del sector público, sector comercial o entidades con o sin ánimo de lucro.
Declaración de conflicto de interésLos autores declaran no tener conflictos de intereses.