La utilización de antibióticos es común entre pacientes hospitalizados. De la mano con su utilización, se presentan reacciones adversas y potenciales toxicidades que es necesario prevenir, identificar y manejar. La multiplicidad de medicamentos y condiciones subyacentes de los pacientes, afectan la identificación y manejo de las reacciones adversas. De ser posible, se debe emplear el menor número de agentes necesarios y se debe seleccionar aquellos con un mejor perfil de seguridad e interacciones.
Este artículo describe los efectos secundarios, toxicidad e interacciones más importantes de los antibióticos más utilizados en pacientes hospitalizados, presentados por sistemas, tal como se presentan en la práctica clínica habitual y posteriormente de acuerdo a sus características farmacocinéticas y farmacodinámicas particulares, que permitan establecer herramientas de prevención y manejo.
Antibiotics use of is common among hospitalized patients. With its use, adverse reactions and potential toxicities are presented, which is necessary to prevent, identify and manage. The multiplicity of drugs and patients underlying conditions, affect the identification and management of adverse reactions. If possible, it should use the minimum number of agents required, and it must select those with a better safety profile and interactions.
This article describes the side effects, toxicity, and most important interactions of antibiotics commonly used in hospitalized patients, presented by system, as presented in routine clinical practice and subsequently according to their pharmacokinetic and pharmacodynamic characteristics tools that establish prevention and management
Una Reacción Adversa a Medicamento (RAM) se define como todo efecto que es perjudicial y no deseado y que ocurre a dosis usadas con fines terapéuticos, profilácticos o de diagnóstico. Las RAM constituyen un problema significativo y preocupante puesto que son causa de morbilidad, mortalidad y aumento de los costos de la atención de salud (1).
En Estados Unidos muchos pacientes son hospitalizados por año a causa de RAM. Reacciones potencialmente mortales incluyen arritmias, toxicidad hepática, falla renal aguda y acidosis láctica por tratamiento antirretroviral (2). Más de 100.000 de las reacciones adversas serias en pacientes hospitalizados en Estados Unidos, fueron mortales. Pacientes añosos (3) e infectados por VIH (4) son especialmente susceptibles.
Recientemente fue publicado un estudio comparativo transnacional de la tasa de eventos adversos a medicamentos en hospitales de Inglaterra, Alemania y Estados Unidos, en el que uno de cada 20 pacientes hospitalizados sufren un evento adverso a medicamentos en el momento del ingreso o durante la estadía en el hospital. El evento adverso más frecuente en todos los países fue la enterocolitis por Clostridium difficile, el segundo más frecuente en Alemania y los Estados Unidos fue la trombocitopenia secundaria a fármacos y luego la intoxicación por drogas. También destacan la neutropenia, agranulocitosis y la anemia aplástica principalmente por el uso de quimioterapia (5).
En Chile en 1995 se inició un programa nacional de farmacovigilancia, cuya finalidad es fomentar la notificación por parte de todo el personal de salud de las sospechas de RAM al Centro Nacional de Información de Medicamentos y Farmacovigilancia (CENIMEF) del Instituto de Salud Pública (ISP). Este informe es voluntario, lo que implica una subnotificación importante. Entre enero y octubre de 2013 fueron ingresadas 6.313 notificaciones, de las cuales el 12% (766 casos) correspondieron a reacciones graves, que causaron la muerte o prolongación de la estadía en el hospital. Según esta misma fuente, las reacciones adversas gastrointestinales y dermatológicas serían las más habituales, seguidas de reacciones del sistema nervioso central (6).
Más del 70% de los pacientes críticos reciben antibióticos como tratamiento o profilaxis, la mayoría de forma empírica y más de la mitad, reciben múltiples agentes. La probabilidad de experimentar una reacción adversa secundaria al uso de antibióticos es importante y si habitualmente no es fácil atribuir una reacción adversa a un antibiótico específico, en este escenario puede ser extremadamente difícil, porque involucra varios factores que operan al unísono (7).
En términos generales, las RAM incluyen las alergias, los efectos secundarios y la toxicidad (8).
- •
Una alergia es una reacción de hipersensibilidad a un fármaco.
- •
Los efectos secundarios incluyen reacciones adversas a medicamentos que no son ni inmunológicamente mediadas ni relacionadas con niveles tóxicos de la droga.
- •
La toxicidad se debe a que el medicamento se encuentra en cantidades superiores a las que pueden ser manejadas fisiológicamente por el organismo, ya sea por excesiva dosificación o por el deterioro del metabolismo y/o eliminación del fármaco por insuficiencia hepática o renal (8).
Que los antibióticos pueden causar diarrea es un hecho conocido desde el comienzo del uso de estos agentes. Además de ser una molestia en si misma, la diarrea puede resultar en otras complicaciones como deshidratación, desbalance electrolítico, malnutrición, contaminación de úlceras por presión y ocasionalmente, perforación intestinal y muerte (9).
La causa más común de diarrea nosocomial es el Clostridium difficile sin embargo, en la mayoría de los casos de diarrea asociada a antibióticos no se encuentra implicado este microorganismo. Existen otros factores de riesgo para la diarrea por Clostridium difficile como la hospitalización prolongada, cirugía gastrointestinal previa, enfermedad grave y comorbilidades, neoplasias y quimioterapia. Las tasas varían drásticamente entre hospitales y dentro de una misma institución, llegando a más de 30 pacientes por cada 1.000 altas (10).
El uso de antibióticos altera la flora del colon permitiendo el sobrecrecimiento de Clostridium difficile que produce diarrea a través de la liberación de toxinas A y B, que promueven la apoptosis celular, inflamación, y secreción de fluidos en el colon (11).
Los antibióticos más implicados en la diarrea por Clostridium difficile son las cefalosporinas, fluoroquinolonas, clindamicina, y ampicilina, aunque todos han sido asociados (11). Generalmente la diarrea comienza la primera semana de administración del antibiótico, pero también puede desarrollarse semanas después. La presentación clínica es altamente variable, pasando desde un portador asintomático a un shock séptico por bacteremia secundaria (12). Los casos más graves se asocian con colitis pseudomembranosa, perforación intestinal o shock séptico (13). Los pacientes pueden tener varias causas de diarrea, dolor abdominal, fiebre o leucocitosis; luego es necesario reconocer algunos elementos para sospechar de un paciente con colitis por Clostridium difficile: (a) inicio de la diarrea después de seis días del inicio de los antibióticos; (b) estadía hospitalaria de más de 15 días; (c) presencia de leucocitos fecales en deposiciones y; (d) heces semi-formadas (14). El diagnóstico se realiza a través de inmunoensayo enzimático, cultivo de tejido o por el hallazgo de pseudomembranas en la endoscopia (15).
Se debe evitar el uso de agentes antimotilidad (loperamida, opioides) y suspender el antibiótico causante. El tratamiento óptimo dependerá de la gravedad de la enfermedad. En casos leves a moderados, tanto metronidazol como vancomicina por vía oral, han mostrado similares tasas de respuesta clínica. En los casos severos y refractarios vancomicina oral es la terapia de elección (16, 17). En casos especialmente graves, con riesgo de perforación de colon, se recomienda la combinación de altas dosis de metronidazol por vía intravenosa e infusiones nasogástricas o enemas de vancomicina. Se encuentran en estudio la terapia con inmunoglobulinas intravenosas y enemas de heces (18). Con el uso de tigeciclina, las reacciones adversas más frecuentes son las gastrointestinales (diarrea, nauseas y vómitos). Considerando este hecho, pacientes con diarrea en tratamiento con el antibiótico, no debieran iniciar empíricamente metronidazol o vancomicina oral (19).
NefrotoxicidadLa nefrotoxicidad asociada a fármacos representa entre el 18% y el 27% de todos los casos de Insuficiencia Renal Aguda (IRA) en hospitales de Estados Unidos (20). Las dos principales causas de IRA son la Necrosis Tubular Aguda (NTA) y la enfermedad pre-renal, seguidas de la falla renal aguda sobre crónica, obstrucción urinaria, glomerulonefritis y nefritis intersticial aguda (21,22).
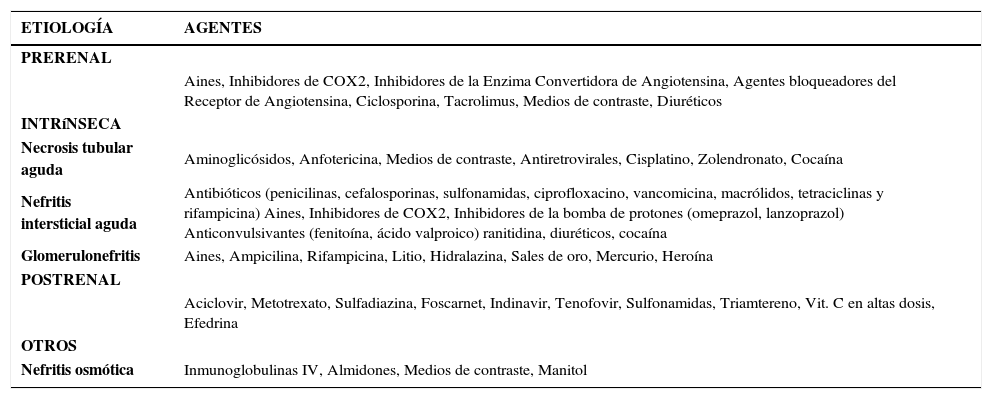
Numerosos fármacos son capaces de afectar la función renal (tabla 1), disminuyendo la filtración glomerular, causando NTA, nefritis intersticial, y cristalización en los túbulos renales. La probabilidad de nefrotoxicidad es mayor en pacientes con comorbilidades o que reciben varios nefrotóxicos (23).
Clasificación de Fármacos Que Inducen Insuficiencia Renal Aguda
| ETIOLOGÍA | AGENTES |
|---|---|
| PRERENAL | |
| Aines, Inhibidores de COX2, Inhibidores de la Enzima Convertidora de Angiotensina, Agentes bloqueadores del Receptor de Angiotensina, Ciclosporina, Tacrolimus, Medios de contraste, Diuréticos | |
| INTRíNSECA | |
| Necrosis tubular aguda | Aminoglicósidos, Anfotericina, Medios de contraste, Antiretrovirales, Cisplatino, Zolendronato, Cocaína |
| Nefritis intersticial aguda | Antibióticos (penicilinas, cefalosporinas, sulfonamidas, ciprofloxacino, vancomicina, macrólidos, tetraciclinas y rifampicina) Aines, Inhibidores de COX2, Inhibidores de la bomba de protones (omeprazol, lanzoprazol) Anticonvulsivantes (fenitoína, ácido valproico) ranitidina, diuréticos, cocaína |
| Glomerulonefritis | Aines, Ampicilina, Rifampicina, Litio, Hidralazina, Sales de oro, Mercurio, Heroína |
| POSTRENAL | |
| Aciclovir, Metotrexato, Sulfadiazina, Foscarnet, Indinavir, Tenofovir, Sulfonamidas, Triamtereno, Vit. C en altas dosis, Efedrina | |
| OTROS | |
| Nefritis osmótica | Inmunoglobulinas IV, Almidones, Medios de contraste, Manitol |
Los aminoglicósidos son un típico grupo de antibióticos asociados con IRA (7–25%), pero otros agentes incluyen sulfonamidas, b-lactámicos, y aciclovir. El daño se presenta como NTA, normalmente no oligúrica y la mayoría de las veces completamente reversible. Algunos pacientes requieren diálisis temporal y menos común, diálisis crónica. (24). Factores que contribuyen a la nefrotoxicidad por aminoglicósidos incluyen la dosis, la duración del tratamiento, el uso concomitante de otros nefrotóxicos, y elevados niveles valle. Incluso con niveles en rangos recomendados puede haber nefrotoxicidad (25). La dosificación una vez al día en adultos con función renal normal es la mejor estrategia para el tratamiento de infecciones por bacilos Gram negativos, con mejores tasas de respuesta clínica y menor toxicidad (26).
Los b-lactámicos, fluoroquinolonas, sulfonamidas, vancomicina y rifampicina en ocasiones pueden causar nefritis intersticial, generalmente tras altas dosis o terapias prolongadas (27). La nefritis intersticial por antibióticos puede ser variable en su presentación clínica y por ello, se debe sospechar de cualquier paciente con un agente potencialmente ofensivo que desarrolla disfunción renal aguda. La presencia de eosinófilos en orina apoyan el diagnóstico, pero está presente en menos de la mitad de los casos. La biopsia renal es el único elemento de diagnóstico concluyente (28).
Las sulfonamidas y aciclovir pueden cristalizar en los túbulos renales causando insuficiencia renal aguda. Las sulfonamidas también pueden bloquear la secreción tubular de creatinina, aumentando su valor plasmático, sin alterar la tasa de filtración glomerular (29).
La reacción adversa más frecuente para el colistin es la nefrotoxicidad y aunque el mecanismo exacto no está del todo claro, se propone un aumento en la permeabilidad de membrana de las células tubulares renales. La efluencia de cationes, aniones y agua causarían edema y lisis celular. Las tasas de nefrotoxicidad han oscilado desde el 100% en estudios más antiguos a un 0% en los más recientes. Las teorías que pueden explicar esta falta de coherencia incluyen estudios con diferentes poblaciones de pacientes, dosis variables y diferencias en el producto utilizado. La frecuencia y gravedad de nefrotoxicidad es consistente entre pacientes críticos con no-críticos. Además se observó que la mayoría de los casos son leves y reversibles. Existe un estudio preliminar que demuestra que la co-administración de ácido ascórbico tendría un efecto protector contra la nefrotoxicidad y la apoptosis inducida por colistin (30–32).
HepatotoxicidadAlteraciones en las pruebas de función hepática son comunes en pacientes hospitalizados. Estas pueden traducirse predominantemente en hepatitis, colestasia o tener un patrón mixto (33–35).
Numerosos antibacterianos se han asociado con injuria hepática (tabla 2). Aunque es poco frecuente para el grupo de los b–lactámicos, la penicilina con ácido clavulánico, es frecuente causa de hepatotoxicidad. Generalmente dentro de las cuatro semanas de iniciado el tratamiento y caracterizado por síntomas clínicos de enfermedad colestásica, como náuseas, vómitos, fatiga, fiebre, e ictericia (33, 34).
Patrón Clínico e Histológico de Injuria Hepática Por Antibióticos (35)
| PATRÓN DE PRESENTACIÓN | ANTIBIÓTICO |
|---|---|
| Necrosis hepatocelular y hepatitis aguda | Isoniazida, nitrofurantoína |
| Colestasia aguda | Eritromicina, sulfametoxazol/trimetoprim, amoxicilina/ácido clavulánico |
| Falla hepática aguda | Isoniazida, rifampicina, nitrofurantoína, sulfametoxazol/trimetoprim, amoxicilina/ácido clavulánico, ciprofloxacino |
| Hepatitis crónica o colestasia | Nitrofurantoína, sulfametoxazol/trimetoprim, minociclina, fucloxacilina |
| Autoinmune o inmunoalérgica | Sulfametoxazol/trimetoprim, minociclina |
| Esteatosis y esteato-hepatitis | Tetraciclinas EV |
| Granulomas | Sulfametoxazol/trimetoprim, amoxicilina/ácido clavulánico, pirazinamida |
Ceftriaxona en altas dosis o por tiempo prolongado, puede causar hepatitis y colestasia con formación de barro biliar (33–35).
Significativa hepatotoxicidad se ha asociado con agentes antituberculosos, específicamente isoniazida y rifampicina. En ambos casos la toxicidad se desarrolla dentro de los primeros meses de su inicio y es caracterizado por elevación de transaminasas. Mayor precaución se requiere con el uso de rifampicina que causa hepatitis ocasionalmente grave (33–35).
PancreatitisPancreatitis aguda por medicamentos es una causa relativamente infrecuente que representa aproximadamente el 0,1% a 2% de todos los casos de pancreatitis aguda (aunque la incidencia puede ser más alta en poblaciones específicas). La pancreatitis inducida por fármacos suele ser leve y autolimitada, aunque 5% a 15% de los pacientes tienen un curso fulminante que puede estar asociado a una morbi-mortalidad significativa. El diagnóstico suele ser basado en la presencia de síntomas (dolor abdominal, náuseas y vómitos) y elevación de las enzimas pancreáticas (36).
Las sulfonamidas producen pancreatitis a través de mecanismos inmunológicos y un efecto tóxico directo. Pentamidina y tetraciclina producirían pancreatitis por acumulación de un metabolito tóxico (36).
CardiotoxicidadUna de las reacciones adversas más temidas a nivel cardíaco es la prolongación del QT con arritmia ventricular, ya que en pacientes con enfermedad coronaria o trastornos electrolíticos, se puede producir torsión de punta y muerte (37). La arritmia de causa farmacológica frecuentemente va precedida de prolongación del QT. La prolongación del QT inducida por fármacos no siempre se traduce en torsión de puntas. Los antibióticos que pueden prolongar el QT incluyen macrólidos, quinolonas y pentamidina. Se debe considerar el uso de antibióticos alternativos en pacientes con un intervalo QT corregido superior a 500ms. Si el QTc aumenta por intervalos de 30 a 60ms o a más de 500ms, se debe considerar la sustitución del agente (37).
Existen reportes de depresión miocárdica, hipotensión y muerte súbita con la administración rápida de vancomicina en el período perioperatorio (38).
Reacciones adversas dermatológicasReacciones adversas cutáneas a fármacos son comunes y afectan del 2% al 3% de los pacientes hospitalizados. Se estima que uno de cada 1.000 pacientes hospitalizados tiene una reacción cutánea grave a medicamentos (39), siendo el uso de antibióticos sistémicos una causa importante de ello. La selección de antibióticos alternativos y el manejo de pacientes infectados con una reacción dermatológica grave, resulta ser todo un reto (40).
Comúnmente se presenta como rash que puede ser inocuo a potencialmente mortal. El problema radica en que las anomalías de la piel pueden ser causadas por múltiples factores y la identificación del agente agresor es difícil debido al gran número de medicamentos administrados a los pacientes y las dificultades en la asociación temporal de la reacción con la iniciación de cualquier agente individual. Los antibióticos más frecuentemente implicados son b-lactámicos, sulfonamidas, fluoroquinolonas y vancomicina, que después del quinto día de terapia producen erupciones maculopapulares que a menudo se generalizan y son pruriginosas (41–43).
Sólo en aquellos casos leves o moderadamente graves producidos por penicilina, es seguro usar cefalosporinas. Los pacientes con antecedentes de alergia a la penicilina pueden recibir con seguridad aztreonam, que es un monobactámico cuyos estudios in vitro y pruebas de la piel han demostrado no tener reactividad cruzada con la penicilina (44).
Se debe sospechar de una reacción grave en presencia de edema facial, urticaria, alteración de las mucosas, púrpura palpable o extensa, ampollas, fiebre o linfadenopatía. La presencia de eosinoflia también se asocia con una enfermedad más grave. Lo más importante es identificar e interrumpir el agente causal (45).
El síndrome de Stevens-Johnson es el eritema multiforme con compromiso de las mucosas de los ojos, de la boca, del tracto gastrointestinal, y genitourinario. Aminopenicilinas (amoxicilina, ampicilina) y sulfonamidas son los antibióticos más frecuentemente implicados. El inicio es típicamente entre la primera y tercera semana de tratamiento y clínicamente la erupción se puede presentar como lesiones simétricas, placas maculopapulares y urticaria, o lesiones vesiculares. La mortalidad es hasta 5%. El diagnóstico puede ser hecho por biopsia (45).
El síndrome de Stevens-Johnson puede evolucionar a Necrolisis Epidérmica Tóxica (NET) aumentando la mortalidad hasta un 30%. Las sulfonamidas son las más frecuentemente asociadas con NET. A pesar de no haber sido demostrados los beneficios de la terapia con corticoesteroides, a menudo se utilizan para el tratamiento (46).
El Síndrome de Hombre Rojo es una reacción transitoria asociada a la administración de vancomicina, caracterizado por prurito y erupción eritematosa en la cara, cuello y la parte superior del torso. Con menor frecuencia puede asociarse hipotensión y angioedema y en casos severos los pacientes se quejan de dolor torácico, disnea y toxicidad cardíaca severa. A menudo los signos aparecen en los primeros minutos de una infusión rápida (menos de una hora) de la primera dosis de vancomicina, pero puede ocurrir por primera vez después de varias dosis o pueden comenzar al final de una infusión lenta de 90 o 120 minutos en pacientes con terapia por más de siete días. Como primera medida, los protocolos de administración deben indicar la infusión en mínimo 60 minutos. Antagonistas de histamina pueden contrarrestar el síndrome en pacientes que no pueden suspender la terapia y que siguen haciendo el cuadro a pesar de la administración lenta (47–49). El Síndrome de Hombre Rojo también se ha relacionado con la administración intraperitoneal y oral de vancomicina (50).
Otra reacción a considerar en pacientes hospitalizados es la flebitis o inflamación de las venas. Se han identificado como antibióticos flebíticos la penicilina potásica, cefalosporinas, vancomicina y cloxacilina. Un problema particularmente difícil es poder diferenciar entre flebitis séptica y química. La primera se produce por infección y la segunda por irritación causada por el material del catéter o por la infusión de una droga. Ambas cursan con enrojecimiento, calor local y aumento de volumen; si es infecciosa, se retira el catéter y se administran antibióticos, pero si se trata de una irritación química, se retira el catéter, se aplica calor húmedo y se disminuye la velocidad de administración del agente (51).
Reacciones adversas hematológicasLeucopeniaLa leucopenia y agranulocitosis inducida por fármacos es generalmente reversible y es raro que los pacientes desarrollen una infección producto de la disminución en los leucocitos funcionantes (52). Se ha reportado con la mayoría de los b-lactámicos, trimetoprim-sulfametoxazol, vancomicina, macrólidos, clindamicina, cloranfenicol y fucitosina (53).
Neutropenia severa se desarrolla entre el 5% y el 15% de los pacientes con b-lactámicos en tratamiento por más de 10 días, dosis altas y con disfunción hepática grave. En tanto que cae a menos de 1% al utilizar cursos cortos en pacientes con función hepática normal (54).
La vancomicina produciría neutropenia después de dos semanas de tratamiento intravenoso y sería a través de la destrucción periférica o el secuestro de mielocitos circulantes (55).
TrombocitopeniaLos antibióticos producen trombocitopenia por destrucción periférica inmunomediada de plaquetas o por una disminución en el número de megacariocitos (56).
El linezolid es el antimicrobiano con más probabilidades de causar destrucción inmunomediada de plaquetas, aunque potencialmente también podría ser a través de mielosupresión directa. La incidencia fluctúa entre un 2% y un 35% en pacientes con función renal normal y tendría directa relación con la duración de la terapia. Los recuentos de plaquetas pueden continuar disminuyendo después de la suspensión, pero se recuperan entre 4 a 13 días después. La insuficiencia renal puede aumentar el riesgo de trombocitopenia (57–60).
La vancomicina puede estimular la producción de anticuerpos anti plaquetarios, provocando trombocitopenia y hemorragia grave. Los estudios sugieren que el recuento de plaquetas alcanza su nadir alrededor del octavo día de tratamiento, llegando la recuperación aproximadamente después de ocho días de interrumpida la terapia o más, en presencia de insuficiencia renal (61).
Las sulfonamidas, rifampicina, fluorquinolonas y menos los b-lactámicos (incluyendo penicilina, ampicilina, meticilina, cefazolina y piperacilina) han reportado inducir la destrucción de las plaquetas (62).
La trombocitopenia inducida por cloranfenicol es dosis dependiente y si no está asociado con anemia aplástica, es reversible tras la discontinuación del fármaco (63).
AnemiaLinezolid y cloranfenicol causan anemia mediante la supresión de la eritropoyesis (63, 64).
El cloranfenicol en aproximadamente uno de cada 25.000 pacientes provoca anemia aplástica irreversible idiosincrática, si las concentraciones del fármaco exceden los límites recomendados (63).
Los b-lactámicos, nitrofurantoína y en raras ocasiones los aminoglicósidos, pueden causar anemia hemolítica. Aquellos pacientes que poseen déficit de 6-fosfato glucosa-deshidrogenasa tienen mayor pre disposición a desarrollar anemia hemolítica por sulfonamidas y por doxiciclina (65).
Alteraciones de la coagulaciónCondiciones como malnutrición, insuficiencia renal y hepática, tumores malignos y medicamentos, pueden predisponer a los pacientes al sangrado (66).
Antibióticos como las penicilinas pueden causar disfunción de la agregación plaquetaria a través del bloqueo de los sitios de unión en la superficie de las plaquetas. La reacción es dosis dependiente y puede ser exacerbada por insuficiencia renal. Se debe sospechar esta causa en pacientes con hemorragia aunque no hayan alteraciones en el INR o en el TTPA (67).
Los antibióticos pueden prolongar el INR al afectar la flora gastrointestinal normal y con ello deteriorar la absorción de vitamina K. Otros antibióticos causan hemorragia con prolongación del INR, como la cefoperazona, que contiene un grupo N-metil- tiotetrazol, que puede interferir con la síntesis de protrombina hepática (68, 69).
NeurotoxicidadLa ototoxicidad inducida por fármacos puede resultar en la pérdida de la audición o disfunción vestibular. La eritromicina y la azitromicina pueden causar pérdida de audición bilateral o disfunción laberíntica, dosis dependiente y normalmente reversible dentro de las dos semanas de discontinuado el agente, pero también pueden provocar pérdida permanente de la audición o vértigo. Estas complicaciones por lo general se producen en presencia de disfunción renal o hepática (70–72).
Los aminoglicósidos causan ototoxicidad o disfunción vestibular en el 10% al 22% de los pacientes, pudiendo ser permanente. Favorecen la disfunción la dosis acumulada, la frecuencia de administración, la duración del tratamiento, la edad avanzada, fiebre, anemia, clearance de creatinina basal y uso concomitante de otros agentes ototóxicos (73).
La ototoxicidad asociada al uso de vancomicina se encuentra entre el 1% y 12%. Reportes preliminares que asociaron la vancomicina con ototoxicidad, fueron atribuidos a impurezas en la formulación sin embargo un estudio piloto de 2009 reportó un 12% de érdida de audición, detectada por audiometría (74).
Los antibióticos también pueden ocasionalmente causar disfunción de nervio periférico o convulsiones. Neuropatía periférica se produce con la administración prolongada de antibióticos como metronidazol. Alucinaciones y convulsiones pueden ser causadas por penicilinas, imipenemcilastatina, ciprofloxacino y rara vez, por otros b-lactámicos. El mecanismo propuesto es la interferencia de los b-lactámicos con la función inhibitoria del ácido g-aminobutírico (75, 76).
La penicilina G intravenosa puede causar neurotoxicidad cuando se administran más de 20 a 50 millones de unidades por día, pero también puede existir neurotoxicidad en dosis más bajas en pacientes con función renal alterada, en presencia de hiponatremia o lesiones cerebrales preexistentes (76).
La incidencia de convulsiones de imipenem-cilastatina fluctúa entre 0,1% a 0,15%. La dosis máxima en adultos con función renal normal es de 4g por día y la recomendación es no emplear dosis mayores a 2g por día a menos que se trate de infecciones por Pseudomonas aeruginosa (77).
El uso de fluoroquinolonas se ha asociado con efectos adversos que incluyen cefalea y convulsiones en 1 a 2% de los pacientes. También se han observado alucinaciones, dificultad para hablar y confusión, que se resuelven una vez suspendido el antibiótico (78).
Bloqueo neuromuscular con parálisis aguda y apnea, se ha reportado con la mayoría de los aminoglicósidos y colistin y su uso debe evitarse en pacientes con miastenia gravis (75, 79). El uso de trimetoprim-sulfametoxazol puede precipitar meningitis aséptica (75).
FiebreHasta un tercio de los pacientes hospitalizados experimentan fiebre comúnmente no infecciosa. El manejo de la fiebre nosocomial sigue siendo controversial y aunque se recomienda una restricción de antibióticos, éstos deben iniciarse de manera empírica en pacientes inmunosuprimidos o con inestabilidad hemodinámica (80, 81).
Los b-lactámicos y sulfonamidas (especialmente en pacientes infectados por el VIH) comúnmente causan fiebre. El diagnóstico se hace sobre la base de una fuerte sospecha clínica, exclusión de otras causas y ante la resolución después de la suspensión del agente sospechoso, aunque esto pueda tomar días, ya que dependerá de la tasa de metabolismo y eliminación. La presencia de rash o eosinofilia también favorece el diagnóstico. (81, 82).
Alteraciones electrolíticasLa sal potásica de Penicilina G contiene aproximadamente 1,7mEq K+ por millón de unidades. Con dosis de más de 20 millones de Penicilina U/día, especialmente aquellos pacientes con insuficiencia renal, pueden desarrollar hiperkalemia clínicamente importante que puede conducir a debilidad muscular, parálisis y falla respiratoria. Si el riesgo es significativo, debería emplearse una preparación sódica de penicilina G (83, 84).
Los aminoglicósidos producen hipokalemia e hipomagnesemia. La secuela fisiológica más grave asociada a la hipokalemia es la arritmia cardíaca incluyendo taquicardia y fibrilación ventricular. La hipomagnesemia favorece la debilidad muscular que puede retardar la salida del ventilador mecánico (84).
El trimetoprim/sulfametoxazol produce hiperkalemia e hiponatremia. Esto se atribuye a que la estructura farmacológica de la droga es similar a la de los diuréticos ahorradores de potasio. Especial precaución en presencia de disfunción renal (84).
La piperacilina/tazobactam contiene 2.79mEq (64mg) de sodio por gramo de piperacilina, por lo tanto, cada frasco aporta 11,16mEq (256mg) de sodio. Precaución en aquellos pacientes con restricción de sodio (85).
Toxicidad muscularEl uso de daptomicina puede estar asociado a un aumento en la incidencia de miopatía, sobre todo a dosis y/o frecuencias de administración mayores a las recomendadas. Se debe discontinuar la terapia en pacientes con signos y síntomas y un aumento en la valor de creatina quinasa (CK) por sobre cinco veces el normal o en pacientes asintomáticos con valores de CK por sobre 10 veces lo normal. Se recomienda vigilancia de CK durante la terapia y mayor precaución en pacientes recibiendo de manera concomitante otras drogas asociadas a miopatía como las estatinas (86).
IIFarmacocinética y farmacodinamiaLos conceptos Farmacocinéticos-Farmacodinámicos (PK-PD) fueron identificados en la década de 1940, en los primeros tiempos de la terapia antimicrobiana y desde entonces se ha buscado establecer la mejor asociación entre la forma de administrar los antibióticos y tasas de cura más rápida con menor toxicidad para el paciente (87). El PK-PD ha permitido identificar las relaciones entre la exposición al antibiótico y la concentración inhibitoria mínima (CIM) del patógeno con la clínica y/o los resultados microbiológicos empleando diferentes técnicas matemáticas, haciendo que hoy en día, nos beneficiemos de esta información para prácticamente cada clase de antibacteriano (88–90).
La farmacocinética (PK) describe la evolución temporal del fármaco desde el sitio de administración hasta el lugar de su actividad farmacológica y su eliminación (figura 1). Estos procesos se describen a menudo con la sigla ADME: absorción, distribución, metabolismo y eliminación (90, 91).
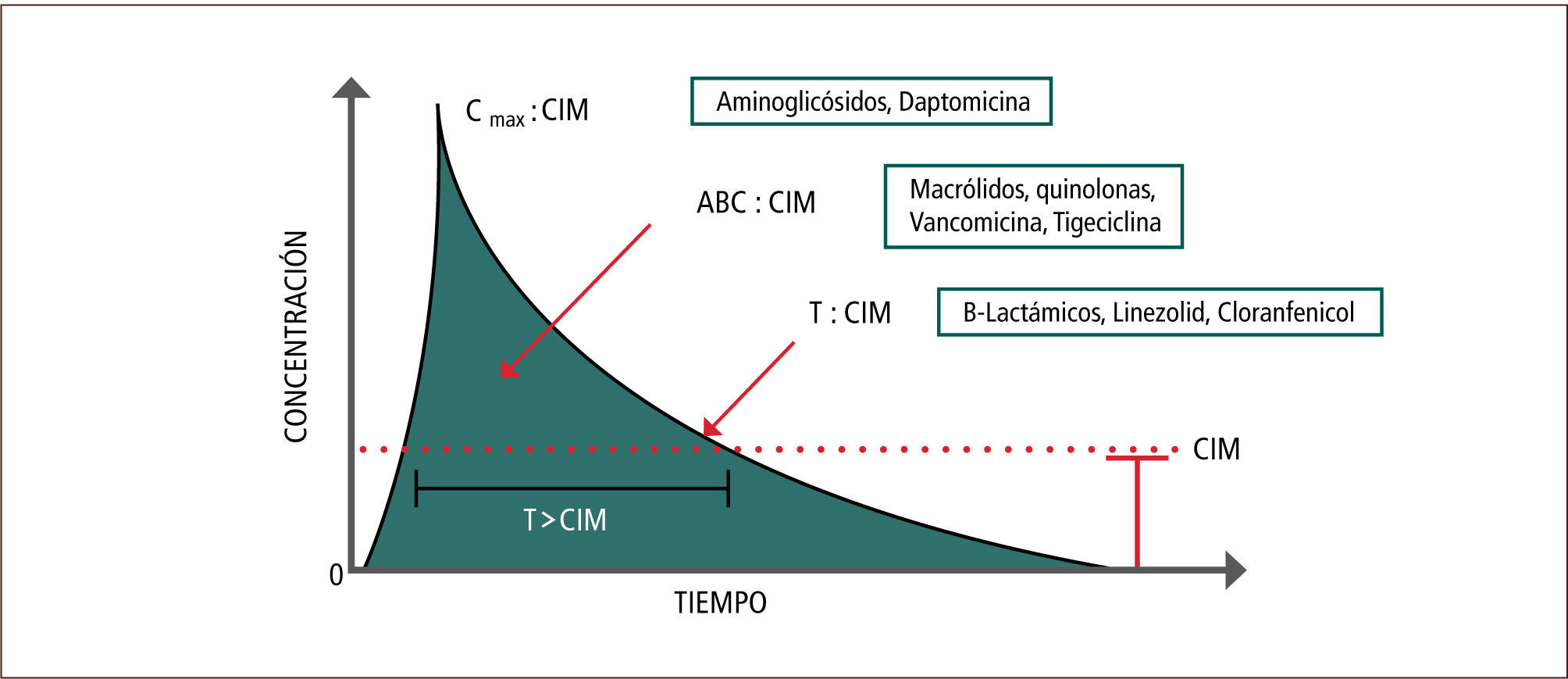
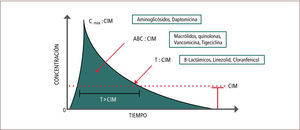
La farmacodinamia (PD) describe todo lo que el fármaco produce en el organismo (90, 91). Por medio de la curva Concentración vs Tiempo (figura 2), se pueden describir los tres principales grupos de antimicrobianos de acuerdo a sus características PK-PD:
- 1.
Dependientes del tiempo en que exceden la CIM del microorganismo. Por ejemplo: beta-lactámicos, linezolid, cloranfenicol.
- 2.
Dependientes de la concentración máxima sobre la CIM del microorganismo. Por ejemplo: aminoglicósidos, daptomicina, metronidazol.
- 3.
Aquellos en que su eficacia depende tanto de la exposición como del tiempo, es decir, del área bajo la Curva (AbC) sobre la CIM. Por ejemplo: vancomicina, macrólidos, quinolonas, clindamicina y tetraciclinas (90, 91).
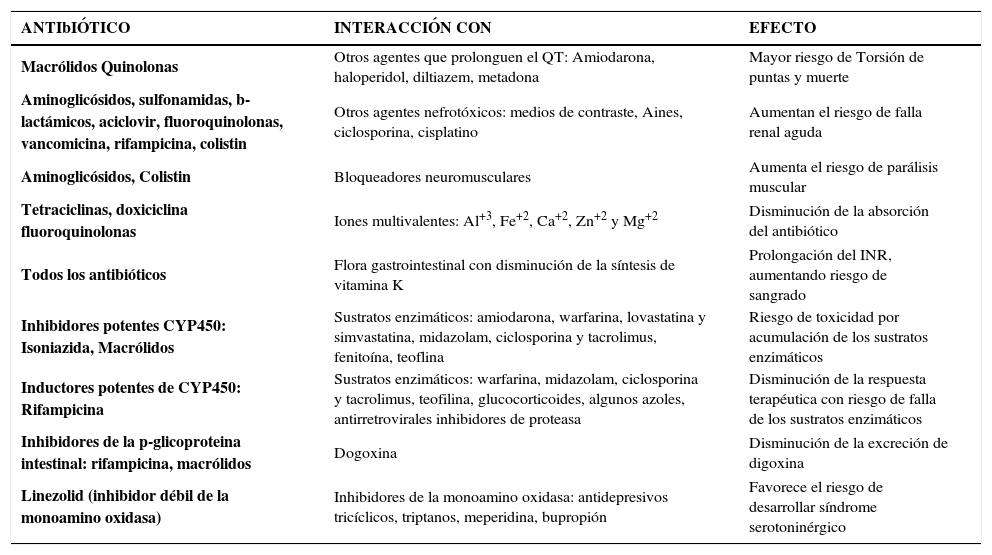
Como cualquier fármaco, los antibióticos pueden ser el precipitante o el objeto de una interacción medicamentosa. Estas interacciones pueden ser beneficiosas o perjudiciales, pudiendo alterar la eficacia del tratamiento o precipitar toxicidad, como se resume en la tabla 3.
| ANTIbIÓTICO | INTERACCIÓN CON | EFECTO |
|---|---|---|
| Macrólidos Quinolonas | Otros agentes que prolonguen el QT: Amiodarona, haloperidol, diltiazem, metadona | Mayor riesgo de Torsión de puntas y muerte |
| Aminoglicósidos, sulfonamidas, b-lactámicos, aciclovir, fluoroquinolonas, vancomicina, rifampicina, colistin | Otros agentes nefrotóxicos: medios de contraste, Aines, ciclosporina, cisplatino | Aumentan el riesgo de falla renal aguda |
| Aminoglicósidos, Colistin | Bloqueadores neuromusculares | Aumenta el riesgo de parálisis muscular |
| Tetraciclinas, doxiciclina fluoroquinolonas | Iones multivalentes: Al+3, Fe+2, Ca+2, Zn+2 y Mg+2 | Disminución de la absorción del antibiótico |
| Todos los antibióticos | Flora gastrointestinal con disminución de la síntesis de vitamina K | Prolongación del INR, aumentando riesgo de sangrado |
| Inhibidores potentes CYP450: Isoniazida, Macrólidos | Sustratos enzimáticos: amiodarona, warfarina, lovastatina y simvastatina, midazolam, ciclosporina y tacrolimus, fenitoína, teoflina | Riesgo de toxicidad por acumulación de los sustratos enzimáticos |
| Inductores potentes de CYP450: Rifampicina | Sustratos enzimáticos: warfarina, midazolam, ciclosporina y tacrolimus, teofilina, glucocorticoides, algunos azoles, antirretrovirales inhibidores de proteasa | Disminución de la respuesta terapéutica con riesgo de falla de los sustratos enzimáticos |
| Inhibidores de la p-glicoproteina intestinal: rifampicina, macrólidos | Dogoxina | Disminución de la excreción de digoxina |
| Linezolid (inhibidor débil de la monoamino oxidasa) | Inhibidores de la monoamino oxidasa: antidepresivos tricíclicos, triptanos, meperidina, bupropión | Favorece el riesgo de desarrollar síndrome serotoninérgico |
1Beta lactámicos
Su acción se relaciona con el tiempo (T) que las bacterias son expuestas a una concentración de antibiótico que excede la CIM, T> CIM. Las penicilinas requieren aproximadamente 50% del tiempo sobre la CIM, mientras que las cefalosporinas y carbapenémicos requieren alrededor del 70% y 40% respectivamente (91, 95).
La administración por infusión prolongada alcanza concentraciones sobre la CIM por mayor tiempo en comparación con la administración intermitente por lo tanto, extender el tiempo de infusión es la estrategia de optimización de b-lactámicos que se está aplicando en la práctica clínica, por medio de infusiones continuas (24 horas) o de infusiones prolongadas en el intervalo de dosificación (91, 95). Deben ser empleadas adecuadas dosis de carga para evitar la exposición prolongada a concentraciones sub-terapéuticas (95).
En un estudio retrospectivo en pacientes críticos con P. aeruginosa, el uso de infusiones prolongadas de piperacilina-tazobactam demostró una mejora en la sobrevida a 14 días (12,2% vs 31,6%, p = 0,04) en la subpoblación de pacientes más graves (APACHE II> 17) en comparación con una cohorte histórica (96).
En el primer estudio multicéntrico en pacientes críticos que compara los efectos de la administración continua e intermitente de b-lactámicos, se reporta una diferencia significativa en tasas de cura clínica de la administración continua versus intermitente para piperacilinatazobactam, meropenem y ticarcilina-clavulánico (70% vs 43%; P = 0.037) (97).
Recientemente fue publicado un estudio realizado a través de 68 UCIs, donde se muestra que la mayoría de los pacientes están por debajo del objetivo PK-PD, sugiriendo a los médicos de UCI ajustar las estrategias de dosificación, ya que con la significativa variabilidad observada, no es posible asegurar una adecuada exposición a estos antibióticos b-lactámicos (98).
2AminoglicósidosSon los agentes concentración dependientes por excelencia. A medida que aumenta la concentración, lo hace la tasa de muerte bacteriana (91, 99).
Una relación Cmax/CIM de 10 es el objetivo, guiado por los datos de CIM conocida o de antibiograma locales. Para ello se recomienda administrar aminoglicósidos una vez al día en infusión de 30 minutos, pese a que aún así se obtienen valores de Cmax que no permiten alcanzar el objetivo de Cmax/CIM de 10 para muchos patógenos incluidos en el rango de sensibilidad (91, 99).
Los aminoglicósidos han limitado su utilización debido a sus efectos adversos. Un factor clave es que el transporte activo renal, proceso que conduce a la nefrotoxicidad, es saturable. Con la administración una vez al día, hay una absorción reducida de la molécula, disminuyendo la probabilidad de toxicidad. Por el contrario, múltiples dosis diarias producen mayor absorción y más rápida manifestación de nefrotoxicidad (100).
La gran variabilidad y potencial de efectos adversos hace mandatoria la monitorización terapéutica de niveles plasmáticos. Mientras que inicialmente el propósito era minimizar la toxicidad, midiendo un nivel valle, la monitorización cada vez más se especifica también para maximizar la eficacia de este grupo de antibióticos, a través del nivel máximo. El Cmax o peak debe ser controlado 30 minutos después de finalizar la infusión intravenosa de 30 minutos. La Cmín o valle debe ser controlado inmediatamente previo a la administración de la siguiente dosis (99–101).
Los aminoglicósidos son moléculas hidrofílicas para los que un aumento del volumen de distribución, como ocurre en pacientes sépticos y quemados, disminuye su concentración máxima, reduciendo su capacidad de alcanzar un Cmax objetivo. El ajuste de dosis en insuficiencia renal se realiza mediante la extensión de la frecuencia de administración (cada 36, 48 y 72 horas o más). Aquellos pacientes con eliminación renal y extrarrenal aumentada (quemados) pueden requerir de una frecuencia de dosificación más acortada (102).
3GlicopéptidosAunque una variedad de parámetros PK-PD se han sugerido para vancomicina, la relación ABC/CIM parece ser el mejor predictor de su respuesta. Se debe buscar una relación ABC/CIM 400 o superior, pero como el ABC no se obtiene de forma rutinaria en la práctica clínica, se ha utilizado la concentración mínima o valle (Cmín), demostrándose que está bien correlacionada con el ABC, considerándose un enfoque más práctico (99,103).
Al utilizar una dosis de carga de vancomicina de 30mg/kg de peso total y dosis de mantención de 15mg/kg cada 12 horas en pacientes con función renal normal, es posible alcanzar el objetivo de Cmín entre 15–20mg/L. (95, 99, 100, 103).
En neumonía por estafilococo con CIM de 0,5mg/L, una dosis estándar de vancomicina de 1g cada 12 horas alcanza el objetivo en un 90%, pero cuando el valor de CIM aumenta a 1,0 o 2,0mg/L, la probabilidad de éxito terapéutico cae a 70% y 22% respectivamente.
Esto promueve el aumento de la dosis total diaria a 3g o incluso 4g por día y refuerza el uso de las dosis de carga, cuyo único objetivo es asegurar concentraciones terapéuticas rápidamente. Aunque la nefrotoxicidad por vancomicina se produce sólo en el 5% de los pacientes y es reversible, es importante la monitorización terapéutica del nivel valle para minimizarla. El control de niveles se obtiene inmediatamente previo (o máximo 30 minutos antes) de la administración de la cuarta dosis de mantención desde el inicio del tratamiento o de una modificación de dosis (95, 99, 100, 103).
4ColistinColistin es un antibiótico péptido que se presenta bajo la forma de una sal, denominada comúnmente como CMS, que es un profármaco sin actividad antibacteriana intrínseca, menos tóxico y que se hidroliza a colistin, potente agente antimicrobiano que causa rápida muerte bacteriana dependiente de la concentración (140, 141).
Aunque CMS se elimina predominantemente por vía renal, el colistin hidrolizado sufre una extensa reabsorción tubular renal y después se elimina por mecanismos no renales. Por ende, una mejora en la función renal no necesariamente mejorará la eliminación de colistin. El aumento del Vd común en los pacientes críticos provoca una prolongación del tiempo de vida media. Estas características apoyan el uso de una dosis más grande con menos frecuencia (104–105).
Un reciente estudio pequeño, de 18 pacientes críticos, mostró que la máxima concentración plasmática en estado estacionario, dosificado según recomendación del fabricante, fue de 2,3mg/L, valor ligeramente por encima del punto de corte de sensibilidad de 2mg/L para P. aeruginosa y A. baumannii establecido tanto por Estándares Clínicos y de Laboratorio (CLSI) y por el Comité Europeo de Pruebas de Sensibilidad Antimicrobiana (104, 105).
En otro pequeño estudio se evaluó la utilización de una dosis de carga pacientes críticos con bacterias Gram negativas multiresistentes, demostrando reducir significativamente el tiempo de erradicación bacteriana comparado con la terapia de mantención sola, sin informar significativa nefrotoxicidad.
En base a estos antecedentes, la mejor estrategia de empleo es utilizar una dosis de carga seguida de una dosis de mantención cada 8–12 horas en pacientes con función renal normal y ajuste de dosis disminuyendo la frecuencia de administración (105).
ConclusiónLa mejor estrategia para aumentar la probabilidad de tener una terapia antibiótica eficaz con mínimos efectos adversos, debe incluir el manejo de las herramientas PK-PD y extender la duración de la terapia antibiótica al menor tiempo posible. Se deben conocer los efectos adversos asociados a la utilización de un determinado agente, permitiendo la prevención y el manejo precoz de los signos de toxicidad, eliminando el agente causal, lo que generalmente revierte el proceso sin secuelas permanentes.
Al mismo tiempo es muy importante fomentar el reporte de eventos adversos dentro de la institución, para identificar las tendencias, fallas en el proceso e intervenir. El continuo desarrollo de sistemas de detección de estos eventos adversos permitirá implementar nuevas herramientas de mejora de calidad y estrategias de prevención.
La autora declara no tener conflictos de interés, en relación a este artículo.