El trasplante hepático pediátrico (THP) es la única alternativa de tratamiento para niños que padecen enfermedades hepáticas terminales, ya sean éstas agudas o crónicas. trasplantes de hígado realizados en nuestro país.
ObjetivoExponer las indicaciones, procedimientos y principales complicaciones del THP desde el punto de vista teórico y realizar un estudio descriptivo de la experiencia recogida por el grupo de trasplante pediátrico de Clínica Las Condes y Hospital Luis Calvo Mackenna desde 1994 a 2009 en esta materia.
Material y MétodosSe recolectaron los datos de 209 trasplantes hepáticos realizados a 173 pacientes menores de 18 entre 1994 y 2009 en ambos centros, realizando estadística descriptiva y curvas de sobrevida de Kaplan y Meier.
ResultadosLas principales causas de trasplante fueron Atresia de Vías Biliares (48%) y Falla hepática aguda (28%). Cuarenta y un trasplantes se realizaron en niños menores de 10 kilos. Se trasplantaron con donante vivo 27% de los casos. Las complicaciones vasculares se presentaron en 13% de los casos y las biliares en 14%. Rechazos moderados o severos se diagnosticaron en 36% de los trasplantes. Enfermedad por Citomegalovirus se detectó en 30% de los pacientes dentro del primer año post trasplante y síndrome linfoproliferativo en 5%. La sobrevida actuarial de pacientes a 1 año ha sido de 76%, a 5 años de 67% y a 10 años de 65%.
ConclusiónLos resultados del THP en términos de sobrevida y complicaciones es similar a la experiencia de centros extranjeros, la cual es superior a las expectativas y calidad de vida de los pacientes sin trasplante. Las áreas de mayor desarrollo de nuestro centro y que presentan los mayores desafíos son el trasplante hepático en niños menores de 10 kilos, en falla hepática aguda, y el uso de donante vivo.
Pediatric liver transplantation (PLT) is the only therapeutic option for children with acute or chronic end stage liver disease. In Chile PLT represents approximately 20% of all liver transplants performed.
ObjectiveTo present indications, procedures and main complications of PLT from an theoretic point of view and describe the experience achieved by the pediatric liver transplant team of Clínica Las Condes and Hospital Luis Calvo Mackenna from 1994 to 2009 in this field.
MethodsData from 209 liver transplants performed in 173 patients younger than 18 years old, between 1994 and 2009 were analyzed with descriptive statistics. Kaplan-Meier's actuarial survival graphs were calculated.
ResultsThe main liverdiseases leading to PLT were Biliary Atresia (48%) an dAcute Liver Failure (28%). Forty-one transplants were performed in children weighting ≤ 10 kilograms. Living donor was used in 27% of the cases. Vascular complications occurred in 13% and biliary reoperations performed in 14%. Moderate and severe acute graft rejection was diagnosed in 36% of the transplants. Cytomegalovirus disease occurred in 30% of the cases and post transplant lymphoproliferative disease in 5%. Actuarial patients survival at 1 year has been 76%, at 5 years 67% and at 10 years 65%.
ConclusionResults of PLT in terms of survival and complications is comparable to foreign transplant centers, which is superior to life expectancy and quality of life of these patients without liver transplant. The areas that have exhibit major development in our center and represent the biggest challenge are liver transplant in small children, in patients with acute liver failure, and the use of living donors.
El trasplante hepático pediátrico (THP) es la única alternativa de tratamiento para niños que padecen enfermedades hepáticas terminales, ya sean éstas agudas o crónicas.
En Chile el THP representa aproximadamente un 20% del total de trasplantes de hígado realizados en nuestro país. Las indicaciones de trasplante hepático en niños pueden clasificarse en las siguientes (1, 2):
Indicaciones de trasplante hepático pediátrico- 1.
– Enfermedades Colestásicas
Atresia de vías biliares, hipoplasia de conductos biliares, síndrome de Alagille, colestasis intrahepática progresiva familiar o hereditaria, hepatitis neonatal, colangitis esclerosante primaria.
- 2.
– Enfermedades crónicas no colestásicas / cirrosis
Hepatitis autoinmune, hepatitis por virus B, hepatitis por virus C.
- 3.
– Enfermedades metabólicas que causan cirrosis
Déficit de alfa 1 anti tripsina, tirosinemia tipo I, enfermedad de Wilson, glucogenosis III, IV y I, hemocromatosis neonatal, fibrosis quística, defectos de oxidación de los ácidos grasos, enfermedades de la cadena respiratoria mitocondrial sin compromiso sistémico, fibrosis hepática congénita.
- 4.
– Errores innatos del metabolismo
Crigler-Najjar tipo I, defectos del ciclo de la urea, alteraciones del metabolismo de aminoácidos ramificados, hiperoxaluria tipo I, hipercoleste-rolemia familiar homozigota.
- 5.
– Tumores
Malignos y benignos, no resecables.
- 6.
– Misceláneas
Enfermedad fibropoliquística, síndrome de Caroli, enfermedad venooclusiva, tumores neuroendocrinos metastáticos
- 7.
– Retrasplante
Una vez que se ha confirmado el diagnóstico etiológico y si el paciente es susceptible de ser trasplantado, se debe realizar una evaluación funcional hepática que nos aproximará al estado evolutivo de la enfermedad, pudiendo presumir un pronóstico vital y qué calidad de vida puede esperarse.
Con estos datos se podrá realizar una estimación de la necesidad del trasplante, sopesando riesgos y beneficios. A partir de este punto, se evaluará cuál es el momento oportuno para incluir al paciente en la lista de espera como candidato, y para ello debe considerarse cuánto es el tiempo medio en la lista de espera en nuestro país, debido a que los pacientes con enfermedad muy avanzada o desnutrición grave los riesgos del trasplante y la morbilidad post operatoria se incrementan en forma considerable (3–5).
El momento adecuado del trasplante será aquel en el que la propia enfermedad presente complicaciones graves, un deterioro importante de la calidad de vida o riesgo de muerte comparado con los riesgos asumibles del trasplante y los inconvenientes de la inmunosupresión prolongada, asumiendo que al trasplantar el beneficio potencial a obtener sea claramente positivo.
El momento oportuno será aquel en que exista (4, 5):
- a)
Disfunción bioquímica que hace presumir una menor supervivencia sin trasplante que con él.
- b)
Ascitis importante, refractaria al tratamiento médico.
- c)
Colangitis a repetición o peritonitis bacteriana, que requiere antibioterapia agresiva con hospitalizaciones prolongadas.
- d)
Episodios recidivantes de sangrado digestivo por hipertensión portal intrahepática o suprahepática, con riesgo vital y sin otras alternativas terapéuticas ya sean quirúrgicas o radiológicas.
- e)
Prurito intratable que condiciona una mala calidad de vida.
En casos de insuficiencia hepática aguda debe descartarse siempre la existencia de enfermedad hematológica o tumoral.
El grado de urgencia para realizar el trasplante estará definido por la esperanza de vida si el trasplante no se realizara. Los enfermos con insuficiencia hepática aguda grave, los trasplantados que presenten falla primaria del injerto dentro de los 3 meses post-trasplante y los que presenten trombosis de la arteria hepática dentro de los 3 meses post-trasplante tienen prioridad absoluta sobre cualquier otro candidato, pudiendo ser activados como urgencia. En el resto de los candidatos el trasplante se realizará en forma electiva (3, 4, 6).
Evaluación de la condición general y hepática del paciente1– Evaluación psicosocialEn los resultados del trasplante hepático a largo plazo influyen en forma decisiva la motivación, disciplina, conocimientos y capacidad de los padres o cuidadores para cumplir las indicaciones médicas en cuanto a medicamentos y cuidados, así como disponer de un medio ambiente adecuado. Por esta razón se debe realizar una evaluación social y familiar con el fin de proporcionar las condiciones y el adiestramiento necesarios.
Se requiere de personal de asistencia social que evalúe al grupo familiar desde el punto de vista social, cultural y económico, en lo referente a enfrentar la vida con un miembro de su grupo familiar que requerirá tratamiento inmunosupresor de por vida, con complicaciones tardías post trasplante y los tratamientos que estas conllevan.
Además, se recomienda apoyo psicológico familiar que les oriente en pautas de conducta adecuadas para que a medida que aumenta la edad del paciente éste sea el responsable de sus cuidados favoreciendo así su autonomía personal (3).
2– Evaluación hepáticaSe debe realizar una completa y cuidadosa anamnesis clínica, que se acompañará de exámenes bioquímicos y hematológicos: grupo sanguíneo, hemograma, estudio de coagulación, y si fuera necesario estudio de la función plaquetaria, función hepática: (transaminasas glutámico oxaloacética y pirúvica, bilirrubina total y directa, fosfatasas alcalinas, amonio, proteinemia, albuminemia, gammaglutamiltranspeptidasa, determinación de alfa-feto proteínas y estudio de autoinmunidad, y otras pruebas que fueran necesarias para llegar al diagnóstico etiológico, si éste no está aclarado al momento de ser evaluado para trasplante hepático.
No es necesario hacer estudio de histocompatibilidad en el caso de trasplante hepático.
Dentro del estudio de imágenes se debe hacer una ecografía abdominal con doppler, donde se evaluará la ecogenicidad del parénquima hepático, flujo portal, diámetro de la vena porta, índice de resistencia arteria hepática, flujos vasculares esplénicos y pancreáticos, y se descartará trombosis vasculares o tumores. Si fuera necesario se harán otros estudios de imágenes complementarios como resonancia magnética, tomografía axial computarizada, angiografía espleno-mesentérico-portal o cavografía.
Debe evaluarse la repercusión general de la enfermedad hepática sobre otros órganos y descartar patologías independientes de su hepatopatía (3–6).
3– Evaluación del estado nutricionalLos pacientes con hepatopatía crónica avanzada generalmente se encuentran con desnutrición severa. La etiología es multifactorial y está claramente relacionada con mayor morbilidad pre y post-trasplante, lo que justifica efectuar conductas terapéuticas para mejorar el estado nutricional, si es posible, con aportes calóricos y proteicos suficientes según la edad, usando suplementos alimentarios y diferentes técnicas de alimentación como alimentación enteral continua si fuera necesario y en situaciones en que ésta no es tolerada por complicaciones como ascitis o hemorragia variceal intratable es necesario usar nutrición parenteral.
Se deben evitar los ayunos prolongados, ajustar los horarios para dar mayor frecuencia de comidas al día, evitando depleción de glucógeno y mejorando el balance nitrogenado. Si existiera hiperamonemia debe administrarse fórmulas en base a aminoácidos ramificados (4, 5).
4– Evaluación cardiológica y pulmonarEl trasplante hepático está asociado con importantes cambios hemodinámicos durante las fases quirúrgica y anhepática, por lo que se requiere evaluación de la función cardíaca y respiratoria previo al trasplante. Debe efectuarse electrocardiograma, ecocardiografía con contraste de burbujas y gases en sangre arterial. Los pacientes con atresia de vías biliares tienen mayor incidencia de enfermedades cardíacas congénitas, especialmente defectos del tabique atrial y ventricular, los pacientes con síndrome de Alagille tienen estenosis de rama pulmonar, en los pacientes sometidos a quimioterapia previamente por tumores hepáticos, así como en los con tirosinemia tipo I y los con acidemias orgánicas pueden desarrollar miocardiopatía por lo que deben ser evaluados en forma específica buscando esta complicación. En algunos casos especiales es necesario efectuar cateterización cardíaca para determinar si la función cardíaca es adecuada para soportar los efectos hemodinámicos del trasplante hepático o si se requiere de cirugía cardíaca previo a él. En caso de ser inoperable, el trasplante hepático pudiera estar contraindicado (3, 6).
Las hepatopatías crónicas en etapa avanzada pueden presentar alteraciones en el intercambio pulmonar de gases, si se asocian con síndrome hepatopulmonar (shunt arteriovenoso pulmonar) por vasodilatación intrapulmonar o por shunt anatómico intrapulmonar. El síndrome hepatopulmonar es infrecuente en el niño, se caracteriza por ser un trastorno de ventilación-perfusión con shunt intrapulmonar derecho-izquierdo y defecto de difusión, hipoxemia arterial con presión arterial de oxígeno menor de 70mmHg y gradiente alvéolo-arterial de oxígeno aumentada (mayor de 15mmHg), ocasionalmente puede existir una alteración en la difusión de dióxido de carbono que no es concordante con la normalidad de la espirometría. Estas alteraciones pueden remitir post trasplante y, por lo tanto, la existencia de un Síndrome Hepatopulmonar progresivo y sintomático puede ser indicación de trasplante, aunque la hepatopatía esté estable, y siempre y cuando la hipoxemia responda a la administración de oxígeno. En casos de PaO2 menor a 50mmHg, hipoxemia grave, existe mayor mortalidad peri operatoria (3, 6).
La hipertensión pulmonar es otra complicación vista en los cuadros de cirrosis y se clasifica en leve Presión Arteria Pulmonar Media (PAPM) de 25–35mmHg, moderada (PAPM sistólica de 36–45) y grave (PAPM mayor o igual a 46mmHg). Estas dos últimas condiciones contraindican el trasplante por la alta mortalidad perioperatoria precoz secundaria a insuficiencia cardíaca derecha, además, de no ser reversible con el trasplante hepático, en esta situación debería plantearse trasplante hepatopulmonar (3, 6).
5– Evaluación renalDebe efectuarse estudio de la función renal, además de urocultivo y ecografía renal, para descartar que exista alguna lesión orgánica asociada. Los pacientes con hepatopatía avanzada descompensada, frecuentemente, presentan insuficiencia renal prerrenal o incluso un síndrome hepatorrenal. Si el cuadro es prerrenal mejorará con la reposición de líquidos lo que no ocurrirá si es un síndrome hepatorrenal, glomerulopatía o necrosis tubular aguda.
El síndrome hepatorrenal revierte con el trasplante, aunque en muchas oportunidades se asocia con una mayor mortalidad post operatoria. Ésta puede disminuirse sometiendo al paciente a diálisis pre y post operatoria, si fuera necesario, con lo que la sobrevida a largo plazo puede ser buena, pero tendrán mayor morbilidad (infección, mayor estadía en unidad de cuidados intensivos). Si está presente una lesión estructural previa con insuficiencia renal y el paciente está en diálisis previa al trasplante, deberá evaluarse el trasplante hepatorrenal (3, 6).
6– Evaluación del desarrollo neurológicoDebido a que el objetivo del trasplante es mejorar la calidad de vida es importante evaluar la presencia de alteraciones neurológicas o psicológicas pre-existentes y la necesidad de tratamiento, esto es particularmente importante en niños con falla hepática fulminante ya que la presencia de daño cerebral irreversible es una contraindicación de trasplante (3, 5, 6).
7– Evaluación dentalLa enfermedad hepática avanzada tiene efectos adversos sobre todos los aspectos del crecimiento y desarrollo incluyendo la dentición, entre estos está la hipoplasia del esmalte e hiperplasia gingival, además debe establecerse una buena higiene dental previa al trasplante.
8– Estudio serológico de infecciones previasEstablecer susceptibilidad a virus de Epstein Barr (a través de IgG), citomegalovirus (IgG), virus de inmunodeficiencia humana (con test de ELISA), virus de hepatitis B (Ag de superficie VHB y anticuerpos anticore VHB) y hepatitis C (IgG), parvovirus B19 (IgG), varicela zoster (IgG) si el antecedente de varicela clínica es negativo o no precisable, virus linfotrópico de células T humano (HTLV-I/II) (IgG), virus herpes simple (IgG), toxoplasma (IgG), enfermedad de Chagas (IgG), lúes (VDRL), y reacción de tuberculina al paciente y su grupo familiar, investigación que es discutible, pero considerando la situación epidemiológica actual de tuberculosis, ésta debe ser descartada, y prever que paciente no será expuesto una vez iniciada su terapia inmunosupresora a un contacto con esta enfermedad (3, 6).
9– VacunasAdemás de exigir el esquema que corresponda a su edad según el Programa Ampliado de Inmunizaciones (PAI) del MINSAL deberán haber recibido vacuna anti neumococo tipo 7 valente dos dosis separadas por 2 meses, anti Varicela 1 dosis, pero en mayores de 13 años deben recibir 2 dosis separadas por 1 mes y como mínimo 1 mes antes del trasplante, anti Hepatitis A 2 dosis separadas por 6 meses desde el año de edad, anti-hepatitis B en los nacidos antes del año 2005, 3 dosis con esquema de 0, 1 y 6 meses o esquema acelerado 0,7 y 21 días; A y anti Neisseria meningitidis C 1 dosis en mayores de 1 año; a los nacidos antes del julio de 1996 debe administrárseles 1 dosis de anti-Haemophillus Influenzae tipo b (3).
ContraindicacionesLas contraindicaciones del trasplante hepático pueden ser: absolutas o relativas.
Respecto de las absolutas se refiere a situaciones en que el trasplante es técnicamente imposible o estados en que existe una enfermedad de base extrahepática, en los cuales la baja supervivencia post trasplante hacen prohibitiva esta terapia o incapacita al paciente para mantener autonomía, de acuerdo a su edad, después del trasplante. Se consideran contraindicaciones absolutas: las enfermedades neurológicas graves e irreversibles, neoplasias hepáticas con metástasis o la presencia de metástasis hepáticas de otro tumor primario, enfermedad terminal, septicemia o infección activa no controlada fuera del árbol biliar. La inmunosupresión agrava mucho estos cuadros (3, 6).
En el caso de hipertensión pulmonar moderada a grave (presión de arteria pulmonar media mayor de 35mmHg) con o sin insuficiencia cardíaca, es considerada una contraindicación absoluta ya que no revierte post trasplante y tiene alta mortalidad perioperatoria (3).
Respecto de las contraindicaciones relativas, éstas se encuentran asociadas a la presencia de un compromiso grave de otro órgano sin tratamiento alternativo y a la trombosis no tumoral de la vena porta. En relación a esta última situación la cirugía tendría mayor riesgo de complicaciones, para lo cual deberá hacerse un estudio exhaustivo angiográfico mesentérico y evaluar alternativas técnicas que permitieran mejorar los resultados del trasplante (3, 6).
También son contraindicaciones relativas el síndrome hepatorrenal y la encefalopatía hepática, cuando existe alteración electroencefalográfica grave y se presuman secuelas. Ambas situaciones están asociadas a mayor morbilidad y menor supervivencia post trasplante (3, 5, 6).
En el caso de pacientes con enfermedades neoplásicas malignas tratadas, y sin recaída, de origen no hepático, se recomienda un mínimo de dos años desde el momento teórico de la curación para efectuar el trasplante hepático (3).
Existen situaciones en que está claramente definido que hay mayor morbilidad postoperatoria y estas son (3, 5, 6):
Edad menor de un año: debido a que con alta probabilidad, por eltipo de donante disponible en mayor frecuencia, el injerto deberá ser segmentario o reducido, lo que aumenta la morbilidad. También la in munosupresión, a tan corta edad, aumenta el riesgo de primoinfección o reactivación del virus Epstein Barr y mayor frecuencia de síndrome linfoproliferativo.
Desnutrición grave.
Encefalopatía hepática grado III-IV.
Síndrome hepatorrenal.
Múltiples cirugías previas.
La sobrevida del THP varía, dependiendo de la etiología del daño hepático. Sin embargo los trasplantes electivos tienen una sobrevida al año que en buenos centros puede superar el 90% y a 5 años el 80%–85%, la que ha ido mejorando en los últimos años ya que en la década del 90 no superaban el 70% al 75% a cinco años, en la mayoría de los centros.
La sobrevida de pacientes sometidos a trasplante por falla hepática fulminante es menor, con sobrevida a 5 años de un 75% aproximadamente dependiendo de las series (7–10).
Sistema de lista de esperaChile tiene un sistema nacional de lista, en que los pacientes que están a la espera de un órgano se encuentran inscritos en el Instituto de Salud Pública y, están debidamente clasificados por grupos sanguíneo. En la medida que se cuenta con donantes se van distribuyendo los diferentes órganos a los pacientes. En el caso específico de hígado, el tiempo de enrolamiento en dicha lista es, después del grupo sanguíneo, el principal criterio para la asignación.
Actualmente existe un nuevo sistema de priorización por gravedad llamado PELD, (Pediatric End Stage Liver Disease). Este sistema permite trasplantar a los pacientes más graves, pero no se encuentra vigente en nuestro país, sin embargo está en vías de estudio su pronta implementación. La utilización del PELD ha sido criticada por algunos sectores ya que sus probables ventajas no estarían claramente demostradas (11). Un puntaje de 15 es considerado, en muchos países, como la cifra mínima para ingresar a la lista de espera. El paciente continuará con el tratamiento de la enfermedad de base y de las eventuales complicaciones que pudiera presentar, manteniendo sus controles médicos frecuentes y, según lo requiera su situación clínica, repitiendo los exámenes de laboratorio pertinentes. Paralelamente debe instituirse un soporte emocional al niño y a sus padres, o núcleo familiar, para sobrellevar la ansiedad y el impacto psicológico que involucra la espera de un órgano
El sistema nacional de distribución asegura que los órganos provenientes de donantes pediátricos son destinados a receptores pediátricos, lo que representa una clara ventaja para este grupo de enfermos, comparado con la legislación de otros países donde no existe esta consideración.
Aquellos pacientes portadores de falla hepática fulminante (FHF) y los que han sido trasplantados hace menos de tres meses y presentan trombosis vasculares o fallas primarias del injerto pueden ser activados como prioridad nacional. También existen algunas excepciones para casos de descompensación grave de pacientes crónicos, hospitalizados en unidades de cuidados intensivos o con algún tipo de soporte vital.
Técnica quirúrgicaEn los niños existe, a diferencia de los adultos, mayores limitaciones para la obtención de órganos ya que por ser más pequeños no pueden recibir el injerto completo. La masa hepática a trasplantar debe ser, idealmente, mayor de un 1%. Sin embargo se han realizado trasplantes con porcentajes de tejido hepático de hasta un 0,6% del peso corporal. Lo ideal es que sea entre un 1% y un 2%. De acuerdo a lo anterior es necesario efectuar algún tipo de reducción del hígado completo para poder injertarlo en la cavidad abdominal de los niños, especialmente cuanto éstos tienen un peso bajo. Se describen las siguientes técnicas: El hígado reducido, consiste en seleccionar los segmentos izquierdos del hígado proveniente de donante cadáver, habitualmente los segmentos II y III que entregan un volumen que en nuestro país representa aproximadamente 150 a 250 gramos es decir se pueden trasplantar niños de 15 y hasta 20 o 25 kilos. Si se adiciona el segmento IV, también izquierdo, se puede obtener un volumen de 400 gramos, aproximadamente.
El hígado dividido es una técnica en que la mitad más grande del hígado, es decir el lóbulo derecho, se destina a un receptor adulto y el izquierdo, más pequeño, es injertado en el paciente pediátrico.
Otra alternativa es la utilización del llamado hígado auxiliar, donde no se efectúa extracción del hígado nativo y se pone sólo un segmento de hígado del donante en el receptor.
Y por último la técnica del donante vivo relacionado, en la cual el padre o la madre donan una parte de su hígado para su hijo (9). Pueden ser otros familiares cercanos. El trasplante hepático pediátrico con donante vivo representa una excelente alternativa para poder trasplantar en forma precoz a los niños que están en lista de espera, evitando con esto el deterioro de su cuadro. Sus resultados son similares a los de niños trasplantados con donante cadáver, sin embargo la oportunidad de la intervención permite finalmente disminuir la mortalidad en la lista de espera (9, 12). Desafortunadamente, no siempre se puede realizar esta técnica. Hemos estudiado, en nuestro medio, las causas por las cuales algunos potenciales donantes no llegan a materializarse como tales. Un 36,4% ha rechazado serlo por temor a complicaciones quirúrgicas, un 18,2% por dependencia de drogas ilícitas, un 18,2% por razones médicas y un 9,1% por razones técnicas (anatomía desfavorable que amenaza el éxito del trasplante) (13).
Trasplante y falla hepática fulminanteLa falla hepática fulminante (FHF) ha sido definida en pediatría como la presencia de evidencia bioquímica de injuria hepática, en ausencia de enfermedad hepática conocida. A esto se suma coagulopatía y encefalopatía (14). El trasplante por falla hepática fulminante representa en algunas series un 13% de las indicaciones de trasplante (14). En nuestro programa hemos reportado una incidencia de 20,4%. La causa es desconocida en un 48,1%, infección por virus de hepatitis A en un 37% (10, 15). El porcentaje de retrasplante en nuestra experiencia es de 14,8% con una sobrevida actuarial de 1 y 5 años de 74,1% (15). Dada la escasez de órganos que se asocia a mortalidad en los casos de hepatitis fulminante, donde la urgencia para obtener los mismos es máxima, es que se han postulado diferentes alternativas, dentro de ellas está el uso de injertos de grupo AB0 incompatible y la técnica de donante vivo relacionado. Nuestro grupo ha reportado la utilización del AB0 incompatible en un 1,3% de todos los trasplantes hepáticos y un 8,8% de los trasplantes por falla hepática fulminante (16). Es un procedimiento de elevada complejidad y alto costo. No es infrecuente que los pacientes deban ser retransplantados.
Otra técnica utilizable es la de donante vivo relacionado. Esta opción terapéutica tiene la ventaja de permitir obtener un injerto antes que el paciente se deteriore en forma irreversible. Nuestra experiencia reportada de 43 pacientes portadores de falla hepática fulminante, en 16 de ellos (37,2%) se realizó el trasplante con injertos provenientes de donante vivo relacionado (17). En todos los casos los padres se ofrecieron como voluntarios. La evaluación preoperatoria de los donantes se completó en menos de 12 horas. El estudio incluyó una entrevista, anamnesis, examen físico, estudio bioquímico, pruebas de función hepática, electrocardiograma, eco doppler hepático y estudio imagenológico del hígado con angioTAC, asegurando la posibilidad técnica de realizar las anastomosis respectivas y un volumen del injerto de a lo menos un 1%. Los candidatos fueron evaluados por especialistas independientes, otorgando los pases preoperatorios respectivos.
Uno de los factores más importantes al utilizar esta técnica es tener una baja morbilidad y ausencia de mortalidad. No encontramos complicaciones importantes en los donantes en este estudio y no hubo mortalidad en la serie (17).
ComplicacionesLos problemas del implante en su período post trasplante inmediato son, mayoritariamente, rechazo celular agudo, trombosis vasculares, complicaciones biliares, infecciones y toxicidad por drogas.
Rechazo celular agudoEl rechazo celular agudo en pacientes trasplantados pediátricos se presenta hasta en un 60% (9). Nuestro grupo ha presentado estudios donde este porcentaje es de 50% (10). El régimen de inmunosupresión utilizado habitualmente incluye un esquema triasociado basado en esteroides, anticalcineurínicos (ciclosporina o tacrolimus) y micofenolato mofetyl o ácido micofenólico. Estas últimas drogas vienen a reemplazar a la azatioprina, ampliamente utilizada en años previos. Todos los episodios de rechazo son comprobados a través de una biopsia percutánea bajo guía ecográfica. El tratamiento inicial consiste en tres bolos de metilprednisolona, en dosis de 20mg/kg administrados en días alternos. En casos de fracaso, debe considerarse la utilización de anticuerpos (10).
Complicaciones biliaresLas complicaciones biliares han sido consideradas como el talón de Aquiles del trasplante hepático.
La mayoría tiene su origen en el período precoz peri trasplante, ya sea daño por preservación, isquemia/reperfusión, trombosis de arteria hepática o isquemia hepática no obstructiva, en caso de pacientes con shock hipovolémico prolongado. También puede ser por problemas técnicos en la realización de las anastomosis biliares o por combinación de factores. En el postoperatorio inmediato se presenta como fístula biliar, manifestada por salida de bilis por los drenajes. El tratamiento más frecuente es la reoperación.
Puede presentarse en el período alejado post trasplante como un síndrome colestásico. En este caso el estudio se inicia con una ecotomografía abdominal. Si hay dilatación de la vía biliar debe hacerse una colangiografía por resonancia magnética (RM).
El tratamiento consiste en solucionar la obstrucción a través de procedimientos percutáneos, endoscópicos o quirúrgicos.
En caso que haya daño hepático irreversible, o existan complicaciones biliares intrahepáticas secundarias a isquemia, o daño por reperfusión el tratamiento será el retrasplante (18).
Complicaciones vascularesLas complicaciones vasculares pueden dividirse en precoces y tardías. La obstrucción del vaso es la más frecuente en el post operatorio inmediato. La trombosis arterial se sospecha por alteración de las pruebas hepáticas y aumento de la LDH. Su confirmación se realiza por estudio doppler, angio TAC, angio RM o angiografía directa. Esta última alternativa permite el tratamiento endovascular en casos seleccionados. La gran mayoría de estos pacientes deberá resolverse quirúrgicamente.
En caso de trombosis portal hay intenso compromiso del estado general, alteración de las pruebas hepáticas, coagulopatía e hipoglicemia. El tratamiento es la reintervención inmediata.
Las complicaciones vasculares alejadas son trombosis, estenosis y dilataciones aneurismáticas. Pueden comprometer la arteria hepática, vena porta y venas suprahepáticas. Estas condiciones producen alteraciones inespecíficas de las pruebas hepáticas cuando hay obstrucciones parciales. Si hay una trombosis alejada aguda su presentación es similar al cuadro post trasplante inmediato con citolisis, aumento de LDH y compromiso del estado general. Lo más frecuente es que frente a alteraciones inespecíficas de las pruebas hepáticas se encuentren estenosis arteriales o portales que pueden ser tratados endovascularmente con dilataciones o prótesis. En algunos casos es preciso hacer reconstrucciones vasculares más complejas ante la presencia de estenosis o aneurismas portales utilizando parches de Poli Tetra Fluorano Expandido (PTFE) o de vena safena.
La estenosis de arteria hepática puede llevar a isquemia mantenida de la vía biliar intrahepática con sus consecuentes complicaciones. En casos severos puede ser necesario un retrasplante.
La oclusión de las venas suprahepáticas puede ocasionar un síndrome de Budd-Chiari agudo o crónico. En el primer caso se manifiesta por un cuadro ascítico severo, falla primaria del injerto y derrame pleural. El tratamiento es la reoperación. Si se presenta en forma crónica. Éste puede ser indistinguible de una cirrosis hepática descompensada de otra etiología. En este caso, el tratamiento, en la medida que las alteraciones sean reversibles, puede ser dilatación con balón percutáneo transyugular o quirúrgico. Si existe un daño irreversible, la alternativa es el retrasplante (19–22).
Eventos trombóticosLos eventos trombóticos, no relacionados con el trasplante mismo, fundamentalmente trombosis venosa profunda, contribuyen en forma significativa a la morbimortalidad de los niños trasplantados. El síndrome postflebítico puede desarrollarse hasta 2 años después de una trombosis venosa profunda. Sin embargo el rol del tratamiento profiláctico anticoagulante, con el objetivo de prevenir trombosis venosas en extremidades, y el consiguiente tromboembolismo pulmonar, no está claramente determinado en niños (23).
Enfermedad veno-oclusivaEnfermedad poco frecuente caracterizada por oclusión no trombótica de las venas hepáticas de pequeño calibre. Se asocia a múltiples etiologías, siendo las más frecuentes el uso de algunas drogas anticancerosas y anticonceptivos. La irradiación del hígado es otro factor desencadenante. En su forma crónica se presenta con hiperbilirrubinemia, elevación de transaminasas y, en casos más graves con trombocitopenia.
La biopsia revela fibrosis intimal y estenosis de las vénulas hepáticas terminales con fibrosis y pérdida del lumen. Puede haber proliferación endotelial. En casos más severos los hallazgos son similares al síndrome de Budd Chiari, pudiendo llegas hasta la cirrosis. El tratamiento es fundamentalmente del factor etiológico (24).
Una complicación alejada es la disfunción tardía del injerto, definida como un inadecuado funcionamiento del hígado trasplantado en un período alejado, habitualmente transcurridos más de 2 meses post trasplante, luego de un período de funcionamiento adecuado del injerto.
Debe diferenciarse de la falla o disfunción primaria del injerto, que se presenta en el período post trasplante inmediato y que se relaciona con daño por preservación, isquemia/reperfusión, hígado graso, isquemia fría o caliente prolongada o simplemente desconocido.
La disfunción tardía del injerto se asocia tanto a presentación de nuevas patologías, recurrencia de enfermedades conocidas o como consecuencia de problemas ocurridos en las etapas tempranas post trasplante como períodos de isquemia que pudiera producir alteraciones biliares alejadas. Existen patologías nuevas y recurrentes, las que trataremos en forma separada.
Patologías nuevas Rechazo crónicoPuede presentarse en forma excepcional en pacientes sin antecedentes de cuadros de rechazo anterior. Lo más frecuente es que aparezca en aquellos pacientes que han presentado múltiples episodios de rechazo, resistentes a esteroides o rechazo persistente. Se presenta, en general, después de los 2 meses y hasta varios años post trasplante, representado entre un 2% y un 17% de los pacientes trasplantados.
Los pacientes pueden ser asintomáticos, pero sin pruebas hepáticas revelarán un patrón colestásico y citolisis. En etapas tardías puede aparecer estenosis biliares intrahepáticas, barro biliar e infartos hepáticos. El diagnóstico final es a través de una biopsia hepática.
El algunos casos afortunados, detectados precozmente, el injerto puede ser rescatado aumentado y/o cambiando el esquema de inmunosupresión. En la mayoría de los casos es necesario un retrasplante (25–27).
Síndrome linfopoliferativo (PTLD)Su incidencia varía entre un 2% y un 5% de los pacientes trasplantados, siendo mucho más frecuente en la población pediátrica. Se asocia a la presencia de virus de Epstein-Barr, sobreinmunopresión y/o uso de anticuerpos.
Su presentación es variable con alteraciones inespecíficas de las pruebas hepáticas asociado con fiebre y linfoadenopatía. Las formas más avanzadas pueden presentarse como obstrucción intestinal. El estudio por imágenes puede revelar desde pequeñas linfoadenopatías toracoabdominales, hasta grandes masas, con compromiso visceral. El diagnóstico se efectúa por biopsia hepática (28).
El tratamiento consiste en disminución y hasta suspensión de la inmunosupresión, asociando a terapia específica anti CD 20, si el inmunofenotipo es acorde y, eventualmente quimioterapia. Ocasionalmente es necesaria una intervención quirúrgica para solucionar problemas obstructivos del tracto gastrointestinal, o resección quirúrgica del tumor cuando sea posible (24, 29, 30).
La incidencia de PTLD, recientemente reportada en nuestra serie de pacientes trasplantados pediátricos fue de 8 casos de un total de 197 trasplantes realizados en 157 receptores menores de 15 años lo que representa un 5%, acorde con los reportes internacionales (30). La mitad aparecieron durante los 2 primeros años post-trasplante. El 87,5% se presentó con masas abdominales o torácicas. El tratamiento efectuado fue la disminución drástica o suspensión de la inmunosupresión, utilización de anticuerpos monoclonales y cirugía en casos de complicaciones obstructivas intraabdominales. La mortalidad de nuestra serie fue de un 37,5% (30).
Infecciones viralesLas infecciones virales pueden recurrir o presentarse de novo post trasplante, tal es el caso de las infecciones por virus hepatitis B y C. Existe otra infección viral que se puede presentar primariamente en el injerto, tal es la infección por citomegalovirus (CMV) que trataremos en esta sección.
Infección por CMVEntre el 50% 90% de los adultos han tenido exposición a este virus. La infección es más frecuente, en aquellos receptores CMV seronegativos que han recibido un injerto CMV seropositivo. Estos pacientes deberían ser tratados con ganciclovir en el periodo post trasplante inmediato. Pese a lo anterior, no es infrecuente su presentación que puede ser ocasional, crónica o persistente.
Su presentación es más frecuente entre el primer y tercer mes post trasplante. Clínicamente hay presencia de un cuadro febril, asociado a pruebas hepáticas con un patrón hepatítico. Tienen eco doppler normal.
El diagnóstico se efectúa a través de una antiginemia o Reacción de Polimerasa en Cadena (PCR) específica para este virus (31). Las infecciones por CMV en nuestra serie representan un 29.8% (10).
Colestasia puraExisten algunos pacientes que presentan síndromes colestásicos alejados, sin alteraciones de la vía biliar intra o extrahepática. Debe descartarse la ingesta de drogas que pudieran originar el cuadro.
La etiología es desconocida, probablemente multifactorial. El tratamiento con ácido usodeoxicólico tiene resultados en algunos casos. Ocasionalmente hay prurito asociado, el que debe tratarse con medidas habituales (29).
Hepatitis Autoinmune de novoSe describió en 1998, se encontró disfunción del injerto asociado a hallazgos de laboratorio de autoinmunidad. Se desarrolla tardíamente, aproximadamente 24 meses post trasplante en pacientes trasplantados por indicación distinta a hepatitis autoinmune.
La mayoría de los que presentan esta complicación responde a un aumento o al agregado de Prednisona junto con azatioprina asociado a su tratamiento con Ciclosporina o FK (32, 33).
Patologías recurrentes Hepatitis Autoinmune (HAI)Está aceptado actualmente que la HAI recurre post trasplante. La recurrencia se estima en aproximadamente un 30%.
DiagnósticoEs más difícil hacer el diagnóstico de la HAI que recurre que el diagnóstico inicial.
La mayoría de los trasplantes por HAI mantienen autoanticuerpos positivos e hipergammaglobulinemia independiente de la función hepática o de las características histológicas, por lo tanto, los autoanticuerpos y la hipergammaglobulinemia no son concluyentes para hacer el diagnóstico.
La recurrencia aparece muchos meses después del trasplante y a medida que pasa el tiempo aumenta el riesgo.
Hay acuerdo en que a los pacientes trasplantados por HAI no debería suspendérseles los corticoides. No está claro el rol del aumento de dosis de otras drogas inmunosupresoras como tacrolimus o ciclosporina (32–34).
Hepatitis BHasta hace algunos años se consideraba una contraindicación para el trasplante hepático, con una tasa de recurrencia de 80% y una mortalidad de 50%. La profilaxis y el tratamiento actual han llevado a una mejoría en el resultado del trasplante por virus B.
Está documentado que el VHB puede vivir en células distintas a los hepatocitos, (células del bazo, médula ósea, páncreas). Se postula que el virus reinfecta el injerto desde estas células en el primer mes post trasplante.
La enfermedad se mantiene silente por alrededor de 3 meses y luego se manifiesta como hepatitis aguda, pudiendo progresar a cirrosis en menos de un año.
El diagnóstico de recurrencia es sencillo, pocos meses post trasplante se presenta elevación de las transaminasas. Se detecta antígeno de superficie VHB positivo y DNA-VHB en suero.
La biopsia hepática muestra reactividad lobular y se encuentra reacción inmunohistoquímica positiva para antígeno de superficie y antígeno anti core (HbcAg).
El mejor tratamiento es la prevención de la recurrencia. Se debe usar pretrasplante gammaglobulina para inmunidad pasiva (no sirve vacunar), se administra vía endovenosa durante el intraoperatorio en la fase anhepática y posteriormente en forma diaria por 6 días, luego mensualmente hasta obtener niveles de anticuerpos anti antigeno de superficie sobre 100UI/L. en aquellos paciente que eran antígeno e y DNA negativo antes del trasplante, pero cuando eran antígeno e o DNA positivos el nivel que se requiere es sobre 500UI/l. Para disminuir costos se puede continuar con administración vía intramuscular, en lugar de endovenosa. Se han utilizado varias drogas para tratar la recurrencia de VHB, entre ellas destaca la lamivudina, que ha logrado hacer una depuración de 100% del virus (24, 35).
Hepatitis CExiste una tasa de casi el 100% de recurrencia por VHC del injerto dentro de los 2 primeros años post trasplante. Es poco frecuente en niños, pero sí lo es en adultos, dado que el trasplante en ese grupo etario por cirrosis secundario a infección viral por virus C, es mucho más frecuente.
El tratamiento estándar para infección crónica por VHC es interferón más ribavirina. El retrasplante es un tratamiento efectivo, ampliamente aceptado para los pacientes con VHC que desarrollan cirrosis en el nuevo hígado. La excepción son pacientes con hepatitis colestásica fibrosante (24,36).
Enfermedades malignas hepatobiliaresLa indicación de trasplante en esta patología es discutible. En el caso de hepatoblastoma la recidiva es mucho más frecuente en aquellos casos en que el trasplante hepático fue indicado como salvataje después del fracaso de un intento de cirugía resectiva. Otra indicación es el hepatocarcinoma asociada a cirrosis.
Los pacientes deben controlarse y estudiarse para pesquisar eventuales recidivas tumorales ya que mucho de ellas son asintomáticas y sin alteraciones de las pruebas hepáticas hasta estadios avanzados de la enfermedad (8, 37).
Enfoque diagnóstico de las complicacionesLa frecuencia de controles en el seguimiento de pacientes trasplantados y el estudio realizado es cada una de dichas consultas es variable según los diferentes grupos trasplantológicos y debe adaptarse a las características personales de cada paciente y su historia. Elementos importantes a considerar es cual fue la indicación de trasplante, y las características del donante. Existen enfermedades que no recurren en el injerto como enfermedad de Wilson, deficiencia de alfa 1 antitripsina, atresia de vías biliares extrahepática, tumores benignos, hepatitis fulminante por virus A, hepatitis fulminante de causa desconocida, enfermedad por depósito de glicógeno, polineuropatía amiloidótica familiar, tirosinemia, déficit de ornitin transcarbamilasa. Hay otras que sí lo hacen, como tumores malignos, hepatitis B, hepatitis C, hepatitis autoinmune, cirrosis biliar primaria y colangitis esclerosante primaria.
Es diferente el enfoque que se dará con los pacientes trasplantados por cirrosis y virus C que otro por atresia biliar. También es diferente si era un donante joven sano que otro añoso, con alteraciones vasculares o hígado graso.
Ante una historia de cirugía compleja, tiempos de isquemia fría o caliente prolongada o antecedente de trombosis arterial se debe estar atento ante la aparición de eventuales complicaciones biliares tardías intra o extrahepáticas.
Sin embargo podemos esbozar una estrategia general del estudio que permita indicar un tratamiento adecuado.
Lo primero es observar si las pruebas hepáticas tienen un patrón colestásico o hepatítico. Posteriormente debe analizarse la historia del paciente y sus eventuales riesgos de complicación, reinfección viral, síndrome linfoproliferativo, complicaciones biliares, etc. La historia debe ser acuciosa para detectar consumo de drogas que producen daño hepático.
Posteriormente debe hacerse un ecodoppler que permitirá descartar alteraciones vasculares como estenosis de arteria hepática o vena porta, obstrucción de venas suprahepáticas, etc. Si existe sospecha de alguna de ellas deberá realizarse estudios angiográficos más avanzados como angio TAC, angio RM o angiografía directa.
El tratamiento puede ser endovascular o quirúrgico dependiendo de los hallazgos y las características del paciente.
Si hay dilatación de la vía biliar intrahepática debe descartarse de problemas biliares como colecciones, biliomas o abscesos. Una TAC, idealmente multicorte, permitirá evidenciarlos. El tratamiento puede ser percutáneo o quirúrgico. Si se encuentra dilataciones saculares intrahepáticas debe realizarse una colangio RM. Puede complementarse con biopsia hepática. Si el contexto es de una ictericia progresiva, formación de abscesos y otras complicaciones como consecuencia de una vía biliar isquémica el tratamiento deberá ser, probablemente, un retrasplante.
Si existe sospecha de un síndrome linfoproliferativo, debe investigarse el tumor, realizándose biopsia y fenotipificación. Además debe realizarse TAC de cerebro, tórax, abdomen y pelvis y mielograma para tener un estudio del estadio de la enfermedad.
Si hay sospecha de recurrencia de enfermedad tumoral, el estudio imagenológico de elección es le TAC multicorte. En la mayoría de los casos el contar con dos estudios por imágenes concluyentes, sumado al antecedente de patología tumoral previa, son suficientes para el diagnóstico. El nivel de alfa feto proteína puede ser de gran ayuda en casos de hepatocarcinoma o hepatoblastoma. Si persiste duda debe considerarse una biopsia hepática, considerando que el riesgo de diseminación en pacientes inmunosuprimidos es elevado.
El estudio de carga viral, antigenemia para CMV, estudio de anticuerpos, etc., debe adoptarse a cada paciente según sospecha clínica. Debe ser seriado y programado ya que en muchos casos son asintomáticos en etapas tempranas. Si no se tiene un diagnóstico certero, o si se desea certificar una hipótesis diagnóstica debe recurrirse a la biopsia hepática. Ésta es mejor realizarla con marcación previa bajo ecografía y, en casos seleccionados como trasplante con hígado reducido y alteraciones anatómicas severas de la caja torácica debe realizarse bajo guía ultrasonográfica.
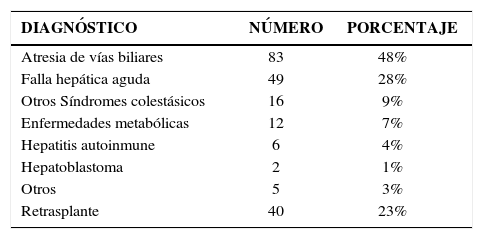
ResultadosEn el programa conjunto de trasplante hepático pediátrico Clínica Las Condes – Hospital Luis Calvo Mackenna, desde sus inicios en 1994 hasta noviembre 2009, hemos efectuado 209 trasplantes en 173 niños menores de 18 años. Las principales causas de trasplante son presentadas en la siguiente tabla:
Etiología del daño hepático que llevó al trasplante a los 173 niños
| DIAGNÓSTICO | NÚMERO | PORCENTAJE |
|---|---|---|
| Atresia de vías biliares | 83 | 48% |
| Falla hepática aguda | 49 | 28% |
| Otros Síndromes colestásicos | 16 | 9% |
| Enfermedades metabólicas | 12 | 7% |
| Hepatitis autoinmune | 6 | 4% |
| Hepatoblastoma | 2 | 1% |
| Otros | 5 | 3% |
| Retrasplante | 40 | 23% |
Un paciente recibió un trasplante hepatorrenal.
36 niños fueron retrasplantados, 4 de ellos 2 veces.
Las principales complicaciones postrasplante en nuestro grupo fueron, al igual que en centros de similares condiciones a nivel mundial, quirúrgicas, infecciosas e inmunológicas.
Las complicaciones vasculares se presentaron en 27 casos (13%), 13 trombosis de arteria hepática, 11 trombosis de vena porta y 3 trombosis de ambos vasos. En 30 pacientes hubo que reintervenir la vía biliar en el post trasplante (14%).
Se registraron 60 episodios de rechazo agudo moderado (29%) y 15 de rechazo agudo severo (7%), 1 de los cuales llevó a pérdida del injerto.
La sobrevida actuarial de los trasplantes hepáticos pediátricos en nuestro grupo es de 76,2% a 1 año, 66,9% a 5 años y 64,9% a 10 años. La sobrevida global de injerto es de 69% a 1 año, 58,6% a 5 años y 52,3% a 10 años.
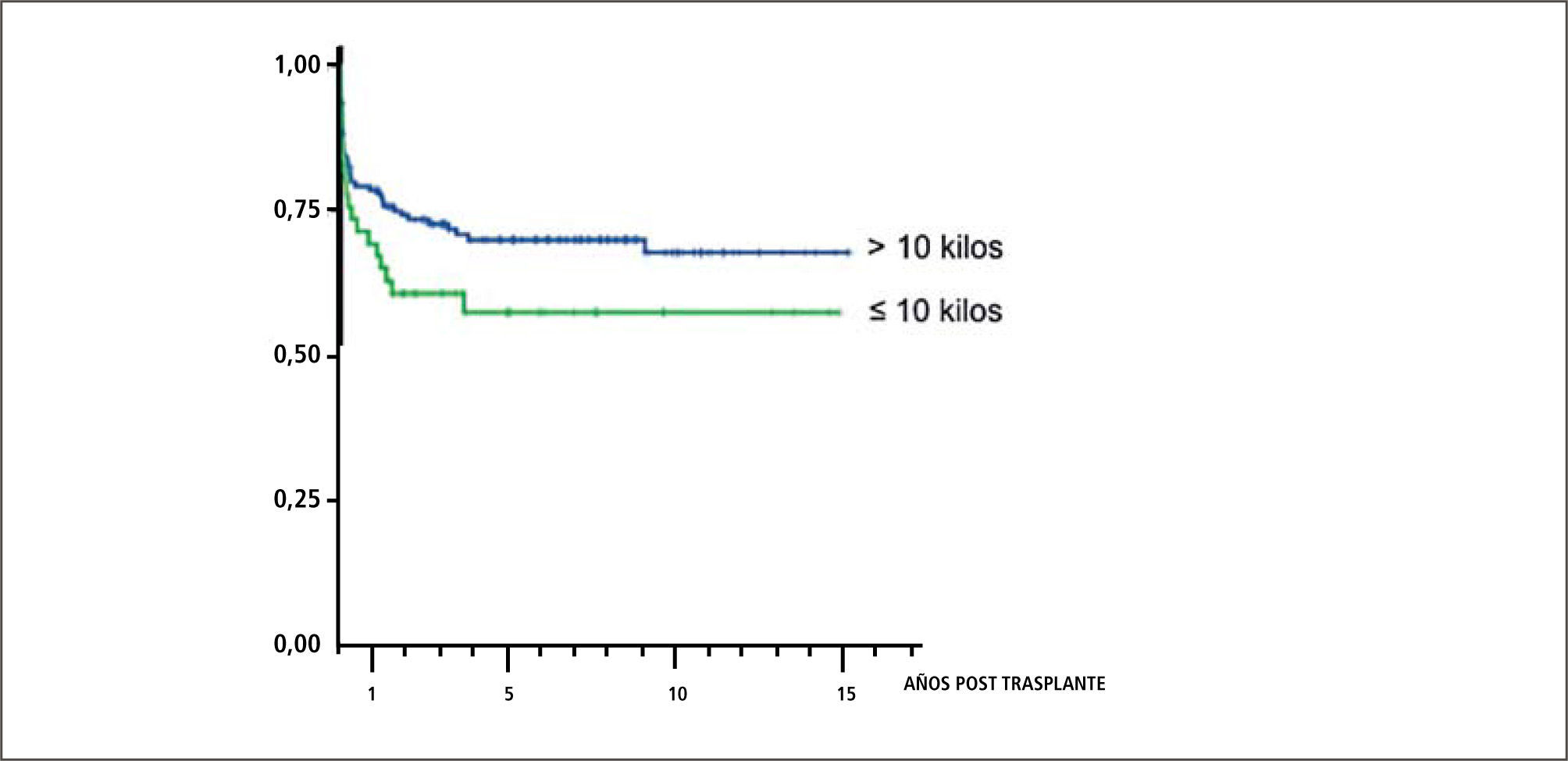
Trasplante en niños menores de 10kgEl trasplante en pacientes pediátricos menores de 10kg. representa un importante desafío para los equipos quirúrgicos y anestésicos por las dificultades técnicas involucradas en cuanto a accesos venosos, manejo de la hipotermia, reposición de volumen, técnicas de anastomosis y control de hemorragias, entre otras. La mayoría de los estudios definen el peso de 10 kilos como un límite en el que aumentarían las complicaciones. La sobrevida actuarial de series internacionales llega al 73% al año, 66% a 5 años y 63% a 10 años (38).
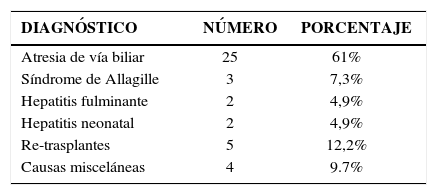
De los 209 trasplantes realizados por nuestro grupo, 41 han sido en receptores menores de 10 kilos. Esta experiencia la hemos comunicado recientemente en eventos científicos internacionales (39). Nuestros resultados señalan que las patologías primarias fueron:
La edad promedio al trasplante fue de 1,3+/−0,5 años, siendo 22 (54%) hombres. Los donantes cadavéricos (DC) fueron 18 (43,9%) utilizándose injerto completo en 9 (50%) y en el resto injerto reducido. Los donantes vivos relacionados (DVR) fueron 23 (56,1%) utilizándose en todos ellos los segmentos II y III como injertos. Fue necesario re-operar 21 casos (51,2%), por trombosis portal (TVP) 8 (38,1%), para aseo quirúrgico 6 (28,6%), por filtración biliar 4 (19,1%), por obstrucción Intestinal 2 (9,5%), por trombosis de la arteria hepática 2 (9,5%) y para explorar la vía biliar en 1 caso (4,8%). La sobrevida actuarial (Kaplan-Meier) de pacientes y del injerto al 1 año fue 75,7% y a 5 y 10 años 67,1%. La TVP fue la principal causa de pérdida de injertos (42,8%). La causa de muerte más frecuente fue la sepsis en el 47,7% de los casos. La sobrevida y resultados del trasplante hepático en niños pequeños en un programa chileno son comparables favorablemente con series extranjeras y lo valida como terapia en este grupo de alto riesgo.
RetrasplanteEl retrasplante hepático pediátrico está indicado en caso de falla del injerto original debido a complicaciones. La sobrevida del paciente y del injerto es menor que en el trasplante original. Representa un 19,3% de las indicaciones de trasplante en nuestro programa (40). Los reportes internacionales señalan un porcentaje de retrasplante que varía entre un 8–29% (9). La sobrevida actuarial reportada por nuestro grupo es de un 76% a 1 y 5 años en aquellos pacientes que fueron retrasplantados una vez y de un 60% a 1 y 5 años en pacientes con más de un retrasplante.
La falla primaria del injerto representa un 30% de las indicaciones de retrasplante en nuestro programa, siendo otras causas importantes la trombosis de la arteria hepática y el rechazo crónico, con un 20% cada una (40). El retrasplante además presenta un alto impacto económico por los costos involucrados.
Cabe destacar que en nuestra serie, reportamos 2 pacientes retrasplantados por pérdida del injerto por AB0 incompatible, pese a haber utilizado plasmaféresis y agresivos esquemas de inmunosupresión. Dado que los 2 pacientes presentaban un cuadro de hepatitis fulminante, el primer injerto, incompatible, sirvió de puente para poder tener la opción de un segundo injerto, habiendo sobrevivido ambos casos (40). Debemos destacar que el porcentaje de retrasplante ha disminuido en forma significativa en los últimos 5 años.
Calidad de vidaLa calidad de vida en los pacientes trasplantados pediátricos también ha sido un tema de constante preocupación. Múltiples áreas han sido evaluadas por diferentes autores considerando las más importantes la salud mental, funcionamiento físico, desarrollo cognitivo y habilidades para el diario vivir (41). Algunos estudios revelan que tanto el desarrollo físico como psicosocial son algo menores en niños trasplantados, comparados con la población general. Sin embargo, la mayor diferencia es observada en el área del desarrollo escolar con alteraciones del aprendizaje en comparación con sujetos no transplantados. Es probable que la pérdida de días de clases, debida a controles o enfermedades relacionadas con su trasplante pueda influir en estos resultados. Otro problema importante que ha sido detectado, es la falta de adherencia al tratamiento el que puede llegar a un 30% (41). Esto se hace más patente durante la adolescencia, en que un sentimiento de rebeldía se desarrolla progresivamente llevando al incumplimiento del tratamiento inmunosupresor.
En nuestra experiencia algunos pacientes han perdido el injerto por este motivo (40). Además quisimos investigar si las interacciones familiares de nuestros niños trasplantados eran normales. Para ello efectuamos un estudio donde se evaluaban 3 factores del entorno familiar comparando niños trasplantados versus sanos. Los elementos estudiados fueron: respeto a reglas y límites de comportamiento, relaciones de alianza u oposición entre los miembros de la familia y respeto a la jerarquía familiar. Nuestros resultados demostraron que no había diferencias entre la estructura familiar y el comportamiento en ambos grupos con un nivel socioeconómico similar (42).
Pese a que el entorno familiar pueda ser normal, la no adherencia al tratamiento durante la adolescencia, sumado a la transferencia a centros trasplantológicos de adultos, donde deben comenzar por conocer a sus nuevos equipos tratantes, constituyen una problemática adicional para estos pacientes y un constante motivo de preocupación para los que estamos involucrados en su cuidado.
Los autores declaran no tener conflictos de interés, en relación a este artículo.