El trasplante pulmonar es considerado en la actualidad el tratamiento de elección para pacientes portadores de una patología pulmonar avanzada, sin compromiso de otro órgano vital y que tengan sobrevida esperada de menos de dos años. Ha presentado una evolución notable en los últimos años mejorando la sobrevida y calidad de vida de los pacientes, lo que ha sido asociado a la mejoría de drogas inmunosupresoras, mejor diagnóstico de situación inmunológica, técnicas de preservación del injerto, protocolos efectivos de profilaxis infecciosa y diagnóstico precoz de las complicaciones.
Los desafíos en la actualidad son el déficit de órganos, que lleva aumento de lista de espera por lo que se han desarrollado técnicas de optimización de injertos, la extensión de la edad de los candidatos a trasplante y se mantiene sin grandes modificaciones la disfunción crónica de injerto.
Lung transplantation is currently considered the treatment of choice for patients with advanced lung disease, without involvement of other vital organ and have expected survival of less than two years. In recent years has presented a remarkable development improving survival and quality of life of patients, which has been associated with improvement of immunosuppressive drugs, better diagnosis of immunological state, techniques graft preservation, effective prophylaxis infectious protocols and early diagnosis of medical complications.
The challenges today are the shortage of organs, which has increased waiting list so that optimization techniques have been developed graft, the extension of the age of transplant candidates and remains largely unchanged chronic dysfunction graft.
En 30 años el trasplante pulmonar ha evolucionado desde lo anecdótico y excepcional a una terapia esperada y habitual para un grupo de pacientes portadores de enfermedad pulmonar avanzada refractaria a tratamiento médico. Se inició como técnica cardiopulmonar en 1981, monopulmonar en 1983 y luego bilateral secuencial desde 19851,2.
En relación a otros trasplantes de órgano sólido, la técnica pulmonar presenta características que han dificultado su desarrollo. Es así como la conexión al ambiente a través de la vía aérea lo expone a irritantes, infecciones y estímulos antigénicos que estimulan la aloreactividad en el receptor y riesgo de rechazo del injerto, a su vez existe un mayor riesgo de no compatibilidad HLA (Human Leukocytes Antibodies) por el escaso tiempo disponible para análisis en el momento del trasplante y así la posibilidad de desarrollar anticuerpos donante específico posteriores3.
El número de trasplantes pulmonares se ha incrementado progresivamente de acuerdo a los registros de ISHLT (Internacional Society Heart and Lung Transplantation) alcanzando en 2013 un total de 37194.
La sobrevida también ha experimentado una mejoría a 1 y 5 años, siendo en 1994 de 72% y 49%, alcanzando en el año 2013 un 80% y 54% respectivamente5. La mejoría de este procedimiento es multifactorial, destacando las soluciones de preservación del órgano, la técnica de anastomosis bronquial, la introducción de inmunosupresores más selectivos, los criterios de selección tanto del donante como del receptor y el aporte de las técnicas de circulación extracorpórea a la Disfunción Primaria de Injerto (DPI)6,7. Otro factor determinante ha sido la asignación de puntajes de urgencia en lista de espera a un grupo de pacientes conocido como LAS (Lung Allocation Score), lo que favorece a pacientes portadores de fibrosis pulmonar o a quienes se deterioran rápidamente y que experimentan la mayor tasa de mortalidad previo a la cirugía8.
El trasplante pulmonar se asocia a una mejoría notable de la calidad de vida en pacientes con severa patología respiratoria, pero el gran desafío en la actualidad lo constituye el manejo del rechazo crónico conocido principalmente como Sindrome Bronquiolitis Obliterante (SBO), siendo responsable del 50% de la mortalidad tardía y que a pesar de la mejoría en la terapia inmunosupresora, no ha logrado modificarse en forma significativa9,10.
PROCESO DEL TRASPLANTE:Al referir un paciente a un Centro de Trasplante se inicia una extensa evaluación de acuerdo a un protocolo establecido y en este proceso se definen tres etapas:
- 1.
Estudio de candidato: se refiere al análisis del compromiso de otros órganos en búsqueda de alguna situación que contraindique o que deba corregirse previo al trasplante.
- 2.
Paciente en lista: es el período de espera en que el paciente recibe educación del proceso, se realiza rehabilitación kinésica, manejo nutricional, soporte psicológico/psiquiátrico y recibe las vacunas de protocolo.
- 3.
Paciente trasplantado: se maneja en controles periódicos de acuerdo a la etapa en que se encuentre para corregir inmunosupresión, monitoreo de función pulmonar y pesquisa precoz de complicaciones.
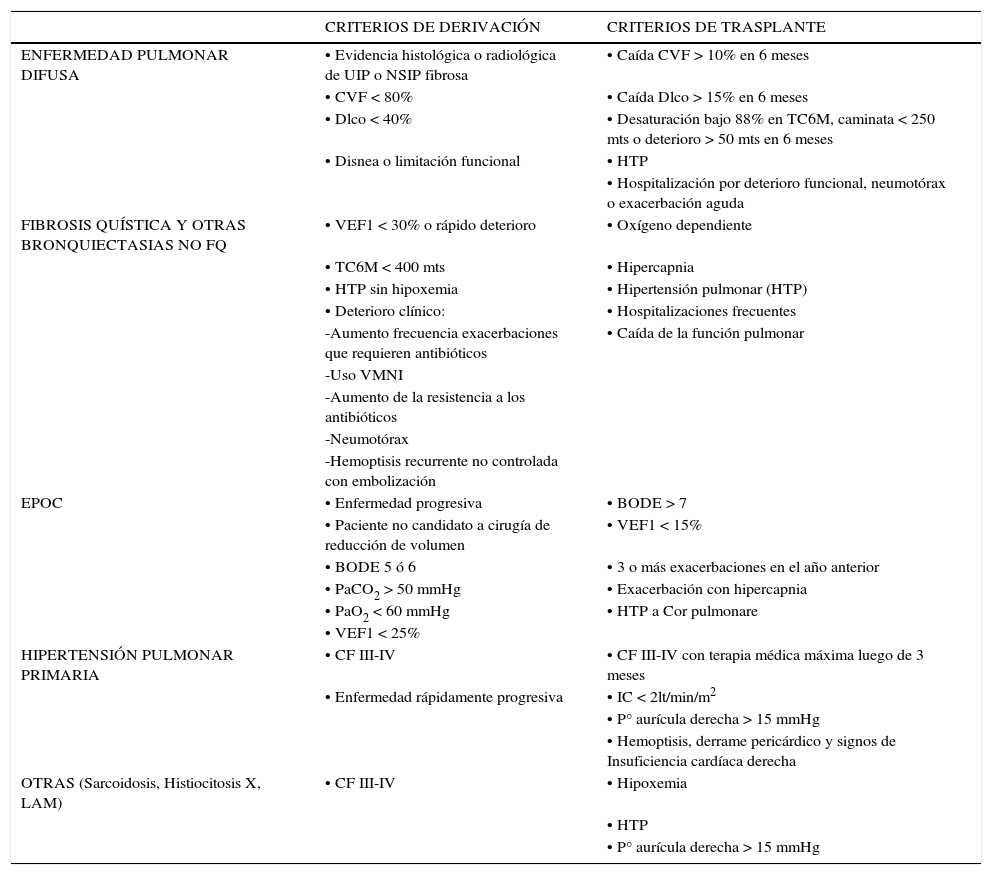
El momento de indicar el trasplante varía de acuerdo a la enfermedad de base. Debe considerarse que existen patologías de deterioro rápidamente progresivo y de mal pronóstico, las que deben tener prioridad en derivación; tal es el caso de portadores de Fibrosis Quística y Fibrosis Pulmonar de tipo UIP. Las indicaciones por enfermedad de base se resumen en Tabla 1. Las contraindicaciones se describen a continuación: 11.
INDICACIONES DE TRASPLANTE PULMONAR POR PATOLOGÍA
| CRITERIOS DE DERIVACIÓN | CRITERIOS DE TRASPLANTE | |
|---|---|---|
| ENFERMEDAD PULMONAR DIFUSA | • Evidencia histológica o radiológica de UIP o NSIP fibrosa | • Caída CVF > 10% en 6 meses |
| • CVF < 80% | • Caída Dlco > 15% en 6 meses | |
| • Dlco < 40% | • Desaturación bajo 88% en TC6M, caminata < 250 mts o deterioro > 50 mts en 6 meses | |
| • Disnea o limitación funcional | • HTP | |
| • Hospitalización por deterioro funcional, neumotórax o exacerbación aguda | ||
| FIBROSIS QUÍSTICA Y OTRAS BRONQUIECTASIAS NO FQ | • VEF1 < 30% o rápido deterioro | • Oxígeno dependiente |
| • TC6M < 400 mts | • Hipercapnia | |
| • HTP sin hipoxemia | • Hipertensión pulmonar (HTP) | |
| • Deterioro clínico: | • Hospitalizaciones frecuentes | |
| -Aumento frecuencia exacerbaciones que requieren antibióticos | • Caída de la función pulmonar | |
| -Uso VMNI | ||
| -Aumento de la resistencia a los antibióticos | ||
| -Neumotórax | ||
| -Hemoptisis recurrente no controlada con embolización | ||
| EPOC | • Enfermedad progresiva | • BODE > 7 |
| • Paciente no candidato a cirugía de reducción de volumen | • VEF1 < 15% | |
| • BODE 5 ó 6 | • 3 o más exacerbaciones en el año anterior | |
| • PaCO2 > 50 mmHg | • Exacerbación con hipercapnia | |
| • PaO2 < 60 mmHg | • HTP a Cor pulmonare | |
| • VEF1 < 25% | ||
| HIPERTENSIÓN PULMONAR PRIMARIA | • CF III-IV | • CF III-IV con terapia médica máxima luego de 3 meses |
| • Enfermedad rápidamente progresiva | • IC < 2lt/min/m2 | |
| • P° aurícula derecha > 15 mmHg | ||
| • Hemoptisis, derrame pericárdico y signos de Insuficiencia cardíaca derecha | ||
| OTRAS (Sarcoidosis, Histiocitosis X, LAM) | • CF III-IV | • Hipoxemia |
| • HTP | ||
| • P° aurícula derecha > 15 mmHg |
UIP: Usual intersticial Pneumonia NSIP: Non usual specific Intersticial Pneumonia.
Consensus Document for Lung Transplant Candidate selection 2015.11
- •
Enfermedad neoplásica en los últimos 2 años. Sin embargo, se sugiere un intervalo > 5 años libre de enfermedad; excepto las neoplasias cutáneas escamosas y basocelular.
- •
Disfunción avanzada e intratable de otro órgano (corazón, hígado y riñón).
- •
Enfermedad aterosclerótica severa.
- •
Condición clínica inestable (falla hepática, IAM, sepsis).
- •
Deformidad importante de la pared torácica.
- •
Alteraciones de la coagulación intratables.
- •
Infección por gérmenes de difícil tratamiento.
- •
Infección activa por M. Tuberculosis.
- •
IMC > 35.
- •
No adherencia o incapacidad de seguir tratamiento y controles.
- •
Condición psiquiátrica o psicológica intratable.
- •
Ausencia de soporte social y familiar.
- •
Adicción activa a sustancias: alcohol, tabaco y drogas, en los últimos 6 meses.
- •
Edad > 65 años.
- •
Infección crónica por hepatitis B, C y VIH (en algunos centros internacionales).
- •
VMI o ECMO.
- •
Pobre potencial de rehabilitación.
- •
Colonización por gérmenes altamente resistentes: bacterias, hongos y mycobacterias.
- •
IMC > 30 y < 17.
- •
Osteoporosis severa sintomática.
- •
Otras condiciones médicas NO tratadas: úlcera péptica, RGE, enfermedad coronaria.
El objetivo en los pacientes con muerte cerebral es mantener la estabilidad para maximizar la utilización de órganos y asegurar el trasplante de la mayor cantidad de injertos posibles.
En los pacientes con muerte cerebral, los pulmones son especialmente frágiles comparados con otros órganos, debido a diversos factores: riesgo directo de aspiración, el proceso de reanimación, la respuesta inflamatoria sistémica e injuria pulmonar asociada a ventilación mecánica.
Las causas de shock en el donante son múltiples: vasodilatación por hipovolemia, diuresis osmótica, Sindrome de respuesta inflamatoria sistémica (SIRS), disminución del cortisol, shock cardiogénico, deficiencia de hormonas tiroídeas y alteración sistémica del sistema simpático12,13.
DONANTE IDEAL- •
Edad < 55 años.
- •
Tabaquismo < 20 paq/año.
- •
Adecuada concordancia peso/talla con el receptor.
- •
PaFi >300mmHg (Con 100% FiO2 y PEEP 5mmHg).
- •
Sin evidencia de infección activa (broncoscopía limpia).
- •
Compatibilidad ABO (grupo sanguíneo).
- •
Ausencia de trauma torácico.
- •
Sin antecedentes de cirugías cardíacas o pulmonares.
- •
VENTILACIÓN
- -
Volumen 6-8ml/Kg
- -
FiO2 50%
- -
Circuito cerrado de aspiración
- -
PEEP 8-10mmHg
- -
- •
HEMODINAMIA
- -
Euvolemia (PVC 6-8mmHg)
- -
Uso de drogas vasoactivas.
- -
- •
TERAPIA HORMONAL
- -
Metilprednisolona 15mg/kg
- -
Vasopresina o desmopresina para diabetes insípida
- -
Reemplazo de hormonas tiroídeas
- -
- -
Monopulmonar: es de elección en pacientes de edad > 55 años y portadores de patología no séptica. Facilita el uso de dos injertos pulmonares con donante único.
- -
Bipulmonar: es la técnica en aumento a nivel mundial4, indicada en patología séptica, pacientes < 55 años, EPOC avanzado y en Hipertensión pulmonar severa.
- -
Cardiopulmonar: fue la técnica inicial para el trasplante de pulmón, pero en desuso en la actualidad. Sólo aplicable en algunos centros, cuando hay patología cardiovascular congénita asociada a hipertensión pulmonar severa.
La complejidad de la respuesta inmuno-inflamatoria del receptor ha llevado a la combinación de distintos agentes inmunosupresores, con diferente perfil terapéutico para evitar dosis mayores, toxicidad secundaria y finalmente lo más importante, como protección del injerto, evitando el rechazo agudo y el desarrollo del rechazo tardío.
Los protocolos de inmunosupresión son levemente variables en distintos centros y en la actualidad prevalece:
- •
Terapia de Inducción: es aplicada al momento del trasplante y predominan los antagonistas del receptor de IL2 (Basiliximab). En casos de pacientes altamente sensibilizados se puede utilizar: Timoglobulina, plasmaféresis, gamaglobulina, rituximab, alemtuzumab entre otros14.
- •
Terapia de mantención: se basa en triterapia: Corticoesteroides, inhibidores de calcineurina (ICN) los que bloquean la activación de linfocitos T: ciclosporina y tacrolimus (preferido en la actualidad) y antimetabolitos que inhiben la proliferación de linfocitos B y T: azatioprina y micofenolato mofetil.
En los últimos años se ha incorporado el uso de bloqueadores mTOR para aquellos pacientes con nefropatía y que no pueden alcanzar dosis óptimas de ICN o que desarrollan rechazo crónico15.
PROFILAXISLa conexión del injerto pulmonar al ambiente, favorece el ingreso de patógenos infecciosos que pueden ocasionar lesiones en la vía aérea o en el parénquima pulmonar. Entre éstos destaca: Pneumocistis jirovecci, Nocardia sp, Aspergillus sp y virus comunitarios respiratorios.
A su vez, la inmunidad previa del receptor a Citomegalovirus (CMV), virus Ebstein barr (VEB) y Herpes es muy importante en la reactivación de infecciones endógenas o la adquisición de infección primaria que en el caso de CMV, puede deteriorar el injerto en forma definitiva, y en la primoinfección a VEB puede asociarse al desarrollo de cuadros linfoproliferativos posteriores.
Tipo de profilaxis:
Pneumocistis jirovecci y Nocardia sp: Cotrimoxazol Forte 1 comp trisemanal y en pacientes de riesgo uso diario.
Aspergillus sp: Anfotericina B nebulizada por un mes asociada a itraconazol o voriconazol en pacientes de alto riesgo por 6-12 meses. Requiere de monitoreo estricto de niveles de ICN.Herpes: Aciclovir por 4-6 meses.
Tuberculosis: En pacientes con PPD > 8mm, o quantiferon (+) o de riesgo, HIN- Rifampicina por 9 meses pretrasplante.
CMV: La literatura es muy variable respecto a duración y uso de terapia anti CMV, si el receptor es IGG (-) se indica valganciclovir por seis meses con controles de PCR (reacción polimerasa en cadena) CMV mensual. Si receptor es IGG (+) se realiza terapia preventiva y se mide PCR CMV quincenal por cuatro meses, y en caso de aumento de inmunosupresión se realiza cobertura con valganciclovir. También existen algunos centros que realizan profilaxis universal durante todo el primer año.
RESULTADOSEl objetivo de los pacientes sometidos a un trasplante por una enfermedad pulmonar avanzada, es en primer lugar mejorar su calidad de vida, suspensión de oxigenoterapia e incorporación a la actividad estudiantil o laboral. El logro de estos objetivos depende de evitar o realizar tratamiento precoz de las complicaciones asociadas a las diferentes etapas del trasplante pulmonar.
Complicaciones precoces:
Pueden presentarse relacionadas directamente al injerto y son una importante causa de morbilidad precoz:
- a.
Disfunción primaria de injerto (DPI) o reacción de reperfusión: ocurre las primeras 72 horas, se caracteriza por un daño alveolar agudo, cuya clínica son infiltrados pulmonares, deterioro de la oxigenación y disminución de la distensibilidad pulmonar habiendo descartado falla cardiaca16. Su incidencia es de 10 a 25%. Los factores de riesgo descritos son: donantes marginales, tiempo de isquemia prolongado e hipertensión pulmonar en el receptor17. El manejo es terapia de sostén en ventilador mecánico hasta uso de ECMO.
- b.
Rechazo agudo: se refiere a la respuesta inmune del receptor de predominio linfocito T a los diversos antígenos del donante, la que provoca una reacción inflamatoria del injerto pulmonar en grado variable. El diagnóstico es histopatológico y el tratamiento son altas dosis de esteroides. La presencia de rechazo agudo reiterado o persistente se asocia a disfunción crónica del injerto.
- c.
Lesión de vía aérea: la zona de la anastomosis bronquial constituye un desafío en el manejo del trasplante, tiene muy escasa irrigación y facilita cicatrización anormal que puede llevar a granulomas obstructivos y estenosis que requieren de manejo broncoscópico. Tardíamente puede desarrollarse malacia bronquial que requiera de prótesis endobronquial.
Relacionadas al uso de inmunosupresión pueden presentarse infecciones de predominio bacteriano en etapa inicial, posteriormente por tratarse de un injerto conectado al ambiente pueden aparecer hongos o virus.
En los inicios del trasplante pulmonar, la infección a CMV de tipo neumonitis provocó gran morbimortalidad por pérdida de injerto18, lo que a la fecha ha mejorado ostensiblemente con inmunosupresores de mayor selectividad y profilaxis antivirales específica.
Otro patógeno a destacar es el hongo Aspergillus, ampliamente distribuido en el ambiente y que puede localizarse en la zona de sutura provocando obstrucción y en caso invasivo deshicencia y hemoptisis fatal. Los pacientes portadores de Fibrosis quística tienen un riesgo mayor y la profilaxis con itraconazol o voriconazol asociado a anfotericina inhalada ha sido muy efectivo19.
Complicaciones tardías:
Pueden presentarse asociadas a comorbilidades del paciente, a disfunción crónica del injerto o asociadas a inmunosupresión a largo plazo.
- a.
Disfunción crónica del injerto (DCI): conocida previamente como Sindrome de Bronquiolitis Obliterante, caracterizado por el deterioro progresivo e irreversible de la función pulmonar. Es la complicación que determina la mayor morbimortalidad tardía. Las causas que llevan a disfunción crónica son variables: desde la presencia de DPI en el post trasplante inmediato, luego desde el punto de vista inmunológico el desarrollo de rechazo agudo reiterado y la formación de anticuerpos donante específicos20,21. Los factores no inmunológicos relacionados son la infección a CMV22, la colonización e infección con Pseudomonas sp y de gran importancia en los últimos años la presencia de reflujo gastro esofágico23.
- b.
Comorbilidad médica: el uso de inmunosupresores a largo plazo facilita en un grupo de pacientes patología cardiovascular (hipertensión y enfermedad coronaria), disfunción renal y metabólica que debe mantenerse en tratamiento para evitar daño en otros órganos.
- c.
Neoplasias: a largo plazo se han descrito en pacientes trasplantados la aparición de lesiones malignas cutáneas, mayor riesgo de síndrome linfoproliferativos y neoplasias de órgano sólidos, por lo que debe mantenerse vigilancia endoscópica y de imágenes24.
Diversos estudios han demostrado la notoria mejoría en la calidad de vida posterior al trasplante25, lo que no sorprende si se considera la precaria condición del paciente en el período de lista de espera. El poder evaluar la calidad de vida va más allá de los estudios de función pulmonar o exámenes de laboratorio. Debe considerarse escala de disnea, tolerancia al ejercicio, independencia de oxígeno, reinserción familiar, educacional y laboral. En general, los pacientes con Fibrosis quística logran la mejor calidad de vida, comparado con otras patologías26.
SOBREVIDADesde inicios de la década del 90, se logran los primeros trasplantes pulmonares exitosos a largo plazo. Según registros del ISHLT alcanzaban sobrevida a 1-2 y 5 años de 72%, 65% y 49% respectivamente, entre 2000-2010 alcanza 80%-72% y 54% 3. La mejoría se atribuye principalmente a mejor soporte perioperatorio y disminución de complicaciones precoces. Los pacientes portadores de Fibrosis quística y enfermedad vascular pulmonar alcanzan sobrevida mayor en comparación a pacientes portadores de EPOC y fibrosis pulmonar, presumiblemente por la edad mayor y comorbilidades asociadas3.
DESAFÍOSA pesar de los avances en el conocimiento de la inmunología, evitar el desarrollo de disfunción crónica de injerto constituye el principal desafío del trasplante pulmonar. Si bien el avance en tecnología para detección de anticuerpos pretrasplante ha optimizado la selección y ha disminuido el rechazo hiperagudo, una de las principales metas es disminuir el daño pulmonar inmediato post trasplante el que aumenta la aloreactividad del injerto, disminuye la tolerancia y facilita el desarrollo de rechazo posterior. La inmunidad innata del receptor también se ve alterada por diversas injurias como la exposición a humo, tabaco e infecciones y estudios recientes indican que la colonización con Pseudomonas sp estimula los neutrófilos y genera un proceso inflamatorio crónico que deteriora el injerto27.
Otro gran desafío es el aumento de la esperanza de vida de la población en general, lo que ha llevado a extender la posibilidad del trasplante más allá de 65 años y según reporte en EE.UU., donde el 26% de los pacientes en lista de espera en 2012 era mayor de 65 años, comparado a solo el 6% el año 200428.
El número de pacientes que espera un trasplante de pulmón excede el número de donantes efectivos. Sólo son utilizados un 15% de los pulmones de los donantes multiorgánicos. El resto se rechaza por diferentes causas: PaFi <300, injuria pulmonar secundaria la muerte cerebral, complicaciones asociadas al manejo de UCI (barotrauma, edema pulmonar), infiltrados pulmonares y sospecha de aspiración29. Con el fin de aumentar el pool de pulmones utilizables, se ha desarrollado la técnica de ex vivo (EVLP: ex vivo lung perfusion) que permite ventilar y perfundir pulmones ya extraídos de donantes (que se han rechazado inicialmente) y que en condiciones fisiológicas protectoras, logran aumentar la utilización, permitiendo reevaluar, tratar y reparar los órganos antes de trasplantarlos, con resultados similares a pulmones sin uso de esta técnica30.
El trasplante pulmonar continúa desafiando en encontrar una medicina personalizada, estratificada, en que la inmunosupresión tenga la mayor especificidad para evitar el rechazo del órgano sin daño a otros órganos del receptor. A más de 30 años de su inicio, hemos aprendido y observado cómo esta técnica ha logrado salvar a miles de personas y ha optimizado su calidad de vida en forma notoria.
EXPERIENCIA NACIONALEn Chile, el trasplante pulmonar se inicia en 1999. Ha sido un proceso largo y complejo y en la actualidad se desarrolla en el área pública y privada logrando resultados a largo plazo comparables con la literatura extranjera.
Se presentan datos de los dos mayores centros activos que desarrollan trasplante pulmonar: Clínica Las Condes que inicia su programa en 1999: (total 76 pacientes) e Instituto Nacional del Tórax en el año 2010 (total 60 pacientes). En este artículo se presentan resultados de pacientes seguidos > 1 mes. Las características demográficas del grupo trasplantado son descritas en la Tabla 2.
Caracterísiticas Demográficas De 129 Pacientes Trasplantados Pulmonares Cohorte Clínica Las Condes E Instituto Nacional Del Tórax
| VARIABLES | n (%) |
|---|---|
| Edad media (min-max) | 48 (13-71) |
| años | |
| Sexo | |
| Hombres | 79 (61) |
| Mujeres | 50 (39) |
| Técnica monopulmonar | 84 (65) |
| PATOLOGÍA BASE | |
| • Fibrosis pulmonar | 80 (62) |
| • Fibrosis quística | 14 (11) |
| • Bronquiolitis obliterante | 12 (9) |
| • Enfisema | 8 (6) |
| • Silicosis | 6 (5) |
| • HTPP* | 2 (1) |
| • Otros: Histiocitosis X, Amiloidosis, hemangioendoteliosis y | 7 (6) |
| LAM ** |
*HTPP: Hipertensión pulmonar primaria
** LAM: Linfangioleiomiomatosis.
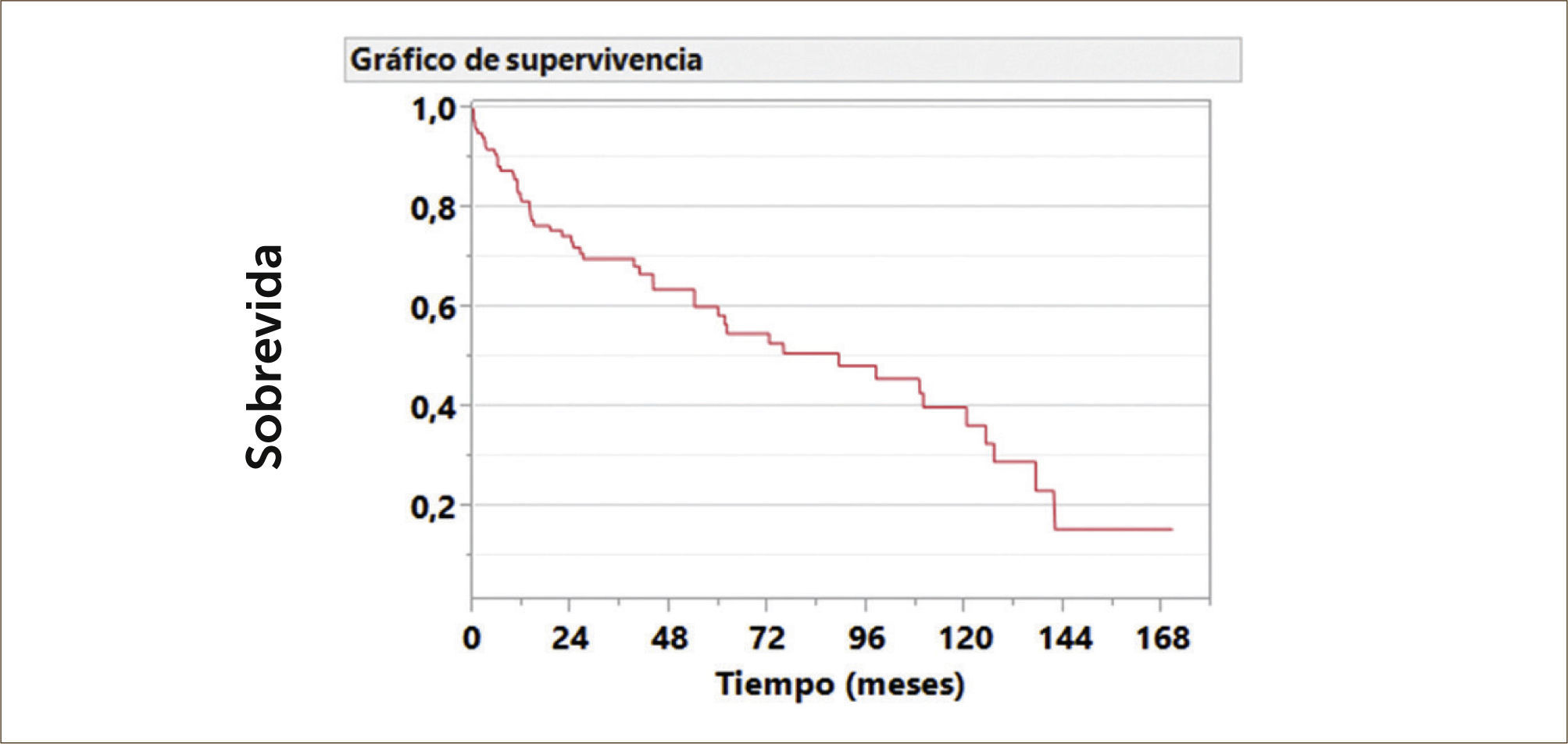
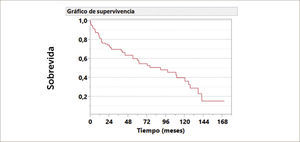
Si consideramos que el paciente que accede a un trasplante pulmonar tiene una muy mala calidad de vida y su esperanza de vida es menor a dos años en los mejores casos, los resultados a largo plazo han sido muy promisorios. De un total de 129 pacientes trasplantados en ambos centros y seguidos a largo plazo, la sobrevida alcanzada es de 90%, 55% y 33% a 1, 5 y 10 años respectivamente. Ver Gráfico 1.
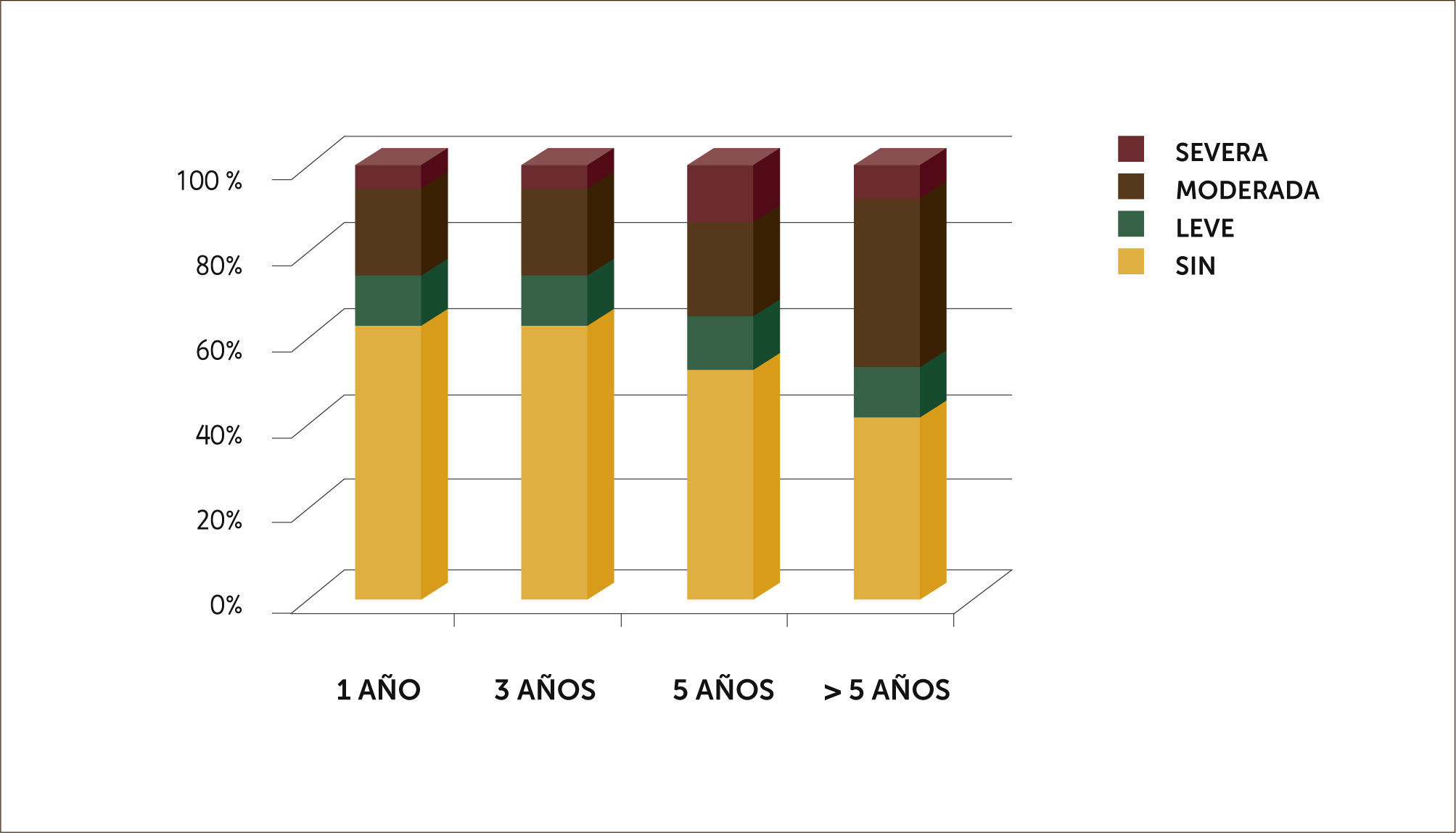
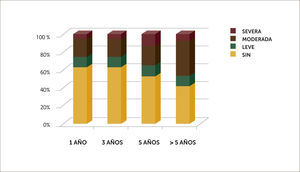
Se ha observado que una vez superados los primeros tres meses post trasplante, la evolución es hacia una franca mejoría de la calidad de vida, evidenciada por suspensión de oxígeno, aumento progresivo de actividad física y luego de seis meses reintegro a la vida laboral o estudiantil. De 12 pacientes jóvenes portadores de Fibrosis quística, 8 de ellos se reintegraron a sus estudios. En los pacientes <65 años, 28 de ellos retomaron actividad laboral. En Gráfico 2 se muestra tipo de limitación física a largo plazo post trasplante.
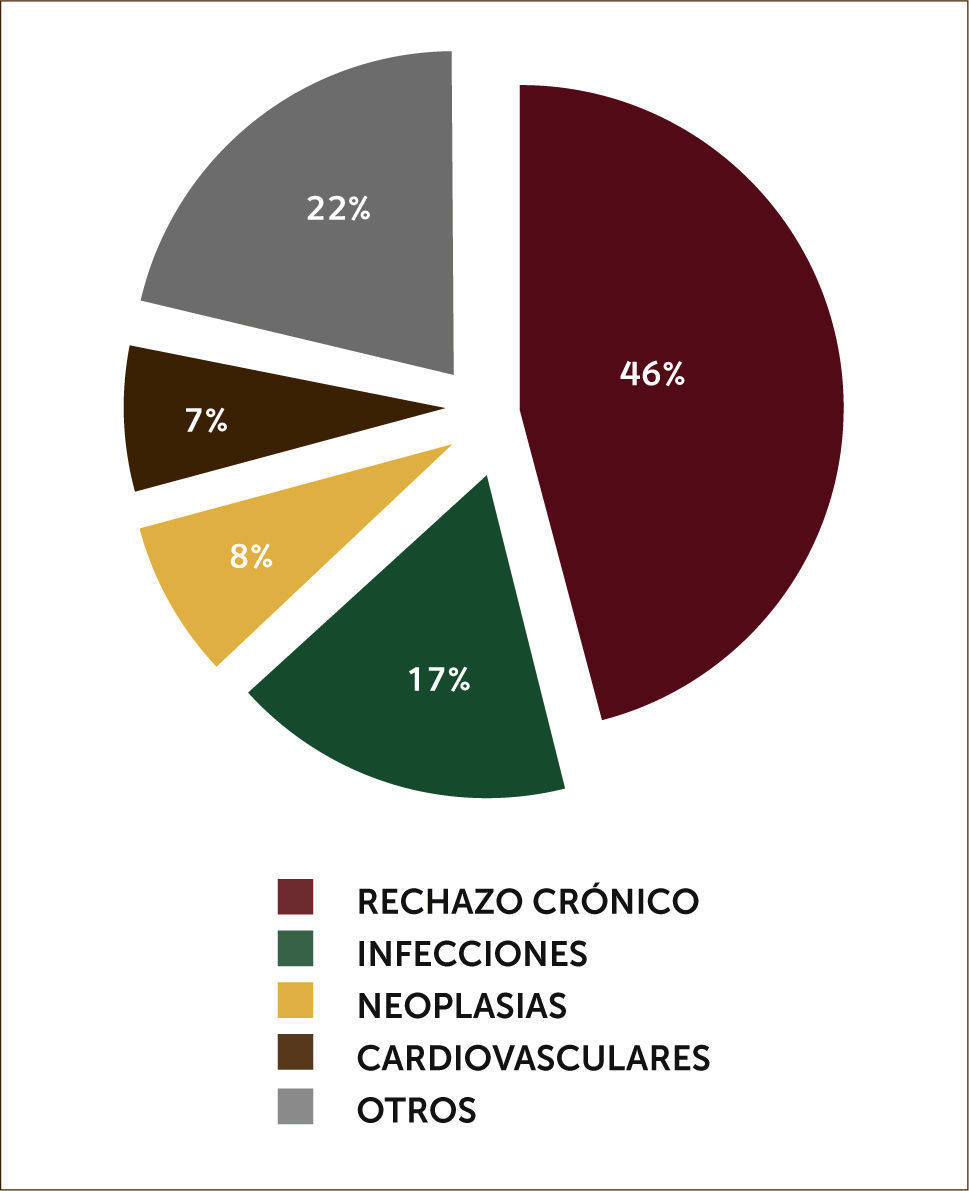
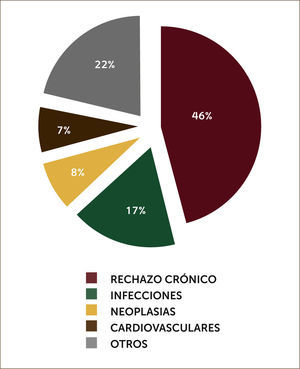
En el seguimiento a largo plazo a 12 años fallecieron 59 pacientes (45,7%). La causa principal fue la disfunción crónica del injerto en 27 pacientes (46%). En gráfico 3 se describen las causas de mortalidad en pacientes trasplantados pulmonares.
En general, las complicaciones observadas fueron más frecuentes durante los primeros seis meses posterior al trasplante y disminuyeron progresivamente, permitiéndole al paciente importante inserción familiar, laboral y mejoría de su calidad de vida.
En nuestro país la tasa de donación aún permanece baja, no alcanzando más allá de 7,1 por 1.000.000 habitantes (reporte de Ministerio de Salud 2014), lo que ha llevado a que la lista de espera nacional se incremente progresivamente y que sumado a las estrictas condiciones a cumplir por el donante, constituyan el gran desafío como política pública a cumplir por nuestro país.
Agradecimientos: Al equipo de Enfermeras Coordinadoras de Trasplante de Clínica Las Condes Sras. Cristina Herzog y Lorena Calabrán; y de INT, Sras. Erika Donoso y Francesca Gajardo. A Dr. Mauricio Salinas por tabla de sobrevida.
Las autoras declaran no tener conflictos de interés, en relación a este artículo.