La pubertad es el período de transición desde la infancia a la adultez, donde el individuo finalmente adquiere la capacidad reproductiva. Los trastornos endocrinos de la pubertad en la niña y adolescente se pueden agrupar dentro de aquellos que alteran el “tempo” de la pubertad, ocurriendo ésta en forma adelantada, lo que se conoce como “pubertad precoz” u ocurriendo en forma más tardía y que se conoce como “pubertad retrasada”.
En este período podemos encontrar aquellos cuadros que se manifiestan por alteraciones en la ciclicidad menstrual y los niveles de andrógenos, dentro de los cuales el Síndrome de Ovario Poliquístico y la Hiperplasia Suprarrenal Congénita No Clásica cobran gran interés.
En este capítulo se revisarán algunos tópicos de pubertad normal y patológica en la niña y adolescente.
Endocrine disorders of puberty in girls and adolescents can be divided into those that alter the “tempos” of puberty, occurring before the expected time, which is known as “precocious puberty” or occurring at a later point, “delayed puberty”.
In this period we can find some disorders that are manifested by alterations in menstrual cyclicity and androgen levels, within which the Polycystic Ovarian Syndrome and Non-Classical Congenital Adrenal Hyperplasia have a lot of interest.
In this chapter we review some topics of normal and abnormal puberty in girls and adolescents.
La pubertad es consecuencia de la acción coordinada de las hormonas del hipotálamo, hipófisis y gónadas, por las cuales se desarrollan los caracteres sexuales secundarios y se adquiere la capacidad reproductiva.
Se ha descrito que el “tempo” de la pubertad está determinado en un 60-80% por la genética y en un 20-40% por el ambiente (1). El inicio de ésta se debe a la pérdida del tono inhibitorio intrínseco que existe sobre el hipotálamo, y al comienzo de la secreción pulsátil de la hormona liberadora de gonadotrofinas (GnRH) (2,3). Cualquier alteración en el inicio o en el patrón de secreción de la GnRH determinará que la pubertad ocurra antes o después.
El objetivo de este artículo es revisar las principales causas de pubertad precoz, pubertad retrasada y algunos trastornos endocrinos de la pubertad en niñas y adolescentes.
Pubertad normalEl inicio de la pulsatilidad de la GnRH estimula la secreción de las gonadotrofinas hipofisiarias, hormona luteinizante (LH) y folículo estimulante (FSH), las cuales estimulan a las células de la granulosa y de la teca ováricas, para la producción de los esteroides sexuales (1). La producción de estrógenos por el ovario determina la aparición de los caracteres sexuales secundarios, como es el botón mamario o la telarquia en la mujer. La telarquia es, en la gran mayoría de las niñas, el primer signo de desarrollo puberal, ocurriendo en promedio a los 8,88 años en Chile, datos basados en la observación de 758 niñas escolares de Santiago. Sin embargo, un 10-15% presenta como primera manifestación de pubertad la aparición de vello púbico o pubarquia (4).
El proceso de la pubertad culmina con la adquisición de la capacidad reproductiva, manifestada por la llegada de la primera menstruación o menarquia, y el inicio de la ciclicidad menstrual. La menarquia, en general, sobreviene 2 a 3 años después de la telarquia, ocurriendo en nuestro país a los 12,7 años, edad similar a la observada en países de Europa y Estados Unidos (4). La tendencia secular observada desde los años 1840 a 1960, respondió principalmente a los cambios nutricionales observados en los países desarrollados. Sin embargo, este adelanto en la edad de la menarquia no se ha observado en nuestro país, permaneciendo estable en las últimas décadas.
Posterior a la menarquia, los ciclos se van haciendo cada vez más regulares, reflejando una mayor tasa de ciclos ovulatorios. Al momento de la menarquia, hasta un 12% de las niñas tienen niveles de progesterona en rango de ovulación, lo cual aumenta a 36% a los 2-3 años postmenarquia (5, 6). De este modo, el ciclo menstrual normal, resulta de la integración de señales estimuladoras e inhibitorias y de la acción coordinada de las señales centrales sobre el ovario, produciendo un crecimiento y descamación sincrónica del endometrio (7).
Respecto a los factores que influyen en el inicio de la pubertad, existen tanto factores internos como externos. Dentro de los factores intrínsecos se describen principalmente los factores familiares o genéticos. Al día de hoy, se han identificado numerosos genes, algunos de los cuales están implicados en el desarrollo de las neuronas productoras de GnRH, en la síntesis, liberación y acción de ésta, en la síntesis de las gonadotrofinas hipofisiarias (8, 9) y en el desarrollo de las gónadas. Respecto a los factores extrínsecos, dentro de los cuales cobra importancia el ambiente y la nutrición, se sabe que las variables nutricionales y psicosociales pueden influir positiva o negativamente en el inicio puberal. Es importante recordar que se requiere de un estado nutricional adecuado para el inicio de ésta, lo cual está regulado por neuropéptidos, como la leptina, kisspeptina, glutamato, ghrelina y el neuropéptido Y, entre otros (10, 11).
Trastornos endocrinos de la pubertadLos trastornos de la pubertad se producen por que ésta comienza antes, lo que se denomina pubertad precoz, o porque sucede en forma más tardía, lo que se conoce como pubertad retrasada.
Pubertad precozSe conoce como pubertad precoz (PP) a la aparición de caracteres sexuales secundarios antes de los 8 años en la niña, ya sea botón mamario o vello púbico asociado a un aumento de la velocidad de crecimiento. Esta edad de corte se ha tratado de redefinir, basándose en estudios del inicio de la pubertad en diferentes razas, por lo que se ha propuesto definir como pubertad temprana a aquella que ocurre entre los 7 y 8 años, y como pubertad precoz a aquella que ocurre antes de los 7 años. Sin embargo, estudios nacionales no permiten avalar el uso de estas definiciones en nuestra población, por lo que seguimos usando la edad de corte de 8 años para definir esta patología (12, 13).
Las causas de pubertad precoz pueden ser de origen central (PPC) o periférico (PPP). La PPC se caracteriza por la aparición de los caracteres secundarios de forma armónica, debido a la activación del eje hipotálamo-hipófisis-ovario como mecanismo principal. Las PPP se caracterizan por la aparición de mamas o vello púbico sin un patrón cronológico habitual, debido a que su mecanismo es la producción de esteroides sexuales por parte de las gónadas, glándulas suprarrenales, o tumores, entre otros, sin haber activación central. En las niñas, las PP periféricas pueden ser isosexuales, dependiendo si las manifestaciones son por exceso de estrógenos, o PP heterosexuales si las manifestaciones están dadas por un aumento en la secreción de los andrógenos (Tabla 1).
Causas de pubertad precoz en la niña y adolescente
| Pubertad precoz central |
| • Idiopática |
| • Anomalías congénitas (hidrocefalia, displasia septo-óptica) |
| • Tumores SNC (glioma, hamartoma, astrocitoma, ependimoma, entre otros) |
| • Secuelas SNC (post meningitis, encefalitis, traumatismo encéfalocraneano, radiación) |
| • Otros (hipotiroidismo, síndromes genéticos, tratamiento tardío de PPP) |
| Pubertad precoz periférica |
| Isosexual |
| • Tumores ováricos (tumor de células de la granulosa, tecoma, quistes foliculares) |
| • Tumores productores de hCG (hepatoma, teratoma, coriocarcinoma) |
| • Sindrome de McCune - Albright |
| • Exposición a estrógenos exógenos |
| Heterosexual |
| • Hiperplasia suprarrenal congénita |
| • Tumores ováricos (tumor de Sertoli-Leydig tecoma, disgerminoma) |
| • Tumores adrenales (adenoma, carcinoma) |
| • Hipertecosis |
| • Latrogenia |
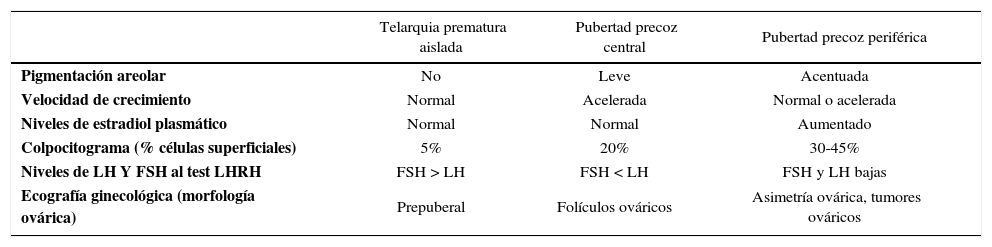
Recordar que los cuadros de PP se acompañan de una aceleración en la velocidad de crecimiento, que se puede ver como un adelanto en la edad ósea. Esto es útil para poder diferenciarla de cuadros que corresponden a variantes del desarrollo normal como son la telarquia prematura, que no se acompaña de otros signos de desarrollo puberal (Tabla 2).
Diagnostico diferencial de la telarquia precoz
| Telarquia prematura aislada | Pubertad precoz central | Pubertad precoz periférica | |
|---|---|---|---|
| Pigmentación areolar | No | Leve | Acentuada |
| Velocidad de crecimiento | Normal | Acelerada | Normal o acelerada |
| Niveles de estradiol plasmático | Normal | Normal | Aumentado |
| Colpocitograma (% células superficiales) | 5% | 20% | 30-45% |
| Niveles de LH Y FSH al test LHRH | FSH > LH | FSH < LH | FSH y LH bajas |
| Ecografía ginecológica (morfología ovárica) | Prepuberal | Folículos ováricos | Asimetría ovárica, tumores ováricos |
La telarquia prematura es muy frecuente dentro de la minipubertad que se observa los primeros dos años de vida en la niña, postulándose una mayor sensibilidad a los estrógenos en estas pacientes. Es importante confirmar que no sea manifestación de alguna neoplasia productora de estrógenos, descartar la presencia de quistes foliculares propios del Síndrome de McCune-Albright y la posibilidad de sustancias externas, conocidas como “disruptores endocrinos”, dentro de los cuales están la soya y la lavanda, entre otros (14).
El estudio inicial de la pubertad precoz puede hacerse con una ecografía ginecológica que confirma el crecimiento uterino, la presencia de línea endometrial y ovarios de más de 2 ml; y con una radiografía de edad ósea que a menudo está sobre las 2 desviaciones estándar para la edad cronológica. Se recomienda que el estudio siguiente y el manejo de esta patología sea realizado por un especialista.
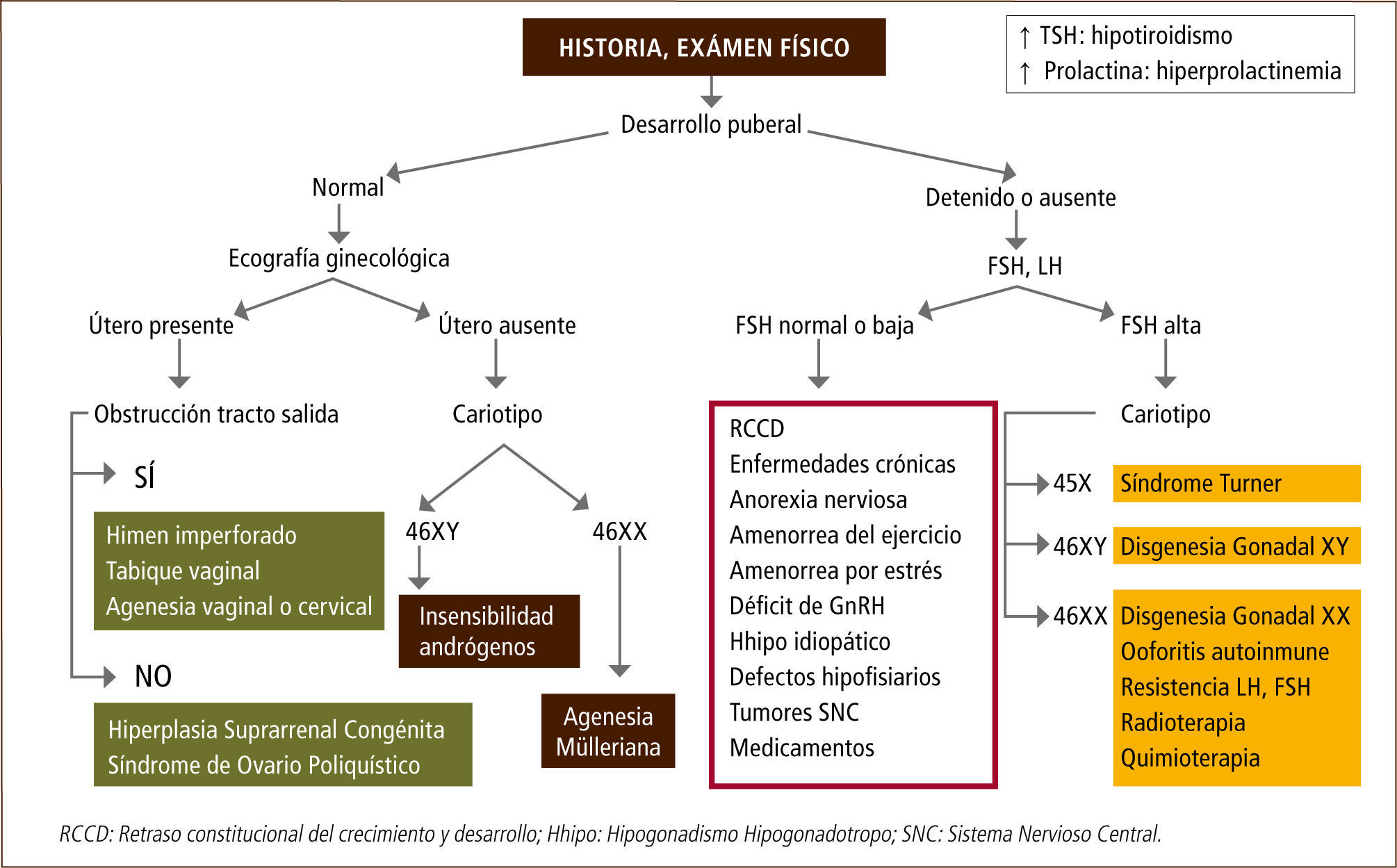
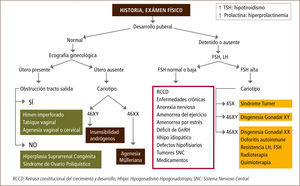
Pubertad retrasadaLa pubertad retrasada puede ser definida por la falla en el inicio y progresión de la maduración sexual. Es importante comprender que la pubertad retrasada puede ser fisiológica en un gran número de casos y a menudo está en el contexto de una talla baja y un retraso constitucional del crecimiento y desarrollo, lo que es más frecuente en niños que en niñas (15). Sin embargo, se debe tener en consideración que el término “retrasada” no es ni preciso ni adecuado, pues incluye alteraciones en las cuales la mayoría de las pacientes nunca inicia la pubertad, como es el caso de algunas disgenesias gonadales.
La ausencia de menstruación o amenorrea puede corresponder a un proceso fisiológico, como ocurre al inicio de la pubertad o puede ser la primera manifestación de un proceso patológico. La amenorrea puede ser primaria o secundaria, dependiendo si ocurre antes o después de la menarquia, respectivamente (6). La amenorrea primaria se define como ausencia de menarquia después de los 13 años sin desarrollo de caracteres sexuales secundarios, o después de los 15 años con desarrollo de caracteres sexuales secundarios (16). Dentro de esta definición se consideran aquellas pacientes sin menarquia después de 3 a 5 años de iniciado el desarrollo mamario o telarquia. La amenorrea secundaria se define como la ausencia de flujo menstrual luego de 3 ciclos o 6-12 meses (17).
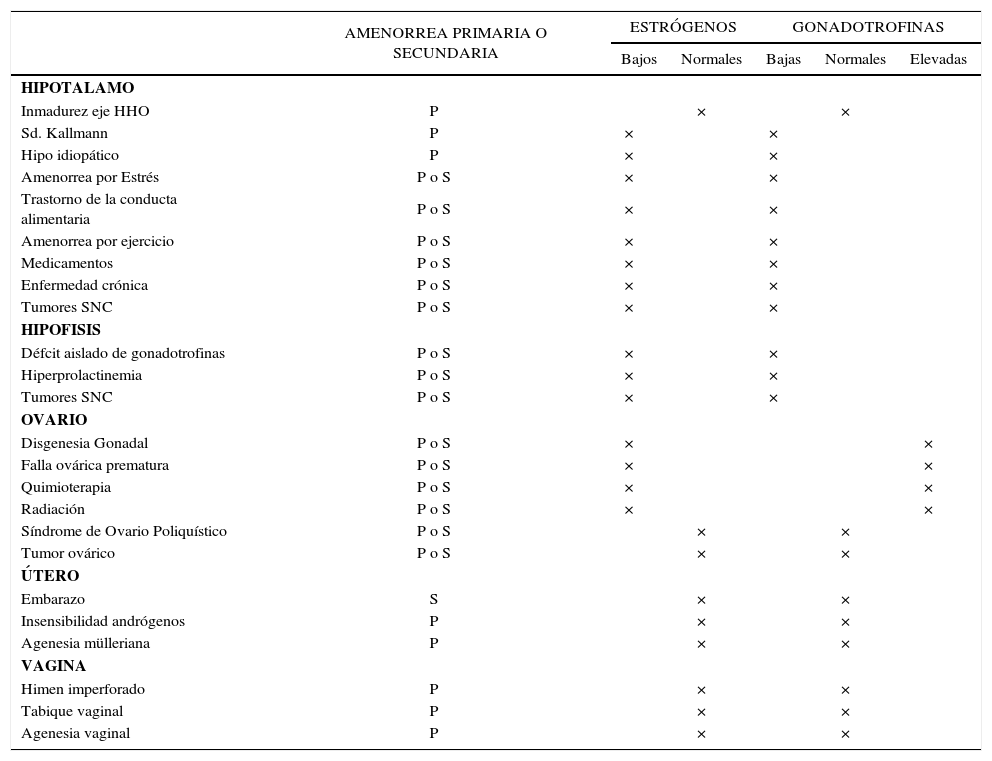
Las diferentes causas de amenorrea se han clasificado dependiendo de los niveles de gonadotrofinas en hipogonadotropas, normogonadotropas o hipergonadotropas. También, la amenorrea puede clasificarse según el compartimento afectado y según los niveles de estrógenos (Tabla 3). La principal causa de amenorrea primaria en la adolescencia es el hipogonadismo hipergonadotropo con un 49%, seguido de un 28% de hipogonadismo hipogonadotropo y un 23% de hipogonadismo normogonadotropo (18).
Causas de pubertad retrasada en la niña y adolescente
| AMENORREA PRIMARIA O SECUNDARIA | ESTRÓGENOS | GONADOTROFINAS | ||||
|---|---|---|---|---|---|---|
| Bajos | Normales | Bajas | Normales | Elevadas | ||
| HIPOTALAMO | ||||||
| Inmadurez eje HHO | P | × | × | |||
| Sd. Kallmann | P | × | × | |||
| Hipo idiopático | P | × | × | |||
| Amenorrea por Estrés | P o S | × | × | |||
| Trastorno de la conducta alimentaria | P o S | × | × | |||
| Amenorrea por ejercicio | P o S | × | × | |||
| Medicamentos | P o S | × | × | |||
| Enfermedad crónica | P o S | × | × | |||
| Tumores SNC | P o S | × | × | |||
| HIPOFISIS | ||||||
| Défcit aislado de gonadotrofinas | P o S | × | × | |||
| Hiperprolactinemia | P o S | × | × | |||
| Tumores SNC | P o S | × | × | |||
| OVARIO | ||||||
| Disgenesia Gonadal | P o S | × | × | |||
| Falla ovárica prematura | P o S | × | × | |||
| Quimioterapia | P o S | × | × | |||
| Radiación | P o S | × | × | |||
| Síndrome de Ovario Poliquístico | P o S | × | × | |||
| Tumor ovárico | P o S | × | × | |||
| ÚTERO | ||||||
| Embarazo | S | × | × | |||
| Insensibilidad andrógenos | P | × | × | |||
| Agenesia mülleriana | P | × | × | |||
| VAGINA | ||||||
| Himen imperforado | P | × | × | |||
| Tabique vaginal | P | × | × | |||
| Agenesia vaginal | P | × | × | |||
Dentro de las amenorreas por falla gonadal o hipergonadotropas (FSH elevada), la causa más frecuente es la disgenesia gonadal, como ocurre en aquellas pacientes con síndrome de Turner. Este desorden genético se caracteriza por la pérdida parcial o completa de un cromosoma X y afecta a 1 en 2500 recién nacidos de sexo femenino. La ausencia en el desarrollo puberal es uno de los signos clínicos más frecuentes, sin embargo, entre un 20-30% de las pacientes presentan un desarrollo puberal espontáneo con cese de la función ovárica posterior (19, 20). Otras causas de falla ovárica son la ooforitis autoinmune y el daño gonadal secundario a tratamiento oncológico.
Las amenorreas llamadas “normogonadotropas” (FSH normal) son aquéllas en que el eje hipotálamo-hipófisis-ovario está indemne y lo que falla es el órgano efector y tracto de salida, como ocurre en las malformaciones müllerianas (agenesias uterinas, tabiques vaginales transversos o himen imperforado) o en las pacientes con insensibilidad a los andrógenos (21, 22).
Las amenorreas de origen hipotalámico o hipogonadotropas dan cuenta de un tercio de las amenorreas en la adolescente y se caracterizan por niveles bajos de estrógenos con gonadotrofinas bajas o anormalmente normales para el grado de hipoestrogenismo. A menudo se difiere su manejo adjudicando la amenorrea a un factor familiar en el contexto de un retraso constitucional del crecimiento y desarrollo, cuadro clínico que es de exclusión, y que es más frecuente en varones con historia familiar positiva para pubertad retrasada. El hipogonadismo hipogonadotropo se produce por alteraciones a nivel del hipotálamo y/o hipófisis, las que pueden ser de origen funcional u orgánico (23). Al estudiar a pacientes con amenorrea primaria un 30% presentan deficiencia congénita de GnRH, un 22% retraso constitucional, un 12% endocrinopatías, 10% enfermedades sistémicas, y 8% diferentes formas de hipopituitarismo, tumores de SNC y trastornos de la conducta alimentaria.
La deficiencia de GnRH afecta a 1/10000 individuos, con una relación hombre:mujer de 5:1. Puede ser causada por alteraciones en los diferentes procesos involucrados en la secreción de GnRH, siendo identificados más de 15 genes en la actualidad. Es así como en la migración de las neuronas productoras de GnRH se describen a KAL1, FGF8, FGFR1, PROK2, PROKR2, TAC3 y TAC3R; y en la síntesis y liberación de la GnRH están KISS1, KISS1R, GnRH1, LEP y LEPR. Estos genes determinan diferentes cuadros con una marcada heterogeneidad genética y fenotípica, como alteraciones del olfato, esqueléticas y renales, entre otros (24, 25).
Es importante en el grupo de las adolescentes, no olvidar la amenorrea hipotalámica de origen funcional. El estrés, el bajo peso y el ejercicio de alto rendimiento alteran la pulsatilidad de la GnRH, lo que puede causar un retraso puberal con amenorrea primaria si la alteración se produce en etapas tempranas del desarrollo, esto es en la infancia y adolescencia temprana. Es causa de un 15-48% de las amenorreas secundarias, pero su incidencia real como causa de amenorrea primaria se desconoce (26, 27).
Es fundamental un adecuado estudio y manejo de las pacientes con pubertad retrasada o hipogonadismo con el objetivo de evitar el hipoestrogenismo y el consecuente deterioro en la adquisición de masa ósea, tarea fundamental de esta etapa de la vida (Figuras 1 y 2).
Otros trastornos endocrinos de la pubertadOtros trastornos endocrinos de la pubertad que provocan mucha preocupación en la niña y adolescente, son aquellos que cursan con irregularidades menstruales y signos de exceso de andrógenos, tales como el síndrome de ovario poliquístico y la hiperplasia suprarrenal congénita no clásica, cuadros que revisaremos brevemente a continuación.
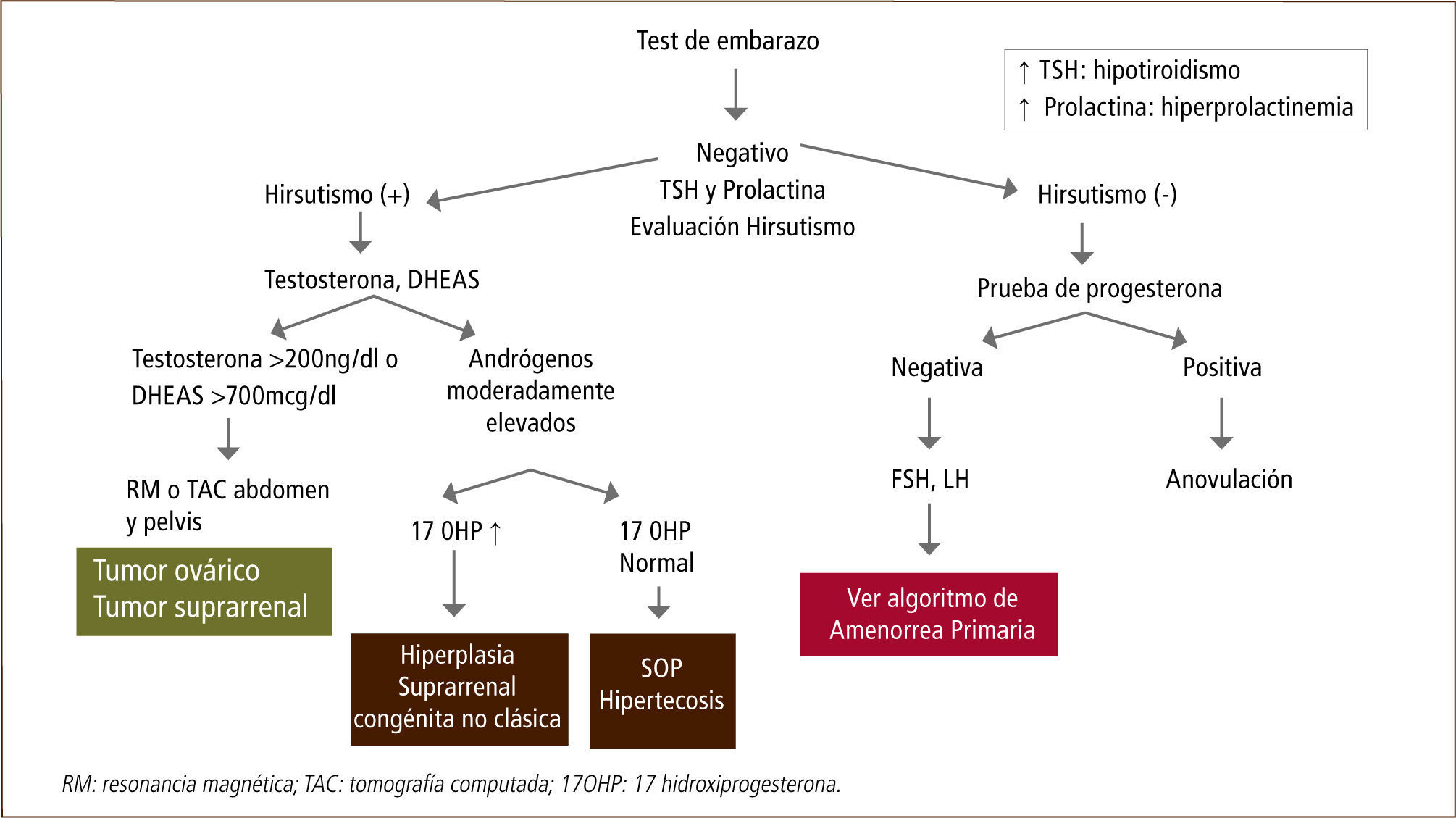
Síndrome de ovario poliquístico en la adolescenciaEl síndrome de ovario poliquístico (SOP) es un trastorno endocrinometabólico que se caracteriza por hiperandrogenismo/hiperandrogenemia y disfunción ovulatoria, con un amplio espectro de síntomas y signos clínicos. Tres diferentes consensos han buscado determinar los criterios diagnósticos para definir a esta enfermedad en mujeres adultas, pero existe controversia sobre el uso de estos criterios en la adolescencia (28, 29).
Los criterios adultos de disfunción ovulatoria no son aplicables en los primeros años postmenarquia. Las adolescentes normalmente tienen ciclos entre 21 y 45 días dentro de los 5 primeros años postmenarquia, con un 12% de ciclos ovulatorios al inicio y llegando a un 36% a los 2-3 años de edad ginecológica (6).
Por otro lado, la presencia de morfología de ovario poliquístico corresponde a un fenómeno fisiológico durante la adolescencia y no se correlaciona con alteraciones endocrinas o metabólicas (30). Se observa en hasta un 30% de adolescentes sanas dentro de los 4 años postmenarquia. Es por este motivo que recomendamos que la morfología de ovario poliquístico no sea un criterio único para definir SOP en las adolescentes.
A raíz de estos dos hechos, expertos internacionales sugieren que el factor clave para el diagnóstico de SOP durante la adolescencia sea el hiperandrogenismo clínico y bioquímico (hiperandrogenemia).
El hiperandrogenismo clínico se definiría por hirsutismo progresivo y no por acné o alopecia, ya que el primero es un hallazgo frecuente en este grupo etáreo y la alopecia es muy poco común. Los valores de corte para hiperandrogenismo bioquímico en la población joven no están descritos, además se debe tener en consideración el aumento fisiológico de los andrógenos e insulinorresistencia característicos de esta etapa, sin embargo, usamos los valores descritos en adultas para definir la hiperandrogenemia en espera de nuevos estudios (31).
Por lo tanto, durante la adolescencia no hay consenso sobre si se deben utilizar los criterios clásicos (NIH) o los de la Sociedad de Exceso de Andrógenos (AES) para el diagnóstico de SOP en este grupo etáreo. Sugerimos que el diagnóstico de SOP se base en la presencia de hirsutismo e hiperandrogenismo bioquímico, asociado a ciclos menstruales persistentemente mayores de 45 días. Aquellas pacientes con un criterio clínico de SOP y antecedentes familiares positivos para este síndrome o enfermedades metabólicas deben ser estrechamente vigiladas durante la adolescencia y estimuladas a mantener un estilo de vida saludable (Tabla 4).
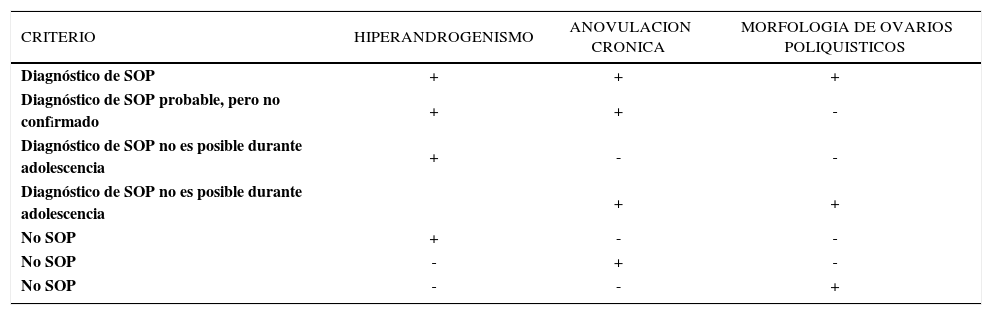
Criterios diagnosticos de sop en adolescentes
| CRITERIO | HIPERANDROGENISMO | ANOVULACION CRONICA | MORFOLOGIA DE OVARIOS POLIQUISTICOS |
|---|---|---|---|
| Diagnóstico de SOP | + | + | + |
| Diagnóstico de SOP probable, pero no confirmado | + | + | - |
| Diagnóstico de SOP no es posible durante adolescencia | + | - | - |
| Diagnóstico de SOP no es posible durante adolescencia | + | + | |
| No SOP | + | - | - |
| No SOP | - | + | - |
| No SOP | - | - | + |
Modificado de Carmina E. The diagnosis of PCOS in adolescents. Am J Obstet Gynecol 2010.
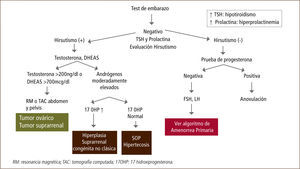
La hiperplasia suprarrenal congénita (HSC) es la enfermedad autosómica recesiva más frecuente producida por defectos en las enzimas que participan en la biosíntesis del cortisol. El cuadro clásico de HSC, que corresponde a la forma de mayor severidad, se manifiesta en los primeros años de vida y es causado por mutaciones que determinan un grave compromiso funcional de las enzimas esteroidogénicas. El cuadro no clásico de HSC (HSC-NC) se caracteriza por un hiperandrogenismo de origen adrenal que se manifiesta durante la niñez o en el período de la adolescencia y adultez (32, 33).
Aunque existen reportes de formas no clásicas por defectos de las otras enzimas, la mayoría de los casos se deben a alteraciones de la 21-hidroxilasa (CYP21A2), con una incidencia de 1 en 1000 in dividuos en población general. Se estima que en 1/60 individuos en población blanca es portador de una mutación del CYP21A2. Las alteraciones genéticas que causan las formas no clásicas afectan en menor grado la actividad de la enzima, no afectando en forma significativa la secreción de cortisol o mineralocorticoides. Esto determina que el aumento en la producción de andrógenos sea insuficiente para producir la virilización de los genitales in útero o durante los primeros años de vida y por ende se manifiesta en la infancia y adolescencia, cuando comienza la activación de la corteza suprarrenal.
Durante la niñez la principal manifestación de la HSC-NC es la pubarquia prematura, que es la aparición de vello púbico antes de los 8 años en las niñas. Un estudio reciente en 238 niños y niñas con pubarquia precoz demostró una incidencia de un 4% de HSC-NC (34). Otras manifestaciones clínicas durante la etapa escolar son una aceleración en la velocidad de crecimiento (talla alta con avance de la edad ósea), clitoromegalia y pubertad precoz periférica (35).
Durante la pubertad es más frecuente realizar el diagnóstico de HSC-NC, debido a la preocupación que produce el hiperandrogenismo en las adolescentes. El motivo de consulta principal es el hirsutismo, que está presente en la gran mayoría de las pacientes y que puede alcanzar gran severidad. Otros signos frecuentes son la amenorrea (3-16%), oligomenorrea (60%) y el acné (33%). La menarquia puede ser normal o tardía, sin embargo debemos tener presente que ciclos menstruales regulares no descartan esta patología (36).
Es importante medir los niveles de 17-hidroxiprogesterona (17 OHP) en fase folicular en adolescentes con alteraciones menstruales con o sin signos de hiperandrogenismo. En caso de tener una 17 OHP sugerente de HSC, se debe realizar un test de ACTH. Recordar que el diagnóstico definitivo se basa en la determinación del defecto genético, lo que además permitirá una adecuada consejería y el tratamiento de las complicaciones asociadas en el futuro de estas niñas y adolescentes.
Consideraciones finalesEs importante recordar que la llegada de la menarquia y la presencia de ciclos menstruales regulares son un marcador de salud de la adolescente e influyen positivamente en su calidad de vida (37)
Es por esto que el estudio debe ser guiado por la clínica, con el fin de lograr un diagnóstico adecuado sin exponer a la paciente a evaluaciones innecesarias, costosas y que no aportan mayor información (38, 39). Y de este modo, el tratamiento de cada uno de estos trastornos debe ser acorde al diagnóstico etiológico y realizado idealmente por un equipo multidisciplinario.
La autora declara no tener conflictos de interés, relacionados a este artículo.