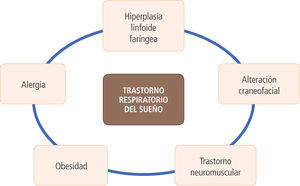
Los trastornos respiratorios del sueño (TRS), incluyendo la apnea obstructiva del sueño, afectan a un grupo importante de los pacientes pediátricos. Su más frecuente síntoma, el ronquido, debe ser buscado dirigidamente en los controles pediátricos e investigado cuando esté presente. La principal causa de los TRS en niños es la hipertrofia adenoamigdalina, pudiendo contribuir también la obesidad, cuadros alérgicos, trastornos neuromusculares y malformaciones craneofaciales. La apnea del sueño en población pediátrica se asocia a trastornos neurocognitivos, retraso del crecimiento, aumento de la resistencia vascular pulmonar, trastornos metabólicos y enuresis. La evaluación es inicialmente clínica, pudiendo ser complementada con una nasofibroscopía y, en casos dudosos, con estudios del sueño (saturometría ambulatoria de O2, polisomnograma). El tratamiento de elección es la adenoamigdalectomía, cirugía con una alta efectividad en resolver los TRS infantiles y con una baja tasa de complicaciones. En casos seleccionados puede ser necesario utilizar equipos de presión positiva (C-PAP).
Sleep-disordered breathing (SDB), including obstructive sleep apnea syndrome (OSAS), is a common problem in the pediatric population. Snoring is its most frequent symptom, and it should be looked for in routine pediatric consultations and studied when present. The main etiology of pediatric SDB is adenotonsillar hypertrophy; obesity, respiratory allergies, neuromuscular diseases and craniofacial malformations may be present as contibuting factors. Sleep apnea in childhood is responsible of neurocognitive dysfunction, failure to thrive, high vascular resistance in pulmonary circulation, metabolic disorders and enuresis. The initial evaluation is based on clinical history and physical examination, and the workup may include a flexible nasopharyngoscopy and, in uncertain cases, sleep studies (night oxygen saturation studies, polysomnogram). Adenotonsillectomy is the treatment of choice, as it is a safe and effective procedure for curing pediatric SDB. In selected cases, continuous positive airway pressure (C-PAP) devices may be necessary.
El ronquido corresponde a un ruido respiratorio que se produce durante el sueño por la vibración de las estructuras naso-faríngeas, causada por una resistencia al flujo aéreo en la vía aérea superior. En muchos casos, el ronquido puede ser el principal o único síntoma de la apnea obstructiva del sueño. Sin embargo, la mayoría de los expertos considera que el ronquido simple y la apnea obstructiva del sueño corresponden a una misma patología en diferentes etapas, dado que comparten una misma fisiopatología y que es posible encontrar muchos casos con formas intermedias de la patología, formando un verdadero continuo de diferentes grados de severidad (1). Es por esto que se suelen agrupar bajo el término de trastornos respiratorios del sueño (TRS). La clasificación internacional de trastornos del sueño (ICSD, por su sigla en inglés) incluye dentro de los trastornos respiratorios relacionados con el sueño a las apneas centrales, las apneas obstructivas y los síndromes de hipoventilación. Sin embargo, para simplificar la terminología, en este artículo nos referiremos a los trastornos respiratorios del sueño (TRS) como a aquellos que caben dentro de los síndromes de apnea obstructiva del sueño y que abarcan cuatro subgrupos: ronquido simple, síndrome de resistencia de la vía aérea superior, hipopnea obstructiva del sueño y apnea obstructiva del sueño (Tabla 1). Para fines prácticos, estos dos últimos grupos suelen agruparse bajo el término de síndrome de apnea e hipopnea obstructiva del sueño (SAHOS).
Clasificación de los distintos tipos de trastornos respiratorios del sueño (TRS)
| Flujo aéreo | Sueño fragmentado | Presión (-) intratoráxica | Saturación O2 | |
|---|---|---|---|---|
| Ronquido | Conservado | - | - | Sin descenso |
| SRVAS | Sin reducción significativa | + | + | Sin descenso |
| SHOS | Reducción del 30-50% > 10 seg. | ++ | ++ | Puede asociarse a desaturación 3-4% |
| SAOS | Cese > 10 seg. | +++ | +++ | Suele asociarse a desaturación > 4% |
SRVAS: Sindrome de Resistencia de la Vía Aérea Superior / SHOS: Sindrome de Hipopnea Obstructiva del Sueño / SAOS: Sindrome de Apnea Obstructiva del Sueño. Modificado de (1)
Se estima que la prevalencia de la roncopatía en niños es de 1,5-15,5%, mientras que la prevalencia del SAHOS sería de 1-4% (2-4). Se ha encontrado una tendencia de que los TRS son más frecuentes en niños que en niñas y en niños de mayor peso.
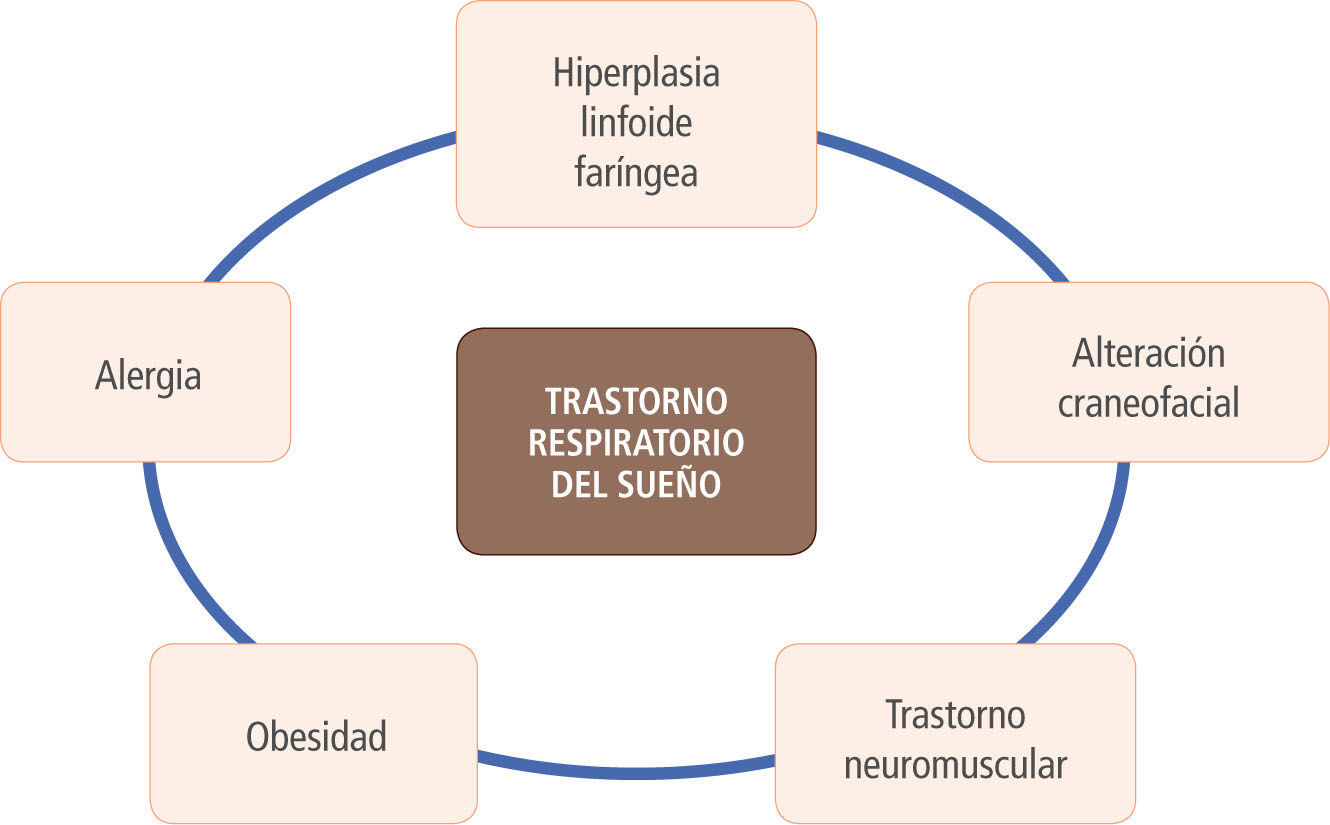
Etiopatogenia de los TRSHipertrofia adenoamigdalinaEs la causa más importante de TRS en pacientes pediátricos. El crecimiento de las amígdalas y los adenoides comienza alrededor de los 6 meses y se mantiene hasta la pubertad, con la máxima proliferación ocurriendo en la edad preescolar (2-5 años), lo que coincide con la edad de máxima incidencia de TRS en pediatría (5). Para explicar la hipertrofia adenoamigdalina que ocurre en algunos niños, se han postulado distintas causas: infecciosas, inflamatorias y genéticas, entre otras. Se ha descrito una alta prevalencia de Haemophilusinfluenzae al cultivar el centro de las amígdalas resecadas en pacientes con síntomas obstructivos (6). Otros microorganismos a los que se les ha atribuido un rol patogénico de la hipertrofia adenoamigdalina son el actinomyces (7), el Virus Epstein Barr (8, 9), Virus Papiloma Humano (10) y Virus Herpes 8 (11). Por otro lado, la expresión aumentada de una serie de mediadores inflamatorios en las amígdalas de pacientes operados por hipertrofia amigdalina obstructiva ha llevado a plantear que el aumento de la inflamación local y sistémica en niños con SAHOS favorecería el crecimiento amigdalino (12-14). Es probable que el traumatismo recurrente que produce el ronquido en la vía aérea alta gatilla una cascada inflamatoria que, a su vez, promueve la hiperplasia amigdalina, generando un verdadero círculo vicioso de obstrucción respiratoria alta.
Alteraciones craneofacialesLos pacientes con dismorfias craneofaciales suelen ver comprometida su vía aérea, exponiéndolos a un mayor riesgo de obstrucción durante el sueño: secuencia de Pierre Robin, la acondroplasia y los síndromes de Treacher Collins, Apert, Prader-Willi y Crouzon (5).
Trastornos neuromuscularesEn los pacientes hipotónicos, la musculatura faríngea tiene una mayor tendencia al colapso al ser sometida a una presión negativa. Condiciones como la parálisis cerebral, la trisomía 21, la malformación de Arnold Chiari, la distrofia muscular y el hipotiroidismo tienen mayor riesgo de presentar SAHOS por este mecanismo (5).
ObesidadLa obesidad no es un factor relevante en el TRS de niños pequeños. Sin embargo, en los adolescentes (en forma similar a los adultos), el sobrepeso y la obesidad constituyen un factor de riesgo independiente para desarrollar SAHOS, en especial si se asocia a otros factores como la presencia de ronquido y la hipertrofia amigdalina (15).
AlergiaLa alergia puede exacerbar una obstrucción de vía aérea alta al producir edema de la mucosa nasal y aumento de las secreciones. Sin embargo, es un factor coadyuvante y no constituye la causa principal de un SAHOS (16).
Asociación familiarSe ha demostrado una importante asociación familiar en los niños con SAHOS (17). Tener un hermano con SAHOS o con hipertrofia adenoamigdalina aumenta significativamente el riesgo de sufrir esa misma condición (18). Esta asociación entre hermanos podría explicarse por un factor genético heredable, por factores ambientales (alimentación, contaminación, alergia) y eventualmente por una mayor conciencia de los padres por el tema. Pueden existir una multitud de factores genéticos heredables que podrían explicar la asociación familiar del SAHOS: conformación craneofacial, tono muscular faríngeo, volumen lingual, alergia respiratoria, tendencia a la hipertrofia adenoamigdalina y a la obesidad.
Efectos del trs infantilTrastornos neurocognitivosLos TRS en niños se asocian a un sueño superficial, poco reparador y con reducción de la etapa REM. A diferencia de los adultos, en los niños hay una menor fragmentación del sueño y pocos despertares, siendo las hipopneas más frecuente que las apneas (5). La hipersomnolencia diurna es poco habitual, siendo más frecuentes la hiperactividad, agresividad, déficit atencional, mala memoria de corto plazo y pobre desempeño académico (19, 20).
Retraso en el crecimientoEl sueño superficial y fragmentado se asocia a una menor producción de hormonas del crecimiento (5). Otros mecanismos que explicarían la talla pequeña en niños con SAHOS incluyen un menor apetito, mayor consumo de energía por la obstrucción respiratoria y efectos centrales de la hipercarbia y la acidosis (21).
Efectos cardiovascularesLa exposición mantenida a hipoxia e hipercarbia resulta en un aumento de la resistencia vascular pulmonar, causando una hipertensión pulmonar y una sobrecarga ventricular derecha. Se ha demostrado la existencia de una correlación entre el tamaño amigdalino y el grado de alteración polisomnográfica con la intensidad de estos efectos cardiovasculares (22, 23). Los casos severos pueden progresar a un cor pulmonale (24).
Efectos metabólicosEl SAHOS en niños contribuye con varios de los componentes del síndrome metabólico, incluyendo trastornos en la homeostasis lipídica y resistencia a la insulina (25).
EnuresisSuele presentarse en niños con SAHOS (19), con una mayor prevalencia en el sexo masculino (26). Como posibles explicaciones se ha postulado una mayor producción de hormona natriurética atrial, una actividad disminuida del sistema renina-angiotensina-aldosterona, un aumento de la producción de catecolaminas (lo que alteraría el tono muscular de la vejiga) y mayores umbrales para despertar (5).
Sin embargo, estos efectos, que influyen en forma importante en la decisión terapéutica, no están presentes en todos los niños con TRS en la misma magnitud (27). Por ejemplo, sólo 30-40% de los niños con TRS demostrado por PSG tienen hiperactividad “patológica”. Un porcentaje desconocido, pero muy pequeño, puede estar afectado por un retraso del crecimiento. Por otro lado, los problemas conductuales, bajo rendimiento escolar, disminución de la calidad de vida, enuresis y retraso del crecimiento pueden tener diversas causas, incluyendo (pero no limitándose a) los TRS.
Evaluación clinica del niño con TRSHistoria clínicaEs fundamental obtener una completa anamnesis del sueño, estableciendo las horas de sueño, la presencia de ronquido, su tipo e intensidad y su asociación a pausas respiratorias. Es importante también indagar respecto de posibles síntomas diurnos secundarios a la mala calidad del sueño: cefalea y/o fatiga matinal, trastornos de conducta (déficit atencional, hiperactividad, irritabilidad), bajo rendimiento escolar e hipersomnolencia.
Examen físicoDebe consignarse el peso, talla y presión arterial del paciente. Es importante determinar el patrón de respiración habitual: oral o nasal. Se debe documentar la presencia de anomalías craneofaciales o neuromusculares, así como la existencia de malformaciones de la pared toráxica o de la columna dorsal que pudieran agravar cualquier problema respiratorio.
En el examen físico otorrinolaringológico es fundamental realizar una buena rinoscopia anterior y un acucioso examen de la cavidad oral y orofaringe. A nivel nasal se debe describir si hay una desviación del tabique, hipertrofia de cornetes inferiores, edema o palidez de la mucosa y presencia de rinorrea. Al examen oral, es importante consignar si hay maloclusión dental, forma y tamaño de la lengua y su relación con la vía aérea faríngea, forma del paladar duro y blando, tamaño de la úvula, función velofaríngea, grado de hipertrofia amigdalina y la distancia entre sus superficies mediales, así como la relación entre el paladar blando y la pared posterior de la faringe.
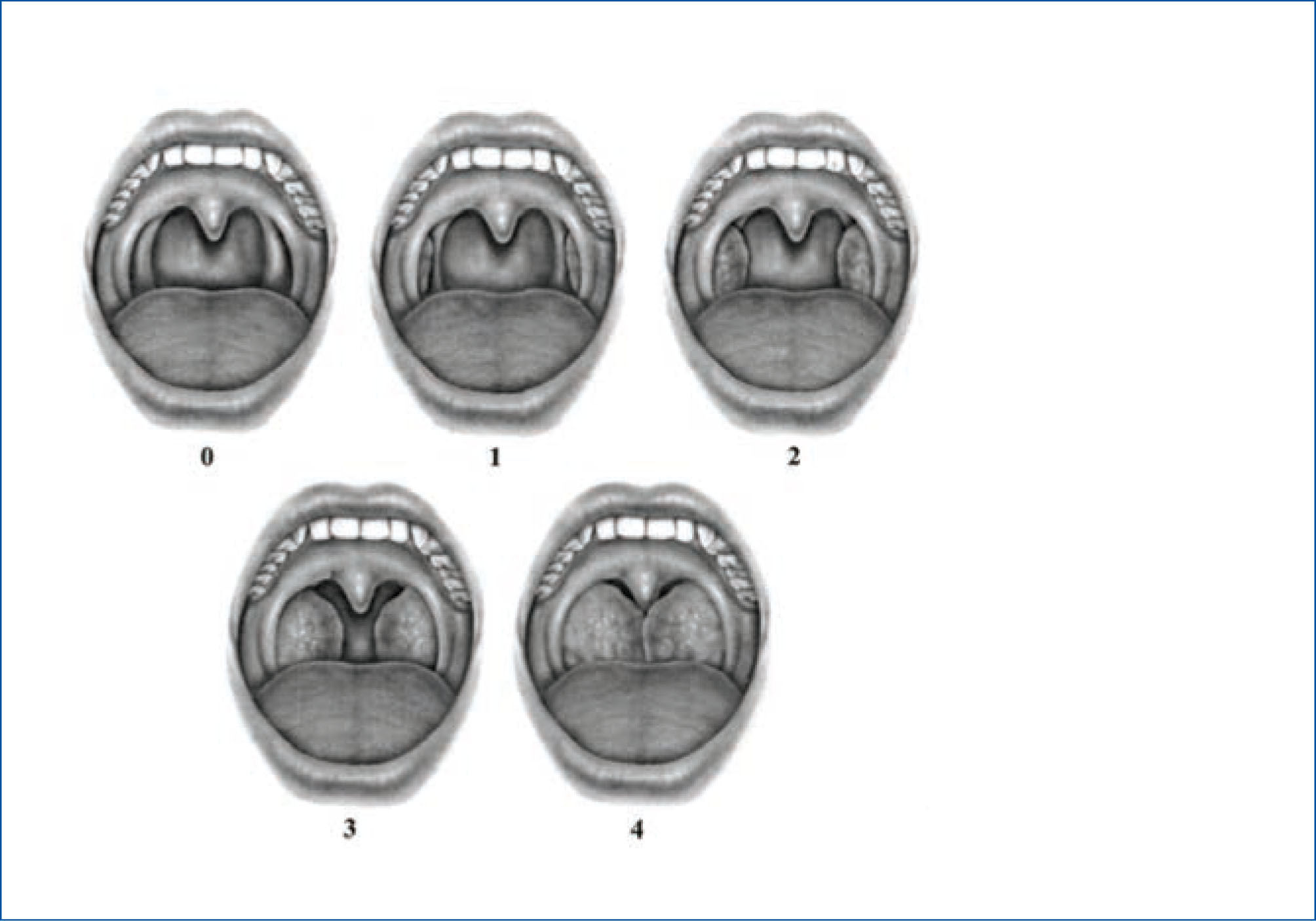
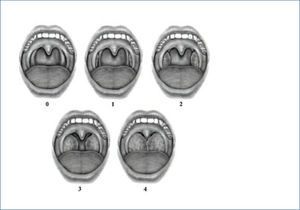
El tamaño amigdalino se puede evaluar en forma precisa con una adecuada fuente de luz y un bajalenguas. La escala más utilizada para registrar el tamaño de las amígdalas es la escala de Brodsky, que ha demostrado tener una buena reproducibilidad intra- e interobservador (28) (Figura 2).
escala de brodsky para evaluación de tamaño amigdalino
Las amígdalas son clasificadas como grado 0 (amígdalas dentro de la fosa amigdalina), grado 1 (amígdalas se asoman de fosa amigdalina y ocupan menos del 25% del ancho de la orofaringe), grado 2 (amígdalas ocupan entre el 26%-50% del ancho orofarín-geo), grado 3 (amígdalas ocupan entre el 51%-75% del ancho orofaríngeo) o grado 4 (amígdalas ocupan más del 75% del ancho orofaríngeo).
La radiografía de cavum rinofaríngeo permite evaluar, aunque en forma bastante inexacta, la vía aérea faríngea. Se interpreta que hay una hipertrofia adenoídea cuando la columna de aire rinofaríngea está estrecha a causa de un aumento de las partes blandas de la pared póstero-superior de la rinofaringe. Otros exámenes de indicación más limitada en niños con TRS son la cefalometría y la tomografía computada (TC) de macizo facial.
Evaluación instrumentalLa nasofaringolaringoscopía (NFC) flexible está indicada en todo paciente en el cual el examen otorrinolaringológico no detecte una alteración anatómica que explique la obstrucción respiratoria que se sospecha por la anamnesis. Es un examen rápido, que no requiere sedación ni monitorización, que permite evaluar en detalle la anatomía nasal, faríngea y laríngea. En particular, la nasofibroscopía permite explorar la rinofaringe y demostrar una hipertrofia adenoídea, así como evaluar el nivel de obstrucción orofaríngea en reposo (con la boca cerrada) secundaria a la hipertrofia amigdalina.
Laboratorio del sueñoPor largo tiempo se ha debatido si la evaluación clínica es suficiente para diagnosticar un TRS infantil. Existe una pobre correlación entre la intensidad del ronquido y el grado de apnea obstructiva (2). El realizar estudios diagnósticos en el laboratorio del sueño permite identificar pacientes expuestos a presentar efectos adversos (neurocognitivos, cardiovasculares, problemas de crecimiento) secundarios a su TRS y evitaría el proceder con intervenciones innecesarias (cirugía o C-PAP) en pacientes que no están en riesgo.
PolisomnogramaEl polisomnograma (PSG) sigue siendo el patrón de oro (gold standard) en el diagnóstico del SAHOS en niños y adultos. Un PSG formal se puede realizar en niños de cualquier edad, asumiendo que en el laboratorio del sueño tengan un equipamiento adecuado y personal entrenado. Sin embargo, entre sus limitaciones están la escasez de laboratorios del sueño con experiencia en niños y la falta de consenso sobre la forma de interpretar un PSG pediátrico. Hay acuerdo en que un PSG está alterado en un niño si tiene un Índice a Apnea e Hipopnea (IAH) mayor a 1 o una desaturación de O2 por debajo de 92%, o ambos. Un IAH sobre 5 se asociaría a un riesgo aumentado de hipertensión arterial (4).
Saturometría nocturnaLa saturometría nocturna es un buen examen de tamizaje (screening), ya que es sencillo, económico y se realiza en forma ambulatoria. Tiene un valor predictivo positivo de 97%, por lo que es diagnóstico de SAHOS cuando está alterada. Sin embargo, si resulta negativo no se puede descartar un SAHOS y deberá realizarse un PSG (29).
Tratamiento1Tratamiento médicoEn general, el tratamiento médico en el TRS infantil es de escasa efectividad. En pacientes obesos, deben utilizarse estrategias de reducción de peso. El manejo de la alergia y la obstrucción nasal pueden ayudar a los pacientes con rinitis, pero ésta no suele ser la principal causa de los TRS. Corticoides tópicos y sistémicos: Pueden reducir el tamaño linfoide adenotonsilar, pero su eficacia a largo plazo se desconoce. Los corticoides tópicos han demostrado una reducción in vitro de la proliferación celular, junto a una reducción de la producción de mediadores inflamatorios (TNF, IL-6, IL-8) en tejido amigdalino y un aumento de la apoptosis (30). La budesonida nasal, utilizada por 6 semanas, logró una normalización del PSG en poco más del 50% de niños con SAHOS leve (31).
Antagonistas del receptor de leucotrienosLos leucotrienos (en particular el LTD4) producen una proliferación celular dosis-dependiente en cultivos celulares de amígdalas de pacientes con SAHOS. A la inversa, el montelukast produce una reducción de la proliferación celular, así como una disminución de la producción de mediadores inflamatorios en el tejido amigdalino (32). En pacientes con TRS persistente postadenoamigdalectomía, el tratamiento combinado de montelukast y budesonida intranasal produjo una significativa mejoría de los parámetros del PSG en comparación con el grupo control (33).
Otras terapias farmacológicasAlgunos casos de hipertrofia amigdalina pueden mejorar con uso de antibióticos por tiempos prolongados, aunque la evidencia que apoya esta terapia es débil. Existen en el mercado terapias naturales que modularían el crecimiento del tejido linfático, como soluciones yodadas (Paralymphine®) y medicamentos homotoxicológicos (Lymphomyosot®). Sin embargo, no existen estudios clínicos controlados que demuestren su efectividad en la hipertrofia adenoamigdalina.
Equipos de presión positiva continua en vía aérea (C-PAP por su sigla en inglés)En niños, el C-PAP tiene una indicación limitada en el SAHOS. En pacientes con contraindicación quirúrgica, tejido adenoamigdalino mínimo, SAHOS persistente después de la adenoamigdalectomía o rechazo a la cirugía, el C-PAP es una alternativa terapéutica. La presión positiva continua en vía aérea se logra a través de un dispositivo electrónico que entrega una presión constante de aire a través de una mascarilla nasal, llevando a una expansión mecánica de la vía aérea y mejorando la capacidad funcional residual pulmonar. Debe usarse a permanencia y requerirá frecuente supervisión y recalibración. Su efectividad es alta en reducir el IAH y mejorar la saturación nocturna de oxígeno. Sin embargo, en niños es muy difícil lograr una adherencia adecuada al tratamiento: se ha estudiado que casi un tercio de los pacientes deja de utilizar el equipo antes de los 6 meses de tratamiento, a pesar de los contactos telefónicos y la consejería. El abandono del tratamiento sería aún mayor en niños pequeños y en niños con trastornos conductuales (p.ej. hiperactividad) (34).
2Tratamiento quirúrgicoEl tratamiento es quirúrgico en la mayoría de los casos, consistente en la resección de amígdalas y adenoides (adenoamigdalectomía). La cirugía tiene una alta efectividad en resolver los trastornos respiratorios del sueño en niños, normalizando el IAH y eliminando las desaturaciones de oxígeno (35). Múltiples estudios han demostrado el beneficioso efecto de la adenoamigdalectomía en niños sobre su calidad del sueño y comportamiento (36), calidad de vida global y específica (35, 57), rendimiento escolar (20), desarrollo pondo-estatural (38), resistencia vascular pulmonar medida por ecocardiografía (22, 23), insulinemia y metabolismo lipídico (25) y enuresis (26). En la mayoría de los casos estos cambios son persistentes en el tiempo (39, 40). En ocasiones se puede realizar adenoidectomía sola (niños pequeños) o amigdalectomía sola (niños más grandes), pero hacer una sola de ambas operaciones tendría un riesgo mayor de recurrencia, por una probable hiperplasia compensatoria del tejido linfático residual.
A pesar de toda la evidencia que sostiene que la adenoamigdalectomía mejora el SAHOS y sus comorbilidades, en muchos casos el PSG no se normaliza y pueden quedar síntomas residuales de TRS. Factores de riesgo de SAHOS recurrente o persistente son un SAHOS severo preoperatorio, obesidad, malformaciones craneofaciales, trastornos neuromusculares e historia familiar de SAHOS. Lamentablemente, en menos de un 10% de los niños se realiza un PSG pre-operatorio y menos aún cuentan con un control post-operatorio, básicamente por problemas de disponibilidad y costo (27).
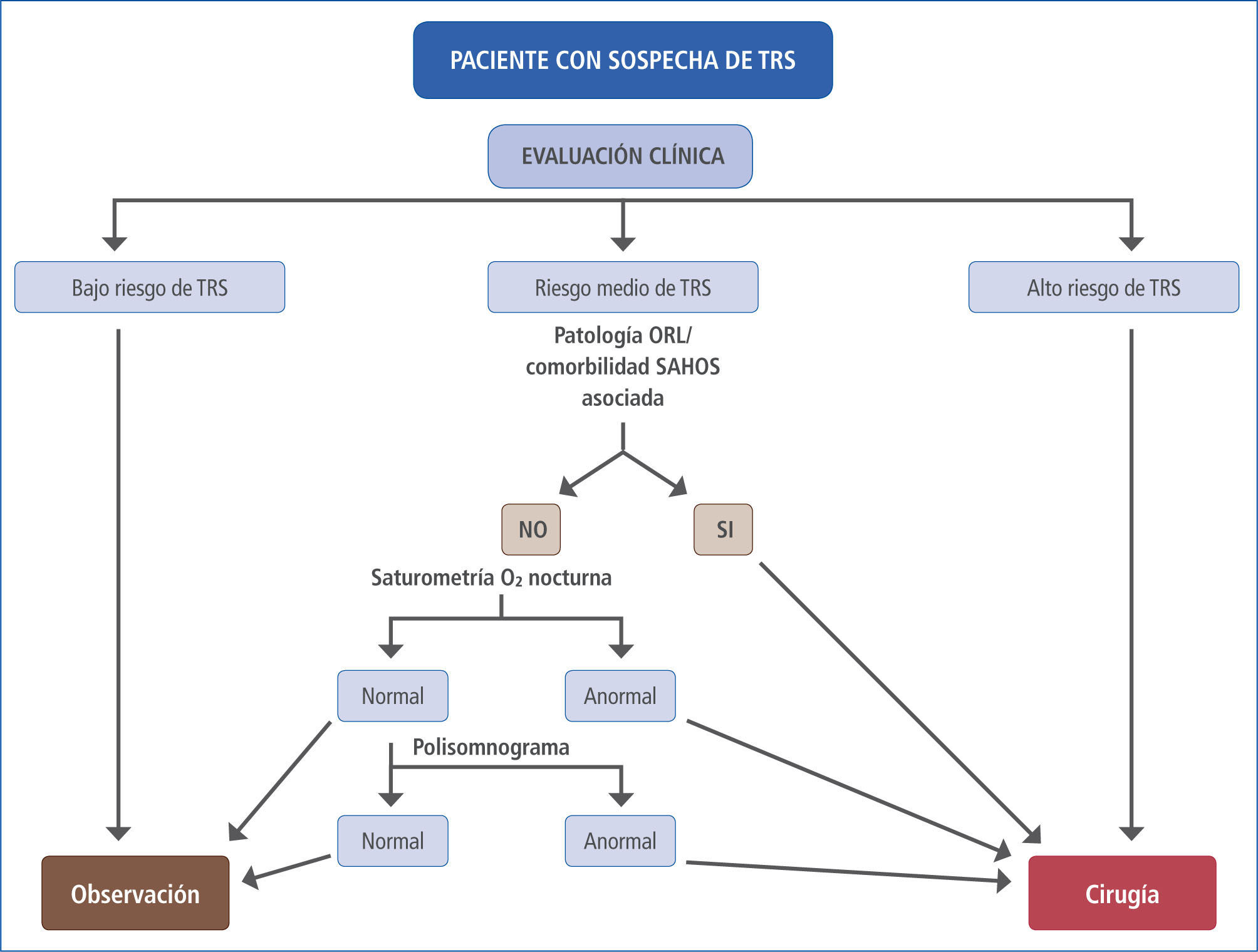
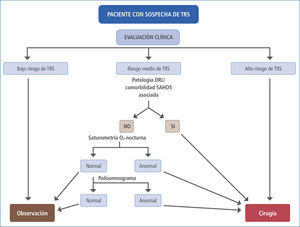
La Academia Americana de Pediatría, en su sección de Neumología Pediátrica, recomienda que en todo niño se evalúe la presencia de ronquido, como parte de los controles rutinarios de salud. Como se mencionó, la historia y el examen físico tienen limitaciones para discriminar entre un ronquido “simple” y un SAHOS, siendo el PSG el único método que objetiva y cuantifica las alteraciones ventilatorias y del sueño (2). Sin embargo, es impracticable que todo niño con sospecha de TRS sea estudiado con un PSG, tanto por los costos involucrados como por la escasez de laboratorios del sueño con suficiente experiencia en estudios pediátricos. La conducta que siguen en la práctica la mayoría de los pediatras y otorrinolaringólogos se basa en la clínica. Cuando hay una clara correlación entre una anamnesis que apoya un TRS junto a un examen físico (con eventual apoyo nasofibroscópico) que demuestra una significativa hipertrofia amigdalina, el paciente es un buen candidato a cirugía y los resultados son, en la mayoría de los casos, excelentes. Si tomamos en consideración la demostrada efectividad de la adenoamigdalectomía para resolver el SAHOS y sus comorbilidades, además de su baja tasa de complicaciones, parece innecesario hacer pasar a todos estos pacientes por un PSG para confirmar la conducta a seguir (27). Por el contrario, cuando la historia clínica no es categórica y el niño no tiene una obstrucción faríngea relevante al examen, la conducta que corresponde es la observación. La situación más compleja es cuando la anamnesis y el examen físico son contradictorios, o bien generan una sospecha “moderada” de un TRS. En este caso, es razonable tomar en cuenta si existe alguna patología de vía aérea superior asociada que también pudiera beneficiarse de un tratamiento quirúrgico: asimetría amigdalina, amigdalitis recurrente, sinusitis crónica y/o recurrente, otitis media aguda recurrente, otitis media con efusión, respiración bucal y rinolalia, por nombrar algunas. También debieran tenerse en consideración si existen comorbilidades que se asocian al TRS y que suelen mejorar con la adenoamigdalectomía: problemas conductuales, pobre calidad de vida, enuresis, retraso de crecimiento (27). Sin embargo, si aún no hay claridad respecto de la indicación quirúrgica, deberán realizarse los estudios de laboratorio pertinentes, comenzando con un examen de tamizaje como la saturometría ambulatoria de O2 y llegando, en casos seleccionados, a realizar un PSG (Figura 3).
Los pacientes deben ser reevaluados en el post-operatorio para determinar si se requiere de algún tratamiento adicional. Todos los pacientes son reevaluados clínicamente y los pacientes de alto riesgo, o con síntomas residuales, debieran ser reevaluados objetivamente con un nuevo PSG (2).
Consideraciones adicionales sobre el tratamiento guirúrgicoLa edad óptima para realizar una adenoamigdalectomía es probablemente entre los 3 y 7 años, pero una edad mayor o menor (incluso menor de 1 año) no es contraindicación quirúrgica, si la cirugía está indicada por obstrucción respiratoria o apnea del sueño. En niños menores, la realimentación post-operatoria puede ser más lenta y difícil, mientras que en niños mayores hay un ligero aumento del riesgo de hemorragia post-operatoria (la que puede ser más tardía) y del dolor post-operatorio.
Una adenoidectomía minuciosa en un niño pequeño con TRS permitiría evitar el llamado “recrecimiento” adenoídeo, que pareciera más asociado a una resección inicial incompleta. La inspección intraoperatoria de la rinofaringe puede realizarse mediante un espejo angulado o, más recientemente, a través de una endoscopía nasal rígida, lo que permite resecar los restos adenoídeos que suelen quedar en la zona superior de la nasofaringe, en la región tubaria y en las coanas.
En los últimos años ha ganado popularidad la amigdalectomía parcial, amigdalectomía intracapsular o amigdalotomía. Esta técnica, en que se reseca la mayor cantidad del tejido amigdalino posible dejando la cápsula adherida al músculo constrictor superior de la faringe, es planteable en niños con hipertrofia amigdalina sintomática que no tienen historia de amigdalitis recurrentes. Su principal ventaja es una reducción del dolor post-operatorio y un menor riesgo de complicaciones. La desventaja es el riesgo de dejar patología residual y eventualmente tener que someter al paciente a una reoperación, en caso que los remanentes amigdalinos se hipertrofien nuevamente. También se han introducido nuevos equipos al arsenal de instrumentos disponibles para la adenoamigdalectomía: electrobisturí, microdebridador y radiofrecuencia. Sus resultados y complicaciones no parecen diferir de aquellos obtenidos con la adenoamigdalectomía tradicional con instrumental “frío”.
La uvulopalatofaringoplastía (UPPP) tiene una indicación excepcional en pediatría, pudiendo ser de utilidad en niños mayores con hipotonía, p.ej. paciente con sindrome de Down. En casos seleccionados puede ser necesaria una cirugía craneofacial o, incluso, una traqueostomía.
Sobre las complicaciones, se debe destacar la hemorragia post-operatoria, que puede ocurrir entre las primeras horas y hasta 10 días después de la adenoamigdalectomía. Su incidencia se ha estimado entre el 0,1-3% de los casos y debe ser manejada en forma urgente. Otras complicaciones son la insuficiencia velofaríngea y la estenosis nasofaríngea. La mortalidad de la amigdalectomía sería de 1 en 35.000 procedimientos (27).
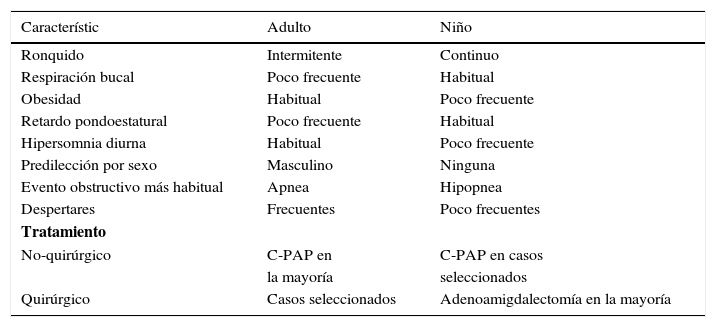
En la tabla 2 se destacan las principales diferencias entre el TRS infantil y de la población adulta. Como se ve, aunque son cuadros relacionados, tienen una serie de diferencias en cuanto a su presentación clínica, fisiopatología y tratamiento.
Diferencias entre sahos adulta y pediátrica
| Característic | Adulto | Niño |
|---|---|---|
| Ronquido | Intermitente | Continuo |
| Respiración bucal | Poco frecuente | Habitual |
| Obesidad | Habitual | Poco frecuente |
| Retardo pondoestatural | Poco frecuente | Habitual |
| Hipersomnia diurna | Habitual | Poco frecuente |
| Predilección por sexo | Masculino | Ninguna |
| Evento obstructivo más habitual | Apnea | Hipopnea |
| Despertares | Frecuentes | Poco frecuentes |
| Tratamiento | ||
| No-quirúrgico | C-PAP en | C-PAP en casos |
| la mayoría | seleccionados | |
| Quirúrgico | Casos seleccionados | Adenoamigdalectomía en la mayoría |
El autor declara no tener conflictos de interés, con relación a este artículo.