El objetivo del presente trabajo es ofrecer una revisión actualizada de la tuberculosis pulmonar; abarcando los aspectos epidemiológicos, la patogenia, cuadros clínicos, diagnóstico y su terapia actual.
Se aborda la tuberculosis activa en sus diferentes formas clínicas. Asimismo se analiza el concepto de tuberculosis latente y subclínica. Se hace una puesta al día de los métodos diagnósticos y terapia de la tuberculosis activa sensible y resistente a antibióticos.
The objective of this work is to offer an updated review of pulmonary tuberculosis; covering epidemiological aspects, pathogenesis, clinical presentation, diagnosis and current therapy.
Active tuberculosis is addressed in its different clinical forms. Likewise, the concept of latent and subclinical tuberculosis is analyzed. An update of diagnostic methods and therapy of active tuberculosis, both sensitive and resistant to antibiotics, is made.
La tuberculosis (TBC) sigue siendo, aun en el año 2024, un enorme problema de salud pública. Ha persistido a pesar de tener una vacuna hace más de 100 años y una terapia efectiva por casi 75 años. Así, según la Organización Mundial de la Salud (OMS), en el año 2022, 1,3 millones de personas murieron de TBC siendo 167 000 de ellos portadores del virus de la inmunodeficiencia humana (VIH). Enfermaron 10,6 millones de personas, de ellos: 5,8 millones eran hombres, 3,5 millones mujeres y 1,3 millones correspondieron a niños1. Fue la segunda enfermedad infecciosa que más muertes ocasionó después del COVID-19 y probablemente volverá a ser la enfermedad infecciosa que más muertes seguirá ocasionando luego de dicha pandemia.
La multirresistencia (MDR, del inglés multidrug-resistance), esto es la resistencia a rifampicina (RF) e isoniacida (HIN), es un problema primordial de cara a la erradicación de la TBC. Según el Global Tuberculosis Report 2023 de la Organización Mundial de la Salud (OMS), a nivel mundial 410 000 pacientes presentaban MDR y sólo 2 de cada 5 tuvieron acceso a un tratamiento adecuado1.
En Chile, en 2022 la tasa de incidencia de TBC fue de 14,4 por 100 000 habitantes. En hombres la tasa fue de 18,4 y 10,6 en mujeres. Los pacientes extranjeros constituyeron el 26,6% de las TBC diagnosticadas, presentando 49 casos de MDR2.
El objetivo de este trabajo es dar una visión actual de la tuberculosis pulmonar en todas sus formas.
PatogeniaEl único reservorio del bacilo de Koch, causante de la TBC, es el hombre. Un individuo sano al entrar en contacto con un paciente tuberculoso puede ser infectado. La capacidad infectante de un paciente depende de su capacidad de generar aerosoles o expectorar Mycobacterium tuberculosis. Se pueden generar aerosoles al respirar o conversar, sin necesidad de toser. Para adquirir la infección se requiere de un contacto prolongado (se considera contacto aquel que duerme bajo el mismo techo o para los extra domiciliarios aquel que tiene al menos contacto unas 15 horas en una semana). Ello significa probablemente que la exposición debe ser repetida. Hay, sin embargo, individuos que a pesar de un contacto estrecho con pacientes bacilíferos nunca muestran evidencias de infección. La razón de ello es desconocida, pero puede ser que su inmunidad natural o adquirida los elimine sin dejar huella.
Los bacilos inhalados llegan al alvéolo donde el surfactante los puede desprender de su pared lipofílica y son captados por los macrófagos alveolares (MA). El bacilo dentro del MA libera el antígeno temprano ESAT6 (early secreted antigenic target de 6 kDa) que impide la unión fago-lisosoma y el bacilo empieza a multiplicarse. Habitualmente después de unos 5-6 ciclos se produce la necrosis del MA y salen los bacilos al exterior, siendo fagocitados de nuevo por otros MA. Así se van liberando toxinas que atraen polinucleares y linfocitos. Con la inflamación local pueden diseminarse bacilos por la sangre o viajar hacia los ganglios linfáticos. Los MA aparte de mantener estos bacilos adormecidos en su interior, también fagocitan restos de los tejidos necrosados hasta un punto en que no pueden metabolizar la enorme carga de ácidos grasos (y sobre todo de colesterol) que supone, fabricando cuerpos lipídicos que se van acumulando dentro del citoplasma, transformándose en macrófagos espumosos. En gran número estos macrófagos pueden bloquear los bronquiolos y generar así una neumonía lipoidea que constituye la primera lesión pulmonar. Eso explica también por qué el signo de “árbol en brote” en la TBC es una buena señal de actividad.
Habitualmente las lesiones se ubican en los lóbulos superiores. Inicialmente se pensó que era por la presencia de mayor cantidad de oxígeno pero ahora se sabe que es debido a un drenaje más deficiente en esa ubicación. En los lóbulos superiores hay poca ventilación, poca circulación y menor flujo linfático en relación a los lóbulos inferiores3.
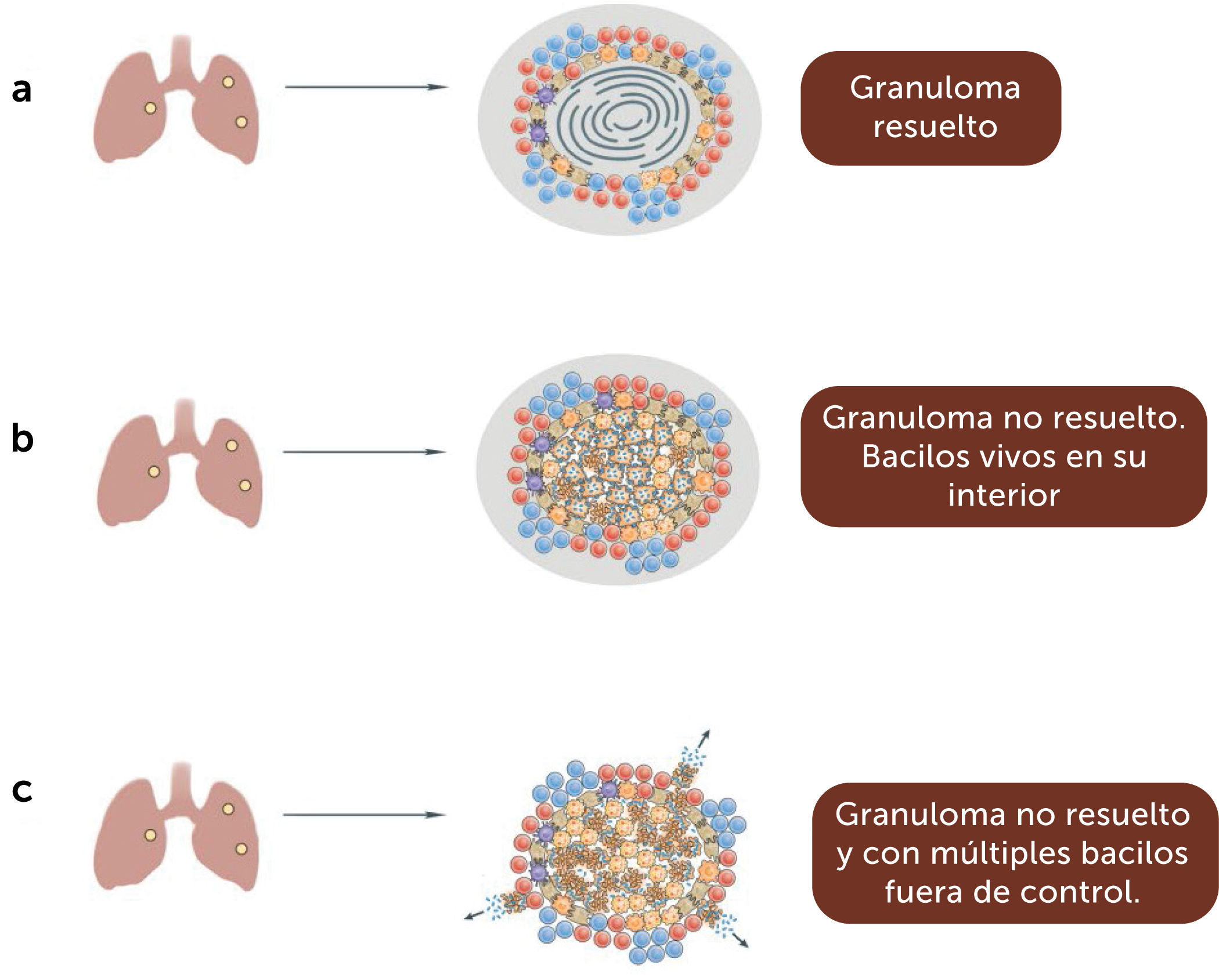
El granuloma característico de la TBC aparece posteriormente y puede ayudar a contener la infección, aunque en etapas iniciales parece ayudar a su diseminación.
El granuloma habitualmente está constituido por macrófagos en diferentes grados de activación, con centro necrótico y una corona de linfocitos, mayoritariamente CD4 y CD8. Sin embargo, los granulomas son heterogéneo. Hay granulomas necróticos, no necróticos, completamente fibróticos, calcificados y cavitarios. Cada granuloma es un microcosmos diferente. Hay una relación compleja entre la inflamación tisular, la respuesta inmune y la actividad del bacilo4. Figura 1.
Aunque antes se pensaba que las lesiones cavitarias de los lóbulos superiores era característica de la TBC de re-activación, hoy sabemos que eso no es así. En estudios realizados en clusters de pacientes (pacientes que comparten el mismo bacilo confirmado por fingerprinting) se puede ver que esas lesiones cavitarias de lóbulos superiores se producen igualmente en la primo infección. El compromiso ganglionar parece relacionarse más a la inmunidad ya que es una característica muy frecuente en pacientes portadores de VIH y en niños5.
TBC Latente (TBCL)Clemens Von Pirquet, pediatra austriaco, en 1905 fue el primero en describir el fenómeno en niños que tenían una respuesta inmunológica a antígenos del bacilo de Koch, sin tener ninguna evidencia de enfermedad. Posteriormente, en 1908, Charles Mantoux describió los criterios de la prueba tuberculínica o PPD (Derivado Proteico Purificado de antígenos compartidos por varias micobacterias) que utilizamos hasta hoy. Esta prueba consiste en inyectar en forma subcutánea en la cara anterior del antebrazo 0,1ml de proteína purificada con jeringa de tuberculina. Luego, a las 48-72 horas se mide el diámetro horizontal. Un PPD (+) para pacientes no HIV es una reacción cutánea igual o superior a 10mm y en pacientes HIV (+) igual o superior a 5mm.
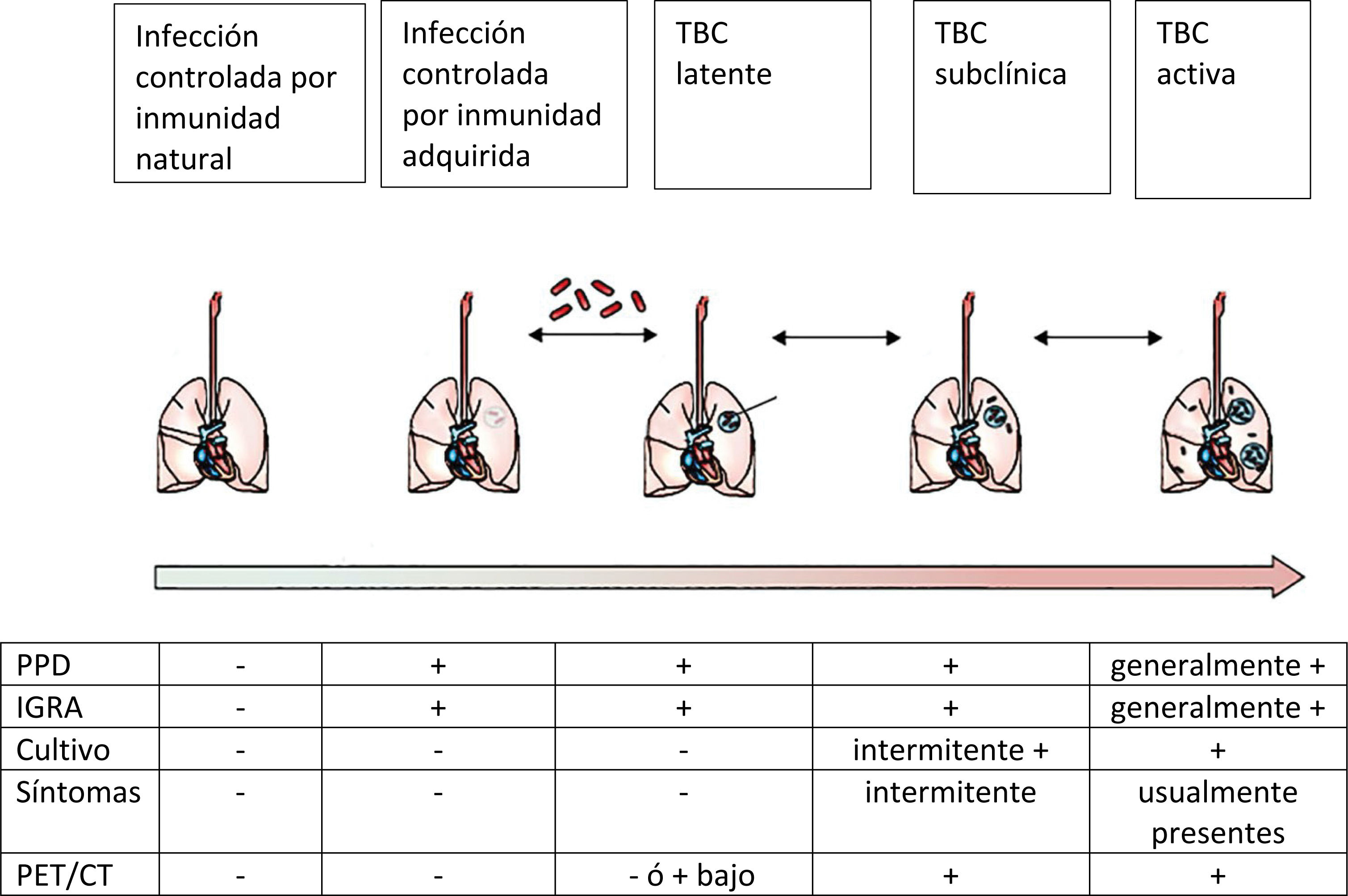
La TBC latente o infección tuberculosa es una respuesta inmune a antígenos del bacilo, sin ninguna evidencia de enfermedad. Habitualmente se considera que la infección por el Mycobacterium tuberculosis resulta en dos estados clínicamente bien definidos: TBC activa y TBC latente. Pero, así como la TBC activa tiene diferentes manifestaciones y diferente gravedad, la TBC latente tiene también diferentes estados.
¿Cómo sabemos que la persona que tiene una respuesta inmune tiene bacilos en el organismo si no lo podemos demostrar?La primera evidencia fue constatar que los pacientes PPD (+) enfermaban más frecuentemente que los que no tenían la respuesta inmunológica. Posteriormente, la isoniacida, fármaco que sólo destruye bacilos en multiplicación activa, fue capaz de disminuir la aparición de enfermedad. En individuos PPD (+), fallecidas por otras causas, últimamente se han podido recuperar bacilos en diferentes órganos y también de células madres hematopoyéticas de personas vivas con respuesta inmunológica positiva6.
Sabemos que aproximadamente entre el 10 y el 15% de los pacientes infectados desarrollarán la enfermedad, y el mayor riesgo está en los primeros 18 meses7
Entre aquellos pacientes que tienen PPD (+) o una prueba de liberación de interferón-gamma (IGRA, del inglés interferon-gamma release assay) positiva (para el ensayo QuantiFERON-TB-Gold Test® es ≥0,35 y en el ensayo ELISpot ≥8 células T efectoras), hay algunos que han eliminado completamente la infección y sólo queda la memoria inmunológica y otros que no lo logran y obviamente tienen mayor riesgo de reactivación.
Esmail et el. nos aporta evidencia en su estudio donde realizaron PET/CT a 35 pacientes con VIH (+) sin terapia antiretroviral y encontraron que 10 pacientes tenían focos positivos y que los restantes 25 pacientes tenían un PET absolutamente negativo. Entre los negativos, ninguno enfermó y 4 de los 10 pacientes con PET (+) enfermaron durante el tiempo de seguimiento8.
La expresión génica en la sangre de pacientes enfermos e infectados también es diferente. En un estudio encontraron que el 25% de los pacientes infectados sin enfermedad tenían la misma expresión génica que los enfermos9,10.
Hay también trabajos en macacos que muestran variaciones lesionales entre aquellos infectados y no enfermos. Algunos no tienen ninguna lesión, otros ganglios o lesiones parenquimatosas11.
Así, hoy se acepta que existe una TBC subclínica, que serían aquellos pacientes que no logran eliminar los bacilos y tendrían un mayor riesgo de enfermar.
Entonces, podríamos considerar que la relación de los seres humanos con la TBC es como la figura 2.
La diversidad de términos usado para describir los distintos estados de la TBC motivó la realización de un consenso reciente que separó infección de enfermedad, basado en el daño anatómico. Así, en la infección, el pulmón no registra daño visible, con ningún examen, pero sí en la enfermedad. Por su parte, en la enfermedad puede haber clínica o no y también puede haber bacteriología positiva o negativa12.
En la actualidad, se estima que entre un tercio a un cuarto de la humanidad tiene una TBC latente y resulta de vital importancia para conseguir la eliminación de la enfermedad, detectar aquellos infectados en riesgo de enfermar. En la TBCL el bacilo se adapta a las malas condiciones ambientales, con poco oxígeno, alterando su expresión génica y regulando las vías metabólicas hacia una respiración anaeróbica. Cuando la persona tiene algún daño de su sistema inmune, como en la infección por VIH, o en la desnutrición o la diabetes, se altera el equilibrio y la TBCL puede pasar a TBC activa. Así los pacientes infectados que adquieren el VIH tienen un riesgo hasta 30 veces mayor de enfermar y se estima en un 10% por año13.
Las pruebas que actualmente nos permiten confirmar la TBCL no nos permiten diferenciar entre aquellos que tienen una memoria inmunológica y los que en realidad tienen una TBCL. Tampoco diferencian entre aquellos con TBC activa y los con TBCL. También su capacidad para predecir aquellos que van a enfermar es bastante pobre. De los exámenes disponibles: el PPD, además de requerir dos visitas del paciente, tiene el inconveniente de ser afectado por la vacunación generando un resultado falso positivo. Asimismo, tiene reacción cruzada con micobacterias ambientales, se ve afectado por la inmunodepresión y su lectura requiere también de cierta preparación. Su mayor ventaja es que es bastante económico.
Aún no se ha identificado cuál de las proteínas del bacilo induce la respuesta inmunológica. Las proteínas chaperonas, que son casi el 60% de contenido proteómico del PPD, han sido las más estudiadas. La respuesta al PPD es muy variable en las diferentes personas y no hay certeza a que se debe. En estudios de pacientes nefrópatas por ejemplo, la suplementación de Vitamina D y los altos niveles de paratohormona se correlacionan con un test negativo.
IGRAsEstas pruebas sanguíneas que miden la liberación de interferón gama (IFN-γ) al estimularlos con el antígeno proteico 10 (CFP10) y el ESAT-6, antígenos no presentes en el bacilo de Calmette-Guerin utilizado en el BCG. El ELISpot mide el número de células que producen IFN-γ mientras que el QuantiFERON-TB-Gold Test® mide el IFN-γ en el plasma. En el QuantiFERON-TB-Gold Test®, se ha agregado la respuesta de los linfocitos CD8 lo que tendría una mejor correlación con el riesgo de enfermar.
Los resultados de estas pruebas pueden ser afectados por el deterioro de la inmunidad secundaria a enfermedades o drogas, como los esteroides. Curiosamente, la diabetes parece no incidir en su resultado. Presentan, asimismo, problemas técnicos que los impactan como la toma de muestra, la hora, el volumen de sangre, la agitación de la muestra y el tiempo para procesarla14. Aunque no hay un gold standard para el diagnóstico de infección el ELISpot parece ser ligeramente más sensible.
También se han utilizado otras pruebas cutáneas como Diaskintest® que utiliza ESAT6 y CFP10 para hacer el test. El C-TB y el y EC-test también utilizan los mismos antígenos.
Los perfiles de transcripción de células mononucleares de sangre periférica de pacientes infectados con TBC y con enfermedad activa han mostrado ser diferentes lo que ha permitido identificar a los genes de las proteínas CXCL10, ATP10A, TRL6, tanto como DOCK9, EPHA4 y NPC2 de sangre periférica incubada con PPD, difiere entre pacientes con TBC activa, latente e individuos sanos15,16. Así, se introdujo el RISK 6, un panel de cinco genes que era capaz de predecir la reactivación de la TBC17 (SERPING1, TRMT2A, GBP2, ADR39L11, FCGR1B, TUBGCP69) con alta probabilidad. Ninguno de estos test está aún disponible en la clínica.
Las enfermedades reumatológicas se asocian a un mayor riesgo de enfermar de TBC, esto ocurre especialmente cuando se usa un fármaco anti-TNF (factor de necrosis tumoral por sus siglas en inglés) o corticoides que aumentan el riesgo de reactivación. En un trabajo hacen PET/CT a 26 macacos18 con TBCL, previo a la administración anti-TNF y pueden determinar según el resultado del examen la reactivación con una sensibilidad de 92% y una especificidad de 92%. Y cuando hacen biopsias de los macacos infectados muestran los diferentes tipos de granulomas, y los con riesgo de enfermar tienen granulomas con más micobacterias.
En los últimos años varios biológicos se han utilizados para modificar el curso de la AR y otras enfermedades inmunológicas (bDMARs): infliximab, etanercept,abatacept, tocilizumab, secukinumab. También, otros sintéticos (sDMARs) como apremilast, y otros inhibidores de la Janus quinasa (JAK). El riesgo de enfermar que se asocia a estas drogas es diferente y pareciera que estas últimas tienen un menor riesgo de reactivación que los inhibidores de TNF. De hecho, parece que el rituximab, el apremilast, y los inhibidores de IL7 e IL23 son más seguros.
Sin embargo, es necesario señalar que no hay grandes estudios especialmente porque después que se supo que el infliximab se asociaba a una reactivación de la TBC la detección previa de infección antes de iniciar éstas terapia es la regla19,20.
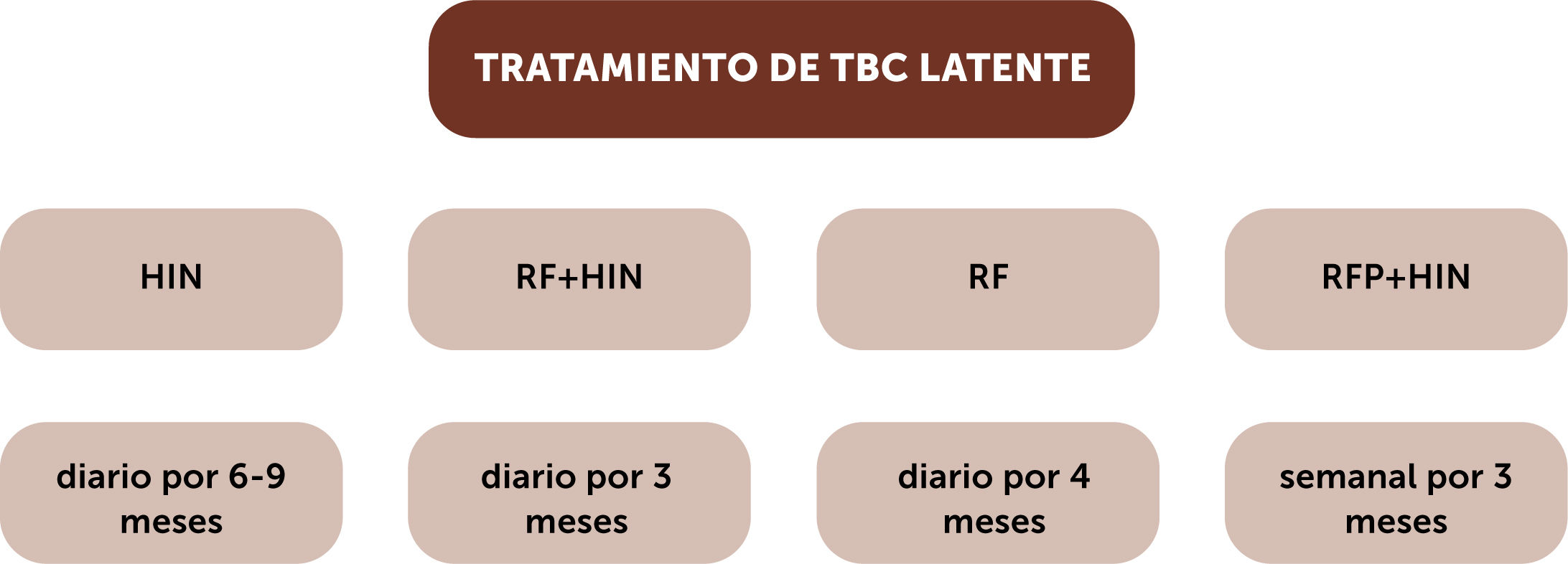
TratamientoEl tratamiento más antiguo y probablemente el más usado como profilaxis es la isoniacida (HIN) 300mg diarios por 6-12 meses. Aunque altamente eficaz, su mayor problema es la adherencia que en general no es muy buena. En los diferentes trabajos las adherencias andan alrededor del 60%. Quizá el mayor inconveniente sea la duración prolongada de la terapia a lo que se agrega su toxicidad hepática que se presenta entre 1-2%, especialmente en personas mayores, consumidores de alcohol y pacientes con daño hepático.
La isoniacida tiene interacción con algunos medicamentos como fenitoína, carbamazepina, warfarina e inhibidores de la MAO.
Menzies et al. en su estudio aleatorizado encontraron que la rifampicina (RF) diaria por tres a cuatro meses demostró ser equivalente a HIN, con mejor adherencia y menor hepatotoxicidad. Al comprar ambas drogas 78,8 vs 63,2 completaron tratamiento y la toxicidad hepática grado 3-4 fue de 0,3 vs 1,821.
La rifampicina es un potente inductor de CYP3A lo que puede afectar los niveles de los antivirales, inmunosupresores, anticonvulsivantes y la warfarina.
Un esquema de isoniacida y rifampicina diaria por 3-4 meses tiene resultados similares a la isoniacida 9-12 meses tanto en pacientes HIV (+) como HIV (-)22.
La rifapentina (RFP) es una rifamicina que tiene efecto más potente y más prolongado que la rifampicina y ha sido utilizada en asociación a la isoniacida.
El esquema es de administración semanal, supervisado (no se da para la casa) es de 900mg de RFP y 900mg de HIN por tres meses. Comparado a isoniacida por 9 meses, tiene mejor adherencia y menos toxicidad hepática (terminaron terapia 82,1% vs 69% y la hepatotoxicidad fue de 0,4% vs 2,7%)23.
Actualmente en Chile, se recomienda el uso de HIN-RFP semanal por doce dosis, bajo estricta supervisión.
El Programa Nacional de TBC de Chile señala que tienen indicación de profilaxis los contactos intra domiciliarios PPD (+) y los extra domiciliarios en menores de 15 años con evidencias de infección y sin evidencias de enfermedad, requiriendo mostrar una radiografía de tórax normal. Entre los extra domiciliarios también se deben considerar para profilaxis aquellos que tienen silicosis. Los pacientes VIH positivos, con evidencias de infección independiente del recuento linfocitario, deben recibir quimioprofilaxis.
En los pacientes que van a usar anti-TNF se recomienda usar la profilaxis con un mes de anticipación. En aquellos pacientes pre-trasplante se ha usado mayoritariamente isoniacida pero ya se está cambiando a HIN-RMP.
Por otra parte, para los contactos de pacientes MDR, el tratamiento profiláctico recomendado por la OMS está basado en quinolonas (levo o moxifloxacino).
Diagnóstico de TBC activaPor años la baciloscopia ha sido el examen diagnóstico más utilizado, por su bajo costo y técnica relativamente simple. Sin embargo, por su baja sensibilidad, en la actualidad ha sido desplazada por las técnicas de amplificación de los ácidos nucleicos (NAAT por sus siglas en inglés, Nucleic Acid Amplification Test)24.
El más utilizado es el Xpert®MTB/RIF, que detecta además la resistencia a RF. Se eligió la RF porque tiene sólo un gen que codifica la resistencia y porque además si es resistente a RF, el 90% es resistente a HIN. De tal modo, si se detecta resistencia a RF se debe manejar como MDR. Tiene una alta sensibilidad y especificidad y su resultado demora aproximadamente dos horas.
Últimamente se está utilizando en Chile el Xpert®MTB/RIF Ultra que tiene una mayor sensibilidad, pero baja un poco su especificidad. Este test se informa como positivo trazas, positivo nivel bajo, positivo nivel medio y o nivel alto.
Las trazas deben ser interpretadas con mucha cautela ya que pueden ser un falso positivo. El hallazgo de trazas en una muestra extrapulmonar como pleura, o meninges debe considerarse positiva e iniciar terapia. A nivel pulmonar es necesario evaluar, ya que pacientes que han tenido TBC, sin enfermedad actual, pueden resultar positivos.
Existen además del Xpert® otras técnicas de NAATs que recomienda la OMS como las sondas en línea (LPA, por sus siglas en inglés), el Truenat®MTB, y la amplificación isotérmica mediada por bucles (LAMP, por sus siglas en inglés)25.
LAMP (loop -mediated isotermal amplification) es una amplificación isotérmica de la PCR (∼65°C) que puede ser realizada en consultorios ya que no requiere gran equipamiento y ha sido recomendada por la OMS desde el 2016, pero está aún sub-utilizada. El resultado del test está en menos de dos horas.
Truenat® MTB es una PCR en tiempo real, que produce resultado en una hora y es una buena alternativa al Xpert®.
LPA (Line Probe Assays) es una prueba molecular para detectar resistencia a fármacos. Se pueden usar en cultivos o directamente de la baciloscopía. Son ensayos con sondas en línea, que utilizan tiras reactivas de nitrocelulosa que contienen regiones moleculares de los genes de resistencia en estudio. En el Instituto de Salud Pública de Chile se utiliza esta técnica para detectar la resistencia de las diferentes drogas de primera y segunda línea.
El lipoarabinomanano es un componente de la pared celular externa del bacilo que se desprende de las células metabólicamente activas o degradadas y se elimina por la orina. En pacientes HIV (+) ha resultado ser un buen método diagnóstico. Aunque se ha evaluado para ver respuesta a la terapia, los resultados no han sido alentadores.
En Chile, se utiliza el Xpert®MTB/RIF Ultra a lo largo del territorio nacional, reservando el uso de LPA al Instituto de Salud Pública de Chile dada su mayor complejidad.
Tratamiento TBC activaPor casi 50 años el tratamiento utilizado para la TBC en el mundo ha sido el “esquema acortado”. Los trabajos conducidos por el British Medical Research Council demostraron que una fase intensiva con HIN-RF y pirazinamida (PZ) seguida por una fase de continuación de 4 meses con HIN-RF podía curar la mayoría de los pacientes.
El esquema con PZ logró bajar la terapia de 9 a 6 meses26.
La tasa de resistencia al HIN, hizo que posteriormente se agregara etambutol (EMB) a la fase inicial. La fase de continuación inicialmente era bisemanal, después por las inasistencias frecuentes que debilitaban el esquema se pasó a trisemanal y actualmente por motivos operacionales se realiza diariamente.
Han existido varios intentos de acortar la terapia. La adición de quinolonas al esquema, no logró los márgenes predefinidos de no inferioridad27.
Últimamente, un esquema con RFP, HIN, PZ y moxifloxacino logró demostrar que con 4 meses de terapia se lograba un éxito aceptable.
También es aceptado que hay un grupo de pacientes, con TBC menos severa que pueden ser tratados con un esquema de 4 meses.
¿Qué ocurre con la resistencia? La resistencia a HIN habitualmente se trata sustituyéndola por una quinolona. Cuando la resistencia es por mutaciones en gen inhA se puede subir la dosis, en cambio cuando es por el gen katG esa no es una opción.
En Chile, el esquema de tratamiento actual es de una fase inicial con RF,HIN,PZ y EMB diario por dos meses (50 dosis) seguido por una fase de continuación diaria de HIN-RF por 4 meses (80 dosis). (Tabla 1).
TBC MultirresistenteLa multiresistencia, (MDR) esto es resistencia a HIN y RF, es un fenómeno que ha ido en aumento. Si antes la MDR era mayoritariamente adquirida por terapias inadecuadas, hoy se produce más por contagios desde pacientes MDR. Si bien las poblaciones de bacilos MDR son heterogéneas, dependiendo de la mutación, la contagiosidad de los bacilos es similar a la TBC sensible21. El pronóstico de la MDR especialmente en los pacientes HIV (+) es malo, así en un estudio en 7 países, la mortalidad fue 19% en HIV (+) versus 9,4% en HIV negativo28,29.
La vista tradicional para la generación de MDR es la aparición de mutantes resistentes y la selección por un esquema inadecuado. Sin embargo, hay otros mecanismos como la diferente penetración de las drogas a las cavidades, la distinta farmacocinética que puede encubrir una monoterapia. También se puede generar resistencia por un mecanismo genómico o un mecanismo epigenético.
El esquema para TBC MDR es con bedaquilina, linezolid, clofazima y levofloxacino. Es importante hacer un electrocardiograma previo, midiendo el QT, ya que las quinolonas, la clofazimina y bedaquilina lo prolongan. Una prolongación mayor de 500 milisegundos puede ser riesgosa. (Tabla 2).
Esquema de tratamiento de la tuberculosis multi drogo resistente en mayores de 15 años en Chile
| Fármacos | Fase inicial(6 meses) | FASE CONTINUACIÓN(3 meses) |
|---|---|---|
| Bedaquilina | 400mg al día por dos semanas, luego 200mg tres veces por semana durante 22 semanas (hasta completar fase inicial) | Suspendido |
| Linezolid | 600mg al día por 24 semanas | Suspendido |
| Clofazimina | 100mg al día por 24 semanas | 100mg al día por 12 semanas |
| Levofloxacino | 1 000mg al día por 24 semanas* | 1 000mg al día por 12 semanas* |
En los últimos años han habido progresos importantes en la identificación de la patogenia y en la terapia de la tuberculosis pulmonar activa. Se han visto también avances significativos en el estudio de los diferentes estados de la tuberculosis latente, impulsando la aparición de nuevos esquemas simplificados de terapia.
Conflicto de interésEl autor declara no tener conflictos de intereses.