Tradicionalmente, el embarazo es considerado un evento fisiológico. Sin embargo, cerca de un 20% de las embarazadas desarrolla patologías obstétricas que se asocian a mortalidad materna y perinatal. A nivel mundial, cada año medio millón de mujeres fallece durante el embarazo y parto debido a estas complicaciones. Desafortunadamente, un número significativo de las urgencias obstétricas ocurre en pacientes sin factores de riesgo, por lo que la prevención, identificación precoz e intervención a tiempo de estos eventos juegan un rol fundamental para contrarrestar un resultado perinatal adverso. En el presente capítulo hemos seleccionado las emergencias que concentran la mayor morbimortalidad de nuestra especialidad. Si bien algunas han quedado fuera, creemos que los temas aquí presentados representan las urgencias obstétricas más importantes que enfrentamos a diario, para las cuales debemos estar preparados con el fin de realizar un manejo óptimo del embarazo y parto para la obtención de un resultado perinatal favorable.
Traditionally, pregnancy is considered a physiologic condition. However, close to 20% of pregnant women develop obstetrical diseases that are associated to maternal and perinatal mortality. Worldwide, every year half a million of women die during pregnancy, labor and delivery due to these complications. Unfortunately, a significant number of obstetrical emergencies occur among patients without risk factors, so that prevention, early identification and timely intervention play a key role to overcome an adverse pregnancy outcome. In the present chapter, we have selected the emergencies that concentrate most of the morbidity and mortality of our field. Although some have not been included, we believe that the obstetrical emergencies presented herein represent the most important ones that we face daily, and for which we should be prepared in order to execute the best possible obstetrical care either during pregnancy or at the time of delivery to obtain a favourable perinatal outcome.
El término urgencias o emergencias se refiere a un hecho o accidente que requiere acción inmediata. Dado que en este capítulo nos vamos a referir a urgencias del ámbito obstétrico, es bueno recordar que la obstetricia en particular tiene la característica de que un porcentaje importante de los partos podría ocurrir en sitios sin ninguna infraestructura. Sin embargo, el 15% a 20% de los partos puede requerir de cuidados cuya ausencia se asocia a morbimortalidad materna y perinatal. La otra condición agravante es que si bien existen tablas de factores de riesgo que permiten reconocer en las madres embarazadas aquellas que requieren cuidados especiales, las urgencias se producen muchas veces en mujeres sin factores de riesgo.
Lo anterior explica que en el mundo aún fallezcan cada año alrededor de medio millón de mujeres por embarazo y parto, y que 15 de cada 100 mujeres que se embarazan cada año desarrollen complicaciones de riesgo vital. Es por eso que entre los objetivos del milenio establecidos el año 2000 por las Naciones Unidas y otras organizaciones internacionales, 4 de los 9 tienen que ver con la salud de la madre (Tabla 1).
Objetivos milenio (cumbre del milenio - año 2000)
| 1. Erradicar la pobreza extrema y el hambre. |
| 2. Lograr la educación primaria universal. |
| 3. Promover la igualdad entre los géneros y la autonomía de las mujeres. |
| 4. Reducir la Mortalidad Infantil |
| 5. Mejorar la Salud Materna |
| 6. Combatir el VIH / SIDA, y otras enfermedades (paludismo, malaria, TBC). |
| 7. Garantizar la sustentabilidad del medio ambiente. |
| 8. Crear una asociación mundial para el desarrollo. |
| 9. Lograr el acceso universal a la salud reproductiva en el año 2015, con la tasa de prevalencia de uso de contracepción como indicador (2007). |
Es importante recordar que Chile tiene hoy indicadores de salud materna y perinatal que le permiten compararse a los países más desarrollados del mundo, y que esto es especialmente meritorio tratándose de un país:
- 1)
cuyo producto interno bruto es 4 veces inferior al de los países más desarrollados;
- 2)
cuyo gasto en salud es muy inferior al de los países desarrollados o al de otros países de nivel similar al nuestro;
- 3)
cuyo uso de anticoncepción entre las mujeres en edad fértil es significativamente menor; y
- 4)
un país donde no está legalizado el aborto (lo que se relaciona ciertamente con reducción de la mortalidad perinatal dado que un tercio de esas muertes son atribuibles a malformaciones congénitas).
Buena parte de los progresos alcanzados se han relacionado con la existencia de fichas clínicas, el registro de las acciones médicas, la posibilidad de derivar pacientes de centros de menor complejidad a centros de mayor complejidad, y la implementación de medidas específicas como la administración de corticoides prenatales a la madre para la reducción de los riesgos inherentes a la prematurez, o el uso de surfactante en los recién nacidos prematuros extremos.
Tales progresos han ido de la mano con la institucionalización de los partos, la medicalización a veces excesiva de un proceso eminentemente fisiológico, y el aumento del número de operaciones cesáreas con el incremento de costos y riesgos que esto significa para madres y recién nacidos. Estos problemas representan parte de los desafíos que la obstetricia moderna hoy enfrenta.
En el presente capítulo seleccionaremos algunas de las más comunes emergencias en la especialidad de obstetricia. Naturalmente dejamos muchas fuera, pero pensamos que los temas que hemos elegido darán buena cuenta de nuestra especialidad.
Hemorragia del primer trimestre del embarazoEl sangrado genital es un motivo de consulta frecuente durante toda la gestación. Su origen es generalmente materno y no fetal. El diagnóstico es inicialmente clínico y provisorio, basado en la edad gestacional y en las características del sangrado (cuantía, dolor asociado, características del dolor). El laboratorio y la ultrasonografía permiten confirmar o mo-difcar el diagnóstico inicial.
El 20 a 40% de las mujeres embarazadas sangra en el primer trimestre. De hecho, aproximadamente un 30% de los embarazos se pierde en el primer trimestre. El diagnóstico diferencial del sangrado en el primer trimestre debe incluir variedades de aborto (amenaza de aborto, aborto incompleto o completo, aborto retenido, aborto inevitable), embarazo ectópico y enfermedad del trofoblasto. Sin embargo, la evaluación de la paciente permitirá también descartar otras causas más infrecuentes (hemorragia de la implantación, hemorragia cervical o vaginal).
Las pacientes que se presentan con hemorragia del primer trimestre de la gestación tienen una anamnesis próxima común: amenorrea, sangrado genital y dolor abdominal. La anamnesis remota puede aportar antecedentes que apoyen el diagnóstico de una causa u otra, y el examen físico general y segmentario ayudarán a establecer una presunción diagnóstica, que se verificará muchas veces a través del examen ginecológico (1). Este examen se practica en posición de litotomía y aporta gran información:
- •
El dolor en la línea media es más propio de las variedades de aborto.
- •
El dolor lateral en el hemiabdomen inferior es más frecuente en los embarazos ectópicos.
- •
La especuloscopia permite descartar las causas vaginales y cervicales.
- •
La visualización de un saco gestacional en un cuello uterino dilatado permite diagnosticar aborto inevitable.
- •
El tamaño uterino se relaciona con la amenorrea. El útero se puede palpar a través del abdomen, sobre la sínfisis del pubis, desde alrededor de las 12 semanas de amenorrea.
Si la gestación está cercana a las 12 semanas, la posibilidad de embarazo ectópico se reduce muy significativamente y un aparato de Doppler puede permitir oír los latidos cardíacos fetales (LCF) que laten a una frecuencia cercana al doble de la frecuencia materna. El no auscultar los LCF, sin embargo, no es suficiente en el primer trimestre para asegurar un diagnóstico de aborto.
La ultrasonografía (US) y la cuantificación de subunidad beta de hormona gonadotrofina coriónica humana (beta-hGC) permiten en la mayoría de los casos, y cuando la anamnesis y el examen físico no han sido suficientes, reducir el espectro diagnóstico y establecer la causa. La ultrasonografía es, hoy en día, el examen fundamental en el diagnóstico de la hemorragia del primer trimestre. Cuando se trata de gestaciones menores de 6 semanas de amenorrea, su correlación con los niveles de gonadotrofina coriónica humana es fundamental.
Las mediciones seriadas de esa hormona permiten definir el diagnóstico y manejo en esos casos:
- •
Niveles de beta-hGC en descenso son consistentes con un embarazo intrauterino no viable o un ectópico en involución.
- •
Niveles de beta - hGC en ascenso son compatibles con un embarazo intrauterino viable (85% de los embarazos viables muestran un incremento de hGC >66% en 48hrs.), pero algunos ectópicos pueden parecerse.
- •
Niveles de beta-hGC en plateau o con aumento lento sugieren un embarazo ectópico.
- •
Ausencia de embarazo intrauterino en US transvaginal con beta-hGC >1000 a 2000UI/L (>6000UI/L en US transabdominal) sugiere un embarazo ectópico.
Es importante mencionar aquí dos diagnósticos diferenciales infrecuentes: uno es el sangrado atribuible a la pérdida precoz de uno de los gemelos en un embarazo múltiple (“vanishing twin”), generalmente producto de un embarazo que resulta de fertilización asistida (2). El otro es la hemorragia de implantación, diagnóstico de exclusión que ocurre alrededor de 10 a 14 días después de la fertilización, y cuya existencia real ha sido cuestionada.
ManejoLas pacientes que se presentan con sangrado genital significativo deben ser manejadas con vía venosa, hidratación y exámenes básicos (grupo sanguíneo y Rh, hematocrito, Coombs indirecto). Las pacientes Rh negativas deben ser vacunadas con inmunoglobulina anti D para evitar los riesgos de sensibilización. El manejo del embarazo ectópico es quirúrgico cuando está complicado y, en caso contrario, puede evaluarse su tratamiento médico.
El embarazo intrauterino, entre las 7 y 11 semanas de gestación, con actividad cardíaca embrionaria, tiene una posibilidad de 90% o más de seguir adelante, de modo que su manejo es expectante (3, 4). El reposo es parte de las prescripciones habituales en estos casos, a pesar de que no existe evidencia de que modifique el pronóstico.
En los casos de aborto incompleto o aborto inevitable, con el cuello uterino dilatado, el tratamiento en general es el legrado uterino, si bien en la actualidad, y con la disponibilidad de ultrasonografía, puede en ocasiones permitirse el manejo expectante y la resolución espontánea. En los abortos retenidos el manejo puede ser expectante o medico-quirúrgico dependiendo fundamentalmente de la edad gestacional al momento del diagnóstico.
Pronóstico. Numerosos estudios consistentemente muestran una asociación entre hemorragia del primer trimestre y resultado perinatal adverso (aborto, parto prematuro, rotura prematura de membranas y restricción del crecimiento intrauterino), razón por la cual es conveniente seguir a estas pacientes en una unidad de alto riesgo obstétrico (5-7).
Hemorragia de la segunda mitad del embarazoEn el segundo y tercer trimestre de la gestación, la hemorragia genital es menos frecuente que durante el primer trimestre (4 a 5% de los embarazos). Las causas más frecuentes de sangrado en estos trimestres corresponde a:
- -
Pérdida asociada a incompetencia cervical o trabajo de parto prematuro.
- -
Placenta previa (20%).
- -
Desprendimiento prematuro de placenta normoinserta (30%).
- -
Rotura uterina (infrecuente).
- -
Vasa previa (raro).
A continuación revisaremos de modo general lo que debemos hacer en el enfrentamiento inicial de la paciente, y luego analizaremos con algún detalle la situación de las causas más frecuentes: placenta previa y desprendimiento placentario.
Evaluación inicialLo primero es determinar la magnitud del sangrado y considerar su asociación a dolor. La ausencia de dolor sugiere incompetencia cervical en embarazos menores de 24 semanas de gestación, o la posibilidad de una lesión vaginal o cervical (pólipos, infecciones, cáncer). El sangrado genital abundante asociado a dolor intenso sugiere un desprendimiento placentario.
La auscultación de los LCF por Doppler o su detección por ultrasonido es fundamental en la toma de decisiones. La ultrasonografia permite el diagnóstico de la localización placentaria y a veces, infrecuentemente, la visualización de hematomas retroplacentarios compatibles con el diagnóstico de desprendimiento. En la actualidad se ha agregado al examen ultrasonográfico la evaluación del cuello uterino a través del ultrasonido transvaginal.
En el caso de desprendimiento prematuro de placenta normoinserta, suelen existir factores de riesgo como desprendimiento placentario en un embarazo previo, tabaquismo, uso de cocaína, hipertensión y rotura prematura de membranas.
Debe recordarse que la magnitud del sangrado vaginal o la ultrasonografia normal no son indicadores confiables de la severidad del desprendimiento o de la hemorragia, porque la sangre puede estar contenida en la regiòn retroplacentaria.
La rotura uterina y la rotura de vasa previa son causas infrecuentes y ocurren durante el trabajo de parto, más que en el anteparto. Ambas son emergencias que pueden llevar a la muerte fetal, y la primera de ellas a la muerte materna (8).
ManejoDepende de la edad gestacional, de la causa del sangrado, de la severidad de la hemorragia y del estado fetal
Placenta previaLa mortalidad materna es menor del 1% en países desarrollados, pero es más alta en países subdesarrollados, donde son frecuentes la lejanía a centros de mayor complejidad, donde faltan recursos y donde existe prevalencia elevada de anemia materna. La morbilidad y mortalidad neonatal está relacionada fundamentalmente con la prematurez asociada a la resolución del embarazo en pacientes con sangrado excesivo antes del término de la gestación.
Los datos de Estados Unidos entre 1989 y 1991, y entre 1995 y 1997, sugieren una mortalidad neonatal superior en 4 veces a la población control (9).
El acretismo placentario complica al 1 a 5% de los embarazos con placenta previa y útero sin cicatriz previa. La presencia adicional de cesárea anterior aumenta el riesgo de acretismo y de histerectomía durante el parto. La recurrencia de placenta previa es 4 a 8% (10, 11).
En pacientes con placenta previa diagnosticada por ultrasonografía y que han permanecido asintomáticas se recomienda evitar la vida sexual y el examen ginecológico durante la segunda mitad de la gestación, así como reducir la actividad física que puede asociarse a aumento de contracciones uterinas y éstas, a sangrado genital. No existe, sin embargo, evidencia disponible para estas recomendaciones. Tampoco existe evidencia de los beneficios de hospitalizaciones prolongadas antes del parto. Estudios observacionales sugieren que mujeres con placenta previa que no han sangrado durante el embarazo tienen bajo riesgo de necesitar una operación cesárea de urgencia (12, 13).
Un sangrado activo en una paciente con placenta previa constituye una emergencia obstétrica absoluta. En pacientes trasladadas a centros de mayor complejidad se han utilizado incluso los pantalones anti- shock para mantener la estabilidad hemodinámica (14).
Manejo- •
Vía venosa permeable y administración de cristaloides. En pacientes con sangrado activo es prudente instalar dos vías venosas. Debe asegurarse un débito urinario cercano a 30mL/hr.
- •
Clasifcación grupo y Rh, y anticuerpos.
- •
Perfl de coagulación
- •
Monitorización hemodinámica materna
- •
Transfusión cuando las pérdidas exceden el 30% del volumen sanguíneo o cuando la hemoglobina es menor de 10g/ dL, o cuando una paciente hipotensa no responde a 2 Lt de cristaloides. La Tabla 2 resume los productos sanguíneos disponibles y sus efectos. Un sangrado importante no impide un manejo conservador. De hecho, al menos la mitad de las pacientes cuyo episodio inicial de sangrado fue mayor de 500mL no requiere resolución inmediata del embarazo.
Tabla 2.Terapia transfusional
Producto Volumen Contenido Efecto (Por Unidad) G rojos 250ml GR, GB, plasma ↑ Hto 3%.
↑ Hb 1g/dlPlaquetas 50ml Plaquetas, GR GB, plasma ↑ Conteo plaquetas (*)
↑ 5000 - 10000/mm3Plasma fresco congelado 250ml Fibrinógeno, AT-III
Factores V y VIII↑ Fibrinógeno 10mg/dl Crioprecipitado 30ml Fibrinógeno, factores
V - VIII - XIII y V W↑ Fibrinógeno 10mg/dl - •
Monitorización fetal. La monitorización electrónica de la frecuencia cardiaca fetal (FCF) así como la ultrasonografia y el Doppler permiten evaluar el estado fetal y su bienestar in utero, o la conveniencia de extraerlo fuera de él.
- •
Parto: la resolución del embarazo y extracción del feto fuera del útero está indicada si existe sospecha de hipoxia fetal intrauterina, trazado de monitorización electrónica de la FCF sospechoso y que no responde a las medidas tradicionales (cambio de posición materna, oxígeno, tocolisis); si existe una hemorragia que amenaza la vida de la madre y si existe sangrado significativo con más de 34 semanas de gestación. A menos que existan condiciones obstétricas muy favorables la vía del parto es más frecuentemente la operación cesárea, y la anestesia general se prefiere sobre los bloqueos regionales.
- •
La data disponible es insuficiente para hacer recomendaciones basadas en evidencia en los sangrados de la segunda mitad de la gestación.
Sin embargo, existe consenso respecto de:
- 1.
Pacientes sintomáticas se mantienen hospitalizadas hasta la resolución del embarazo.
- 2.
Se deben administrar corticoides a la madre sintomática desde las 24 semanas de gestación para reducir los riesgos asociados a la prematurez (15).
- 3.
Debe administrarse inmunoglobulina anti-D a las mujeres Rh negativas que sangran.
- 4.
La tocolisis no se utiliza en pacientes con sangrado activo, si bien su uso puede ser considerado cuando existen contracciones uterinas y el sangrado no es significativo, y se pretende ganar tiempo en beneficio del pronóstico fetal.
- 5.
No hay evidencia de beneficio con la colocación de cerclaje cervical.
Si bien la causa primaria del desprendimiento placentario es desconocida, existen diversos factores de riesgo: hipertensión arterial, trauma, descompresión uterina brusca, uso de cocaína, tumores o anomalías uterinas y rotura prematura de membranas (16, 17).
Las manifestaciones clínicas del desprendimiento placentario pueden ser muy variables. El sangrado externo puede ser profuso y no haber sufrimiento fetal, o puede ser escaso o casi ausente y existir un desprendimiento completo con muerte fetal.
Complicaciones DPPNIMaternas- •
Hipovolemia
- •
Necesidad de transfusión sanguínea
- •
Coagulación intravascular diseminada
- •
Insufciencia renal
- •
Sindrome de distress respiratorio del adulto
- •
Falla orgánica multisistémica
- •
Muerte
- •
Restricción de crecimiento intrauterino
- •
Hipoxemia o asfixia fetal
- •
Parto prematuro
- •
Muerte
Los riesgos de la madre en el DPPNI se relacionan con la severidad del desprendimiento, mientras que los riesgos fetales se relacionan además con la edad gestacional a la cual ocurre el parto (18-20).
ManejoComo en otras circunstancias del embarazo, el manejo, y, en especial la decisión de interrupcion del embarazo depende de la edad gestacional, del compromiso materno, del compromiso fetal y de las condiciones obstétricas.
El manejo inicial es similar al planteado para la paciente con placenta previa: monitorización materna y fetal, vías venosas permeables y administración de cristaloides, sonda vesical y registro de diuresis, pruebas sanguíneas básicas y estudio de coagulación.
El test del coágulo puede realizarse colocando 5mL de sangre de la paciente en un tubo sin anticoagulante. Si en 10 minutos no se ha formado un coágulo signifca que el fbrinógeno está anormalmente bajo. Desde el punto de vista de reemplazo de productos sanguineos debe considerarse lo siguiente:
- -
Mantener el hematocrito sobre 30%.
- -
Dar 6 U de plaquetas a pacientes con trombocitopenia menor de 20.000/ microL o con plaquetas 5<000 si hay sangrado excesivo y necesidad de practicar operación cesárea.
- -
Plasma fresco congelado o crioprecipritado si el fibrinógeno es menor de 150mg/dL. Si en relación a múltiples transfusiones el tiempo de protrombina o el tiempo de tromboplastina parcial exceden en 1.5 veces el valor control, deben transfundirse 2 U de plasma fresco congelado.
El manejo posterior del DPPNI depende de si el feto está vivo o muerto, y del estado materno. Si el feto está vivo y tiene más de 34 semanas de gestación el embarazo debe interrumpirse. Si existe compromiso materno y/o fetal, y el parto vaginal se considera no posible, debe practicarse operación cesárea. En presencia de bradicardia fetal, un intervalo menor o igual a 20 minutos entre la decisión y la operación cesarea se relaciona con un mejor pronóstico fetal que intervalos mayores.
Cuando el feto está muerto el parto vaginal puede ser preferible. La rotura artificial de membranas es una maniobra que en los casos de desprendimiento favorece la resolución vaginal.
El resultado perinatal depende de la magnitud del desprendimiento y de la edad gestacional a la cual el desprendimiento ocurre. Un estudio en 7 millones de nacimientos en Estados Unidos comunicó una mortalidad perinatal en el contexto de DPPNI de 119/1000 nacidos vivos vs 8.2/1000 en los otros embarazos. Más de la mitad de las muertes perinatales se debieron a prematurez, y la mayoría de las otras a asfixia, que ocurre en general con desprendimientos mayores del 50% (21). El DPPNI está implicado en alrededor del 10% de los nacimientos prematuros.
En embarazos siguientes las pacientes afectadas tienen un riesgo mayor en varias veces de un nuevo desprendimiento. El riesgo de recurrencia ha sido reportado entre 5 y 15% vs 0.4 a 1.3% en la población general. Este riesgo aumenta si hay dos desprendimientos sucesivos, en hermanas de mujeres afectadas y después de un desprendimiento severo (22, 23).
Hemorragia del postpartoHemorragia del postparto es una emergencia obstétrica que se presenta después de un parto vaginal o cesárea. Es causa de morbilidad materna mayor (primera causa obstétrica de ingreso a unidades de cuidado intensivo) y la primera causa de muerte materna en el mundo (25% de las cerca de 500000 muertes que ocurren cada año). El riesgo de mortalidad es menor en los países desarrollados (1/100.000 nacidos vivos) vs. los subdesarrollados (1/1.000 nv).
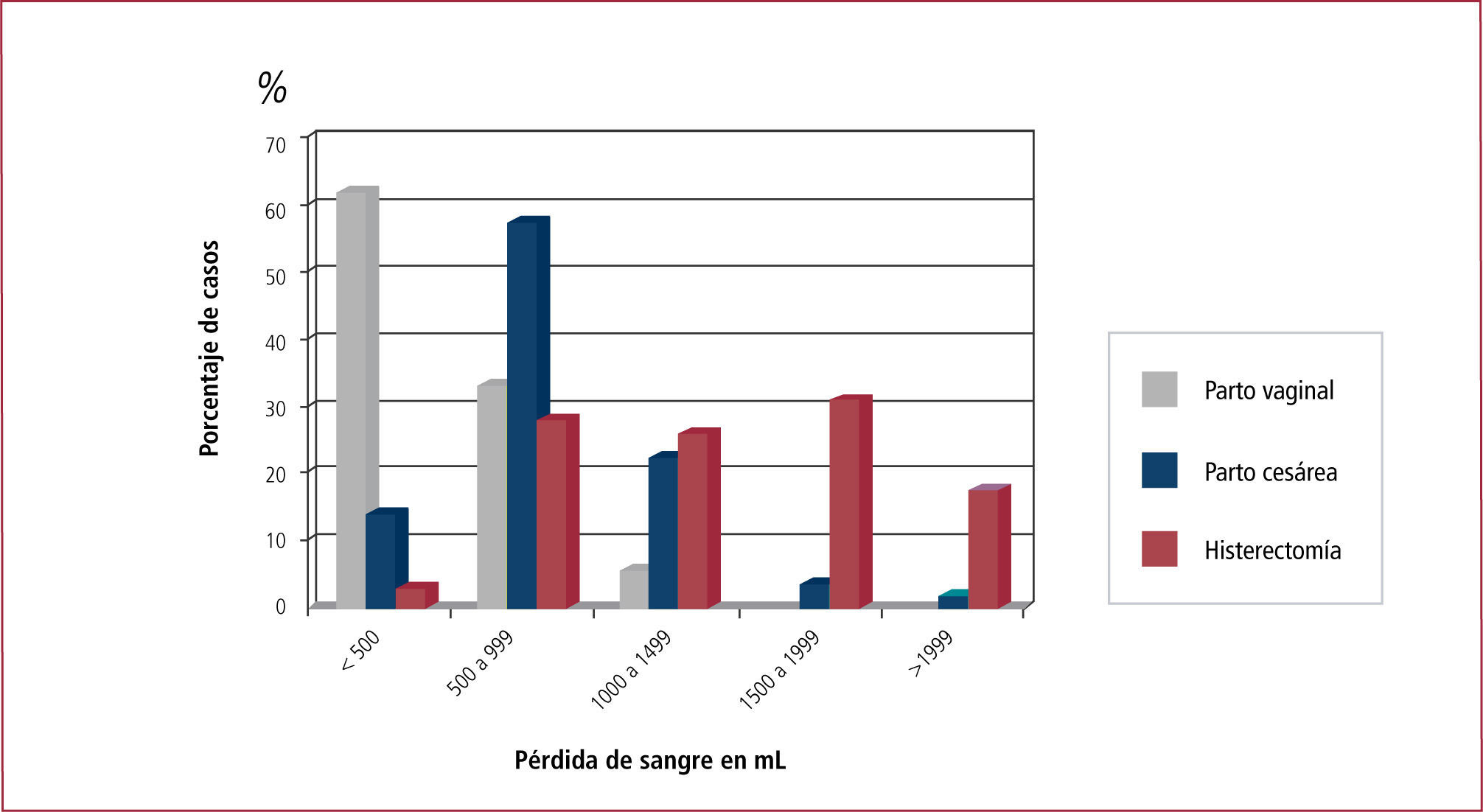
IncidenciaLa incidencia en Chile es similar a la de los países desarrollados y varía según su defnición. Tradicionalmente se la ha definido como la pérdida mayor a 500mL en las primeras 24 horas del post parto vaginal y mayor a 1000mL después de una operación cesárea. Sin embargo se ha demostrado que 40% de las pacientes pierde más de 500mL después de un parto vaginal, y 30% pierde más de 1000mL después de una cesárea electiva (Figura 1), lo que señala que las pérdidas estimadas son habitualmente la mitad de las pérdidas reales. Por esta razón la defnición operacional debe considerar a toda mujer con sangrado genital excesivo después del parto y la aparición de signos y síntomas de hipovolemia e inestabilidad hemodinámica (hipotensión, taquicardia, oliguria, baja saturación de oxígeno) (24-26).
Una estimación razonable es que el trastorno se presenta en alrededor del 5% de los partos. Por otra parte, data reciente muestra que el diagnóstico se ha incrementado en los últimos años, así como las muertes atribuidas a esa causa (probablemente por el aumento de operaciones cesáreas y de acretismo placentario) (27-29).
La hemorragia postparto también se puede definir como primaria o secundaria. La primera es la que ocurre 24 horas después del parto y la segunda es la que ocurre entre 24 horas y 12 semanas después del parto.
Etiología y factores de riesgoLa Tabla 3 resume las causas de hemorragia postparto. El 80% de ellas son atribuibles a inercia o atonía uterina (ausencia de retracción uterina). Ella se relaciona con sobredistensión uterina (embarazo múltiple, macrosomía), infección uterina, ciertos medicamentos, trabajo de parto prolongado, inversión uterina y retención placentaria. Las otras causas tienen que ver con laceraciones del canal del parto o rotura uterina, y con defectos de coagulación (preclampsia severa, síndrome HELLP, DPPNI, muerte fetal, embolía amniótica y sepsis).
Las mujeres que han tenido una hemorragia postparto la pueden presentar en el embarazo siguiente con un riesgo de 10% de recurrencia.
PrevenciónLa Joint Commission de acreditación de organizaciones de salud recomienda que los grupos obstétricos periódicamente conduzcan cursos de preparación en su personal para enfrentar una hemorragia postparto. En el anteparto la prevención supone reconocer factores de riesgo, clasifcación de grupo y Rh, mantener una hemoglobina adecuada y vía venosa permeable durante el parto. En el post parto, estudios randomizados muestran que el manejo activo del alumbramiento (ligadura y sección precoz del cordón umbilical, alumbramiento dirigido y administración de agentes uterotónicos) se relaciona con menos hemorragia que el manejo expectante.
TratamientoDebe considerarse como primer objetivo salvar la vida de la paciente, y secundariamente preservar su fertilidad.
- -
Manejo inicial: evaluación hemodinámica, sonda vesical, vías venosas lo más gruesas posibles (teflón 16).
- -
Laboratorio: clasificación grupo y Rh, hematocrito y recuento plaquetario, fbrinógeno y TP y TTPA, test del coágulo.
- -
Medidas específcas: médicas, mecánicas y quirúrgicas. El tratamiento médico incluye la administración de volumen y transfusión de componentes sanguíneos cuando se considera necesario (Tabla 2). Además, agentes uterotónicos (ocitocina, metilergonovina, misoprostol y carbetocina).
El tratamiento mecánico incluye masaje uterino bimanual con vejiga vacía y “packing” uterino con gasa o balón.
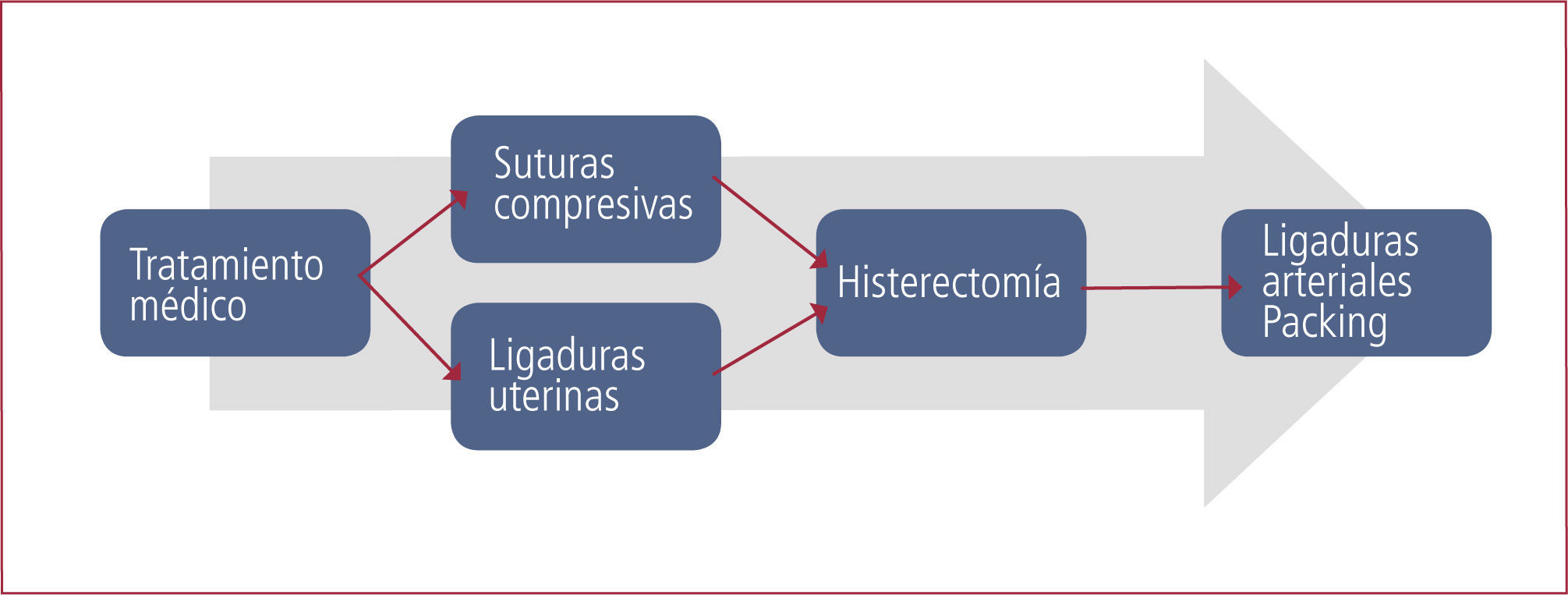
El tratamiento quirúrgico incluye suturas de lesiones del canal del parto, ligadura de arterias uterinas, ligadura de arterias ováricas, uso de suturas compresivas del útero (B Lynch), ligadura de arterias hipogástricas, histerectomía, embolización arterial y “packing” pelviano (30, 31).
La elección de una técnica quirúrgica u otra depende de la cuantía de la hemorragia, deseos de fertilidad de la paciente, estabilidad hemodinámica y experiencia del equipo médico. La Figura 2 resume el manejo sugerido por nuestra institución.
ResultadosEl año 2007 se publicó la mayor experiencia disponible de histerectomía periparto, resultado del registro del Reino Unido entre 2005 y 2006. Ella analizó 318 pacientes con 80% cesáreas y 2 muertes. Más de la mitad fueron atribuibles a inercia uterina. Hubo acretismo placentario en el 39% de los casos y se transfundieron en promedio 10 U de sangre (0-116). En 21% de los casos hubo daño a otras estructuras en la operación, 20% requirieron reoperarse, y 19% presentó morbilidad severa adicional. Estos resultados reflejan la gravedad del cuadro denominado hemorragia postparto (32).
Hemorragia secundaria postpartoSe presenta en el 0.5 a 2% de las pacientes en los países desarrollados. Su origen se relaciona con subinvolución uterina asociada a restos placentarios retenidos y/o infección, pero se desconoce su causa exacta. Cuando se presenta deben descartarse diátesis hemorrágicas como enfermedad de von Willebrand. Causas infrecuentes son pseudaneurisma de la arteria uterina y malformaciones arteriovenosas.
No existen estudios randomizados que permitan orientar el tratamiento. El manejo actual incluye agentes uterotónicos y antibióticos de amplio espectro, aún cuando no existan signos evidentes de infección. Tradicionalmente se proscribió el legrado uterino en estas pacientes por un riesgo probablemente mayor de perforación uterina. Sin embargo hoy se considera que pacientes seleccionadas y con ultrasonografía sugerente de contenido uterino podrían ser sometidas a legrado como parte del manejo (33).
EclampsiaCorresponde a un cuadro de convulsiones generalizadas y/o coma en el contexto de una preclampsia (PE), y en ausencia de otras condiciones neurológicas que expliquen el cuadro convulsivo. Puede presentarse en cualquier momento durante la segunda mitad de la gestación o en el postparto. Tradicionalmente se pensó que el cuadro era el resultado final de una PE. Sin embargo, actualmente se la considera una manifestación clínica más de una PE severa (Tabla 4).
Criterios preeclampsia severa (*)
|
|
|
|
|
|
|
|
|
|
|
Se presenta en el 0.5% de las pacientes con PE moderada y en el 2 a 3% de las pacientes con cuadros severos. En los países desarrollados mantiene hoy una incidencia estable de alrededor de 4 a 6/10.000 nacidos vivos. En los países subdesarrollados su incidencia alcanza hasta 100/10.000 nacidos vivos. Los factores de riesgo son similares a los de la PE (34, 35).
Su aparición antes de las 20 semanas es rara y obliga a plantear la posibilidad de enfermedad del trofoblasto o síndrome antifosfolípidos. La mitad de los casos ocurre antes del término de la gestación. Alrededor de un tercio ocurre al término, intraparto o las primeras 48hrs. postparto; 25% aproximadamente se presenta entre dos días y 4 semanas postparto.
Patogenia de las convulsionesLa causa exacta se desconoce. Se han propuesto dos hipótesis: 1) sobrerregulación cerebral en respuesta a la hipertensión arterial que resulta en vasoespasmo de las arterias cerebrales, hipoperfusión cerebral, isquemia e infartos cerebrales y edema; y, 2) pérdida de la autorregulación del fujo sanguíneo cerebral en respuesta a la hipertensión con hiperperfusión, daño endotelial y edema extracelular.
Clínica y diagnósticoEl diagnóstico es clínico basado en la presencia de convulsiones tónico-clónicas y/o coma en una mujer embarazada con PE, y sin otras condiciones neurológicas. Las convulsiones son autolimitadas y rara vez duran más de 3 a 4 minutos. Antes de la convulsión puede haber cefalea frontal u occipital persistente, visión borrosa, fotofobia, dolor epigástrico y alteraciones mentales.
Durante y después de la convulsión es frecuente que haya bradicardia fetal. Ella no requiere operación cesárea de emergencia. Estabilizada la madre lo esperable es que el feto se recupere in utero.
Diagnóstico diferencialLas convulsiones eclámpticas son indistinguibles de otras convulsiones tónico-clónicas generalizadas. Otros cuadros clinicos a considerar en el diagnóstico diferencial son:
- •
Accidente vascular encefálico
- •
Encefalopatía hipertensiva
- •
Tumor del sistema nervioso central
- •
Trastornos metabólicos o infecciosos
- •
Púrpura trombocitopénico trombótico
- •
Epilepsia
- •
Vasculitis cerebral
El ABC (airway, breathing, circulation) de resucitación es válido en el tratamiento primario de la eclampsia: vía aérea permeable, respiración y vía venosa. A continuación las medidas terapéuticas deben pretender:
Prevenir la hipoxia materna y el trauma. ABC resucitación. Administración de oxígeno.
Manejar la hipertensión severa. Casi 20% de las muertes por eclampsia son por accidentes vasculares encefálicos secundarios a la hipertensión severa. Cifras diastólicas mayores o iguales a 110mmHg (o sistólicas mayores de 160) obligan a usar antihipertensivos de acción rápida. Hoy usamos Labetalol (10 a 20mg ev y doblamos la dosis cada 10 minutos, hasta 80mg). La presión arterial no debe bajarse más de 140mmHg la sistólica y más de 100 o 90mmHg la diastólica.
Tratar las convulsiones y prevenir su recurrencia. Sulfato de magnesio es la droga de elección, con el beneficio adicional (hoy avalado por estudios randomizados) de que su uso antes de un nacimiento prematuro se asocia a reducción del riesgo de disfunciones neurológicas severas y parálisis cerebral. Estudios randomizados han demostrado que el sulfato de magnesio es significativamente mejor que el diazepam y que la fenitoína en la prevención de la recurrencia de convulsiones (RR 0.32 - 0.51) y en términos de mortalidad materna (RR 0.39-0.99). Además el sulfato de magnesio es más barato, más seguro y más facil de administrar que todas las drogas con las que se le ha comparado (36, 37).
La dosis inicial de sulfato de magnesio es 4 a 6g ev en 15 minutos, y la dosis de mantención que utilizamos es 2g ev por hora. La miastenia gravis es contraindicación formal para el uso del sulfato. El gluconato de calcio (1g ev) es el antídoto para contrarrestar la toxicidad por sulfato de magnesio. La pérdida del reflejo patelar debe sugerir la conveniencia de discontinuar la infusión de sulfato.
En caso de convulsiones persistentes puede usarse una nueva dosis de sulfato de magnesio en bolo (2g) o amobarbital sódico o diazepam.
Evaluar la interrupción del embarazo. La interupción del embarazo es el tratamiento definitivo de la enfermedad, independientemente de la edad gestacional. De hecho, la eclampsia se considera contraindicación de manejo expectante. Ocasionalmente hemos manejado pacientes muy alejadas del término de modo conservador para prolongar la gestación y alcanzar viabilidad fetal adecuada. La interrupción del embarazo, por otra parte, no es inmediata, sino sólo una vez estabilizada la madre. En ausencia de condiciones obstétricas favorables para esperar una resolución del parto por vía vaginal, es razonable practicar una operación cesárea (38-41).
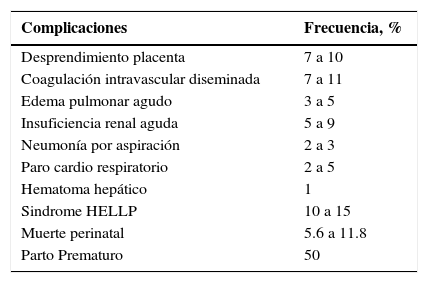
PronósticoLa Tabla 5 resume las complicaciones de la eclampsia. La mortalidad materna en eclampsia varía entre 0 y 14%, siendo menor entre las madres controladas adecuadamente durante su embarazo y que son resueltas en centros terciarios por especialistas. La mortalidad perinatal varía entre 9 y 23% y se relaciona fundamentalmente con la edad gestacional al nacimiento.
Complicaciones de eclampsia
| Complicaciones | Frecuencia, % |
|---|---|
| Desprendimiento placenta | 7 a 10 |
| Coagulación intravascular diseminada | 7 a 11 |
| Edema pulmonar agudo | 3 a 5 |
| Insuficiencia renal aguda | 5 a 9 |
| Neumonía por aspiración | 2 a 3 |
| Paro cardio respiratorio | 2 a 5 |
| Hematoma hepático | 1 |
| Sindrome HELLP | 10 a 15 |
| Muerte perinatal | 5.6 a 11.8 |
| Parto Prematuro | 50 |
A largo plazo las mujeres que han presentado preeclampsia-eclampsia tienen más riesgo de desarrollar hipertensión cronica y patología cardiovascular (42, 43).
RecurrenciaLa tasa de recurrencia en embarazos posteriores es de un 2%. El riesgo se reduce con monitorización cercana, control estricto e interrupción agresiva si se desarrolla PE. Las mujeres que han presentado PE severa también tienen más riesgo de complicaciones en embarazos futuros, especialmente aquellas cuyos cuadros fueron alejados del término (antes de las 28 semanas de gestación) (44, 45).
PrevenciónAún cuando existen casos de eclampsia que se consideran no prevenibles (inicio súbito, postparto tardío), la búsqueda de factores responsables ha mostrado que error médico y ausencia de control prenatal dan cuenta de más de la mitad de los casos.
Trombosis venosa y tromboembolismo pulmonarEl embarazo y el puerperio constituyen factores de riesgo para trombosis venosa (TV), con una incidencia que varía entre 4 y 50 veces más que en la mujer no embarazada. La incidencia absoluta es de 1/500 a 2.000 embarazos. En los Estados Unidos el tromboembolismo pulmonar (TEP) es la primera causa de mortalidad materna (20% de las muertes), por sobre hemorragia materna (17%) e hipertensión arterial (16%). El riesgo de TV aumenta al doble en operación cesárea respecto de parto vaginal, y es más frecuente en la extremidad inferior izquierda (46-53).
PatogeniaEl embarazo y el postparto se caracterizan por la presencia de los 3 componentes de la tríada de Vichow: éstasis venoso, injuria endotelial (parto) y estado de hipercoagulabilidad (aumento de factores de coagulación como el I, II, VII, VIII, IX y X, disminución de proteína S, aumento de resistencia a la proteína C activada, mayor actividad de los inhibidores de la fibrinolisis). Las trombofilias hereditarias o adquiridas aumentan además el riesgo de tromboembolismo.
DiagnósticoEl diagnóstico clínico es de baja sensibilidad y especificidad, problema que se incrementa en la gestación. Tres variables objetivas tienen mayor utilidad clínica: síntomas en la pierna izquierda, circunferencia mayor en 2 cm o más, y presencia de los síntomas en el primer trimestre de la gestación.
El examen más utilizado para el diagnóstico definitivo es el ultrasonido Doppler. La venografía ascendente contrastada se considera el standard con o sin embarazo, si bien raramente se realiza por ser invasiva y entregar radiación. También puede utilizarse la resonancia nuclear magnética.
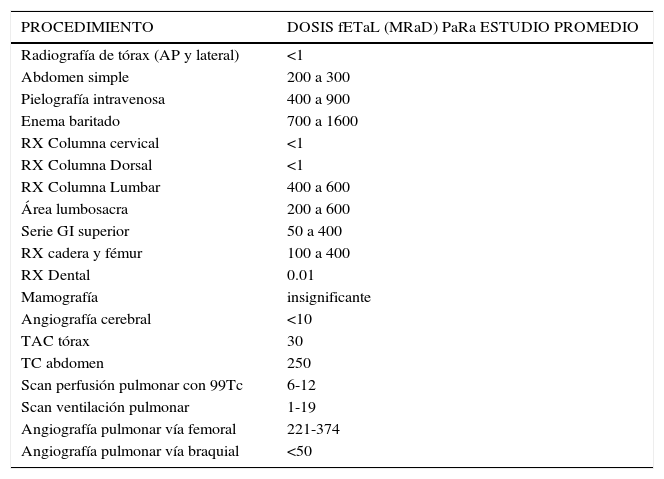
Si se sospecha TEP, no basta el examen de ultrasonido Doppler negativo. En ese caso se utilizan la angiografía con contraste, la cintigrafía pulmonar y el scanner de ventilación / perfusión. La exposición fetal a radiación producto de la combinación de radiografía de tórax, scanner de ventilación/ perfusión y arteriografía pulmonar es menor de 5000 mcGy (500 mrad) (Tabla 6). Esta dosis es 100 a 200 veces menor que la necesaria para un riesgo significativo de anomalías fetales.
Dosis de radiación y efecto fetal
| PROCEDIMIENTO | DOSIS fETaL (MRaD) PaRa ESTUDIO PROMEDIO |
|---|---|
| Radiografía de tórax (AP y lateral) | <1 |
| Abdomen simple | 200 a 300 |
| Pielografía intravenosa | 400 a 900 |
| Enema baritado | 700 a 1600 |
| RX Columna cervical | <1 |
| RX Columna Dorsal | <1 |
| RX Columna Lumbar | 400 a 600 |
| Área lumbosacra | 200 a 600 |
| Serie GI superior | 50 a 400 |
| RX cadera y fémur | 100 a 400 |
| RX Dental | 0.01 |
| Mamografía | insignificante |
| Angiografía cerebral | <10 |
| TAC tórax | 30 |
| TC abdomen | 250 |
| Scan perfusión pulmonar con 99Tc | 6-12 |
| Scan ventilación pulmonar | 1-19 |
| Angiografía pulmonar vía femoral | 221-374 |
| Angiografía pulmonar vía braquial | <50 |
Cuando existe la sospecha de tromboembolismo está indicado el inicio empírico de terapia anticoagulante incluso antes de completar la evaluación diagnóstica. Las guías del Colegio Americano de Médicos de Tórax del 2008 indican que decidido el inicio de terapia anticoagulante, debe usarse heparina de bajo peso molecular, heparina endovenosa o heparina subcutánea. La primera es preferida porque su uso es más sencillo, parece más efcaz y su perfil de seguridad es superior. Estas consideraciones son extrapoladas de estudios clínicos en pacientes no embarazadas. En un meta-análisis de 22 estudios randomizados (8.867 pacientes) la heparina de bajo peso molecular, sc, disminuyó la mortalidad y la trombosis recurrente significativamente, y, además, se asoció a trombos de menor tamaño y a menores riesgos de hemorragia.
La dosis inicial es dalteparin 200U/kg una vez al dia, tinzaparin 175U/kg una vez al dia, dalteparin 100U/kg cada 12 hours, o enoxaparina 1mg/kg cada 12hrs. Algunos controlan el tratamiento midiendo niveles de anti Xa.
Si se utiliza heparina ev, la dosis inicial es un bolo de 80U/Kg/hora para seguir con una infusión continua de 18U/Kg/hora. La dosis se titula para mantener un TTPA que corresponde a un nivel de anti Xa de 0.3 a 0.7 U. Si la heparina se usa sc, la dosis inicial debe ser 17500 U cada 12 horas y luego se titula la dosis de igual modo.
El tratamiento anticoagulante debe ser discontinuado 24 a 36 horas antes del parto si eso es predecible. En casos de mayor riesgo de recurrencia de la trombosis puede usarse antes de la interrupción del embarazo la heparina endovenosa en infusión y suspenderse 4 a 6 horas antes del parto.
En casos aún más severos, la suspensión del tratamiento anticoagulante debe asociarse a la colocacion de un filtro en vena cava inferior. Las indicaciones de colocación de estos filtros durante el embarazo son las mismas que se consideran sin embarazo.
En pacientes bajo terapia anticoagulante que presentan trabajo de parto, no existe contraindicación de parto vaginal, si bien se recomienda no usar anestesia peridural.
La terapia anticoagulante debe reiniciarse 12 horas después de una operación cesárea o 6 horas postparto vaginal. Puede cambiarse a anticoagulación oral aún durante la lactancia, y mantenerse al menos por 6 semanas postparto. Si los factores de riesgo presentes para el trombo embolismo eran transitorios (embarazo, operación cesárea) el tratamiento anticoagulante debe durar en total 6 meses, porque la experiencia clínica sugiere que esa duración se asocia a menor riesgo de recurrencia (53-57).
Embolia de líquido amnióticoLa embolía de líquido amniótico, también llamada síndrome anaflac-toídeo del embarazo, es una condicion catastrófica que ocurre durante el embarazo o poco después del parto. Reportado por primera vez en 1926, no fue reconocido sino hasta 1941 en relación a una serie de autopsias en 8 mujeres que habían muerto súbitamente durante el trabajo de parto y en las cuales se encontró células escamosas y mucina de origen fetal en la vasculatura pulmonar materna.
IncidenciaEs una patología rara, cuya incidencia se estima en un caso cada 8000 a 80.000 partos. Un estudio reciente estimó la incidencia de embolía de líquido amniótico en 1/15.200 y 1/53.800 partos en Estados Unidos y Europa, respectivamente (58, 59).
Factores de riesgoSe ha asociado a trabajo de parto precipitado, edad materna avanzada, parto instrumental u operación cesárea, placenta previa y DPPNI, gran multiparidad (más de 5 nacimientos), polihidroamnios, laceraciones cervicales, sufrimiento fetal, eclampsia, rotura uterina e inducción del trabajo de parto. A pesar de estos factores descritos el pensamiento actual es que ellos no son causa del síndrome y éste se considera impredecible y no prevenible (58, 59).
FisiopatologíaEl líquido amniótico probablemente entra a la circulación materna a través de las venas endocervicales o del sitio de inserción de la placenta o de una zona de trauma uterino, precipitando entonces shock cardiogénico, insuficiencia respiratoria y una respuesta inflamatoria sistémica. Los estudios hemodinámicos han mostrado que la respuesta hemodinámica es bifásica, inicialmente con presión arterial pulmonar elevada, aumento de la presión capilar pulmonar, falla ventricular derecha, reducción del gasto cardíaco y, finalmente, falla ventricular izquierda.
ClínicaEl inicio de los síntomas ocurre más frecuentemente durante el trabajo de parto y durante el parto mismo, o inmediatamente después del parto. Los hallazgos clínicos más frecuentes son el inicio abrupto y fulminante de hipotensión por shock cardiogénico, hipoxemia por insuficiencia respiratoria y coagulación intravascular diseminada. La hipoxemia causa alrededor del 50% de las muertes que ocurren en la primera hora. El sangrado prolongado de los sitios de punción o de los sitios quirúrgicos son la manifestación más frecuente del trastorno de coagulación.
Diagnóstico diferencialExisten numerosas causas de hipotensión, hipoxemia y hemorragia en mujeres embarazadas. Ellas pueden ser de origen obstétrico, anestésico o por causas no obstétricas. Las primeras incluyen DPPNI, rotura uterina, inercia uterina, eclampsia y miocardiopatía periparto. Entre las causas anestésicas están el ascenso de anestesia espinal y toxicidad del anestésico local. Las causas no obstétricas incluyen TEP, embolía aérea, anaflaxis, shock séptico, aspiración de contenido gástrico e infarto del miocardio.
DiagnósticoSe sospecha cuando existe shock o insuficiencia respiratoria durante el trabajo de parto, parto o postparto (60-62).
ManejoNo hay tratamiento específico. El tratamiento pretende corregir la hipoxemia y la hipotensión. Idealmente deben instalarse catéteres arteriales y venosos centrales. Debe suministrarse oxígeno para mantener una PaO2 sobre 65mm Hg. El soporte hemodinámico se consigue generalmente con el uso de vasopresores (norepinefrina y dopamina) y con la infusión de fluidos. Terapias promisorias incluyen el uso de vasodilatadores pulmonares selectivos y el uso del factor VII recombinante activado.
La resolución del parto inmediata debe ser evaluada caso a caso, y la vía de parto también dependerá de la condición de cada paciente en particular. Si se decide practicar una operación cesárea, generalmente la intervención debe asociarse al uso de sangre, plasma fresco congelado, plaquetas y crioprecipitado.
Resultado perinatalLa mortalidad materna reportada es de un 20 a 90%. Entre las sobrevivientes son frecuentes las secuelas neurológicas por hipoxia cerebral. El resultado neonatal también es malo, con una mortalidad estimada entre 20 y 60% (63, 64).
Distocia de hombrosLa distocia o retención de hombros se define como la necesidad de realizar maniobras adicionales para realizar el parto de los hombros fetales en el contexto de un parto vaginal. Ocurre en 0.2 a 3% de los nacimientos y representa una emergencia obstétrica. La mayoría de los casos no son anticipables ni prevenibles dado que ocurren en ausencia de factores de riesgo. Cuando se presenta deben cumplirse ciertos pasos con el objeto de prevenir la asfixia fetal y una parálisis de Erb permanente, así como traumas físicos (maternos y fetales).
La Joint Commission de los Estados Unidos recomienda, al igual que en otras emergencias obstétricas, que se realicen ensayos periódicos que permitan mantener al personal preparado para enfrentarla (65, 66).
FisiopatologíaEl diámetro biacromial del feto entra a la pelvis normalmente en un ángulo oblicuo, con el hombro posterior por delante del anterior, y rotando a la posición antero-posterior al final cuando el polo cefálico ha hecho la rotación externa. En ese momento el hombro anterior queda bajo la sínfisis pubiana para su salida. Si los hombros permanecen en una posición antero-posterior durante el descenso o si descienden simultáneamente y no secuencialmente, el hombro anterior puede impactarse detrás de la sínfisis pubiana y el hombro posterior queda atascado por el promontorio sacro. Las lesiones neonatales pueden resultar de daños prenatales, traumas del parto o de las maniobras para extraer al niño. La compresión del cordón umbilical puede causar acidemia fetal.
DiagnósticoEs subjetivo. Se sospecha cuando la cabeza fetal se retrae hacia el periné (signo de la tortuga) después de su salida, debido a la tracción reversa de los hombros impactados en el estrecho inferior de la pelvis. El diagnóstico se confirma cuando la tracción rutinaria de la cabeza fetal no logra completar el parto del hombro anterior. Un tiempo mayor de 60 segundos entre la expulsión de la cabeza y el cuerpo fetal se asocia a recién nacidos de mayor peso, Apgar más bajo al minuto y mayor frecuencia de traumatismos fetales.
ManejoPretende desimpactar el hombro anterior desde detrás de la sinfisis del pubis rotando el tronco fetal o permitiendo el parto del hombro posterior. En general, el operador tiene hasta 7 minutos para extraer a un recién nacido de término previamente bien oxigenado antes que aumente el riesgo de asfixia. No hay estudios randomizados que comparen los resultados de las distintas maniobras. El consenso general es que ninguna de ellas es claramente superior para resolver la distocia y prevenir el daño fetal (67-69).
Medidas generalesDeben acudir a la sala de partos enfermera, matrona, anestesista, obstetra y pediatra. La madre no debe pujar mientras se prepara la realización de las maniobras secuenciales. Debe evitarse tracción excesiva de la cabeza fetal o sus rotaciones, así como la presión sobre el fondo uterino, porque tales maniobras se asocian a lesión del plexo braquial y pueden favorecer mayor impactación de los hombros, y rotura uterina. Debe practicarse una episiotomía amplia.
ManiobrasMcRoberts: es la primera a realizar y la menos invasiva. Requiere que dos asistentes traccionen las piernas extendidas de la madre, flectando los muslos sobre el abdomen. Esta maniobra única permite resolver la distocia en cerca de la mitad de los casos.
Presión suprapúbica: un asistente aplica presión suprapubiana sobre el hombro anterior hacia abajo y lateralmente, hacia la cara fetal, en conjunto con la maniobra de McRoberts.
Rubin: causa aducción del hombro fetal de modo que los hombros se desplacen desde el diámetro anteroposterior de la pelvis, permitiendo que el hombro posterior entre a la pelvis. Con anestesia adecuada, el operador introduce una mano en la vagina, por detrás del hombro posterior y lo rota hacia anterior, hacia la cara fetal. Alternativamente se puede intentar el desplazamiento del hombro anterior, si éste está más accesible.
Woods: rota el feto ejerciendo presión sobre la superficie clavicular, anterior, del hombro posterior para rotar al feto hasta que el hombro anterior emerge desde detrás de la sinfisis del pubis. El operador usa la mano para empujar la clavícula del hombro posterior y rotar al feto en 180 grados en dirección del reloj. No deben rotarse la cabeza o el cuello fetales. Puede combinarse con la maniobra de Rubin.
Parto del hombro posterior: o maniobra de Barnum. Se introduce una mano en la vagina para localizar el hombro posterior y se aplica presión sobre el codo a nivel de la fosa antecubital. Esto flecta el codo y permite tracionar el antebrazo o la mano, y extraer el brazo fuera de la vagina. Si el hombro anterior no sale ahora, el feto puede ser rotado y se repite el procedimiento para el hombro anterior transformado en posterior.
fractura clavícula: la fractura intencional de la clavícula reduce el diámetro biacromial, pero es dificil de realizar.
Complicaciones- -
Neonatales: series que incluyen más de 100 casos de distocia de hombros han reportado parálisis transitoria del plexo braquial (3.3 a 16.8%), fractura de clavícula (1.7 a 9.5%), fractura de húmero (0.4 a 4.2%), parálisis braquial permanente (0.5 a 1.6%), y muerte (0 a 0.35%). Debe recordarse, sin embargo, que estas lesiones han sido reportadas en ausencia de retención de hombros e incluso después de una cesárea (70).
- -
Maternas: hemorragia (11%) y desgarros perineales de cuarto grado (3.8%).
El aumento de mujeres que se embarazan a edades avanzadas, y la coexistencia en la edad fértil de factores de riesgo como sobrepeso, obesidad, tabaquismo e hiperlipidemias, ha aumentado la importancia de patologías médicas que coexisten con el embarazo y que aumentan las posibilidades de descompensación cardiopulmonar. El uso más liberal, por otra parte, de anestesias y de procedimientos quirúrgicos incluyendo la operación cesárea, también aumenta el riesgo de una falla cardiopulmonar (71, 72).
El problema fundamental del paro cardiorrespiratorio en el embarazo es que compromete a dos pacientes, la madre y el feto. Si bien su ocurrencia obliga a implementar los algoritmos de resucitación, deben considerarse algunas variables propias del embarazo. No existen estudios randomizados que permitan resolver este tipo de situaciones de acuerdo a la mejor evidencia, de modo que lo que sabemos procede de series pequeñas de casos clinicos, revisiones de la literatura u opinión de expertos (73-75).
PrevalenciaVaría de 1/20.000 a 1/50.000 embarazos.
EtiologíaEl paro cardiorrespiratorio puede relacionarse con condiciones propias del embarazo o condiciones coexistentes con la gestación (Tabla 7). La causa más frecuente en la literatura inglesa es el TEP, luego hemorragia, sepsis, miocardiopatía periparto, accidente vascular encefálico, eclampsia, complicaciones anestésicas, embolía amniótica, infarto al miocardio y enfermedad cardíaca preexistente.
Causas de paro cardio respiratorio en el embarazo
|
|
|
|
|
|
|
|
- -
código pre-establecido que llama a equipo multidisciplinario.
- -
desplazamiento lateral del útero hacia la izquierda si el útero está sobre el ombligo para minimizar la compresión aortocava. Existe un estudio randomizado que muestra mejores resultados con el desplazamiento manual del útero que con el desplazamiento de la mesa quirúrgica.
- -
iniciar el ABC de resucitación cardiopulmonar. Manejo agresivo de la vía aérea. Intubar tan pronto como sea posible, proteger de la aspiración. Restauración agresiva del volumen circulatorio, incluyendo el uso de productos sanguíneos si parece necesario.
La vía aérea es fundamental porque las embarazadas tienen más riesgo de hipoxemia por una disminución de su capacidad residual funcional y aumento del consumo de oxígeno. Las compresiones torácicas deben ser con la mano más cefálica que en mujeres no embarazadas (discretamente sobre el centro del esternón). Las vías venosas deben ser en extremidades superiores o cuello. En ausencia de vía venosa permeable algunos medicamentos pueden administrarse por el tubo endotraqueal (lidocaína, atropina, epinefrina).
- -
estimar la edad gestacional del feto.
- -
si el útero está a más de 4 dedos sobre el ombligo, iniciar a los 4 minutos de maniobras infructuosas la operación cesárea (perimortem) de modo de extraer al feto no mas allá de 5 minutos de ocurrido el paro. La extracción fetal puede favorecer la sobrevida materna. Estos tiempos recomendados se basan en que el daño cerebral irreversible puede ocurrir, en ausencia de embarazo, después de 4 a 6 minutos de anoxia, y las embarazadas se hacen anóxicas antes (76, 77).
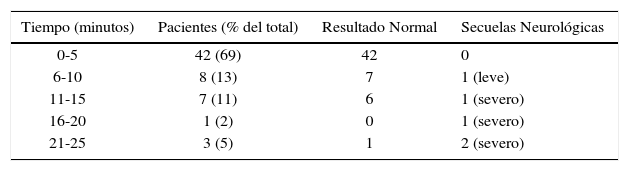
Si bien no existen estudios randomizados, la revisión de los casos reportados de cesárea perimortem entre 1900 y 1985 mostró que el resultado neonatal sin secuelas neurológicas era más probable cuando el parto había ocurrido dentro de los 5 minutos de ocurrido el paro cardiorrespiratorio. La evaluación posterior de casos entre 1985 y 2004 mostró lo mismo (9/12 sin daño neurológico), y, además, mejoría del resultado materno en 12 de 20 casos cuando el parto había ocurrido hasta 5 minutos después del paro (Tabla 8).
Resultado neonatal después del parto por cesárea perimortem
| Tiempo (minutos) | Pacientes (% del total) | Resultado Normal | Secuelas Neurológicas |
|---|---|---|---|
| 0-5 | 42 (69) | 42 | 0 |
| 6-10 | 8 (13) | 7 | 1 (leve) |
| 11-15 | 7 (11) | 6 | 1 (severo) |
| 16-20 | 1 (2) | 0 | 1 (severo) |
| 21-25 | 3 (5) | 1 | 2 (severo) |
La edad gestacional mínima para considerar una cesárea perimortem es controversial, pero la mayor parte de los centros terciarios considera actualmente 24 semanas.
La sugerencia para la cesárea es practicar una incisión vertical.
- -
Todas las medicaciones que se usan en el estado de no gravidez deben utilizarse en la mujer embarazada.
- -
Si a los 15 minutos no hay respuesta, iniciar masaje cardíaco directo si eso es posible.
- -
El manejo de arritmias ventriculares puede requerir defibrilación y las recomendaciones al respecto sin embarazo son las mismas para la condición de embarazo.
- -
No se recomienda la monitorización fetal durante la resucitación materna. Si la resucitación es exitosa, entonces se controla la frecuencia cardiaca fetal.
- -
Complicaciones de la resucitación cardiopulmonar a tener en mente: fracturas costales, hemotórax, hemopericardio, laceración y rotura de órganos internos e hipoxia fetal.
Resultado materno: Un estudio multicéntrico reportó los resultados en 55 mujeres con paro cardíaco durante el embarazo, incluyendo 12 mujeres sometidas a cesárea permimortem. Un 15% (8/55) de las mujeres sobrevivieron. Los casos sometidos a operación cesárea no tuvieron sobrevida mayor, si bien ninguno de esos casos fue en los primeros 5 minutos.
Los autores declaran no tener conflictos de interés, en relación a este artículo.