¿ Introducción
El síndrome hepatorrenal (SHR) se define como la insuficiencia renal funcional (en ausencia de daño del parénquima renal) y reversible, que ocurre en pacientes con insuficiencia hepática avanzada e hipertensión portal, que se debe a vasoconstricción severa de la circulación renal.1,2
De los pacientes con cirrosis y ascitis, 18% desarrollarán SHR a un año y 39% a cinco años.1 El desarrollo de SHR eleva significativamente la mortalidad en estos pacientes. Además es mayor el riesgo de complicación posterior al trasplante y menor la sobrevida posterior a cirugía. Es por ello que desde 2002 se introdujo el Model for Endstage Liver Disease (MELD), que toma en cuenta las cifras de creatinina sérica, como herramienta para dar prioridad a cada caso en la lista de trasplante hepático.1,2
¿ Fisiopatología del SHR
Los pacientes con cirrosis descompensada suelen cursar con hipertensión portal severa, principal responsable de las alteraciones hemodinámicas.3
También la translocación de bacterias aeróbicas desde la luz intestinal hacia los ganglios linfáticos mesentéricos, juega un papel importante en el deterioro de la función circulatoria. La translocación bacteriana y la endotoxemia resultante son responsables de estimular una respuesta pro-inflamatoria caracterizada por producción de citocinas como el factor de necrosis tumoral alfa (TNF-alfa) e interleucina-6 (IL-6); ello favorece la actividad de una sintasa de óxido nítrico (ON) inducible, tanto en células endoteliales como en músculo liso, así existe incremento en la producción de ON que favorece vasodilatación del lecho esplácnico.2
La severa vasodilatación del lecho esplácnico arterial condiciona la reducción intensa del flujo sanguíneo arterial efectivo, el cual no logra ser restituido a pesar de mecanismos contrarreguladores, como el incremento en el gasto cardiaco y el incremento del volumen plasmático. En la cirrosis avanzada, la activación de sistemas vasoconstrictores resulta un mecanismo compensador importante para mantener las resistencias vasculares sistémicas y la tensión arterial, sin embargo, en etapas tardías de la enfermedad estos mecanismos resultan deletéreos. La activación del sistema renina-angiotensina-aldosterona (SRAA), el sistema nervioso simpático (SNS) y en la etapa más tardía la hipersecreción no osmótica de hormona antidiurética se encargan de incrementar las resistencias vasculares sistémicas e inducen la retención de sodio y agua libre, de esta manera, conducen progresivamente a edema y ascitis, seguido de disfunción renal debida principalmente a vasoconstricción arterial renal e hipoperfusión.2,3
¿ Criterios diagnósticos
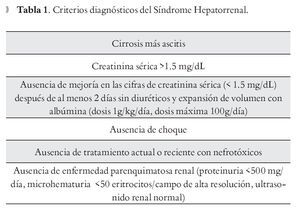
El Club Internacional de Ascitis en 2007 revisó los criterios para diagnóstico de SHR,4,5 considerando que deben cumplirse los incluidos en la Tabla 1.
Los criterios menores que apoyan el diagnóstico, pero no se consideran indispensables son: oliguria y sodio urinario <10 mmol/L.
En la actualidad, los pacientes con infección bacteriana concomitante y que cumplen criterios de SHR, deben iniciar terapia específica para SHR sin tener que esperar a que se resuelva el proceso infeccioso, esto ha demostrado mejorar el pronóstico en estos pacientes.6
La depuración de creatinina en orina de 24 horas no es una prueba recomendable para evaluar la función renal en pacientes cirróticos pues diversos estudios han demostrado que este método sobrestima la tasa de filtración glomerular, además de ser poco práctico.2
¿ Tipos de SHR
El SHR se divide en dos tipos de acuerdo al tiempo de evolución del mismo. La incidencia de SHR en pacientes cirróticos no ha sido bien estudiada. Un estudio de Ginés A y colaboradores que evaluó 234 pacientes cirróticos con ascitis, demostró que 18% desarrolló SHR tipo un a un año y 39% a cinco años de seguimiento.1 En un estudio de Sertsé y colaboradores, se dio seguimiento a una cohorte de 30 pacientes con ascitis refractaria, 83.3% de ellos desarrolló disfunción renal, de los cuales 53.3% cumplieron criterios para SHR tipo 2.7
El SHR tipo 1, se caracteriza por ser rápidamente progresivo, manifestándose por el incremento hasta el doble de la creatinina sérica inicial, la cual llega a valores mayores a 2.5 mg/dL en menos de dos semanas. La mortalidad es elevada, con una supervivencia media de 20% a dos semanas y tan sólo 10% a tres meses sin tratamiento. El SHR tipo 1 es frecuentemente precipitado por infecciones bacterianas, la más común es la peritonitis bacteriana espontánea (PBE).6,8
El SHR tipo 2, se caracteriza por ser lentamente progresivo, con cifras de creatinina entre 1.5 mg/dL a 2.5 mg/dL. La supervivencia media es de seis a 12 meses. El SHR tipo 2 está frecuentemente asociado con ascitis refractaria.6,8,9
Cabe mencionar que estos dos tipos no son excluyentes y pacientes con SHR tipo 2 pueden abruptamente desarrollar progresión a SHR tipo 1 en presencia de diversos factores precipitantes como son sepsis o hemorragia gastrointestinal.10
Algunos pacientes que cumplen criterios de SHR, no pueden ser categorizados propiamente en los tipos 1 o 2, pues cursan además con enfermedad renal aguda o crónica subyacente o cumplen criterios de SHR, pero éste se presenta en el contexto de pacientes sin cirrosis y que cursan con insuficiencia hepática aguda. Otros autores han propuesto categorizar a estos pacientes en dos grupos distintos: SHR tipo 3 cuando se cumplen criterios de SHR, aunado a enfermedad renal crónica (ejemplo: nefropatía diabética, nefropatía hipertensiva, glomerulonefritis crónica, etc.) o a daño renal agudo (ejemplo: necrosis tubular aguda). Es importante mencionar que en estos pacientes pueden coexistir las alteraciones circulatorias y hemodinámicas derivadas de la hipertensión portal que ya se han comentado, junto con alteraciones propias del daño renal intrínseco. Cuando la disfunción renal se presenta en el contexto de insuficiencia hepática aguda se ha propuesto categorizar a estos pacientes como SHR tipo 4.11-13
¿ Tratamiento del SHR
1. Medidas generales:
Es importante identificar oportunamente comorbilidades que puedan perpetuar o agravar la falla renal, tales como hemorragia gastrointestinal e infecciones bacterianas, estas últimas (en particular la PBE) suelen ser factores precipitantes de SHR tipo 1, por lo que es indispensable la pronta instauración de tratamiento antibiótico aunado al manejo específico del SHR.2
Se deben evitar fármacos nefrotóxicos, incluidos los diuréticos, ya que en presencia de insuficiencia renal los diuréticos ahorradores de potasio como la espironolactona pueden favorecer la hiperpotasemia y los diuréticos de asa como furosemide o bumetanida pueden ser ineficaces.2
Es importante evitar también la sobrecarga de líquidos que puede condicionar edema y ascitis. Es recomendable monitorizar la presión venosa central. Deberán vigilarse los signos vitales, la tensión arterial, la presión arterial media, el gasto urinario.14
En pacientes con ascitis a tensión es oportuno realizar una paracentesis terapéutica aunada a infusión de albumina intravenosa a dosis de seis a ocho gramos por cada litro de ascitis drenado. Si además existe hiponatremia se recomienda la restricción hídrica a un litro al día.15
2. Tratamiento médico específico:
2.1 Vasoconstrictores asociados a albúmina.
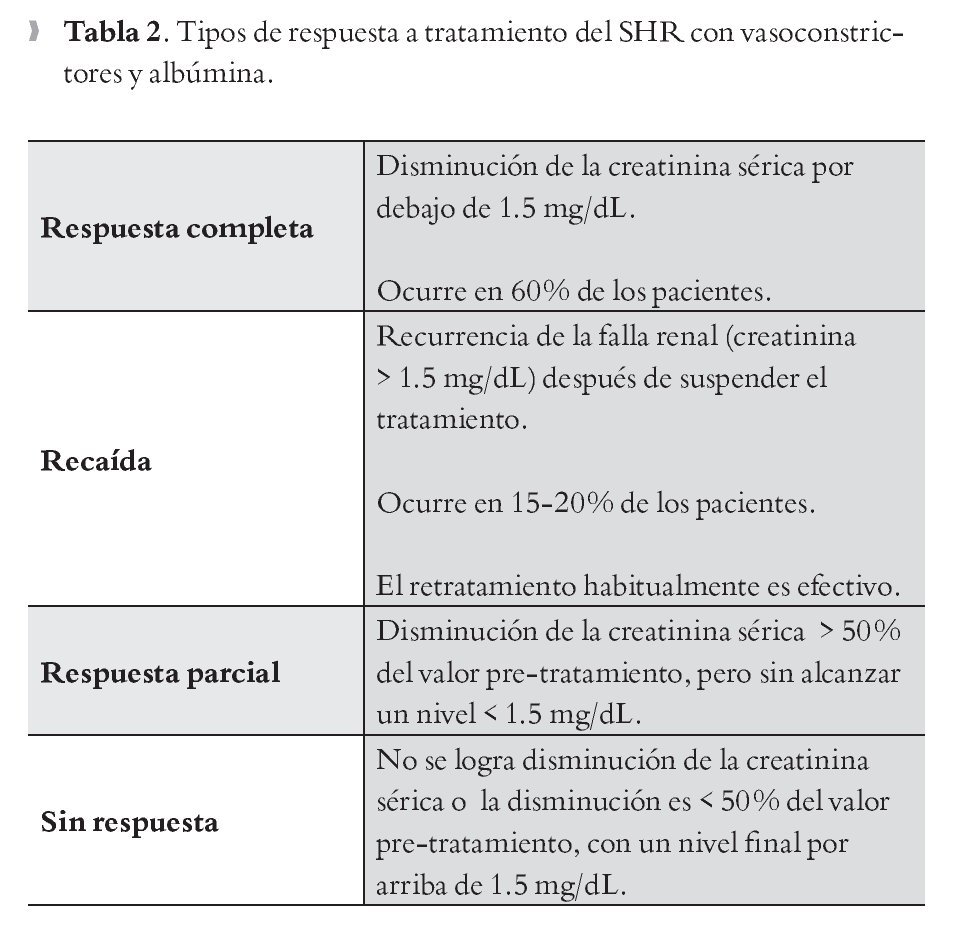
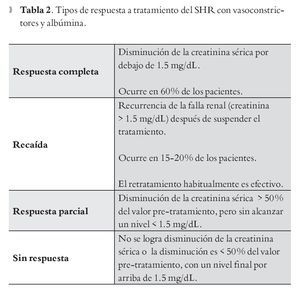
2.1.1 Análogos de vasopresina: Actúan a través de receptores V1a de vasopresina.11 Al unirse al receptor ejercen vasoconstricción del lecho esplácnico con lo cual mejoran el volumen sanguíneo arterial efectivo y el gasto cardiaco, seguido ocurre supresión del SRAA y del SNS, así se favorece la vasodilatación de la circulación renal y mejoría en la perfusión.2,16 Diversos estudios han demostrado su eficacia, se reporta que hasta 50% de los pacientes con SHR tipo 1 logran respuesta completa. El análogo de vasopresina más estudiado hasta ahora es la terlipresina, se recomienda iniciarla a dosis de 1mg en bolo intravenoso cada cuatro horas, deberá re-evaluarse la creatinina sérica al tercer día de tratamiento, si no se ha logrado disminución ≥ 25% respecto del valor basal, se recomienda aumentar la dosis hasta alcanzar 2 mg en bolo intravenoso cada cuatro horas. El tratamiento debe mantenerse hasta lograr la disminución de las cifras de creatinina sérica por debajo de 1.5 mg/dL, en general, entre uno a 1.2 mg/dL.
La mejoría en el gasto urinario, el incremento de la presión arterial y la mejoría en la concentración del sodio sérico son parámetros indirectos de respuesta al tratamiento. Se ha estimado que el tiempo promedio de respuesta son 14 días, sin embargo, este puede variar en función del nivel basal de creatinina. La recurrencia de SHR posterior a suspender el tratamiento es infrecuente y en general existe respuesta con el retratamiento.11,17-23
Un estudio reciente de Nazar y colaboradores, realizado en pacientes con SHR tipo 1, identificó como factores predictivos de respuesta a tratamiento con terlipresina y albúmina, valores de bilirrubina ≤10 mg/dL y el incremento ≥ 5 mm Hg en la presión arterial media al día tres de tratamiento.24
2.1.2 Norepinefrina: Es un agonista alfa-adrenérgico. Se recomienda a dosis inicial de 0.1 mcg/kg/ minuto en infusión intravenosa; debe lograrse el incremento de 10 mm Hg en la presión arterial media (PAM) respecto del valor basal, si esto no ocurre, se recomienda incrementar gradualmente la dosis (0.05 mcg/kg/minuto cada cuatro horas) hasta una dosis máxima de 0.7 mcg/kg/minuto.11 Otro esquema de tratamiento consiste en iniciar con dosis de 0.5 mg/ hora e incrementar hasta 3 mg/hora hasta lograr incrementar 10 mm Hg la PAM sobre los valores basales. La respuesta a tratamiento se evalúa monitorizando las cifras de creatinina sérica, siendo la meta llevar al paciente hasta niveles <1.5 mg/dL (se recomienda entre uno a 1.2 mg/dL).25
2.1.3 Midodrine y ocreótide: Resulta en conjunto un esquema de tratamiento efectivo. El midodrine es un agonista alfa-adrenérgico que se administra por vía oral, se recomienda a dosis de 7.5 mg tres veces al día, se puede incrementar hasta 12.5 mg tres veces al día. El ocreótide es un análogo de la somatostatina cuya función en el tratamiento del SHR es inhibir a los vasodilatadores endógenos, se administra a dosis inicial de 100 mcg por vía subcutánea cada ocho horas e incrementando la dosis hasta 200 mcg por vía subcutánea cada ocho horas si es necesario. Se recomienda lograr el aumento de la PAM en 15 mm Hg respecto del valor basal.26,27
2.1.4 Contraindicaciones para el empleo de vasoconstrictores: Hasta en 12% de los pacientes tratados con terlipresina, se han reportado efectos adversos isquémicos cardiovasculares.21 Son contraindicaciones para el uso de terlipresina u otros vasoconstrictores: coronariopatía, cardiomiopatías, arritmias cardiacas, insuficiencia cardiaca o respiratoria, hipertensión arterial, enfermedad cerebrovascular, enfermedad vascular periférica, asma o broncoespasmo, enfermedad hepática terminal, carcinoma hepatocelular avanzado, edad mayor a 70 años.11
2.1.5 Albúmina: Diversos estudios han demostrado mayor eficacia y respuesta al tratamiento cuando se asocian vasoconstrictores y albúmina en infusión, en comparación al uso de vasoconstrictores o albúmina en forma de monoterapia.21,22 Se recomienda una dosis de un gramo por kilo de peso (con una dosis máxima de 100 g/día) el primer día, seguido de 20 a 40 g/día en los días siguientes.2
Se han señalado cuatro tipos de respuesta al tratamiento del SHR con vasoconstrictores y albúmina4 (Tabla 2).
Fármacos que no han demostrado utilidad: No se recomienda el empleo de ocreótide en monoterapia, dopamina, fenoldopam, antagonistas de endotelina (tezosentan), péptidos natriuréticos (urodilantin, nesiritide), antagonistas de adenosina (teofilina).1
3. Cortocircuitos porto-sistémicos intrahepáticos transyugulares (Transjugular intrahepatic porto-systemic shunts, TIPS): Método de descompresión portal que consiste en la inserción de una prótesis intrahepática entre las venas porta y hepática a través de abordaje transyugular.15,28-30 Esto disminuye la presión portal y favorece el retorno de parte del volumen sanguíneo de la circulación esplácnica a la circulación sistémica, disminuyendo la cantidad de sangre en el lecho vascular esplácnico, así se suprime la actividad del SRAA y del SNS disminuyendo el efecto vasoconstrictor que ejercen en la circulación renal.11,15,28
Los TIPS han demostrado disminuir significativamente el gradiente de presión portal, además de mejorar significativamente la función renal hasta en 86% de los pacientes con SHR tipo 1, manifestado por disminución de la creatinina sérica y el nitrógeno ureico en sangre e incremento del filtrado glomerular y el flujo plasmático renal a 30 días posterior a los TIPS. Estos efectos en la mejoría en la función renal se han asociado con disminución significativa de la actividad de la renina plasmática, la norepinefrina y la aldosterona. La supervivencia media también mejoró, reportándose supervivencia de estos pacientes por más de tres meses posteriores a los TIPS.29
El uso de TIPS en SHR tipo 2 se ha asociado con mejoría en la función renal, mejor control de la ascitis y disminución en el riesgo de progresión a SHR tipo 1. Sin embargo no hay una diferencia en cuanto a la sobrevida cuando se comparan con las paracentesis repetidas con reposición de albumina intravenosa.30
Por otro lado, los TIPS no son inocuos, siendo los efectos adversos más frecuentes la oclusión del cortocircuito y el desarrollo de encefalopatía hepática (EH).29 La EH de novo o el empeoramiento de la EH previa ocurre en un tercio de los pacientes, pero se logra el control con lactulosa en 50% de ellos.30 Otras complicaciones menos frecuentes son punción transcapsular, hemorragia intraperitoneal, infarto hepático, fístula, hemobilia, sepsis, infección de los TIPS, hemolisis y migración de la prótesis.31 El incremento en el retorno venoso producido por los TIPS puede empeorar la disfunción cardiaca observada en el SHR.11
Las guías más recientes de la American Association for Study of Liver Disease (AASLD) publicadas en 2010 respecto al papel de los TIPS en el manejo de hipertensión portal consideran que en la actualidad se requieren de ensayos clínicos controlados comparativos con tratamiento médico, por lo que el empleo de TIPS en pacientes con SHR todavía no puede recomendarse. Su empleo sólo debe por el momento de considerarse en pacientes con SHR tipo 1 en el contexto de estudios de investigación.31,32
4. Soporte hepático artificial:
Varios sistemas de soporte hepático han sido evaluados para el tratamiento de la falla hepática y renal en conjunto. El sistema más estudiado es el Sistema de Recirculación Absorbente Molecular (MARS). Este sistema puede remover toxinas solubles en agua y unidas a albúmina, además proporcionan apoyo a la función renal y hepática.1
El sistema MARS se compone de tres circuitos: Sanguíneo con dializador capilar de alta permeabilidad, 600 ml de albúmina a 20% y hemodiafiltración veno-venosa continúa. Su función consiste en realizar una diálisis con baño de albúmina y membrana de poro de gran tamaño y posteriormente un tratamiento de hemodiafiltración convencional sobre la albúmina.33
Este tipo de sistemas pueden causar hipotensión durante el tratamiento, pero la presión arterial se normaliza o incrementa después de que se completa el tratamiento, una hipótesis para explicar este fenómeno es que durante el tratamiento se remueven mediadores vasodilatadores unidos a albumina. Además, inducen incremento en el índice de resistencia vascular sistémica y disminuyen la frecuencia cardiaca, el aporte de oxigeno y la extracción de oxígeno probablemente por el enfriamiento sanguíneo en el circuito extracorpóreo y la disminución del índice cardiaco. También se ha observado incremento de la cuenta de leucocitos, probablemente por la activación leucocitaria por el sistema extracorpóreo.1
Se requiere tratamiento anticoagulante en el circuito extracorpóreo para prevenir coagulación dentro del circuito, por lo que es necesaria la vigilancia estricta de los tiempos de coagulación para prevenir un incremento en el riesgo de sangrado.1
El MARS permite la recuperación transitoria de la función hepática hasta cierto punto.34 Remueve las sustancia unidas a albumina, incluyendo bilirrubinas, ácidos biliares, aminoácidos aromáticos, ácidos grasos de cadena media y citocinas.4 Ha mostrado mejorar la hemodinámica sistémica y reduce los niveles plasmáticos de renina en pacientes con SHR tipo I.30 Tales efectos resultan en mejoría clínica de la función renal y esto también produce un efecto positivo en la sobrevida a 30 días.34 Hay pocos datos sobre MARS en pacientes cirróticos con SHR y esos datos son controversiales.4 Los sistemas de apoyo hepático extracorpóreo han demostrado la capacidad de mejorar algunos parámetros bioquímicos. Un ensayo clínico controlado realizado por Mitzner y colaboradores,35 evaluaron el impacto respecto de la supervivencia a 30 días en pacientes con cirrosis (alcohólica, virus B, cirrosis biliar primaria y cirrosis biliar secundaria) con bilirrubina mayor a 15 mg/dL y que cursaban además con SHR tipo 1. Se incluyeron 13 pacientes, ocho de ellos recibieron tratamiento con MARS y hemodiafiltración; cinco pacientes recibieron sólo hemodiafiltración. Todos recibieron tratamiento médico estándar de acuerdo a las complicaciones presentadas (plasma fresco, concentrados eritrocitarios y plaquetarios, diuréticos, excepto en pacientes anúricos, expansión con albúmina, etc.). Se observó disminución de la bilirrubina y creatinina séricas, incremento en el sodio sérico y en la actividad del tiempo de protrombina que fueron significativas estadísticamente (p <0.01) en el grupo de MARS en comparación con el grupo que solo recibió hemodiafiltración. Además, la mortalidad fue significativamente menor en el grupo de MARS (75% vs. 100%, p <0.01). Sin embargo, son necesarios estudios adicionales para confirmar esos hallazgos y evaluar el impacto real de estos sistemas.30 MARS aún se considera un tratamiento experimental y su uso en pacientes con SHR tipo 1 no puede ser recomendado fuera de protocolos de investigación.31
5. Trasplante hepático:
Es el tratamiento definitivo del SHR. Muchos estudios han demostrado la resolución del SHR y la sobrevida a largo plazo después del trasplante, sin embargo hay un ligero incremento en la morbilidad y mortalidad perioperatoria comparado con los pacientes trasplantados sin SHR.11
Los pacientes con SHR tipo 1 frecuentemente alcanzan alta prioridad en la asignación de los órganos donados. A pesar de esto, frecuentemente no son trasplantados. El evento precipitante del SHR, como la PBE puede evitar el trasplante, además los pacientes se encuentran habitualmente extremadamente enfermos, con falla orgánica múltiple y el riesgo de la cirugía puede ser prohibitivo. Adicionalmente, en regiones con una lista de donadores muy corta el tiempo de espera de un donador puede ser insuficiente.11
Idealmente el trasplante hepático debe indicarse antes del desarrollo de SHR. La presencia de SHR se asocia con un incremento en la morbilidad y mortalidad temprana después del trasplante. Los pacientes con ascitis que más probablemente desarrollarán SHR son aquellos con sodio urinario muy reducido (<10 mEq/L), hiponatremia dilucional, hipotensión arterial, marcada activación del SRAA y el SNS. Es recomendable que los pacientes con esos signos sean evaluados para trasplante hepático.30
En contraste, el trasplante hepático puede ser más práctico y exitoso en los pacientes con SHR tipo 2 por la ausencia de factores precipitantes, su curso clínico prolongado y la falla renal relativamente menos grave.11
Las contraindicaciones más comunes para trasplante hepático en SHR son edad avanzada, alcoholismo activo e infección.30
En los pacientes con SHR, después del trasplante y por el estrés quirúrgico, el filtrado glomerular puede disminuir el uso de inmunosupresores. Muchos pacientes pueden requerir hemodiálisis (35% vs. 5% de los pacientes sin SHR).11 Los inhibidores de la calcineurina (ciclosporina y tacrolimus) pueden contribuir a la alteración del filtrado glomerular, se ha sugerido retrasar su administración hasta que ocurra la recuperación de la función renal, usualmente 48 a 72 horas posteriores al trasplante.34,36
Los pacientes con SHR presentan más complicaciones postrasplante; permanecen más tiempo en la unidad de cuidados intensivos y tienen mayor índice de mortalidad que los pacientes trasplantados sin SHR. La sobrevida a tres años es de 60% comparado con 70% a 80% de los pacientes trasplantados sin SHR.4,34
Es importante el tratamiento con vasoconstrictores y albúmina en los pacientes con SHR candidatos a trasplante hepático. El tratamiento del SHR tipo 1 con vasoconstrictores y albumina incrementa la sobrevida y el número de pacientes que alcanzan el trasplante y disminuye la morbilidad y mortalidad tempranas después de la cirugía.11,37 El trasplante combinado de hígado y riñón para pacientes con SHR no mejora los resultados finales obtenidos con el trasplante de hígado solo y por tanto, no se recomienda.30
¿ Prevención del SHR
Se deben identificar y tratar los procesos infecciosos con el fin de disminuir el riesgo de SHR. En estudios recientes se ha demostrado que la administración de norfloxacino como profilaxis de PBE, reduce las probabilidades de SHR a 28% comparado con 41% en los controles a un año de seguimiento.11
La administración de albúmina previene el SHR en pacientes con PBE. Los casos que reciben albúmina a dosis de 1.5 g/kg en el día cero (al momento del diagnóstico de PBE) y 1 g/kg en el día tres, muestran una reducción de 66% en la incidencia de SHR, una disminución significativa de los ingresos hospitalarios (10% vs. 29%) y de las tasas de mortalidad a tres meses (22% vs. 41%).4,9
Un estudio realizado en la India, encontró que la administración de pentoxifilina 400 mg tres veces al día a pacientes con hepatitis alcohólica aguda grave, se asocia con disminución en la incidencia de SHR y la mortalidad intrahospitalaria comparados con los pacientes que recibieron prednisolona.38 Se requieren estudios adicionales para validar estos hallazgos.
¿ Controversias y perspectivas a futuro
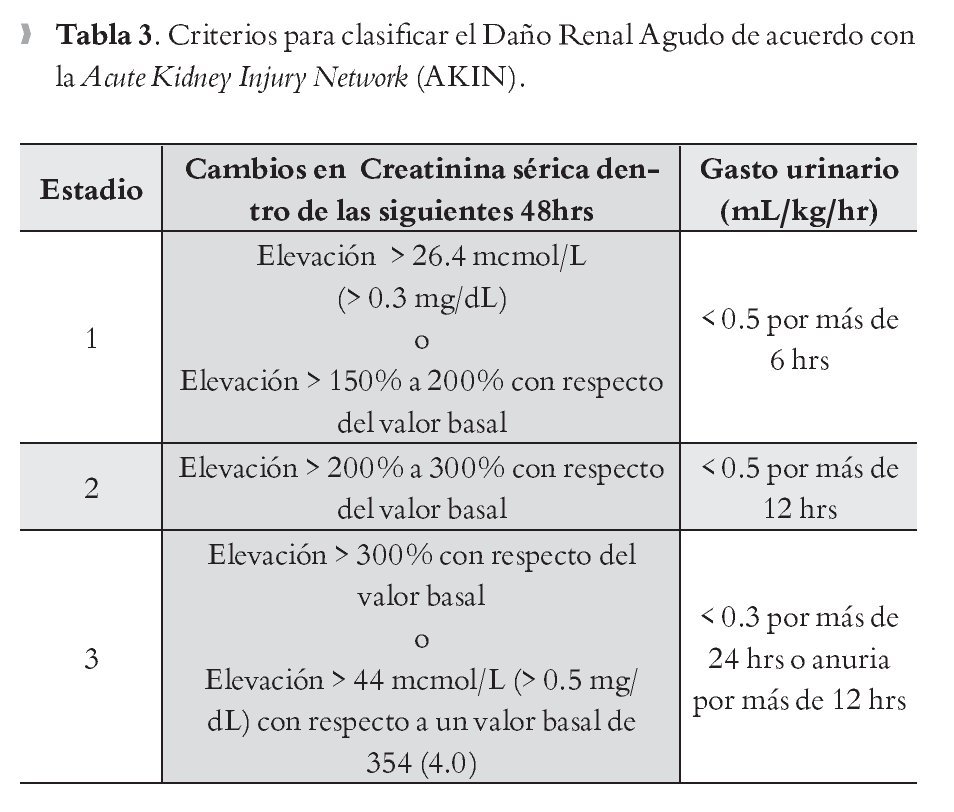
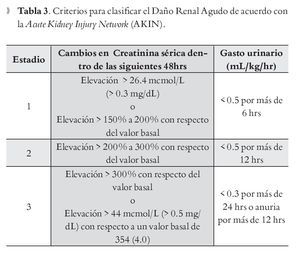
Los criterios para definir al SHR están en constante revisión. Es reconocido que la creatinina sérica es un marcador de pobre valor para estimar la función renal en pacientes con cirrosis. La definición de SHR se basa en un valor arbitrario de creatinina sérica, pero no se toma en cuenta que los pacientes cirróticos suelen cursar con cifras basales menores de creatinina. En consecuencia, pacientes con cirrosis pueden ya cursar con pérdida de hasta 50% de la función renal, antes de que se les catalogue como SHR. La clasificación más reciente de la Acute Kidney Injury Network (AKIN) toma en cuenta el valor basal de creatinina sérica del paciente para catalogarlo como portador de daño renal agudo, algunos autores consideran que esta clasificación podría ser más precisa y objetiva para clasificar a los pacientes con SHR (Tabla 3). Nuevos biomarcadores de daño renal agudo resultan muy prometedores, como son cistatina-c, lipocalin gelatinasa sérica del neutrófilo, molécula urinaria de daño renal-1 e interleucina-18; ellos han demostrado superioridad pues detectan daño renal agudo antes que ocurra la elevación en los niveles de creatinina, así un diagnóstico más temprano podría mejorar el pronóstico en estos pacientes.39
Por otra parte, en el mundo es cada vez mayor el número de pacientes que desarrollan cirrosis por diversas causas, así que es esperado que con mayor frecuencia nos enfrentemos a pacientes que cursan con complicaciones derivadas de la descompensación de la cirrosis. Este desarrollo de SHR, impacta importantemente en la sobrevida, por lo que el reconocer oportunamente esta entidad para iniciar su tratamiento, puede impactar en la sobrevida del paciente con cirrosis. A pesar de los avances en el tratamiento del SHR todavía un porcentaje significativo no responde o responde de forma parcial al tratamiento con vasoconstrictores y albúmina, de ahí que sea necesario explorar otras opciones de tratamiento para mejorar la calidad de vida y disminuir la mortalidad en este tipo de pacientes. Como se comentó previamente, hay opciones prometedoras -como la colocación de TIPS y los sistemas de apoyo hepático artificial como el sistema MARS- que aún requieren ser exploradas en el contexto de ensayos clínicos antes de poder recomendar su empleo en la práctica clínica, sin embargo, representan un gran avance respecto del manejo del paciente cirrótico con SHR como "puente" al trasplante hepático.
¿ Agradecimientos
María de Fátima Higuera de la Tijera, realiza trabajo de investigación en el área de Hepatología, en el Hospital General de México y en el Laboratorio de Hígado, Motilidad y Páncreas (HIPAM) de la Facultad de Medicina de la UNAM, con apoyo del "Estímulo Ángeles Espinosa Yglesias 2010" que otorgan FUNSALUD AC, Fundación AMPARO y FUNDHEPA AC, México.
Correspondencia: Gastroenterología-107, Calle Dr. Balmis Nº 148, Col. Doctores, Del. Cuauhtémoc, C.P. 06726, México D. F.
Teléfono: 27 89 2000. Extensiones: 1047, 1048 y 1706.
Correo electrónico:fatimahiguera@yahoo.com.mx, josluiperez@hotmail.com