El cáncer de ovario es la neoplasia ginecológica que presenta mayor letalidad, debido a que tiene pocos síntomas en etapas iniciales y a la presencia de mecanismos que obstaculizan el tratamiento con cisplatino y carboplatino. Estos mecanismos involucran genes que participan en los procesos de apoptosis, proliferación y protección celular, ejemplo de ello son los miembros de la familia de NF-kB/IKK, genes que a últimas fechas se han asociado a la baja respuesta a la quimioterapia y a cánceres ováricos agresivos (Tipo II).
Ovarian cancer is the gynecologic malignancy with higher lethality due to its prolonged asymptomatic preclinical stage and the presence of mechanisms that hinder treatment with cisplatin and carboplatin. These mechanisms involve genes related to the processes of apoptosis, cell proliferation and protection, such as the NF-kB/IKK family members, that have been associated with poor chemotherapy response and with a most aggressive ovarian cancer (Type II).
El cáncer de ovario representa la octava neoplasia más recurrente en las mujeres y es el segundo cáncer ginecológico más común, siendo éste el responsable de aproximadamente 140.000 muertes al año en todo el mundo. En México, en el 2003 se registraron más de 4,000 casos nuevos y representó la cuarta causa de muerte por cáncer en la población femenina. La edad promedio en la que ésta enfermedad se presenta mayoritariamente oscila entre los 50 y los 70 años de edad1,2.
Actualmente los carcinomas de ovario se clasifican como: tumores Tipo I, que son neoplasias de crecimiento lento, estables genéticamente y que tienen como precursores a los tumores de Borderline y tumores ováricos Tipo II, que se caracterizan por ser carcinomas genéticamente inestables y con alto grado de metástasis3.
Recientemente se han realizado estudios a nivel molecular, en los cuales ha sido posible detectar a distintos factores de transcripción que participan en el origen, el desarrollo y la resistencia al tratamiento con quimioterapia en cáncer de ovario. Dentro de estos factores es posible mencionar a los miembros de la familia de NF-kB, que está constituida por cinco proteínas RelA, RelB, RelC, p52 y p50 y que tienen un papel fundamental en el crecimiento, proliferación, diferenciación y muerte celular. Sin embargo, aun cuando se conoce la función protectora y antiapoptótica de NF-kB, su sobreexpresión está íntimamente relacionada con el desarrollo, metástasis y la baja respuesta al tratamiento con quimioterapéuticos y radiación ionizante4–7.
Clasificación histológica del cáncer de ovarioEntre los cánceres ginecológicos, el cáncer de ovario es una de principales causas de muerte en los países desarrollados. Esta neoplasia se caracteriza por su alta tasa de mortalidad que es causada por su detección en etapas avanzadas con un mal pronóstico. El pronóstico depende fundamentalmente del tipo histológico, originándose el 85% de estas neoplasias en el epitelio que cubre la superficie del ovario y el 15% restante, a partir del estroma y de las células germinales8,9 (tabla 1).
Clasificación histológica del cáncer de ovario
| Clasificación | Benigno | Maligno |
|---|---|---|
| Tumores epiteliales | I. Cistoadenoma cerosoII. Cistoadenoma mucinosoIII. Cistoadenofibroma serosoIV. Cistoadenofibroma mucinosoV. Tumores de Brenner | I. Cistoadenomacarcinoma serosoII. Cistoadenomacarcinoma mucinosoIII. Cistoadenomacarcinoma de células clarasIV. Cistoadenomacarcinoma endometroideV. Tumor Mülleriano mixto |
| Tumores germinales | I. FibromaII. FibrotecomaIII. Tecoma | I. Tumor del seno endodérmicoII. Disgerminoma |
| Tumores del estromagonadal | I. TeratomaII. Quiste dermoide | I. Tumor de células de la granulosa |
| Tumores de bajopotencial maligno(Borderline) | I. Cistoadenocarcinoma Borderline serosoII. Cistoadenocarcinoma Borderline mucinosoIII. Cistoadenofibroma Borderline |
Adaptada de Cuello et al.10
La carcinogénesis ovárica como muchos tipos de cáncer implica múltiples alteraciones genéticas, aunque la mayoría de los casos de cáncer de ovario son consecuencias de mutaciones esporádicas, aproximadamente el 10% se atribuye a una predisposición familiar. Recientemente se ha demostrado que la mutación o la pérdida de la función de los genes supresores de tumor BRCA1 y BRCA2 están asociados cánceres ginecológicos como el de mama y ovario11,12.
Sin embargo a pesar de ser una enfermedad variable e inestable genéticamente existe una clasificación molecular que permite diferenciar y proporcionar un mejor diagnóstico:
Tumores Tipo I Tumores clínicamente indolentes y estables genéticamente. Tienen una baja tasa de incidencia. Los tumores de tipo I, incluyen tumores serosos de bajo grado, endometrioides de bajo grado, tumores de células claras y carcinomas mucinosos13.
Las mutaciones que pueden llegar a presentar están en la tabla 2.
Estadificación del cáncer de ovario según la clasificación de la FIGO
| Tipo de tumor | Mutación |
|---|---|
| Carcinomas cerosos de bajo grado | Mutaciones específicas en KRAS, BRAF, y ErbB2. |
| Carcinomas endometrioides de bajo grado | Aberraciones en la vía de señalización Wnt |
| Carcinomas mucinosos de bajo grado | Mutaciones en KRAS en el 50% de los casos |
| Carcinomas de células claras | Mutaciones PIK3CA |
| Tumores Tipo II: Tumores altamente agresivos, con tasas de incidencia elevada, regularmente se detectan en etapasavanzadas y poseen un alto grado de inestabilidad genética, es decir la mutaciones que pueden llegar a presentar son pococonocidas. Dentro de las mutaciones que se pueden encontrar en estos tumores están: | |
| Tipo de tumor | Mutación |
| Carcinoma seroso de alto gradoCarcinoma endometrioide de alto gradoTumores mesodérmicos mixtos malignosCarcinomas indiferenciados | Mutación en Tp53 en el 80% de los casos y la amplificación de la CCNE. |
| Estadios del cáncer de ovario | |
| Estadio | Características |
| I | Tumor limitado a los ovarios• IA: Crecimiento limitado a un ovario, ningún crecimiento superficial,cápsula intacta.• IB: Crecimiento limitado a ambos ovarios• IC: Afectación superficial, rotura capsular, ascitis maligna, lavados positivos. |
| II | Tumor que involucra a un ovario o ambos con extensión pélvica, implantes oambos.• IIA: Extensión al útero o a las trompas de Falopio.• IIB: Extensión a otros tejidos pélvicos (incluido al rectosigma)• IIC: Afectación superficial, rotura capsular, ascitis maligna, lavados positivos. |
| III | Involucra a uno o ambos ovarios con implantes peritoneales, microscópicamenteconfirmados afuera de la pelvis. Y se realiza la siguiente clasificación:• IIIA: Metástasis peritoneal microscópica más allá de la pelvis.• IIIB: Metástasis peritoneal macroscópica más allá de la pelvis de 2cm omenos.• IIIC: metástasis peritoneal macroscópica más allá de la pelvis de más de 2cm o metástasis a los ganglios linfáticos regionales. |
| IV | Tumor con metástasis a distancia. |
La detección oportuna del cáncer de ovario no ha tenido éxito, debido a que el origen y patogénesis es poco conocida, además de que los signos y síntomas clínicos son inespecíficos y se presenta asintomático de manera inicial, lo cual dificulta su detección en etapas tempranas. El 75% de las pacientes con éste tipo de cáncer se presenta con una enfermedad avanzada en estadio III o IV asociado a un mal pronóstico y una supervivencia global media de 24 a 60 meses11,13,16–18.
Sin embargo es importante mencionar los métodos de diagnóstico que actualmente se emplean para detectar el cáncer ovario.
Diagnóstico por síntomas clínicosEl diagnóstico clínico se inicia regularme considerando los síntomas ginecológicos: sangrado y/o flujo vaginal, prolapso, masa abdominal, hinchazón generalizada y dolor abdominal o pélvica; los síntomas gastrointestinales: dificultad para deglutir, plenitud abdominal, nauseas, diarrea y estreñimiento y los síntomas urinarios: poliuria15,19–21.
Antígeno CA-125El antígeno CA-125 es una glicoproteína que se encuentra en mayor concentración en células neoplásicas incluyendo el cáncer de ovario. Se ha documentado que la utilidad clínica de los niveles en suero del antígeno CA-125 en el manejo de pacientes con cáncer de ovario avanzado está “bien establecida”, ya que un incremento sostenido en el valor de este antígeno se considera como un indicador fiable de la progresión de esta enfermedad. Sin embargo, no existen evidencias claras de que los niveles séricos de antígeno CA- 125 proporcionen datos sobre la evolución clínica a corto plazo, además el empleo del antígeno CA-125 es poco útil para el diagnóstico de cáncer de ovario. Adicionalmente es importante mencionar que no solo los procesos neoplásicos producen altas concentraciones de antígeno CA-125, también existen otras condiciones que pueden mostrar un comportamiento similar tales como: las infecciones en el abdomen y en el pecho, la menstruación, el embarazo, los tumores benignos del ovario y las enfermedades hepáticas, proporcionándole al antígeno CA-125 un alto grado de especificidad21–23.
Proteína humana del epidídimo 4 (HE4)La proteína del epidídimo humano 4 (HE4) es una proteína de 11kDa, precursora de la proteína secretora del epidídimo E4, que se expresa en concentraciones bajas en una amplia diversidad de tejidos normales incluyendo el epitelio de tejidos respiratorios y reproductivos. Se encuentra sobrexpresada en carcinomas ováricos y puede ser detectada en el suero mediante ELISA con una sensibilidad similar a la de CA-125 y con una mayor especificidad para las enfermedades malignas. También se puede detectar en orina con un nivel de especificidad del 94.4%24–26.
EcografíaEl estudio ecográfico es indispensable en ginecología y está considerado como un valioso instrumento de diagnóstico en el cáncer de ovario. Puede hacerse de dos formas transabdominal y transvaginal. La primera permite detectar la extensión y tamaño de masas ováricas, la presencia ascitis y la metástasis a otros órganos abdominales. La ecografía transvaginal es una técnica imagenológica que se realiza con escaneos lineales o sectoriales y que permite, por la proximidad de la cabeza vaginal al ovario, obtener imágenes ováricas mucho más precisas, lo cual a su vez facilita el descubrimiento de tumoraciones ováricas muy pequeñas. El uso de la ecografía transvaginal posee múltiples ventajas porque permite detectar el cáncer de ovario en un estadio temprano y nos proporciona un diagnóstico más específico que la determinación sérica de CA-125, razón por la cual la ecografía transvaginal es un componente importante en la detección de cáncer de ovario27–29.
Test de la mutación BCRA1 y BCRA2BCRA1 y BCRA2 fueron identificados en 1994 y 1996 respectivamente, como genes implicados en el desarrollo de cáncer de mama y de ovario, ya que se han observado mutaciones de estos genes en pacientes con cáncer de mama y ovario con historia familiar múltiple, sin embargo, la identificación de mutaciones se ha visto obstaculizada por el gran tamaño de los genes BCRA1 y BCRA2 y la frecuente aparición de mutaciones únicas. Actualmente no existe una explicación bien establecida de la relación existente de las formas mutadas de BCRA1 y BCRA2 y el desarrollo de cáncer de mama y ovario específicamente, aunque se piensa que los niveles de estrógeno están involucrados en la expresión de estos genes. Por tales razones los genes BCRA1 y BCRA2 representan un nuevo enfoque genético para identificación de mujeres de alto riesgo a desarrollar cáncer de mama y ovario30–34.
Tratamiento empleado en cáncer de ovarioEl tratamiento inicial estándar consiste en una cirugía radical o de citoreducción seguido de la quimioterapia. Los quimioterapéuticos de primera línea en el cáncer de ovario son usualmente los compuestos platinados (cisplatino, carboplatino, oxiplatino) y el empleo de taxanos (paclitaxel). En pacientes que presentan resistencia al cisplatino, los fármacos de elección son: topotecan y doxorubicina liposomal. Otros agentes citotóxicos son docetaxel, gemcitabina, etopósido y vinorelbina. Como agentes antiangiogénicos se utiliza principalmente bevacizumab35,36.
Vías de acción de fármacos utilizados en el tratamiento de cáncer de ovarioMecanismo de acción de compuestos platinadosHasta ahora existen tres compuestos platinados de amplio uso en la terapia contra el cáncer: el cisplatino, carboplatino y oxaliplatino. De los cuales el cisplatino y el carboplatino han dominado en la terapia contra el cáncer de ovario. El cis- diaminodicloroplatino(II) o cisplatino es un fármaco capaz de dañar al ADN, formando aductos que incluyen entrecruzamientos entre proteínas del ADN, monoaductos y entrecruzamientos inter e intracatenarios. Estos aductos inhiben las ADN y ARN polimerasas, interfieren con la división celular y la muerte celular programada. El carboplatino tiene dos grupos amino en configuración cis y forma aductos similares a los del cisplatino, sin embargo, carboplatino es más estable y menos reactivo que el cisplatino debido a que el 1,1-ciclobutanodicarboxilato grupo de carboplatino es mucho menos lábil que el cloruro de cisplatino, dando como resultado una menor respuesta37–41.
La reactividad del cisplatino está influenciada por la concentración de cloruros al interior y exterior de la célula, al exterior de la célula hay una concentración 100mM y el cisplatino es relativamente menos reactivo, en contraste en el interior de la célula hay una concentración de 2 a 30mM, elevando la actividad del cisplatino. El cisplatino se administra por vía intravenosa, una vez en la circulación sanguínea, una fracción se une a proteínas plasmáticas, principalmente por aquellas que poseen grupos tioles; el cisplatino que queda de manera libre se internaliza a la célula por medio de difusión pasiva, ya dentro de la célula al haber una baja concentración de cloruros, uno de sus átomos de cloro es sustituido por una molécula de agua formando el catión [Pt(H2O)2(NH3)2]2+, esta especie diaquo, es muy reactiva hacia los centros nucleofílicos de biomoléculas por ejemplo las purinas del ADN, debido a que el H2O es mejor grupo saliente que el Cl-39 (fig. 1).
Mecanismo de acción de los inhibidores de la aromatasaMuchos canceres ginecológicos como el cáncer epitelial de ovario expresan receptores de hormonas, lo cual ha llevado a establecer un tratamiento con diversas manipulaciones hormonales incluyendo la inhibición de la aromatasa42.
La aromatasa es una enzima de la súper familia del citocromo p450, codificada por el gen CYP19A1, capaz de convertir a los andrógenos en estrógenos, por lo cual la expresión de ésta en el epitelio del ovario, da lugar a un aumento local de los estrógenos a partir de andrógeno como sustrato. Se ha observado que uno de los precursores de estrógenos, androstenediona tiene un papel importante en el desarrollo de cáncer de ovario, principalmente en mujeres postmenopáusicas43–46.
En base a estas evidencias es importante mencionar que hoy en día se cuenta con distintos fármacos encaminados a inhibir la función de esta enzima, tales como exemestano (aromasin) y los triazoles, anastrozol (Arimidex) y letrozol (Femara)45.
Mecanismo de acción de los taxanosLa combinación de un taxano como (paclitaxel y el docetaxel) y un compuesto platinado se ha convertido en el tratamiento de elección para el cáncer de ovario primario, demostrando una alta tasa de efectividad. Los taxanos tienen la capacidad de estimular la fosforilación de Bcl-2, una proteína que es parte del mecanismo de apoptosis en muchas células cancerosas, la fosforilación de Bcl-2 inhibe sus efectos anti-apoptóticos y conduce a la muerte celular programada47.
Mecanismo de acción antiangiogénicosLa angiogénesis es el proceso mediante el cual se forman nuevos vasos capilares a partir de los ya existentes, se produce principalmente en condiciones específicas como la cicatrización de heridas, la inflamación y el desarrollo del cuerpo lúteo en el ciclo menstrual, pero también en condiciones patológicas como el cáncer de ovario, promoviendo el crecimiento, la progresión del tumor y la diseminación metastásica48–50.
En las últimas décadas se ha implementado el uso de agentes antiangiogénicos, tales como el bevazicumab el cual es un potente inhibidor de la citocina proangiogénica VEGF-A, miembro de la familia VEGF (factor de crecimiento endotelial vascular), citocinas que tienen la capacidad de generar la neovascularización y crecimiento tumoral51.
Cáncer y su asociación con la familia NF-kBLas proteínas de la familia de NF-κB son conocidas por regular diversos procesos biológicos como el crecimiento y la supervivencia celular, el desarrollo de tejidos y órganos, la inflamación y la respuesta inmune innata por estimular la expresión de citoquinas, receptores de citoquinas y genes de histocompatibilidad. En contraste, la sobreexpresión de NF- κB se ha asociado a múltiples padecimientos como las enfermedades autoinmunes, la inflamación crónica, procesos neurodegenerativos, desordenes metabólicos y cáncer52.
NF-κB puede actuar como un oncogén a través de su capacidad para estimular la proliferación y supervivencia celular y se ha demostrado que se activa de manera constitutiva en distintos canceres humanos y ha sido propuesto como un importante vínculo entre la inflamación y el desarrollo de cáncer53.
Cáncer de ovario asociado a proteínas de NF-kBEl factor nuclear NF-κB se ha encontrado en diversos tipos de tejidos y se ha estudiado ampliamente en el desarrollo de neoplasias linfoides. Sin embargo, se ha identificado la presencia de actividad constitutiva en tumores de origen epitelial, incluyendo el cáncer de mama, colon, pulmón y ovario. Existe evidencia de que NF-κB tiene un papel fundamental en la carcinogénesis ovárica, ya que se ha observado la sobrexpresión de proteínas específicas de esta familia, tales como IKKε en cultivos primarios de cáncer de ovario y se le ha asociado a este oncogén la resistencia al cisplatino5,54–56.
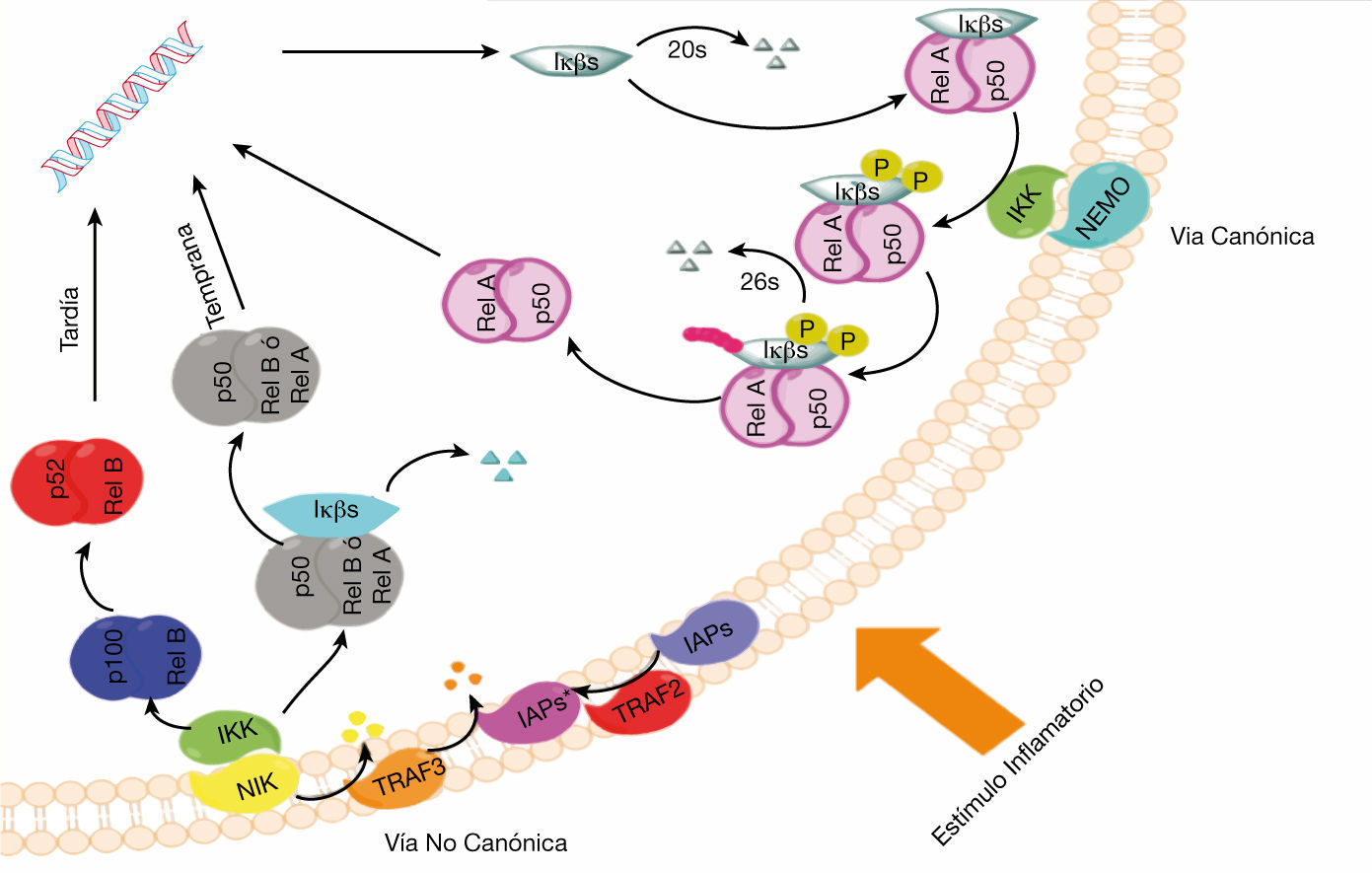
Proteínas NF-kBEn los mamíferos la familia de NF-κB está constituida por cinco proteínas, RelA, c-Rel, RelB, que se sintetizan en forma madura y por NFκB1 y NFκB2 cuyas proteínas precursoras p105 y p100 son sometidas a un proceso de proteólisis para obtener sus formas maduras p50 y p52 respectivamente. Estas proteínas comparten un dominio de homología Rel (RHD) que media su unión con el ADN y la formación de homodímeros y heterodímeros57,58.
Se conocen también sus inhibidores IκBs, que incluyen a las subunidades IκBα, IκBβ, IκBε, IκBγ y Bcl-3, estas proteínas se caracterizan por la presencia repetida de anquirinas mismas que median la interacción de NF-κB con el ADN vía RHD. Su fosforilación y la ubiquitinación, son dos importantes señales para su degradación en el proteasoma 26 y la posterior liberación de los dímeros de NF-κB57.
Finalmente sus quinasas activadoras IKK, que constan de cuatro subunidades catalíticas IKKα, IKKβ, IKKε y una subunidad reguladora IKKγ o NEMO (modulador esencial de NF-κB) que se requiere para la activación de IKKα/IKKβ en respuesta de citoquinas inflamatorias como el TNF-α y IL-159,60.
Vías de señalizaciónExisten dos vías de señalización para la activación de NF-κB:
Vía canónicaLa vía clásica o canónica, se define como la vía de activación de NF-κB mediada por IKKγ o NEMO. Se activa por prácticamente todos los estímulos que afectan a NF-κB como RANKL, TNF-α y citoquinas inflamatorias. Esta vía regularmente conduce a la activación de dímeros que contienen a p65 o cRel. La activación de esta vía, inicia tras un estímulo principalmente inflamatorio, que activa a NEMO lo cual resulta en la activación de IKKα/IKKβ, fosforilando a IkBα IkBβ e IkBε lo que desencadena la liberación de los dímeros de RelA/p50 y su posterior translocación al núcleo para generar la expresión de genes antiapoptóticos6,61–63.
Vía no canónicaLa activación de la vía no canónica de NF-κB es independiente de NEMO, ya que ésta depende principalmente de un conjunto de proteínas que se encuentran aguas arriba de la vía de señalización que implican a los inhibidores celulares de apoptosis cIAP1 y cIAP2, TRAF2 y TRAF3 y NIK. La vía no canónica inicia regularmente con la activación de cIAP1/2 mediada por TRAF2, lo que tiene como consecuencia la degradación de TRAF3, lo cual estabiliza los niveles y la función de NIK que a su vez activa a IKKα, quinasa que induce a la degradación de IKβ, liberando a los dímeros de p50/RelA generando la expresión temprana de genes o bien catalizando la proteólisis de p100 a la forma madura p52, para formar dímeros de p52/Relb6,7,64,65 (fig. 2).
FinanciamientoNo se recibió fnanciamiento para la realización de éste trabajo.
Conflicto de interesesNo se declara conflicto de interés.