La transformación de los ambientes naturales hacia ambientes manejados como cultivos o pastizales conlleva un impacto directo en la abundancia de las especies que ahí habitan. Se ha registrado que algunos cultivos, como los cafetales de sombra diversificada tienen un menor efecto en la abundancia de las especies y que incluso pueden incrementar su abundancia. En un mosaico de cafetales diversificados y bosques nativos en el Soconusco chiapaneco, se evaluó la abundancia por mes, utilización del hábitat, microhábitat y hora de actividad en la lagartija Ameiva undulata en, durante noviembre del 2000 a abril del 2002. La abundancia más alta fue registrada en febrero. La mayoría de organismos se observó en cafetales de sombra diversificada y en microhábitats asociados a la hojarasca. A lo largo del día, la mayor actividad se registró de las ll:00 a 12:00h, seguida por un decremento continuo en el nivel de actividad hasta las 18:00h. Los resultados indican que esta lagartija presenta una mayor abundancia en ambientes con insolación y perturbación media, condiciones que están poco representadas en ambientes conservados como los bosques mesófilos y las selvas medianas, o bien, en ambientes altamente transformados y sin sombra como los pastizales.
The transformation of complex native habitats through simpler and managed habitats like crops or grasslands implies a direct effect on species abundance. Agrosystems like diversified shade coffee crops (commonly named rustic cafetales) have been described as suitable habitats or refuge for many vertebrate species, which enhance or increase abundance of some vertebrate species. From November 2000 to April 2002 we evaluated monthly abundance, habitat use, microhabitat use, and time of activity along the day in the teiid lizard Ameiva undulata. The study was conducted in a landscape composed by coffee crops, gallery forests, and native forest in the Chiapas Soconusco. The highest record of abundance by month was recorded in February. Most lizards were observed in diversified shade coffee crops, associated to leaf litter. Along the day, the highest activity reported was from 11:00 to 12:00h, followed by an activity decline through 18:00h. Our results indicated that A. undulata showed higher abundance in habitats with middle sun radiation and middle perturbation and is poor represented in native habitats like cloud forest and rain forest, or in the more disturbed habitats like grasslands.
La transformación de los ambientes naturales por perturbaciones naturales o antropogénicas tiene efectos directos en la dinámica de las poblaciones que ahí habitan (Karr y Fremark, 1985; Primack, 2002). Se ha propuesto que la perturbación intermedia fomenta el aumento de la diversidad y la abundancia de algunas especies (Paine y Levin, 1981), lo que se ha documentado en algunos tipos de agrosistemas como los cafetales (Moguel y Toledo, 1996; 1999; Perfecto et al., 1996; Macip-Ríos y Casas-Andreu, 2008; Moguel, 2010). Esta información ha sido útil para considerar a los cafetales como ambientes que fomentan la conservación. Sin embargo, la mayoría de los trabajos empíricos se han enfocado hacia los estudios de los diferentes niveles de diversidad (Greenberg et al., 1997; Rendón et al., 1998; Cruz-Lara et al., 2004; Macip-Ríos y Muñoz-Alonso, 2008).
Por lo general, en los ensambles de especies o comunidades existen muchas especies raras, algunas comunes y muy pocas muy abundantes (Magurran, 2004). En estos patrones de distribución de la abundancia tiene mucho que ver la historia natural y la ecología de cada especie, así como las condiciones del hábitat, es decir, la disponibilidad y oferta de recursos específicos para cada especie (Brown, 1984), y la capacidad de las especies para explotar estos recursos (Pianka, 1986, 1993). El presente estudio se enfocó en determinar la abundancia a lo largo de un año en diferentes localidades y hábitats, así como el uso de microhábitat y la hora de actividad en un paisaje transformado en el Soconusco chiapaneco por la lagartija Ameiva undulata.
La lagartija A. undulata es común en los bosques del trópico de México. Geográficamente se distribuye desde México hasta Costa Rica a través de la vertiente del Pacífico y desde el estado de Tamaulipas en el golfo de México hasta Nicaragua a lo largo de la vertiente del Atlántico. Altitudinalmente se encuentra de los 0 a los 2 000m snm (Gehlbach y Collette, 1957; Lee, 1996; Campbell, 1998). A. undulata es la representante de su género que habita más al norte, ya que la mayoría de las especies se distribuyen en latitudes meridionales. En México es común encontrarla en los bosques tropicales, tanto húmedos como secos, además, es una especie importante en la composición faunística de los cafetales (Macip-Ríos y Muñoz-Alonso, 2008).
Ameiva undulada es ovípara y tiene una reproducción estacional (Savage, 2002) como otras especies del mismo género (Rodríguez-Ramírez y Lewis, 1991; Vitt y Colli, 1994; Censky, 1995). Alcanza la madurez sexual a los 4 meses de edad (Lee, 1996). Los integrantes del género Ameiva se consideran heliofílicos (Hirth, 1963), es decir, necesitan de fuerte insolación para regular su temperatura de forma eficiente, esto lo logran de manera activa por un comportamiento de “switching” o cambio, el cual implica el paso del sol a la sombra y viceversa para mantener la temperatura dentro de los límites óptimos (Ramírez-Vélez y Lewis, 1994); sin embargo, no toleran temperaturas tan altas como otros téidos, por ejemplo Aspidoscelis communis, A. lineattisima y A. deppi (Casas-Andreu, 1982; Casas-Andreu y Gurrola-Hidalgo, 1993; Macip-Ríos y Muñoz-Alonso, 2008), especies con quienes comparte el hábitat a lo largo de su distribución.
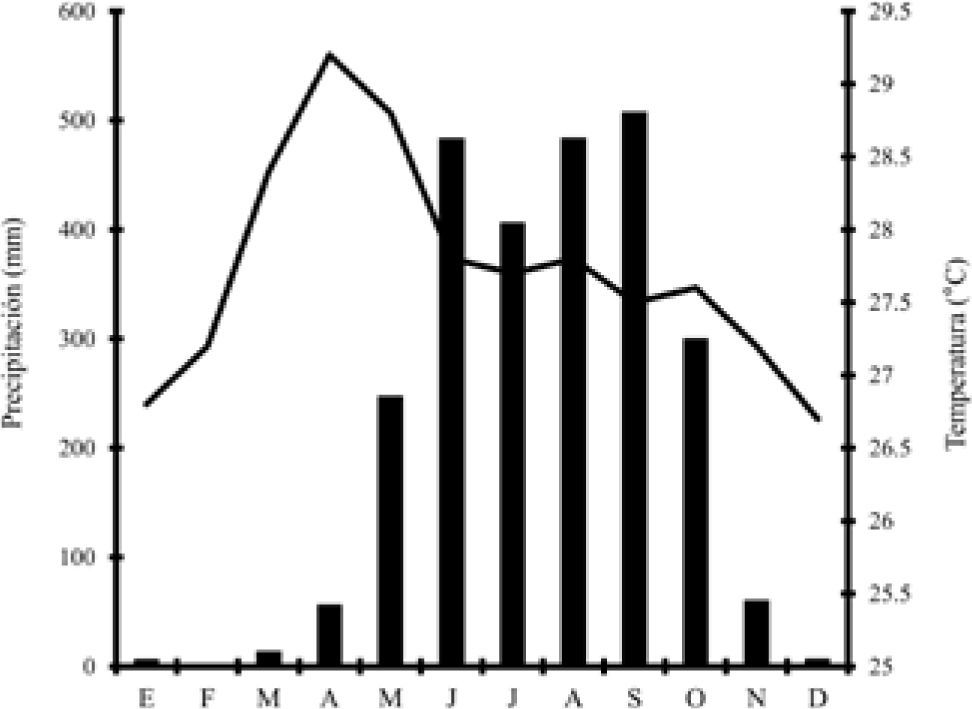
Materiales y métodosÁrea de estudio. El estudio se realizó en el municipio de Mapastepec (15°40'26” y 15°14'12” N, 93°06'05” y 92°39'12” O); con un intervalo altitudinal de los 300 a los 1 000m snm (INEGI, 2000) de noviembre del 2000 hasta abril del 2002. El clima en el área de estudio es cálido húmedo con abundantes lluvias en verano y seco durante la primavera (Fig. 1). La vegetación de la zona de estudio se encuentra distribuida en un mosaico de vegetación nativa como la selva mediana, bosque mesófilo de montaña, selva alta perennifolia y vegetación secundaria como los pastizales, maizales, cacaotales y cafetales de sombra diversificada y monoespecífica (Inga micheliana), lo cual es el resultado del establecimiento de las grandes plantaciones de cacao entre el siglo XVIII y mediados del XIX, para ser sustituidas por plantaciones de café de mediados del siglo XIX a la fecha (Gasco, 1989; Miranda, 1998).
Climograma de Mapastepec, Chiapas, México. Las barras denotan la precipitación y las líneas la temperatura promedio mensual (INEGI, 2000).
Muestreo. Se llevó a cabo de noviembre del 2000 a febrero del 2002 en 3 localidades: Nicolás Bravo 2 (a 350m snm) con asociaciones vegetales, tales como: el pastizal inducido, el cafetal de sombra diversificada y relictos de selva alta perennifolia; Unión los Olivos (a 700m snm) con selva mediana subperennifolia y cafetales de sombra diversificada y Nicolás Bravo 1 (a 1 000m snm) con cafetales diversificados de sombra monoespecífica y bosque mesófilo de montaña. En el cuadro 1 se presentan las características físico-ambientales de la zona de estudio (Muñoz et al., 2002). El esfuerzo de muestreo consistió en 17 salidas de campo, 1 cada mes, con una duración de 4 días efectivos de muestreo. En cada salida se visitaron 2 de las 3 localidades seleccionadas, con un total de 6 visitas para Unión los Olivos y Nicolás Bravo 1, y 5 visitas para Nicolás Bravo 2.
Características físico-ambientales de las estaciones de muestreo. Los valores de precipitación y temperatura representan los promedios anuales
| Nicolás Bravo 1 | Unión los Olivos | Nicolás Bravo 2 | ||||
|---|---|---|---|---|---|---|
| Extensión (has) | % del total | Extensión (has) | % del total | Extensión (has) | % del total | |
| Vegetación | ||||||
| Cafetales | 618 | 37.83 | 253.5 | 15.52 | 802.3 | 49.11 |
| Pastizal | 669.6 | 40.98 | 0 | 0.00 | 258.4 | 15.82 |
| Selva fragmentada | 116.4 | 7.12 | 893.4 | 54.69 | 573 | 35.07 |
| Selva mediana | 229.8 | 14.07 | 485.7 | 29.73 | 0 | 0.00 |
| Bosque mesófilo | 0 | 0.00 | 1.1 | 0.07 | 0 | 0.00 |
| Altitud | ||||||
| 0 a 300m | 0 | 0.00 | 0 | 0.00 | 95.8 | 11.63 |
| 300 a 500m | 11.2 | 0.69 | 188.4 | 11.53 | 496 | 60.22 |
| 500 a 1 000m | 942.1 | 57.66 | 811.6 | 49.68 | 231.9 | 28.15 |
| 1 000 a 1 500m | 680.5 | 41.65 | 633.6 | 38.79 | 0 | 0.00 |
| Clima | ||||||
| C (m) W'' | 0 | 0.00 | 229.4 | 14.04 | 0 | 0.00 |
| A (C) m (‘’) | 943.7 | 57.44 | 1 266.8 | 77.54 | 118.9 | 7.28 |
| A m (w'') | 699.1 | 42.56 | 137.6 | 8.42 | 1 514.9 | 92.72 |
| Precipitación | ||||||
| 3 000 a 3 500mm | 299.3 | 18.32 | 1 520.3 | 93.05 | 191.6 | 11.73 |
| 3 500 a 4 000mm | 1 334.5 | 81.68 | 113.5 | 6.95 | 1 442.2 | 88.27 |
| Temperatura | ||||||
| 16° a 18° | 0 | 0.00 | 229.4 | 14.04 | 0 | 0.00 |
| 18° a 20° | 157.5 | 9.64 | 750.9 | 45.96 | 0 | 0.00 |
| 20° a 22° | 777.2 | 47.57 | 515.9 | 31.58 | 118.9 | 7.29 |
| 22° a 24° | 699.1 | 42.79 | 137.6 | 8.42 | 1245 | 76.34 |
| 24° a 26° | 0 | 0.00 | 0 | 0.00 | 266.9 | 16.37 |
El muestreo de los organismos consistió en la observación directa y conteo de los organismos en recorridos dirigidos (de oeste a este) por las principales asociaciones vegetales de las localidades. Es decir, en un día se recorrieron las principales asociaciones vegetales (sin contar caminos, asentamientos humanos y la vegetación secundaria asociada a éstos) de una localidad. Los recorridos se hicieron de las 9:00 a las 19:00h, revisando minuciosamente el entorno y buscando los organismos de manera activa a lo largo de un intervalo visual aproximado de 5m a la redonda del observador. Una vez recorridas todas las diferentes asociaciones vegetales por localidad, se suspendió el muestreo para evitar contar al mismo individuo en más de una ocasión por salida (Brower et al., 1997).
Análisis de los datos. Para obtener la abundancia promedio por mes en toda la zona de estudio se calculó la media aritmética y desviación estándar por mes del año, usando el número de individuos observados por día en algún tipo de vegetación o hábitat como variable aleatoria discreta (se incluyeron los datos procedentes de distintos años). La abundancia total por mes en toda la zona de estudio se calculó sumando el número total de organismos observados por día en algún tipo de vegetación o hábitat en cada uno de los meses de muestreo. Se utilizó una prueba de Kruskall-Wallis para explorar la variación entre la abundancia promedio por mes y una χ2 (Chi cuadrada) para explorar la variación en la abundancia total por mes. Para determinar una posible correlación entre la abundancia por mes con la temperatura o precipitación, se llevaron a cabo pruebas de correlación no paramétrica de Spearman (ρ), para ello se utilizaron los datos de temperatura y precipitación mensual promedio (Fig. 1) con los datos de abundancia total por mes. Para explorar la abundancia por localidad y por tipo de hábitat (uso de hábitat) se siguió el mismo procedimiento utilizado para calcular la abundancia total por mes del año, utilizándose una χ2 como prueba de homogeneidad (Zar, 1999) para explorar la abundancia total por hábitat y por localidad.
Para el caso del uso del microhábitat se llevó a cabo el mismo procedimiento que para explorar la abundancia por tipo de hábitat. En lo referente a la hora de actividad, se tabuló el número de individuos observados por localidad en intervalos de 1 hora desde las 9:00 hasta las 18:00h, para proseguir con un análisis gráfico de la hora de actividad. Todas las pruebas estadísticas se llevaron a cabo con un α=0.05 y fueron realizadas en el programa estadístico JMP ver. 5.0.1 (SAS Institute, 2002).
ResultadosDurante el estudio se observó un total de 575 lagartijas. Febrero fue el mes donde se obtuvieron las mayores abundancias promedio y total, mientras que la menor abundancia se registró en los meses de junio y julio (Cuadro 2). No se encontraron diferencias significativas en la abundancia promedio mensual en la zona de estudio (Kruskall-Wallis; H8,574=8.90, p=0.35); sin embargo, la abundancia total por mes sí presentó diferencias (χ28=417.61, p<0.0001), soportando una mayor abundancia en los meses de febrero, enero y marzo (Cuadro 2). La temperatura mensual promedio (ρ=-0.55, p=0.12) y la precipitación mensual promedio (ρ=-0.40, p=0.27) no mostraron ninguna correlación con la abundancia total por mes. En lo que respecta a la abundancia por localidad, Nicolás Bravo 2 tuvo la mayor abundancia (266 individuos observados), seguida de Unión los Olivos (207) y Nicolás Bravo 1 (102 individuos). Las diferencias en la abundancia total por tipo de hábitat también fueron significativas (χ22=72.68, p<0.0001).
Abundancia promedio y total por mes para Ameiva undulata en el municipio de Mapastepec, Chiapas, México
| Mes | Año de muestreo | Abundancia promedio (□ DE) | Abundancia total |
|---|---|---|---|
| Enero | 2001 | 12.2 (7.66) | 61 |
| Febrero | 2001, 2002 | 16.73 (14.12) | 204 (158+46) |
| Marzo | 2001 | 11 (11.57) | 77 |
| Abril | 2001 | 11 (6.90) | 18 |
| Mayo | 2001 | 6 (2.64) | 48 |
| Junio | 2001 | 12 (10.19) | 16 |
| Julio | 2001 | 4 (2.44) | 17 |
| Septiembre | 2001 | 4.25 (2.50) | 67 |
| Noviembre | 2000, 2001 | 11.9 (3.90) | 67 (15+52) |
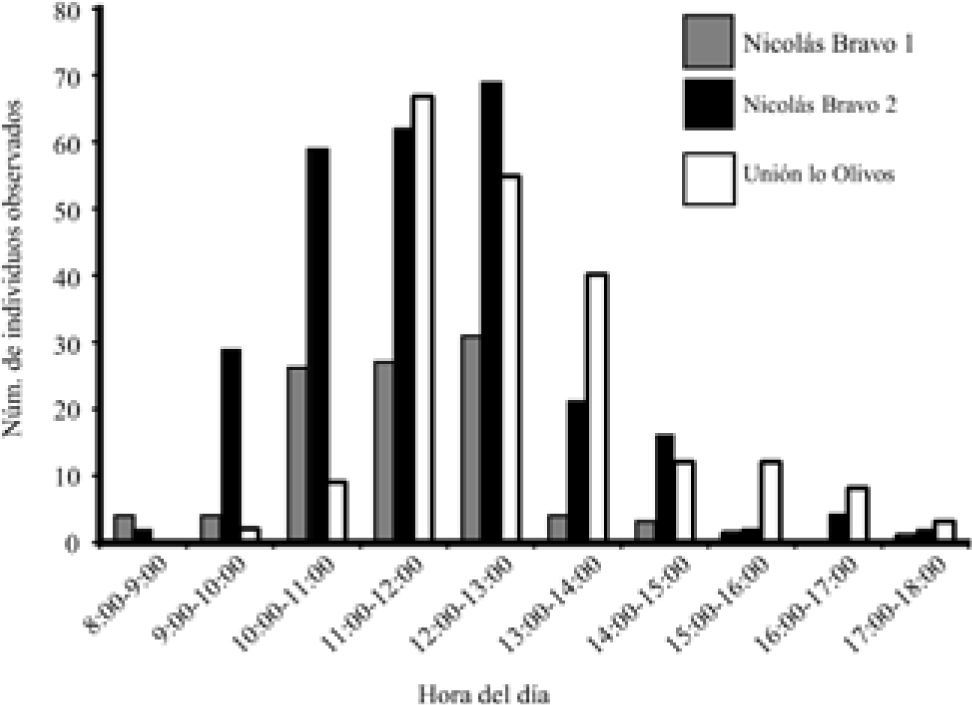
El periodo de actividad por localidad de A. undulata se distribuyó de las 10:00 a las 18:00h, con un pico de máxima actividad (más individuos observados), entre las 11:00 y las 12:00h. A partir de la hora más calurosa del día (13:00h) la actividad disminuyó paulatinamente hasta las 18:00h, después de esta hora no se observó ningún organismo activo (Fig. 2).
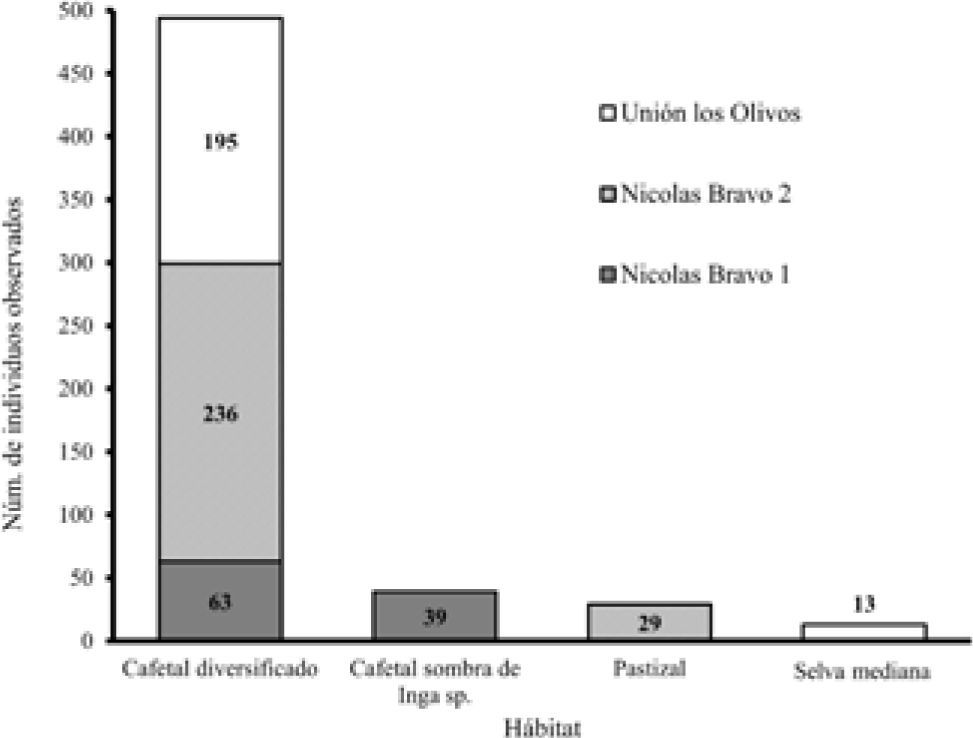
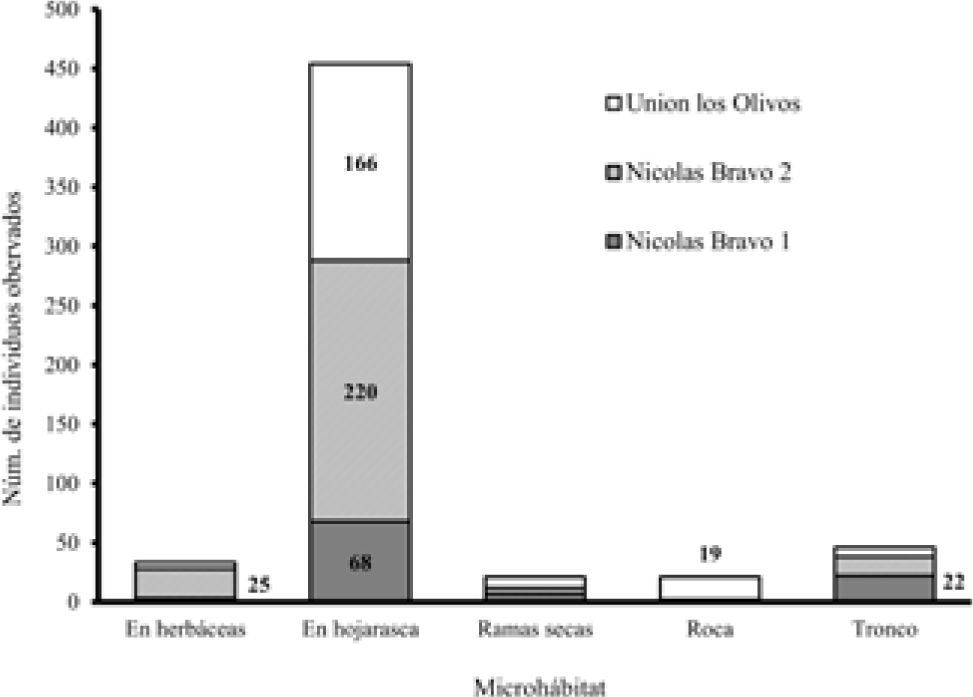
Ameiva undulata fue observada y contabilizada en los siguientes 4 tipos básicos de hábitats en la zona de estudio: el cafetal diversificado, el cafetal de sombra monoespecífica (I. micheliana), la selva mediana y el pastizal inducido. La abundancia total observada por hábitat presentó una clara tendencia significativa hacia el cafetal diversificado (χ23=115.29, p<0.0001), en donde se contabilizó el 86% (496) del total de organismos observados en todo el estudio (Fig. 3). En lo referente al uso del microhábitat, se distinguieron 5 tipos básicos: suelo con herbáceas, hojarasca, ramas secas sobre el suelo, rocas y troncos. La hojarasca fue el microhábitat más usado de manera significativa (χ24=962.80, p<0.0001), en donde se contabilizó al 79% (455) del total de organismos observados (Fig. 4). Como se muestra en las figuras 2 y 3, el uso de hábitat y microhábitat fue proporcional a la abundancia reportada por localidad.
DiscusiónLa mayor abundancia de A. undulata en los meses más secos del año (ver climograma Fig. 1 y Cuadro 1) concuerda con lo observado por Echternacht (1970, 1971) quien menciona que A. undulata es más conspicua en la temporada seca del año. Esto puede ser explicado por 2 causas no excluyentes: 1) la disponibilidad térmica en esta época del año y por hábitat (Censky, 1995; Angilletta et al., 2002) y 2) la disponibilidad de alimento por época del año y por hábitat. Al ser una especie heliotérmica con requerimientos altos de temperatura, la temporada seca parece ser la que mejores condiciones térmicas ofrece en comparación con la de lluvias. En el climograma (Fig. 1) se muestra cómo la temperatura es poco variable a lo largo del año, no obstante en la época seca del año hay una mayor abundancia de días despejados (con pocas nubes), a diferencia de la temporada lluviosa, lo cual, en teoría permite un ambiente térmico más adecuado para los organismos heliotérmicos (Rivera-Vélez y Lewis, 1994); por otra parte, en los meses secos hay una disminución en la diversidad y disponibilidad de presas (Vitt, 1991), por lo que las lagartijas tienen que realizar recorridos más largos o concentrarse en parches donde exista mayor disponibilidad de presas, lo cual las vuelve más conspicuas.
Se observó una disminución en la abundancia hacia las localidades que se encuentran en mayor elevación. Aunque los resultados sobre abundancia mensual con temperatura y precipitación mensual promedio no resultaron significativos, es en la localidad de mayor elevación (Nicolás Bravo 1) es donde se reporta una mayor cobertura de temperaturas más bajas (Cuadro 1), Lee (1996) menciona que A. undulada no frecuenta ambientes con una disponibilidad térmica reducida, además un patrón común que se ha reportado es el de una mayor abundancia de anfibios y reptiles del suelo o terrestres en zonas bajas, donde los microhábitats tienen una mayor estabilidad térmica (Fauth et al., 1989). Los datos físico-ambientales (Cuadro 1) muestran que la cobertura de la vegetación ya sea nativa o perturbada (cafetales y pastizales) puede tener un efecto en la abundancia total por localidad. Ordenadas las localidades de mayor a menor grado de transformación (por porcentaje de cobertura de vegetación nativa), Nicolás Bravo 1 es la más perturbada, seguida por Nicolás Bravo 2 y, finalmente Unión los Olivos. La mayor abundancia de A. undulada se encuentra en Nicolás Bravo 2 (266 individuos), seguida por Unión los Olivos (207) y, finalmente por Nicolás Bravo 1 (102 individuos). Los datos sugieren una mayor abundancia en el sitio con una perturbación intermedia y menor altitud, al parecer son las mismas condiciones ambientales preferidas por A. undulata en otros sitios (Lee, 1996; Campbell, 1998) y por otras especies del mismo género (Echternacht, 1970, 1971; Vitt y Colli, 1994).
La hora de actividad de A. undulada también muestra una concordancia con la de otros teídos (Vitt y Colli, 1994; Sartorius et al., 1999; Winne y Keck, 2004); sin embargo, en este trabajo no obtuvimos información sobre la oferta térmica diaria ni sobre las temperaturas basales y operativas de A. undulata, lo cual ayudaría a explicar el efecto de la oferta térmica en el patrón de actividad de esta lagartija. Lewis y Saliva (1987) registraron que el asoleo o percha y el merodeo o forrajeo son las conductas más comunes en A. exsul, a su vez, Schell et al. (1993) encontraron que Ameiva chrysolaema ocupa más del 70% de su periodo de actividad en cazar y merodear. El periodo de actividad registrado para A. undulata (6-7h) es típico de los forrajeros activos, el cual debe poder cubrir un alto gasto energético (Huey y Pianka, 1981; Rodríguez-Ramírez y Lewis 1991; Rivera-Vélez, 1994; Censky, 1995; Vitt y Pianka, 2004).
Para Angilleta et al. (2002) la utilización del ambiente por las lagartijas depende de las condiciones térmicas, la cobertura de la vegetación, la disponibilidad del sustrato preferido, el porcentaje de sol directo sobre el substrato y la humedad relativa; aunado a esto, está también la capacidad de termorregulación de cada linaje o especie de lagartija para explotar el ambiente (Pianka y Vitt, 2006). Con base en las observaciones hechas y reportadas en el presente trabajo es evidente que A. undulata utiliza ambientes con un grado de insolación media como los cafetales (en específico los de Nicolás Bravo 2). La elevada abundancia de A. undulata en los cafetales y la ausencia o abundancia reducida en otros sitios de la zona con baja insolación o muy alta insolación (bosques mesófilos, selvas medianas y/o pastizales) indican que los cafetales ofrecen buenas condiciones térmicas, de alimento y/o refugio. Ya se ha registrado la presencia de A. undulata en numerosos tipos de ambientes perturbados (Hirth, 1963; León y Ruiz, 1971; Schell et al., 1993; Campbell, 1998; Macip-Ríos y Muñoz Alonso, 2008). Otras especies del género como A. quadrilineata, A. festiva y A. leptophrys (Hillman, 1969; Smith, 1969; Colli, 1991) también han sido registradas en ambientes medianamente perturbados. Echternacht (1970, 1971) y Lee (1996) mencionan que A. undulata es una especie común y abundante en condiciones “de borde de hábitat”, lo que indica que está bien adecuada a las condiciones intermedias entre los bosques tropicales y los claros.
El uso principal de la hojarasca por A. undulata es importante, no sólo por distribuirse en parches de insolación media, lo cual refuerza la hipótesis de un ambiente térmico adecuado, sino porque la hojarasca provee de protección y alimento. La hojarasca es rica en insectos de suelo y otras presas potenciales para la especie como serpientes pequeñas (Campbell, 1998). A. undulata se considerada como un forrajero activo y en las observaciones de campo se detectó que realiza muchas de sus actividades principales como alimentarse, termorregular, cortejo y apareamiento en ese microhábitat. Los datos apuntan a una cierta especialización hacia la hojarasca, la cual, al ser un microhábitat abundante en los cafetales de sombra diversificada y selva mediana, también influye potencialmente en la abundancia de la especie.
A pesar de no aportar datos sobre oferta térmica ni sobre disponibilidad de presas, las observaciones del presente trabajo apoyan la perspectiva de que los cafetales, al ser un tipo de vegetación secundaria, con insolación intermedia, abundancia de presas potenciales y diversidad de microhábitats disponibles (Perfecto et al., 1996), es un hábitat propenso para soportar una alta abundancia de especies (Macip-Ríos y Casas-Andreu, 2008) e individuos en lo que se refiere a anfibios y reptiles. Otros trabajos han mostrado que los cafetales albergan una gran cantidad de fauna y sirven como corredores entre diferentes hábitat y refugios, ya que mantienen una arquitectura vegetal similar a la del hábitat original (Moguel y Toledo, 1996, 1999; Perfecto et al., 1996; Macip-Ríos y Casas-Andreu, 2008; Moguel, 2010), lo cual influye en los patrones de riqueza y abundancia de lagartijas (Vitt, 1991). Es importante reconocer que se conoce poco sobre la historia natural de A. undulata en México y que los datos y observaciones aportadas en este trabajo contribuyen a aumentar el conocimiento sobre la abundancia de esta especie de lagartija en ambientes conservados y perturbados; también vale la pena reconocer que se necesita mayor investigación e información para determinar de manera más precisa los patrones de abundancia de esta especie, en especial en los altos valores encontrados en los cafetales; sin embargo, esos datos aportan elementos que apoyan la importancia de los cafetales como una opción en las estrategias de conservación y desarrollo en zonas tropicales.
Los autores agradecen al IDESMAC (Instituto para el Desarrollo Sustentable en Mesoamérica)-Banco Mundial por el apoyo financiero para la realización de este estudio. Asimismo, al Colegio de la Frontera Sur, Unidad San Cristóbal de las Casas por las facilidades brindadas. A Ruth Percino-Daniel, Mariana Ramírez, Pilar Martínez y Marilú Moreno por su colaboración en el trabajo de campo. El primer autor agradece al Dr. Gustavo Casas-Andreu por los comentarios en los primeros borradores de este manuscrito. A dos revisores anónimos que hicieron comentarios y sugerencias que enriquecieron el manuscrito.