Existen algunos análisis acerca del impacto del cambio climático en la distribución de los mamíferos terrestres de México. Sin embargo, los impactos en las áreas de endemismo no han sido analizados. Por esto, el objetivo de este análisis fue determinar los efectos del cambio climático en los patrones de endemismo de los mamíferos de México, dado las diferencias climáticas entre 2 períodos, el presente (1961-1990) y el futuro (2080-2099). Para ello, se obtuvieron 405 modelos de distribución de especies de los mamíferos terrestres de México, aplicando un algoritmo de máxima entropía (MaxEnt), y haciendo una proyección futura bajo el escenario climático A2 de acuerdo a 3 modelos de circulación general. Posteriormente, se realizó un análisis de endemicidad para identificar las áreas de endemismo y sus taxones endémicos. Se identificaron 23 áreas de endemismo en el presente, mientras que en las proyecciones futuras se obtuvieron de 14 a 16. Por último, se presenta una comparación entre los 2 periodos usando un análisis espacial y midiendo la vulnerabilidad de las áreas de endemismo con un factor relativo de vulnerabilidad. La pérdida de patrones de endemismo, el desplazamiento geográfico, la reducción de superficies y el cambio en la composición de especies de las áreas de endemismo, muestran el impacto negativo que puede provocar el calentamiento global en los patrones de endemismo.
There are some analyses about the impact of climatic change in the distribution of Mexican land mammals. However, this impact has not been analyzed on areas of endemism. For this reason, the aim of this analysis was to determine the climate change effects in the patterns of endemism of the mammals of Mexico, regarding the climatic differences between 2 time periods, present time (1961-1990) and future time (2080-2099). For this purpose, 405 species distribution models of the Mexican land mammals were obtained applying a maximum entropy algorithm (MaxEnt), and using their projections under climate scenario A2 according to 3 general circulation models. Later, an Endemicity Analysis was performed in order to identify areas of endemism and their endemic taxa. Twenty-three areas of endemism in the present time were identified, while 14-16 areas of endemism were identified for the future time. Finally, a comparison between present and future time is presented, using spatial analysis and measuring vulnerability of the areas of endemicity with a relative vulnerability factor. Loss of patterns of endemism, geographic displacement, surfaces reduction and change in species composition of the areas of endemism show the negative impact that global warming may cause on the endemism patterns.
La confirmación del cambio climático como una de las principales amenazas para la diversidad biológica (Beever y Belant, 2012; Jarema, Samson, Mcgill y Humphries, 2009; Karsh y MacIver, 2010; Moritz et al., 2008; Rosenzweig et al., 2008; Thuiller et al., 2009), han hecho necesario implementar diversas medidas de adaptación y mitigación a nivel internacional y local desarrolladas a partir de diferentes análisis de vulnerabilidad con diferentes métodos (Cahill et al., 2012). En el caso de los mamíferos de México se desconocen muchas de las consecuencias del calentamiento global, pero existen algunos estudios sobre el tema (Martínez-Meyer, Calixto-Pérez y Arroyo-Lamber, 2011; Trejo et al., 2011) y la información que se tiene sobre su historia y biología indican que el fenómeno climático de las últimas décadas repercutirá en la distribución de los mamíferos en el país como se conoce hoy en día. Un cambio en la distribución de los taxones mastofaunísticos sugiere modificaciones conductuales, microevolutivas y adaptativas, que muchas veces no se pueden analizar por el desconocimiento de diferentes aspectos de la biología de los mamíferos, pero se pueden analizar los patrones biogeográficos, los cuales se han considerado como evidencia de la historia evolutiva de las especies (Morrone, 2009). Por lo cual, el objetivo de este estudio es analizar los patrones de endemicidad de los mamíferos terrestres de México en el marco de un calentamiento global como consecuencia de las actividades humanas.
Materiales y métodosÁrea de estudio y datosEl estudio fue limitado a México, en donde se han registrado 550 especies de mamíferos (Ceballos y Arroyo-Cabrales, 2012), de las cuales solo 405 especies (74% del total, pertenecientes a 12 órdenes) fueron empleadas en este estudio, dada su estabilidad taxonómica y su implemento frecuente en otros estudios biogeográficos (Escalante, Morrone y Rodríguez-Tapia, 2013). El total de registros suma 78,478, con un promedio de 194 registros por especie, los cuales fueron obtenidos del Atlas biogeográfico de los mamíferos terrestres de América del Norte (http://atlasbiogeografico.com/; Escalante, 2013; Escalante y Rodríguez-Tapia, 2011). Se trató de utilizar las especies con mayor número de registros, para obtener modelos de distribución más robustos, pero lamentablemente se reduciría la representatividad de la mastofauna presente en México a un 30% (163 especies con 100 o más registros). Para evitar errores en las georreferencias, los datos se revisaron espacialmente en ArcGIS 9.3 (ESRI, 2008) y se consultaron 405 fichas de especies de la International Union for Conservation of Nature (IUCN, 2013) y 47 de Mammalian Species (ASM, 2013; Apéndice 1, véase versión digital), mientras que para la nomenclatura se siguieron los trabajos de Ceballos, Arroyo-Cabrales, Medellín y Domínguez-Castellanos (2005); Ceballos y Arroyo-Cabrales (2012); Ramírez-Pulido, Arroyo-Cabrales y Castro-Campillo (2005) y Redondo, Brina, Silva, Ditchfield y Santos (2008). Las 21 capas bioclimáticas (se incluyen el índice de aridez anual y de verano, derivados de las otras capas) a una resolución de 30 segundos de arco se obtuvieron del Moscow Forestry Sciences Laboratory (MFSL, 2012; ver URL http://forest.moscowfsl.wsu.edu/climate/) tanto para la línea base que corresponde al periodo 1961-1990 como para el horizonte 2090. El escenario socioeconómico seleccionado fue el A2, debido a que sus estimaciones se asemejan a las tendencias socioeconómicas del presente, con un crecimiento y desarrollo desigual entre regiones, altas tasas de crecimiento poblacional y uso de combustibles fósiles; y estima un aumento promedio en la temperatura de 3.9 para el 2090-2099 (Rogelj, Meinshausen y Knutti, 2012). El A2 propone algo muy similar que el RCP 8.5, el cual es uno de los nuevos escenarios presentados en el quinto informe de evaluación del panel intergubernamental sobre cambio climático (IPCC, por sus siglas en inglés), en 2013. En ambos escenarios pesimistas la capacidad de adaptación y mitigación es baja, lo que ocasiona altos costos en la adaptación en un futuro cercano (Van Vuuren et al., 2012). Los modelos de circulación elegidos fueron 3, dado las ventajas y desventajas decada uno: CGCM3, versión T63, cuya resolución de 2.8° latitud /longitud ayuda a modelar con mejor precisión el clima en zonas tropicales (CCCMA, 2014); GFDLCM21, el cual mejora el modelado de fenómenos tropicales como el niño (ENSO; Delworth et al., 2006); HADCM3, debido a que tiene el mejor desempeño para México, aunque la mejor resolución se obtiene con GFDLCM21, de acuerdo con la comparación realizada por Conde, Estrada, Martínez, Sánchez y Gay (2011), donde se prueba el desempeño para México de 21 modelos utilizados en el cuarto informe del IPCC.
Modelos de distribución de especies (MDE)Se utilizó el programa MaxEnt v3.3.3k (Phillips, Anderson y Schapire, 2006) para elaborar los modelos de distribución de 405 especies. Previó al modelado en MaxEnt se empleó el factor de inflación de la varianza (FIV) en el programa SPSS, versión 20, para conocer la relación entre las 21 variables ambientales y, de ser necesario, eliminar algunas para reducir la colinealidad en cada modelo. La calibración de MaxEnt utilizada fue la establecida por defecto, la regla de corte elegida fue “igual sensibilidad y especificidad del entrenamiento” (Bean, Stafford y Brashares, 2012; Liu, Berry, Dawson y Pearson, 2005); el multiplicador de regularización utilizado fue de 1 para muestras pequeñas (<100) y de 1.5 para muestras mayores (Anderson y González Jr., 2011); 40 réplicas para cada especie. En todos los casos, se utilizó la técnica bootstrapping para las réplicas (Phillips y Dudík, 2008) y, de esta forma, se pudieron validar los conjuntos de pocos datos (Pearson, Raxworthy, Nakamura y Peterson, 2007; Yáñez-Arenas, Mandujano, Martínez-Meyer, Pérez-Arteaga y González-Zamora, 2012). El porcentaje de datos para la validación del modelo fue 25% de los registros de cada especie. La evaluación del modelo se realizó mediante el área bajo la curva (AUC; Fielding y Bell, 1997; Longoria, 2008; Phillips et al., 2006; Phillips y Dudík, 2008). Los modelos fueron rechazados si el valor de AUC fue menor a 0.7 (un valor de 0.5 indica que el modelo propuesto es igual que el azar; Phillips y Dudík, 2008). La contribución de cada una de las variables se midió por medio de la prueba de Jackniffe (Phillips et al., 2006). Para el caso de los modelos en el tiempo presente o línea base, estos fueron limitados geográficamente (Downer, 2009; Elith et al., 2011; Soberón, 2010) con las provincias fisiográficas y en algunos casos con las cuencas hidrológicas o las cotas altitudinales, capas obtenidas a partir del Continuo de Elevación Mexicano 3.0 del Inegi (2013; ver URL http://www.inegi.org.mx/geo/contenidos/datosrelieve/continental/continuoelevaciones.aspx), de las provincias fisiográficas del Inegi, (2001) y del Atlas ambiental de América del Norte de la Comisión para la cooperación ambiental, CCA (2006; http://www.cec.org/Page.asp?PageID=122&ContentID=2336). Para aplicar esta delimitación geográfica a los modelos de distribución en el presente de cada especie, se consultaron las fuentes de información antes mencionadas en el área de estudio y datos, así como los trabajos de Alexander y Riddle (2005); Ascorra, Wilson y Gardner (1991); Dawnson (2005); Jezkova, Jaeger, Marshall y Riddle (2009); León-Paniagua, Navarro-Sigüenza, Hernández-Baños y Morales (2007); Woodman (2005) y Woodman y Timm (1999). En el caso de las proyecciones futuras (horizonte 2090) de cada distribución de las especies, se consideró como parte de la distribución potencial las superficies contraídas o expandidas, que se encontraban adyacentes o dentro de las superficies obtenidas en el presente.
Análisis de endemicidadLos MDE obtenidos se unieron en conjuntos de 33 especies y se intersectaron con la grilla de 1° × 1° previamente etiquetada de acuerdo con Szumik, Casagranda y Roig (2006). La tabla de atributos de esta última capa se editó en una hoja de cálculo (.ods). La edición consistió en la elaboración de una tabla dinámica, donde las columnas fueron las presencias y ausencias de los MDE y las filas las celdas de la grilla. Posteriormente, la tabla se exportó en un editor de texto, donde se editó y guardó conforme a lo establecido por Szumik et al. (2006). Con el software NDM/VNDM, versión 3.0 (Goloboff, 2012; http://www.lillo.org.ar/phylogeny/endemism/) se identificaron las áreas de endemismo y se obtuvo el valor de endemicidad de cada especie y a partir de dicho valor, se calculó el índice de endemicidad del área (IE), en donde la regla utilizada fue que el área de endemismo estuviera formada por la simpatría parcial de las distribuciones de al menos 2 taxones (Szumik et al., 2006). Para el análisis se utilizaron los parámetros por defecto de NDM/VNDM y solo se modificó el porcentaje de especies únicas para retener áreas superpuestas con un 98%, una semilla aleatoria de 362 (celda escogida al azar dentro de la grilla donde inicia el análisis el programa) y un porcentaje mínimo de ajuste de la distribución de cada especie al área endémica de 0.2, con la finalidad de evaluar los posibles cambios en los patrones de endemismo (ver Apéndice 2, véase versión digital). Posteriormente, se realizaron consensos entre áreas con 25% de similaridad de especies para evitar la sobrerrepresentación y ambigüedad (Escalante, Szumik y Morrone, 2009). Lo anterior se realizó para la línea base y los 3 escenarios futuros, con la finalidad de observar las diferentes tendencias que pudieran presentarse de acuerdo con cada uno de los escenarios climáticos empleados. Por último, las áreas de endemismo obtenidas se validaron con las propuestas en otros estudios acerca de patrones de endemismo y provincias biogeográficas sustentadas en los endemismos (Escalante et al., 2009; Escalante et al., 2013; Gámez, Escalante, Rodríguez, Linaje y Morrone, 2012; Morrone, 2001), así como la nomenclatura de las áreas de endemismo utilizados en la tabla 1, estuvo de acuerdo con el principio de prioridad taxonómico (Ramírez-Pulido y Castro-Campillo, 1992), mientras que los acrónimos empleados para cada una de las áreas, se obtuvieron de las primeras 3 letras de cada palabra del nombre compuesto por 1 o 2 palabras y solo las iniciales del nombre para más de 3 palabras.
Áreas de endemismo obtenidas en este estudio, con sus respectivos índices de endemicidad (IE) y sus especies endémicas. Además, se muestran los valores de endemicidad de cada especie en el presente y en el futuro
| Area de Endemismo | Abreviacion | IE | Especies | Valor para cada especie. | Futuro | ||
|---|---|---|---|---|---|---|---|
| Presente | Presente | CGCM3 | GFDLCM21 | HADCM3 | |||
| Altiplano Mexicano | Altmex | 2.2 | Bison | 6.6 | 8.8 | ||
| Cynomys ludovicianus | 6.6 | ||||||
| Geomys arenarius | 8.8 | 9.9 | |||||
| Perognathus flavescens | 8.8 | ||||||
| California | Cal | 3.3 | Chaetodipus californicus | 0.0 | 8.8 | 7.7 | |
| Chaetodipus fallax | 7.7 | 9.9 | 0.0 | 8.8 | |||
| Microtus californicus | 9.9 | 8.8 | 7.7 | 4.4 | |||
| Neotoma macrotis | 0.0 | 7.7 | 8.8 | ||||
| Peromyscus californicus | 9.9 | 9.9 | 9.9 | 8.8 | |||
| Scapanus latimus | 9.9 | 9.9 | 7.7 | 8.8 | |||
| Sciurus griseus | 7.7 | 6.6 | 7.7 | ||||
| Sorex ornatus | 0.0 | 9.9 | 9.9 | 8.8 | |||
| Spermophilus beecheyi | 7.7 | 0.0 | 0.0 | ||||
| Chiapas | Chi | 5.5 | Alouatta pigra | 8.8 | |||
| Chironectes minimus | 8.8 | 3.3 | |||||
| Peromyscus zarhynchus | 8.8 | 9.9 | 6.6 | ||||
| Peropteryx kappleri | 7.7 | ||||||
| Phylloderma stenops | 7.7 | ||||||
| Sorex stizodon | 8.8 | ||||||
| Tylomys tumbalensis | 9.9 | 8.8 | 8.8 | ||||
| Distrito Este Disest | 3.3 | Cratogeomys merriami | 7.7 | 0.0 | 6.6 | ||
| Neotomodon alstoni | 8.8 | 9.9 | 7.7 | ||||
| Distrito Este (cont.) | Disest | 3.3 | Peromyscus bullatus | 0.0 | 0.0 | 8.8 | 7.7 |
| Peromyscus furvus | 4.4 | ||||||
| Romerolagus diazi | 5.5 | 8.8 | 8.8 | 8.8 | |||
| Sorex oreopolus | 8.8 | 8.8 | 8.8 | ||||
| Sorex ventralis Xerospermophilus perotensis | 8.8 | 8.8 | 0.0 | ||||
| Faja Volcanica Transmexicana | FVTM | 3.3 | Cratogeomys fumosus | 8.8 | 5.5 | 7.7 | |
| Cryptotis alticola | 9.9 | 7.7 | 8.8 | 7.7 | |||
| Cryptotis parva Neotomodon alstoni | 8.8 | 7.7 | |||||
| Reithrodontomys chrysopsis | 8.8 | 7.7 | 7.7 | 8.8 | |||
| Sorex oreopolus Sorex saussurei | 8.8 | 7.7 | 7.7 | 9.9 | |||
| Spermophilus adocetus | 2.2 | ||||||
| Golfo de Mexico | Golmex | 5.5 | Balantiopteryx io | 8.8 | |||
| Carollia sowelli | 8.8 | ||||||
| Didelphis marsupialis | 9.9 | ||||||
| Eptesicus brasiliensis | 6.6 | ||||||
| Marmosa mexicana | 9.9 | ||||||
| Myotis albescens Myotis keaysi | 7.7 | 7.7 | |||||
| Oryzomys alfaroi | 8.8 | 8.8 | 8.8 | ||||
| Peromyscus beatae | 7.7 | ||||||
| Peromyscus mexicanus | 8.8 | 8.8 | 6.6 | ||||
| Philander opossum | 9.9 | ||||||
| Platyrrinus helleri | 9.9 | ||||||
| Sylvilagus brasiliensis | 9.9 | 9.9 | |||||
| Mohave | Moh | 7.7 | Chaetodipus formosus Eumops perotis | 7.7 | 7.7 | ||
| Perognathus longimembris | 0.0 | 6.6 | |||||
| Peromyscus crinitus | 9.9 | 9.9 | |||||
| Neartica Oeste | Neaoes | 8.8 | Antrozous pallidus | 9.9 | |||
| Dipodomys merriami | 9.9 | 0.0 | |||||
| Lepus californicus | 9.9 | 8.8 | 9.9 | ||||
| Lynx rufus | 8.8 | ||||||
| Sylvilagus audubonii | 0.0 | 8.8 | 8.8 | ||||
| Taxidea taxus | 8.8 | ||||||
| Neotropical | Neo | 7.7 | Chiroderma villosum Eptesicus furinalis | 7.7 | 9.9 | 9.9 | |
| Micronycteris microtis | 0.0 | 0.0 | |||||
| Myotis nigricans | 9.9 | 9.9 | |||||
| Oligoryzomys fulvescens Potos flavus | 9.9 | 9.9 | |||||
| Tamandua mexicana | 0.0 | 8.8 | |||||
| Neotropical Amplia | Neoamp | 5.5 | Artibeus jamaicensis | 9.9 | 9.9 | 9.9 | 9.9 |
| Artibeus lituratus | 9.9 | 9.9 | 8.8 | 9.9 | |||
| Centurio senex | 9.9 | ||||||
| Glossophaga soricina | 6.6 | 0.0 | 5.5 | 9.9 | |||
| Leopardus wiedii Molossus rufus | 9.9 | 8.8 | |||||
| Panthera onca Pteronotus davyi | 9.9 | 7.7 | 3.3 | ||||
| Pteronotus parnelli Pteronotus personatus | 6.6 | 0.0 | 9.9 | 9.9 | |||
| Puma yaguarondi Sturnira lilium | 8.8 | 9.9 | 9.9 | ||||
| Neotropical Pacffico Central | NPC | 2.2 | Baiomys musculus | 9.9 | 7.7 | 9.9 | 9.9 |
| Carollia subrufa | 8.8 | 8.8 | 8.8 | ||||
| Hylonycteris underwoodi | 8.8 | 8.8 | 6.6 | ||||
| Glossophaga morenoi | 9.9 | 9.9 | |||||
| Orthogeomys grandis | 7.7 | 8.8 | |||||
| Enchisthenes hartii | 7.7 | 6.6 | 7.7 | ||||
| Nyctomys sumichrasti Bassariscus sumichrasti | 9.9 | 9.9 | |||||
| Phyllostomus discolor | 9.9 | ||||||
| Oaxaca-Tehuacanense | Oaxteh | 8.8 | Centronycteris centralis Cryptotis alticola | 8.8 | 7.7 | 7.7 | |
| Cryptotis magna | 8.8 | 9.9 | 7.7 | ||||
| Cryptotis mexicana Cryptotis phillipsii | 7.7 | 7.7 | 6.6 | 6.6 | |||
| Diaemus youngi | 6.6 | 8.8 | |||||
| Oaxaca-Tehuacanense (cont.) | Oaxteh | 8.8 | Habromys ixtlani | 6.6 | 7.7 | 7.7 | 6.6 |
| Habromys lepturus | 6.6 | 7.7 | 7.7 | 6.6 | |||
| Megadontomys cryophilus | 5.5 | 6.6 | 6.6 | 9.9 | |||
| Microtus oaxacensis | 5.5 | 0.0 | 0.0 | 0.0 | |||
| Microtus umbrosus | 7.7 | 7.7 | |||||
| Myotis albescens | 7.7 | ||||||
| Oryzomys chapmani | 7.7 | ||||||
| Peromyscus melanocarpus | 8.8 | 0.0 | 0.0 | 0.0 | |||
| Peromyscus melanurus | 8.8 | 4.4 | |||||
| Rheomys mexicanus | 6.6 | 7.7 | 5.5 | ||||
| Pacffico | Pac | 7.7 | Liomys pictus | 9.9 | |||
| Macrotus waterhousii | 9.9 | ||||||
| Rhogeessa parvula | 9.9 | ||||||
| Pacffico Centro | Paccen | 6.6 | Megasorex gigas | 9.9 | |||
| Oryzomys melanotis | 7.7 | 7.7 | 7.7 | 9.9 | |||
| Osgoodomys banderanus | 7.7 | 9.9 | |||||
| Pappogeomys bulleri | 0.0 | 9.9 | |||||
| Peromyscus perfulvus | 8.8 | ||||||
| Sigmodon alleni | 9.9 | 8.8 | 8.8 | 9.9 | |||
| Spermophilus annulatus | 7.7 | ||||||
| Sylvilagus cunicularius | 5.5 | ||||||
| Pacffico Norte | Pacnor | 7.7 | Chaetodipus artus | 8.8 | 9.9 | ||
| Chaetodipus goldmani | 6.6 | 9.9 | |||||
| Chaetodipus pernix | 7.7 | 9.9 | |||||
| Neotoma phenax | 9.9 | 8.8 | |||||
| Reithrodontomys burti | 8.8 | ||||||
| Peninsula de Baja California | PBC | 4.4 | Chaetodipus arenarius | 9.9 | |||
| Chaetodipus rudinoris | 6.6 | 0.0 | 3.3 | 9.9 | |||
| Dipodomys simulans | 9.9 | 9.9 | |||||
| Eumops perotis | 9.9 | ||||||
| Peromyscus eva | 9.9 | 9.9 | 7.7 | 9.9 | |||
| Peromyscus fraterculus | 9.9 | 9.9 | |||||
| Sylvilagus bachmani | 9.9 | 6.6 | 9.9 | ||||
| Peninsula de Yucatan | Penyuc | 5.5 | Cryptotis mayensis | 9.9 | 8.8 | ||
| Heteromys gaumeri | 6.6 | ||||||
| Mazama pandora | 9.9 | ||||||
| Otonyctomys hatti | 0.0 | 9.9 | |||||
| Peromyscus yucatanicus | 9.9 | ||||||
| Rhogeessa aeneus | 8.8 | 6.6 | |||||
| Sierra Madre Oriental | SMO | 0.0 | Microtus quasiater | 0.0 | |||
| Oryzomys chapmani | 9.9 | ||||||
| Peromyscus furvus | 0.0 | ||||||
| Sorex macrodon | 9.9 | ||||||
| Sierra Madre Oriental Norte | SMON | 1.1 | Cynomys mexicanus | 8.8 | |||
| Myotis planiceps | 8.8 | ||||||
| Sciurus alleni | 8.8 | ||||||
| Sorex milleri | 8.8 | ||||||
| Soconusco | Soc | 7.7 | Cryptotis tropicalis | 0.0 | 9.9 | 9.9 | 7.7 |
| Habromys lophurus | 9.9 | 9.9 | 7.7 | ||||
| Heteromys nelsoni | 7.7 | 0.0 | 6.6 | ||||
| Macrophyllum | 8.8 | ||||||
| Microtus guatemalensis | 6.6 | 7.7 | 8.8 | 9.9 | |||
| Peromyscus guatemalensis | 0.0 | 0.0 | 9.9 | 8.8 | |||
| Peromyscus gymnotis | 4.4 | 2.2 | 5.5 | ||||
| Reithrodontomys tenuirostris | 7.7 | 7.7 | 8.8 | 7.7 | |||
| Tierras Altas de America Central | TAAC | 1.1 | Chrotopterus auritus | 3.3 | |||
| Cryptotis merriami | 8.8 | 9.9 | 9.9 | 8.8 | |||
| Habromys lophurus | 8.8 | ||||||
| Liomys salvini | 6.6 | 8.8 | 9.9 | 8.8 | |||
| Noctilio albiventris | 8.8 | 8.8 | 8.8 | ||||
| Sciurus variegatoides | 9.9 | 9.9 | 7.7 | ||||
| Scotinomys teguina | 8.8 | 6.6 | 6.6 | 7.7 | |||
| Zona de iransiciön Mexicana | ZTM | 7.7 | Corynorhinus mexicanus | 9.9 | 9.9 | 8.8 | |
| Dipodomys phillipsii | 7.7 | ||||||
| Liomys irroratus | 7.7 | ||||||
| Peromyscus difficilis | 9.9 | 7.7 | |||||
| Peromyscus melanotis | 8.8 | ||||||
| Sigmodon leucotis | 9.9 | 8.8 | 7.7 | ||||
| Zona de Transiciön Mexicana Amplia | ZTMA | 5.5 | Conepatus leuconotus | 7.7 | |||
| Mephitis macroura | 9.9 | ||||||
| Myotis velifer | 9.9 | ||||||
Para observar los posibles cambios en los patrones de endemismo en los diferentes escenarios se utilizó ArcGIS 9.3 (ESRI, 2008) para superponer las áreas de endemismo correspondientes al presente y futuro, y visualizar las modificaciones en las superficies de las áreas de endemismo para el 2090, debidas al cambio climático. Antes de analizar los resultados en el sistema de información geográfica, se importaron los datos en forma vectorial y, posteriormente se transformaron a “raster” para conocer el número de pixeles y, a partir de ellos, se calcularon los porcentajes de superficie de cada área de endemismo tanto para el presente como para el futuro. Las diferencias entre la longitud y la latitud se obtuvieron mediante el análisis del desplazamiento del centroide de las áreas con la herramienta directional distribution de ArcGIS. Por último, la vulnerabilidad de las áreas se calculó con el factor de vulnerabilidad (FV) modificado a partir de Balica, Wright y Van der Meulen (2012), el cual se obtiene de acuerdo con:
donde: SppS son las especies que son más susceptibles al cambio climático o especies que solo se presentan en el presente y se pierden en el futuro; Spp son las especies totales del presente; y SppR las especies resistentes al cambio climático o especies del presente que prevalecen en el futuro. El FV se interpretó en forma relativa de acuerdo con el valor más alto obtenido dentro de las diferentes áreas de endemismo. Para explicar parte de la vulnerabilidad de las áreas de endemismo se obtuvieron las temperaturas medias y precipitaciones anuales observadas en el presente y esperadas en el futuro, a partir de la superposición de las áreas con las superficies climáticas.
ResultadosSe obtuvieron 405 modelos para cada escenario, incluyendo la línea base, correspondientes a cada una de las especies, en total 1,620 modelos. En los MDE se observó una tendencia a la disminución de la superficie de su distribución, pero en algunas especies la respuesta fue diferenciada según el modelo de circulación general utilizado; por ejemplo, Ammospermophilus interpres, Corynorhinus townsendii, Eumops glaucinus y Dipodomys phillipsi perderían la totalidad de su superficie actual de ocurrir lo propuesto en el escenario A2 con el modelo CGCM3, pero solo se reducirían sus superficies con los otros 2 modelos. Aún con las diferencias cualitativas observadas entre los diferentes modelos de circulación general, la mayoría de las distribuciones de las especies (58%) siguen una tendencia a incrementar su superficie al norte para el horizonte 2090.
Análisis de endemicidadSe obtuvieron 23 áreas de endemismo para el presente, mientras que en las proyecciones para el futuro se recuperaron 15 con CGCM3, 14 con GFDLCM y 16 con HADCM3. Las áreas de endemismo y su composición de especies se presentan en la tabla 1, junto con el índice de endemicidad (IE) y el puntaje de contribución de cada especie al IE, para cada uno de los escenarios. Algunos ejemplos cartográficos se muestran en la figura 1.
En el mapa se muestran 5 áreas de endemismo obtenidas al realizar el análisis de endemicidad para el presente y el futuro (CGCM3). En el caso de la Sierra Madre Oriental (SMO) solo se obtuvo en la línea base. Aunque las formas de las superficies pueden variar entre los 3 modelos de circulación general, los resultados fueron muy similares en cuanto a los efectos del cambio climático: desplazamiento de las áreas de endemismo, cambios en la composición biológica de cada área y pérdidas de áreas en el futuro.
Se observó que de las 23 áreas de endemismo para el presente, California (Cal) tiene la mayor riqueza de especies y el índice de endemicidad más alto (7.3), pero los porcentajes de superficie respecto al tamaño del país (2.1%) es de los más pequeños. Por otra parte, la Zona de Transición Mexicana (ZTM), la Península de Baja California (PBC), la Sierra Madre Oriental Norte (SMON), el Altiplano Mexicano (Altmex), el Pacífico (Pac) y la Zona de Transición Mexicana Amplia (ZTMA) fueron las que tuvieron la menor riqueza de especies. El área de mayor tamaño fue la ZTMA que cubre 47.1% del territorio nacional, seguida de Neártica Oeste (Neaoes) con 38.5%. Lo anterior indica que no existe una tendencia entre el tamaño y el IE, pero sí una relación entre el IE y el número de especies (fig. 2). Por otra parte, los IE más altos tienen una cierta tendencia a localizarse en las 2 partes extremas del país en términos de la latitud. En el norte, Cal (–116.09, 31.35) es la que tiene la mayor riqueza y el IE más alto, mientras que en el sur Oaxaca-Tehuacanense (Oaxteh) (–96.35, 17.26) y Neotropical Amplia (Neoamp) (–96.59, 18.99) son las que tienen la mayor cantidad de endemismos (fig. 3). Al comparar el escenario presente con los de cambio climático, se puede observar que bajo el escenario CGCM3 únicamente el 65% de las áreas de endemismo actuales está representado, mientras que en GFDLCM21 es el 60% y para HADCM3 el 69%, lo que hace a este último el menos severo en cambios en cuanto al número de áreas de endemismo. La permanencia de algunas áreas de endemismo indica cierta estabilidad y pocos efectos del cambio climático sobre estas, pero al considerar el IE y la composición, así como su transformación en tamaño y posición, la situación es distinta. Por tanto, de acuerdo con las ganancias o pérdidas en superficie, se encontró que de las 23 áreas del presente, solo 10 de ellas presentan ganancias en el porcentaje de superficie, en al menos un escenario. Dichos porcentajes oscilan entre 0.6 a 32% en CGCM3, del 4 al 32% en GFDLCM21 y del 5 al 31% en HADCM3. Por otra parte, las pérdidas van desde 4% en Neotropical (Neo) (HADCM3) hasta un 99% en Altmex (GFDLCM21; fig. 4). En cuanto a las tendencias de los cambios esperados para el 2090, se observó que las áreas de endemismo más afectadas para CGCM3 y GFDLCM21 son las del norte del país, mientras que las áreas de endemismo tropicales para HADCM3.
Relación entre el número de especies que componen las áreas de endemismo y su índice de endemicidad. El tamaño de las burbujas indica el porcentaje de superficie terrestre del país que ocupa el área. A) Altiplano Mexicano; B) Zona de Transición Mexicana Amplia; C) Neártica Oeste; D) Golfo de México; E) Distrito Este; F) Chiapas; G) Península de Baja California; H) Mohave; I) Pacífico Centro; J) Pacífico; K) Zona de Transición Mexicana; L) Neotropical Pacífico Central; M) Faja Volcánica Transmexicana; N) Sierra Madre Oriental Norte; Ñ) Tierras Altas de América Central; O) Sierra Madre Oriental; P) Neotropical; Q) Pacífico Norte; R) Soconusco; S) Península de Yucatán; T) Neotropical Amplia; U) California; V) Oaxaca-Tehuacanense.
Distribución en la longitud y la latitud de los índices de endemicidad en las áreas de endemismo del presente. El tamaño de las burbujas representa la magnitud del índice de endemicidad, donde el mayor corresponde a California con 7.3. A) California; B) Mohave; C) Península de Yucatán; D) Altiplano Mexicano; E) Neártica Oeste; F) Pacífico Norte; G) Pacífico; H) Pacífico Centro; I) Zona de Transición Mexicana Amplia; J) Zona de Transición Mexicana; K) Sierra Madre Oriental Norte; L) Faja Volcánica Transmexicana; M) Distrito Este; N) Sierra Madre Oriental; Ñ) Neotropical Amplia; O) Neotropical; P) Golfo de México; Q) Neotropical Pacífico Central; R) Oaxaca-Tehuacanense; S) Soconusco; T) Tierras Altas de América Central; U) Chiapas; V) Península de Yucatán.
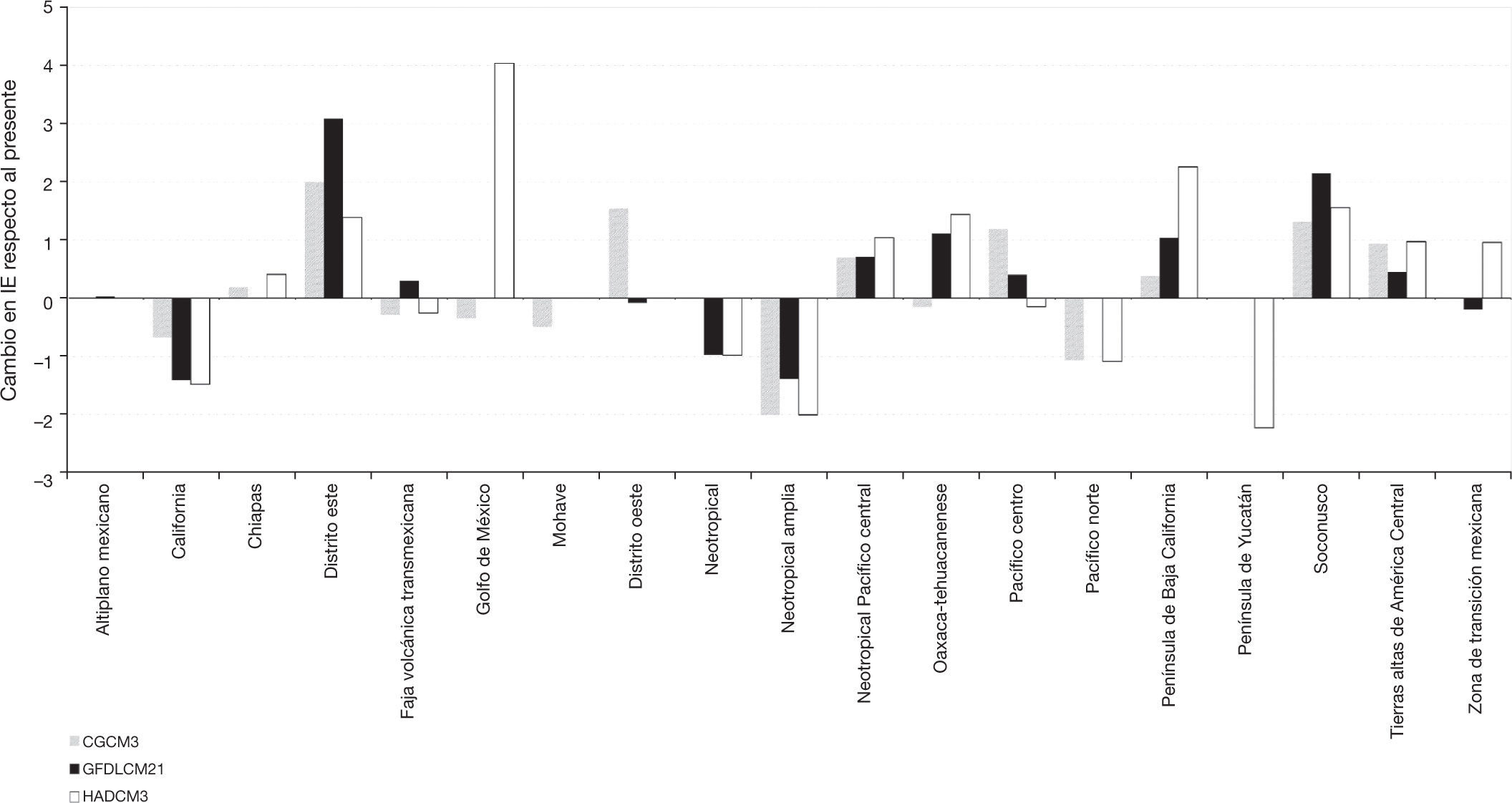
La relación del IE de las áreas de endemismo actuales con sus correspondientes en el futuro, también se vio afectada, siendo la Neotropical Amplia (Neoamp) y la Península de Yucatán (Penyuc) las áreas con mayores cambios negativos en el IE (–2.0 y –2.2, respectivamente), mientras que las áreas que tuvieron un mayor incremento en su IE fueron el Distrito Este (Disest) y el Golfo de México (Golmex; fig. 5).
Por otro lado, la vulnerabilidad de las áreas de endemismo en CGCM3 fue mayor en Neoamp con un factor relativo de vulnerabilidad (FRV) de 0.62 y menor en el Pacífico Centro (Paccen) y el Disest con 0.14. En el caso de GFDLCM, el área de endemismo con un mayor FRV fue la Neotropical (Neo) con 0.57, mientras con un FRV menor fue el Soconusco (Soc) con 0.20. El mayor FRV en HADCM3 se registró en Neoamp y el área de endemismo con menor FRV fue Golmex (fig. 6).
Las modificaciones en la composición de especies de las áreas de endemismo provocan un cambio en el factor relativo de vulnerabilidad (FRV). Este factor es mayor donde existen pérdidas de taxones endémicos o cambios de los mismos. Mientras que es menor donde se preservan las especies del escenario actual.
En el caso de la variación geográfica y distribución de los patrones se observó que en CGCM3, la tendencia general es un desplazamiento a mayores latitudes con un ligero desplazamiento al oeste. Las diferencias entre este escenario y el actual son: un desplazamiento máximo de 0.98° hacia el norte (PBC) y en algunos casos es un cambio a latitudes bajas de 0.58° (Tierras Altas América Central, TAAC); mientras que los cambios en la longitud presentan un desplazamiento al oeste que pueden llegar a ser hasta de 2.91° (TAAC). Para GFDLCM21, la tendencia general es un desplazamiento al noroeste, lo que se observa muy marcado en el caso de Neoamp con un cambio al oeste de 2.07° y 0.07° al norte, así como en el caso de PBC con un desplazamiento al norte de 1° y 0.81° al oeste. La tendencia general anterior es muy similar en HADCM3, donde Neoamp tiene un desplazamiento al oeste de 3.7° y al norte de 0.6, mientras que Paccen su distribución se recorre 0.7° al oeste y al norte (fig. 7). Cabe señalar que se puede inferir que el desplazamiento al sur de algunas áreas de endemismo se debe a la presencia de algún sistema montañoso ubicado al sur del área de endemismo o dentro de ella, como el caso de la Faja Volcánica Transmexicana y Distrito Este (FVTM y Disest), donde el desplazamiento al sur fue de 0.1° en 2 modelos para la Faja Volcánica Transmexicana (CGCM3 y GFDLCM21), mientras que para Disest entre 0.04 y 0.2.
DiscusiónEl impacto del cambio climático aquí observado coincide con otros estudios (Moritz et al., 2008; Trejo et al., 2011), los cuales indican que una de las respuestas esperadas para los mamíferos es el desplazamiento de su distribución, principalmente hacia latitudes norteñas y a altitudes mayores. Estas modificaciones se transfieren a los patrones de endemismo, dada la dependencia de estos a las distribuciones de las especies. Lo anterior trae consigo una limitante para su estudio, puesto que los vacíos de información ecológica y biogeográfica en la distribución de especies afectan el resultado de la identificación de las áreas de endemismo.
Aún con dicha limitante, los resultados obtenidos en cuanto a los patrones de endemismo para el presente coinciden con los propuestos en otros trabajos (Escalante et al., 2013; Ferrusquía-Villafranca et al., 2010; Morrone, 2001; Ramírez-Pulido y Castro-Campillo, 1992), lo que indica una mayor naturalidad de los patrones biogeográficos aquí descritos. Mientras que los cambios en las áreas de endemismo debidos al calentamiento global, son plausibles con la evidencia histórica del desplazamiento de los mamíferos y sus capacidades de adaptación (Barnosky, Hadly y Bell, 2003; Blois y Hadly, 2009). Por ejemplo: Bison perteneciente a Altmex es considerado por sus registros fósiles, característico de la provincia morfotectónica planicies y sierras de Chihuahua-Coahuila, y representativo del Rancholabreano (Pleistoceno) de las edades de mamíferos del Norte de América (Ferrusquía-Villafranca et al., 2010). Además, se empiezan a tener evidencias del impacto del cambio climático en sus poblaciones, debido a las limitantes que este fenómeno provocaría en la disponibilidad de recursos naturales para las poblaciones de especies como el bisonte (Craine, 2013; Koons et al., 2012).
Para ejemplificar los posibles cambios en la composición de especies en las áreas de endemismo se discuten los siguientes casos:
- 1)
La composición de especies en el Altiplano Mexicano. Al conocer que Peromyscus flavescens derivó de la diversificación de su ancestro entre el Mioceno tardío y el Pleistoceno, debido a los cambios climáticos que hicieron que los pastizales se expandieran por la parte central de América del Norte en los periodos secos (Hafner y Hafner, 1983; Neiswenter y Riddle, 2011); pastizales que ahora son vulnerables a un nuevo calentamiento global de mayor magnitud, se puede suponer que es posible el cambio de especies endémicas en el Altmex (P. flavescens por C. ludovicianus) en el futuro. Pero estos resultados no se pueden interpretar como una sustitución absoluta de una especie por otra, puesto que no se consideraron las interacciones entre las especies, ni otros factores como los recursos, tanto por las limitaciones del método como por el enfoque del estudio. Aunque dichos resultados sí indican cierta vulnerabilidad de los patrones al cambio climático, como se puede observar en el FVR del área.
- 2)
Cambios en la composición de la FVTM y el Disest. Dada la susceptibilidad y vulnerabilidad de la FVTM y Disest observada en el pasado (Pleistoceno; Ferrusquía-Villafranca et al., 2010; Gámez et al., 2012), la composición de especies para el futuro puede estar mucho más comprometida que en Altmex. Puesto que de ocurrir cambios en las distribuciones de las especies, esto puede agravarse por la fragilidad y escasez de los recursos naturales de la parte central en el país. En donde especies muy adaptadas a los zacatonales alpinos del Disest como Romerolagus diazii, posiblemente no esté en condiciones de competencia al interaccionar con especies adaptadas a diversas condiciones de la FVTM como Peromyscus y Neotomodon alstoni, que al presentarse un cambio climático se desplacen hacia la parte este de la FVTM. Aunque de la misma forma que en Altmex, los resultados deben considerarse como una evaluación de la vulnerabilidad de las áreas de endemismo y no se deben tomar como un hecho, los cambios esperados en el futuro ya se han observado de cierta forma en el pasado, puesto que la complejidad de la biodiversidad de la FVTM y del Disest está asociada a los cambios climáticos ocurridos en el Pleistoceno (Dawson, 2005; Williams, Ramírez-Pulido y Baker, 1985).
Por último, se encontraron algunas especies que en el pasado expandieron su distribución o se diversificaron, debido a los cambios climáticos a los que estuvieron expuestos en el Neógeno, y que actualmente contribuyen o son parte de algún área de endemismo vulnerable al moderno calentamiento global. Ejemplos de ello son: Peromyscus californicus (Dawnson, 2005), Chaetodipus californicus y C. fallax (Alexander y Ridlle, 2005; Hafner et al., 2007), Microtus californicus (Cudworth y Koprowski, 2010), Peromyscus zarhynchus (Dawson, 2005), Sorex stizodon (Hope, Speer, Demboski, Talbot y Cook, 2012), P. longimembris y P. crinitus (Hafner y Hafner, 1983; Johnson y Armstrong, 1987; Kurten y Anderson, 1980; Neiswenter y Riddle, 2011).
Por otra parte, las diferencias obtenidas en cada escenario tanto en las distribuciones potenciales y las áreas de endemismo en el futuro, se deben a la exposición a aumentos de la temperatura, mayores en las regiones del norte del país para CGCM3 y GFDLCM21 y en la parte sur para HADCM3, lo anterior asociado a una mayor disminución de la precipitación para los primeros y un ligero aumento en la parte sureste del país en el caso de HADCM3. Mientras que la vulnerabilidad de acuerdo con el FRV es muy similar en los 3 escenarios, coincidiendo en áreas de endemismo que abarcan todo el país (Neoamp y Neo) y que incluyen especies neárticas y neotropicales, por lo cual, es necesario que el FRV empleado incorpore directamente la exposición para observar mayores diferencias (Young et al., 2011). Si bien lo anterior es una limitante del FRV propuesto, este evalúa la vulnerabilidad de acuerdo con uno de los rasgos más importantes de las áreas de endemismo, las especies que la componen. Dicha vulnerabilidad es plausible con la propia historia de las áreas y sus especies, puesto que es mayor en áreas con biotas complejas como son Neoamp y Neo. Lo anterior, hace que el FRV tenga la ventaja de poder evaluar la vulnerabilidad de una forma rápida, pero eficiente de acuerdo con lo observado biogeográfica e históricamente.
El cambio climático repercutirá en la composición y distribución de los patrones de endemicidad de los mamíferos de México, en algunos casos hasta la ausencia de ellos en el futuro, dependiendo del escenario que se utilice. Por otra parte, dados los resultados obtenidos en el FRV, se puede afirmar que la vulnerabilidad es mayor en áreas de endemismo neotropicales que en áreas del norte de México. Aunque la estrecha relación entre las biotas de las áreas de endemismo, provoca que un cambio en la composición de especies en alguna de estas áreas, implique una modificación en las áreas adyacentes a cualquiera de ellas.
En cuanto a la vulnerabilidad de las áreas de endemismo de los mamíferos al cambio climático, posiblemente sea muy similar en los nuevos escenarios de cambio climático, dado que las tendencias socioeconómicas no han cambiado mucho, aun cuando se han señalado las consecuencias del cambio climático en diversos sectores. Por eso, para fines de conservación, es necesario ampliar la base de datos biológicos para desarrollar un índice de vulnerabilidad más robusto del aquí empleado, tomando a las áreas de endemismo como unidades biogeográficas históricas de manejo que permitan una aplicación práctica de lo presentado en este artículo.
AgradecimientosAl Dr. Oswaldo Téllez y la Dra. Cecilia Conde por su apoyo y comentarios a este trabajo. Al Posgrado en Ciencias Biológicas de la Universidad Nacional Autónoma de México y al Consejo Nacional de Ciencia y Tecnología por la beca otorgada para la realización de este proyecto. Así como al Dr. Gerardo Sánchez-Rojas por sus comentarios y observaciones.