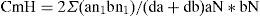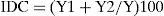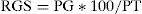El arroyo Yabotí se ubica en la selva Paranaense, punto importante en cuanto a la necesidad de conservación. El objetivo fue determinar la estructura y funcionamiento de la comunidad íctica del arroyo Yabotí con base en parámetros de diversidad, similitud, dominancia y biología reproductiva y alimentación. Se realizaron 4 campañas de pesca experimental entre noviembre de 2006 y noviembre de 2007 en 3 sectores del arroyo, utilizando una batería de 10 redes en coincidencia con las estaciones del año. La diversidad (H’) fue de 3.55 bits y no hubo diferencia significativa (p>0.05) entre los sectores de la cuenca. Se capturaron 1,327 individuos de 65 especies. La mayor similaridad fue entre la cuenca alta y baja, donde las especies dominantes fueron Apareiodon piracicabae (A. piracicabae) y Leporinus striatus (L. striatus). La mayor abundancia y diversidad específica se registró en la cuenca baja durante el invierno. Especies como A. piracicabae, L. striatus, Pimelodus absconditus, Steindachnerina brevipinna y Acestrorhynchus pantaneiro (A. pantaneiro) fueron dominantes durante la mayor parte del año. Los insectos y materia vegetal de origen alóctono fueron los recursos más consumidos, y dominaron las especies omnívoras y piscívoras. La cuenca baja fue la de mayor actividad reproductiva, registrándose la mayor RGS y hembras maduras de A. pantaneiro, A. piracicabae y L. striatus. La actividad reproductiva fue mayor durante el invierno y la primavera.
The present study was carried out in the Yabotí stream located in the Paraná Forest, in urgent need for conservation. The research aimed at determining the structure and dynamics of the fish community in the Yabotí stream. Data collection was focused on the following parameters: diversity, similarity, dominance, reproductive and feeding aspects. Four experimental fishing campaigns in 3 sections of the stream were organized between November 2006 and November 2007. Ten fishing nets were used and the activity was developed during the different seasons of the year. Diversity (H’) was 3.55 bit and no significant difference (p>.05) was observed. 1,327 individuals from 65 species were caught. The most outstanding similarity was between the high and the low basin where the dominant species were Apareiodon piracicabae (A. piracicabae) and Leporinus striatus (L. striatus). The highest abundance and specific diversity occurred in the lower basin during winter. Species such as A. piracicabae, L. striatus, Pimelodus absconditus, Steindachnerina brevipinna and Acestrorhynchus pantaneiro (A. pantaneiro) were the dominant ones most of the year. Insects and vegetal matter of allochthonous origin were the most consumed resouces. The lower basin was of greater reproductive activity, registering the largest RGS and mature A. pantaneiro, A. piracicabae and L. striatus females. Reproductive activity increased during winter and spring.
La provincia de Misiones está ubicada en la región Neotropical, subregión Guayano-Brasileña, y forma parte de la ecorregión selva Paranaense o Misionera (Burkart, Bárbaro, Sánchez y Gómez, 1999), una de las de mayor diversidad de Argentina (Giraudo et al., 2003). Según Myers, Mittermeier, Mittermeier, da Fonseca y Kent (2000) esta selva es el cuarto punto importante de biodiversidad en cuanto a la necesidad de conservación por la excepcional concentración de especies endémicas y la alta tasa de desaparición de sus ambientes. La fauna notablemente diversa incluye más de 300 especies de peces, además de otros vertebrados e invertebrados acuáticos; esta región tiene un alto grado de endemismo de especies de agua dulce (Olson et al., 2000).
La provincia cuenta con un gran número de áreas protegidas, entre ellas la Reserva de Biosfera Yabotí que se destaca por una importante red hidrográfica que corresponde a la cuenca del río Uruguay. La ictiofauna de esta cuenca es reconocida por el elevado número de especies endémicas (López, Miquelarena y Ponte-Gómez, 2005) y ha sido estudiada por diversos investigadores, especialmente en aspectos taxonómicos (Bonetto, 1976; Bonetto, 1986; López, 1990; Pozzi, 1945; Ringuelet, Arámburu y Alonso de Arámburu, 1967). Trabajos más recientes como los de Giraudo et al. (2003), Gómez y Chebez (1996), López, Miquelarena y Menni (2003) y López et al. (2005) han ampliado la información existente.
Aspectos relacionados con la comunidad de peces de los afluentes del río Alto Uruguay, inmersos en la Reserva de Biosfera Yabotí, han sido abordados en investigaciones como las realizadas por Araya, Hirt y Flores (2012) y Chatellenaz (2007). Para estos ambientes no se registran trabajos sobre la biología reproductiva y alimentación de los peces, sin embargo, diversos autores han caracterizado los hábitos alimentarios (Casciotta, Almirón y Bechara, 2005; Hahn, Agostinho, Gomes y Bini, 1998; Monasterio de Gonzo, Barros, Mamaní y Mosqueira, 2003; Sverlij, Delfino, López y Espinach-Ros, 1998; Vazzoler, Agostinho y Hann, 1997) y el comportamiento reproductivo de especies fluviales (Araya, Hirt y Flores, 2003; Flores, Araya y Hirt, 2009; Hirt, Araya y Flores, 2011).
Conocer los atributos que determinan la estructura y dinámica de una comunidad como nivel ecológico permite interpretar la organización de un nivel superior como el de ecosistema río-arroyo. La estimación de dichos atributos es relevante tanto para el entendimiento del comportamiento de la comunidad de peces como para la administración, manejo y conservación del recurso. El trabajo se realizó en la región ictiológica más diversa de Argentina; a pesar de ello, la información existente es incompleta para la mayoría de los cursos fluviales tanto de la vertiente del río Paraná (Araya, Hirt y Flores, 2013) como de la del río Uruguay. Baigun, Colautti, López, van Damme y Reis (2012) manifiestan la necesidad de ampliar los estudios sobre la ictiofauna en diferentes afluentes, ya que incluyen importantes humedales, particularmente aquellos que pueden ser dañados por el uso del suelo y del agua, afectando la diversidad biológica. El presente trabajo tiene por objetivo examinar la estructura y funcionamiento de la comunidad íctica del arroyo Yabotí con base en los parámetros de diversidad, similitud, dominancia y aspectos biológicos de reproducción y alimentación. Los resultados de esta investigación se integran a los ya publicados por Araya et al. (2012), dando continuidad a una base de datos que permitirá conocer la diversidad en el área y desarrollar futuros programas de conservación.
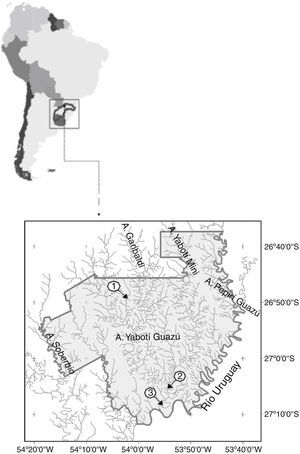
Materiales y métodosLa Reserva de Biosfera Yabotí está localizada en el centro-este de la provincia de Misiones (26°59’36” S, 53°59’4” O) cuenta con un importante desarrollo hidrográfico, destacándose el arroyo Yabotí o Pepirí-Miní integrado por 2 grandes cursos de agua, el Yabotí Guazú y el Yabotí Miní. La cuenca del arroyo Yabotí Guazú y el área correspondiente a los saltos del Moconá han sido calificadas como «Área de biodiversidad 44 sobresaliente» (Bertonatti y Corcuera, 2000). Se establecieron 3 sitios de muestreo (fig. 1): 1) Cuenca alta (26°50’11” S, 54°07’50.7” O), ubicado a 48km de la desembocadura en el río Uruguay. Se caracteriza por un ancho aproximado de 15m en aguas bajas, lecho rocoso y aguas claras con una secuencia de pozas y rápidos y abundante vegetación marginal característica de la selva misionera que propician la formación de microhábitats. La profundidad promedio fue de 1.61m; la velocidad de la corriente de 0.41m/s en promedio, variando entre 0.3 y 0.5m/s, y la transparencia fue de 1.46m. 2) Cuenca media (27°03’29” S, 53°53’03” O), ubicado en la denominada «Barra Yabotí» a 20km de la desembocadura con el río Uruguay en la confluencia de los arroyos Yabotí Guazú y Yabotí Miní. Las márgenes son altas y abruptas con un importante desarrollo de vegetación marginal; se observan extensos y profundos remansos con sustrato rocoso-arenoso. La profundidad promedio fue de 3.53m; la velocidad de la corriente de 0.77m/s en promedio, variando entre 0.05 y 2.23m/s y la transparencia 1.66m. 3) Cuenca baja (27°08’29” S, 53°55’50” O), ubicado a 2km de la desembocadura en el río Uruguay, el cauce se ensancha a 25m, aproximadamente, y la profundidad es variable por el desarrollo de pozas y rápidos, la vegetación marginal es importante. La profundidad promedio fue 2.38m; la velocidad de la corriente de 0.33m/s en promedio, variando entre 0.07 y 0.6m/s y la transparencia 2.04m.
Se realizaron 4 campañas de pesca experimental coincidiendo con las estaciones del año, en el periodo comprendido entre noviembre de 2006 y noviembre de 2007. Se utilizaron redes de espera monofilamento, cuyos tamaños de malla fueron 2.5, 3, 3.5, 4.5, 6, 7, 8, 10 y 12cm entre nudos opuestos. Las redes estuvieron caladas durante 24h en cada sitio de muestreo y fueron revisadas cada 12h. Las condiciones físicas y topográficas de la zona hacen difícil aumentar la frecuencia de colecta de la captura. De los ejemplares capturados se registró la especie, longitud estándar (cm), peso total (g), sexo, peso de gónadas (g), estadio de maduración gonadal, grado de llenado gástrico e intestinal. Se analizó la diversidad específica de la comunidad íctica en los diferentes sitios de muestreo, aplicando el índice de Shannon. Para determinar la existencia de diferencias entre las medidas de diversidad se aplicó Anova con medias repetidas utilizando los lugares de muestreo y las estaciones del año como factores.
La similaridad se estimó según el índice de Morisita-Horn modificado por Wolda (1983), cuya fórmula es:
donde aN es el número total de individuos en la estación A y an1 el número de individuos de la i-ésima especie en A (Magurran, 1987). Se calculó el índice de dominancia comunitaria (IDC) de McNaughton, según la fórmula de Goulding, Leal-Carvalho y Ferreira (1988):donde Y1+Y2 es la suma de la abundancia de las 2 especies dominantes, e Y: es la suma de la abundancia de todas las especies. Se calculó la constancia específica como medida de la frecuencia de aparición de una especie según la fórmula:donde x es el número de veces que aparece una especie en el muestreo y n el número total de muestras. Las especies fueron clasificadas según las categorías propuestas por Lasso (2001), donde C1: raras o accidentales (C<25%), C2: comunes o accesorias (C>25% y<50%) y C3: comunes o abundantes (C3:>50%).Se estudió la composición y estructura de la comunidad de peces mediante análisis canónico de componentes principales (CAP), el que utiliza la medida de similaridad de Bray Curtis y 999 permutaciones para establecer diferencias significativas entre las distintas comunidades de peces de los sitios de muestreo y las estaciones del año. Para el cálculo se utilizó el programa de computación CAP. Se utilizó la captura por unidad de esfuerzo en número como medida de abundancia relativa por especie, sitio y estación del año expresada en número de individuos/100m2 de red/por 24h de pesca (ind/100m2/24h).
Los estudios de alimentación se realizaron basándose en la categorización semicuantitativa del llenado estomacal (lleno, semilleno y vacío) y según la metodología propuesta por Prej y Colomine (1981), estableciéndose los ítems alimentarios de las especies de frecuente captura. Se definieron 5 categorías tróficas: detritívoro, omnívoro, piscívoro, carnívoro amplio y detritívoro-herbívoro siguiendo la clasificación propuesta por Hahn et al. (1998). También se utilizaron datos bibliográficos sobre las categorías tróficas de otras 21 especies.
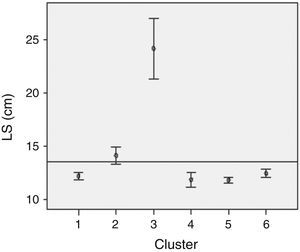
Para evaluar la actividad reproductiva, se calculó la relación gonadosomática (RGS) promedio siguiendo un criterio temporal y espacial según la fórmula:
donde PG es el peso gonadal en gramos y PT el peso total en gramos. Se determinaron los estadios gonadales siguiendo criterios macroscópicos tales como color, transparencia, vascularización superficial, flacidez y, en el caso de ovarios, tamaño y posición en la cavidad abdominal y grado de visualización de los ovocitos. Para caracterizar a las especies según el tamaño ovocitario se midieron 100 ovocitos de cada hembra madura utilizando un microscopio con ocular micrométrico.Con el fin de evidenciar una asociación en la comunidad de peces se utilizó el método de análisis de conglomerados en 2 fases (twostep cluster); se optó por este procedimiento por la ventaja de seleccionar automáticamente el mejor número de agrupaciones y por la posibilidad de analizar archivos con gran cantidad de datos. Las variables seleccionadas fueron cuantitativas (longitud estándar) y cualitativas (estación del año, sitio de muestreo y estadio reproductivo). Los ejemplares testigos fueron depositados en la colección científica Fauna íctica de Misiones, en la Facultad de Ciencias Exactas, Químicas y Naturales de la Universidad Nacional de Misiones y en el Instituto de Limnología de La Plata, Argentina.
ResultadosAraya et al. (2012) identificaron 65 especies para el arroyo Yabotí. Los resultados del presente estudio demostraron que la diversidad (H¿) fue de 3.55bits, siendo más elevada en la cuenca media (H¿ 4.06), seguida por la cuenca alta (H¿ 3.86) y la cuenca baja (H¿ 3.03). Por Anova, sin embargo, estas variaciones entre los sectores de la cuenca no fueron significativas (p>0.05). El análisis de similitud entre los sectores de la cuenca indica la presencia de 17 especies comunes (tabla 1). El índice de Morisita-Horn que combina la composición y abundancia relativa de las especies evidenció un valor de 0.52 entre la cuenca alta y media, siendo mayor la aproximación estructural entre la cuenca alta y baja (0.82). Por otra parte, en la cuenca alta y baja el índice de dominancia comunitaria mostró la predominancia de Apareiodon piracicabae (A. piracicabae) y Leporinus striatus (L. striatus), mientras que en la cuenca media las especies dominantes fueron Acestrorhynchus pantaneiro (A. pantaneiro) e Hypostomus isbrueckeri (tabla 2).
Composición y abundancia relativa por lugar de muestreo expresada en porcentaje.
| Especies | C.A. | C.M. | C.B. | C.T. |
|---|---|---|---|---|
| Apareiodon piracicabae (Eigenmann, 1907) | 3.84 | 0.15 | 15.83 | O |
| Steindachnerina brevipinna (Eigenmann y Eigenmann, 1889) | 1.43 | 0.98 | 4.14 | D |
| Steindachnerina cf. biornata | 0.23 | 0.08 | D | |
| Leporinus obtusidens (Valenciennes, 1836) | 0.08 | 0.08 | Oa | |
| Leporinus striatus (Kner, 1858) | 6.93 | 1.73 | 14.54 | O |
| Schizodon nasutus (Kner, 1858 | 0.98 | 0.08 | 0.53 | DH |
| Hoplias malabaricus (Bloch, 1794) | 0.30 | Pb | ||
| Hoplias lacerdae (Miranda Ribeiro, 1908) | 0.15 | 0.90 | 0.08 | P |
| Acestrorhynchus pantaneiro (Menezes, 1992) | 1.43 | 2.86 | 4.30 | P |
| Rhaphiodon vulpinus (Spix y Agassiz, 1829) | 0.08 | Pb | ||
| Astyanax asuncionensis (Géry, 1972) | 0.45 | 0.83 | Oc | |
| Astyanax fasciatus (Cuvier, 1819) | 0.83 | 0.23 | 0.15 | Pd |
| Astyanax saguazu (Caciotta, Almirón y Azpelicueta, 2003) | 3.54 | 0.68 | ||
| Astyanax troya (Azpelicueta, Casciotta y Almirón, 2002) | 0.15 | 0.08 | ||
| Astyanax abramis (Jenyns, 1842) | 0.30 | 0.60 | CAd | |
| Astyanax ojiara (Aspelicueta y García, 2000) | 0.38 | |||
| Astyanax paris (Azpelicueta, Almirón y Casciotta, 2002) | 0.90 | 0.08 | DH | |
| Astyanax ita (Almirón, Azpelicueta y Casciotta, 2002) | 0.23 | 0.23 | ||
| Astyanax tupi (Azpelicueta, Miranda, Almirón y Casciotta, 2002)Astyanax sp. | 0.30 | 0.080.15 | ||
| Astyanax sp. AAstyanax sp. B | 0.08 | 0.530.23 | ||
| Astyanax sp. C | 0.08 | |||
| Astyanax sp. D | 0.08 | |||
| Galeocharax humeralis (Valenciennes, 1834) | 0.08 | 0.90 | Pd | |
| Oligosarcus hepsetus (Cuvier, 1829) | 0.15 | CAe | ||
| Oligosarcus jenynsii (Günter, 1864) | 0.90 | 0.15 | P | |
| Oligosarcus sp. | 0.08 | |||
| Salminus brasiliensis (Cuvier, 1816) | 0.08 | 0.15 | Pa | |
| Serrasalmus maculatus (Kner, 1858) | 0.15 | Pa | ||
| Prochilodus lineatus (Valenciennes, 1836) | 0.08 | Df | ||
| Platydoras armatulus (Valenciennes, 1840) | 0.08 | Of | ||
| Rhinodoras dorbignyi (Kner, 1855) | 0.08 | 0.15 | Od | |
| Trachelyopterus striatulus (Steindachner, 1877) | 0.30 | 0.30 | CA | |
| Auchenipterus osteomystax (Miranda Ribeiro, 1918) | 0.15 | Oa | ||
| Pimelodus absconditus (Azpelicueta, 1995) | 0.30 | 0.68 | 6.18 | O |
| Pimelodus maculatus (Lacépède, 1803) | 0.23 | 0.38 | O | |
| Iheringichthys labrosus (Lütken, 1874) | 0.08 | 1.28 | O | |
| Rhamdia quelen (Quoy y Gaimard, 1824) | 0.15 | 0.30 | 0.15 | P |
| Pimelodella gracilis (Valenciennes, 1835) | 0.15 | Of | ||
| Hypostomus aspilogaster (Cope, 1894) | 0.15 | |||
| Hypostomus luteomaculatus (Devincenzi, 1942) | 0.15 | Dd | ||
| Hypostomus commersonii (Valenciennes, 1836) | 0.15 | Dd | ||
| Hypostomus isbrueckeri (Reis, Weber y Malabarba, 1990) | 0.15 | 1.73 | 0.45 | |
| Hypostomus regani (Ihering, 1905) | 0.08 | |||
| Hypostomus sp. | 0.08 | 0.15 | ||
| Hypostomus sp. A | 0.15 | 1.28 | 0.45 | |
| Hypostomus sp. B | 0.15 | 0.23 | 0.15 | |
| Hypostomus sp. C | 0.08 | |||
| Hemiancistrus fuliginosus (Cardoso y Malabarba, 1999) | 1.96 | 0.30 | 0.15 | |
| Hemiancistrus sp. A | 0.08 | |||
| Rineloricaria sp. | 0.08 | 0.08 | ||
| Crenicichla lepidota (Heckel, 1840) | 0.38 | 0.08 | 0.45 | CAf |
| Crenicichla vittata (Heckel, 1840)Crenicichla celidochilus (Casciotta, 1987) | 0.080.15 | 0.230.08 | 0.830.38 | Pf |
| Crenicichla minuano (Lucena y Kullander, 1992) | 0.15 | |||
| Crenicichla missioneira (Lucena y Kullander, 1992) | 0.23 | 0.23 | 0.45 | |
| Crenicichla sp. | 0.08 | |||
| Gymnogeophagus sp. | 0.23 | |||
| Gymnogeophagus sp. A | 0.08 | 0.08 | ||
| Gymnogeophagus sp. B | 0.08 | |||
| Gymnogeophagus balzanii (Perugia, 1891) | 0.15 | 0.08 | CAf | |
| Pachyurus bonariensis (Steindachner, 1879) | 0.08 | |||
| Eigenmania trilineata (López y Castello, 1966) | 0.23 | 0.83 | CAa |
C.A.: cuenca alta; CA: carnívoro amplio; C.B.: cuenca baja; C.M.: cuenca media; C.T.: categorías tróficas; D: detritívoro; DH: detritívoro-herbívoro; I: insectívoro; O: omnívoro; P: piscívoro.
Índice de dominancia comunitaria por lugar de muestreo. Arroyo Yabotí.
| Lugar de muestreo | N | Número de especies | IDC | Especies dominantes |
|---|---|---|---|---|
| Cuenca alta | 371 | 39 | 38 | Apareiodon piracicabae |
| Leporinus striatus | ||||
| Astyanax saguazu | ||||
| Cuenca media | 187 | 32 | 32 | Acestrorhynchus pantaneiro |
| Hypostomus isbrueckeri | ||||
| Leporinus striatus | ||||
| Cuenca baja | 769 | 50 | 52 | Apareiodon piracicabae |
| Leporinus striatus | ||||
| Pimelodus absconditus |
IDC: índice de dominancia comunitaria.
En el análisis de los 3 sitios de muestreo en conjunto y según las categorías propuestas por Lasso (2001), A. pantaneiro, Astyanax fasciatus (A. fasciatus), A. piracicabae, L. striatus, Steindachnerina brevipinna (S. brevipinna) y Pimelodus absconditus (P. absconditus) fueron especies constantes, el 38% accesorias y el 53% accidentales. Al explorar por sitio de muestreo no se registraron especies accidentales, siendo 12 las especies constantes en la cuenca alta y 14 en las cuencas media y baja. A. pantaneiro y A. fasciatus fueron constantes en los 3 tramos considerados, otras de abundante captura como L. striatus fue constante en los tramos alto y bajo, mientras que A. piracicabae, P. absconditus y S. brevipinna en los tramos medio y bajo.
Del total de las especies, 15 fueron capturadas únicamente en la cuenca baja del arroyo Yabotí, algunas de pequeño porte como Astyanax tupi (A. tupi), Crenicichla minuano (C. minuano) y Platydoras armatulus, otras como Rhaphiodon vulpinus (R. vulpinus) y Auchenipterus osteomystax (A. osteomystax) de mediano porte y propias de ambientes de río. Los resultados del análisis canónico de componentes principales indican que no hay diferencia significativa (p>0.05) en la composición y abundancia (captura por unidad de esfuerzo en número) entre los sitios de muestreo y entre las estaciones del año. La captura total fue de 73 (ind/100m2/24h), registrándose la mayor abundancia en la cuenca baja (128 ind/100m2/24h) durante el invierno (106 ind/100m2/24h). La composición específica analizada por estación del año mostró que el invierno fue más diverso con 41 especies; entre las que fueron más abundantes encontramos L. striatus, A. piracicabae, A. pantaneiro, S. brevipinna y Hemiancistrus fuliginosus, en tanto la primavera con 19 especies, fue la de menor diversidad. Veintiocho especies tuvieron registro en una sola estación, destacándose A. osteomystax, A. tupi, C. minuano, Crenicichla vittata, Hypostomus luteomaculatus (H. luteomaculatus), Hypostomus regani; y otras como L. striatus, A, piracicabae, A. pantaneiro, S. brevipinna, Iheringichthys labrosus y Astyanax abramis fueron capturadas en las 4 estaciones del año (fig. 2).
El análisis del contenido estomacal de una submuestra de 110 estómagos pertenecientes a individuos de 14 especies mostró 6 vacíos, 24 semillenos y los restantes llenos. Los alimentos identificados fueron agrupados en los siguientes ítems: a- insectos: larvas y pupas de los órdenes Trichoptera y Diptera (Quironomidae); b- detritos: materia orgánica particulada, barro, sedimento, arena y piedras; c- restos vegetales; d- gasterópodos de diferentes especies; e- escamas; y f-peces. Los recursos más utilizados fueron los insectos y la materia vegetal de origen alóctono (tabla 3). Con base en los ítems alimentarios identificados en las 14 especies estudiadas y utilizando datos bibliográficos correspondientes a otras 21 especies, fueron reconocidas 5 categorías tróficas: 1) omnívoras: 11 especies; 2) piscívoras: 11 especies, 3) detritívoras-herbívoras: 2 especies; 4) detritívoras: 5 especies; 5) carnívoras amplias: 6 especies. Para las demás especies presentes en este sistema, hasta el momento no se cuenta con datos sobre su alimentación (tabla 1).
Ítems alimentarios predominantes para 14 especies de peces del arroyo Yabotí.
| Especies | n | Rango LS (cm) | IAP |
|---|---|---|---|
| Pimelodus absconditus | 26 | 11-18 | Insectos, detritos, RV, gasterópodos |
| Leporinus striatus | 23 | 11-15 | RV, insectos, gasterópodos, Bacillariophyceae, Clorophyceae |
| Steindachnerina brevipinna | 17 | 7.5-10.5 | Detritos |
| Apareiodon piracicabae | 12 | 10-13 | Detritos, insectos, RV |
| Schizodon nasutus | 9 | 22-36 | RV, Bacillariophyceae, Clorophyceae |
| Iheringichthys labrosus | 6 | 7.5-21 | Insectos, detritos, RV |
| Acestrorhynchus pantaneiro | 3 | 14-16 | Peces |
| Steindachnerina biornata | 2 | 10-12 | Detritos |
| Trachelyopterus striatulus | 2 | 10-18 | Insectos, peces, gasterópodos |
| Pimelodus maculatus | 2 | 12.5-26 | Insectos, detritos |
| Rhamdia quelen | 1 | 16 | Insectos, peces y escamas, RV |
| Astyanax parís | 1 | 7.5 | RV |
| Oligosarcus jenynsii | 1 | 16 | Peces y escamas |
| Hoplias lacerdae | 1 | 46 | Peces |
IAP: ítems alimentarios predominantes; LS: longitud estándar; RV: restos vegetales.
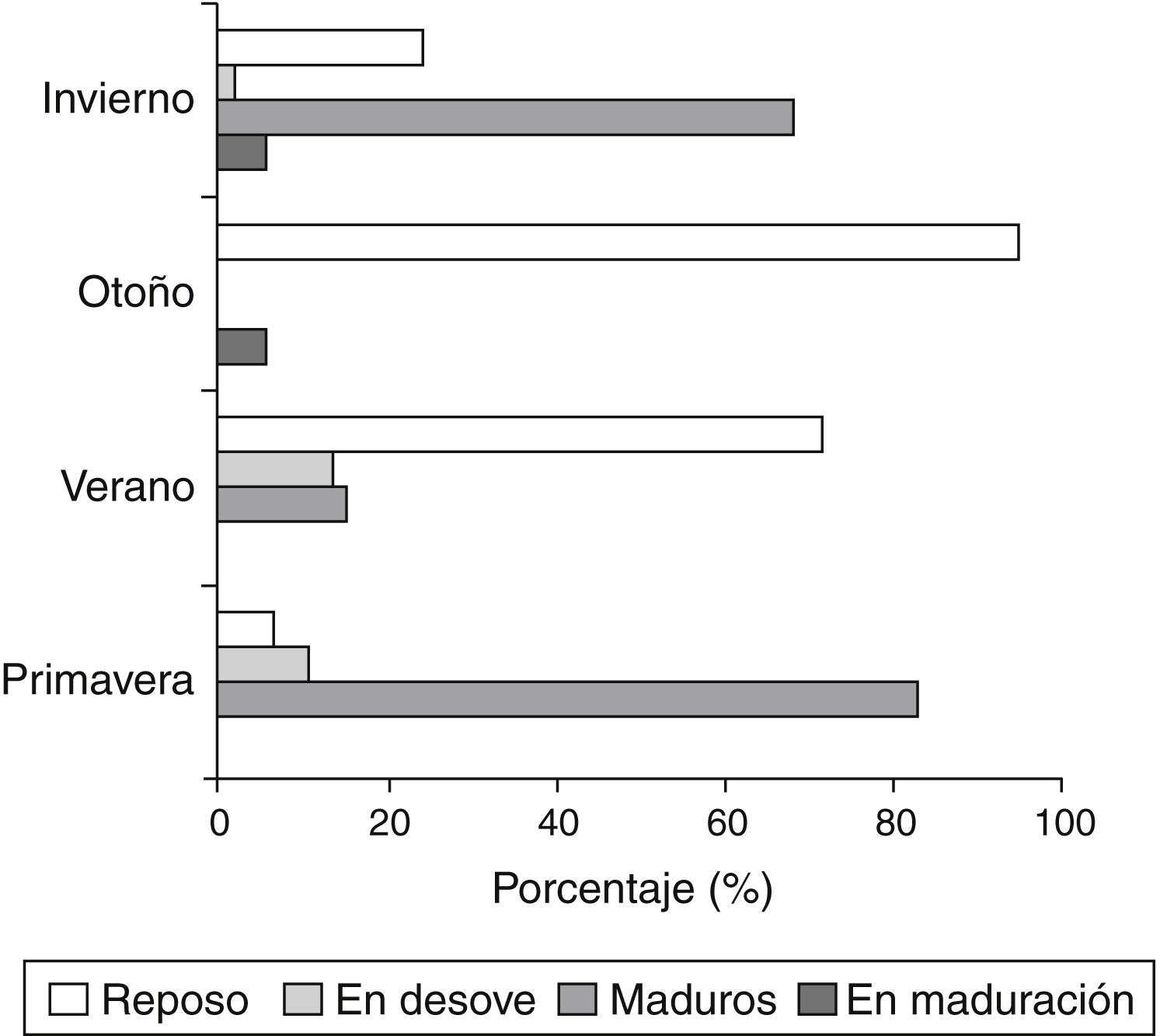
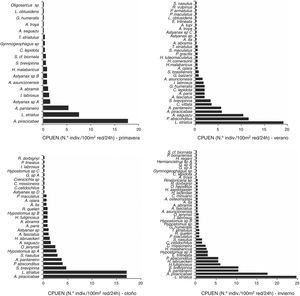
Respecto a la reproducción, el 54% de los individuos sexados (n: 472) presentó signos de actividad reproductiva. Se registraron hembras maduras de especies como A. piracicabae (50%), L. striatus (34%) y A. pantaneiro (10%), otras como S. brevipinna, Steindachnerina biornata y Galeocharax humeralis representaron el 1% cada una. La actividad reproductiva fue intensa durante la primavera, invierno y verano, estaciones en las que se registró el mayor número de individuos maduros y la relación gonadosomática media más elevada (4.5, 4.72 y 3.59%, respectivamente). Durante el otoño disminuyó la RGS (1.25) en relación con el predominio de individuos en reposo gonadal (fig. 3).
En la cuenca baja la actividad reproductiva fue importante, registrándose la mayor RGS media (7.13%) y hembras maduras de especies abundantes como A, piracicabae, L. striatus y A. pantaneiro, y otras de menor captura como Leporinus obtusidens (L. obtusidens). La medición del diámetro máximo de los ovocitos maduros de 6 especies permitió la caracterización de 2 grupos, el primero, que incluye especies con fecundación interna o que desarrollan cuidado parental como H. luteomaculatus (1,850μm), A. osteomystax (1,414μm) y Trachelyopterus striatulus (T. striatulus) (1,415μm) que presentaron los ovocitos de mayor tamaño, frente al otro que incluye especies de fecundación externa sin cuidado parental, cuyos ovocitos fueron más pequeños, tal el caso de L. striatus (840μm), A, piracicabae (770μm), Astyanax asuncionensis (680μm) y Lycengraulis grossidens (550μm).
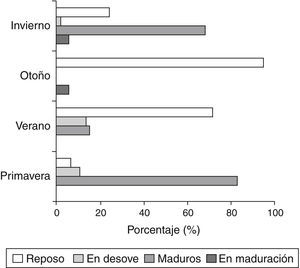
Tomando como variable la longitud estándar, el análisis cluster mostró que la comunidad íctica está integrada por organismos de una talla promedio de 13.52cm, distribuidos en 6 conglomerados (fig. 4). El más numeroso tiene como variable de importancia el lugar de muestreo, siendo este la cuenca alta. Las especies que se destacan son: L. striatus, A, piracicabae, Astyanax saguazu, S. brevipinna y A. pantaneiro. El cluster 3 que presenta la mayor variación respecto a la variable longitud es el menos numeroso e incluye individuos de talla superior al promedio (24.1cm). Los clusters 4, 5 y 6 aglomeran organismos capturados en la cuenca baja y en ellos adquiere relevancia la variable estadio reproductivo en coincidencia con los mayores valores hallados en la RGS promedio. Las especies más abundantes fueron: A. piracicabae, L. striatus, P. absconditus, S. brevipinna y A. pantaneiro.
DiscusiónLa diversidad específica del arroyo Yabotí es alta en comparación con otros afluentes del río Uruguay tales como el Quaraí Chico donde se identificaron 37 especies (Castro-Pessano et al., 2005), 53 en el Santa María (Bossemeyer, Weis, Benemann y Bier, 1985), 26 en los ríos Jaguarí y Cambará (Copatti y Copatti, 2011; Copatti, Gonçalves-Zanini y Valente, 2009). La elevada diversidad en los cuerpos de agua neotropicales ha sido interpretada considerando factores como el aislamiento geográfico de los continentes y la diversidad de hábitats (Agostinho, Gomes y Pelicice, 2007). En ambientes acuáticos de América del Sur Barletta et al. (2010) han identificado la pérdida de hábitat como la principal causa de degradación de la biodiversidad. En este contexto el arroyo Yabotí, uno de los principales cursos de agua de la Reserva de Biosfera Yabotí, puede considerarse prístino dada la mínima o nula acción antrópica.
El patrón de distribución de la ictiofauna en un sistema fluvial acompaña los cambios físicos y químicos del agua en el gradiente longitudinal (Vannote, Ninshall, Cummins, Sedell y Cushing, 1980), que no solo permite el establecimiento de comunidades adaptadas a hábitats particulares, sino también la dinámica de adición, remoción o sustitución de especies. Así, especies como A. piracicabae y L. striatus fueron capturadas en los 3 sectores del arroyo Yabotí, otras solo estuvieron presentes en un sector particular, tal es el caso de Hoplias lacerdae Miranda-Ribeiro, 1908 e Hypostomus aspilogaster Cope, 1894. Se evidenció una variación en la riqueza específica a lo largo del arroyo, aumentando el número de especies hacia la desembocadura asociado a una mayor complejidad estructural y funcional, tal y como han propuesto Matthews (1998) y Vannote et al. (1980).
La desembocadura del arroyo Yabotí en el río Uruguay es un sector cuyos ambientes son utilizados por especies propias del río (Araya et al., 2012), aumentando la diversidad específica. El índice de diversidad (H¿) alfa fue mayor en los otros sectores de la cuenca, hecho que podría atribuirse al índice utilizado, ya que está influido por la abundancia de las especies, siendo que 12 de las registradas exclusivamente en la cuenca baja totalizaron 23 individuos. Según Lemes y Garutti (2002) la frecuencia de presencia de una especie parece reflejar la capacidad de explotar los recursos presentes en el biotopo en diferentes momentos y dependiendo de la fase del ciclo de vida. Uieda (1984) argumenta que, además de distinguir entre especies migrantes y residentes, permite demostrar posibles efectos de los cambios estacionales sobre la comunidad; en este sentido un bajo porcentaje de especies constantes como el registrado en este estudio (9%) podría explicarse con base en diferencias entre los distintos hábitats, tal como proponen Pavanelli y Caramaschi (1997) para pequeños tributarios del río Paraná.
Los cambios en la estructura de la comunidad son los esperados a lo largo del año, dado que los organismos son afectados por las variaciones estacionales de los factores ambientales. En este trabajo se verificó que la captura de invierno fue la más abundante, como así también la de mayor diversidad específica. Este resultado no es el esperado si consideramos lo expresado por Wootton (1990), quien manifiesta que la eficiencia de las redes de espera, por ser artes de pesca pasiva, están influidas por los movimientos de los peces, que son más activos en periodos de temperatura más elevadas. Esta relación directa entre las capturas y la temperatura ha sido verificada por Copatti et al. (2009). Lowe-McConnell (1987) atribuye a los cambios en el nivel hidrométrico la estacionalidad de los ríos tropicales, lo que interfiere en la dinámica poblacional de las especies y los movimientos tróficos y reproductivos. Por su parte, trabajos realizados por Suárez y Petrere, (2006a, 2006b) sobre la organización de la comunidad íctica a lo largo del río Iguatemi, Mato Grosso do Sul, validan la influencia que tiene el volumen de agua en la distribución de los peces. Se podría inferir que los cambios del nivel hidrométrico podría ser una de las causas que modelarían la estructura de la comunidad íctica del arroyo Yabotí, al haberse registrado durante el invierno (agosto) y principio de primavera (octubre) los mayores niveles en el río Uruguay, en Puerto San Javier, según datos de la Prefectura Naval Argentina. Esta relación se deberá corroborar con nuevos estudios.
Los recursos alimentarios utilizados por la comunidad de peces pueden ser muy variados y dependen de las particularidades de cada ambiente (Fugi, Hahn y Agostinho, 1996). En ambientes similares al estudiado las lluvias intensas provocan la elevación brusca de nivel y alteraciones del lecho, induciendo el arrastre con alteraciones y renovación de la biota. El análisis del contenido estomacal de 14 especies permitió verificar un amplio espectro alimentario con preferencia por determinadas fuentes de energía, entre las que se destacan la materia de vegetales superiores y los insectos. Resultados similares fueron encontrados por Hahn, Andrian, Fugi y Lescano-de Almeida (1997) en distintos ambientes de la planicie de inundación del Alto río Paraná (Brasil). En relación con la estructura trófica, los omnívoros y piscívoros fueron las categorías que reunieron el 62% de las especies estudiadas. En ambientes de río, Agostinho, Hahn, Gomes y Bini (1997) evidenciaron una elevada participación de peces piscívoros, siendo esta una característica de las comunidades de peces tropicales (Lowe-McConnell, 1987). En el ambiente estudiado las especies detritívoras/herbívoras no fueron numerosas, a pesar de haberse demostrado la dependencia de la comunidad íctica respecto del material alóctono proveniente de la vegetación riparia. Este hecho marca la necesidad de conservación de la vegetación marginal para mantener la ictiofauna, especialmente aquellas especies con baja capacidad de movilizarse y que dependen de las condiciones locales existentes (Copatti y Copatti, 2011).
La mayor actividad reproductiva registrada en la cuenca baja del arroyo Yabotí podría relacionarse con la hipótesis planteada por Reynalt-Tataje, Hermes-Silva, da Silva, Bialetzki y Zaniboni-Filho (2008), según la cual la desembocadura de los tributarios se constituye en áreas de reproducción. En este contexto y coincidiendo con lo observado por Zaniboni-Filho y Schulz (2003), la topografía del río Uruguay permite que las lluvias eleven rápidamente el nivel hidrométrico, provocando el represamiento de los sectores inferiores de los tributarios, favoreciendo así las condiciones ambientales para el desarrollo de huevos y larvas de especies tales como Salminus brasiliensis (S. brasiliensis) (dorado), L. obtusidens (boga) y Prochilodus lineatus (sábalo) que ingresan desde el río en una época determinada del año. Según Reynalt-Tataje et al. (2008), la estrategia reproductiva caracterizada por fecundación externa y sin cuidado parental es favorecida por la formación de remansos, ya que estos ambientes son utilizados como áreas de desarrollo de larvas y alevines. En el arroyo estudiado A. pantaneiro, A. piracicabae y L. striatus, especies más abundantes, exhibieron la estrategia descrita. Para la mayoría de las especies que se capturaron en el arroyo Yabotí no existen datos de referencia sobre diámetro máximo de los ovocitos maduros, exceptuando los mencionados por Vazzoler (1996) y Nakatani et al. (2001) para ejemplares del Alto río Paraná de especies como A. osteomystax (1,315μm), Hoplias malabaricus (H. malabaricus) (2,445μm) y Apareiodon affinis (971μm).
Entre las especies presentes con menor abundancia, A. osteomystax se destaca por brindar cuidados parentales; y Trachelyopterus striatulus, H. malabaricus, H. luteomaculatus, Hypostomus commersonii y Gymnogeophagus sp. por presentar fecundación interna. En estos casos, los ovocitos maduros son de mayor tamaño lo que se traslada a valores más bajos de fecundidad, revelando la relación entre estrategia reproductiva y tamaño alcanzado por los ovocitos maduros que según la teoría de la inversión parental de Trivers (1972) y el modelo triangular de historia de vida de Winemiller (2005) contribuyen a asegurar la eficacia biológica de la progenie. Según Zaniboni-Filho y Schulz (2003), el 11% de las especies presentes en el tramo brasileño de la cuenca del río Uruguay son migratorias, entre ellas Brycon orbignyanus, S. brasiliensis, R. vulpinus y Schizodon nasutus realizan migraciones por el cauce principal, o hacia los tributarios, ambientes en los que se produce el desove. Este podría ser otro factor relacionado con la mayor diversidad específica registrada en la cuenca baja del arroyo Yabotí. El análisis cluster constituye una primera aproximación a teorizar sobre la distribución por talla, actividad reproductiva y la utilización del espacio por parte de las especies relevadas. Podemos decir que las más abundantes en el arroyo Yabotí son A. piracicabae, L. striatus y A. pantaneiro de pequeño y mediano porte, distribuidas en los 3 sectores de la cuenca, sin cuidado parental y de fecundación externa.
Queremos expresar nuestro agradecimiento a los becarios del proyecto de investigación «Una alternativa turística para la Reserva Yabotí: la fauna íctica y su uso potencial en la pesca deportiva con devolución»; a los encargados del Refugio Moconá, a los guardaparques del Parque Provincial Moconá y Ministerio de Ecología y Recursos Naturales Renovables de la Provincia de Misiones. A M. Godoy y C. Benassi de la FCEQyN, por la revisión del abstract. El presente trabajo fue subsidiado por SECTyP-PFIP convocatoria 2005.
La revisión por pares es responsabilidad de la Universidad Nacional Autónoma de México.