¿ Introducción
El síndrome de Sjögren es una enfermedad multisistémica de origen autoinmune, caracterizada por queratoconjuntivitis sicca, xerostomía, presencia de diversos autoanticuerpos en sangre, hipergammaglobulinemia policlonal, gran variedad de desórdenes inmunológicos y aumento en el riesgo de linfoma.1 Debido a una estimulación crónica del sistema inmune, los pacientes con síndrome de Sjögren tienen un riesgo mayor de desarrollar enfermedades linfoproliferativas; 5% de los pacientes con síndrome de Sjögren primario, desarrollaran Linfoma No Hodgkin de células B. El riesgo se asocia a la hiperactividad de las células B y la disminución de la actividad natural de las células asesinas.1
Esta patología afecta a glándulas exocrinas, primordialmente a las glándulas lagrimales y salivales,2 y también puede involucrar algunos otros órganos, como la membrana mucosa vaginal, respiratoria y gástrica.3,4
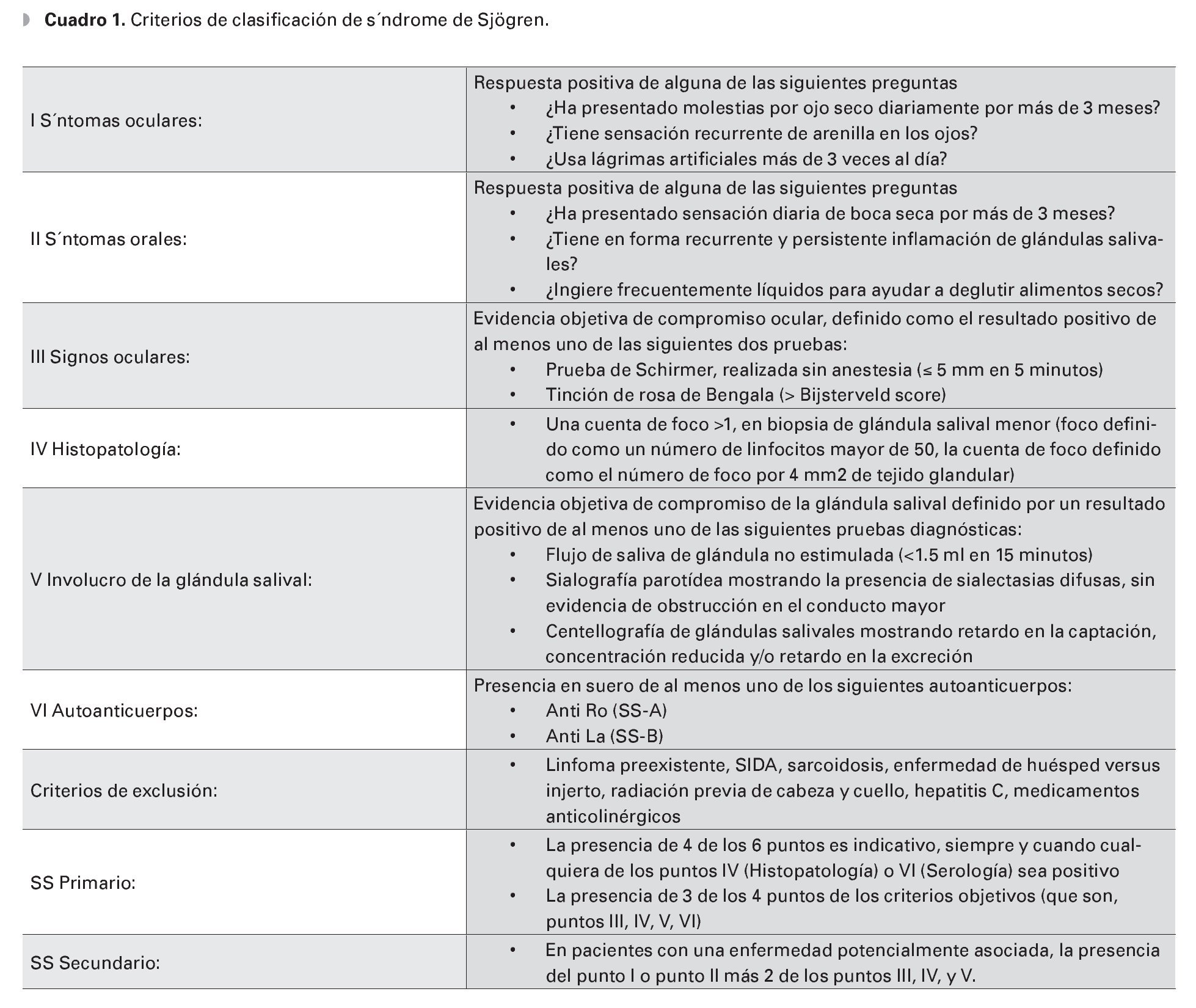
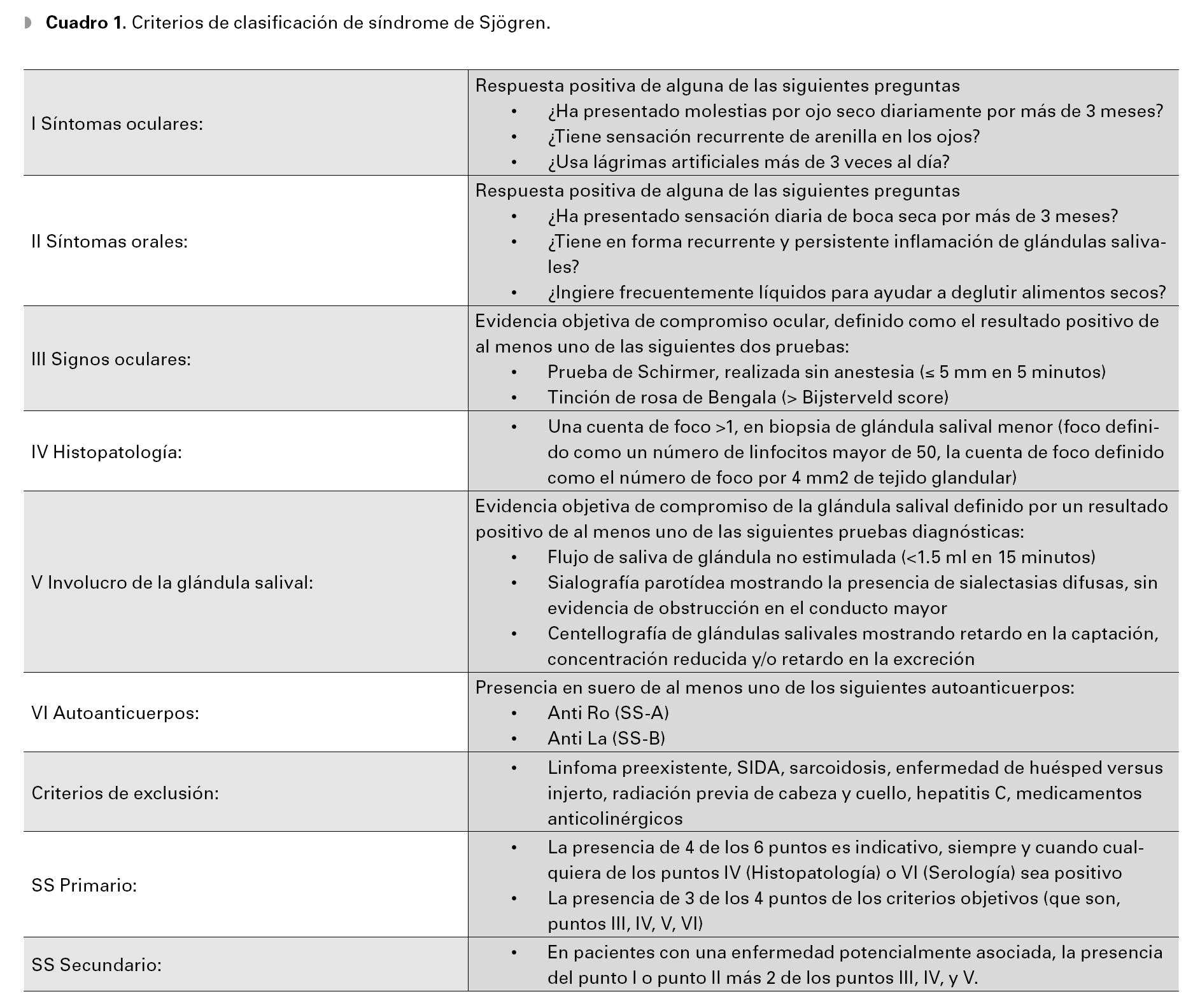
A nivel histopatológico, las glándulas lagrimales y salivales presentan una infiltración linfocitaria difusa o focal, cerca de los ductos glandulares, asociada con áreas de destrucción glandular.4 Los acini glandulares presentan infiltración por linfocitos-T CD8+ activados, que causan daño acinar irreversible y destrucción de células ductales con la consecuente hiposecreción de lágrima y/o saliva.3,4 La activación inflamatoria de las glándulas afectadas produce la expresión de autoantígenos en la superficie de las células epiteliales y la retención de tejido específico de células T, CD4+ y CD8+. La hiposecreción se amplifica por un bloqueo neurosecretor potencialmente reversible, así como por los efectos liberados de las citoquinas inflamatorias locales o la presencia de anticuerpos circulantes dirigidos hacia los receptores muscarínicos de las glándulas.3,5 El síndrome de Sjögren se puede dividir en dos subtipos: el primario consiste en una deficiencia de lágrima-ojo seco en combinación con síntomas de xerostomía, la presencia de autoanticuerpos, evidencia de disminución de secreción de la glándula salival y un resultado positivo de la biopsia de una glándula salival menor2 (Cuadro 1); el segundo se refiere a pacientes con las características clínicas de la forma primaria, pero en los que existe una clara asociación a enfermedad del tejido conectivo como artritis reumatoide adulta (más común),2 lupus eritematoso sistémico, esclerodermia, enfermedad mixta del tejido conectivo, CREST (acrónimo de síndrome de escleroderma: Calcinosis, fenómeno de Raynaud, disfunción esofágica, esclerodactilia y telangiectasias), entre otras.3,4
Se han postulado diversos factores que probablemente tengan relación con la patogénesis del síndrome de Sjögren como factores ambientales, infecciones virales por Epstein Barr, hepatitis C y enterovirus, los cuales se han visto asociados con la inflamación y la apoptosis de las células epiteliales de la glándula lagrimal y salival, desencadenando el síndrome de Sjögren, pero ninguno de ellos ha sido confirmado como factor patogénico definitivo de la enfermedad.6-8
Se ha demostrado la presencia de alteraciones morfológicas en el espesor corneal, células e inervación, en pacientes con ojo seco asociado a síndrome de Sjögren, manifestada por la disminución en el espesor corneal central, probablemente secundaria al proceso inflamatorio y una reducción en el número de fibras del plexo sub-basal trigeminal que puede explicar la hiposensibilidad corneal que se observa en los pacientes con síndrome de Sjögren.9 Además, este síndrome se ha visto asociado a factor hormonal, ya que el andrógeno promueve la función de las glándulas de Meibomio y la lágrima. La queratoconjuntivitis sicca es una enfermedad multifactorial, que afecta la producción de la lágrima y la superficie ocular, que se manifiesta por sintomatología relacionada a malestar, visión borrosa e inestabilidad de la película lagrimal con daño potencial a la superficie ocular. Se acompaña de un aumento de la osmolaridad lagrimal e inflamación de la superficie ocular.3,7,10 La patogénesis de la queratoconjuntivitis sicca en pacientes con síndrome de Sjögren, está dada por la hiposecreción lagrimal acompañada de la infiltración linfocitaria y los cambios inflamatorios que se observan en las glándulas lagrimales, así como por la presencia de mediadores inflamatorios en la lágrima y la conjuntiva. Hay un aumento del factor de necrosis tumoral alpha (TNF-α) y citoquinas pro inflamatorias en las glándulas de los pacientes con síndrome de Sjögren, así como niveles altos de Interleucina-6 en sus lágrimas, la cual se asocia con la severidad de la enfermedad y la manifestación en la superficie ocular.11
La citología de la conjuntiva, en una fase temprana de la enfermedad, muestra aumento en el número de las células caliciformes, contrario a lo que se observa en etapas crónicas de la enfermedad, donde se observa pérdida de células caliciformes, metaplasia escamosa y queratinización del epitelio conjuntival.12 Sin embargo, el espectro clínico de la disfunción lagrimal es muy amplio en cuanto a la gravedad, de tal manera que existen pacientes con síndrome de ojo seco leve, otros presentan sequedad moderada y otro grupo de pacientes padecen de ojo seco grave, y estos cambios no siempre se relacionan con el curso clínico de la enfermedad. Es decir, no siempre se cumple, que la gravedad de la sequedad ocular está directamente ligada a un tiempo de evolución más prolongado de la enfermedad.
El propósito de este trabajo es analizar posibles predictores de gravedad de la queratoconjuntivitis sicca que desarrollan los pacientes que padecen el síndrome de Sjögren.
¿ Métodos
Se diseñó un estudio original, aplicativo, longitudinal, analítico, retrospectivo y prospectivo con la finalidad de analizar si existen factores pronosticadores de gravedad de la QCS en pacientes con síndrome de Sjögren.
Todos los pacientes incluidos en el estudio, leyeron y firmaron el consentimiento informado, se les informó que participarían en un trabajo de investigación el cual sería publicado.
Se incluyeron a pacientes con diagnóstico de síndrome de Sjögren primario o secundario que acudieron al Servicio de Córnea y Enfermedades Externas del Centro de Oftalmología de la Escuela de Biotecnología y Salud, Tecnológico de Monterrey (ITESM).
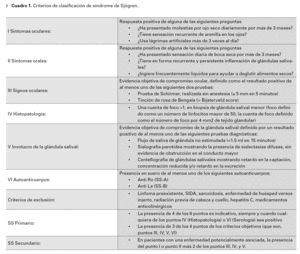
El diagnóstico de síndrome de Sjögren se basó en los criterios de clasificación de la American Rheumatology Association (ARA),13 (Cuadro 1) que incluye los siguientes criterios clínicos oftalmológicos: Sensación de cuerpo extraño, sensación de ojo seco por más de tres meses, uso de lágrimas artificiales más de tres veces al día sin referir mejoría, sensación de boca seca por más de tres meses y necesidad de liquido al tomar los alimentos secos.
Se excluyeron a todos aquellos pacientes que no aceptaron participar en el estudio de manera voluntaria; pacientes sin bases diagnósticas del inicio del síndrome de Sjögren y de ojo seco; pacientes que no contaron con un seguimiento clínico ≥ tres meses; pacientes que por diversos motivos no se les realizaron todas las pruebas diagnósticas y de laboratorio requeridas; pacientes en tratamiento con fármacos que son potencialmente causantes de sequedad ocular (ej. benzodiacepinas, antihistamínicos, diuréticos); pacientes con enfermedades de la superficie ocular externa (por ejemplo: blefaritis crónica, síndrome de Stevens-Johnson, penfigoide cicatrizal ocular, etc.) que se presenten en forma concomitante y que son causa o exacerban el síndrome de ojo seco.
Técnicas y procedimiento del estudio:
1. A todos los pacientes incluidos se les aplicó un cuestionario de identificación diagnóstica enfocado a padecimientos reumatológicos y a ojo seco el cuál contestaron, considerado como información confidencial.
2. Se realizó un examen oftalmológico completo que consistió en agudeza visual, examen de párpados, conjuntiva y esclera, exploración con biomicroscopio de córnea, cámara anterior, iris y cristalino.
3. Exploración del aparato lagrimal mediante tiempo de ruptura de la película lagrimal, prueba de Schirmer con anestésico, pruebas de tinción de defectos epiteliales con fluoresceína, pruebas de tinción de células desvitalizadas con verde de lisamina o rosa de Bengala, empleando el puntaje de tinción de Van Bijsterveld, así como el tamaño del menisco lagrimal.10,14
Prueba de Schirmer: La prueba de Schirmer con anestésico (Schirmer-II) determina la producción de lágrima basal del ojo. Esta prueba se realiza midiendo la cantidad de humedad de un papel filtro (Whatman N°1) de 5 mm de ancho y 35 mm de longitud, previa instilación de una gota de tetracaína al 5% para bloquear el lagrimeo reflejo.10,14 Se estima que el resultado normal es 310 mm con anestesia. Entre 5 mm y 10 mm, representa un resultado limítrofe; menor de 5 mm sugiere la existencia de una alteración en la secreción lagrimal. Algunos autores sugieren que el punto de corte entre lo normal y lo anormal es de 6 mm.7,14,15
Tamaño del menisco lagrimal: Es un signo básico que orienta a sospechar la patología de ojo seco. El menisco lagrimal debe ser uniforme y abundante, siendo en condiciones normales de aproximadamente 1 mm de alto. En pacientes con ojo seco, el menisco lagrimal suele ser cóncavo y menor de 1 mm.16
Medición de la estabilidad de la película lagrimal: El tiempo de rotura lagrimal valora la estabilidad de la película lagrimal en la superficie ocular que ocupa la hendidura interpalpebral. La prueba consiste en la tinción con fluoresceína al 2% y la observación bajo lámpara de hendidura, empleando luz azul de cobalto, del comportamiento de la película lagrimal entre intervalos de parpadeo. El tiempo de rotura es el intervalo transcurrido entre el último parpadeo y la aparición de la primera mancha seca. Un tiempo de rotura lagrimal ≤ cinco segundos se considera acortado.7,15 Este parámetro clínico siempre se encuentra alterado en pacientes con QCS.14,17
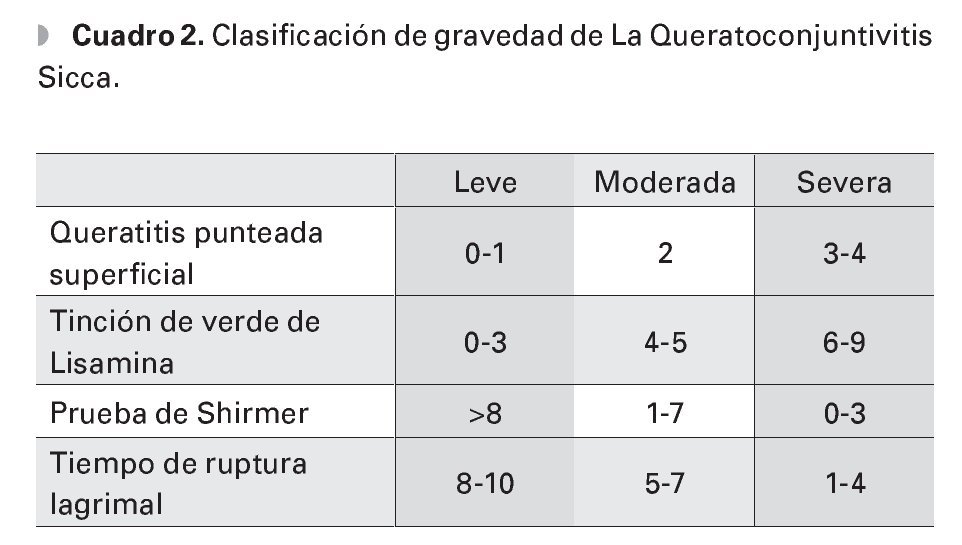
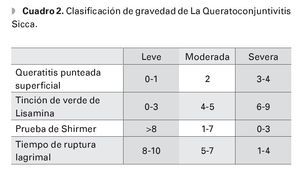
Medición de la integridad de la película lagrimal: La tinción con verde de lisamina o rosa de Bengala es la prueba más sensible para indicar gravedad de la QCS. Estas tinciones tienen especial afinidad por las células muertas o desvitalizadas, así como áreas de la superficie ocular desprovistas de mucina. El patrón de tinción típico de la QCS consiste en dos triángulos (nasal y temporal) formados en la conjuntiva bulbar localizada en la hendidura interpalpebral, los cuales tienen sus bases en el limbo esclero-corneal, así como el epitelio corneal medio. El colorante tiene mayor afinidad por los filamentos y las placas corneales.15 Para evaluar el grado de tinción se utilizó el método de Van Bijsterveld.14 Mediante este método, se le asigna un puntaje de 0 a 3 (0 = ausencia, 3 = tinción máxima) a cada uno de los tres tercios de la superficie ocular entre la hendidura interpalpebral (nasal, corneal y temporal). De tal forma, un puntaje sumatorio de 1 a 3 se considera leve, de 4 a 6 moderado y de 7 a 9 se considera grave para KCS.14
Medición de la integridad epitelial: Para medir la integridad epitelial se utilizó la tinción con fluoresceína de las áreas de la superficie ocular que presentaron pérdida de la integridad epitelial (defectos epiteliales). Se utilizaron tirillas impregnadas con fluoresceína estéril o una solución de fluoresceína al 2%.
A todos los pacientes se les solicitaron estudios de laboratorio consistentes en biometría hemática completa, proteína-C reactiva, velocidad de sedimentación eritrocítica, determinación de factor reumatoide (partículas de látex), anticuerpos antinucleares (ANA) en células Hep-2, anticuerpos anti-Ro (SS-A) y anti-La (SS-B).
Se analizaron los resultados de las distintas características demográficas y clínicas, así como las pruebas serológicas para conocer cuáles de ellas pudieran ser factores pronósticos de gravedad de la sequedad ocular.7 Para ello, se dividió a la población estudiada en tres grandes grupos acorde a la gravedad de la QCS. Después de un seguimiento clínico ≥ tres meses, en el que se continuaron evaluando los parámetros clínicos en estudio, todos los pacientes con síndrome de Sjögren estudiados fueron clasificados como queratoconjuntivitis sicca leve, moderada o severa, con base en los criterios descritos en el Cuadro 2.
Posterior a ello, se dividieron en dos grupos: QCS no severa (los pacientes de QCS leve y moderada) y QCS severa para poder hacer una comparación de los factores de riesgo presentes entre los dos grupos.
Las características basales entre ambos grupos se presentan en medidas de resumen (media) y de dispersión (como la desviación estándar y rangos intercuartiles). Las variables continuas se compararon mediante la prueba t de Student cuando seguían una distribución normal. Las variables categóricas se compararon mediante la prueba exacta de Fisher. Ambos grupos fueron comparados mediante este análisis univariado para obtener un valor de p. Después se analizaron mediante regresión logística binaria (método Forward LR) para evaluar asociación entre las mismas y el desenlace final. Todos los valores de p <0.05 fueron considerados significativos. Para la estadística descriptiva se utilizaron los programas Excel de Microsoft y SPSS versión 13.0.
¿ Resultados
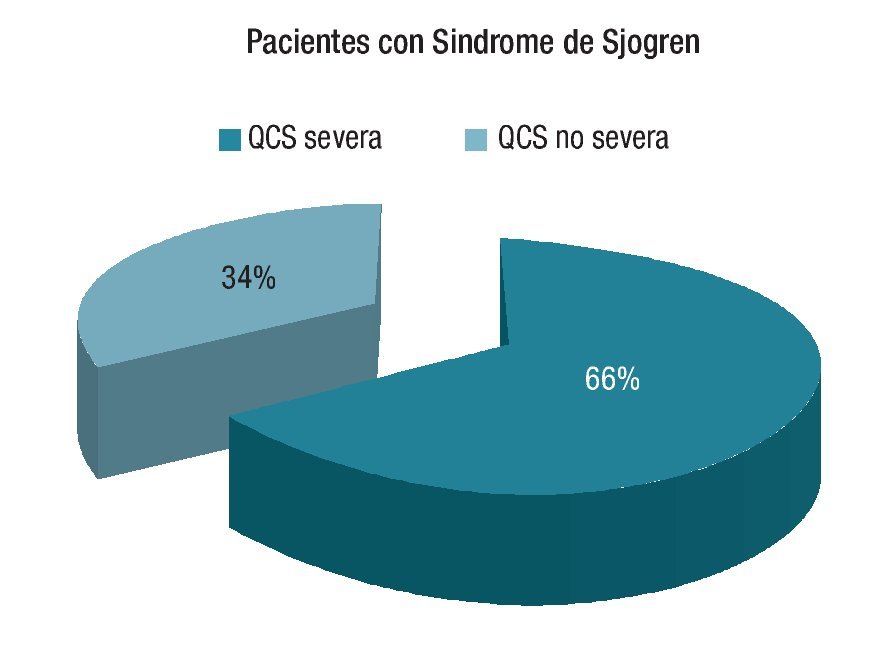
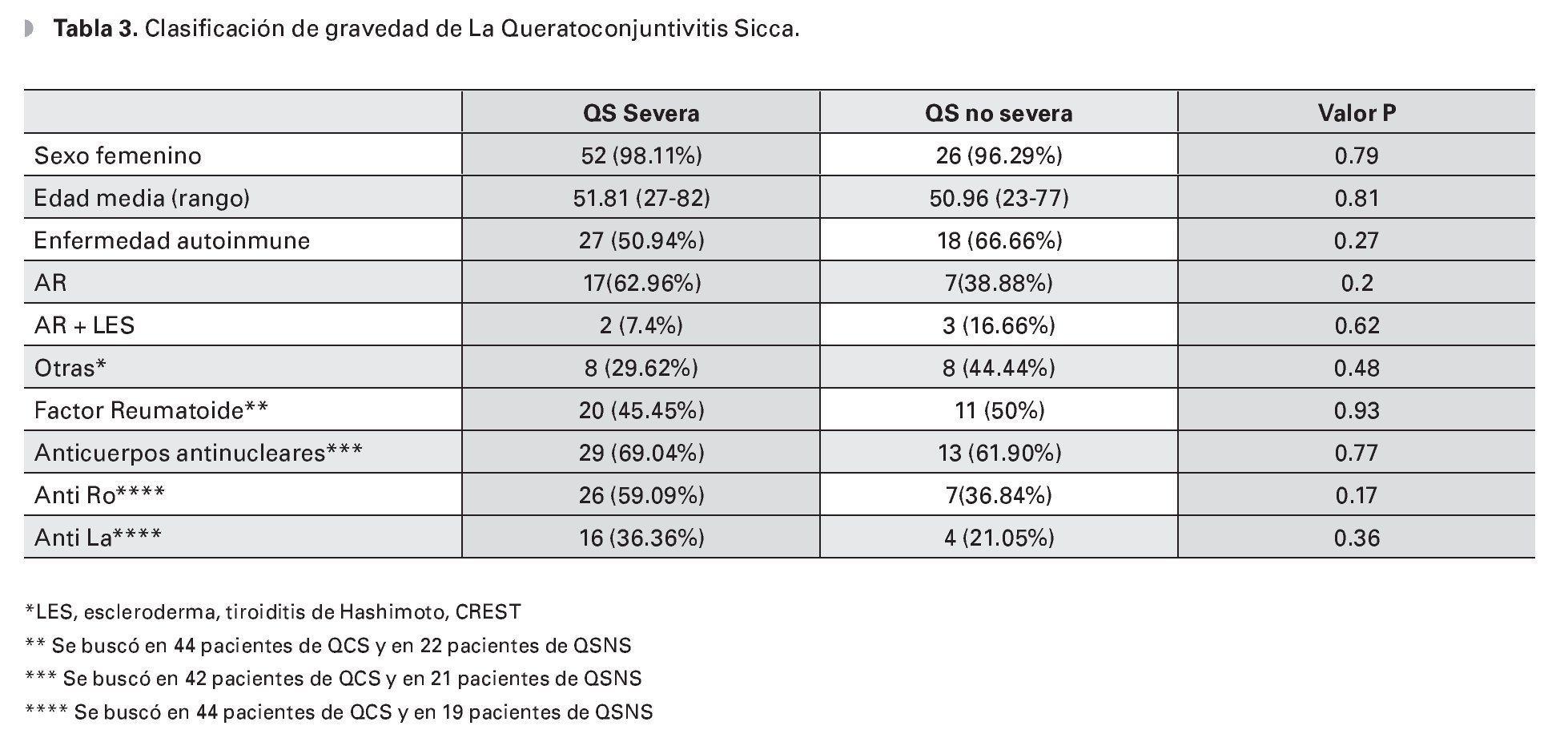
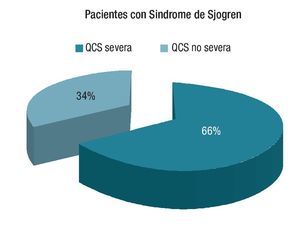
Se estudiaron un total de 80 pacientes (160 ojos), de los cuales 53 (66.25%) se clasificaron como queratoconjuntivitis sicca severa y 27 (33.75%) como una queratoconjuntivitis no severa (leve y moderada) (Gráfica 1). Del grupo de pacientes de queratoconjuntivitis sicca severa, 52 (98.11%) fueron mujeres y del segundo grupo 22 (96.29%) (p= 0.79).
¿ Gráfica 1. Porcentaje de QCS severa y no severa en pacientes con síndrome de Sjögren.
El promedio de edad en pacientes con queratoconjuntivitis sicca severa fue de 52.8 años (rango 27 a 82 años), mientras que en los pacientes que presentaron QCS no severa fue de 50.9 años (rango 23 a 77 años) (p = 0.81).
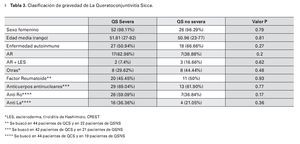
De los 53 pacientes con QCS severa, 26 (49.0%) presentaron síndrome de Sjögren primario, mientras que 27 (50.9%) presentaron una enfermedad autoinmune asociada, siendo la más frecuente la artritis reumatoide adulta con diecisiete pacientes (62.9%), seguida de lupus eritematoso sistémico en seis pacientes (22.22%), tiroiditis de Hashimoto en tres pacientes (11.11%), y síndrome de CREST en un paciente (3.7%).
En el grupo de QCS no severa, nueve pacientes (33.3%) presentaron Sjögren primario, mientras que dieciocho (66.6%) presentaron una enfermedad autoinmune asociada, siendo también la artritis reumatoide adulta la más común en nueve (50%), seguida del LES en siete (38.88%), la esclerodermia en un paciente (5.5%), y el síndrome de CREST en un paciente también (5.5%).
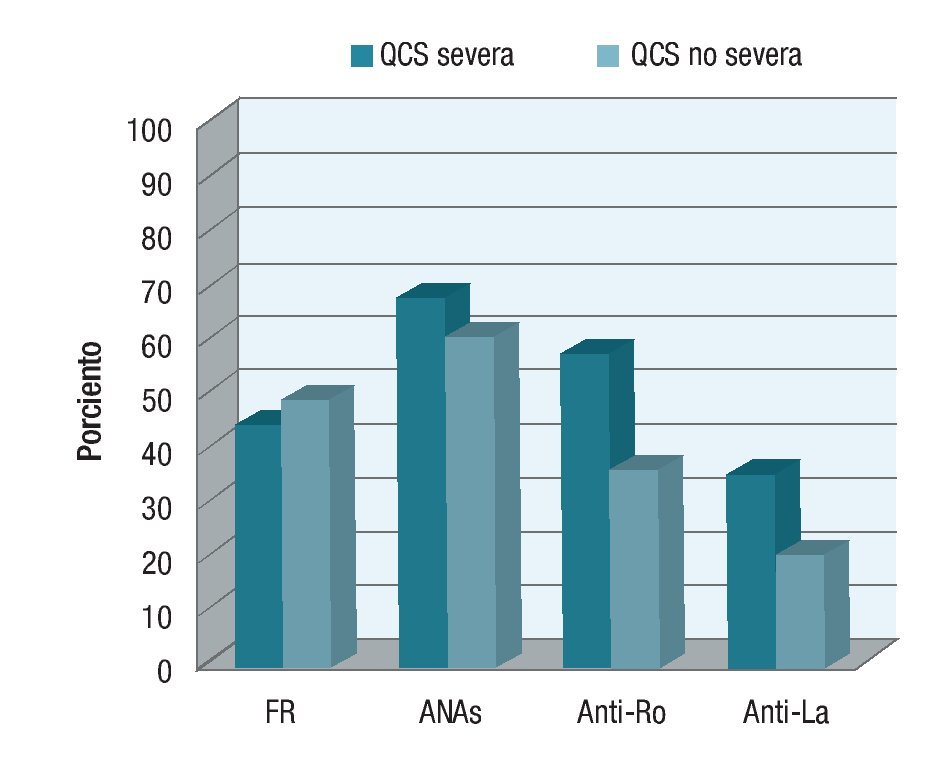
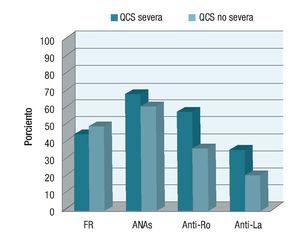
En cuanto a las pruebas serológicas, el factor reumatoide resultó positivo en 20 pacientes con QCS severa (45.45%), mientras que en 24 pacientes de este grupo resultó negativo (54.54%). Del grupo de QCS no severa, 11 pacientes (50%) tuvieron un FR positivo y 11 pacientes (50%) resultaron con FR negativo (p = 0.93) (Gráfica 2).
¿ Gráfica 2. Comparación de resultados entre los pacientes con QCS severa y no severa.
Los anticuerpos antinucleares en el grupo de la QCS severa resultaron positivos en 29 pacientes (69.04%) y en 13 casos (30.95%) resultaron negativos. Un total de 11 pacientes (20.75%) no se realizaron el estudio.
En el grupo de QCS no severa, en 13 pacientes (61.90%) el resultado fue positivo, mientras que en ocho fue negativo (38.09%) (p = 0.77). En este grupo, un total de seis pacientes no se realizaron el estudio.
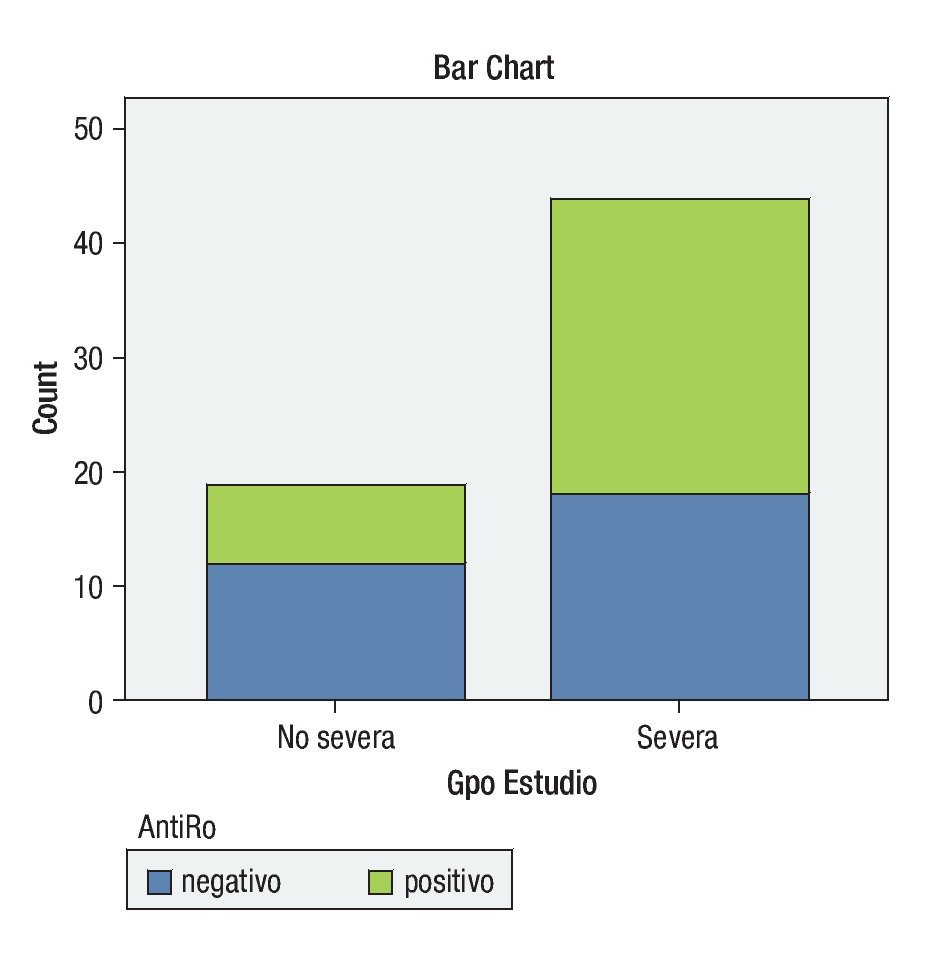
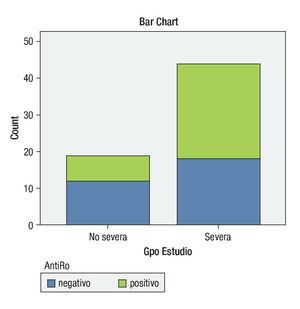
Respecto a los anticuerpos anti-Ro (SS-A), en el grupo de QCS severa, 26 pacientes tuvieron un resultado positivo (59.09%), mientras que en 18 de ellos (40.90%), el resultado fue negativo. Un total de nueve no se realizaron el estudio (16.98%). En el grupo de la QCS no severa, sólo siete pacientes (36.84%) lo tuvieron positivo, mientras que doce (63.15%) fueron negativos (p = 0.17). Un total de ocho (42.1%) no se realizaron el estudio (Gráfica 3).
¿ Gráfica 3. Comparación de resultados de Anti-Ro entre el grupo de QCS severa y no severa.
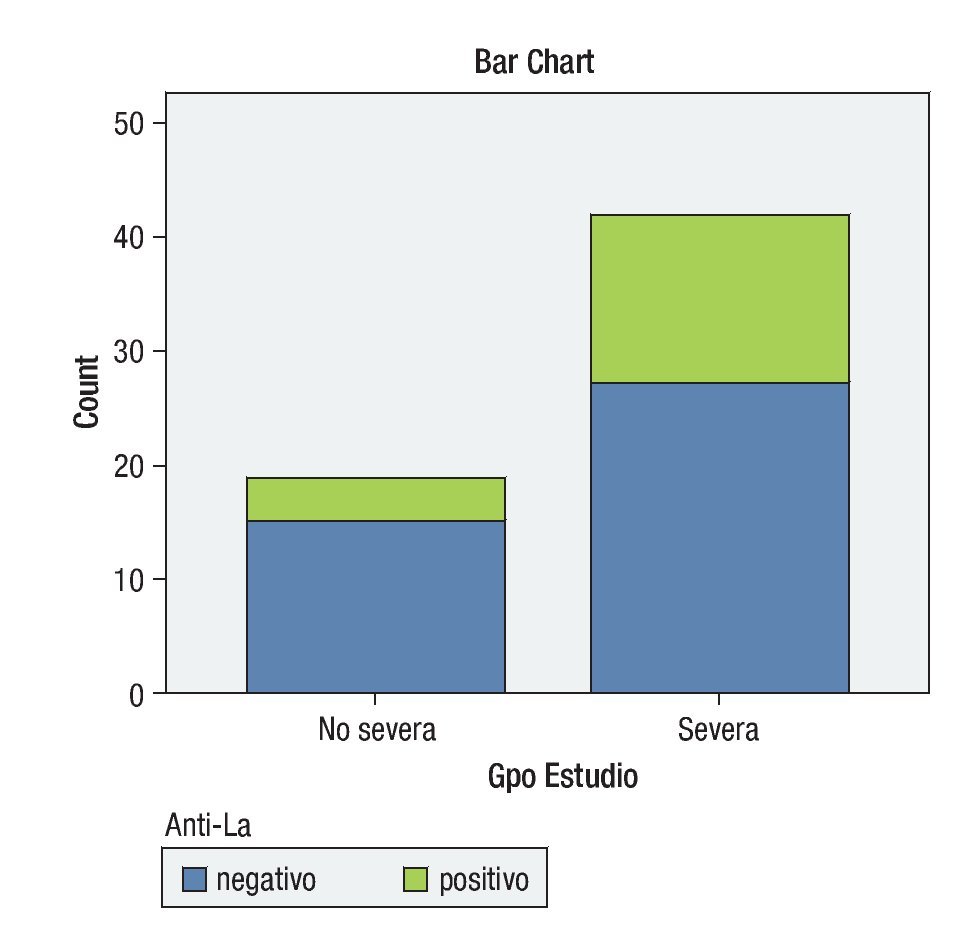
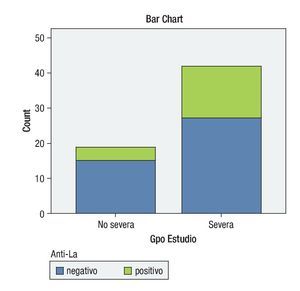
Con respecto a los anticuerpos anti-La (SS-B): en el grupo de QCS severa, 16 pacientes resultaron positivos (36.36%), mientras que 28 fueron negativos (63.63%); en el grupo de pacientes con QCS no severa, cuatro (21.05%) pacientes resultaron positivos, y quince (78.94%) negativos (p = 0.36) (Gráfica 4).
¿ Gráfica 4. Comparación de resultado de Anti-La entre los grupos de QCS severa y no severa.
Los valores de p de cada característica analizada se muestran en el Cuadro 3.
¿ Discusión
El síndrome de Sjögren representa un espectro clinicopatológico que engloba a pacientes con diversos grados de sequedad ocular bajo el mismo diagnóstico que no siempre se relaciona con el curso clínico de la enfermedad. Es por eso que la intención de llevar a cabo este estudio fue la de conocer, si existen ciertas características clínicas específicas del paciente que se relacionen con mayor gravedad de dicha sequedad y nos guíen hacia un tratamiento preventivo y un mejor pronóstico.
En el presente estudio se describen los parámetros demográficos, clínicos y análisis de laboratorio que analizamos como potenciales factores de riesgo para desarrollar queratoconjuntivitis sicca severa en pacientes con síndrome de Sjögren. Un total de 80 pacientes cumplieron con los criterios diagnósticos de síndrome de Sjögren según ARA, y contaban con un expediente completo que incluía todos los parámetros analizados.
Cabe destacar que en dicha población estudiada, la mayoría (66.25%) de estos pacientes presentaron QCS severa. Esto pudiera ser reflejo del sesgo de referencia de pacientes a un centro de especialidad de tercer nivel de atención. Además, del total de los pacientes registrados en el estudio, la gran mayoría (97.5%) fueron mujeres, confirmando la influencia hormonal que existe tanto en el síndrome de ojo seco como en el síndrome de Sjögren. En este sentido, se ha comprobado que los andrógenos juegan un papel preponderante en la función de las glándulas lagrimales, así como en las glándulas de Meibomio y, por esta razón, es evidente que el sexo del paciente influya en la prevalencia y tal vez en la severidad de la queratoconjuntivitis sicca.18
El promedio de edad presentado en los pacientes con QCS severa y no severa fue de 51.81 y 50.96, respectivamente, lo que refleja una mayor tendencia a presentar síndrome de Sjögren en pacientes adultos hacia la quinta década de la vida, acorde con lo observado previamente de que la edad se asocia con cambios fisiológicos que aumentan el riesgo de presentar ojo seco, como la diminución de la secreción de lágrima, aumento de la osmolaridad y disminución de la estabilidad de la película lagrimal, así como la alteración en la composición de los lípidos de la glándula de Meibomio.18
El síndrome de Sjögren puede ser primario o secundario como ya se mencionó anteriormente, y esta condición de presentar una enfermedad autoinmune asociada con la artritis reumatoide adulta o el lupus eritematoso sistémico, tampoco representó un factor de riesgo para desarrollar QCS severa, ya que ambos grupos tuvieron un porcentaje similar de casos graves.
Los anticuerpos antinucleares tienen una gran importancia en estos pacientes ya que también representan un criterio diagnóstico en el síndrome de Sjögren y representan de manera contundente un estado de autoinmunidad por desregulación del sistema inmune. En nuestro estudio encontramos que un alto porcentaje de los pacientes presentan anticuerpos antinucleares positivos tanto en los pacientes con QCS severa (69.04%) y no severa (61.90%).
Por otra parte, el factor reumatoide fue positivo en 45.45% y 50.0% de los pacientes con QCS severa y no severa respectivamente sin encontrarse una diferencia estadísticamente significativa entre ambos grupos en la presencia del mismo, por lo que el factor reumatoide positivo tampoco representó un factor de riesgo para desarrollar QCS severa.
Bettero publicó un estudio donde analizó las manifestaciones oculares en pacientes con artritis reumatoide, concluyendo que el síndrome de Sjögren secundario es más frecuente en mujeres y en pacientes con afectación articular mayor, pero tampoco encontró relación con la severidad de la enfermedad por la presencia de anticuerpos antinucleares, factor reumatoide, edad al diagnóstico y tiempo de evolución de la enfermedad.19 En cuanto a la presencia de anticuerpos anti-Ro (SS-A) en esta población estudiada, encontramos una diferencia entre ambos grupos, ya que 59.09% (n=26) de los pacientes con QCS severa presentaron anticuerpos anti-Ro positivos a diferencia de sólo 36.84% (n=7) de los pacientes con QCS no severa. Hubo una diferencia entre ambos grupos que representa un factor de riesgo para presentar QCS, aunque el valor de p no resultó estadísticamente significativo; éste probablemente lo hubiese sido, si la muestra de pacientes hubiera sido un poco más grande.
En cuanto a la presencia de anticuerpos anti-La (SS-B) éstos fueron positivos en 36.36% (n=16) de los pacientes con QCS severa y en 21.05% (n=4) de los pacientes con QCS no severa; con estos valores no podemos asegurar que la presencia de estos anticuerpos representa un factor de riesgo, pero probablemente lo sea, ya que observamos una tendencia mayor de la presencia de este anticuerpo en los pacientes con QCS severa.
En la universidad de Rouen, Francia, se realizó un estudio en pacientes con síndrome de Sjögren primario, en los que se comparó la presencia de anticuerpos antinucleares, anti-Ro (SS-A) y anti-La (SS-B) entre hombres, en donde concluyeron que los ANAs y los anti-SS-A eran más frecuentes en mujeres que en hombres y que la presencia de autoanticuerpos no afectaba la severidad del cuadro,20 a diferencia de nuestro estudio, en el cual sí encontramos que el presentar anticuerpos anti-Ro positivos si parece estar relacionado con la severidad de la enfermedad.
¿ Conclusiones
Las características demográficas, clínicas y de laboratorio en pacientes con síndrome de Sjögren que se analizaron en este estudio no mostraron diferencias significativas entre el grupo de QCS severa y no severa, con excepción de la presencia de anticuerpos anti-Ro (SS-B), en los que sí encontramos una mayor tendencia de su positividad en el grupo de QCS severa.
Podemos concluir entonces que los parámetros clásicos analizados universalmente en clínicas de atención a pacientes con síndrome de Sjögren, no son capaces de orientarnos en la predicción y pronóstico de gravedad de la queratoconjuntivitis sicca observada en estos pacientes, y que únicamente observamos tendencias en la presencia de ciertos factores serológicos que reflejan autoinmunidad, como los anticuerpos anti-Ro (SS-A) que nos inclinan a sugerir que aquellos pacientes que producen estos autoanticuerpos podrían tener un grado de sequedad ocular más grave.
Correspondencia: Dr. Alejandro Rodríguez-García.
Río San Juan no. 103 (1er piso) Col. Miravalle, Monterrey, N.L. 64660.
Teléfonos: (81) 8356 1878 y 1884, Fax. (81) 8356 1799.
Correo electrónico: arodri@itesm.mx