El TEC según la IBIA es la principal causa de convulsiones, muerte y discapacidad adquirida mundialmente. Las principales causas son las caídas en mayores de 65 años y los accidentes de tránsito en los menores. Los hematomas pos-TEC son una complicación muy frecuente, cuyas manifestaciones son variables, especialmente en los subdurales, presentando desde cefalea hasta síndromes demenciales o déficit neurológico focal, dentro de los cuales no es usual el reporte de casos con manifestaciones visuales. El presente artículo reporta un caso de discapacidad visual por déficit neurológico pos-TEC complicado con hematomas subdurales subcrónicos bilaterales parietooccipitales, y revisa la neuroanatomía funcional visual involucrada en ella.
According to the IBIA TBI is the leading cause of seizures, death, and disability acquired worldwide. The main causes are falls in the elderly of 65 years and road traffic in minors. Hematomas pos-TEC are a very frequent complication whose manifestations are variable, especially in the subdural, presented from headache to demented syndromes or focal neurological deficits, within which the report of cases with visual manifestations is not usual. This article reports a case of visual impairment by neurologic deficit pos-TEC complicated with sub chronic bilateral subdural hematomas parieto-occipital, and revises the neuro visual functional anatomy involved in it.
La discapacidad visual (DV) es un término general que relaciona a las deficiencias funcionales y/o estructurales del sistema visual, con las limitaciones en las actividades y restricciones en la participación que presente la persona, tomando como parámetro la capacidad real funcional y las restricciones que el déficit visual genere en su desempeño1. Es una entidad clínica que afecta aproximadamente a 285 millones de personas en el mundo, de los cuales 246 millones se consideran baja visión y 39 millones ceguera2.
Es posible evidenciar grupos poblacionales susceptibles al estudiar la DV, ya que más del 90% de la población afectada vive en países en desarrollo, las mujeres presentan un riesgo significativamente mayor que los hombres de adquirir una discapacidad visual, y más del 82% de las personas con ceguera son mayores de 50 años3.
Las principales causas del déficit en DV son oftalmológicas, sobresaliendo las ametropías no corregidas, la catarata y el glaucoma. No obstante, datos sobre las causas neurológicas del déficit visual son escasos4. Sin embargo, en el año 2006 la Organización Mundial de la Salud reportó que los desórdenes neurológicos son los que originan la mayor cantidad de años de vida ajustados en función de la discapacidad, al ser responsables de más del 6% del total. Incluso se encuentra por encima de enfermedades crónicas infecciosas (tipo VIH/sida y tuberculosis), y de otras enfermedades crónicas no transmisibles (tipo neoplasias malignas, enfermedad isquémica cardiaca, enfermedad respiratoria, entre otras). Dicho informe identifica que las enfermedades neurológicas que frecuentemente originan deficiencias permanentes y a la vez mayor cantidad de años de vida ajustados en función de la discapacidad son la enfermedad cerebrovascular y las demencias (incluyendo Alzheimer)5.
Frente a la ausencia relativa de datos consistentes, que muestren el impacto de los trastornos neurológicos en la DV, McKenna et al. encontraron que posterior a un TEC moderado o severo el 74% de los pacientes posee dificultades en la visión, y el 38% llegan a DV6. Adicionalmente, algunos autores señalan que los déficits sensoriales visuales posteriores a traumas encefálicos pueden ir desde dificultades espaciales visuales simples hasta una pérdida visual discapacitante7.
El neurotrauma es una condición crítica muy frecuente en salud pública que incluye los traumatismos encefálicos y medulares8. De estos, hacen parte el trauma encefalocraneano (TEC) y el grupo de las hemorragias intracraneales traumáticas, ya sea epidural, subdural o intracerebral9,10. La International Brain Injury Association, reporta que la lesión cerebral es la principal causa de convulsiones, muerte y discapacidad adquirida a nivel mundial. Cerca de 5.3 millones de personas en los Estados Unidos poseen alguna discapacidad relacionada con TEC, cuyas principales causas son las caídas en mayores de 65 años y los accidentes de tránsito vehicular en menores de 60 años11. Los hematomas pos-TEC son frecuentes.
Las manifestaciones de hematomas consecuencia de TEC, principalmente subdurales son variables, donde se encuentra desde cefalea hasta síndromes demenciales, convulsiones y déficit neurológico focal, entre otros12. Pero son escasos los reportes y datos clínicos de manifestaciones visuales por hematoma subdural pos-TEC, incluyendo los hematomas subdurales ubicados en fosa posterior (escasos, pues se encuentran del 5 al 10% de los casos)13.
Es objetivo del presente artículo es reportar un caso de DV por déficit neurológico pos-TEC complicado con hematomas subdurales subcrónicos bilaterales parietooccipitales, y revisar la neuroanatomía funcional visual involucrada en ella.
Presentación del casoPaciente masculino de 62 años, con educación universitaria posgradual, sin antecedentes personales ni familiares de importancia. El 17 de abril del año 2011 sufre un accidente en bicicleta donde presenta un TEC, al parecer sin pérdida de la conciencia. Fue atendido inicialmente en urgencias, de donde se dio alta temprana, rotulado como TEC leve, asociado a múltiples laceraciones en rostro y extremidades.
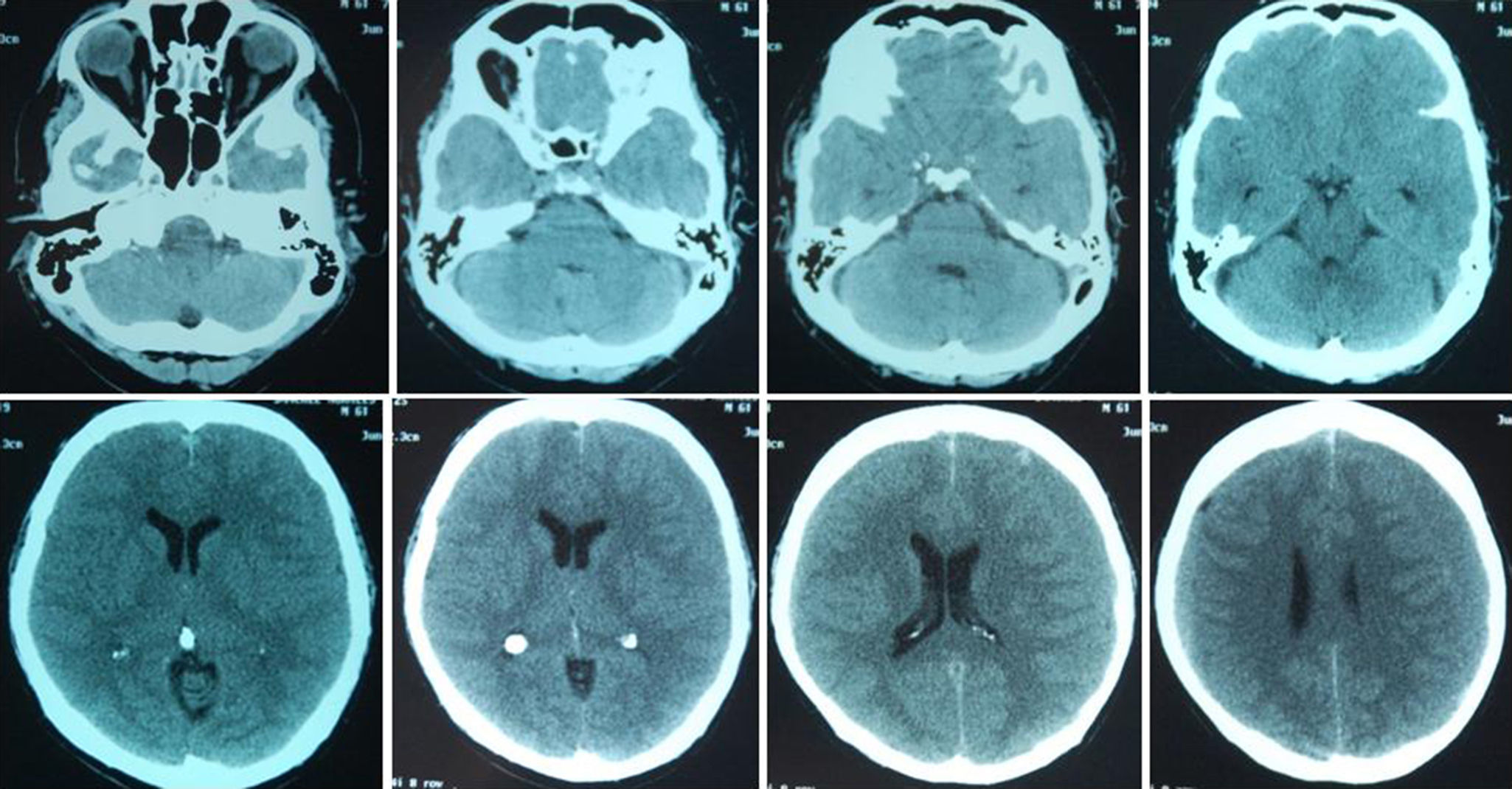
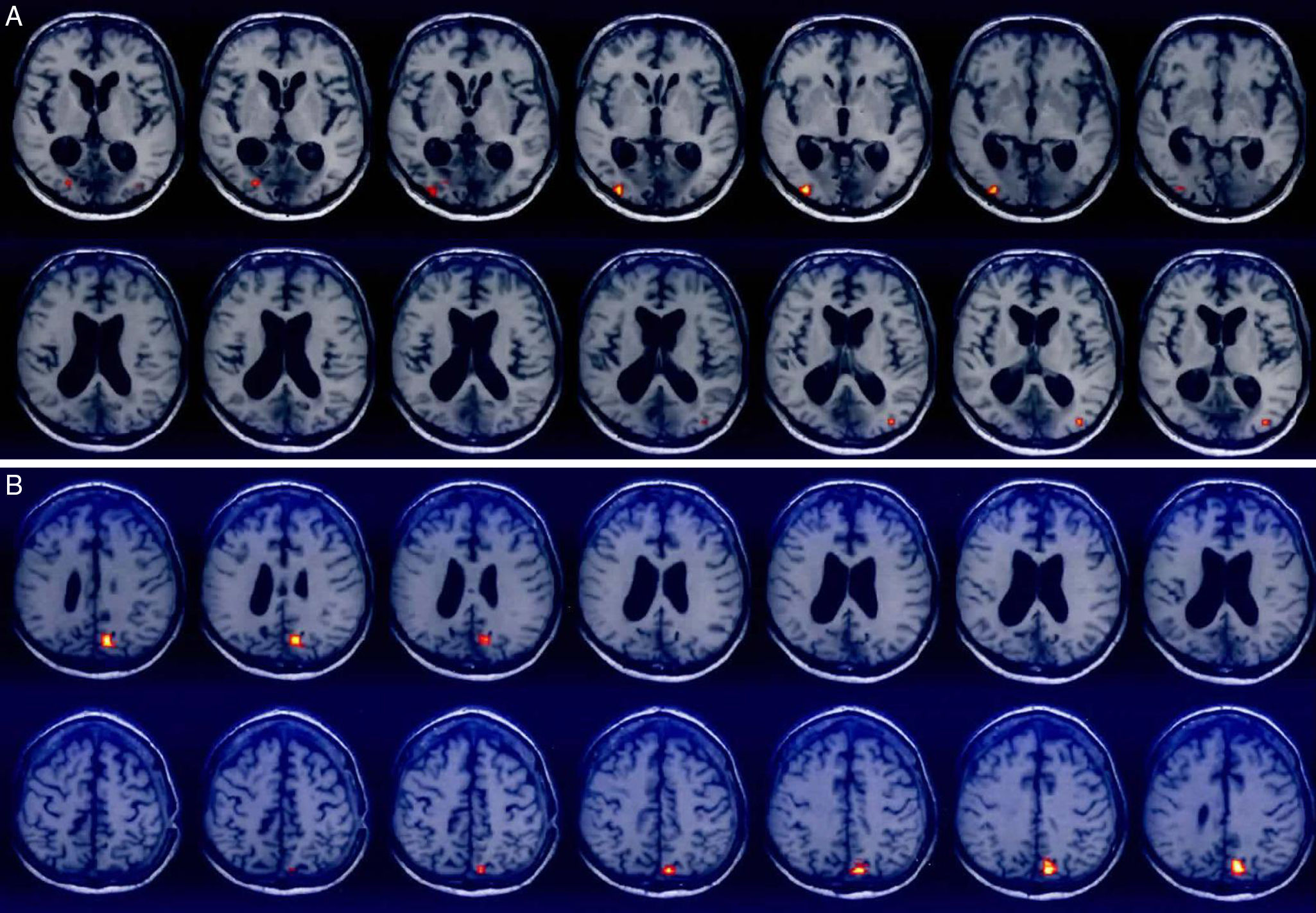
Posterior al alta y de manera progresiva comienza a presentar cambios de comportamiento y de memoria no objetivada, sin deterioro visual. La figura 1 muestra las secuencias de la TAC inicial.
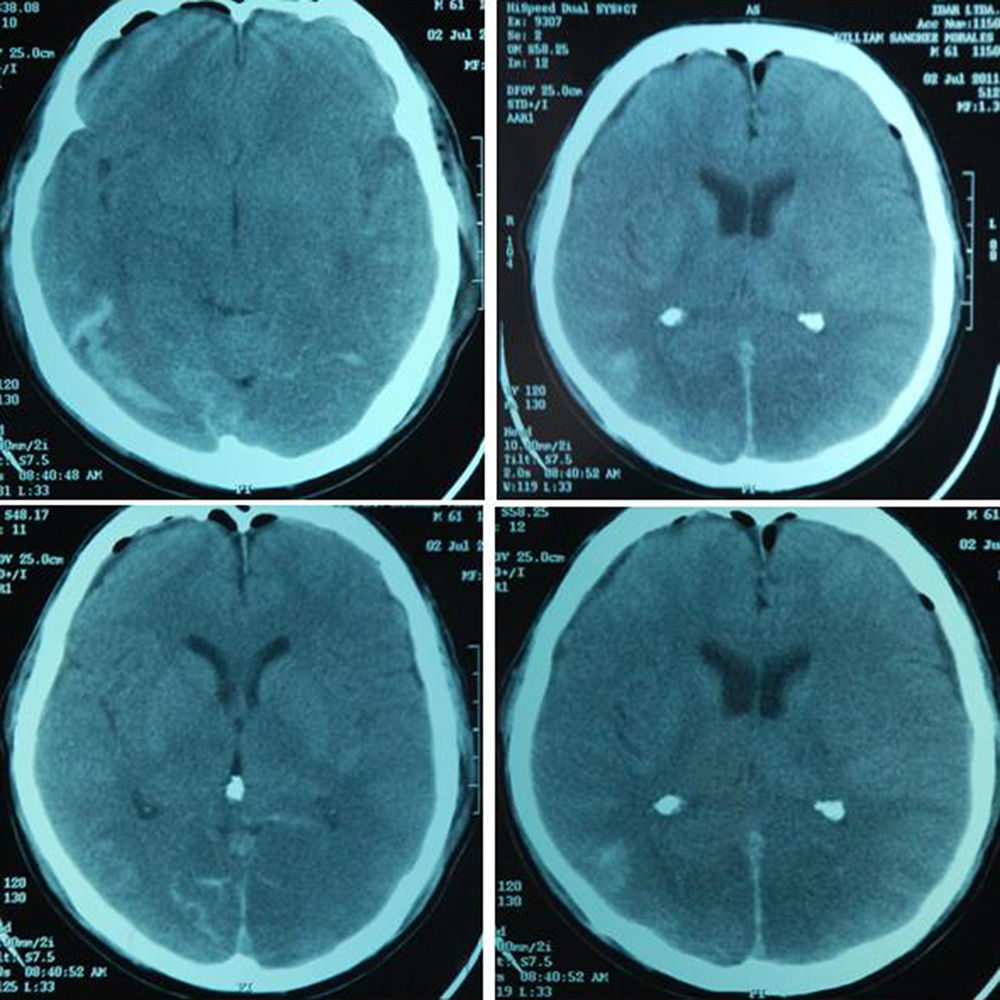
A los dos meses del episodio traumático, experimentó episodio súbito de vómito, cefalea y problemas en la marcha. Se diagnosticó hematomas subdurales difusos, para los cuales se le realizó drenaje de hematomas subdurales con trepanación frontal. A continuación puede observarse la TAC de la agudización del cuadro previo a la cirugía, (fig. 2).
Descripción quirúrgica (29 de junio de 2011): «ligadura y pinzamiento de vasos meníngeos durales, bilaterales derecho e izquierdo… drenaje de colección de espacio subdural por trepanación bilateral… grandes hematomas subdurales bilaterales, vasos sanguíneos durales sangrantes, los causales del hematoma». El diagnóstico POP fue: hematomas subdurales bilaterales.
- •
Primer reporte UCI: responde al dolor, no obedece órdenes, Glasgow 7/15, pupilas anisocóricas izquierdas 5mm, derecha 3mm, muy perezosas a la luz. Reflejo corneal positivo, con hipo. Al estímulo doloroso hay mayor movimiento en hemicuerpo derecho.
- •
Reporte por neurología en UCI: POP de drenaje de hematomas subdurales con alteraciones hidroelectrolíticas leves y trastorno del sensorio, que pueden estar en correspondencia con el estado POP.
En el POP temprano (día 2 a 4): el hijo del paciente notó «problemas de la visión… él no está viendo». El paciente requirió un mes de hospitalización y al alta hospitalaria se documentó ataxia, amnesia, ceguera (con negación psíquica de la ceguera), y parestesias en el hemicuerpo izquierdo.
Al mes y 20 días del POP de drenaje quirúrgico de hematomas subdurales: fue remitido a control por neurocirujano y fisiatra, donde ambos coinciden con presencia de depresión, ceguera y dependencia completa para actividades de la vida diaria.
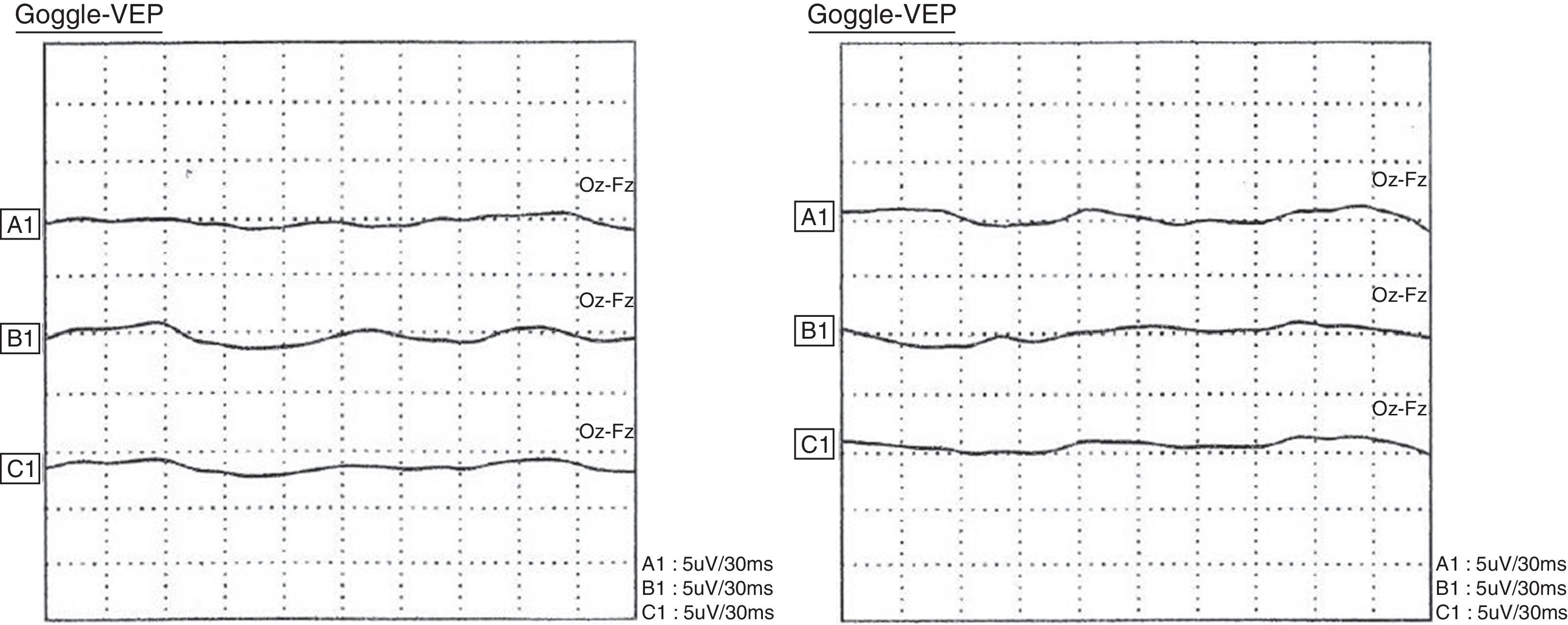
Potenciales evocados visuales (1 de agosto de 2011): potenciales anormales al no registrar respuesta evocada en ninguno de los dos lados estimulados con diodo luminoso (fig. 3).
Consulta oftalmológica (2 de agosto de 2011): sin percepción de luz bilateral, de manera cercana y lejana. Motilidad ocular normal. Reflejo directo y consensual presentes bilateral. Fondo de ojo (bajo dilatación pupilar) se observó: polo posterior, máculas y discos ópticos normales. Se realizan los siguientes diagnósticos por oftalmología: astigmatismo miópico, amaurosis, ceguera cortical, lesión isquémica occipital bilateral.
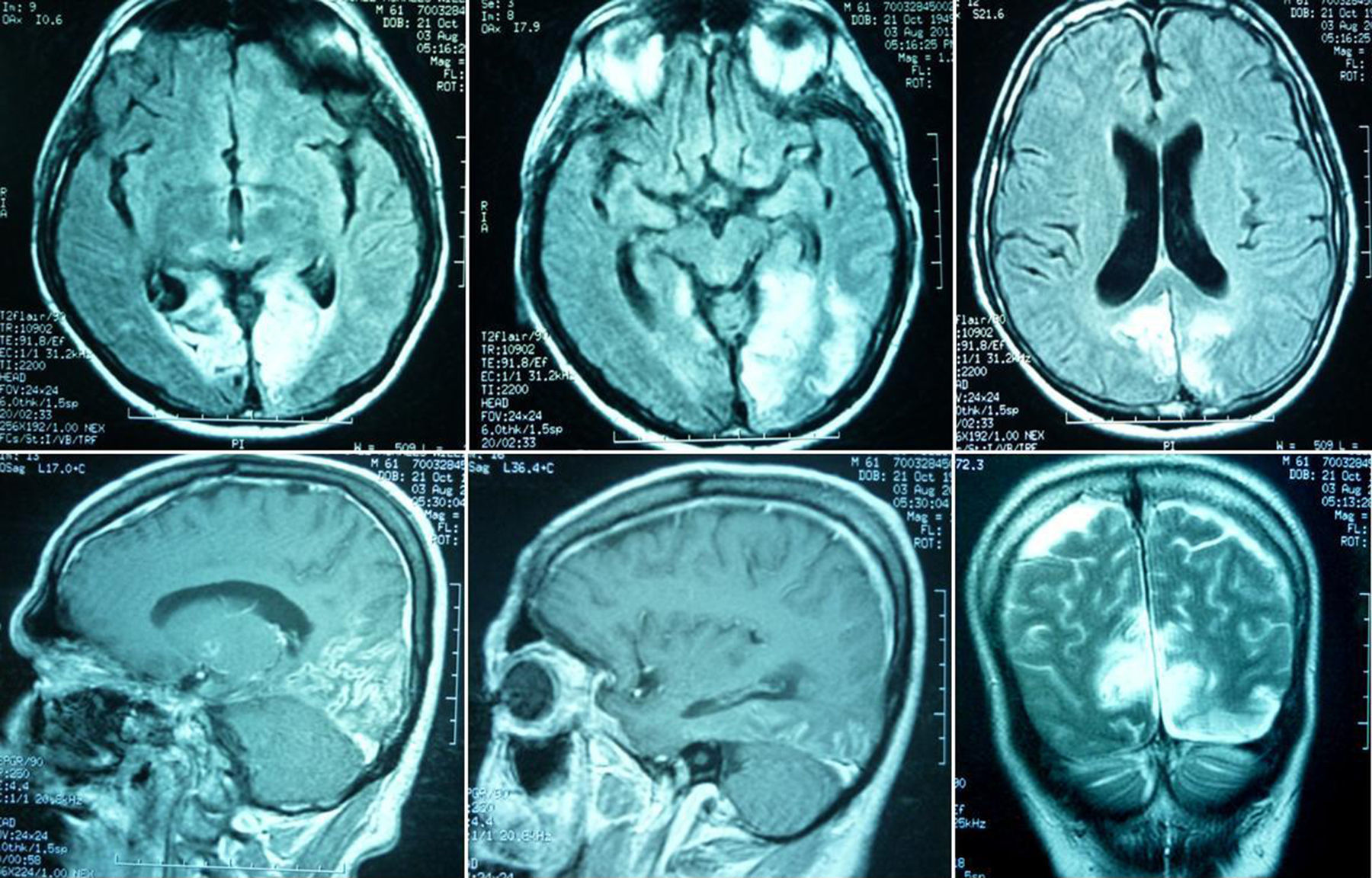
RMN simple y contrastada (3 de agosto de 2011): áreas de infarto que comprometen los lóbulos occipitales con signos de necrosis cortical pseudolaminar, con mayor compromiso del lóbulo occipital izquierdo. Pequeñas áreas de isquemia que comprometen los tálamos especialmente el derecho. Pequeños infartos lacunares en la región izquierda de la protuberancia. Pequeño foco hemorrágico en la región temporal posterior derecha. Cambios ex vacuo por atrofia central y cortical difusa. Realce de leptomeninges, las cuales se encuentran engrosadas (fig. 4).
A los 4 meses es evaluado por neuropsicología (4 de octubre de 2011). El informe neuropsicológico reportó: durante los tres meses entre el TEC y la neurocirugía existió pérdida de memoria que se agudizó después la intervención quirúrgica. Desorientación parcial en tiempo, orientado en lugar y persona, integridad de procesos práxicos, atencionales y neurolingüísticos, DV de origen neurológico por cuadro de ceguera cortical, amnesia anterógrada y fallas en funciones ejecutivas.
Consulta médica de neurorrehabilitación (1 de noviembre de 2011): variabilidad de déficit en corteza cerebral y núcleos de interconexión (como el tálamo). Clínicamente se trata de un paciente con DV de origen neurológico central, de tipo perceptual, con compromiso difuso de circuitos corticales que alteran el proceso de integración de la sensación visual que está preservada. El paciente logra leer palabras y detectar algunos tipos de estímulos luminosos (siluetas de figuras geométricas, colores, luz, movimientos simples de objetos), pero se comporta como invidente: orientación y movilidad alterada, no sortea obstáculos, no reconoce rostros). Ceguera cortical en evolución, DV de origen neurológico central y alteración de la integración cerebral visual. El paciente ingresa en un protocolo de investigación sobre causas neurológicas de pérdida visual, se realiza RMN funcional visual (4 de abril de 2012) (fig. 5), donde se documenta malacias occipitales de predominio izquierdo.
DiscusiónComentaremos a continuación algunos de los hechos relevantes de la historia del paciente que nos permitan aproximarnos a una explicación etiopatogénica.
El paciente sufrió un TEC, y tres meses después fue intervenido quirúrgicamente para evacuar los hematomas subdurales. En el postoperatorio se refieren signos de pérdida de la visión que el paciente niega (posiblemente un síndrome de Anton), pero que fueron evidenciados con un estudio de potenciales evocados practicados días después. El reporte de neurorrehabilitación médica señaló persistencia de algunas sensaciones visuales incluso con visualización de palabras. La prueba neuropsicológica reportó adicional a la ceguera cortical, déficit de la memoria anterógrada y desorientación espacial.
En las imágenes de la TAC inicial no se evidenciaron lesiones cerebrales, pero la RMN posterior al drenaje quirúrgico describe daño estructural de los lóbulos occipitales (áreas de infarto occipital, signos de necrosis pseudolaminar, mayor compromiso del lóbulo occipital izquierdo).
Al revisar todos los datos y evolución clínica del paciente la explicación por correlación anatomofuncional es que el paciente presentó en determinado momento un déficit de irrigación súbito en el territorio de ambas arterias cerebrales posteriores (ACP), con mayor compromiso de sus tramos calcarinos, teniendo como resultado un infarto de ambas cortezas estriadas. Aspecto que se justificará a continuación.
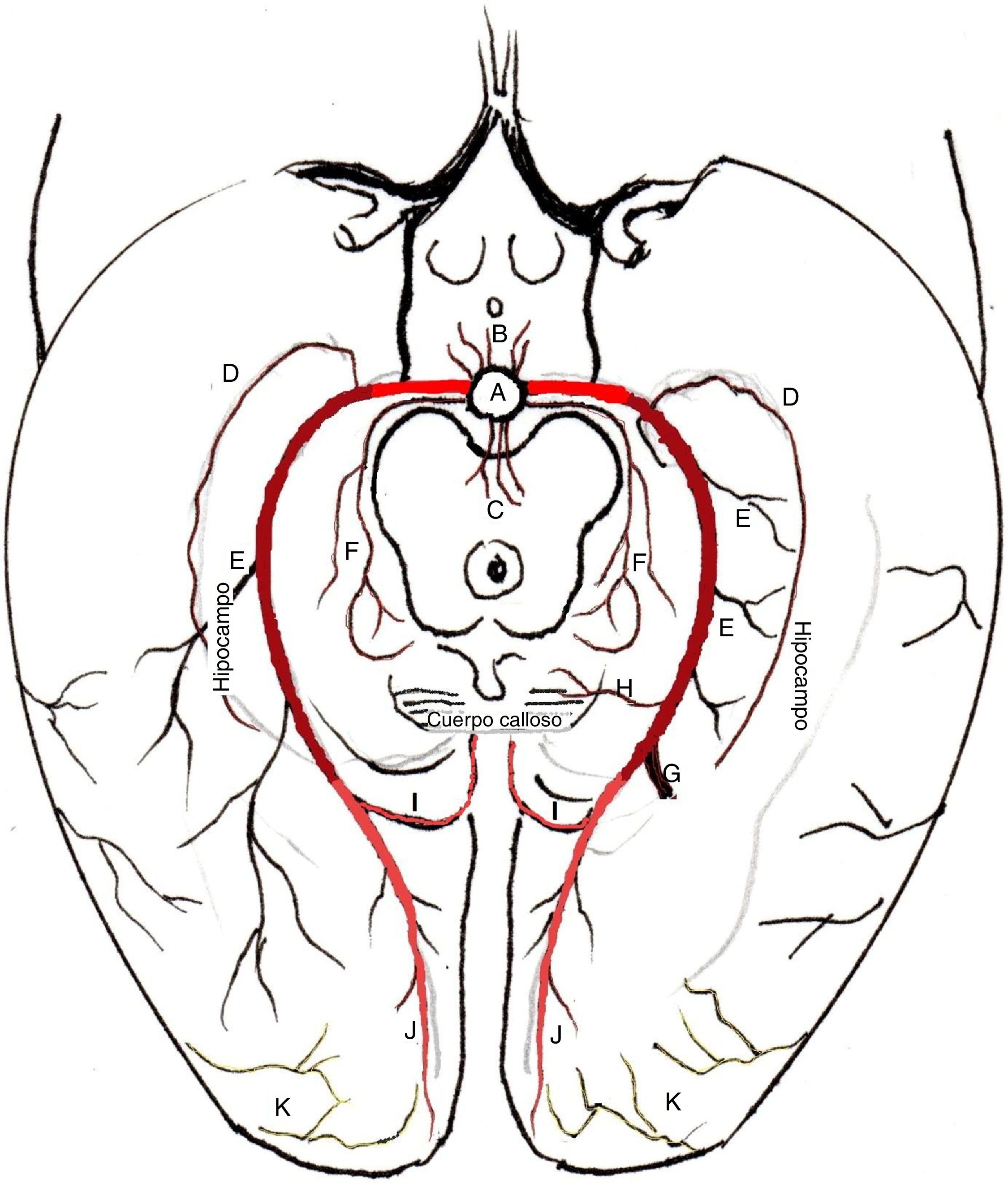
En la figura 6 se señalan las ramas principales de la ACP. En su segmento P1 (precomunicante, escarlata en la imagen), da ramas pequeñas para el tálamo y para el tegmento mesencefálico, proporcionando además ramas circunflejas que se distribuyen en la protuberancia, lámina cuadrigémina y cuerpo geniculados. En su segmento P2 (color vino tinto en la imagen) da origen a las arterias coroideas posteriores (medial y lateral), arterias temporales inferiores, anterior, media y posterior y a las arterias del hipocampo. En su porción P3 (color rosa en la imagen) da origen a la arteria esplenial para el esplenio del cuerpo calloso y a sus dos ramas terminales: arteria parietooccipital y arteria calcarina.
Recorrido arteria cerebral posterior. A: arteria basilar; B: ramas talámicas; C: ramas tegmentarias; D: arterias termporales inferiores; E: arterias del hipocampo; F: arterias circunferenciales; G: arteria coroidea posterior; H: arteria esplenial; I: arteria parietooccipital; J: arteria calcarina; K: ramas de la arteria cerebral media.
En la corteza estriada hay una clara proyección de las zonas de la retina: en el labio superior de la fisura calcarina se proyectan los cuadrantes superiores de la retina (encargada del hemicampo visual inferior), y en el labio inferior los cuadrantes inferiores de la retina (encargada del hemicampo visual superior), del ojo contralateral. Además, las porciones más periféricas de la retina encargadas del campo periférico se proyectan a la región anterior de la corteza estriada, las regiones centrales de la retina lo hacen hacia regiones posteriores de la corteza calcarina, y la retina macular (encargada del campo visual central) lo hace hacia las regiones más posteriores de la corteza calcarina (en la región polar de la corteza). Las fibras maculares constituyen aproximadamente dos terceras partes de la corteza occipital.
Preservación de la visión macular (macular sparing)Al ocurrir una lesión en la región de la corteza calcarina, se produce una hemianopsia homónima contralateral, que paradójicamente se acompaña de una preservación de la visión macular, las lesiones bilaterales de la corteza occipital producen ceguera total o en algunos casos una constricción severa del campo visual conservando unos pocos grados del campo visual central.
Dicho fenómeno ha tenido diferentes puntos de vista, para algunos autores se explica porque en el quiasma óptico la decusación de las fibras del segundo par craneano es incompleta, por lo cual algunas fibras provenientes de la mácula pasarían al tracto óptico ipsilateral. Otros autores refieren que existe un hipotético fascículo originado en la corteza de representación macular de un ojo que pasaría a la corteza del otro ojo a través del esplenio del cuerpo calloso. Por último dicho fenómeno es explicado por la proyección macular en distintas zonas de la corteza estriada según otros autores. Sin embargo, no se ha esclarecido la teoría correcta y sigue siendo un tema de estudio.
En el presente reporte de caso, el paciente del estudio presenta una preservación de su visión macular lo cual le permite reconocer letras, y se debe dar una explicación anatómica para esto. Los estudios de la irrigación cerebral de Salomón muestran que ramificaciones de la arteria cerebral media, por medio de la arteria témporo-occipital, se extienden hasta el polo occipital, y por tanto participan en la irrigación de la porción más posterior de la corteza visual, y más específicamente de la corteza de representación macular. Creemos por tanto, que la preservación de la visión macular en casos de hemianopsia por lesión de la arteria calcarina es debida a la irrigación del área de representación macular por ramas de la arteria cerebral media14–16.
Preservación de la capacidad de lecturaSe ha anotado que el paciente puede reconocer letras y aun leer algunas palabras. Desde los trabajos de Dejerine se reconoce al giro angular de la corteza como el centro de asociación de las imágenes visuales con los estímulos sonoros que son la base anatómica y funcional del proceso de lectura17. Concluimos por tanto, que las conexiones entre la porción preservada de la corteza visual y la corteza del giro angular están conservadas en el paciente en estudio. Además de las áreas visuales primarias y secundarias, existen otras áreas extra estriadas y extra occipitales (áreas corticales temporales, parietales y frontales, para procesar color, movimiento, estereopsis y reconocimiento de caras).
Sintomatología de la visión macularNormalmente los ojos presentan cortos movimientos en todo sentido, varios por segundo, que buscan enfocar la visión macular en un punto fijo del campo visual y generar una imagen nítida del objeto central. Tal fenómeno son los movimientos sacádicos, de los que se cuentan más de 200,000 en el día. Una vez que se ha encontrado un punto de interés, el ojo se fija en él, y si este se mueve el ojo lo sigue con los movimientos de seguimiento18. En nuestro paciente los ojos están fijos, y las sacadas son escasas o nulas.
Áreas visualesLa visión es un fenómeno complejo en el que intervienen distintos factores. Desde la década de los 60, con los trabajos de Hubel y Wiesel en gatos, se comenzaron a describir diferentes tipos de neuronas y vías implicadas en funciones visuales particulares como la identificación de la forma, color y orientación de los objetos en el campo visual19,20. En 1976, los mismos autores con un grupo de investigadores adicionales describieron la arquitectura del área cortical visual primaria y sus variaciones en monos normales y con un solo ojo funcional. Desde este momento hacia adelante comenzarían a aparecer estudios en ratones y primates que permitirían realizar aproximaciones más contundentes con la neurofisiología de la visión en los seres humanos21.
Samir Saki a su vez, reconoció en el mono y en el humano varias áreas: V1, V2, V3, V4 y V5, con funciones específicas. El área V1 (corteza visual primaria), es la zona de recepción de las radiaciones ópticas provenientes de los cuerpos geniculados laterales de los tálamos, y desde allí se distribuyen los estímulos visuales a las distintas áreas según su función. En las áreas V2 y V3 se percibe la forma. A nivel de V4, que hace parte del giro lingual, se recibe e interpreta el color y el área V5 situada en la superficie lateral del lóbulo occipital percibe el movimiento22–25.
El paciente en etapas cercanas al postoperatorio no distinguía formas. Cuando inicialmente fue visto por nuestro servicio, se le mostraba la mano del examinador frente a sus ojos y decía que algo se movía (activación de área V5). En un principio tampoco diferenciaba colores pero decía que veía blanco y negro. En sesiones subsiguientes de estimulación y rehabilitación visual, se anota que reconoció varios colores. Simultáneamente se practicó una RMf visual, y con el paradigma de colores se obtuvo una activación parietal mesial izquierda, que pudiera corresponder, en parte, al área V4. En otra sesión de rehabilitación se anota también que pudo reconocer un rostro ampliamente publicitado. Recordemos que adyacente al área V4, en el giro fusiforme, se describe una zona cortical implicada en el reconocimiento de rostros cuya destrucción resulta en prosopagnosia, y que en el presente caso estaría indemne o parcialmente indemne.
Trastorno de la memoriaPor la misma época en que se notaron los trastornos visuales se evidenció un déficit de la memoria reciente, corroborado luego en la evaluación neuropsicológica practicada en el mes de octubre 2011.
Como anotamos, la ACP en su segmento P2da dos o tres ramas para la irrigación de hipocampo y es presumible que su afectación sea la causa del deterioro mnésico del paciente.
Déficit vascular de las arteria cerebral posterior (causas del embolismo de la arteria cerebral posterior)La causa más frecuente de déficit circulatorio de la arteria cerebral posterior es el tromboembolismo; el sitio preferencial de ubicación de las placas arterioescleróticas es la bifurcación de la arteria basilar.
El embolismo de la ACP puede dar síntomas y signos similares a la trombosis. Se señala como origen de los émbolos las lesiones valvulares cardiacas, la fibrilación auricular o las manipulaciones arteriales en el cuello. Ninguna de estas causas parece estar relacionada con nuestro caso.
Una revisión de la literatura ofrece tres títulos que se aproximan al caso:
Se debe recordar que los trastornos del paciente se iniciaron como resultado de hematomas subdurales bilaterales, con intervención quirúrgica. Si ello es así, queda por explicar la relación causal del hematoma subdural con el embolismo de la ACP, o si es solo una asociación accidental.
La enfermedad cerebrovascular en la edad media se caracteriza por trombosis y embolia arterioesclerótica, embolismo cardiaco, hemorragia cerebral primaria (por HTA), rotura de aneurisma sacular, disección arterial y displasia fibromuscular. A nivel del adulto mayor, se caracteriza por enfermedad aterosclerótica oclusiva trombótica, enfermedad embolica, ACV lacunar, hemorragia cerebral, demencia multiinfarto y enfermedad de Binswanger26.
Complicaciones asociadas al manejo quirúrgico de drenaje de hematomas subduralesEl método más utilizado como tratamiento es la evacuación de la sangre acumulada. Este método se puede realizar de dos maneras: hacer un agujero en la bóveda craneal para que evacue el líquido o hacer una craneotomía y eliminar los hematomas junto con la membrana que los rodea. Según la literatura, se debe dar prioridad a estos métodos, puesto que ayuda a reducir el volumen del hematoma por el agujero taladrado y además es bastante eficaz27. A pesar de que el método de drenaje sea eficaz hay un reporte de un paciente que después de la cirugía empezó a tener diferentes complicaciones desde hemiparesias izquierdas leves hasta hemorragias intracraneales e interventriculares. Este reporte muestra la existencia de posibles complicaciones iatrogénicas que pueden existir asociadas al manejo quirúrgico28.
Traumatismo craneoencefálicoEl TEC implica daño cerebral por una lesión o contusión externa, con compromiso neurológico o déficit de las capacidades cognitivas. El daño encefálico puede suponer contusión, laceración cerebral, hematoma intracraneal, cizallamiento de las fibras nerviosas, hipertensión intracraneal, hipoxia, anemia, anomalías metabólicas, hidrocefalia y derrame subaracnoideo29,30.
La incidencia del TEC varía entre 200-300 casos por cada 100,000 habitantes31. Siendo más frecuente en hombres que en mujeres, con una mayor prevalencia, en edades entre los 15 y 24 años32.
La severidad del TEC es clasificada como leve, moderada o severa dependiendo de sus características y consecuencias29.
- a.
TEC leve: daño externo en el cerebro, confusión, desorientación o pérdida de la conciencia por menos de treinta minutos; un resultado de 13 a 15 puntos en la escala de coma de Glasgow, y una amnesia postraumática menor de 24 horas.
- b.
TEC moderado: pérdida de la conciencia entre 30 minutos y 24 horas, entre 9 y 12 puntos en la escala de coma de Glasgow, y una amnesia postraumática entre 1 y 7 días.
- c.
TEC severo: extensa pérdida de la memoria y de conciencia con resultados mucho más drásticos de la pérdida cognitiva.
El TEC produce tres tipos de daño a saber:
a) Daño primario: se da por el impacto inmediatamente después del traumatismo. Entre ellas se encuentran: fracturas, contusiones y laceraciones.
b) Daño secundario: se inicia al momento del impacto pero presenta manifestaciones clínicas tardías. Entre ellas se encuentran los hematomas, hemorragias intracraneales, congestión vascular cerebral, edema y lesiones isquémicas.
c) Daño terciario: consecuencia del daño primario que son inevitables y de las secundarias que son evitables con tratamiento oportuno10.
Traumatismo craneoencefálico y hematoma subduralUna de las complicaciones del TEC es el hematoma subdural. El hematoma subdural es una acumulación de líquido serosanguinoliento entre las dos meninges externas, es decir entre la duramadre y aracnoides. Lesión ocupante de espacio supratentorial33. Constituye en sí una hemorragia, desencadenada por la rotura de los vasos sanguíneos de tipo venoso. Este proceso lleva a una marcada separación entre las dos meninges, produciendo aumento de la presión intracraneal, más un proceso inflamatorio34.
Hematoma subduralEl hematoma subdural se caracteriza por tener un cuadro clínico heterogéneo e inespecífico. Afecta principalmente a los adultos mayores y es predominante en el sexo masculino. Se presenta en 1 a 3 casos por 100,000 habitantes anualmente, aumentando en los mayores de 70 años a 7/100,000 habitantes. Además de la edad como factor, el sexo también es un punto de diferencia. Se reporta que los hematomas subdurales ocurren con mayor frecuencia en hombres que en mujeres; un estudio encontró que aproximadamente el 80% de los casos son hombres y el 20% mujeres35.
Hay varios factores que se han visto relacionados con los hematomas subdurales, entre ellos se encuentran algunas enfermedades como la hipertensión arterial, diabetes mellitus tipo II y cardiopatía coronaria. También se han descubierto algunos antecedentes personales como haber tenido un traumatismo craneano anteriormente y el uso de algunos fármacos, principalmente de anticoagulantes. Es más frecuente en personas de edad avanzada, secundario a la atrofia cerebral que hace a las venas corticales más susceptibles a laceración. Los traumatismos son la principal causa, sin embargo la gravedad de la lesión necesaria para producirla es menor a medida que avanza la edad33.
Las manifestaciones del hematoma subdural son variables, entre ellos puede encontrarse desde una cefalea hasta síndromes demenciales, convulsiones y déficit neurológico, entre otros12. Los hematomas subdurales se producen principalmente sobre la superficie (convexidad) de los hemisferios cerebrales, pero tanto la clínica como su ubicación anatómica, dependen de su clasificación temporal.
Los hematomas subdurales se clasifican en agudos y subagudos-crónicos. El hematoma subdural agudo o hiperdenso se manifiesta inmediatamente después del trauma (de minutos a horas). No es necesario un trauma craneal. Puede ser desencadenado por medicamentos anticoagulantes y patologías que comprometan los sistemas vasculares. Las lesiones tienen un foco de expansividad notable y puede haber compresión nerviosa, edema traumático y repercusiones isquémicas. Las manifestaciones principales se relacionan con alteraciones en el estado de conciencia, entre ellas se encuentran: estupor, coma, hemiparesias y pupila midriática unilateral36.
El hematoma subdural subagudo y crónico (isodenso e hipodenso) aparecen generalmente entre la primera y segunda semana posterior al trauma. Suelen ocurrir en traumas craneales de impacto menor, pasan inadvertidos inicialmente pero progresivamente empeoran. Las manifestaciones son diversas, desde cefalea y cambio en la conducta, hasta hemiparesia de inicio lento, afasia y alteración de las funciones cerebrales36.
Complicaciones generales del hematoma subdural y relación con déficit visualLas complicaciones y repercusiones desencadenadas por el hematoma subdural dependen del origen y localización de la lesión. Un estudio japonés reporta que las complicaciones neurológicas del hematoma subdural son más frecuentes en adultos mayores que en jóvenes37.
La localización de los hematomas es importante para identificar las manifestaciones y alteraciones que pueden ocurrir con el tiempo. La localización encontrada con más frecuencia ha sido a nivel temporal, principalmente donde se encuentra el pterión, después le sigue la localización frontal, parietal y occipital. Los hematomas subdurales ubicados en la fosa posterior son escasos, representan solo el 5 a 10% de los casos13.
En un estudio realizado con pacientes con hematoma subdural en fosa posterior de origen traumático se encontraron complicaciones comunes, entre ellas fracturas de cráneo, pobre puntuación en la escala de Glasgow y alta tasa de mortalidad38.
Otros estudios reportan manifestaciones diferentes y mucho más escasas. En uno de ellos se presentó hemianopsia homónima39. En otro, un paciente joven que además del hematoma tuvo una herniación del tentorio, se encontró una hemianopsia bitemporal que conservaba la visión central (macular). Esta última manifestación fue asociada en el caso con aterioesclerosis y otras enfermedades que posiblemente generaron predisposición como el embolismo, anoxia, sarcoidosis, meningioma, enfermedad de Hodgkin y envenenamiento con monóxido de carbono40.
La ceguera cortical transitoria también ha sido reportada41. Dos reportes de caso señalan hematomas interhemisféricos, localizados en la cisura interhemisférica, hematomas generados por trauma, con complicaciones escazas tipo síndrome de Falx (hemiparesia contralateral de las extremidades inferiores)42.
Otras complicaciones más comunes del hematoma subdural, especialmente del crónico, son las convulsiones43.
ConclusionesLas deficiencias visuales permanentes pueden afectar tanto la sensación como la percepción visual alterando el funcionamiento visual. Las deficiencias visuales pueden ser de etiología oftalmológica, neurooftalmológica y/o neurológica, como fue el caso aquí presentado y analizado. El neurotrauma tipo TEC es una causa potencial de DV de origen neurológico que requiere de mayor documentación e investigación.
El modelo anatomo-clínico es necesario y útil en la compresión del origen de las deficiencias visuales, y más cuando estas son de tipo neurooftalmológico y neurológico visual.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciamientoLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.